一种基于LiMn2O4电极材料从含锂溶液中提锂的方法与流程
本发明涉及一种从水溶液中提取锂资源的方法,具体涉及一种基于锂电池电极材料从含锂溶液中提锂的电化学方法。
背景技术:
锂是自然界质量最轻的金属,拥有十分活泼的化学性质。锂金属及其化合物广泛应用于玻璃、冶金、陶瓷、润滑剂和制冷剂等行业,同时随着电动汽车、风电、核电等新兴产业的迅速崛起,社会发展对锂资源的需求也逐渐呈现跳跃式增长。目前,锂资源的提取从矿石提锂转向盐湖卤水及海水提锂方向,因此如何有效地从盐湖卤水、海水中提取锂资源成为众多研究者的研究热点。
碳酸盐沉淀法是应用较早且工艺技术较成熟的提锂方法,此工艺利用石灰除去经自然蒸发、浓缩后含锂卤水中的钙镁杂质后,加入碳酸钠最终得到碳酸锂沉淀。这种方法最初需要经历12-18个月的自然蒸发,并且在这个过程中容易受到降雨、温度、湿度、风力以及太阳辐射等不可控自然因素的影响。此外,这种方法由于引入了其他物质,因此会产生大量工业废物,如果不加处理会对环境产生较大危害。离子交换与吸附法(锂离子筛法)也是目前研究较多的一种方法,其中锂锰氧化物是利用锂离子筛型氧化物进行溶液提锂的主要研究对象之一。二氧化锰离子筛无毒、成本低、对锂离子选择性高,但是在锂离子筛制备以及对锂离子进行洗脱的过程中需要用到盐酸,因此会腐蚀设备并且对环境造成危害。此外,在酸改型过程中,mn(iii)容易发生歧化反应而部分被酸液溶解,导致吸附量降低。
重庆大学石晓茜在其学位论文中研究了磷酸铁锂在锂离子水溶液中的嵌锂行为。研究证明lifepo4材料在水溶液体系中具有良好的电化学可逆性,首先在lino3水溶液中进行恒电位嵌锂,再对嵌锂后的lifepo4材料进行恒电位脱锂,将嵌入材料中的li+释放到去离子水溶液中,成为含li+水溶液,由此实现电极提取锂离子的目的,但是计算出lifepo4材料的嵌锂效率较低(约为35%)。因此,需要发展一种高效低耗、环境友好的提锂方法。
技术实现要素:
本发明旨在克服现有液态提锂方法存在的缺陷,提供了一种基于limn2o4电极材料从含锂溶液中提锂的方法。该方法将limn2o4电极应用于溶液提锂中,用阴离子交换膜将回收液与提取液分割开,使锂离子可以同时选择性地脱出和嵌入,将脱锂、嵌锂两个反应结合起来同时进行。本发明为一种高效低耗、环境友好的电化学提锂方法。
本发明的技术方案为:
一种基于limn2o4电极材料从含锂溶液中提锂的方法,包括以下步骤:
1)将limn2o4粉末、导电剂和粘结剂混合后,将混合物涂布于集流体表面,真空干燥,制作成limn2o4富锂态电极;
其中,质量比为limn2o4粉末:导电剂:粘结剂=60~90:5~20:5~20;涂覆量为5~20mg混合物/cm2;
2)取上步得到的limn2o4富锂态电极为正极,agcl电极作为负极,置于电解液中,以恒定的电压进行脱锂,当电流低至0.2ma即停止反应,得到li1-xmn2o4贫锂态电极;
所述的电解液为含有nacl和kcl中的一种或多种的水溶液;溶液中阳离子总的摩尔浓度为0.01~0.1mol/l,电压为0.5~1.2v;
3)在电解池中装入单价阴离子交换膜,交换膜两侧分别注入回收液和提取液,将第1)步制得的富锂态电极作为正极放入回收液中,将第2)步制得的贫锂态电极作为负极放入提取液中,在恒定电压下反应,当电流低至0.2ma即停止反应;
其中,电压为0.2~1.2v;所述的回收液具体为含有nacl、kcl中的一种或多种的水溶液,溶液中阳离子总的摩尔浓度为0.01~0.1mol/l;所述的提取液为含有licl的溶液,或具体为含有licl和其他氯化物的溶液;溶液中锂离子的摩尔浓度为0.01~0.05mol/l;所述的其他氯化物为kcl、nacl、mgcl2和cacl2中一种或多种;
4)将步骤3)中反应后的两个电极位置进行调换,在恒定电压下反应,当电流低至0.2ma即停止反应;电压为0.2~1.2v;
5)依次重复进行如步骤4)的调换电极的操作、反应,最终得到锂离子浓度大于0.01mol/l的回收液,以此实现锂资源的提取和富集。
所述的步骤5)中的重复次数优选为3~9次。
所述的步骤1)中采用的导电剂可为乙炔黑或导电炭黑,采用的粘结剂可为ptfe或pvdf;
所述的步骤1)中采用的集流体可为碳布、碳纸、石墨片、不锈钢片中的一种。
所述的步骤1)中真空干燥的温度可为60~120℃,时间为10~12h。
所述的阴离子交换膜优选为为日本astom公司单价阴离子交换膜。
采用d8-focusx射线衍射仪对反应后的锰酸锂电极进行表征,采用tas-990f原子吸收分光光度计来测定步骤3)中反应前后回收液中各阳离子的浓度变化。
本发明与现有的技术相比,本发明具有的有益效果为:
1)本发明基于limn2o4电极的充放电反应,将limn2o4电极应用于水溶液提锂中,采用阴离子交换膜将回收液与提取液分隔开,使脱锂/嵌锂反应同时进行,具有工艺简单、操作方便、安全可靠的优点;
2)在锂资源的提取/回收过程中仅利用电能,避免了使用危险或污染性试剂,具有能量转化率高、反应快速、环境友好、成本低的优点;适用于高镁锂比的浓海水、卤水中提锂;
3)在离子交换与吸附法提锂的研究中,limn2o4/li1-xmn2o4作为最有前景的锂离子筛前驱体/锂离子筛,可以使锂离子选择性地迁出/嵌入,本发明基于此特点制备出limn2o4电极用于水溶液中提取锂资源,具有目标离子选择性高、循环性能好的优点;
4)本发明适用于浓海水/卤水中锂资源的提取,便于规模化生产,有很好的实用价值和工业应用前景。
附图说明
图1为本发明实施例1、2中锂提取/回收过程中的实验装置及原理示意图。
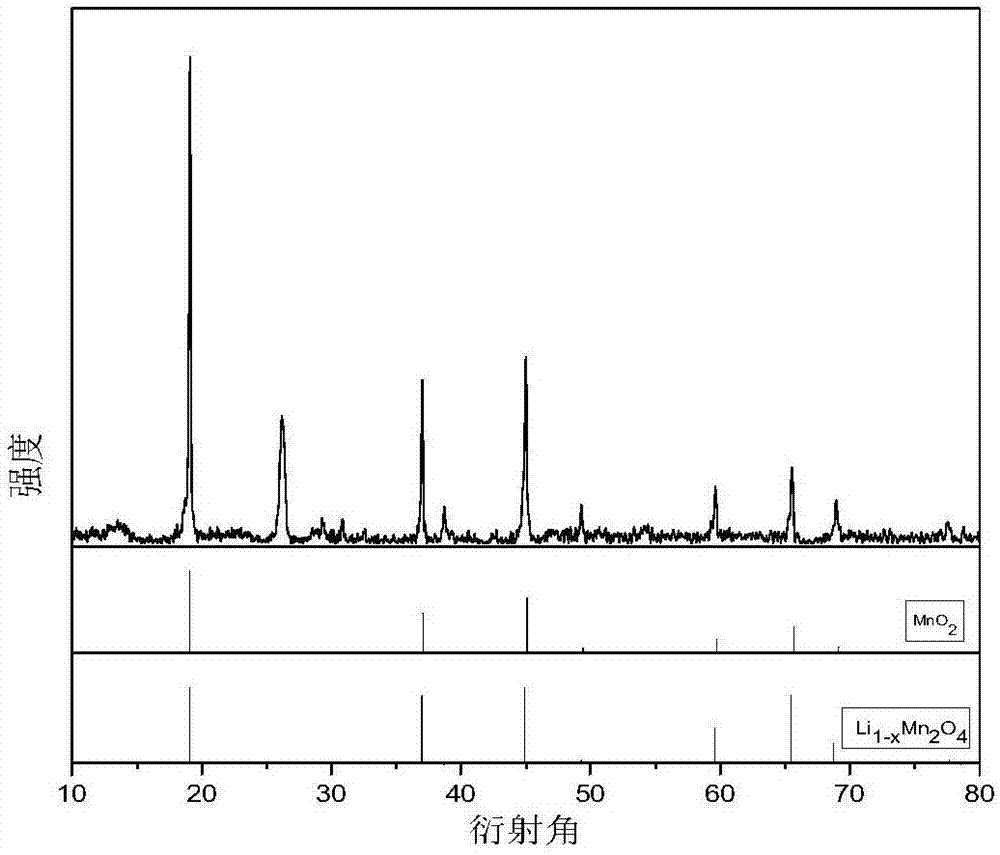
图2为本发明实施例1中锰酸锂电极反应后的xrd图。
图3为本发明实施例1中回收液中各离子浓度的变化图。
图4为本发明实施例1中4次循环过程中的电流变化图。
图5为本发明实施例2中回收液中各离子浓度的变化图。
具体实施方式
为了更加具体、清楚地说明本发明的目的、优点及实施方法,以下将结合具体实施案例以及附图对本发明进行详细说明,但本发明不限于此。
实施例1
(1)富锂态电极的制备:
将limn2o4粉末与导电剂乙炔黑、粘结剂ptfe按质量比80:10:10充分混合后,加入适量乙醇使之成为浆状,涂于碳布表面,碳布有效面积为3.5×3cm2,涂覆质量约为10mg/cm2,于70℃放置12h烘干,制作成富锂态limn2o4电极。
(2)贫锂态电极的制备:
以limn2o4电极为正极(即阳极),以agcl电极为负极(即阴极),放入电解池中,采用0.05mol/l的kcl溶液为电解液,在0.8v的恒定电压下进行电化学脱锂。当电流值低至0.2ma时即停止反应,得到贫锂态li1-xmn2o4电极。
采用d8-focusx射线衍射仪对脱锂后的锰酸锂电极进行表征,图2为脱锂后的锰酸锂电极的xrd图,由图可知,反应后的电极材料与li1-xmn2o4甚至mno2的衍射峰非常吻合,说明在反应的过程中limn2o4电极中有锂脱下来,逐渐变成li1-xmn2o4甚至mno2,即成功制备出了贫锂态电极。
(3)电化学法从溶液中提取/回收锂:
实验装置及原理示意图如图1所示,采用日本astom单价阴离子交换膜将有机玻璃装置从中间分开,回收液为0.05mol/lkcl溶液,提取液为licl、nacl、mgcl2、cacl2浓度分别为0.021、0.33、0.04、0.00775mol/l的模拟智利阿塔卡玛卤水。
以富锂态limn2o4电极为正极放入回收液中,以贫锂态li1-xmn2o4电极为负极放入提取液中,连通直流电源,在0.6v电压下进行反应,正极发生氧化反应,limn2o4中mn(iii)失去电子转化为mn(iv),li+从富锂态电极上脱嵌下来进入到回收液中,由于li+无法透过阴离子交换膜,而提取液一侧的cl-受到吸引可以透过阴离子交换膜并进入回收液中,因此锂便以licl的形式在回收液中得到富集;同时,负极发生还原反应,li1-xmn2o4中mn(iv)得到电子转化为mn(iii),li+从提取液中嵌入到贫锂态电极上。当电流低至0.2ma时停止反应。
交换两电极的位置(即原先的正极变为负极,原先的负极变为正极)保持电压不变继续进行反应,当电流低至0.2ma时停止反应;
重复上段的调换电极、反应,依次调换、反应4次后,回收液中锂离子浓度达到了11.15mmol/l,实现了锂资源在回收液中的富集。4次循环过程的电流随时间的变化如图4所示。
采用tas-990f原子吸收分光光度计来测定步骤3)中反应前后回收液中各阳离子的浓度变化。回收液中各离子的浓度均随循环次数的增加而增加,如图3所示,可见limn2o4电极对锂离子的选择性高于其他离子,并且循环性能也较好,4次循环过程后回收液中锂离子的摩尔百分含量为91.9%,通过原子吸收测得的数据及实验过程中电流的变化数据计算得到,四次循环过程中平均消耗的电量为18wh/molli。。
实施例2
(1)富锂态电极的制备:
将limn2o4粉末与导电剂乙炔黑、粘结剂ptfe按质量比80:10:10充分混合后,加入适量乙醇使之成为浆状,涂于碳布表面,碳布有效面积为3.5×3cm2,涂覆质量约为8mg/cm2,于70℃放置12h烘干,制作成富锂态limn2o4电极。
(2)贫锂态电极的制备:
以limn2o4电极为正极(即阳极),以agcl电极为负极(即阴极),放入电解池中,采用0.05mol/l的kcl溶液为电解液,在0.8v的电压下进行电化学氧化。当电流值低至0.2ma时即停止反应,得到贫锂态li1-xmn2o4电极。
(3)电化学法从溶液中提取/回收锂:
实验装置及原理示意图如图1所示,采用日本astom单价阴离子交换膜将有机玻璃装置从中间分开,回收液为0.05mol/lkcl溶液,提取液为licl、nacl、mgcl2、cacl2浓度分别为0.032、0.905、0.0937、0.0180mol/l的模拟浓海水。
以富锂态limn2o4电极为正极放入回收液中,以贫锂态li1-xmn2o4电极为负极放入提取液中。连通直流电源,在0.4v电压下进行反应,正极发生氧化反应,limn2o4中mn(iii)失去电子转化为mn(iv),li+从富锂态电极上脱嵌下来进入到回收液中,由于li+无法透过阴离子交换膜,而提取液一侧的cl-受到吸引可以透过阴离子交换膜并进入回收液中,因此锂便以licl的形式在回收液中得到富集;同时,负极发生还原反应,li1-xmn2o4中mn(iv)得到电子转化为mn(iii),li+从提取液中嵌入到贫锂态电极上。当电流低至0.2ma时停止反应。
交换两电极的位置(即原先的正极变为负极,原先的负极变为正极),保持电压不变继续进行反应,当电流低至0.2ma时停止反应。
重复上段的调换电极、反应,依次调换、反应5次后,回收液中锂离子的浓度达到了10.06mmol/l,实现了锂资源在回收液中的富集。
采用tas-990f原子吸收分光光度计来测定步骤3)中反应前后回收液中各阳离子的浓度变化。回收液中各离子的浓度均随循环次数的增加而增加,如图5所示,可见limn2o4电极对锂离子的选择性高于其他离子,并且循环性能也较好,5次循环过程后回收液中锂离子的摩尔百分含量为89.6%,五次循环过程中平均消耗的电量为12.3wh/molli。
本发明未尽事宜为公知技术。
- 还没有人留言评论。精彩留言会获得点赞!