使用共同轻链制备完全人双特异性抗体的方法与流程
使用共同轻链制备完全人双特异性抗体的方法本申请是在2013年6月5日作为PCT国际专利申请提交的,并且要求2012年6月5日提交的美国专利申请No.13/488,628的优先权,所述美国专利申请的公开内容通过引用整体并入本文。技术领域提供了遗传修饰的小鼠,其表达具有与多样化的人可变区/小鼠恒定区重链结合的共同的人可变区/小鼠恒定区轻链的抗体。提供了制备来自小鼠B细胞的人可变区基因序列的人双特异性抗体的方法。
背景技术:
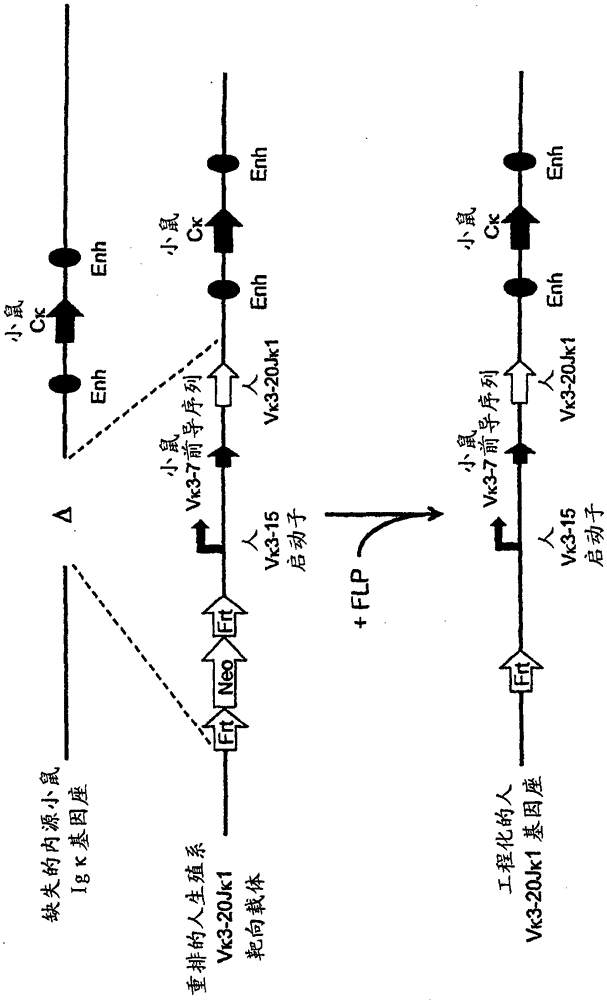
抗体通常包括同源二聚体重链组分,其中每条重链单体与相同的轻链结合。期望具有异源二聚体重链组分的抗体(例如双特异性抗体)作为治疗性抗体。但是制备具有可以令人满意地结合双特异性抗体的每条重链的适当轻链组分的双特异性抗体已经证明存在问题。在一种方法中,可以通过调查所有轻链可变结构域的使用情况统计信息、鉴定人抗体中最常用的轻链和在体外将该轻链与两条不同特异性的重链进行配对来选择轻链。在另一种方法中,可以通过观测噬菌体展示文库(例如包含人轻链可变区序列的噬菌体展示文库,例如人scFv文库)中的轻链序列和从该文库选择最常使用的轻链可变区来选择轻链。随后可以在两条不同的目的重链上测试轻链。在另一种方法中,可以通过使用两条目的重链的重链可变序列作为探针对轻链可变序列的噬菌体展示文库进行测定来选择轻链。结合两个重链可变序列的轻链可作为所述重链的轻链被选出。在另一种方法中,候选轻链可以与重链的同源轻链进行比对,并对轻链进行修饰以更紧密地匹配两条重链的同源轻链所共有的序列特征。如果免疫原性的可能性需要被最小化,修饰优选地导致存在于已知的人轻链序列中的序列,这样基于本领域已知的用于评估免疫原性的可能性的参数和方法(即,在硅片(insilico)以及湿法检测),蛋白水解过程不太可能产生T细胞表位。上述所有的方法依赖于包含许多先验约束(例如序列同一性、与特定的预先选定的重链结合的能力等)的体外方法。本领域存在对于不依赖于体外条件下的操作,而相反使用更加生物学合理的方法来制备包含共同轻链的人表位结合蛋白的组合物和方法的需要。发明简述提供了遗传修饰的小鼠,其表达人免疫球蛋白重链和轻链可变结构域,其中所述小鼠具有有限的轻链可变库。提供了用于产生与多样化的亲和力成熟的人重链可变结构域库结合并表达的人轻链可变结构域的生物系统。提供了用于制备包含免疫球蛋白可变结构域的结合蛋白的方法,包括用目的抗原免疫具有有限的免疫球蛋白轻链库的小鼠,并且特异性结合将小鼠的免疫球蛋白可变区基因序列用于特异性结合目的抗原的结合蛋白。方法包括制备适合用于制备多特异性抗原结合蛋白的人免疫球蛋白重链可变结构域的方法。提供了遗传工程小鼠,其选择适当的来源于未经重排的人重链可变区基因区段库的亲和力成熟的人免疫球蛋白重链可变结构域,其中亲和力成熟的人重链可变结构域与来源于一种人轻链可变区基因区段的单一人轻链可变结构域结合并表达。还提供了呈现两种人轻链可变区基因区段的选择的遗传工程小鼠。在多个方面,一种或两种基因区段包括人Vκ1-39和人Vκ3-20。提供了遗传工程小鼠,其表达来自有限的人轻链可变区基因区段库的有限的人轻链可变结构域库或单一人轻链可变结构域。将小鼠遗传工程化以包含单一未经重排的人轻链可变区基因区段(或两种人轻链可变区基因区段),所述基因区段重排以形成表达单一轻链(或表达两种轻链中的任一种或两种)的重排的人轻链可变区基因(或两种重排的轻链可变区基因)。重排的人轻链可变结构域能够与多个经小鼠选择的亲和力成熟的人重链配对,其中重链可变区特异性地结合不同的表位。提供了遗传工程小鼠,其表达来自有限的人轻链可变区序列库的有限的人轻链可变结构域库或单一人轻链可变结构域。将小鼠遗传工程化以包含单一V/J人轻链序列(或两种V/J序列),所述序列表达单一轻链可变区(或表达两种可变区中的任一种或两种)。包含可变序列的轻链能够与多个经小鼠克隆选择的亲和力成熟的人重链配对,其中重链可变区特异性地结合不同的表位。一方面,提供了遗传修饰的小鼠,其包含单一人免疫球蛋白轻链可变(VL)区基因区段,所述基因区段能够与人J基因区段(选自一个或多个JL区段)重排并且编码人免疫球蛋白轻链的VL结构域。另一方面,小鼠包含不多于两种的人VL基因区段,其中每一种能够与人J基因区段(选自一个或多个JL区段)重排并且编码人免疫球蛋白轻链的VL结构域。在一个实施方式中,单一人VL基因区段可操作地连接至选自Jκ1、Jκ2、Jκ3、Jκ4和Jκ5的人JL基因区段,其中所述单一人VL基因区段能够与任何一个或多个的人JL基因区段重排以形成编码轻链可变区基因的序列。在一个实施方式中,遗传修饰的小鼠包含不含有能够重排以形成免疫球蛋白轻链基因的内源小鼠VL基因区段的免疫球蛋白轻链基因座,其中VL基因座包含能够重排以编码轻链基因的VL区的单一的人VL基因区段。在具体的实施方式中,人VL基因区段是人Vκ1-39Jκ5基因区段或人Vκ3-20Jκ1基因区段。在一个实施方式中,遗传修饰的小鼠包含不含有能够重排以形成免疫球蛋白轻链基因的内源小鼠VL基因区段的VL基因座,其中VL基因座包含不多于两个的能够重排以编码轻链基因的VL区的人VL基因区段。在具体的实施方式中,不多于2个的人VL基因区段是人Vκ1-39Jκ5基因区段和人Vκ3-20Jκ1基因区段。一方面,提供了包含编码人免疫球蛋白轻链VL结构域的单一的经重排的(V/J)人免疫球蛋白轻链可变(VL)区(即,VL/JL区)的遗传修饰的小鼠。另一方面,小鼠包含不多于两个的能够编码人免疫球蛋白轻链VL结构域的重排的人VL区。在一个实施方式中,VL区是重排的人Vκ1-39/J序列或重排的人Vκ3-20/J序列。在一个实施方式中,重排的VL/JL序列的人JL区段选自Jκ1、Jκ2、Jκ3、Jκ4和Jκ5。在具体的实施方式中,VL区是人Vκ1-39Jκ5序列或人Vκ3-20Jκ1序列。在具体的实施方式中,小鼠具有人Vκ1-39Jκ5序列和人Vκ3-20Jκ1序列两者。在一个实施方式中,人VL基因区段可操作地连接至人或小鼠前导序列。在一个实施方式中,前导序列是小鼠前导序列。在具体实施方式中,小鼠前导序列是小鼠Vκ3-7前导序列。在具体的实施方式中,前导序列可操作地连接至未经重排的人VL基因区段。在具体的实施方式中,前导序列可操作地连接至重排的人VL/JL序列。在一个实施方式中,VL基因区段可操作地连接于免疫球蛋白启动子序列。在一个实施方式中,启动子序列是人启动子序列。在具体的实施方式中,人免疫球蛋白启动子是人Vκ3-15启动子。在具体的实施方式中,启动子可操作地连接至未经重排的人VL基因区段。在具体的实施方式中,启动子可操作地连接至重排的人VL/JL序列。在一个实施方式中,轻链基因座包括前导序列,所述前导序列的5′(相对于VL基因区段的转录方向)侧接人免疫球蛋白启动子,并且3′侧接人VL基因区段,所述人VL基因区段与人J区段重排并编码包含内源小鼠轻链恒定区(CL)的反向嵌合轻链的VL结构域。在具体的实施方式中,VL基因区段在小鼠Vκ基因座上,并且小鼠CL是小鼠Cκ。在一个实施方式中,轻链基因座包括前导序列,所述前导序列的5′(相对于VL基因区段的转录方向)侧接人免疫球蛋白启动子,并且3′侧接重排的人VL区(VL/JL序列)并编码包含内源小鼠轻链恒定区(CL)的反向嵌合轻链的VL结构域。在具体的实施方式中,重排的人VL/JL序列在小鼠kappa(κ)基因座,并且小鼠CL是小鼠Cκ。在一个实施方式中,修饰的小鼠的VL基因座是κ轻链基因座,并且κ轻链基因座包含小鼠κ内含子增强子、小鼠κ3′增强子、或内含子增强子和3′增强子。在一个实施方式中,小鼠包含无功能的免疫球蛋白lambda(λ)轻链基因座。在具体的实施方式中,λ轻链基因座包含基因座的一个或多个序列的删除,其中一个或多个删除导致λ轻链基因座不能重排以形成轻链基因。在另一个实施方式中,λ轻链基因座的所有或基本上所有的VL基因区段被删除。在一个实施方式中,小鼠产生包含来源于人VL基因区段的经体细胞突变的VL结构域的轻链。在一个实施方式中,轻链包含来源于人VL基因区段的经体细胞突变的VL结构域和小鼠Cκ区。在一个实施方式中,小鼠不表达λ轻链。在一个实施方式中,遗传修饰的小鼠能够对人VL区序列进行体细胞高变。在具体的实施方式中,小鼠包含细胞,所述细胞包括来源于能够重排并编码VL结构域的人VL基因区段的重排的免疫球蛋白轻链基因,并且重排的免疫球蛋白轻链基因包含体细胞突变的VL结构域。在一个实施方式中,小鼠包含表达含有连接至小鼠Cκ的经体细胞突变的人VL结构域的轻链的细胞,其中轻链与包含来源于人VH基因区段的经体细胞突变的VH结构域的重链结合,并且其中重链包含小鼠重链恒定区(CH)。在具体的实施方式中,重链包含小鼠CH1、小鼠铰链、小鼠CH2和小鼠CH3。在具体的实施方式中,重链包含人CH1、铰链、小鼠CH2和小鼠CH3。在一个实施方式中,小鼠包含用一个或多个人VH基因区段对内源小鼠VH基因区段的置换,其中人VH基因区段可操作地连接至小鼠CH区基因,以便小鼠重排人VH基因区段并且表达包含人VH结构域和小鼠CH的反向嵌合免疫球蛋白重链。在一个实施方式中,90-100%的未经重排的小鼠VH基因区段被至少一个未经重排的人VH基因区段置换。在具体的实施方式中,所有或基本上所有的内源小鼠VH基因区段被至少一个未经重排的人VH基因区段置换。在一个实施方式中,用至少19个、至少39个、或至少80个或81个未经重排的人VH基因区段进行置换。在一个实施方式中,用至少12个功能性未经重排的人VH基因区段、至少25个功能性未经重排的人VH基因区段、或至少43个功能性未经重排的人VH基因区段进行置换。在一个实施方式中,小鼠包含用至少一个未经重排的人DH区段和至少一个未经重排的人JH区段对所有小鼠DH和JH区段的置换。在一个实施方式中,至少一个未经重排人DH区段选自1-1、D1-7、1-26、2-8、2-15、3-3、3-10、3-16、3-22、5-5、5-12、6-6、6-13、7-27及其组合。在一个实施方式中,至少一个未经重排人JH区段选自1、2、3、4、5、6及其组合。在具体的实施方式中,一个或多个人VH基因区段选自1-2、1-8、1-24、1-69、2-5、3-7、3-9、3-11、3-13、3-15、3-20、3-23、3-30、3-33、3-48、3-53、4-31、4-39、4-59、5-51、6-1人VH基因区段及其组合。在一个实施方式中,小鼠包含表达特异性结合目的抗原的结合蛋白的B细胞,其中结合蛋白包含来源于人Vκ1-39/Jκ5重排或人Vκ3-20/Jκ1重排的轻链,并且其中细胞包含重排的免疫球蛋白重链基因,其来源于选自1-69、2-5、3-13、3-23、3-30、3-33、3-53、4-39、4-59和5-51基因区段的人VH基因区段的重排。在一个实施方式中,一个或多个人VH基因区段与选自1、2、3、4、5和6的人重链JH基因区段重排。在一个实施方式中,一个或多个人VH和JH基因区段与选自1-1、1-7、1-26、2-8、2-15、3-3、3-10、3-16、3-22、5-5、5-12、6-6、6-13和7-27的人DH基因区段重排。在具体的实施方式中,轻链基因具有1个、2个、3个、4个或5个或更多的体细胞高变。在一个实施方式中,小鼠包含B细胞,所述B细胞包含含有选自2-5/6-6/1、2-5/3-22/1、3-13/6-6/5、3-23/2-8/4、3-23/3-3/4、3-23/3-10/4、3-23/6-6/4、3-23/7-27/4、3-30/1-1/4、3-30/1-7/4、3-30/3-3/3、3-30/3-3/4、3-30/3-22/5、3-30/5-5/2、3-30/5-12/4、3-30/6-6/1、3-30/6-6/3、3-30/6-6/4、3-30/6-6/5、3-30/6-13/4、3-30/7-27/4、3-30/7-27/5、3-30/7-27/6、3-33/1-7/4、3-33/2-15/4、4-39/1-26/3、4-59/3-16/3、4-59/3-16/4、4-59/3-22/3、5-51/3-16/6、5-51/5-5/3、5-51/6-13/5、3-53/1-1/4、1-69/6-6/5和1-69/6-13/4的VH/DH/JH区的重排的免疫球蛋白重链可变区基因序列。在具体的实施方式中,B细胞表达包含与小鼠重链恒定区融合的人免疫球蛋白重链可变区和与小鼠轻链恒定区融合的人免疫球蛋白轻链可变区的结合蛋白。在一个实施方式中,重排的人VL区是人Vκ1-39Jκ5序列,并且小鼠表达包括(i)来源于人VL/JL序列的VL结构域和(ii)小鼠CL的反向嵌合轻链;其中轻链与反向嵌合重链结合,所述反向嵌合重链包括(i)小鼠CH和(ii)来源于选自1-2、1-8、1-24、1-69、2-5、3-7、3-9、3-11、3-13、3-15、3-20、3-23、3-30、3-33、3-48、3-53、4-31、4-39、4-59、5-51、6-1人VH基因区段及其组合的人VH基因区段的经体细胞突变的人VH结构域。在一个实施方式中,小鼠表达经体细胞突变的轻链。在一个实施方式中,CL是小鼠Cκ。在具体的实施方式中,人VH基因区段选自2-5、3-13、3-23、3-30、4-59、5-51和1-69基因区段。在具体的实施方式中,体细胞突变的人VH结构域包括来源于选自1-1、1-7、2-8、3-3、3-10、3-16、3-22、5-5、5-12、6-6、6-13和7-27的DH区段的序列。在具体的实施方式中,体细胞突变的人VH结构域包含来源于选自1、2、3、4、5和6的JH区段的序列。在具体的实施方式中,体细胞突变的人VH结构域被选自2-5/6-6/1、2-5/3-22/1、3-13/6-6/5、3-23/2-8/4、3-23/3-3/4、3-23/3-10/4、3-23/6-6/4、3-23/7-27/4、3-30/1-1/4、3-30/1-7/4、3-30/3-3/4、3-30/3-22/5、3-30/5-5/2、3-30/5-12/4、3-30/6-6/1、3-30/6-6/3、3-30/6-6/4、3-30/6-6/5、3-30/6-13/4、3-30/7-27/4、3-30/7-27/5、3-30/7-27/6、4-59/3-16/3、4-59/3-16/4、4-59/3-22/3、5-51/5-5/3、1-69/6-6/5和1-69/6-13/4的重排的人VH/DH/JH序列编码。在一个实施方式中,重排的人VL区是人Vκ3-20Jκ1序列,并且小鼠表达包括(i)来源于重排的人VL/JL序列的VL结构域和(ii)小鼠CL的反向嵌合轻链;其中轻链与反向嵌合重链结合,所述反向嵌合重链包括(i)小鼠CH和(ii)来源于选自1-2、1-8、1-24、1-69、2-5、3-7、3-9、3-11、3-13、3-15、3-20、3-23、3-30、3-33、3-48、3-53、4-31、4-39、4-59、5-51、6-1人VH基因区段及其组合的人VH基因区段的经体细胞突变的人VH。在一个实施方式中,小鼠表达经体细胞突变的轻链。在一个实施方式中,CL是小鼠Cκ。在具体的实施方式中,人VH基因区段选自3-30、3-33、3-53、4-39和5-51基因区段。在具体的实施方式中,体细胞突变的人VH结构域包括来源于选自1-1、1-7、1-26、2-15、3-3、3-16和6-13的DH区段的序列。在具体的实施方式中,体细胞突变的人VH结构域包含来源于选自3、4、5和6的JH区段的序列。在具体的实施方式中,体细胞突变的人VH结构域被选自3-30/1-1/4、3-30/3-3/3、3-33/1-7/4、3-33/2-15/4、4-39/1-26/3、5-51/3-16/6、5-51/6-13/5和3-53/1-1/4的重排的人VH/DH/JH序列编码。在一个实施方式中,小鼠包含重排的人Vκ1-39Jκ5序列和重排的人Vκ3-20Jκ1序列,并且小鼠表达包括(i)来源于人Vκ1-39Jκ5序列或人Vκ3-20Jκ1序列的VL结构域和(ii)小鼠CL的反向嵌合轻链;其中轻链与反向嵌合重链结合,所述反向嵌合重链包括(i)小鼠CH和(ii)来源于选自1-2、1-8、1-24、1-69、2-5、3-7、3-9、3-11、3-13、3-15、3-20、3-23、3-30、3-33、3-48、3-53、4-31、4-39、4-59、5-51、6-1人VH基因区段及其组合的人VH基因区段的经体细胞突变的人VH。在一个实施方式中,小鼠表达经体细胞突变的轻链。在一个实施方式中,CL是小鼠Cκ。在一个实施方式中,90-100%的内源未经重排的小鼠VH基因区段被至少一个未经重排的人VH基因区段置换。在具体的实施方式中,所有或基本上所有的内源未经重排的小鼠VH基因区段被至少一个未经重排的人VH基因区段置换。在一个实施方式中,用至少18个、至少39个、至少80个或81个未经重排的人VH基因区段进行置换。在一个实施方式中,用至少12个功能性未经重排的人VH基因区段、至少25个功能性未经重排的人VH基因区段或至少43个未经重排的人VH基因区段进行置换。在一个实施方式中,遗传修饰的小鼠是C57BL品系,在具体的实施方式中其选自C57BL/A、C57BL/An、C57BL/GrFa、C57BL/KaLwN、C57BL/6、C57BL/6J、C57BL/6ByJ、C57BL/6NJ、C57BL/10、C57BL/10ScSn、C57BL/10Cr和C57BL/Ola。在具体的实施方式中,遗传修饰的小鼠是前述的129品系和前述的C57BL/6品系的混合。在另一个具体的实施方式中,小鼠是前述129品系的混合,或前述BL/6品系的混合。在具体的实施方式中,混合的129品系是129S6(129/SvEvTac)品系。在一个实施方式中,小鼠表达反向嵌合抗体,所述抗体包含含有小鼠Cκ和来源于重排的人Vκ1-39Jκ5序列或重排的人Vκ3-20Jκ1序列的经体细胞突变的人VL结构域的轻链,以及包含含有小鼠CH和来源于选自1-2、1-8、1-24、1-69、2-5、3-7、3-9、3-11、3-13、3-15、3-20、3-23、3-30、3-33、3-48、3-53、4-31、4-39、4-59、5-51和6-1人VH基因区段的人VH基因区段的经体细胞突变的人VH结构域的重链,其中小鼠不表达完全的小鼠抗体并且不表达完全的人抗体。在一个实施方式中,小鼠包含κ轻链基因座,所述基因座包含用重排的人Vκ1-39Jκ5序列或重排的人Vκ3-20Jκ1序列对内源小鼠κ轻链基因区段的置换,并且包含用完整的或基本上完整的人VH基因区段库对所有或基本上所有的内源小鼠VH基因区段的置换。一个方面,提供了源自本文所述小鼠的抗原特异性抗体群,其中抗体包含来源于人Vκ1-39/Jκ5重排或人Vκ3-20/Jκ1重排的轻链基因,并且其中抗体包括来源于选自1-2、1-3、1-8、1-18、1-24、1-46、1-58、1-69、2-5、2-26、2-70、3-7、3-9、3-11、3-13、3-15、3-16、3-20、3-21、3-23、3-30、3-33、3-43、3-48、3-53、3-64、3-72、3-73、4-31、4-34、4-39、4-59、5-51和6-1人VH基因区段的人VH基因区段的重排的经重排的免疫球蛋白重链基因。在一个实施方式中,一个或多个人VH基因区段与选自1、2、3、4、5和6的人重链JH基因区段重排。在具体的实施方式中,轻链具有1个、2个、3个、4个或5个或更多的体细胞高变。在一个实施方式中,轻链具有1个、2个、3个或4个体细胞高变。在一个实施方式中,轻链基因具有1个或2个突变。在多个实施方式中,轻链基因能够在其序列中承受多个突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排并且轻链具有至少一个或不超过4个体细胞高变。在一个实施方式中,轻链包含至少2个体细胞高变。在一个实施方式中,轻链包含至少3个体细胞高变。在一个实施方式中,轻链包含至少4个体细胞高变。在具体的实施方式中,突变存在于轻链的一个或多个框架区(FW)中。在具体的实施方式中,突变存在于轻链的一个或多个互补决定区(CDR)中。在具体的实施方式中,突变存在于轻链的一个或多个FW和/或一个或多个CDR中。在多个实施方式中,框架区选自框架1(FW1)、框架2(FW2)、框架3(FW3)和/或其组合。在多个实施方式中,CDR选自CDR1、CDR2、CDR3和/或其组合。在一个实施方式中,重链包含至少1个在一个或多个FW或一个或多个CDR中的突变。在一个实施方式中,重链包含至少1个在一个或多个FW和一个或多个CDR中的突变。在一个实施方式中,重链包含至少2个在一个或多个FW和一个或多个CDR中的突变。在一个实施方式中,重链包含至少3个在一个或多个FW和一个或多个CDR中的突变。在一个实施方式中,重链包含至少4个在一个或多个FW和一个或多个CDR中的突变。在一个实施方式中,重链包含至少5个或多于5个在一个或多个FW和一个或多个CDR中的突变;在具体的实施方式中,重链包含至少5个或多于5个在两个FW中的突变;在具体的实施方式中,重链包含至少5个或多于5个在一个FW和一个CDR中的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约9%的Vκ1-39/Jκ5来源的轻链具有至少1个位于FW1的突变;在一个实施方式中,至少9%的轻链包含1个位于FW1的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约25%的Vκ1-39/Jκ5来源的轻链具有至少1个或不多于2个的位于CDR1的突变;在一个实施方式中,至少19%的轻链具有1个位于CDR1的突变;在一个实施方式中,至少5%的轻链具有2个位于CDR1的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约20%的Vκ1-39/Jκ5来源的轻链具有至少1个或不多于3个位于FW2的突变;在一个实施方式中,至少17%的轻链具有1个位于FW2的突变;在一个实施方式中,至少1%的轻链具有2个位于FW2的突变;在一个实施方式中,至少1%的轻链具有3个位于FW2的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约10%的Vκ1-39/Jκ5来源的轻链具有至少1个或不多于2个位于CDR2的突变;在一个实施方式中,至少10%的轻链具有1个位于CDR2的突变;在一个实施方式中,至少1%的轻链具有2个位于CDR2的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约29%的Vκ1-39/Jκ5来源的轻链具有至少1个或不多于4个位于FW3的突变;在一个实施方式中,至少21%的轻链具有1个位于FW3的突变;在一个实施方式中,至少5%的轻链具有2个位于FW3的突变;在一个实施方式中,至少2%的轻链具有3个位于FW3的突变;在一个实施方式中,至少2%的轻链具有4个位于FW3的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约37%的Vκ1-39/Jκ5来源的轻链具有至少1个或不多于4个位于CDR3的突变;在一个实施方式中,至少27%的轻链具有1个位于CDR3的突变;在一个实施方式中,至少8%的轻链具有2个位于CDR3的突变;在一个实施方式中,至少1%的轻链具有3个位于CDR3的突变;在一个实施方式中,至少1%的轻链具有4个位于CDR3的突变。在一个实施方式中,提供了源自本文所述小鼠的抗原特异性抗体群,其中抗体包含来源于人Vκ1-39/Jκ5重排的轻链,并且大约9%的Vκ1-39/Jκ5来源的轻链具有1个或更多的位于FW1的突变,大约25%的Vκ1-39/Jκ5来源的轻链具有1个或更多的位于CDR1的突变,大约20%的Vκ1-39/Jκ5来源的轻链具有1个或更多的位于FW2的突变,大约10%的Vκ1-39/Jκ5来源的轻链具有1个或更多的位于CDR2的突变,大约29%的Vκ1-39/Jκ5来源的轻链具有1个或更多的位于FW3的突变,并且大约37%的Vκ1-39/Jκ5来源的轻链具有1个或更多的位于CDR3的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约35%的重链具有至少1个位于FW1的突变;在一个实施方式中,至少25%的重链具有1个位于FW1的突变;在一个实施方式中,至少9%的重链具有2个位于FW1的突变;在一个实施方式中,至少1%的重链具有3个位于FW1的突变;在一个实施方式中,至少1%的重链具有多于5个位于FW1的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约92%的重链具有至少1个或不多于4个位于CDR1的突变;在一个实施方式中,至少92%的重链具有至少1个、至少2个、至少3个或至少4个位于CDR1的突变;在一个实施方式中,至少26%的重链具有1个位于CDR1的突变;在一个实施方式中,至少44%的重链具有2个位于CDR1的突变;在一个实施方式中,至少19%的重链具有3个位于CDR1的突变;在一个实施方式中,至少3%的重链具有4个位于CDR1的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约66%的重链具有至少1个或不多于3个位于FW2的突变;在一个实施方式中,至少66%的重链具有至少1个、至少2个或至少3个位于FW2的突变;在一个实施方式中,至少35%的重链具有1个位于FW2的突变;在一个实施方式中,至少23%的重链具有2个位于FW2的突变;在一个实施方式中,至少8%的重链具有3个位于FW2的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约70%的重链具有至少1个或不多于4个位于CDR2的突变;在一个实施方式中,至少70%的重链具有至少2个、至少3个或至少4个位于CDR2的突变;在一个实施方式中,至少34%的重链具有1个位于CDR2的突变;在一个实施方式中,至少20%的重链具有2个位于CDR2的突变;在一个实施方式中,至少12%的重链具有3个位于CDR2的突变;在一个实施方式中,至少5%的重链具有4个位于CDR2的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约91%的重链具有至少1个或多至5个或更多的位于FW3的突变;在一个实施方式中,至少91%的重链具有至少2个、至少3个、至少4个或至少5个或更多个位于FW3的突变;在一个实施方式中,至少19%的重链具有1个位于FW3的突变;在一个实施方式中,至少33%的重链具有2个位于FW3的突变;在一个实施方式中,至少22%的重链具有3个位于FW3的突变;在一个实施方式中,至少11%的重链具有4个位于FW3的突变;在一个实施方式中,至少7%的重链具有5个或更多个位于FW3的突变。在一个实施方式中,轻链来源于人Vκ1-39/Jκ5重排,并且大约63%的重链具有至少1个或不多于2个位于CDR3的突变;在一个实施方式中,至少63%的重链具有至少1个位于CDR3的突变;在一个实施方式中,至少54%的重链具有1个位于CDR3的突变;在一个实施方式中,至少9%的重链具有2个位于CDR3的突变。在一个实施方式中,提供了源自本文所述小鼠的抗原特异性抗体群,其中抗体包含来源于人Vκ1-39/Jκ5重排的轻链并且至少35%的重链具有1个或更多个位于FW1的突变,大约92%的重链具有1个或更多个位于CDR1的突变,大约66%的重链具有1个或更多个位于FW2的突变,大约70%的重链具有1个或更多个位于CDR2的突变,大约91%的重链具有1个或更多个位于FW3的突变,大约63%的重链具有1个或更多个位于CDR3的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且轻链基因具有至少1个或不多于2个体细胞高变;在一个实施方式中,轻链基因具有至少2个、至少3个、至少4个或更多个体细胞高变。在具体的实施方式中,突变存在于轻链的一个或多个框架区中。在具体的实施方式中,突变存在于轻链的一个或多个CDR区中。在具体的实施方式中,突变存在于轻链的一个或多个框架区和/或一个或多个CDR区中。在多个实施方式中,框架区选自框架1(FW1)、框架2(FW2)、框架3(FW3)和/或其组合。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且大约10%的Vκ3-20/Jκ1来源的轻链具有至少一个位于FW1的突变;在一个实施方式中,至少10%的轻链具有一个位于FW1的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且大约53%的Vκ3-20/Jκ1来源的轻链具有至少1个或不多于2个位于CDR1的突变;在一个实施方式中,至少27%的轻链具有1个或多个位于CDR1的突变;在一个实施方式中,大约54%的轻链具有1个或2个位于CDR1的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且大约6%的Vκ3-20/Jκ1来源的轻链具有至少1个或不多于2个位于FW2的突变;在一个实施方式中,至少6%的轻链具有至少1个位于FW2的突变;在一个实施方式中,至少3%的轻链具有1个位于FW2的突变;在一个实施方式中,至少3%的轻链具有2个位于FW2的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且至少约3%的Vκ3-20/Jκ1来源的轻链具有至少1个位于CDR2的突变;在一个实施方式中,至少3%的轻链具有1个位于CDR2的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且大约17%或更多的Vκ3-20/Jκ1来源的轻链具有至少1个或不多于2个位于FW3的突变;在一个实施方式中,至少20%的轻链具有1个位于FW3的突变;在一个实施方式中,至少17%的轻链具有2个位于FW3的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且至少43%的Vκ3-20/Jκ1来源的轻链具有至少1个位于CDR3的突变;在一个实施方式中,至少43%的轻链具有1个位于CDR3的突变。在一个实施方式中,提供了源自本文所述小鼠的抗原特异性抗体群,其中抗体包含来源于人Vκ3-20/Jκ1重排的轻链,并且大约10%的Vκ3-20/Jκ1来源的轻链具有1个或更多的位于FW1的突变,大约53%的Vκ3-20/Jκ1来源的轻链具有1个或更多的位于CDR1的突变,大约6%的Vκ3-20/Jκ1来源的轻链具有1个或更多的位于FW2的突变,大约3%的Vκ3-20/Jκ1来源的轻链具有1个或更多的位于CDR2的突变,大约37%的Vκ3-20/Jκ1来源的轻链具有1个或更多的位于FW3的突变,并且大约43%的Vκ3-20/Jκ1来源的轻链具有1个或更多的位于CDR3的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且大约43%的重链具有至少1个或不多于2个位于FW1的突变;在一个实施方式中,至少41%的重链具有至少1个位于FW1的突变;在一个实施方式中,大约41%的重链具有1个位于FW1的突变;在一个实施方式中,大约2%的重链具有2个位于FW1的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且大约92%的重链具有至少1个或不多于4个位于CDR1的突变;在一个实施方式中,至少43%的重链具有至少1个位于CDR1的突变;在一个实施方式中,至少25%的重链具有至少2个位于CDR1的突变;在一个实施方式中,至少15%的重链具有至少3个位于CDR1的突变;在一个实施方式中,至少10%的重链具有4个或更多的位于CDR1的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且大约46%的重链具有至少1个或不多于3个位于FW2的突变;在一个实施方式中,至少34%的重链具有至少1个位于FW2的突变;在一个实施方式中,至少10%的重链具有2个或更多的位于FW2的突变;在一个实施方式中,至少2%的重链具有3个或更多的位于FW2的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且大约84%的重链具有至少1个或多至5个或多于5个位于CDR2的突变;在一个实施方式中,至少39%的重链具有1个或更多的位于CDR2的突变;在一个实施方式中,至少18%的重链具有2个或更多的位于CDR2的突变;在一个实施方式中,至少21%的重链具有3个或更多的位于CDR2的突变;在一个实施方式中,至少3%的重链具有4个或更多的位于CDR2的突变;在一个实施方式中,至少2%的重链具有5个或更多的位于CDR2的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且大约92%的重链具有至少1个或多至5个或多于5个位于FW3的突变;在一个实施方式中,至少21%的重链具有至少1个位于FW3的突变;在一个实施方式中,至少20%的重链具有至少2个位于FW3的突变;在一个实施方式中,至少13%的重链具有至少3个位于FW3的突变;在一个实施方式中,至少20%的重链具有至少4个位于FW3的突变;在一个实施方式中,至少18%的重链具有至少5个位于FW3的突变。在一个实施方式中,轻链来源于人Vκ3-20/Jκ1重排,并且大约7%的重链具有至少1个位于CDR3的突变;在一个实施方式中,大约7%的重链具有1个位于CDR3的突变。在一个实施方式中,提供了源自本文所述小鼠的抗原特异性抗体群,其中抗体包含来源于人Vκ3-20/Jκ1重排的轻链并且大约43%的重链具有1个或更多个位于FW1的突变,大约92%的重链具有1个或更多个位于CDR1的突变,大约46%的重链具有1个或更多个位于FW2的突变,大约84%的重链具有1个或更多个位于CDR2的突变,大约92%的重链具有1个或更多个位于FW3的突变,大约7%的重链具有1个或更多个位于CDR3的突变。在一个方面,提供了表达来自重排的免疫球蛋白轻链序列的免疫球蛋白轻链的小鼠,其中重排的免疫球蛋白轻链序列存在于小鼠的种系中,其中免疫球蛋白轻链包括人可变序列。在一个实施方式中,小鼠的种系包括来源于与存在于包含重排的轻链序列的小鼠的每一个B细胞中的所有非替代轻链序列相同的V区段和相同的J区段的重排的免疫球蛋白轻链序列。在一个实施方式中,小鼠的种系缺少功能性未经重排的免疫球蛋白轻链V基因区段。在一个实施方式中,小鼠的种系缺少功能性未经重排的免疫球蛋白轻链J基因区段。在一个实施方式中,小鼠的种系包含不多于1个、不多于2个或不多于3个经重排的(V/J)轻链序列。在一个实施方式中,重排的V/J序列包括κ轻链序列。在具体的实施方式中,κ轻链序列是人κ轻链序列。在具体的实施方式中,κ轻链序列选自人Vκ1-39/J序列、人Vκ3-20/J序列及其组合。在具体的实施方式中,κ轻链序列是人Vκ1-39/Jκ5序列。在具体的实施方式中,κ轻链序列是人Vκ3-20/Jκ1序列。在一个实施方式中,小鼠在其种系中还包括选自相对于重排的免疫球蛋白轻链序列的5′侧的小鼠κ内含子增强子、小鼠κ3′增强子及其组合的序列。在一个实施方式中,小鼠包含未经重排的人VH基因区段、未经重排的人DH基因区段和未经重排的人JH基因区段,其中VH、DH和JH基因区段能够重排以形成可操作地连接至重链恒定基因序列的免疫球蛋白重链可变基因序列。在一个实施方式中,小鼠包含多个人VH、DH和JH基因区段。在具体的实施方式中,人VH、DH和JH基因区段在内源小鼠免疫球蛋白重链基因座上置换内源小鼠VH、DH和JH基因区段。在具体的实施方式中,小鼠包含用所有或基本上所有的功能性人VH、DH和JH基因区段对所有或基本上所有的功能性小鼠VH、DH和JH基因区段的置换。在一个实施方式中,小鼠表达包含小鼠恒定序列的免疫球蛋白轻链。在一个实施方式中,小鼠表达包含人恒定序列的免疫球蛋白轻链。在一个实施方式中,小鼠表达包含选自CH1序列、铰链序列、CH2序列、CH3序列及其组合的小鼠序列的免疫球蛋白重链。在一个实施方式中,小鼠表达包含选自CH1序列、铰链序列、CH2序列、CH3序列及其组合的人序列的免疫球蛋白重链。在一个实施方式中,小鼠种系中重排的免疫球蛋白轻链序列位于内源小鼠免疫球蛋白轻链基因座。在具体的实施方式中,小鼠种系中重排的免疫球蛋白轻链序列在内源小鼠免疫球蛋白轻链基因座上置换所有或基本上所有的小鼠轻链V和J序列。在一个方面,提供了包含B细胞群的小鼠,所述B细胞群的特征在于包含非替代轻链序列的每个B细胞包含来源于单一的人V区段和单一的人J区段的经重排的轻链基因,其中小鼠种系中的唯一的轻链可变序列是来源于单一的人V区段和单一的人J区段的重排序列,并且其中包含重排的轻链基因每个B细胞还包含编码同源人重链可变结构域的基因,并且其中重排的轻链基因包括至少1个、至少2个、至少3个或至少4个体细胞高变。在一个方面,提供了源自本文所述的小鼠的多能性、诱导多能性或全能性细胞。在具体的实施方式中,细胞是小鼠胚胎干(ES)细胞。在一个方面,提供了源自本文所述的小鼠的组织。在一个实施方式中,组织源自本文所述的小鼠的脾、淋巴结或骨髓。在一个方面,提供了源自本文所述小鼠的细胞核。在一个实施方式中,细胞核来自非B细胞的二倍体细胞。在一个方面,提供了分离自本文所述的小鼠的小鼠细胞。在一个实施方式中,细胞是ES细胞。在一个实施方式中,细胞是淋巴细胞。在一个实施方式中,淋巴细胞是B细胞。在一个实施方式中,B细胞表达包含来源于人基因区段的可变结构域的嵌合重链;和来源于重排的人Vκ1-39/J序列、重排的人Vκ3-20/J序列或其组合的轻链;其中重链可变结构域融合至小鼠恒定区并且轻链可变结构域融合至小鼠或人恒定区。在一个方面,提供了杂交瘤细胞,其中所述杂交瘤细胞用本文所述的小鼠的B细胞制备。在具体的实施方式中,B细胞来自已用包含目的表位的抗原免疫的本文所述的小鼠,并且B细胞表达结合目的表位的结合蛋白,结合蛋白具有经体细胞突变的人VH结构域和小鼠CH,并且具有来源于重排的人Vκ1-39Jκ5或重排的人Vκ3-20Jκ1的人VL结构域和小鼠CL。在一个方面,提供了小鼠胚胎,其中所述胚胎包含源自本文所述小鼠的供体ES细胞。在一个方面,提供了靶向载体,其在相对于载体的5′和3′小鼠同源臂序列的转录方向上从5′至3′,包含5′小鼠同源臂、人或小鼠免疫球蛋白启动子、人或小鼠前导序列,和选自重排的人Vκ1-39Jκ5或重排的人Vκ3-20Jκ1的人VL区,和3′小鼠同源臂。在一个实施方式中,5′和3′同源臂将载体靶向至相对于存在于小鼠Cκ基因的5′侧并且邻近于其的增强子序列的5′的序列。在一个实施方式中,启动子是人免疫球蛋白可变区基因区段启动子。在具体的实施方式中,启动子是人Vκ3-15启动子。在一个实施方式中,前导序列是小鼠前导序列。在具体的实施方式中,小鼠前导序列是小鼠Vκ3-7前导序列。在一个方面,提供了如上面描述的靶向载体,但人或小鼠启动子的5′侧接了位点特异性重组识别位点(SRRS)以取代5′小鼠同源臂,并且人VL区的3′侧接了SRRS以取代3′小鼠同源臂。在一个方面,如本文所描述的小鼠生产的反向嵌合抗体,其中所述反向嵌合抗体包含含有人VL和小鼠CL的轻链,和含有人VH和小鼠CH的重链。在一个方面,提供了制备抗体的方法,所述方法包括在单一细胞中表达(a)本文所述的经免疫的小鼠的与人CH基因序列融合的第一VH基因序列;(b)本文所述的经免疫的小鼠的与人CL基因序列融合的VL基因序列;以及(c)在足够表达完全人抗体的条件下维持细胞,并且分离抗体。在一个实施方式中,细胞含有本文所述的第二免疫小鼠的与人CH基因序列融合的第二VH基因序列,第一VH基因序列编码识别第一表位的VH结构域,并且第二VH基因序列编码识别第二表位的VH结构域,其中第一表位和第二表位是不同的。在一个方面,提供了制备表位结合蛋白的方法,所述方法包括将本文描述的小鼠暴露于包含目的表位的免疫原,在足以使小鼠产生特异性结合目的表位的免疫球蛋白分子的条件下维持小鼠,和分离特异性结合目的表位的免疫球蛋白分子;其中表位结合蛋白包含含有经体细胞突变的人VH和小鼠CH的重链,所述重链与含有小鼠CL和源自重排的人Vκ1-39Jκ5或重排的人Vκ3-20Jκ1的人VL的轻链结合。在一个方面,提供了表达表位结合蛋白的细胞,其中所述细胞含有:(a)编码来源于重排的人Vκ1-39Jκ5或重排的人Vκ3-20Jκ1的人VL结构域的人核苷酸序列,其中所述人核苷酸序列融合(直接地或通过接头)至人免疫球蛋白轻链恒定结构域cDNA序列(例如人κ恒定结构域DNA序列);以及(b)编码来源于第一人VH核苷酸序列的人VH结构域的第一人VH核苷酸序列,其中所述第一人VH核苷酸序列融合(直接或通过接头)至人免疫球蛋白重链恒定结构域cDNA序列;其中表位结合蛋白识别第一表位。在一个实施方式中,表位结合蛋白以低于10-6M、低于10-8M、低于10-9M、低于10-10M、低于10-11M或低于10-12M的解离常数结合第一表位。在一个实施方式中,细胞包含编码第二人VH结构域的第二人核苷酸序列,其中第二人序列融合(直接或通过接头)至人免疫球蛋白重链恒定结构域cDNA序列,并且其中第二人VH结构域不特异性识别第一表位(例如,显示例如10-6M、10-5M、10-4M或更高的解离常数),并且其中表位结合蛋白识别第一表位和第二表位,并且其中第一和第二免疫球蛋白重链各自与相同的(a)的轻链结合。在一个实施方式中,第二VH结构域以低于10-6M、低于10-7M、低于10-8M、低于10-9M、低于10-10M、低于10-11M或低于10-12M的解离常数结合第二表位。在一个实施方式中,表位结合蛋白包含第一免疫球蛋白重链和第二免疫球蛋白重链,每条重链与来源于选自人Vκ1-39Jκ5或人Vκ3-20Jκ1的重排的人VL区的相同的轻链结合,其中第一免疫球蛋白重链以纳摩至皮摩范围内的解离常数结合第一表位,第二免疫球蛋白重链以纳摩尔至皮摩范围内的解离常数结合第二表位,第一表位和第二表位是不同的,第一免疫球蛋白重链不结合第二表位或以弱于微摩范围(例如毫摩范围)的解离常数结合第二表位,第二免疫球蛋白重链不结合第一表位或以弱于微摩范围(例如毫摩范围)的解离常数结合第一表位,并且VL、第一免疫球蛋白重链的VH和第二免疫球蛋白重链的VH中的一个或多个是经体细胞突变的。在一个实施方式中,第一免疫球蛋白重链包含蛋白A结合残基,并且第二免疫球蛋白重链缺少蛋白A结合残基。在一个实施方式中,细胞选自CHO、COS、293、HeLa和表达病毒核酸序列的视网膜细胞(如例PERC.6TM细胞)。在一个方面,提供了反向嵌合抗体,其包含人VH和小鼠重链恒定结构域,人VL和小鼠轻链恒定结构域,其中抗体通过包括用包含表位的免疫原免疫本文所述的小鼠的方法制备,并且抗体特异性结合用来免疫小鼠的免疫原的表位。在一个实施方式中,VL结构域是经体细胞突变的。在一个实施方式中,VH结构域是经体细胞突变的。在一个实施方式中,VL结构域和VH结构域都是经体细胞突变的。在一个实施方式中,VL连接至小鼠Cκ结构域。在一个方面,提供了小鼠,其包含在内源小鼠重链基因座上置换所有或基本上所有的小鼠VH基因区段的人VH基因区段;置换所有小鼠轻链基因区段的不多于1个或2个的选自重排的Vκ1-39/J和重排的Vκ3-20/J或其组合的重排的人轻链VL/JL序列;其中人重链可变基因区段连接至小鼠恒定基因,并且重排的人轻链基因序列连接至人或小鼠恒定基因。在一个方面,小鼠ES细胞包含用人重链可变基因区段对所有或基本上所有的小鼠重链可变基因区段的置换,和不多于1个或2个的重排的人轻链VL/JL序列,其中人重链可变基因区段连接至小鼠免疫球蛋白重链恒定基因,并且重排的人轻链VL/JL序列连接至小鼠或人免疫球蛋白轻链恒定基因。在具体的实施方式中,轻链恒定基因是小鼠恒定基因。在一个方面,提供了通过本文描述的小鼠制备的抗原结合蛋白。在具体的实施方式中,抗原结合蛋白包含与小鼠恒定区融合的人免疫球蛋白重链可变区,和来源于Vκ1-39基因区段或Vκ3-20基因区段的人免疫球蛋白轻链可变区,其中轻链恒定区是小鼠恒定区。在一个方面,提供了从来自本文描述的小鼠的免疫球蛋白可变区基因序列制备的完全人抗原结合蛋白,其中抗原结合蛋白包含含有源自本文描述的小鼠的序列的人可变区的完全人重链,并且包含含有Vκ1-39或Vκ3-20的完全人轻链。在一个实施方式中,轻链可变区包含1至5个体细胞突变。在一个实施方式中,轻链可变区是在小鼠B细胞中与重链可变区配对的同源轻链可变区。在一个实施方式中,完全人抗原结合蛋白包含第一重链和第二重链,其中第一重链和第二重链包含不同的独立地源自本文描述的小鼠的可变区,并且其中第一和第二重链的每一个在宿主细胞中与来源于Vκ1-39基因区段或Vκ3-20基因区段的人轻链结合表达。在一个实施方式中,第一重链包含特异性结合第一抗原的第一表位的第一重链可变区,并且第二重链包含特异性结合第二抗原的第二表位的第二重链可变区。在具体的实施方式中,第一抗原和第二抗原是不同的。在具体的实施方式中,第一抗原和第二抗原是相同的,并且第一表位和第二表位是不同的;在具体的实施方式中,结合蛋白的第一分子对第一表位的结合不会阻碍结合蛋白的第二分子对第二表位的结合。在一个方面,源自本文描述的小鼠的人免疫球蛋白序列的完全人结合蛋白包含第一免疫球蛋白重链和第二免疫球蛋白重链,其中第一免疫球蛋白重链包含不同于第二免疫球蛋白重链的可变区的第一可变区,并且其中第一免疫球蛋白重链包含野生型蛋白A结合决定簇,并且第二重链缺少野生型蛋白A结合决定簇。在一个实施方式中,第一免疫球蛋白重链在分离条件下结合蛋白A,并且第二免疫球蛋白重链在分离条件下不结合蛋白A或以至少10倍、百倍或千倍弱于第一免疫球蛋白重链结合蛋白A的能力结合蛋白A。在具体的实施方式中,第一和第二重链是IgG1同种型,其中第二重链包含选自95R(EU435R)、96F(EU436F)及其组合的修饰,并且其中第一重链缺少这样的修饰。在一个方面,提供了制备双特异性抗原结合蛋白的方法,包括将本文描述的第一小鼠暴露给包含第一表位的第一目的抗原,将本文描述的第二小鼠暴露给包含第二表位的第二目的抗原,允许第一和第二小鼠各自进行针对目的抗原的免疫应答,在第一小鼠中鉴定结合第一目的抗原的第一表位的第一人重链可变区,在第二小鼠中鉴定结合第二目的抗原的第二表位的第二人重链可变区,制备编码结合第一目的抗原的第一表位的第一重链的第一完全人重链基因,制备编码结合第二目的抗原的第二表位的第二重链的第二完全人重链基因,在表达来源于人Vκ1-39或人Vκ3-20基因区段的单一完全人轻链的细胞中表达第一重链和第二重链以形成双特异性抗原结合蛋白,以及分离所述双特异性抗原结合蛋白。在一个实施方式中,第一抗原和第二抗原是不同的。在一个实施方式中,第一抗原和第二抗原是相同的,并且第一表位和第二表位是不同的。在一个实施方式中,第一重链可变区与第一表位的结合不会阻碍第二重链可变区与第二表位的结合。在一个实施方式中,人轻链当与第一重链配对时特异性结合第一抗原的第一表位,并且当与第二重链配对时特异性结合第二抗原的第二表位。在一个实施方式中,第一抗原选自可溶性抗原和细胞表面抗原(例如肿瘤抗原),并且第二抗原包括细胞表面受体。在具体的实施方式中,细胞表面受体是免疫球蛋白受体。在具体的实施方式中,免疫球蛋白受体是Fc受体。在一个实施方式中,第一抗原和第二抗原是相同的细胞表面受体,并且第一重链结合至第一表位不阻碍第二重链结合至第二表位。在一个实施方式中,轻链的轻链可变结构域包含2至5个体细胞突变。在一个实施方式中,轻链可变结构域是在第一或第二免疫的小鼠的B细胞中与第一或第二重链可变结合域表达的经体细胞突变的同源轻链。在一个实施方式中,细胞的轻链包含种系序列。在一个实施方式中,第一完全人重链具有降低其时蛋白A的亲和力的氨基酸修饰,而第二完全人重链不包含降低其对蛋白A的亲和力的修饰。在一个方面,提供了制备特异性结合第一和第二抗原的双特异性抗体的方法,其中所述方法包括(a)鉴定编码特异于第一抗原的第一人重链可变(VH)结构域的第一核酸序列;(b)鉴定编码特异于第二抗原的第二人重链可变(VH)结构域的第二核酸序列;(c)提供编码人轻链可变(VL)区的第三核酸序列,所述人轻链可变(VL)区当与(a)的VH区配时时特异性结合第一抗原,并且当与(b)的VH区配对时特异性结合第二抗原;(d)培养含有第一、第二和第三核酸序列的宿主细胞以允许第一和第二人VH区和人VL区表达以形成双特异性抗体;和(d)回收所述双特异性抗体。在多个方面,第一和第二抗原是彼此不同的。在多个方面,第一和第二核酸序列分离自表达来自重排的免疫球蛋白轻链序列的人免疫球蛋白VL区的经免疫的小鼠,其中重排的免疫球蛋白序列在小鼠的种系中。在一个实施方式中,人VL区来源于包含人Vκ1-39基因区段或人Vκ3-20基因区段的重排的人轻链序列。在具体的实施方式中,重排的人轻链序列是种系序列(即在V基因区段序列中不包含体细胞高变)。在一个实施方式中,第三核酸序列分离自表达来自小鼠种系中的重排的免疫球蛋白轻链序列的人免疫球蛋白VL区的小鼠。在一个实施方式中,重排的免疫球蛋白轻链序列包含人Vκ1-39或人Vκ3-20基因区段。在具体的实施方式中,重排的免疫球蛋白轻链序列包含人Vκ1-39基因区段。在一个实施方式中,人免疫球蛋白VL区从经修饰的内源免疫球蛋白轻链基因座表达。在一个实施方式中,第一和第二抗原存在于一个分子上。在一个实施方式中,第一和第二抗原存在于不同的分子上。在多个实施方式中,第一或第二核酸序列包含降低编码的重链对蛋白A的亲和力的修饰。在一个实施方式中,第一或第二核酸序列包含重排的人重链可变区序列,所述可变区序列包含选自VHl-2、VHl-3、VHl-8、VH1-18、VHl-24、VHl-46、VHl-58、VH1-69、VH2-5、VH2-26、VH2-70、VH3-7、VH3-9、VH3-11、VH3-13、VH3-15、VH3-20、VH3-21、VH3-23,VH3-30,VH3-33,VH3-43、VH3-48、VH3-53、VH3-64、VH3-72,VH3-73、VH4-31、VH4-34、VH4-39、VH4-59、VH5-51和VH6-1的人重链基因区段。在具体的实施方式中,重链基因区段是VH2-5、VH3-23或VH3-30。在一个方面,提供了制备特异性结合第一和第二抗原的双特异性抗体的方法,其中所述方法包括(a)鉴定编码特异于第一抗原的第一人重链可变(VH)结构域的第一核酸序列;(b)鉴定编码特异于第二抗原的第二人重链可变(VH)结构域的第二核酸序列;(c)提供编码来源于人Vκ1-39或人Vκ3-20基因区段的人轻链可变(VL)区的第三核酸序列,所述人轻链可变(VL)区当与(a)的VH区配对时特异性结合第一抗原,并且当与(b)的VH区配对时特异性结合第二抗原;(d)培养含有第一、第二和第三核酸序列的宿主细胞以允许第一和第二人VH区和人VL区表达以形成双特异性抗体;和(d)回收所述双特异性抗体。在多个方面,第一和第二抗原是彼此不同的。在多个方面,第一和第二核酸序列分离自经免疫的小鼠,所述小鼠表达来自来源于人Vκ1-39或人Vκ3-20基因区段的重排的免疫球蛋白序列的人免疫球蛋白VL区,其中重排的人Vκ1-39或人Vκ3-20基因区段在小鼠的种系中。在一个实施方式中,第三核酸序列是种系序列(即在V基因区段序列中不包含体细胞高变)。在一个实施方式中,第三核酸序列分离自表达人免疫球蛋白VL区的小鼠,所述人免疫球蛋白VL区来源于来自小鼠种系中的重排的免疫球蛋白轻链序列的人Vκ1-39或人Vκ3-20基因区段。在具体的实施方式中,第三核酸序列在互补决定区(CDR)和/或框架区(FWR)中包含2至5个体细胞高变。在一个实施方式中,人免疫球蛋白VL区从经修饰的内源免疫球蛋白轻链基因座表达。在一个实施方式中,第一和第二抗原存在于一个分子上。在一个实施方式中,第一和第二抗原存在于不同的分子上。在一个实施方式中,第一或第二核酸序列包含降低编码的重链对蛋白A的亲和力的修饰。在一个实施方式中,第一或第二核酸序列包含重排的人重链可变区序列,所述可变区序列包含选自VHl-2、VHl-3、VHl-8、VH1-18、VHl-24、VHl-46、VHl-58、VH1-69、VH2-5、VH2-26、VH2-70、VH3-7、VH3-9、VH3-11、VH3-13、VH3-15、VH3-20、VH3-21、VH3-23,VH3-30,VH3-33,VH3-43、VH3-48、VH3-53、VH3-64、VH3-72,VH3-73、VH4-31、VH4-34、VH4-39、VH4-59、VH5-51和VH6-1的人重链基因区段。在具体的实施方式中,重链基因区段是VH2-5、VH3-23或VH3-30。在一个方面,提供了制备双特异性抗体的方法,包括将本文描述的小鼠暴露给目的抗原,允许小鼠进行针对目的抗原的免疫应答,鉴定结合目的抗原的第一表位的第一人重链可变区,鉴定结合目的抗原的第二表位的第二人重链可变区,制备编码结合目的抗原的第一表位的第一重链的第一完全人重链基因,制备编码结合目的抗原的第二表位的第二重链的第二完全人重链基因,在表达来源于人Vκ1-39或人Vκ3-20基因区段的单一完全人轻链的细胞中表达第一重链和第二重链以形成双特异性抗体,以及分离双特异性抗原结合蛋白。在一个实施方式中,第一表位和第二表位是不同的。在一个实施方式中,第一重链可变区与第一表位的结合不会阻碍第二重链可变区与第二表位的结合。在一个实施方式中,第一和第二重链能够同时结合第一和第二表位。在一个实施方式中,双特异性抗体同时结合第一和第二表位。在一个实施方式中,双特异性抗体独立地结合第一和第二表位。在一个实施方式中,双特异性抗体对抗原的结合反应大约2倍高于第一重链可变区对抗原的结合反应。在一个实施方式中,双特异性抗体对抗原的结合反应大约2倍高于第二重链可变区对抗原的结合反应。在一个实施方式中,双特异性抗体对抗原的结合反应大约相同或大约等于第一重链可变区和/或第二重链可变区对抗原的结合反应。在一个实施方式中,抗原选自可溶性抗原、细胞表面抗原(例如肿瘤抗原)和细胞表面受体。在具体的实施方式中,细胞表面受体是免疫球蛋白受体。在具体的实施方式中,免疫球蛋白受体是Fc受体。在一个实施方式中,轻链的轻链可变结构域包含2至5个体细胞突变。在一个实施方式中,轻链可变结构域是在经免疫的小鼠的B细胞中与第一或第二重链可变结合域表达的经体细胞突变的同源轻链。在一个实施方式中,第一完全人重链具有降低其对蛋白A的亲和力的氨基酸修饰,而第二完全人重链不包含降低其对蛋白A的亲和力的修饰。在多个实施方式中,制备双特异性抗体的方法通过采用共同轻链来配时双特异性抗体的每个重链可变区而得到加强。在多个实施方式中,采用本文所描述的共同轻链,相较于使用原始同源轻链,降低了不适当的缺少双特异性的免疫球蛋白的种类的数目。在多个实施方式中,从包含共同轻链的单特异性抗体鉴定双特异性抗体的重链可变区。在多个实施方式中,双特异性抗体的重链可变区包含在体内在小鼠B细胞中经重排的人重链可变基因区段,其在体内在小鼠B细胞中重排,所述B细胞在之前已被工程化以表达与人重链同源的有限的人轻链库或单一的人轻链,并且作为暴露于目的抗原的响应,产生含有多个与一个或两个中的一个可能的人轻链可变区同源的人重链可变区的嵌合抗体库,其中所述嵌合抗体特异于目的抗原。在多个方面,提供了制备双特异性抗体的方法,所述双特异性抗体包含1)第一多肽和第二多肽,其中第一和第二多肽各自包括多聚化结构域(例如免疫球蛋白Fc结构域)从而允许第一和第二多肽形成二聚体,并且多聚化结构域促进第一和第二多肽间稳定的相互作用,并且其中多聚化结构域的一个具有降低其对蛋白A的亲和力的氨基酸修饰并且另一个多聚化结构域缺少所述修饰,2)第一和第二多肽的每一个中的结合结构域,每个结合结构域包含可变重链和可变轻链,其中第一多肽的可变区链和第二多肽的可变轻链具有共同的氨基酸序列,所述共同的序列具有等同于每条多肽的原始轻链至少80%、至少85%、优选至少90%、更优选至少95%和最优选100%序列同一性的氨基酸序列。在多个实施方式中,可变轻链来源于人Vκ1-39或人Vκ3-20基因区段。在多个实施方式中,可变轻链是重排的人轻链序列。在多个实施方式中,可变轻链分离自本文描述的小鼠。在多个实施方式中,方法包括步骤(i)培养包含编码第一多肽、第二多肽和共同轻链的核酸的宿主细胞,其中所述核酸被表达;和(ii)从宿主细胞培养物回收双特异性抗体;在一个实施方式中,编码第一多肽的核酸或编码第二多肽的核酸,具有降低其对蛋白A的亲和力的氨基酸修饰。在一个实施方式中,编码第一多肽、第二多肽和共同轻链的核酸存在于单一载体或分离的载体中。在一个实施方式中,依照前述段落将宿主细胞用于制备双特异性抗体。在一个方面,提供了制备双特异性抗体的方法,所述方法包括(a)选择分离自本文描述的小鼠的编码第一人重链可变区的第一核酸;(b)选择分离自同一个或不同的本文描述的小鼠的编码第二人重链可变区的第二核酸;(c)提供分离自本文描述的小鼠或来源于本文描述的重排的人轻链可变区的编码人轻链可变区的第三核酸;(c)将第一、第二和第三核酸引入宿主细胞,并且培养宿主细胞以使第一、第二和第三核酸的表达发生;以及(d)从细胞培养物回收形成的双特异性抗体。在一个实施方式中,第一和第二人重链可变区是经体细胞突变的。在具体的实施方式中,第一和第二人重链可变区独立地来源于选自1-2、1-3、1-8、1-18、1-24、1-46、1-58、1-69、2-5、2-26、2-70、3-7、3-9、3-11、3-13、3-15、3-16、3-20、3-21、3-23、3-30、3-33、3-43、3-48、3-53、3-64、3-72、3-73、4-31、4-34、4-39、4-59、5-51和6-1人VH基因区段的重排的人VH基因区段。在一个实施方式中,第一和第二人重链可变区独立地来源于选自2-5、3-30和3-23的重排的人VH基因区段。在一个实施方式中,第一人重链可变区来源于人VH2-5基因区段并且第二人重链可变区来源于人VH3-30基因区段。在一个实施方式中,第一人重链可变区来源于人VH3-30基因区段并且第二人重链可变区来源于人VH3-23基因区段。在一个实施方式中,第一人重链可变区来源于人VH3-23基因区段并且第二人重链可变区来源于人VH3-30基因区段。在一个实施方式中,第一或第二核酸在步骤(c)之前被修饰,其中第一或第二核酸被修饰以便其具有降低的对蛋白A的亲和力。在一个实施方式中,第三核酸分离自本文描述的小鼠。在一个实施方式中,第三核酸包含2至5个体细胞突变。在一个实施方式中,第三核酸编码来源于人Vκ1-39基因区段的人轻链可变区。在一个实施方式中,第三核酸编码来源于人Vκ3-20基因区段的人轻链可变区。在一个实施方式中,第三核酸来源于重排的人轻链可变区。在一个实施方式中,重排的人轻链可变区包含来源于人Vκ1-39基因区段或人Vκ3-20基因区段的序列。在一个实施方式中,重排的人轻链可变区包含种系人Vκ1-39序列(即,在V基因区段序列中不包含体细胞高变)。在一个实施方式中,重排的人轻链可变区包含种系人Vκ3-20序列在多个实施方式中,提供了制备包括包含来源于在其种系中缺少重排的人轻链序列的经修饰的小鼠的可变结构域的第一人重链的双特异性抗体的方法,其中第一人重链与包含来源于人Vκ1-39或人Vκ3-20基因区段的重排的人轻链可变区的同源人轻链配对。在多个实施方式中,从本文描述的经免疫的小鼠鉴定具有与第一人重链不同的特异性的第二人重链。编码两个重链和共同轻链的核酸被引入前述段落描述的宿主细胞中,以便所有三条链的表达发生并且从细胞培养物中回收双特异性抗体。在一个实施方式中,使用用于产生第一人重链可变结构域的相同抗原免疫小鼠。在一个实施方式中,使用用于产生第一人重链可变结构域的不同抗原免疫小鼠。在一方面,提供了选择可以与单一人轻链配对以制备双特异性抗体的人重链的方法,包括编码双特异性抗体的核酸和含有所述核酸的宿主细胞。在一个方面,提供了在细胞培养物中增加期望的双特异性抗体相对于非期望的产物例如单特异性抗体的数量的方法,其中双特异性抗体的重链中的一条被修饰以降低其时蛋白A的亲和力。在一个方面,提供了分离的宿主细胞,其中所述宿主细胞包括(a)编码结合第一抗原的第一人重链可变区的第一核酸序列,其中第一核酸序列分离自用第一抗原免疫的小鼠,所述小鼠表达来自小鼠种系中的重排的免疫球蛋白轻链序列的人免疫球蛋白VL区;(b)编码结合第二抗原的第二人重链可变区的第二核酸序列,其中第二核酸序列分离自用第二抗原免疫的小鼠,所述小鼠表达来自小鼠种系中的重排的免疫球蛋白轻链序列的人免疫球蛋白VL区;(c)编码人轻链可变区的第三核酸序列,所述人轻链可变区当与(a)的重链可变区配对时特异性结合第一抗原,并且当与(b)的重链可变区配对时特异性结合第二抗原。在多个方面,第一和第二抗原彼此是不同的。在多个方面,第一、第二和第三核酸序列的表达导致特异性结合第一和第二抗原的双特异性抗体的形成。在一个实施方式中,人VL区来源于包含人Vκ1-39基因区段或人Vκ3-20基因区段的重排的人轻链序列。在具体的实施方式中,重排的人轻链序列是种系序列(即在可变结构域中不包含体细胞高变)。在一个实施方式中,第三核酸序列分离自从重排的免疫球蛋白轻链序列表达人免疫球蛋白VL区的小鼠,其中重排的人轻链序列存在于小鼠的种系中。在一个实施方式中,重排的免疫球蛋白轻链序列包含人Vκ1-39基因区段或人Vκ3-20基因区段。在具体的实施方式中,人Vκ1-39基因区段或人Vκ3-20基因区段在互补决定区(CDR)或框架区(FWR)中包含至少一个体细胞高变。在具体的实施方式中,第一、第二和第三核酸序列分离自表达人免疫球蛋白VL区的小鼠,所述人免疫球蛋白VL区来源于来自重排的免疫球蛋白轻链序列的人Vκ1-39基因区段或人Vκ3-20基因区段,其中重排的免疫球蛋白轻链序列存在于小鼠的种系中。在多个实施方式中,小鼠不含有能够重排以形成免疫球蛋白轻链的内源轻链可变区基因区段。在一个实施方式中,人免疫球蛋白VL区从修饰的内源免疫球蛋白轻链基因座表达。在一个实施方式中,第一和第二抗原存在于一个分子上。在一个实施方式中,第一和第二抗原存在于不同的分子上。在一个实施方式中,第一或第二核酸序列包含降低编码的重链对蛋白A的亲和力的修饰。在一个实施方式中,第一或第二核酸序列包含重排的人重链可变区序列,所述可变区序列包含选自VHl-2、VHl-3、VHl-8、VH1-18、VHl-24、VHl-46、VHl-58、VH1-69、VH2-5、VH2-26、VH2-70、VH3-7、VH3-9、VH3-11、VH3-13、VH3-15、VH3-20、VH3-21、VH3-23、VH3-30、VH3-33,VH3-43、VH3-48、VH3-53、VH3-64、VH3-72、VH3-73、VH4-31、VH4-34、VH4-39、VH4-59、VH5-51和VH6-1的人重链基因区段。在具体的实施方式中,重链基因区段是VH2-5、VH3-23或VH3-30。在一个方面,提供了根据本发明制备的含有人重链可变结构域的抗体或双特异性抗体。在另一个方面,提供了本文描述的小鼠制备完全人抗体或完全人双特异性抗体的用途。在一个方面,本文描述的经遗传修饰的小鼠、胚胎或细胞包含保留内源调节或控制元件例如小鼠κ内含子增强子、小鼠κ3′增强子或内含子增强子和3′增强子两者的κ轻链基因座,其中调节或控制元件促进κ轻链基因座的所表达的序列的体细胞突变和亲和力成熟。在一个方面,提供了包含B细胞群的小鼠,所述B细胞群的特征在于具有来源于不多于1个或不多于2个的重排的或未经重排的免疫球蛋白轻链V和J基因区段的免疫球蛋白轻链,其中所述小鼠显示出与包含免疫球蛋白轻链V和J基因区段的野生型互补物的小鼠大致相同的κ∶λ轻链比。在一个实施方式中,免疫球蛋白轻链来源于不多于1个或不多于2个的重排的免疫球蛋白轻链V和J基因区段。在具体的实施方式中,轻链来源于不多于1个的重排的免疫球蛋白轻链V和J基因区段。在一个方面,提供了本文描述的小鼠,其表达来源于不多于1个或不多于2个的人Vκ/Jκ序列的免疫球蛋白轻链,其中所述小鼠包含用一个或多个人重链可变区基因区段对所有或基本上所有的内源小鼠重链可变区基因区段的置换,并且所述小鼠显示出约1至约20的(a)表达具有λ轻链的免疫球蛋白的CD19+B细胞对(b)表达具有κ轻链的免疫球蛋白的CD19+B细胞的比例。在一个实施方式中,小鼠表达来源于人Vκ1-39Jκ5序列的单一κ轻链,并且表达具有λ轻链的免疫球蛋白的CD19+B细胞对表达具有κ轻链的免疫球蛋白的CD19+B细胞的比例是约1至约20;在一个实施方式中,比例是约1至至少约66;在具体的实施方式中,比例是约1至66。在一个实施方式中,小鼠表达来源于人Vκ3-20Jκ5序列的单一κ轻链,并且表达具有λ轻链的免疫球蛋白的CD19+B细胞时表达具有κ轻链的免疫球蛋白的CD19+B细胞的比例是约1至约20;在一个实施方式中,比例是约1至约21。在具体的实施方式中,比例是1至20、或1至21。在一个方面,提供了表达单一的经重排的κ轻链的经遗传修饰的小鼠,其中所述小鼠包含功能性λ轻链基因座,并且其中所述小鼠表达包含Igκ+细胞的B细胞群,所述Igκ+细胞表达来源于相同的单一的经重排的κ轻链的κ轻链。在一个实施方式中,小鼠中Igκ+Igλ+B细胞的百分比大约与野生型小鼠中的相同。在具体的实施方式中,小鼠中Igκ+Igλ+B细胞的百分比是约2%至约6%。在具体的实施方式中,其中单一的经重排的κ轻链来源于Vκ1-39Jκ5序列的小鼠中的Igκ+Igλ+B细胞的百分比是约2至约3;在具体的实施方式中,百分比是约2.6。在具体的实施方式中,其中单一的经重排的κ轻链来源于Vκ3-20Jκ1序列的小鼠中的Igκ+Igλ+B细胞的百分比是约4至约8;在具体的实施方式中,百分比是约6。在一个方面,提供了遗传修饰的小鼠,其中所述小鼠表达来源于人Vκ和Jκ基因区段的单一的经重排的κ轻链,其中所述小鼠表达包含来源于单一的经重排的κ轻链序列的单一κ轻链的B细胞群,其中所述遗传修饰的小鼠未被赋予对体细胞高变的抗性。在一个实施方式中,在小鼠的B细胞上表达的至少90%的κ轻链表现出从至少1个到约5个的体细胞高变。在一个方面,提供了遗传修饰的小鼠,其被修饰以表达来源于不多于1个或不多于2个的重排的κ轻链序列的单一κ轻链,其中所述小鼠表现出高于由野生型小鼠所表现出的κ轻链使用或高于由包含κ轻链基因区段的野生型库的同一品系的小鼠所表现出的κ轻链使用约2倍或更多、至少约3倍或更多、或至少约4倍或更多的κ轻链使用。在具体的实施方式中,小鼠表达来自不多于1个重排的κ轻链序列的单一κ轻链。在更具体的实施方式中,重排的κ轻链序列选自Vκ1-39Jκ5和Vκ3-20Jκ1序列。在一个实施方式中,重排的κ轻链序列是Vκ1-39Jκ5序列。在一个实施方式中,重排的κ轻链序列是Vκ3-20Jκ1序列。在一个方面,提供了遗传修饰的小鼠,其表达来源于不多于1个或不多于2个的重排的κ轻链序列的单一κ轻链,其中所述小鼠表现出高于由具有完整的或基本上完整的人κ轻链基因座的小鼠所表现出的相同κ轻链使用大约100倍或更多、至少约200倍或更多、至少约300倍或更多、至少约400倍或更多、至少约500倍或更多、至少约600倍或更多、至少约700倍或更多、至少约800倍或更多、至少约900倍或更多、至少约1000倍或更多的κ轻链使用。在具体的实施方式中,具有完整的或基本上完整的人κ轻链基因座的小鼠缺少功能性未经重排的小鼠κ轻链序列。在具体的实施方式中,小鼠表达来自不多于1个重排的κ轻链序列的单一κ轻链。在具体的实施方式中,小鼠包含一个拷贝的重排的κ轻链序列(例如杂合子)。在具体的实施方式中,小鼠包含两个拷贝的重排的κ轻链序列(例如纯合子)。在更具体的实施方式中,重排的κ轻链序列选自Vκ1-39Jκ5和Vκ3-20Jκ1序列。在一个实施方式中,重排的κ轻链序列是Vκ1-39Jκ5序列。在一个实施方式中,重排的κ轻链序列是Vκ3-20Jκ1序列。在一个方面,提供了遗传修饰的小鼠,其表达来源于不多于1个或不多于2个的重排的轻链序列的单一轻链,其中遗传修饰的小鼠中的轻链显示出高于由具有完整的或基本上完整的轻链基因座的小鼠所表现出的相同的重排的轻链的表达至少10倍至约1000倍、100倍至约1000倍、200倍至约1000倍、300倍至约1000倍、400倍至约1000倍、500倍至约1000倍、600倍至约1000倍、700倍至约1000倍、800倍至约1000倍、或900倍至约1000倍的表达水平。在一个实施方式中,轻链包含人序列。在具体的实施方式中,人序列是κ序列。在一个实施方式中,人序列是λ序列。在一个实施方式中,轻链是完全人轻链。在一个实施方式中,表达水平通过定量转录的轻链序列的mRNA和将其与具有完整或基本上完整的轻链基因座的小鼠的转录的轻链序列进行比较来表征。在一个方面,提供了遗传修饰的小鼠,其表达来源于不多于1个或不多于2个的重排的κ轻链序列的单一κ轻链,其中所述小鼠在用抗原免疫后表现出可与使用相同抗原免疫的野生型小鼠相比较的血清滴度。在具体的实施方式中,小鼠表达来自不多于1个的重排的κ轻链序列的单一κ轻链。在一个实施方式中,血清滴度被表征为总免疫球蛋白。在具体的实施方式中,血清滴度被表征为IgM比滴度(specifictiter)。在具体的实施方式中,血清滴度被表征为IgG比滴度。在更具体的实施方式中,重排的κ轻链序列选自Vκ1-39Jκ5和Vκ3-20Jκ1序列。在一个实施方式中,重排的κ轻链序列是Vκ1-39Jκ5序列。在一个实施方式中,重排的κ轻链序列是Vκ3-20Jκ1序列。在一个方面,提供了遗传修饰的细胞,其表达抗原特异性抗体群,其中抗原特异性抗体群的所有免疫球蛋白轻链包含来源于相同的单一人VL基因区段的人轻链可变(VL)区,并且免疫球蛋白重链包含来源于多种人VH基因区段中的一种的人重链可变(VH)区。在多个实施方式中,人VH基因区段选自VH1-2、VH1-3、VH1-8、VH1-18、VH1-24、VH1-46、VH1-58、VH1-69、VH2-5、VH2-26、VH2-70、VH3-7、VH3-9、VH3-11、VH3-13、VH3-15、VH3-20、VH3-21、VH3-23、VH3-30、VH3-33,VH3-43、VH3-48、VH3-53、VH3-64、VH3-72、VH3-73、VH4-31、VH4-34、VH4-39、VH4-59、VH5-51和VH6-1。在多个实施方式中,相同的单一人VL基因区段选自人Vκ1-39基因区段和人Vκ3-20基因区段。在多个实施方式中,所有免疫球蛋白轻链包含选自Jκ和Jλ基因区段的人轻链J(JL)基因区段。在具体的实施方式中,人JL基因区段选自人Jκ1和Jκ5基因区段。在多个实施方式中,小鼠缺少选自小鼠免疫球蛋白VL基因区段、小鼠免疫球蛋白JL基因区段及其组合的序列。在多个实施方式中,人VL区可操作地连接于人、小鼠或大鼠免疫球蛋白轻链恒定(CL)区。在具体的实施方式中,人VL区可操作地连接于小鼠Cκ区。在具体的实施方式中,人VL区可操作地连接于大鼠Cκ区。在多个实施方式中,人VL区从内源免疫球蛋白轻链基因座表达。在多个实施方式中,人VH区可操作地连接于人、小鼠或大鼠免疫球蛋白重链恒定(CH)区。在多个实施方式中,(CH)区包含选自CH1、铰链、CH2、CH3、CH4和/或其组合的人序列。在多个实施方式中,人VH区由内源免疫球蛋白重链基因座表达。在一个方面,提供了遗传修饰的小鼠,其表达多个与单一轻链结合的免疫球蛋白重链。在一个实施方式中,重链包含人序列。在多个实施方式中,人序列选自可变序列、CH1、铰链、CH2、CH3及其组合。在一个实施方式中,单一轻链包含人序列。在多个实施方式中,人序列选自可变序列、恒定序列及其组合。在一个实施方式中,小鼠包含失去功能的内源免疫球蛋白基因座并且从转基因或染色体外的附加体表达重链和/或轻链。在一个实施方式中,小鼠在内源小鼠基因座上包含用一个或多个人免疫球蛋白序列对部分或所有的内源小鼠重链基因区段(即V、D、J)和/或部分或所有的内源小鼠重链恒定序列(例如,CH1、铰链、CH2、CH3或其组合)和/或部分或所有的内源小鼠轻链序列(例如,V、J、恒定区或其组合)的置换。在一个方面,提供了适合用于制备具有相同轻链的抗体的小鼠,其中所述小鼠产生的所有或基本上所有的抗体表达有相同的轻链。在一个实施方式中,轻链由内源轻链基因座表达。在一个方面,提供了制备人抗体的轻链的方法,其包括从本文描述的小鼠中得到轻链序列和重链序列,并将轻链序列和重链序列用于制备人抗体。在一个实施方式中,人抗体是双特异性抗体。在一个方面,提供了鉴定能够与本文所述工程化轻链可变结构域一起结合目的抗原的人重链可变结构域的方法,其中所述方法包括提供源自能够结合抗原的第一抗体的重链可变结构域,将重链可变结构域与种系轻链序列再配对并且转染细胞,以便各自被表达以形成第二抗体,将第二抗体暴露给抗原,和测量第二抗体与抗原的结合。在一个实施方式中,第一抗体的轻链包含人Vκ1-39序列。在一个实施方式中,第一抗体的轻链包含人Vκ3-20序列。在一个实施方式中,种系轻链序列包含人Vκ1-39或Vκ3-20序列。在多个实施方式中,第二抗体与抗原的结合通过与第一抗体与抗原的结合的比较来确定。在一些实施方式中,提供了制备双特异性抗原结合蛋白的方法,其中所述方法包括将表达单一人免疫球蛋白轻链的第一小鼠暴露给包含第一表位的第一目的抗原,将表达单一人免疫球蛋白轻链的第二小鼠暴露给包含第二表位的第二目的抗原,允许第一和第二小鼠各自产生针对目的抗原的免疫应答,在第一小鼠中鉴定结合第一目的抗原的第一表位的第一人重链可变区,在第二小鼠中鉴定结合第二目的抗原的第二表位的第二人重链可变区,制备编码结合第一目的抗原的第一表位的第一重链的第一完全人重链基因,制备编码结合第二目的抗原的第二表位的第二重链的第二完全人重链基因,在表达单一完全人轻链的细胞中表达第一重链和第二重链以形成双特异性抗原结合蛋白,和分离双特异性抗原结合蛋白。在一些实施方式中,提供了制备双特异性抗原结合蛋白的方法,其中所述方法包括将表达单一人免疫球蛋白轻链的第一小鼠暴露给包含第一表位的第一目的抗原,将表达单一人免疫球蛋白轻链的第二小鼠暴露给包含第二表位的第二目的抗原,允许第一和第二小鼠各自产生针对目的抗原的免疫应答,在第一小鼠中鉴定结合第一目的抗原的第一表位的第一人重链可变区,在第二小鼠中鉴定结合第二目的抗原的第二表位的第二人重链可变区,制备编码结合第一目的抗原的第一表位的第一重链的第一完全人重链基因,制备编码结合第二目的抗原的第二表位的第二重链的第二完全人重链基因,在表达单一完全人轻链的细胞中表达第一重链和第二重链以形成双特异性抗原结合蛋白,和分离双特异性抗原结合蛋白,并且其中所述单一完全人轻链来源于重排的人Vκ1-39或人Vκ3-20基因区段。在一些实施方式中,提供了制备双特异性抗原结合蛋白的方法,其中所述方法包括将表达单一人免疫球蛋白轻链的第一小鼠暴露给包含第一表位的第一目的抗原,将表达单一人免疫球蛋白轻链的第二小鼠暴露给包含第二表位的第二目的抗原,允许第一和第二小鼠各自产生针对目的抗原的免疫应答,在第一小鼠中鉴定结合第一目的抗原的第一表位的第一人重链可变区,在第二小鼠中鉴定结合第二目的抗原的第二表位的第二人重链可变区,制备编码结合第一目的抗原的第一表位的第一重链的第一完全人重链基因,制备编码结合第二目的抗原的第二表位的第二重链的第二完全人重链基因,在表达单一完全人轻链的细胞中表达第一重链和第二重链以形成双特异性抗原结合蛋白,和分离双特异性抗原结合蛋白;并且其中(a)第一和第二抗原是不同的;或(b)第一和第二抗原是相同的,并且第一表位和第二表位是不同的。在一些实施方式中,提供了制备双特异性抗原结合蛋白的方法,其中所述方法包括将表达单一人免疫球蛋白轻链的第一小鼠暴露给包含第一表位的第一目的抗原,将表达单一人免疫球蛋白轻链的第二小鼠暴露给包含第二表位的第二目的抗原,允许第一和第二小鼠各自产生针对目的抗原的免疫应答,在第一小鼠中鉴定结合第一目的抗原的第一表位的第一人重链可变区,在第二小鼠中鉴定结合第二目的抗原的第二表位的第二人重链可变区,制备编码结合第一目的抗原的第一表位的第一重链的第一完全人重链基因,制备编码结合第二目的抗原的第二表位的第二重链的第二完全人重链基因,在表达单一完全人轻链的细胞中表达第一重链和第二重链以形成双特异性抗原结合蛋白,和分离双特异性抗原结合蛋白;并且其中人轻链当与第一重链配对时特异性结合第一抗原的第一表位并且当与第二重链配对时特异性结合第二抗原的第二表位。在一些实施方式中,提供了制备双特异性抗原结合蛋白的方法,其中所述方法包括将表达单一人免疫球蛋白轻链的第一小鼠暴露给包含第一表位的第一目的抗原,将表达单一人免疫球蛋白轻链的第二小鼠暴露给包含第二表位的第二目的抗原,允许第一和第二小鼠各自产生针对目的抗原的免疫应答,在第一小鼠中鉴定结合第一目的抗原的第一表位的第一人重链可变区,在第二小鼠中鉴定结合第二目的抗原的第二表位的第二人重链可变区,制备编码结合第一目的抗原的第一表位的第一重链的第一完全人重链基因,制备编码结合第二目的抗原的第二表位的第二重链的第二完全人重链基因,在表达单一完全人轻链的细胞中表达第一重链和第二重链以形成双特异性抗原结合蛋白,和分离双特异性抗原结合蛋白;并且其中所述第一完全人重链基因具有降低其对蛋白A的亲和力的氨基酸修饰,并且第二完全人重链不包含降低其对蛋白A的亲和力的修饰。在一些实施方式中,降低对蛋白A的亲和力的修饰选自95R(EUR435R)、96F(EUR436F)及其组合。在一些实施方式中,提供了制备双特异性抗原结合蛋白的方法,其中所述方法包括将表达单一人免疫球蛋白轻链的第一小鼠暴露给包含第一表位的第一目的抗原,将表达单一人免疫球蛋白轻链的第二小鼠暴露给包含第二表位的第二目的抗原,允许第一和第二小鼠各自产生针对目的抗原的免疫应答,在第一小鼠中鉴定结合第一目的抗原的第一表位的第一人重链可变区,在第二小鼠中鉴定结合第二目的抗原的第二表位的第二人重链可变区,制备编码结合第一目的抗原的第一表位的第一重链的第一完全人重链基因,制备编码结合第二目的抗原的第二表位的第二重链的第二完全人重链基因,在表达单一完全人轻链的细胞中表达第一重链和第二重链以形成双特异性抗原结合蛋白,和分离双特异性抗原结合蛋白;并且其中细胞的人轻链包含种系序列。在一些实施方式中,提供了制备人双特异性抗体的方法,其包括将表达单一人轻链可变结构域的小鼠的两种不同的B细胞的两个人重链可变区序列用于双特异性抗体的步骤。在一些实施方式中,提供了制备人双特异性抗体的方法,其包括将表达单一人轻链可变结构域的小鼠的两种不同的B细胞的两个人重链可变区序列用于双特异性抗体的步骤,其中所述单一人轻链可变结构域包含重排的人Vκ1-39或人Vκ3-20基因区段。在一些实施方式中,提供了制备人双特异性抗体的方法,其包括将表达单一人轻链可变结构域的小鼠的两种不同的B细胞的两个人重链可变区序列用于双特异性抗体的步骤,其中单一人轻链可变结构域还包含重排的人Jκ5或人Jκ1基因区段。在一些实施方式中,提供了制备人双特异性抗体的方法,其包括将表达单一人轻链可变结构域的小鼠的两种不同的B细胞的两个人重链可变区序列用于双特异性抗体的步骤,其中所述小鼠还包含含有可操作地连接至一个或多个非人重链恒定区基因的一个或多个未经重排的人VH基因区段、一个或多个未经重排的人DH基因区段和一个或多个未经重排的人JH基因区段的人源化重链基因座。在一些实施方式中,人源化重链基因座包含可操作地连接至一个或多个小鼠重链恒定区基因的80个未经重排的人VH基因区段、27个未经重排的人DH基因区段和6个未经重排的人JH基因区段。在一些实施方式中,方法包括其中一个或多个人VH基因区段包含人VH1-2、VH1-8、VH1-24、VH1-69、VH2-5、VH3-7、VH3-9、VH3-11、VH3-13、VH3-15、VH3-20、VH3-23、VH3-30、VH3-33、VH3-48、VH3-53、VH4-31、VH4-39、VH4-59、VH5-51、VH6-1或其组合。在一些实施方式中,提供了制备人双特异性抗体的方法,其包括将表达单一人轻链可变结构域的小鼠的两种不同的B细胞的两个人重链可变区序列用于双特异性抗体的步骤,其中所述小鼠不合有能够重排以形成免疫球蛋白轻链的内源轻链可变基因区段。在一些实施方式中,提供了选择用于双特异性抗体的两个人免疫球蛋白重链可变结构域的方法,其包括用目的抗原免疫小鼠,其中所述小鼠表达单一人轻链可变结构域,并且其中所述两个人免疫球蛋白重链可变结构域独立地与单一人轻链可变结构域结合以结合目的抗原。在一些实施方式中,提供了制备人双特异性抗体的方法,其包括将表达单一人轻链可变结构域的小鼠的两种不同的B细胞的两个人重链可变区序列用于双特异性抗体的步骤,其中所述单一人轻链可变结构域来源于重排的人Vκ1-39基因区段。在一些实施方式中,单一的人轻链可变结构域还包含重排的人Jκ5基因区段。在一些实施方式中,单一的人轻链可变结构域来源于重排的人Vκ3-20基因区段。在一些实施方式中,单一的人轻链可变结构域还包含重排的人Jκ1基因区段。在一些实施方式中,提供了选择用于双特异性抗体的两个人免疫球蛋白重链可变结构域的方法,其包括用目的抗原免疫小鼠,其中所述小鼠表达单一人轻链可变结构域,并且其中所述两个人免疫球蛋白重链可变结构域独立地与单一人轻链可变结构域结合以结合目的抗原,其中所述小鼠不含有能够重排以形成免疫球蛋白轻链的内源轻链可变基因区段。本文描述的任何实施方式和方面,除非另外指明或从上下文显而易见,均可以相互结合使用。其它的实施方式从下文描述中对于本领域技术人员而言是明显的。附图图1演示了用于使用人Vκ1-39Jκ5基因区置换内源小鼠免疫球蛋白轻链可变区基因区段的靶向策略。图2演示了用于使用人Vκ3-20Jκ1基因区置换内源小鼠免疫球蛋白轻链可变区基因区段的靶向策略。图3演示了用于使用人VpreB/Jλ5基因区置换内源小鼠免疫球蛋白轻链可变区基因区段的靶向策略。图4显示了野生型小鼠(WT)、对于工程化的人重排的Vκ1-39Jκ5轻链区是纯合的小鼠(Vκ1-39Jκ5HO)和对于工程化的人重排的Vκ3-20Jκ1轻链区是纯合的小鼠(Vκ3-20Jκ1HO)的来自外周血的CD19+B细胞(y轴)的百分比。图5A显示了在对于利用人Vκ和Jκ基因区段对内源Vκ和Jκ基因区段的置换是纯合的小鼠(Hκ)、野生型小鼠(WT)以及对于工程化人重排的Vκ1-39Jκ5轻链区是杂合的小鼠(Vκ1-39Jκ5HET)中,使用特异于工程化的人重排的Vκ1-39Jκ5轻链区的接合部(Vκ1-39Jκ5接合部探针)和人Vκ1-39基因区段(Vκ1-39探针)的探针在定量PCR检测中测定的Vκ1-39来源的轻链的相对mRNA表达(y轴)。将信号针对小鼠Cκ的表达进行标准化。N.D.:未检出。图5B显示了在对于利用人Vκ和Jκ基因区段对内源Vκ和Jκ基因区段的置换是纯合的小鼠(Hκ)、野生型小鼠(WT)以及对于工程化人重排的Vκ1-39Jκ5轻链区是纯合的小鼠(Vκ1-39Jκ5HO)中,使用特异于工程化的人重排的Vκ1-39Jκ5轻链区的接合部(Vκ1-39Jκ5接合部探针)和人Vκ1-39基因区段(Vκ1-39探针)的探针在定量PCR检测中测定的Vκ1-39来源的轻链的相对mRNA表达(y轴)。将信号针对小鼠Cκ的表达进行标准化。图5C显示了在对于利用人Vκ和Jκ基因区段对内源Vκ和Jκ基因区段的置换是纯合的小鼠(Hκ)、野生型小鼠(WT)以及对于工程化人重排的Vκ3-20Jκ1轻链区是杂合的(HET)和纯合的(HO)小鼠中,使用特异于工程化人重排的Vκ3-20Jκ1轻链区的接合部(Vκ3-20Jκ1接合部探针)和人Vκ3-20基因区段(Vκ3-20探针)的探针在定量PCR检测中测定的Vκ3-20来源的轻链的相对mRNA表达(y轴),。将信号针对小鼠Cκ的表达进行标准化。图6A显示了在用β-半乳糖苷酶免疫的野生型(WT;N=2)和对于工程化的人重排的Vκ1-39Jκ5轻链区是纯合的(Vκ1-39Jκ5HO;N=2)小鼠中IgM(左侧)和IgG(右侧)的滴度。图6B显示了在用β-半乳糖苷酶免疫的野生型(WT;N=5)和对于工程化的人重排的Vκ3-20Jκ1轻链区是纯合的(Vκ3-20Jκ1HO;N=5)小鼠中总免疫球蛋白(IgM、IgG、IgA)的滴度。图7A显示了单特异性抗体(亲本1和亲本2)和从每个亲本单特异性抗体的重链可变区构建的双特异性抗体(双特异性)的图示。共同的轻链可变区(黑色)显示于双特异性抗体中。图7B显示了两个亲本单克隆抗体(亲本1和亲本2)对目的抗原的结合特性以及通过用共同的轻链配对每个单特异性亲本抗体的重链可变区来构建的双特异性抗体的结合特性的图示。展示了双特异性抗体分别地(左下)或同时地(右下)结合目的抗原的两个不同表位的能力。图8显示了300nM双特异性(黑色柱)和单特异性(条纹和灰色柱)抗体对经捕获的单体抗原E表面的结合的柱状图,使用BIACORETM单位(RU)。显示了单克隆亲本1抗体(P1Ab)、单克隆亲本2抗体(P2Ab)和双特异性抗体(BsAb)。发明详述本发明不限于特定的方法和描述的实验条件,因为这些方法和条件可以改变。还应当理解,本文所用的术语仅用于描述特定实施方案的目的,并且不旨在进行限制,因为本发明的范围由权利要求书限定。除非另有定义,本文所用的所有术语和短语包括在本领域中已得到的术语和短语的含义,除非有明确指出的或术语或短语所使用的上下文中有明确显示的相反教导。虽然任何类似或等同于本文描述的方法和材料的方法和材料可以在本发明的实践和检测中使用,但现描述特定的方法和材料。所有提及的出版物均通过引用整体并入本文。本文使用的术语“抗体”包括含有4条多肽链(通过二硫键相互连接的两条重(H)链和两条轻(L)链)的免疫球蛋白分子。每条重链包含重链可变(VH)区和重链恒定(CH)区。重链恒定区包含3个结构域,CH1、CH2和CH3。每条轻链包含轻链可变(VL)区和轻链恒定区(CL)。VH区和VL区可进一步细分为被命名为互补决定区(CDR)的高变区,其中散布着更保守的命名为框架区(FR)的区域。每个VH和VL包含3个CDR和4个FR,其从氨基末端到羧基末端按照下面的顺序排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4(重链CDR可简称为HCDR1、HCDR2和HCDR3;轻链CDR可简称为LCDR1、LCDR2和LCDR3)。术语“高亲和力”抗体是指具有相对于其靶表位约10-9M或更低(例如,约1×10-9M、1×10-10M、1×10-11M或约1×10-12M)的KD的抗体。在一个实施方式中,通过表面等离子体共振例如BIACORETM测定KD,;在另一实施方式中,通过ELISA测定KD。短语“双特异性抗体”包括能够选择性结合两个或更多个表位的抗体。双特异性抗体包括两个不同的单克隆抗体(图7A)的片段并且通常包括来自两个不同单克隆抗体的两条不相同的重链,其中每条重链特异性结合不同的表位——在两个不同的分子上(例如在两个不同免疫原上的不同表位;参见图7B左下)或在同一个分子上(例如在同一个免疫原上的不同表位;参见图7B右下)。如果双特异性抗体能够选择性结合两个不同的表位(第一表位和第二表位),那么通常第一重链对第一表位的亲和力将低于第一重链对第二表位的亲和力至少1个至2个或3个或4个或更多个数量级,反之亦然。双特异性抗体特异性结合的表位可在同一或不同的靶上(例如在同一或不同蛋白上;参见图7B)。示例性的双特异性抗体包括具有对肿瘤抗原特异的第一重链和对细胞毒性标记物例如Fc受体(例如FcγRI、FcγRII、FcγRIII等)或T细胞标记物(例如CD3、CD28等)特异的第二重链的抗体。此外,第二重链可变区可以被具有不同的期望特异性的重链可变区置换。例如,具有对肿瘤抗原特异的第一重链和对毒素特异的第二重链的双特异性抗体可被配对从而递送毒素(例如皂素、长春花生物碱等)至肿瘤细胞。其它示例性的双特异性抗体包括具有对活化受体(例如B细胞受体、FcγRI、FcγRIIA、FcγRIIIA、FcαRI、T细胞受体等)特异的第一重链和对抑制性受体(例如FcγRIIB、CD5、CD22、CD72、CD300a等)特异的第二重链的抗体。这样的双特异性抗体可被构建用于与细胞活化相关的治疗性病况(例如过敏和哮喘)。双特异性抗体可以通过例如组合识别同一或不同免疫原的不同表(图7B)位的重链来制备。例如,编码识别同一或不同免疫原的不同表位的重链可变序列的核酸序列可以融合至编码同一或不同重链恒定区的核酸序列,并且这些序列可在表达免疫球蛋白轻链的细胞中表达。典型的双特异性抗体具有两条重链,每条重链具有3个重链CDR,随后是(N末端至C末端)CH1结构域、铰链、CH2结构域和CH3结构域,以及免疫球蛋白轻链,所述轻链未赋予表位结合特异性但可以与每条重链结合,或者其可以与每条重链结合并且可结合一个或多个被重链表位结合区结合的表位,或者其可以与每条重链结合并且使得能够或使得重链的一条或两条能够结合至一个或两个表位。术语“细胞”包括任何适合用于表达重组核酸序列的细胞。细胞包括原核生物和真核生物(单细胞或多细胞)的细胞、细菌细胞(例如大肠杆菌(E.coli)、芽孢杆菌(Bacillusspp.)、链霉菌(StreptomycESspp.)等的菌株)、分枝杆菌细胞、真菌细胞、酵母细胞(例如酿酒酵母(S.cerevisiae)、酒裂殖酵母(S.pombe)、巴斯德毕赤酵母(P.pastoris)、甲醇毕赤酵母(P.methanolica)等)、植物细胞、昆虫细胞(例如SF-9、SF-21、杆状病毒感染的昆虫细胞、粉纹夜蛾(Trichoplusiani)等)、非人动物细胞、人细胞、或细胞融合体例如杂交瘤或四源杂交瘤。在一些实施方式中,细胞是人、猴子、猿、仓鼠、大鼠或小鼠细胞。在一些实施方式中,细胞是真核的并选自下述细胞:CHO(例如CHOKl、DXB-11CHO、Veggie-CHO)、COS(例如COS-7)、视网膜细胞、Vero、CV1、肾细胞(例如HEK293、293EBNA、MSR293、MDCK、HaK、BHK)、HeLa、HepG2、WI38、MRC5、Colo205、HB8065、HL-60、(例如BHK21)、Jurkat、Daudi、A431(表皮的)、CV-1、U937、3T3、L细胞、C127细胞、SP2/0、NS-0、MMT060562、塞托利细胞、BRL3A细胞、HT1080细胞、骨髓瘤细胞、肿瘤细胞和来源于前述细胞的细胞系。在一些实施方式中,细胞包括一个或多个病毒基因,例如表达病毒基因的视网膜细胞(例如PER.C6TM细胞)。短语“互补决定区”或术语“CDR”包括被生物体的免疫球蛋白基因的核酸序列编码的氨基酸序列,其通常(即在野生型动物中)出现在免疫球蛋白分子(例如抗体或T细胞受体)的轻链或重链的可变区的两个框架区之间。CDR可以被,例如种系序列或重排的或未经重排的序列和例如被初始或成熟B细胞或T细胞编码。CDR可以被体细胞突变(例如与动物种系中编码的序列不同)、人源化和/或用氨基酸置换、添加或删除修饰。在一些情况下(例如对于CDR3),CDR可以被两个或更多个序列(例如种系序列)编码,所述序列是不连续的(例如在未经重排的核酸序列中)但在B细胞核酸序列中是连续的,例如,因剪接或连接序列(例如V-D-J重组以形成重链CDR3)而产生的。术语“保守的”,当用于描述保守的氨基酸置换时,包括用另一个含有具有相似化学性质(例如电荷或疏水性)的侧链R基团的氨基酸残基对氨基酸残基的取代。通常,保守的氨基酸取代不会实质性改变目的蛋白的功能性质,例如可变区以期望的亲和力特异性结合靶表位的能力。含有具有相似化学性质的侧链的氨基酸的组的实例包括脂肪族侧链例如甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;脂肪族-羟基侧链例如丝氨酸和苏氨酸;含酰胺侧链例如天冬酰胺和谷氨酰胺;芳香族侧链例如苯丙氨酸、酪氨酸和色氨酸;碱性侧链例如赖氨酸、精氨酸和组氨酸;酸性侧链例如天冬氨酸和谷氨酸;以及含硫侧链例如半胱氨酸和甲硫氨酸。保守的氨基酸取代组包括,例如,缬氨酸/亮氨酸/异亮氨酸、苯丙氨酸/酪氨酸、赖氨酸/精氨酸、丙氨酸/缬氨酸、谷氨酸/天冬氨酸、和天冬酰胺/谷氨酰胺。在一些实施方式中,保守的氨基酸取代可以是用丙氨酸取代蛋白中的任何天然残基,如在例如丙氨酸扫描诱变中使用的。在一些实施方式中,进行的保守取代在PAM250对数-似然矩阵中具有正数值,所述矩阵公开于Gonnet等人(1992)ExhaustiveMatchingoftheEntireProteinSequenceDatabase,Science256:1443-45中,其通过引用并入本文。在一些实施方式中,取代是中度的保守取代,其中所述取代在PAM250对数-似然矩阵中具有非负数的值。在一些实施方式中,免疫球蛋白轻链或重链中的残基位置相异于一个或多个保守的氨基酸取代。在一些实施方式中,免疫球蛋白轻链或其功能性片段(例如允许从例如B细胞中表达和分泌的片段)中的残基位置不与其氨基酸序列在本文列出的轻链完全相同,但相异于一个或多个保守的氨基酸取代。短语“表位结合蛋白”包括具有至少一个CDR的蛋白并且其能够选择性识别表位,例如能够以约一微摩或更低的KD(例如KD是约1×10-6M、1×10-7M、1×10-8M、1×10-9M、1×10-10M、1×10-11M或约1×10-12M)结合表位。治疗性表位结合蛋白(例如治疗性抗体)通常需要在纳摩或皮摩范围内的KD。短语“功能性片段”包括能够表达、分泌并以微摩、纳摩或皮摩范围内的KD特异性结合表位的表位结合蛋白的片段。特异性识别包括具有至少在微摩范围、纳摩范围或皮摩范围内的KD。术语“种系”包括参照非体细胞突变的细胞(例如非体细胞突变的B细胞或前体B细胞或造血细胞)中的免疫球蛋白核酸序列。短语“重链”或“免疫球蛋白重链”包括来自任何生物体的免疫球蛋白重链恒定区序列。除非另有规定,重链可变结构域包括3个重链CDR和4个FR区。重链的片段包括CDR、CDR和FR及其组合。典型的重链具有,在可变结构域之后(从N末端到C末端):CH1结构域、铰链、CH2结构域和CH3结构域。重链的功能性片段包括能够特异识别表位(例如以微摩、纳摩或皮摩范围内的KD识别表位)、能够从细胞中表达并分泌以及包含至少一个CDR的片段。术语“同一性”当与序列结合使用时,包括通过本领域中已知的能够用于测量核苷酸和/或氨基酸序列同一性的多种不同的算法测定的同一性。在本文描述的一些实施方式中,同一性通过使用采用10.0的开放缺口罚值、0.1的扩展缺口罚值的ClustalWv.1.83(慢)比对,以及使用Gonnet相似性矩阵(MACVECTORTM10.0.2,MacVectorInc.,2008)来测定。相对于序列的同一性进行比较的序列的长度将取决于具体的序列,但在轻链恒定结构域的情况下,长度应该包括足以折叠成轻链恒定结构域的长度的序列,其能够自结合以形成标准的轻链恒定结构域,例如能够形成两个包含β链的β片层并且能够与人或小鼠的至少一个CH1结构域相互作用。在CH1结构域的情况下,序列长度应该含有足以折叠成CH1结构域的长度的序列,其能够形成两个包含β链的β片层并且能够与小鼠或人的至少一个轻链恒定结构域相互作用。短语“免疫球蛋白分子”包括两条免疫球蛋白重链和两条免疫球蛋白轻链。重链可以是相同或不同的,并且轻链可以是相同或不同的。短语“轻链”包括来自任何生物体的免疫球蛋白轻链序列,并且除非另有说明,包括人κ和λ轻链和VpreB,以及替代轻链。除非另有说明,轻链可变(VL)结构域通常包括3个轻链CDR和4个框架(FR)区。通常地,全长轻链包括,从氨基末端到羧基末端,包含FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4的VL结构域和轻链恒定结构域。轻链包括例如不选择性结合被表位结合蛋白(其中出现所述轻链)结合的第一或第二表位的轻链。轻链还包括结合并识别或协助重链结合或识别一个或多个被表位结合蛋白(其中出现所述轻链)选择性结合的表位的轻链。共同轻链是来源于重排的人Vκ1-39Jκ5序列或重排的人Vκ3-20Jκ1序列的轻链,并且包括经体细胞突变的(例如亲和力成熟的)形式。短语“微摩范围”是指1-999微摩;短语“纳摩范围”是指1-999纳摩;短语“皮摩范围”是指1-999皮摩。短语“体细胞突变”包括参照来自已经经历类别转换B细胞的核酸序列,其中经类别转换的B细胞中的免疫球蛋白可变区(例如重链可变结构域或包括重链CDR或FR序列)的核酸序列不同于类别转换之前的B细胞中的核酸序列,例如,在未经历类别转换的B细胞和已经经历类别转换的B细胞之间的CDR或框架核酸序列中的差异。“体细胞突变”包括参照来自亲和力成熟的B细胞的核酸序列,其不同于非亲和力成熟的B细胞中的相应的免疫球蛋白可变区序列(例如在种系细胞基因组中的序列)。短语“体细胞突变”还包括参照来自将B细胞暴露至目的表位后的B细胞的免疫球蛋白可变区核酸序列,其中所述核酸序列不同于将B细胞暴露至目的表位之前的相应的核酸序列。短语“体细胞突变”是指来自已在具有人免疫球蛋白可变区核酸序列的动物例如小鼠中响应于免疫原的刺激而产生的,以及因这样的动物中固有运行的选择过程而产生的抗体的序列。关于核酸序列的术语“未经重排的”包括存在于动物细胞的种系中的核酸序列。短语“可变结构域”包括免疫球蛋白轻链或重链(按期望修饰的)氨基酸序列,其包含下述氨基酸区域,以从N末端至C末端的顺序(除非另有说明):FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。通用轻链此前制备有用的多特异性表位结合蛋白例如双特异性抗体的努力,已被各种各样的问题阻碍,这些问题通常具有共同的模式:序列的体外选择或操作以合理地工程化或至通过试错法工程化用于配时异源二聚体的双特异性人免疫球蛋白的适当形式。不幸地,大多数(如果不是所有的)的体外工程化方法提供大量专门的适合用于(如果有的话)个体分子的解决办法。另一方面,还未实现将复杂生物体用于选择适当的能够导致人治疗剂的配对的体内方法。通常,天然小鼠序列往往不是人治疗性序列的优质来源。至少由于这个原因,产生与共同人轻链配对的小鼠重链免疫球蛋白可变区具有有限的实用价值。在试错过程中更多的体外工程化工作会耗费在试图人源化小鼠重链可变序列同时期望保留表位特异性和亲和力同时维持与共同的人轻链偶联的能力,这带有不确定的结果。在这样的过程的最后,最终产物可维持一些特异性和亲和力并与共同的轻链相结合,但其最终在人中的免疫原性可能依然有很深的风险。因此,用于制备人治疗剂的适当小鼠应包括适当大量的取代内源小鼠重链可变区基因区段的人重链可变区基因区段库。人重链可变区基因区段应能够重排并与内源小鼠重链恒定结构域重组以形成反向嵌合重链(即重链包含人可变结构域和小鼠恒定区)。重链应能够类型转换和体细胞高变,以便适当大量的重链可变结构域库可用于小鼠以选择一个可以与有限的人轻链可变区库结合的重链可变结构域。选择用于多个重链的共同轻链的小鼠具有实用价值。在多个实施方式中,在仅可表达共同轻链的小鼠中表达的抗体将具有可以与相同或基本上相同的轻链结合并表达的重链。这在制备双特异性抗体中是特别有用的。例如,这样的小鼠可以用第一免疫原免疫以产生表达特异性结合第一表位的抗体的B细胞。小鼠(或遗传上相同的小鼠)可被第二免疫原免疫以产生表达特异性结合第二表位的抗体的B细胞。可从B细胞中克隆可变重链区,并与同样的重链恒定区和同样的轻链表达,并且在细胞中表达以制备双特异性抗体,其中双特异性抗体的轻链组分已被小鼠选择以与轻链组分结合并表达。本发明人已将小鼠工程化以产生免疫球蛋白轻链,所述轻链将适当地与相当多样化的重链家族配时,包括其可变区与种系序列背离(例如亲和力成熟或经体细胞突变的可变区)的重链。在多种实施方式中,设计小鼠以将人轻链可变结构域与包括体细胞突变的人重链可变结构域配对,从而使得能够得到适合用作人治疗剂的高亲和力结合蛋白的途径。通过在生物体内漫长而复杂的抗体选择过程,遗传工程化小鼠产生在将多样化的人重链可变结构域库与有限数目的人轻链选择进行配对中的生物学上适当的选择。为了实现此,小鼠被工程化以呈现与广泛多样的人重链可变结构域选择结合的有限数目的人轻链可变结构域选择。在用免疫原刺激后,小鼠最大化其库中解决方案的数目以产生针对免疫原的抗体,这主要或仅受到其库中的数目或轻链选择的限制。在多种实施方式中,这包括允许小鼠获得轻链可变结构域的适当的和相容的体细胞突变,尽管如此其将与相对大量的人重链可变结构域包括特别地经体细胞突变的人重链可变结构域相容。为获得轻链选择的有限库,小鼠被工程化以使得其制备或重排天然小鼠轻链可变结构域的能力无功能或基本上无功能。这可以例如通过删除小鼠的轻链可变区基因区段来实现。随后可以通过可操作地连接至内源小鼠轻链恒定区的选择的外源适当人轻链可变区基因区段,以这样的方式以便外源人可变区基因区段可以与内源小鼠轻链恒定区基因组合并形成重排的反向嵌合轻链基因(人可变区,小鼠恒定区)来修饰内源小鼠基因座。在多种实施方式中,轻链可变区能够进行体细胞突变。在多种实施方式中,为了最大化轻链可变区获得体细胞突变的能力,在小鼠中保留适当的增强子。例如,在修饰小鼠κ轻链基因座以用人κ轻链基因区段置换内源小鼠κ轻链基因区段中,小鼠κ内含子增强子和小鼠κ3′增强子是得到功能性维持或不被破环的。提供了的遗传修饰的小鼠,其表达与多样化的反向嵌合(人可变区,小鼠恒定区)重链结合的有限的反向嵌合(人可变区,小鼠恒定区)轻链库。多种实施方式中,内源小鼠κ轻链基因区段被删除并被可操作地连接于内源小鼠Cκ基因的单一(或两个)重排的人轻链区置换。在最大化重排的人轻链区的体细胞高变的实施方式中,保留小鼠κ内含子增强子和小鼠κ3′增强子。在多种实施方式中,小鼠还含有非功能性的λ轻链基因座或其删除或导致基因座不能制备λ轻链的删除。在多种实施方式中,提供了遗传修饰的小鼠,其包括缺少内源小鼠轻链VL和JL基因区段并包含可操作地连接于小鼠恒定区的重排的人轻链可变区(在一个实施方式中,重排的人VL/JL序列)的轻链可变区基因座,其中所述基因座能够进行体细胞高变,并且其中所述基因座表达包含连接至小鼠恒定区的人VL/JL序列的轻链。因此在多种实施方式中,基因座包含与有正常的或野生型水平的体细胞高变相关的小鼠κ3′增强子。在多种实施方式中,当用目的抗原免疫时,遗传工程化小鼠产生B细胞,所述B细胞显示出与一个或两个重排的轻链表达并发挥功能的人免疫球蛋白重链可变区重排的多样性,包括其中一个或两个轻链包含含有例如1至5个体细胞突变的人轻链可变区的实施方式。在多种实施方式中,如此表达的人轻链能够与小鼠中表达的任何人免疫球蛋白重链可变区结合并表达。结合多于一个表位的表位结合蛋白本文描述的组合物和方法可被用于制备以高亲和力结合多于一个表位的结合蛋白,例如双特异性抗体。本发明的有利方面包括选择适当的各自与单一轻链结合的高结合性(例如亲和力成熟的)重链免疫球蛋白链的能力。已报道了几个从重组的细胞培养物中制备双特异性抗体片段的技术。然而,双特异性结合蛋白的合成和表达存在问题,部分归因于与鉴别适当的可与两条不同重链结合并表达的轻链相关的问题,部分归因于分离的问题。在多种实施方式中,本文描述的组合物和方法提供不需要特定的修饰以通过增加组分的稳定性/相互作用来维持传统免疫球蛋白结构的全长双特异性抗体(图7A)的有利方面。在多种实施方式中,这样的修饰被证明是繁琐的并且在发展双特异性抗体技术及其用于治疗人类疾病的潜在用途中充当阻碍。因此,在多种实施方式中,通过提供具有添加的多特异性性质的天然免疫球蛋白结构(即全长),全长双特异性抗体维持以前的双特异性抗体所缺少的关键的效应子功能,并且还提供了显示较长的半衰期的重要的药物动力学参数的治疗剂。本文描述的组合物和方法允许遗传修饰的小鼠通过在其他方面天然的途径选择适当的能够与多于一个重链(包括经体细胞突变的(例如亲和力成熟的)重链)结合并表达的轻链。可鉴定来自表达具有反向嵌合重链(即人可变区和小鼠恒定区)亲和力成熟的抗体的本文描述的经免疫的小鼠的适当的B细胞的人VH和VL序列并与适当的人恒定区基因序列(例如人IgG1)在框内地克隆入表达载体中。可以制备两个这样的构建体,其中每个构建体编码结合不同表位的人重链可变结构域。可将种系序列中的或来自其中序列已被体细胞突变的B细胞的人VL的一个(例如人Vκ1-39Jκ5或人Vκ3-20Jκ1),在框内地融合至适当的人恒定区基因(例如人κ恒定基因)。这3个完全人重链和轻链构建体可被置于适当的用于表达的细胞中。细胞将表达两个主要的种类:具有同样的轻链的同源二聚体重链,和具有同样的轻链的异源二聚体重链。为了允许容易地分离这些主要的种类,重链的一个被修饰以删除蛋白A结合决定簇,导致同源二聚体结合蛋白与异源二聚体结合蛋白不同的亲和力。解决这个问题的组合物和方法描述在申请日2010年6月25日,名称为“ReadilyIsolatedBispecificAntibodiESwithNativeImmunoglobulinFormat”,作为US2010/0331527A1公开的USSN12/832,838中,将其通过引用并入本文。在一个方面,提供了本文描述的表位结合蛋白,其中人VH和VL序列来源于已被包含目的表位的抗原免疫的本文描述的小鼠。在一个实施方式中,提供了表位结合蛋白,其包含第一和第二多肽,第一多肽从N末端到C末端包含选择性结合第一表位的第一表位结合区、随后是包含选自IgG1、IgG2、IgG4及其组合的人IgG的第一CH3区的恒定区;并且第二多肽从N末端到C末端包含选择性结合第二表位的第二表位结合区、随后是包含选自IgG1、IgG2、IgG4及其细合的人IgG的第二CH3区的恒定区,其中第二CH3区包含降低或消除所述第二CH3区与蛋白A的结合的修饰。在一个实施方式中,第二CH3区包含H95R修饰(按照IMGT外显子编号;按照EU编号为H435R)。在另一个实施方式中,第二CH3区还包含Y96F修饰(IMGT;按照EU为Y436F)。在一个实施方式中,第二CH3区来自修饰的人IgG1,并且还包含选自D16E、L18M、N44S、K52N、V57M和V82I(IMGT;按照EU为D356E、L358M、N384S、K392N、V397M和V422I)的修饰。在一个实施方式中,第二CH3区来自修饰的人IgG2,并且还包含选自N44S、K52N和V82I(IMGT;按照EU为N384S、K392N和V422I)的修饰。在一个实施方式中,第二CH3区来自修饰的人IgG4,并且还包含选自015R、N44S、K52N、V57M、R69K、E79Q和V82I(IMGT;按照EU为Q355R、N384S、K392N、V397M、R409K、E419Q和V422I)的修饰。制备结合多于一个表位的表位结合蛋白的一个方法是使用包含第一目的表位的抗原免疫依据本发明的第一小鼠,其中所述小鼠包含不含有能够重排并形成轻链的内源小鼠VL的内源免疫球蛋白轻链可变区基因座,其中在内源小鼠免疫球蛋白轻链可变区基因座上的是可操作地连接至小鼠内源轻链恒定区基因的单一的经重排的人VL区,并且重排的人VL区选自人Vκ1-39Jκ5和人Vκ3-20Jκ1,并且内源小鼠VH基因区段已被人VH基因区段全部或部分地置换,以便小鼠制备的免疫球蛋白重链是完全的或实质上的包含人可变结构域和小鼠恒定结构域的重链。当被免疫时,这样的小鼠将产生仅包含两种人轻链可变结构域中的一个(例如人Vκ1-39Jκ5或人Vκ3-20Jκ1中的一个)的反向嵌合抗体。在鉴定了编码结合目的表位的VH的B细胞后,可回收(例如通过PCR)VH(可选地和VL)的核苷酸序列与适当的人免疫球蛋白恒定结构域在框内地克隆入表达构建体。这一过程可被重复以鉴定结合第二表位的第二VH结构域,并可回收第二VH基因序列并与第二适当的免疫球蛋白恒定结构域在框内地克隆入表达载体。第一和第二免疫球蛋白恒定结构域可以是相同或不同的同种型,并且可以如本文或US2010/0331527A1中所描述地修饰免疫球蛋白恒定结构域的一个(而非另一个),并且表位结合蛋白可以在适当的细胞中表达并基于其与同源二聚体表位结合蛋白相比对蛋白A不同的亲和力来分离,例如US2010/0331527A1中所描述的。在一个实施方式中,提供了制备双特异性表位结合蛋白的方法,其包括从本文描述的小鼠中鉴定出第一亲和力成熟的(例如包含一个或多个的体细胞高变)人VH核苷酸序列(VH1),从本文描述的小鼠中鉴定出第二亲和力成熟的(例如包含一个或多个的体细胞高变)人VH核苷酸序列(VH2),将VH1与描述于US2010/0331527A1中的缺乏蛋白A决定簇修饰的人重链在框内地克隆以形成重链1(HC1),将VH2与描述于US2010/0331527A1中的包含蛋白A决定簇的人重链在框内地克隆以形成重链2(HC2),将包含HC1的表达载体和同一个或不同的包含HC2的表达载体引入细胞,其中所述细胞还表达包含融合至人轻链恒定结构域的人Vκ1-39/人Jκ5或人Vκ3-20/人Jκ1的人免疫球蛋白轻链,允许细胞表达包含被VH1编码的VH结构域和被VH2编码的VH结构域的双特异性表位结合蛋白,和基于其与单特异性同源二聚体表位结合蛋白相比不同的结合蛋白A的能力来分离双特异性表位结合蛋白。在具体的实施方式中,HC1是IgG1,并且HC2是包含H95R(IMGT;按照EU为H435R)修饰并还包含Y96F(IMGT;按照EU为Y436F)修饰的IgG1。在一个实施方式中,被VH1编码的VH结构域、被VH2编码的VH结构域或其两者是经体细胞突变的。与共同人VL表达的人VH基因来自针对四种不同抗原产生的亲和力成熟的抗体的多种人可变区,与其同源轻链或选自人Vκ1-39/Jκ5、人Vκ3-20/Jκ1或人VpreB/Jλ5的人轻链的至少一个一起表达(参见实施例1)。对于每一个抗原的抗体,来自不同基因家族的经体细胞突变的高亲和力重链成功地与重排的人种系Vκ1-39Jκ5和Vκ3-20Jκ1区配对并且从表达重链和轻链的细胞中分泌。对于Vκ1-39Jκ5和Vκ3-20Jκ1,来源于下述人VH基因家族的VH结构域优选表达:1-2、1-8、1-24、2-5、3-7、3-9、3-11、3-13、3-15、3-20、3-23、3-30、3-33、3-48、4-31、4-39、4-59、5-51和6-1。因此,被工程化以表达有限的来自Vκ1-39Jκ5和Vκ3-20Jκ1的一个或两个的人VL结构域库的小鼠将从经修饰以用人VH基因区段置换小鼠VH基因区段的VH基因座产生多样化的经体细胞突变的人VH结构域群。当用目的抗原免疫时,经遗传工程化以表达与单一的经重排的轻链(例如Vκ1-39/J或Vκ3-20/J)结合的反向嵌合(人可变区、小鼠恒定区)免疫球蛋白重链的小鼠,其所产生的B细胞包含多样化的人VH重排并且表达多样化的高亲和力抗原特异抗体,所述抗体具有相对于其阻断抗原与它们的配体的结合的能力和相对于其结合抗原变体的能力的多样化的性质(参见实施例5-10)。因此,本文描述的小鼠和方法可用于制备和选择人免疫球蛋白重链可变结构域,包括因多样化的重排而产生的、显示广泛多样的亲和力(包括显示出约纳摩或更少的KD的)、广泛多样的特异性(包括结合至同一抗原的不同表位)以及与相同的或基本上相同的人免疫球蛋白轻链可变区结合并表达的经体细胞突变的人重链可变结构域。具有共同轻链的完全人双特异性抗体作为不同实施方式中的第一步,各自编码人重链可变结构域的第一和第二核酸序列(和形成双特异性抗体的任何其它的核酸序列)从具有期望的特性例如能够结合不同表位(参见图7A和7B)、具有不同亲和力等的亲本单克隆抗体中选择出来。通常,从本文描述的经免疫的小鼠中分离编码人重链可变结构域的核酸序列以允许与人重链恒定区融合以适合用于人类施用。可通过引入突变对序列进行其它的修饰,其给双特异性抗体增加可实现的另外的功能性,包括,例如,增加血清半衰期(例如参见U.S.7,217,797)和/或增加抗体依赖的细胞介导的细胞毒性(例如参见U.S.6,737,056)。向抗体恒定区中引入突变是本领域中已知的。另外,可以在细胞培养物中重组制备双特异性抗体的部分,并可通过上述提及的那些技术制备分子的其它部分。已描述了生产抗体的一些技术。例如,在多种实施方式中,在本文描述的小鼠中生产嵌合抗体。抗体可以从免疫的小鼠的B细胞中直接分离(例如参见U.S.2007/0280945A1)和/或免疫的小鼠的B细胞可被用于制备杂交瘤细胞(Kohler和Milstein,1975,Nature256:495-497)。使用常规技术容易地分离并测序来自本文所述小鼠的编码抗体(人重链和/或轻链)的DNA。来源于本文所述小鼠的杂交瘤和/或B细胞用作这样的DNA的优选来源。经分离后,DNA可被置于表达载体中,其随后被转染入不另外产生免疫球蛋白的宿主细胞,以在重组宿主细胞中实现单克隆抗体的合成。还可例如通过用替换鼠序列的人重链和轻链恒定结构域取代编码序列来修饰DNA。在多种实施方式中,在分离DNA和选择编码具有期望的特异性/亲和力的第一和第二人重链可变结构域的第一和第二核酸序列和编码人轻链结构域(分离自本文描述的小鼠的轻链序列或种系重排的序列)的第三核酸序列之后,使用本领域中广泛使用的重细技术表达编码分子的3个核酸序列以形成双特异性抗体。通常,选择的表达系统包括哺乳动物细胞表达载体和宿主,以便双特异性抗体被恰当地糖基化(例如在包括糖基化的抗体结构域的双特异性抗体情况下)。然而,还可以在原核表达系统中产生分子。通常地,用在同一载体或独立的载体上的编码第一人重链可变结构域、第二人重链可变结构域、人轻链结构域的DNA转化宿主细胞。然而,可以在独立的表达系统中表达第一人重链可变结构域、第二人重链可变结构域和人轻链结构域(双特异性抗体的组分)并且在体外结合表达的多肽。在多种实施方式中,人轻链结构域包含种系序列。在多种实施方式中,人轻链结构域包含不多于1个、不多于2个、不多于3个、不多于4个或不多于5个的轻链结构域的轻链可变序列中的体细胞高变。在多种实施方式中,将编码两条重链和单一人轻链的核酸(例如cDNA或基因组DNA)插入到可复制载体中以用于进一步克隆(扩增DNA)和/或用于表达。许多载体是可用的并且通常包括恒不限于下述中的一个或多个:信号序列、复制起始点、一个或多个标记基因、增强子元件、启动子和转录终止序列。可逐一地或基于宿主细胞选择或实验确定的其他标准选择每个组分。每个组分的一些实例在本领域中是已知的。表达和克隆载体通常含有被宿主生物体识别的启动子并且可操作地连接至编码双特异性抗体的每一个或所有组分的序列。大量的被多种潜在宿主细胞识别的启动子是公知的。通过从来源DNA通过限制性酶消化移除启动子并将分离的启动子序列插入载体中来将这些启动子可操作地连接至编码双特异性抗体的DNA。用于真核宿主细胞(酵母、真菌、昆虫、植物、动物、人或来自其它多细胞生物体的有核细胞)的表达载体还可含有转录的终止和稳定mRNA所必需的序列。这样的序列通常可以从真核或病毒DNA或cDNA的5′和偶而地3′的非翻译区得到。这些区域含有被转录为编码双特异性抗体组分的mRNA的非翻译区中的聚腺苷酸化片段的核苷酸区段。用于多种实施方式的适当的表达载体包括在哺乳动物细胞中提供编码双特异性抗体的DNA的瞬时表达的载体。一般而言,瞬时表达包括使用能够在宿主细胞中有效复制的表达载体,这样宿主细胞聚集表达载体的许多拷贝并且进而合成高水平的被表达载体编码的期望的多肽。包括适当的表达载体和宿主细胞的瞬时表达系统允许对克隆的DNA编码的多肽进行方便的阳性鉴定,以及允许快速筛选相对于具有第一或第二人重链可变结构域的同源二聚体的亲本抗体具有期望的结合特异性/亲和力或期望的凝胶迁移特性的双特异性抗体。在多个实施方式中,在编码双特异性抗体组分的DNA被组装入本文描述的期望的载体中之后,它们被引入用于表达和回收的适当的宿主细胞中。可以使用本领域已知的适合于所选择的宿主细胞的标准技术(例如电穿孔、核显微注射、细菌原生质体与完整细胞的融合、或聚阳离子,例如聚凝胺、聚鸟氨酸等)来实现转染宿主细胞。在多种实施方式中,选择最适合含有组分的表达载体并允许双特异性抗体种类最高效和有利的生产的宿主细胞。用于表达的示例性宿主细胞包括原核生物和真核生物(单细胞或多细胞)的细胞、细菌细胞(例如大肠杆菌、芽孢杆菌、链霉菌等的菌株)、分枝杆菌细胞、真菌细胞、酵母细胞(例如酿酒酵母、酒裂殖酵母、巴斯德毕赤酵母、甲醇毕赤酵母等)、植物细胞、昆虫细胞(例如SF-9、SF-21、杆状病毒感染的昆虫细胞、粉纹夜蛾等)、非人动物细胞、人细胞、或细胞融合体例如杂交瘤或四源杂交瘤。在多种实施方式中,细胞是人、猴子、猿、仓鼠、大鼠或小鼠细胞。在多种实施方式中,细胞是真核细胞选自:CHO(例如CHOK1、DXB-11CHO、Veggie-CHO)、COS(例如COS-7)、视网膜细胞、Vero、CV1、肾细胞(例如HEK293、293EBNA、MSR293、MDCK、HaK、BHK)、HeLa、HepG2、WI38、MRC5、Colo205、HB8065、HL-60、(例如BHK21)、Jurkat、Daudi、A431(表皮的)、CV-1、U937、3T3、L细胞、C127细胞、SP2/0、NS-0、MMT060562、塞托利细胞、BRL3A细胞、HT1080细胞、骨髓瘤细胞、肿瘤细胞和来源于前述细胞的细胞系。在多种实施方式中,细胞包括一个或多个病毒基因,例如表达病毒基因的视网膜细胞(例如PER.C6TM细胞)。用于产生双特异性抗体的哺乳动物宿主细胞可以在多种培养基中培养。市售的培养基例如Ham′sF10(Sigma)、MinimalEssentialMedium((MEM),Sigma)、RPMI-1640(Sigma)和DulbeccolsModifiedEagle′sMedium((DMEM),Sigma)适合用于培养宿主细胞。培养基可以根据需要补充激素和/或其它生长因子(例如胰岛素、转铁蛋白或表皮生长因子)、盐(例如氯化钠、钙、镁和磷酸盐)、缓冲液(例如HEPES)、核苷(例如腺苷和胸苷)、抗生素(例如GENTAMYCINTM)、微量元素(定义为通常以微摩范围的终浓度存在的无机化合物)和葡萄糖或等效的能源。还可以以本领域技术人员公知的适当的浓度包含任何其它的补充剂。在多个实施方式中,培养条件例如温度、pH等是所选择的用于表达的宿主细胞所先前使用的条件,并且其对于本领域技术人员而言是显而易见的。在多个实施方式中,将双特异性抗体作为分泌的多肽从细胞培养物中回收,尽管当在不具有分泌信号的情况下被直接产生时,其也可以从宿主细胞裂解物中回收。如果双特异性抗体是膜结合的,则可以使用适当的去垢剂溶液(例如Triton-X100)从膜释放其。优选地,本文所描述的双特异性抗体包括第一免疫球蛋白CH3结构域和第二免疫球蛋白CH3结构域的应用,其中第一和第二免疫球蛋白CH3结构域彼此在至少一个氨基酸上不相同,并且其中至少一个氨基酸的差异与缺少该氨基酸差异的双特异性抗体相比降低了双特异性抗体与蛋白A的结合(参见U.S.2010/0331527A1;通过引用并入本文)。在一个实施方式中,第一免疫球蛋白CH3结构域结合蛋白A并且第二免疫球蛋白CH3结构域含有降低或废除蛋白A结合的突变,例如H95R修饰(依照IMGT外显子编号;依照EU编号为H435R)。第二CH3还可包含Y96F修饰(依照IMGT;依照EU为Y436F)。可以在第二CH3内发现的其它修饰包括:在IgG1抗体的情况下D16E、L18M、N44S、K52N、V57M和V82I(依照IMGT;依照EU为D356E、L358M、N384S、K392N、V397M和V422I);在IgG2抗体的情况下N44S、K52N和V82I(IMGT;依照EU为N384S、K392N和V422I);和在IgG4抗体的情况下Q15R、N44S、K52N、V57M、R69K、E79Q和V82I(依照IMGT;依照EU为Q355R、N384S、K392N、V397M、R409K、E419Q和V422I)。上述双特异性抗体形式的变异包含在本发明的范围内。由于双特异性抗体的双重性质(即可特异于一个多肽的不同的表位或可以包含特异于多于一个靶多肽的抗原结合结构域,参见图7B;也可参见例如Tutt等人,1991,J.Immunol.147:60-69;Kufer等,2004,TrendsBiotechnol.22:238-244),它们提供了许多对于治疗应用的有利方面。例如,双特异性抗体可以用于重定向细胞毒性(例如以杀死肿瘤细胞),用作疫苗佐剂,用于递送溶血栓剂至凝块,用于在靶位点(例如肿瘤)转化酶激活的药物前体,用于治疗感染疾病,靶向免疫复合体至细胞表面受体,或用于递送免疫毒素至肿瘤细胞。本文描述的双特异性抗体还可以用于几种治疗性和非治疗性和/或诊断性检测方法,例如,酶免疫检测、双位点免疫检测、多种疾病(例如癌症)的体外或体内免疫诊断、竞争性结合测定、直接和间接夹心测定以及免疫沉淀测定。双特异性抗体的其它的用途对于本领域技术人员而言将是显而易见的。提供了下列实施例以向本领域普通技术人员描述如何制备和使用本发明的方法和组合物,并不旨在限定发明人所认为的其发明的范围。已做出努力以确保对于所使用的数字(例如数量、温度等)的准确性,但存在一些实验误差和偏差。除非另外指出,部分是按重量计的部分,分子量是平均分子量,温度表示为摄氏度,并且压力为大气压或接近大气压。实施例提供了下列实施例以向本领域技术人员描述如何制备和使用本发明的方法和组合物,并且不旨在限定发明人视其为发明的范围。已作出努力确保对于所使用的数字(例如数量、温度等)的准确性,但应考虑一些实验误差和偏差。除非另有说明,温度用摄氏度表示,压力是大气压或接近大气压,部分是按重量计的部分,并且分子量是平均分子量。实施例1与选择的人VL区结合的人VH区的鉴定构建了体外表达系统以确定是否单一的经重排的人种系轻链可以与来自抗原特异性人抗体的人重链共表达。用于在遗传修饰的小鼠中产生人抗体的方法是公知的(参见例如US6,596,541,RegeneronPharmaceuticals,)。技术涉及产生具有包含可操作地连接至内源小鼠恒定区基因座的人重链和轻链可变区的基因组的遗传修饰小鼠,以便小鼠响应于抗原刺激产生包含人可变区和小鼠恒定区的抗体。编码产生自小鼠的抗体的重链和轻链的可变区的DNA是完全人的。首先,分离具有人可变区和小鼠恒定区的高亲和力嵌合抗体。如下所述,针对期望的特性包括亲和力、选择性、表位等来表征和选择抗体。小鼠恒定区被期望的人恒定区置换以产生包括非IgM同种型例如野生型或修饰的IgG1、IgG2、IgG3或IgG4的完全人抗体。虽然选择的恒定区可以根据特定的用途而不同,但高亲和力抗原结合和靶特异性特征位于可变区。用促进血管生成的生长因子(抗原C)免疫小鼠,分离抗原特异性人抗体,使用本领域认可的标准技术对V基因的使用进行测序。将选择的抗体克隆至人重链和轻链恒定区,并且选择69个重链以与3条人轻链之一配对:(1)连接至人κ恒定区的同源κ轻链,(2)连接至人κ恒定区的重排的人种系Vκ1-39Jκ5,或(3)连接至人κ恒定区的重排的人种系Vκ3-20Jκ1。使用标准技术将每个重链和轻链配对共转染入CHO-KI细胞。在ELISA测定中用抗人IgG检测上清液中抗体的存在。测定每个重链/轻链配对的抗体滴度(ng/ml),并且将不同的重排的种系轻链的滴度与得到的亲本抗体分子(例如与同源轻链配对的重链)的滴度进行比较,计算天然滴度(nativetitier)的百分比(表1)。VH:重链可变基因。ND:当前的实验条件下未检测到表达。表1在相似的实验中,用几种不同的抗原免疫小鼠并对选择的抗原特异性人抗体的重链与不同的重排的人种系轻链配对的能力进行检测(如上面描述的)。本实验中使用的抗原包括涉及胆固醇体内稳态的酶(抗原A),涉及调节葡萄糖体内稳态的血清激素(抗原B),促进血管生成的生长因子(抗原C)和细胞表面受体(抗原D)。从每个免疫组的小鼠中分离抗原特异性抗体,并克隆和测序重链和轻链可变区。根据重链和轻链的序列,确定V基因的使用并且将选择的重链与其同源的轻链或重排的人种系Vκ1-39Jκ5区进行配对。将每个重链/轻链配对共转染入CHO-K1细胞并且在ELISA测定中用抗人IgG检测上清液中抗体的存在。测定每个重链/轻链配对的抗体滴度(μg/ml),并且将不同的重排的种系轻链的滴度与得到的亲本抗体分子(例如与同源轻链配对的重链)的滴度进行比较,计算天然滴度的百分比(表2)。VH:重链可变基因。Vκ:κ轻链可变基因。ND:当前的实验条件下未检测到表达。表2从这些实验得到的结果证明了来自不同基因家族的经体细胞突变的高亲和力重链能够与重排的人种系Vκ1-39Jκ5和Vκ3-20Jκ1区配对并且作为正常的抗体分子从细胞中分泌。如表1所示,与亲本抗体的同源轻链相比,当与重排的人Vκ1-39Jκ5轻链配对时大约61%(69个中的42个)的重链和当与重排的人Vκ3-20Jκ1轻链配对时大约29%(69个中的20个)的重链的抗体滴度增加了。与亲本抗体的同源轻链相比,对于大约20%(69个中的14个)的重链,两种重排的人种系轻链均赋予表达的增加。如表2所示,与亲本抗体的同源轻链相比,重排的人种系Vκ1-39Jκ5区赋予几种特异于一些不同种类的抗原的重链的表达的增加。与亲本抗体的同源轻链相比,大约35%(15/43)的重链的抗体滴度增加超过2倍。对于两个重链(315和316),与亲本抗体相比,增加多于10倍。相对于亲本抗体的同源轻链显示增加的表达的所有重链中,相比其它重链可变区基因家族,家族3(VH3)重链被过多地表现。这表明人VH3重链与重排的人种系Vκ1-39Jκ5和Vκ3-20Jκ1轻链配对的有利关系。实施例2重排的人种系轻链基因座的产生使用技术(参见,例如,US专利No.6,586,251和Valenzuela等,(2003)High-throughputengineeringofthemousegenomecoupledwithhigh-rESolutionexprESsionanalysis,NatureBiotech.21(6):652-659)制备多种重排的人种系轻链靶向载体以修饰小鼠基因组细菌人工染色体(BAC)克隆302g12和254m04(Invitrogen)。使用这两个BAC克隆,基因组构建体被工程化以含有单一的经重排的人种系轻链区并且被插入已预先经修饰以删除内源κ可变和连接基因区段的内源κ轻链基因座。构建重排的人种系轻链靶向载体。使用本领域公认的标准分子生物技术制备3个不同的重排的人种系轻链区。用于构建这3个区的人可变基因区段包括重排的人Vκ1-39Jκ5序列、重排的人Vκ3-20Jκ1序列和重排的人VpreBJλ5序列。通过从头DNA合成(IntegratedDNATechnologies)来制备含有小鼠Vκ3-7基因的外显子1(编码前导肽)和内含子1的DNA区段。包括了5′非翻译区到天然存在的BlpI限制性酶切位点的部分。从人基因组BAC文库PCR扩增人Vκ1-39和Vκ3-20基因的外显子。正向引物具有含有小鼠Vκ3-7基因的内含子1的剪接受体位点的5′外延部分。用于人Vκ1-39序列的PCR的反向引物包含编码人Jκ5的外延部分,而用于人Vκ3-20序列的PCR的反向引物包含编码人Jκ1的外延部分。通过从头DNA合成(IntegratedDNATechnologies)制备人VpreBJλ5序列。从质粒pBS-296-HA18-PISceIPCR扩增包含剪接供体位点的人Jκ-Cκ内含子部分。正向PCR引物包括编码人Jκ5、Jκ1或Jλ5序列的部分的外延部分。反向引物包括预先被工程化入内含子的PI-SceI位点。将小鼠Vκ3-7外显子1/内含子1、人可变轻链外显子和人Jκ-Cκ内含子片段通过重叠延伸PCR连接在一起,用BlpI和PI-SceI消化,并连接入质粒pBS-296-HA18-PISceI,所述质粒含有来自人Vκ3-15可变基因区段的启动子。质粒pBS-296-HA18-PISceI中的loxed潮霉素盒被侧接有NotI和AscI位点的FRTed潮霉素盒置换。将该质粒的NotI/PI-SceI片段连接入修饰的小鼠BAC254m04中,所述修饰的小鼠BAC254m04含有部分的小鼠Jκ-Cκ内含子、小鼠Cκ外显子和小鼠κ基因座下游约75kb的基因组序列,其提供了用于小鼠ES细胞中的同源重组的3′同源臂。该BAC的NotI/AscI片段随后被连接入修饰的小鼠BAC302g12中,所述修饰的小鼠BAC302g12含有FRTed新霉素盒和用于小鼠ES细胞中同源重组的内源κ基因座上游的约23kb的基因组序列。重排的人种系Vκ1-39Jκ5靶向载体(图1)。限制性酶切位点被引入工程化轻链插入片段的5′和3′末端以用于克隆入靶向载体:5′末端的AscI位点和3′末端的PI-SceI位点。在5′AscI位点和3′PI-SceI位点内靶向构建体从5′至3′包括:含有获自小鼠BAC克隆302g12的内源小鼠κ轻链基因座的5′端的序列的5′同源臂、FRTed新霉素抗性基因、含有人Vκ3-15启动子的基因组序列、小鼠Vκ3-7可变基因区段的前导序列、小鼠Vκ3-7可变基因区段的内含子序列、重排的人种系Vκ1-39Jκ5区的开放阅读框、含有人Jκ-Cκ内含子的部分的基因组序列、以及含有获自小鼠BAC克隆254m04的内源小鼠Jκ5基因区段的3′端的序列的3′同源臂(图1,中间)。内源小鼠κ轻链基因座上游和大多数3′Jκ基因区段的下游的基因和/或序列(例如内源3′增强子)未被靶向构建体修饰(参见图1)。工程化的人Vκ1-39Jκ5基因座序列显示在SEQIDNO:1中。通过聚合酶链式反应(PCR)使用定位于重排的人种系轻链区中的序列的引物来确认重排的人种系Vκ1-39Jκ5区至BACDNA中的靶向插入。简要地,小鼠Vκ3-7前导序列的3′的内含子序列用引物ULC-m1F(AGGTGAGGGTACAGATAAGTGTTATGAG;SEQIDNO:2)和ULC-m1R(TGACAAATGCCCTAATTATAGTGATCA;SEQIDNO:3)来确认。重排的人种系Vκ1-39Jκ5区的开放阅读框用引物1633-h2F(GGGCAAGTCAGAGCATTAGCA;SEQIDNO:4)和1633-h2R(TGCAAACTGGATGCAGCATAG;SEQIDNO:5)来确认。新霉素盒用引物neoF(GGTGGAGAGGCTATTCGGC;SEQIDNO:6)和neoR(GAACACGGCGGCATCAG;SEQIDNO:7)来确认。随后靶向的BACDNA被用于电穿孔小鼠ES细胞以产生经修饰的用于产生表达重排的人种系Vκ1-39Jκ5区的嵌合小鼠的ES细胞。使用特异于插入到内源基因座的工程化Vκ1-39Jκ5轻链区的探针通过TAQMANTM筛查和核型分析来确认阳性的ES细胞克隆。简要地,探针neoP(TGGGCACAACAGACAATCGGCTG;SEQIDNO:8)结合在新霉素标记基因中,探针ULC-m1P(CCATTATGATGCTCCATGCCTCTCTGTTC;SEQIDNO:9)结合在小鼠Vκ3-7前导序列的3′端的内含子序列中,以及探针1633h2P(ATCAGCAGAAACCAGGGAAAGCCCCT;SEQIDNO:10)结合在重排的人种系Vκ1-39Jκ5开放阅读框中。阳性的ES细胞克隆随后被用于植入雌性小鼠以产生一窝表达种系Vκ1-39Jκ5轻链区的幼鼠。或者,用表达FLP的构建体转染具有重排的人种系Vκ1-39Jκ5轻链区的ES细胞,以去除通过靶向构建体引入的FRTed新霉素盒。任选地,通过与表达FLP重组酶的小鼠交配来移除新霉素盒(例如US6,774,279)。任选地,新霉素盒保留在小鼠中。重排的人种系Vκ3-20Jκ1靶向载体(图2)。以类似的方式,使用靶向构建体制备表达重排的人种系Vκ3-20Jκ1区的工程化的轻链基因座,所述靶向构建体从5′至3′包括:含有获自小鼠BAC克隆302g12的内源小鼠κ轻链基因座的5′端的序列的5′同源臂、FRTed新霉素抗性基因、含有人Vκ3-15启动子的基因组序列、小鼠Vκ3-7可变基因区段的前导序列、小鼠Vκ3-7可变基因区段的内含子序列、重排的人种系Vκ3-20Jκ1区的开放阅读框、含有人Jκ-Cκ内含子的部分的基因组序列、以及含有获自小鼠BAC克隆254m04的内源小鼠Jκ5基因区段的3′端的序列的3′同源臂(图2,中间)。工程化的人Vκ3-20Jκ1基因座的序列显示在SEQIDNO:11中。通过聚合酶链式反应(PCR)使用定位于重排的人种系Vκ3-20Jκ1轻链区中的序列的引物确认重排的人种系Vκ3-20Jκ1区至BACDNA中的靶向插入。简要地,小鼠Vκ3-7前导序列的3′的内含子序列用引物ULC-m1F(SEQIDNO:2)和ULC-m1R(SEQIDNO:3)来确认。重排的人种系Vκ3-20Jκ1区的开放阅读框用引物1635-h2F(TCCAGGCACCCTGTCTTTG;SEQIDNO:12)和1635-h2R(AAGTAGCTGCTGCTAACACTCTGACT;SEQIDNO:13)来确认。新霉素盒用引物neoF(SEQIDNO:6)和neoR(SEQIDNO:7)来确认。随后靶向的BACDNA被用于电穿孔小鼠ES细胞以创建经修饰的产生表达重排的人种系Vκ3-20Jκ1轻链的嵌合小鼠的ES细胞。使用特异于插入到内源κ轻链基因座中的工程化Vκ3-20Jκ1轻链区的探针通过TAQMANTM筛查和核型分析来确认阳性的ES细胞克隆。简要地,探针neoP(SEQIDNO:8)结合在新霉素标记基因中,探针ULC-m1P(SEQIDNO:9)结合在小鼠Vκ3-7前导序列中,以及探针1635h2P(AAAGAGCCACCCTCTCCTGCAGGG;SEQIDNO:14)结合在人Vκ3-20Jκ1开放阅读框中。阳性的ES细胞克隆随后被用于植入雌性小鼠。一窝表达人种系Vκ3-20Jκ1轻链区的幼鼠。或者,可以用表达FLP的构建体转染具有人种系Vκ3-20Jκ1轻链区的ES细胞,以去除通过靶向构建体引入的FRTed新霉素盒。任选地,通过与表达FLP重组酶的小鼠交配来移除新霉素盒(例如US6,774,279)。任选地,新霉素盒保留在小鼠中。重排的人种系VpreBJλ5靶向载体(图3)。以类似的方式,使用靶向构建体制备表达重排的人种系VpreBJλ5区的工程化的轻链基因座,所述靶向构建体从5′至3′包括:含有获自小鼠BAC克隆302g12的内源小鼠κ轻链基因座的5′端的序列的5′同源臂、FRTed新霉素抗性基因、含有人Vκ3-15启动子的基因细序列、小鼠Vκ3-7可变基因区段的前导序列、小鼠Vκ3-7可变基因区段的内含子序列、重排的人种系VpreBJλ5区的开放阅读框、含有人Jκ-Cκ内含子的部分的基因组序列、以及含有获自小鼠BAC克隆254m04的内源小鼠Jκ5基因区段的3′端的序列的3′同源臂(图3,中间)。工程化的人VpreBJλ5基因座的序列显示在SEQIDNO:15中。通过聚合酶链式反应(PCR)使用定位于重排的人种系VpreBJλ5区轻链区中的序列的引物来确认重排的人种系VpreBJλ5区至BACDNA中的靶向插入。简要地,用引物ULC-m1F(SEQIDNO:2)和ULC-m1R(SEQIDNO:3)来确认小鼠Vκ3-7前导序列的3′的内含子序列。重排的人种系VpreBJλ5区的开放阅读框用引物1616-h1F(TGTCCTCGGCCCTTGGA;SEQIDNO:16)和1616-h1R(CCGATGTCATGGTCGTTCCT;SEQIDNO:17)来确认。新霉素盒用引物neoF(SEQIDNO:6)和neoR(SEQIDNO:7)来确认。随后靶向的BACDNA被用于电穿孔小鼠ES细胞以创建经修饰的产生表达重排的人种系VpreBJλ5轻链的嵌合小鼠的ES细胞。使用特异于插入到内源κ轻链基因座的工程化VpreBJλ5轻链区的探针通过TAQMANTM筛查和核型分析来确认阳性的ES细胞克隆。简要地,探针neoP(SEQIDNO:8)结合在新霉素标记基因中,探针ULC-m1P(SEQIDNO:9)结合在小鼠IgVκ3-7前导序列中,以及探针1616h1P(ACAATCCGCCTCACCTGCACCCT;SEQIDNO:18)结合在人VpreBJλ5开放阅读框中。阳性的ES细胞克隆随后被用于植入雌性小鼠以产生一窝表达种系轻链区的幼鼠。或者,用表达FLP的构建体转染具有重排的人种系VpreBJλ5轻链区的ES细胞以去除通过靶向构建体引入的FRTed新霉素盒。任选地,通过与表达FLP重组酶的小鼠交配来移除新霉素盒(例如US6,774,279)。任选地,新霉素盒保留在小鼠中。实施例3表达单一的经重排的人轻链的小鼠的产生将上文描述的靶向的ES细胞用作供体ES细胞并通过方法(参见,例如,US专利No.7,294,754和Poueymirou等,(2007)F0generationmicethatareESsentiallyfullyderivedfromthedonorgene-targetedEScellsallowingimmediatephenotypicanalysesNatureBiotech.25(1):91-99)引入8细胞期的小鼠胚胎。通过使用检测唯一的经重排的人种系轻链区的存在的修饰的等位基因测定(Valenzuela等,同上)的基因分型来鉴定独立地具有工程化的人种系Vκ1-39Jκ5轻链区、Vκ3-20J1轻链区或VpreBJλ5轻链区的对幼鼠进行基因分型并选择对于唯一的经重排的人种系轻链区是杂合或纯和的小鼠以用于表征重排的人种系轻链区的表达。流式细胞术。通过分析共同轻链小鼠的脾细胞和外周血中的免疫球蛋白κ和λ的表达来验证共同轻链小鼠的正常抗体库中重排的人轻链区的表达。使用标准方法制备来自野生型(n=5)、Vκ1-39Jκ5共同轻链杂合子(n=3)、Vκ1-39Jκ5共同轻链纯合子(n=3)、Vκ3-20Jκ1共同轻链杂合子(n=2)以及Vκ3-20Jκ1共同轻链纯合子(n=2)小鼠的收集的脾和外周血的细胞悬浮液并使用荧光标记抗体(BDPharmigen)给所述细胞悬浮液进行CD19+、Igλ+和Igκ+染色。简要地,将1×106个细胞与抗小鼠CD16/CD32(克隆2.4G2,BDPharmigen)在冰上温育10分钟,随后在冰上用下述抗体混合物标记30分钟:APC缀合的抗小鼠CD19(克隆1D3,BDPharmigen)、PerCP-Cy5.5缀合的抗小鼠CD3(克隆17A2,BioLegend)、FITC缀合的抗小鼠Igκ(克隆187.1,BDPharmigen)、PE缀合的抗小鼠Igλ(克隆RML-42,BioLegend)。染色之后,洗涤细胞并用2%甲醛固定。在LSRII流式细胞仪上进行数据采集并且用FlowJo分析。门控:总B细胞(CD19+CD3-),Igκ+B细胞(Igκ+Igλ-CD19+CD3-),Igλ+B细胞(Igκ-Igλ+CD19+CD3-)。从血液和脾细胞样本采集的数据证实了类似的结果。表3列出了来自Igλ+、Igκ+或Igλ+Igκ+的各组中一只代表性小鼠的外周血的阳性CD19+B细胞的百分数。来自野生型(WT)和对于Vκ1-39Jκ5或Vκ3-20Jκ1共同轻链是纯合的小鼠的外周血中的CD19+B细胞的百分数显示于图4中。表3共同轻链的表达。在杂合和纯合的小鼠中使用定量PCR测定(例如TAQMANTM)分析每种共同轻链(Vκ1-39Jκ5和Wκ3-20Jκ1)的表达。简要地,使用小鼠CD19微珠(MiltenyiBiotec)根据厂商的说明书从野生型、对于利用相应的人重链和κ轻链可变区基因座对小鼠重链和κ轻链可变区基因座的置换是纯合的小鼠(Hκ)、以及对于每个重排的人轻链区(Vκ1-39Jκ5或Vκ3-20Jκ1)是纯合和杂合的小鼠的脾纯化得到CD19+B细胞。根据厂商的说明书使用RNeasyMinikit(Qiagen)从CD19+B细胞纯化得到总RNA,并且使用无RNase的DNase柱上处理(Qiagen)来去除基因组RNA。使用第一链cDNA合成试剂盒(Invitrogen)将200ngmRNA反转录成cDNA并且用TaqmanUniversalPCRMasterMix(AppliedBiosystems)扩增得到的cDNA。利用跨越(1)两种共同轻链的Vκ-Jκ接合部、(2)单独的Vκ基因(即Vκ1-39和Vκ3-20)和(3)小鼠Cκ区的引物和TaqmanMGB探针,使用ABI7900SequenceDetectionSystem(AppliedBiosystems)进行所有反应。表4列出了该检测中使用的引物和探针的序列。将相对表达针对小鼠Cκ区的表达进行标准化。结果显示在图5A、5B和5C中。表4抗原特异性共同轻链抗体。用β-半乳糖苷酶免疫在内源小鼠κ轻链基因座上具有Vκ1-39Jκ5或Vκ3-20Jκ1共同轻链的共同轻链小鼠并测量抗体滴度。简要地,按照制造商的指导在titermax佐剂(Sigma)中乳化β-半乳糖苷酶(Sigma)。通过皮下注射100μgβ-半乳糖苷酶/Titermax来免疫野生型(n=7)、Vκ1-39Jκ5共同轻链纯合子(n=2)和Vκ3-20Jκ1共同轻链纯合子(n=5)。通过用50μgβ-半乳糖苷酶/Titermax皮下注射两次、间隔三周对小鼠进行增强。在第二次增强后,按照制造商的指导,利用眶后出血从麻醉的小鼠中收集血液至血管分离管(BDBiosciencES)中。为了测量抗β-半乳糖苷酶的IgM或IgG抗体,用1μg/mL的β-半乳糖苷酶在4℃涂覆ELISA平板(Nunc)过夜。先洗掉过量的抗原,随后用含1%BSA的PBS在室温封闭1小时。将连续稀释度的血清加入到平板并且在室温温育1小时,随后洗涤。随后用HRP缀合的抗IgM(SouthernBiotech)或抗IgG(SouthernBiotech)在室温温育平板1小时。在再一次洗涤之后,用TMB底物(BDBiosciencES)对平板进行显影。用1N的硫酸终止反应并用VictorX5PlateReader(PerkinElmer)读取OD450。用GraphPadPrism分析数据并将信号计算为高于背景两倍的血清稀释度。结果显示在图6A和6B中。如本实施例所示,在Vκ1-39Jκ5和Vκ3-20Jκ1共同轻链小鼠的脾和外周区室中的κ/λB细胞的比例均显示近似野生型的模式(表3和图4)。然而,VpreBJλ5共同轻链小鼠显示较少的外周B细胞,其中大约1-2%表达工程化的人轻链区(数据未显示)。与含有利用人Vκ和Jκ基因区段对小鼠Vκ和Jκ基因区段的完全置换的内源κ轻链基因座相比,来自内源κ轻链基因座的Vκ1-39Jκ5和Vκ3-20Jκ1重排的人轻链区的表达水平升高(图5A、5B和5C)。VpreBJλ5重排的人轻链区的表达水平显示出与杂合和纯合小鼠中来自内源κ轻链基因座的表达相似的高表达(数据未显示)。这证明在与小鼠λ、κ或两个内源轻链基因座的直接竞争中,单一的经重排的人VL/JL序列可以产生优于来自内源κ轻链基因座的野生型水平的表达并且产生正常方的脾和血液B细胞频率。此外,具有人Vκ1-39Jκ5或人Vκ3-20Jκ1序列的工程化的κ轻链基因座的存在被小鼠很好的耐受,并通过代表免疫应答的体液成分中轻链库的主要部分而显示以野生型的方式发挥功能(图6A和6B)。实施例4表达单一的经重排的人种系轻链的小鼠的繁殖本实施例描述了几种其它的遗传修饰的小鼠品系,其可与本文描述的共同轻链小鼠中的任何一种交配,以创建具有多重遗传修饰免疫球蛋白基因座的多重遗传修饰小鼠品系。内源Igλ敲除(KO)。为了优化工程化轻链基因座的使用,将具有一种重排的人种系轻链区的小鼠与另一种含有内源λ轻链基因座的删除的小鼠交配。以这种方式,得到的后代将表达如实施例2中描述的重排的人种系轻链区作为其仅有的轻链。按照本领域公知的标准技术并可选地由商业繁殖者(例如TheJacksonLaboratory)来进行繁殖。针对唯一轻链区的存在和内源小鼠λ轻链的不存在来筛选具有工程化轻链基因座和内源λ轻链基因座的删除的小鼠品系。人源化的内源重链基因座。将具有工程化人种系轻链基因座的小鼠与含有利用人重链可变基因基因座对内源小鼠重链可变基因基因座的置换的小鼠(参见US6,596,541;小鼠,RegeneronPharmaceuticals,Inc.)交配。小鼠包含含有可操作地连接至内源小鼠恒定区基因座的人重链可变区的基因组,以便小鼠响应抗原刺激产生含有人重链可变区和小鼠重链恒定区的抗体。分离编码抗体的重链的可变区的DNA并可操作地连接至编码人重链恒定区的DNA。随后在能够表达抗体的完全人重链的细胞中表达DNA。获得具有用人VH基因座对内源小鼠VH基因座的置换和内源κ轻链基因座上的单一的经重排的人种系VL区的小鼠。在用目的抗原免疫后,获得含有经体细胞突变的重链(人VH和小鼠CH)与单一人轻链(人VL和小鼠CL)的反向嵌合抗体。鉴定表达抗体的B细胞的VH和VL核苷酸序列,并且通过在适当的表达系统中将VH和VL核苷酸序列融合至人CH和CL核苷酸序列来制备完全人抗体。实施例5来自表达人重链和重排的人种系轻链区的小鼠的抗体的产生在将含有工程化人轻链区的小鼠与多种期望的含有其它内源Ig基因座(如实施例4中描述的)的修饰和删除的品系进行交配后,可用目的抗原免疫所选择的小鼠。通常,用抗原刺激含有一种单一的经重排的人种系轻链区的小鼠,并且从动物的血清中回收淋巴细胞(例如B细胞)。将淋巴细胞与骨髓瘤细胞系融合以制备永生化杂交瘤细胞系,并且对该杂交瘤细胞系进行筛选和选择以鉴定产生含有人重链可变区和重排的人种系轻链的抗体的杂交瘤细胞系,所述抗体特异于用于免疫的抗原。分离编码重链和轻链的可变区的DNA,并将其连接至重链和轻链的期望的同种型恒定区。由于内源小鼠序列和存在于内源基因座中的任何其它的顺式作用元件的存在,每个抗体的单一轻链可被体细胞突变。这给包含单一轻链和不同重链序列的抗原特异性库增加了额外的多样性。生成的克隆抗体序列随后在细胞例如CHO细胞中表达。可选地,直接从抗原特异性淋巴细胞中鉴定编码抗原特异性嵌合抗体或轻链和重链的可变结构域的DNA。首先,分离具有人可变区和小鼠恒定区的高亲和力嵌合抗体。如上所述,依据期望的特性包括亲和力、选择性、表位等来表征和选择抗体。用期望的人恒定区置换小鼠恒定区以产生含有经体细胞突变的人重链和来源于本发明的重排的人种系轻链区的单一轻链的完全人抗体。适当的人恒定区包括,例如野生型或修饰的IgG1或IgG4。用人细胞表面受体蛋白(抗原E)免疫不同的含有用人VH、DH和JH基因区段对内源小鼠重链基因座的置换和用工程化种系Vκ1-39Jκ5人轻链区或工程化种系Vκ3-20Jκ1人轻链区(如上所述)对内源小鼠κ轻链基因座的置换的小鼠群。将抗原E直接施用至小鼠后肢足底,每3-4天连续注射6次。注射前,将2至3微克的抗原E与10μg的CpG寡核苷酸(Cat#tlrl-modn-ODN1826寡核苷酸;InVivogen,SanDiego,CA)和25μg的Adju-Phos(磷酸铝凝胶佐剂,Cat#H-71639-250;BrenntagBiosector,Frederikssund,Denmark)混合。在最后的抗原回忆(antigenrecall)前总共给予6次注射,并在处死前3-5天给予所述抗原回忆。在第四和第六次注射后收集血液并且通过标准的抗原特异性免疫测定监测抗体免疫应答。当获得期望的免疫应答时,收集脾细胞并将其与小鼠骨髓瘤细胞融合以保持其生存力并形成杂交瘤细胞系。筛选和选择杂交瘤细胞系以鉴定产生抗原E特异性共同轻链抗体的细胞系。使用该技术获得了一些抗-抗原E特异性共同轻链抗体(即具有人重链可变结构域、相同的人轻链可变结构域和小鼠恒定结构域的抗体)。可选地,直接从未与骨髓瘤细胞融合的抗原阳性B细胞中分离抗-抗原E共同轻链抗体,如在U.S.2007/0280945A1中描述的,特别地将其通过引用整体并入本文。使用该方法,获得了一些完全人抗-抗原E共同轻链抗体(即具有人重链可变结构域、工程化的人Vκ1-39Jκ5轻链或工程化人Vκ3-20Jκ1轻链区以及人恒定结构域的抗体)。根据本实施例的方法产生的示例性抗-抗原E共同轻链抗体的生物学性质详细地描述于下面的章节中。实施例6抗原特异性共同轻链抗体中重链基因区段的使用为了分析所产生的人抗-抗原E共同轻链抗体的结构,编码重链抗体可变区的核酸被克隆并测序。根据抗体的核酸序列和预测的氨基酸序列,鉴定了选择到的共同轻链抗体的重链可变区(HCVR)的基因使用,所述抗体获自被免疫的含有工程化的人抗体Vκ1-39Jκ5轻链或工程化人Vκ3-20Jκ1轻链区的小鼠。结果显示在表5和6中,其证明当采用表达来自唯一的人Vκ1-39-或人Vκ3-20-来源的轻链的轻链的小鼠时,由于多样的重排,依照本发明的小鼠产生来自多种人重链基因区段的抗原特异性共同轻链抗体。2、3、4和5个家族的人VH基因区段与多种人DH区段和人JH区段重排以产生抗原特异性抗体。表5表6实施例7通过LUMINEXTM测定确定抗原特导性共同轻链抗体的阻断能力在基于小珠的测定中,检测针对抗原E产生的98个人共同轻链抗体阻断抗原E的天然配体(配体Y)与抗原E的结合的能力。将抗原E的细胞外结构域(EDC)与两个myc表位标签和6×组氨酸标签缀合(抗原E-mmH),并且以20μg/mL浓度在MES缓冲液中胺偶联至羧基化微球。将混合物在室温温育2小时,随后使用1MpH8.0Tris进行小珠失活,再用含0.05%(v/v)Tween-20的PBS洗涤。之后,用含有2%(v/v)BSA(Sigma-AldrichCorp.,St.Louis,MO)的PBS(IrvineScientific,SantaAna,CA)封闭小珠。在96孔过滤板中,将含有抗原E特异性共同轻链抗体的上清液在缓冲液中按1∶15稀释。制备含有具有与用于抗体上清液的相同的培养基组分的模拟上清液的阴性对照。将抗原E标记的小珠加入到上清液中,并在4℃温育过夜。将生物素化的配体Y蛋白以0.06nM的终浓度加入,并在室温温育2小时。通过缀合至链霉亲和素的R-藻红蛋白(MossInc,Pasadena,MD)确定结合至抗原E-myc-myc-6His标记的小珠的生物素化的配体Y的检测并随后在基于LUMINEXTM流式细胞术的分析仪中进行测量。从所有的样品中减去不含有配体Y的样品的背景平均荧光强度(MFI)。通过每个样品的减去背景的MFI除以调整后的阴性对照值,乘以100,在从100减去所得的值来计算百分比阻断。在类似的实验中,检测相同的98个针对抗原E产生的人共同轻链抗体阻断抗原E与配体Y标记的小珠的结合的能力。简要地,以在MES缓冲液中稀释的20μg/mL的浓度将配体Y胺偶联至羧基化微球。将混合物在室温温育2小时,随后使用1MTrispH8.0进行小珠失活,之后用含0.05%(v/v)Tween-20的PBS洗涤。之后,用含有2%(w/v)BSA(Sigma-AldrichCorp.,St.Louis,MO)的PBS(IrvineScientific,SantaAna,CA)封闭小珠。在96孔过滤板中,含有抗原E特异性共同轻链抗体的上清液在缓冲液中按1∶15稀释。制备含有具有与用于抗体上清液的相同的培养基组分的模拟上清液的阴性对照。将生物素化的抗原E-mmH以0.42nM的终浓度加入,并在4℃温育过夜。随后将配体Y标记的小珠加入至抗体/抗原E混合物中并在室温温育2小时。通过缀合至链霉亲和素的R-藻红蛋白(MossInc,Pasadena,MD)确定结合至配体Y小珠的生物素化抗原E-mmH的检测并随后在基于LUMINEXTM流式细胞术的分析仪中进行测量。从所有的样品中减去不含有抗原E的样品的背景平均荧光强度(MFI)。通过每个样品的减去背景的MFI除以调整后的阴性对照值,乘以100,在从100减去所得值来计算百分比阻断。表7和8显示了在两个LUMINEXTM测定中测试的所有98个抗-抗原E共同轻链抗体的百分比阻断。ND:当前实验条件下未检测到。表7表8在上面描述的第一个LUMINEXTM实验中,测试了80个含有Vκ1-39Jκ5工程化轻链的共同轻链抗体的阻断配体Y与抗原E标记的小珠结合的能力。在这80个共同轻链抗体中,68个显示出>50%的阻断,而12个显示出<50%的阻断(6个25-50%的阻断和6个<25%的阻断)。对于18个含有Vκ3-20Jκ1工程化轻链的共同轻链抗体,针对配体Y与抗原E标记的小珠的结合,12个显示出>50%的阻断,而6个显示出<50%的阻断(3个25-50%的阻断和3个<25%的阻断)。在上面描述的第二个LUMINEXTM实验中,测试了相同的80个含有Vκ1-39Jκ5工程化轻链的共同轻链抗体的阻断抗原E与配体Y标记的小珠结合的能力。在这80个共同轻链抗体中,36个显示出>50%的阻断,而44个显示出<50%的阻断(27个25-50%的阻断和17个<25%的阻断)。对于18个含有Vκ3-20Jκ1工程化轻链的共同轻链抗体,针对抗原E与配体Y标记的小珠的结合,1个显示出>50%的阻断,而17个显示出<50%的阻断(5个25-50%的阻断和12个<25%的阻断)。表7和8的数据显示表5和6中描述的重排产生了以不同程度的功效阻断配体Y与其同源受体抗原E的结合的抗-抗原E特异性共同轻链抗体,这与病况具有相对于抗原E的重叠和非重叠的表位特异性的抗体的表5和6的抗-抗原E共同轻链抗体相一致。实施例8通过ELISA测定抗原特异性共同轻链抗体的阻断能力在ELISA实验中对针对抗原E产生的人共同轻链抗体测试其阻断抗原E与配体Y涂覆的表面结合的能力。将以稀释在PBS中的2μg/mL的浓度的配体Y涂覆在96孔板上并温育过夜,随后用含有0.05%Tween-20的PBS洗涤4次。随后用含有0.5%(w/v)BSA(Sigma-AldrichCorp.,St.Louis,MO)的PBS(IrvineScientific,SantaAna,CA)在室温封闭平板1小时。在一个单独的板中,将含有抗-抗原E共同轻链抗体的上清液在缓冲液中按1∶10稀释。使用具有抗体的相同成分的模拟上清液作为阴性对照。将抗体E-mmH(上述的)以0.150nM的终浓度加入并在室温温育1小时。随后将抗体/抗原E-mmH混合物加入至含有配体Y的板中,并在室温温育1小时。通过缀合至抗-Penta-His抗体的辣根过氧化物酶(HRP)(Qiagen,Valencia,CA)测定结合至配体Y的抗原E-mmHg的检测并通过使用由硫酸中和的四甲基联苯胺(TMB)底物(BDBiosciencES,SanJose,CA)的标准比色反应来显影。在OD450读取吸光度0.1秒。从所有样品中减去不含有抗原E的样品的背景吸光度。通过每个样品的减去背景的MFI除以调整后的阴性对照值,乘以100,并从100减去所得的值来计算百分比阻断。表9和10显示所有98个抗-抗原E共同轻链抗体在ELISA实验中检测到的百分比阻断。ND:当前实验条件下未检测到。表9表10如本实施例所述,在测试了其阻断抗原E与配体Y涂覆的表面结合的能力的80个含有Vκ1-39Jκ5工程化轻链的共同轻链抗体中,22个显示出>50%的阻断,而58个显示出<50%的阻断(20个25-50%的阻断和38个<25%的阻断)。对于18个含有Vκ3-20Jκ1工程化轻链的共同轻链抗体,针对抗原E与配体Y涂覆表面的结合,1个显示出>50%的阻断,而17个显示出<50%的阻断(5个25-50%的阻断和12个<25%的阻断)。这些结果也与包括具有相对于抗原E的重叠和非重叠表位特异性的抗体的抗原-E特异性共同轻链抗体库相一致。实施例9抗原特异性共同轻链抗体的BIACORETM亲和力测定使用BIACORETMT100设备(GEHealthcare)通过SPR(表面等离子体共振)测定选择的抗体上清液的平衡解离常数(KD)。将HBS-EP(10mMHepES,150mMNaCl,0.3mMEDTA,0.05%表面活性剂P20,pH7.4)用作运行和样品缓冲液在25℃获得所有的数据。从原始上清液样品将抗体捕获在CM5传感器芯片表面上,所述芯片表面已预先使用标准胺偶联化学法利用高密度的抗-人Fc抗体进行衍生化(derivatized)。在捕获步骤中,将上清液以3μL/min的流速注入经过抗-人Fc抗体表面,进行总共3分钟。在捕获步骤后,将100nM浓度的运行缓冲液或分析物以35μL/min的流速注入2分钟。监测抗原从捕获的抗体上的解离,进行6分钟。通过短暂注入10mMpH1.5的甘氨酸来去除捕获的抗体。通过从分析物传感图减去来自缓冲液注射的传感图来双参考(doublereference)所有的传感图,从而去除由抗体从捕获表面上解离而产生的假象。使用BIAcoreT100Evaluation软件v2.1将每个抗体的结合数据调整到1∶1的传质结合模型。结果显示在表11和12中。表11表12表11和12中显示的含有表5和6中显示的重排的共同轻链抗体的结合亲和力各自不同,其中几乎所有均显示在纳摩范围内的KD。亲和力数据与由表5和6中描述的重排的可变结构域的组合结合所产生的具有高亲和力、经克隆选择的和经体细胞突变的共同轻链抗体相一致。联合先前显示的数据,表5和6中描述的共同轻链抗体包含多样的、高亲和力的显示出对抗原E上一个或多个表位的特异性的抗体库。实施例10通过LUMINEXTM实验测定抗原特异性共同轻链抗体的结合特异性检测选择的抗-抗原E共同轻链抗体结合至抗原E的ECD和抗原E的ECD变体的能力,所述变体包括食蟹猴同源物(Mf抗原E),其在约10%的氨基酸残基上与人蛋白不同;抗原E的缺少ECD的C末端最后10个氨基酸的缺失突变体(抗原E-ΔCT);和两个在与配体Y相互作用的推测位置上包含丙氨酸取代的突变体(抗原E-Ala1和抗原E-Ala2)。在CHO细胞中产生抗原E蛋白并且其各自含有C末端myc-myc-His标签。对于结合性研究,通过在室温与共价涂覆有抗-myc单克隆抗体(MAb9E10,杂交瘤细胞系CRL-1729TM;ATCC,Manassas,VA)的1×106个微球(LUMINEXTM)小珠温育2小时来从1mL的培养基中捕获抗原E的ECD蛋白或变体蛋白(如上所述)。随后在使用前用PBS洗涤小珠。将含有抗-抗原E共同轻链抗体的上清液在缓冲液中按1∶4稀释并加到96孔过滤板中。将不含有抗体的模拟上清液用作阴性对照。随后将含有捕获的抗原E蛋白的小珠加入到抗体样品中(每孔3000个小珠)并在4℃温育过夜。次日,洗涤样品小珠并且使用R-藻红蛋白缀合的抗-人IgG抗体检测结合的共同轻链抗体。用基于LUMINEXTM流式细胞术的分析仪测量小珠(对于结合至每个抗原E蛋白的每个抗体样品,约100个小珠)的荧光强度,记录每小珠/抗体相互作用的至少100计数的小珠的中位数荧光强度(MFI)。结果显示于表13和14中。表13表14抗-抗原E共同轻链抗体上清液显示出与连接至抗原E-ECD的小珠的高特异性结合。对于这些小珠,阴性对照模拟上清液当与抗原E-ECD小珠样品组合时产生可以忽略不计的信号(<10MFI),而含有抗-抗原E共同轻链抗体的上清液显示出强的结合信号(对于98个抗体上清液,平均MFI是2627;91/98抗体样品的MFI>500)。作为选择的抗-抗原E共同轻链抗体识别抗原E的ECD上不同表位的能力的测量,测定了抗体与变体的相对结合。如上文对于天然抗原E-ECD结合研究所描述地,将所有四种抗原E变体捕获至抗-mycLUMINEXTM小珠,并且测定相对结合比率(MFI变体/MFI抗原E-ECD)。对于表12和13中显示的98个检测的共同轻链抗体上清液,每个变体的平均比率(MFI变体/MFI抗原E-ECD)不同,可能反映了小珠上不同的蛋白捕获量(对于抗原E-ΔCT、抗原E-Ala1、抗原E-Ala2和Mf抗原E,平均比率分别是0.61、2.9、2.0和1.0)。对于每个蛋白变体,98个检测的共同轻链抗体中的一个亚组的结合显示出大大降低的结合,表明对表征给定变体的突变的敏感性。例如,共同轻链抗体样品中的19个以<8%的MFI变体/MFI抗原E-ECD结合至Mf抗原E。由于该组中的许多包括高的或中等的高亲和力抗体(5个具有<5nM的KD,15个具有<50nM的KD),因此该组中较低的信号可能是来自于对在天然抗原E-ECD与给定的变体之间的序列(表位)差异的敏感性,而不是来自于较低的亲和力。这些数据显示了表5和6中描述的共同轻链抗体代表了多样化的抗原E特异性共同轻链抗体组,其特异性识别抗原E上多于1个表位。实施例11共同轻链抗体中的轻链改组在将重链与种系Vκ1-39Jκ5或种系Vκ3-20Jκ1工程化轻链(如实施例1中所述的)进行再配对之后,检测选择的抗原特异性共同轻链抗体的重链与抗原E的结合。简要地,将抗原E特异性共同轻链抗体(Vκ1-39Jκ5和Vκ3-20Jκ1)的247条重链与种系Vκ1-39或种系Vκ3-20工程化轻链一起转染并且通过LUMINEXTM测定(如实施例7和实施例10中所述)针对与抗原E的结合进行再次筛选。通过BIACORETM(如实施例9中所述)确认与抗原E的结合。结果显示在表15中。如本实施例所示,当与轻链的种系形式配对时28个对抗原E特异的共同轻链抗体能够结合至抗原E。表15实施例12共同轻链抗体中的重链基因使用和体细胞高变频率将小鼠(例如US6,596,541和US7,105,348)中产生的抗体的重链和轻链序列(>6000)与通过采用工程化轻链小鼠(上文描述的)的多抗原免疫方案获得的共同轻链抗体的重链和轻链序列(>600)进行汇编以比较抗体链的重链基因区段使用和体细胞高变频率。重链基因使用。用人细胞表面受体(抗原E)、两个人细胞表面糖蛋白的异源二聚体(抗原F)、人细胞因子受体(抗原G)和人肿瘤分化抗原(抗原H)免疫含有用人VH、DH和JH基因区段对内源信小鼠重链基因座的置换和用工程化种系Vκ1-39Jκ5人轻链区或工程化种系Vκ3-20Jκ1人轻链区(如实施例2中所述的)对内源小鼠κ轻链基因座的置换的小鼠,分析获得的重链和轻链序列的重链基因区段使用并记录VH和JH基因区段。结果显示在表16-18中。表16-18中的百分比代表了凑整值并且在一些情况下加起来可能不等于100%。表16列出了来自小鼠(VI)的抗体、来自具有同源Vκ1-39轻链的小鼠(VI-Vκ1-39)的抗体、来自Vκ1-39工程化轻链小鼠(Vκ1-39)的抗体、来自具有同源Vκ3-20轻链的小鼠(VI-Vκ3-20)的抗体和来自Vκ3-20工程化轻链小鼠(Vκ3-20)的抗体的重链家族使用百分比。表17列出了来自小鼠(VI)的抗体、来自具有同源Vκ1-39轻链的小鼠(VI-Vκ1-39)的抗体、来自Vκ1-39工程化轻链小鼠(Vκ1-39)的抗体、来自具有同源Vκ3-20轻链的小鼠(VI-Vκ3-20)的抗体和来自Vκ3-20工程化轻链小鼠(Vκ3-20)的抗体的VH和JH基因使用百分比。表18列出了来自每个免疫组(抗原E、F、G和H)的Vκ1-39工程化轻链小鼠(Vκ1-39小鼠)的抗体的VH基因使用百分比,以及来自选择的免疫组(抗原E和G)的Vκ3-20工程化轻链小鼠(Vκ3-20小鼠)的抗体的VH基因使用百分比。如本实施例所示,针对在Vκ1-39Jκ5工程化轻链小鼠中检测的抗原的重链基因使用的特征在于占多数的VH家族III亚组(VH3-7、VH3-9、VH3-11、VH3-13、VH3-20、VH3-23、VH3-30、VH3-33和VH3-48)。其它VH家族亚组的显著使用的特征在于VH1-18、VH1-69、VH2-5、VH4-59和VH6-1的使用。对于在Vκ3-20Jκ1工程化轻链小鼠中检测的抗原,重链基因使用的特征在于占多数的VH家族III亚组、VH家族IV亚组和VH家族V亚组(VH3-11、VH3-30、VH3-33、VH4-39、VH4-59和VH5-51)。其它VH家族亚组的显著使用的特征在于VH1-18、VH1-69、VH2-70和VH6-1的使用。体细胞高变频率。根据每条重链和/或轻链所显示的重链和轻链基因使用来将小鼠和工程化轻链小鼠(上文描述的)中产生的抗体的重链和轻链比对至种系序列。计算每个序列的重链和轻链的每个框架区(FW)和互补决定区(CDR)的氨基酸改变。结果显示在表19-22中。表21-24中的百分比代表了凑整值并且在一些情况下加起来可能不等于100%。表19列出了在来自小鼠的抗体的重链、来自Vκ1-39工程化轻链小鼠(Vκ1-39小鼠)的抗体的重链和来自Vκ3-20工程化轻链小鼠(Vκ3-20小鼠)的抗体的重链的每个FW和CDR区中观察到的氨基酸(AA)改变的数目。表20列出了在来自小鼠的抗体的轻链、来自Vκ1-39工程化小鼠(Vκ1-39小鼠)的抗体的轻链和来自Vκ3-20工程化小鼠(Vκ3-20小鼠)的抗体的轻链的每个FW和CDR区中观察到的氨基酸(AA)改变的数目。表21列出了对于选择的免疫组(抗原E、F和H),在来自Vκ1-39工程化轻链小鼠(Vκ1-39小鼠)的抗体的重链的每个FW和CDR区中观察到的氨基酸(AA)改变的数目。表22列出了对于选择的免疫组(抗原E和G),在来自Vκ3-20工程化轻链小鼠(Vκ3-20小鼠)的抗体的重链的每个FW和CDR区中观察到的氨基酸(AA)改变的数目。表16VH家族VIVI-Vκ1-39Vκ1-39VI-Vκ3-20Vκ3-2019.014.83.37.14.922.21.84.601.6377.869.877.361.429.548.48.311.227.139.350.900.74.323.061.75.33.001.6表17表18表19表20表21表22实施例13具有通用轻链的双特异性抗体的结合亲和力使用本领域中已知的标准重组DNA技术从选择的单特异性抗-抗原E共同轻链抗体(描述于实施例5中)的克隆的人重链可变区构建完全人双特异性抗体。表23列出了来自选择的亲本单特异性抗体的人重链(HC-1和HC-2)的配对,每个配对采用种系重排的人Vκ1-39/Jκ5轻链以用于构建每个双特异性抗体。在BIACORETM2000设备(GEHealthcare)上采用实时表面等离子体共振生物传感器检测来测定双特异性或亲本单特异性抗-抗原E抗体与抗原E的细胞外结构域(ECD)的结合。将通过使用EDC-NHS化学利用抗-c-myc-特异性单克隆抗体(Clone#9E10)衍生化的CM5BIACORETM传感器表面用于捕获抗原E的C末端myc-myc-六组氨酸标记的ECD(抗原E-mmh)。大约190RU的抗原E-mmh被捕获在BIACORETM传感器表面上,接着以50μl/min的流速注入300nM和50nM浓度的不同的双特异性或亲本单特异性抗-抗原E抗体。在25℃在HBST运行缓冲液(0.01MHEPESpH7.4,0.15MNaCl,3mMEDTA,0.05%v/v表面活性剂P20)中进行实验。在抗体注入结束前3秒记录在300nM的浓度结合至抗原E-mmh表面的抗体的量并制图。表24和图8列出了观察到的每个双特异性抗体(BsAb)和单特异性亲本抗体(PAb-1、PAb-2)的结合反应(BIACORETM单位;RU)。由于每个抗体在饱和的条件下注入经过相同的抗原E-mmh表面,因此结合反应反映了结合至抗原捕获表面的每个抗体的结合化学计量。如本实施例所示,观察到的每个双特异性抗体的结合反应大约2倍高于每个亲本单特异性抗体的结合反应(表24和图8),证明了使用抗原特异性单克隆抗体的重链和共同轻链的双特异性抗体的功能性构建,其中双特异性抗体分子的每个Fab臂同时结合细胞表面受体的细胞外结构域上的不同表位(抗原E;参见图7B,左下)。表23双特异性抗体亲本HC-1亲本HC-2310829522978310929783022311129523005311230223005表24
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺