基因序列校验组合物、方法和试剂盒与流程
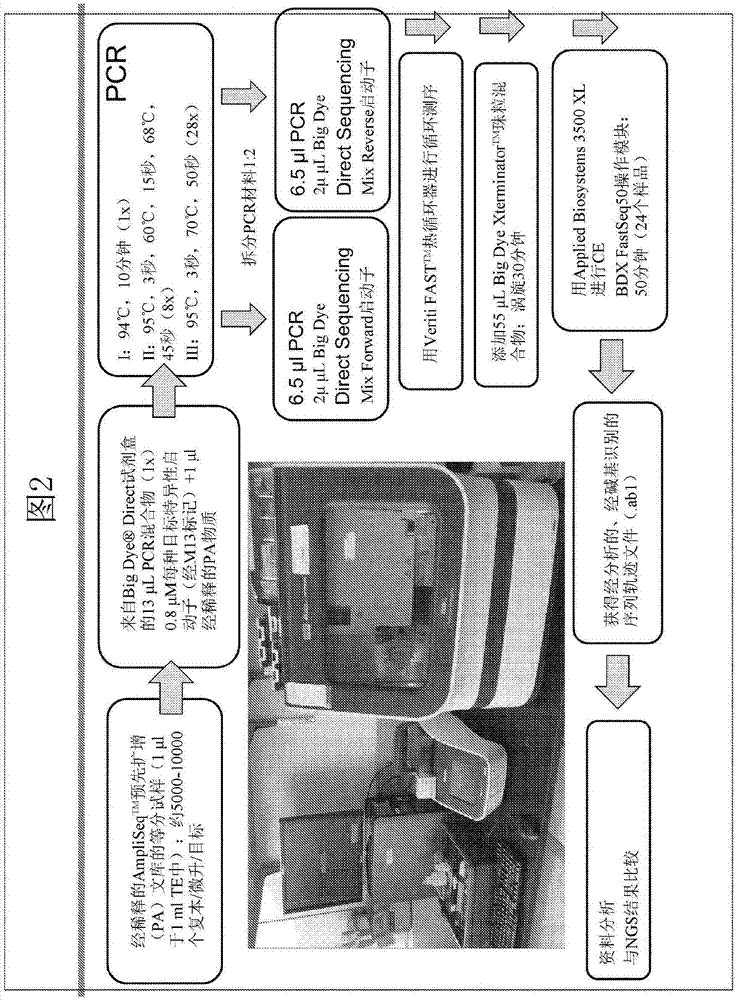
交叉参考:本申请案要求2014年10月3日申请的美国临时申请案第62/059,821号和2014年10月3日申请的第62/059,824号在35u.s.c§119(e)下的优先权,其公开内容以全文引用的方式并入本文中以用于所有目的。在本申请中,引用各种公开案、专利案和/或专利申请案。所述公开案、专利案和/或专利申请案的公开内容在此以全文引用的方式并入本申请案中以便更充分地描述本发明所涉及的目前最先进的水平。本传授内容涉及经化学修饰的寡核苷酸序列引物组合物以及用于dna测序和片段分析的方法。教示内容还涉及用于制备、片段分析和核酸(如cdna和dna)测序的组合物。具体来说,描述用于扩增含有多个目标序列的样品内的一个或多个目标序列的方法、组合物、系统、设备和试剂盒。任选地,在单次扩增反应内扩增多个目标序列,例如至少10、50、100、500或1000个。在一些实施例中,本发明大体上涉及用于扩增来自单一来源(如基因组dna或福马林固定的链烷烃嵌入(ffpe)型dna)的一个或多个目标序列的方法、组合物、系统、设备和试剂盒。本发明中描述扩增和测序的方法以及其组合物和试剂盒,其可用于通过桑格测序(sangersequencing)(与通过ngs方法进行的测序组合/依序进行或在其之后进行)来验证来自单一来源的一个或多个目标序列的核苷酸序列。技术实现要素:在本发明的一个方面中,提供用于测序至少一个扩增子的方法,其包括以下步骤:提供至少一个扩增子,其中所述至少一个扩增子包含相关序列和从第一激活序列并入的相对于相关序列位于5′的前导序列;使所述至少一个扩增子在第一反应混合物中扩增,所述第一反应混合物包括多种核酸酶敏感性扩增引物以形成经扩增的dna产物;使含有经扩增的dna产物的第一反应混合物与包含核酸酶和至少一种化学增强型引物的第二反应混合物接触,所述至少一种化学增强型引物引起多种核酸酶敏感性扩增引物由核酸酶降解;使核酸酶失活;在测序反应中用至少一种化学增强型引物激活经扩增的dna产物;以及制备至少一种化学增强型引物的延伸产物。在一些实施例中,延伸产物可以经荧光标记。在各种实施例中,可使用第一激活序列产生扩增子。在各种实施例中,第一激活序列可包括至少一个可裂解部分。在一些实施例中,前导序列可以是第一激活序列的一部分。在所述方法的各种实施例中,可在相同反应器中进行使第一反应混合物与第二反应混合物接触、使核酸酶失活以及制备化学增强型引物的延伸产物的步骤。在各种实施例中,可在不存在中间纯化步骤的情况下进行使至少一个扩增子扩增、使第一反应混合物与第二反应混合物接触、使核酸酶失活以及制备化学增强型引物的延伸产物的步骤。在所述方法的各种实施例中,所述至少一个扩增子进一步包括相对于相关序列位于3′的接续序列,其中接续序列与用于产生至少一个扩增子的第二激活序列互补。至少一个扩增子可具有约100个核苷酸到约400个核苷酸的长度。至少一个扩增子的相关序列可具有约100个核苷酸到约300个核苷酸的长度。在其它实施例中,至少一个扩增子的相关序列可具有约125个核苷酸到约275或约250个核苷酸的长度。所述至少一个扩增子可以是多个扩增子。在一些实施例中,多个扩增子可包括至少两个不同扩增子,第一个具有作为主要变异序列的相关序列,并且第二个扩增子具有来自样品核酸的相同区域的次要变异序列。在一些实施例中,所述方法进一步包括以下步骤:基于测序反应获得测序结果;以及基于所述结果测定至少相关序列的核苷酸碱基序列。测序结果可通过基于迁移率的分离方法获得。在一些实施例中,基于迁移率的分离方法可以是毛细电泳法。在一些实施例中,可比较所测定的至少序列相关的核苷酸碱基序列与从ngs测序方法获得的至少相关序列的第二核苷酸碱基序列。ngs测序方法可包括大规模平行测序技术,例如使用荧光团或半导体检测的合成测序和焦磷酸测序。在一些实施例中,ngs测序方法可以是半导体测序。在各种实施例中,扩增dna可包括聚合酶链反应扩增。在所选择的实施例中,测序反应可包括循环测序。在各种实施例中,第一反应混合物还可以包括聚合酶。聚合酶可以是热稳定聚合酶。在一些实施例中,聚合酶可以是taq聚合酶。第一反应混合物可进一步包括脱氧核苷酸三磷酸酯。在各种实施例中,第二反应混合物进一步包含聚合酶、脱氧核苷酸三磷酸酯和经染料标记的双脱氧核苷酸三磷酸酯。第二反应混合物的聚合酶可以是热稳定聚合酶。在一些实施例中,聚合酶是taq聚合酶。在用于测序至少一个扩增子的方法的各种实施例中,核酸酶可选自外切核酸酶i、exoiii、pfu和dnapoli。在用于测序至少一个扩增子的方法的各种实施例中,化学增强型引物可包括寡核苷酸序列、ncm以及没有或至少一个核酸酶抗性键。在一些实施例中,化学增强型引物可包括位于末端3′端的一个核酸酶抗性键。化学增强型引物可包括位于末端5′端或化学增强型引物的寡核苷酸序列内的多个ncm。在一些实施例中,多个ncm可位于末端5′端。在各种实施例中,ncm可以是(cn)间隔基,其中n是1到9的任何整数。ncm可包括多个(cn)间隔基。在各种实施例中,化学增强型引物可具有下式的结构:(cn)x-oligo,其中(cn)x具有下式的结构:其中n的每个实例可以独立地是1到9的整数;并且x可以是1到约30的整数;oligo具有下式的结构:其中b是核碱基;k是s或o;m是0或1;z是3到约100的整数;w是oh、f、ome或h;并且nt是具有下式的部分:在一些实施例中,化学增强型引物可具有如本发明中所描述的任何结构。在用于测序至少一个扩增子的方法的各种实施例中,多个核酸酶敏感性扩增引物中的每一个可经配置以激活特定疾病病况的相关序列。在一些实施例中,多个核酸酶敏感性扩增引物可激活与特定疾病病况有关的一组序列。在本发明的另一个方面中,提供用于确定dna序列的方法,其包括以下步骤:使用至少第一激活序列扩增包含核酸的样品以提供多个扩增子,其中所述多个扩增子中的每一个包括相关序列和从第一激活序列并入的相对于相关序列位于5′的前导序列;在包括多个核酸酶敏感性扩增引物的第一反应混合物中扩增所述多个扩增子的第一等分试样以形成经扩增的dna产物;使含有经扩增的dna产物的第一反应混合物与包括核酸酶和至少一个化学增强型引物的第二反应混合物接触,其中通过使核酸酶与第一反应混合物接触,核酸酶敏感性扩增引物由核酸酶降解;使核酸酶失活;在测序反应中用至少一种化学增强型引物激活经扩增的dna产物;以及制备化学增强型引物的延伸产物。在一些实施例中,延伸产物可以经荧光标记。在各种实施例中,可使用第一激活序列产生扩增子。第一激活序列可包括至少一个可裂解部分。在一些实施例中,前导序列可以是第一激活序列的一部分。在所述方法的各种实施例中,可在相同反应器中进行使第一反应混合物与第二反应混合物接触、使核酸酶失活以及制备化学增强型引物的延伸产物的步骤。在各种实施例中,可在不存在中间纯化步骤的情况下进行使多个扩增子扩增、使第一反应混合物与第二反应混合物接触、使核酸酶失活以及制备化学增强型引物的延伸产物的步骤。在所述方法的各种实施例中,多个扩增子中的每一个进一步包括相对于相关序列位于3′的接续序列,其中接续序列与用于产生扩增子的第二激活序列互补。多个扩增子中的每一个可具有约100个核苷酸到约400个核苷酸的长度。多个扩增子中的每一个的相关序列可具有约100个核苷酸到约300个核苷酸的长度。在其它实施例中,多个扩增子中的每一个的相关序列可具有约125个核苷酸到约275或约250个核苷酸的长度。在一些实施例中,多个扩增子可包括至少两个不同扩增子,第一个具有作为主要变异序列的相关序列,并且第二个扩增子具有来自样品核酸的相同区域的次要变异序列。在一些实施例中,所述方法更包括以下步骤:基于测序反应获得测序结果;以及基于所述结果测定至少相关序列的核苷酸碱基序列。测序结果可通过基于迁移率的分离方法获得。在一些实施例中,基于迁移率的分离方法可以是毛细电泳法。在一些实施例中,可比较至少相关序列的所测定的核苷酸碱基序列与从对多个扩增子的第二等分试样进行ngs测序方法获得的至少相关序列的第二核苷酸碱基序列。ngs测序方法可包括大规模平行测序技术,例如使用荧光团或半导体检测的合成测序和焦磷酸测序。在一些实施例中,ngs测序方法可以是半导体测序。在各种实施例中,扩增dna可包括聚合酶链反应扩增。在所选择的实施例中,测序反应可包括循环测序。在各种实施例中,第一反应混合物还可以包括聚合酶。聚合酶可以是热稳定聚合酶。在一些实施例中,聚合酶可以是taq聚合酶。第一反应混合物可进一步包括脱氧核苷酸三磷酸酯。在各种实施例中,第二反应混合物进一步包含聚合酶、脱氧核苷酸三磷酸酯和经染料标记的双脱氧核苷酸三磷酸酯。第二反应混合物的聚合酶可以是热稳定聚合酶。在一些实施例中,聚合酶是taq聚合酶。在用于确定dna序列的方法的各种实施例中,核酸酶可选自外切核酸酶i、exoiii、pfu和dnapoli。在用于确定dna序列的方法的各种实施例中,化学增强型引物可包括寡核苷酸序列、ncm和没有或至少一个核酸酶抗性键。在一些实施例中,化学增强型引物可包括位于末端3′端的一个核酸酶抗性键。化学增强型引物可包括位于末端5′端或化学增强型引物的寡核苷酸序列内的多个ncm。在一些实施例中,多个ncm可位于末端5′端。在各种实施例中,ncm可以是(cn)间隔基,其中n是1到9的任何整数。ncm可包括多个(cn)间隔基。在各种实施例中,化学增强型引物可具有下式的结构:(cn)x-oligo,其中(cn)x具有下式的结构:其中n的每个实例可独立地是1到9的整数;并且x可以是1到约30的整数;oligo具有下式的结构:其中b是核碱基;k是s或o;m是0或1;z是3到约100的整数;w是oh、f、ome或h;并且nt是具有下式的部分:在一些实施例中,化学增强型引物可具有如本发明中所描述的任何结构。在用于确定dna序列的方法的各种实施例中,多个核酸酶敏感性扩增引物中的每一个可经配置以激活特定疾病病况的相关序列。在一些实施例中,多个核酸酶敏感性扩增引物可激活与特定疾病病况有关的一组序列。在本发明的另一个方面中,提供用于准备dna测序的方法,其包括以下步骤:使用至少第一激活序列扩增包含核酸的样品以提供多个扩增子,其中多个扩增子中的每一个包括相关序列和从第一激活序列并入的相对于相关序列位于5′的前导序列;在第一反应混合物中使多个扩增子的等分试样扩增以形成经扩增的dna产物,所述第一反应混合物包括核酸酶敏感性扩增引物;使含有经扩增的dna产物的第一反应混合物与包含核酸酶和化学增强型引物的第二反应混合物接触,从而使核酸酶敏感性扩增引物由核酸酶降解;使核酸酶失活;在测序反应中用化学增强型引物激活经扩增的dna产物;以及制备化学增强型引物的延伸产物。在本发明的另一方面中,提供用于测序和检验相关变异型核酸序列的方法,其包括以下步骤:使用至少第一激活序列使包括核酸的样品扩增以提供多个扩增子,其中多个扩增子中的每一个包括相关序列和从第一激活序列并入的相对于相关序列位于5′的前导序列;将多个扩增子拆分成第一等分试样和第二等分试样;在第一反应混合物中使多个扩增子的第一等分试样扩增以形成第一经扩增的dna产物,所述第一反应混合物包括核酸酶敏感性扩增引物;使含有第一经扩增的dna产物的第一反应混合物与包括核酸酶和化学增强型引物的第二反应混合物接触,其中通过使核酸酶与第一反应混合物接触,核酸酶敏感性扩增引物由核酸酶降解;使核酸酶;在测序反应中用化学增强型引物激活第一经扩增的dna产物;制备化学增强型引物的延伸产物;使用迁移率依赖性分离获得经延伸的化学增强型引物的至少相关序列的测序结果;以及测定经延伸的化学增强型引物的至少相关序列的核苷酸碱基序列;使扩增子的第二等分试样扩增以形成第二dna产物;使用ngs测序方法获得第二dna产物的至少相关序列的测序结果;以及通过比较其与经延伸的化学增强型引物的至少相关序列的核苷酸碱基序列来检验第二dna产物的核苷酸序列。在所述方法的各种实施例中,使多个扩增子的第二等分试样扩增以形成第二dna产物的步骤进一步包含接合接附子、结合于珠粒和接合条形码中的至少一个。在本发明的另一个方面中,提供用于核酸测序的组合物,其包括:pcr扩增反应产物,其包含:从至少一个扩增子扩增的dna产物,其中扩增子包含相关序列和从第一激活序列并入的相对于相关序列位于5′的前导序列;非核酸酶抗性扩增引物;以及化学增强型引物,其中化学增强型引物包含寡核苷酸序列、ncm和没有或至少一个核酸酶抗性键。化学增强型引物可包括位于末端5′端或化学增强型引物的寡核苷酸序列内的多个ncm。ncm可以是(cn)间隔基,其中n可以是1到9的任何整数。在各种实施例中,ncm包含多个(cn)间隔基。在各种实施例中,化学增强型引物可具有式i的结构:其中b是核碱基;k是s或o;每个n独立地是1到9的整数;m是0或1;x是1到约30的整数;z是3到约100的整数;w是oh、f、ome或h;并且nt是具有下式的部分:在本发明的组合物的一些实施例中,化学增强型引物可以是本发明中所描述的任何化学增强型引物。在各种实施例中,化学增强型引物的寡核苷酸部分可包括通用引物。通用引物可选自m13、us1、t7、sp6和t3。通用引物可以是m13。在一些实施例中,化学增强型引物可包括一个核酸酶抗性键。在本发明的组合物的一些实施例中,组合物可进一步包括核酸酶。在其它实施例中,组合物可进一步包括聚合酶、脱氧核苷酸三磷酸酯、双脱氧核苷酸三磷酸酯和染料标记。在一些实施例中,双脱氧核苷酸三磷酸酯可包括标记有染料标记的双脱氧核苷酸三磷酸酯。经染料标记的双脱氧核苷酸三磷酸酯可包括经荧光染料标记的双脱氧核苷酸三磷酸酯。在一些实施例中,染料标记可连接到ncm或寡核苷酸序列。在本发明的组合物的一些实施例中,核酸酶可选自外切核酸酶i、exoiii、pfu和dnapoli。在一些实施例中,聚合酶可以是taq聚合酶。在一些实施例中,pcr扩增反应产物进一步包括经扩增的dna产物,其中dna产物是多个扩增子的扩增产物。在本发明的另一个方面中,提供化学增强型引物,其包括寡核苷酸序列、至少一个ncm和没有或至少一个核酸酶抗性键,并且其中至少10个位于化学增强型引物的3′端的核苷酸与至少10个位于扩增子的5′端的核苷酸互补,其中扩增子包括相关序列和从第一激活序列并入的相对于相关序列位于5′的前导序列。在一些实施例中,化学增强型引物包含位于末端3′端的一个核酸酶抗性键。化学增强型引物可包括位于末端5′端或化学增强型引物的寡核苷酸序列内的多个ncm。ncm可以是(cn)间隔基,其中n可以是1到9的任何整数。ncm可包括多个(cn)间隔基。在化学增强型引物的各种实施例中,化学增强型引物可具有下式的结构:(cn)x-oligo,其中(cn)x具有下式的结构:其中n的每个实例独立地是1到9的整数;并且x是1到约30的整数;oligo具有下式的结构:其中b是核碱基;k是s或o;m是0或1;z是3到约100的整数;w是oh、f、ome或h;并且nt是具有下式的部分:在本发明的另一个方面中,描述一种试剂盒,其包括:聚合酶、核酸酶、至少一种脱氧核苷酸三磷酸和双脱氧核苷酸三磷酸酯。双脱氧核苷酸三磷酸酯可以是标记有染料标记的双脱氧核苷酸三磷酸酯。经染料标记的双脱氧核苷酸三磷酸酯可以是经荧光染料标记的双脱氧核苷酸三磷酸酯。在一些实施例中,核酸酶可选自外切核酸酶i、exoiii、pfu和dnapoli。在各种实施例中,试剂盒可包括如本发明中所描述的化学增强型引物。在其它实施例中,试剂盒可进一步包括多个核酸酶敏感性扩增引物。多个核酸酶敏感性扩增引物可经配置以激活特定疾病病况的相关序列。试剂盒中的多个核酸酶敏感性扩增引物可经配置以激活连接到特定疾病病况的一组序列。本文中参考多种专利案、专利申请案和其它公开案,其皆以全文引用的方式并入本文中。此外,以下标准参考著作以引用的方式并入本文中:《最新分子生物学实验方法汇编(currentprotocolsinmolecularbiology)》,johnwiley&sons,n.y.,2007年10月版本;sambrook,russell和sambrook,《分子克隆实验指南(molecularcloning:alaboratorymanual)》,第3版,coldspringharborlaboratorypress,coldspringharbor,2001。如果本说明书与以参考方式并入的任何文献之间存在冲突,那么本说明书应占主导地位,应了解,判定是否存在冲突或不一致属于本发明人的判断范围内并且可以在任何时间进行。本发明教示内容的其它特征和优点将由以下说明显示,并且将部分由所述说明显而易见,或可通过实践本发明教示内容得知。应理解,先前概述和以下详细描述都仅是例示性和解释性并且意图提供本发明教示内容的进一步说明而不限制本发明教示内容。附图说明随附图式(其并入本说明书中并且组成本说明书的一部分)举例说明所披露的实施例,并且与说明书一起用于解释和说明所揭示的实施例的原理。确切地说:图1是用于使用预先扩增的样品的小型等分试样,通过毛细电泳法分离来检验变异型序列的工作流的图形表示。这允许在ngs方法(例如(但不限于)ionampliseqtm半导体测序)以及通过有效正交毛细电泳法分析路径进行的确认分析中使用尺寸有限的待分析的样品。图2是用于在本发明的方法中处理预先扩增的样品的分析步骤的注释说明。图3是通过本发明的方法获得的序列数据的资料分析的流程图。图4是测试样品和资料类型的示意图。ce表示毛细电泳法(桑格测序资料)并且pgmtm表示ionpersonalgenome(资料是半导体测序资料)。chpv2是来源于iontorrentampliseqtmcancerhotspotpanelv2的预先扩增物质并且ocp是来自专属iontorrentampliseqoncominetm的预先扩增物。图5是通过桑格再测序并且具体说来,direct测序技术进行的校验分析的特定目标的示意图。chpv.2表明这些基因座是ionampliseqtmcancerhotspotpanelv.2的一部分并且ocp表明所指示的基因座是iononcominetm癌症图的一部分。图6是对ionpgmtm(318晶片)使用ionampliseq方法,发现由三个样品产生的变异体的示意图。第二栏表示在特定样品中发现的变异体的数目。对于特定基因座,右边的其余栏表示所观察的变异型序列的百分比。图7是在使用本发明的方法通过桑格测序再测序时,从相同的三个样品发现的变异型序列的示意图。研究相同基因座并且确认变异体。图8a-8b是图5的chpv2pa的targetsangerce测试集a的qualitygrid的示意性图示(如在appliedbiosystemsvariantreportertm软体中所见)。图8a的下部在图8b中以更大的比例再现,并且说明对于由ampliseq到桑格测序的工作流获得的四个极具限制性的初始样品中的每一个,96个所得扩增子中的88个具有2x覆盖度(正向/反向),并且8个具有1x覆盖度。不存在脱扣。向右的箭头表示成功的正向延伸产物制备并且向左的箭头表示成功的反向延伸产物制备。图9a-9b是图5的chpv2pa的targetsangerce测试集b的qualitygrid的示意性图示(如在appliedbiosystemsvariantreportertm软体中所见)。图9a的下部在图9b中以更大的比例再现,并且说明对于由ampliseq到桑格测序的工作流获得的四个极具限制性的初始样品中的每一个,96个所得扩增子中的93个具有2x覆盖度(正向/反向),并且3个具有1x覆盖度。不存在脱扣。向右的箭头表示成功的正向延伸产物制备并且向左的箭头表示成功的反向延伸产物制备。图10是电泳图的图形表示,其表明检测样品ffpe-5的alk-2中的次要变异体的测序结果。左图(正向序列)和右图(反向序列)中的箭头明确展示在主要变异体信号峰下的大量次要变异体,其通过kbtm碱基识别可称为混合碱基。可比较这一目测比率与使用iontorrentsuitetm软体获得的所提供的ampliseq衍生结果的比率以分析次要与主要的比率,其指配次要变异体的比率是26.8%。图11是电泳图的图形表示,其表明检测样品na8020的egfr-6中的次要变异体的测序结果。左图(正向序列)和右图(反向序列)中的箭头明确展示在主要变异体信号峰下的可检测量的次要变异体,其通过kbtm碱基识别不可称为混合碱基。可比较这一目测比率与使用iontorrentsuitetm软体获得的所提供的ampliseq衍生结果的比率以分析次要与主要的比率,其指配次要变异体的比率是9.6%。图12是由对ionpgmtm(318晶片)使用ocpampliseqtm的三个样品的测序发现的tp53突变的出现频率的示意图。图13是图12的再测序样品的示意图,使用本发明的方法验证图12中展示的tp53突变。图14a-14b是四个样品的来自ocpampliseqtm的24个tp53individual扩增子的qualitygrid的图形表示(如在appliedbiosystemsvariantreportertm软体中所见)。图14a的下部在图14b中以更大的比例再现,并且说明对于由ampliseqtm到桑格测序的工作流获得的四个极具限制性的样品中的每一个,96个扩增子中的94个具有完全2x覆盖度(正向/反向)。不存在脱扣。向右的箭头表示成功的正向延伸产物制备并且向左的箭头表示成功的反向延伸产物制备。图15是检测样品ffpe5的tp53中的次要变异体的测序结果的电泳图的图形表示。左图(正向序列)和右图(反向序列)中的箭头明确展示在主要变异体信号峰下的可检测量的次要变异体。使用iontorrentsuitetm软体分析次要(c)与主要(t)的比率表明次要变异体的比率是17.9%。图16是检测图15中展示的不同位置处tp53中的次要变异体的测序结果的电泳图的图形表示,例如ffpe5。左图(正向序列)和右图(反向序列)中的箭头明确展示在主要变异体信号峰下的可检测量的次要变异体。使用iontorrentsuitetm软体分析次要(t)与主要(c)的比率表明次要变异体的比率是21.8%。图17是检测图15中展示的第三位置处tp53中的次要变异体的测序结果的电泳图的图形表示,例如ffpe5。左图(正向序列)和右图(反向序列)中的箭头明确展示在主要变异体信号峰下的可检测量的次要变异体。使用iontorrentsuitetm软体分析次要(c)与主要(g)的比率表明次要变异体的比率是20.2%。具体实施方式为了有助于对本发明教示内容的理解,提供以下定义。应理解,通常,未以其它方式定义的术语具有其在所属领域中一般公认的的普通含义。如本文中所使用,“扩增”或“扩增反应”和其派生词通常指用于将核酸分子(称为模板核酸分子)的至少一部分复写或复制到至少一个其它核酸分子中的任何作用或过程。其它核酸分子任选地包括与模板核酸分子的至少某一部分实质上一致或大体上互补的序列。模板核酸分子可以是单股或双股并且另一个核酸分子可以独立地是单股或双股。在一些实施例中,扩增包括模板依赖性活体外酶催化反应,其用于制备核酸分子的至少某一部分的至少一个复本或制备与核酸分子的至少某一部分互补的核酸序列的至少一个复本。扩增任选地包括核酸分子的线性或指数复制。在一些实施例中,使用等温条件进行这类扩增;在其它实施例中,这类扩增可包括热循环。在一些实施例中,扩增是多元扩增,其包括在单次扩增反应中同时扩增多个目标序列。至少一些目标序列可单次扩增反应中所包括的相同核酸分子或不同目标核酸分子上。在一些实施例中,“扩增”包括单独或呈组合形式的基于dna和rna的核酸的至少某一部分的扩增。扩增反应可包括单股或双股核酸衬底并且可进一步包括所属领域的一般技术人员已知的扩增方法中的任一种。在一些实施例中,扩增反应包括聚合酶链反应(pcr)。如本文中所使用,“扩增条件”和其派生词通常指适用于扩增一个或多个核酸序列的条件。这类扩增可以是线性或指数的。在一些实施例中,扩增条件可包括等温条件或可包括热循环条件,或等温和热循环条件的组合。在一些实施例中,适用于扩增一个或多个核酸序列的条件包括聚合酶链反应(pcr)条件。通常,扩增条件指足以扩增核酸(如一个或多个目标序列)或扩增接合到一个或多个衔接子的经扩增的目标序列(例如衔接子接合的经扩增的目标序列)的反应混合物。通常,扩增条件包括用于扩增或用于核酸合成的催化剂,例如聚合酶;与待扩增的核酸具有一定程度的互补性的引物;以及核苷酸,诸如脱氧核糖核苷酸三磷酸酯(dntp),以促进与核酸杂交之后引物的延伸。扩增条件需要引物与核酸的杂交或粘接,引物的延伸和变性步骤,其中经延伸的引物与经历扩增的核酸序列分离。通常但未必,扩增条件可包括热循环,在一些实施例中,扩增条件包括多个循环,其中重复粘接、延伸和分离步骤。通常,扩增条件包括阳离子,如mg++或mn++(例如mgcl2等),并且还可以包括多种离子强度调节剂。如本文中所使用,“目标序列”或“相关序列”和其派生词通常并且可互换地指可根据本发明扩增或合成的任何单股或双股核酸序列,包括怀疑或预期样品中存在的任何核酸序列。在一些实施例中,在添加目标特异性引物或附接衔接子之前,相关序列以双股形式存在并且包括待扩增或合成的具体核苷酸序列的至少一部分或其补体。目标序列可包括可与适用于扩增或合成反应的引物在聚合酶延伸之前杂交的核酸。在一些实施例中,所述术语指核酸序列。其序列一致性、核苷酸的次序或位置由本发明的方法中的一种或多种测定。如本文中所定义,“可裂解基团”通常指在并入核酸后可在适当条件下裂解的任何部分。举例来说,可将可裂解基团并入样品的引物、经扩增的序列、衔接子或核酸分子中。在例示性实施例中,目标特异性引物可包括可裂解基团,其变成并入经扩增的产物中并且接着在扩增之后裂解,从而从经扩增的产物移除一部分或所有目标特异性引物。可裂解基团可裂解或以其它方式通过任何可接受的手段从样品的目标特异性引物、经扩增的序列、衔接子或核酸分子移除。举例来说,可通过酶促、热学、光氧化或化学处理从样品的目标特异性引物、经扩增的序列、衔接子或核酸分子移除可裂解基团。在一个方面中,可裂解基团可包括非天然存在的核碱基。举例来说,寡脱氧核苷酸可包括一个或多个rna核碱基,如可通过尿嘧啶糖基化酶移除的尿嘧啶。在一些实施例中,可裂解基团可包括一个或多个经修饰的核碱基(如7-甲基鸟嘌呤、8-侧氧基-鸟嘌呤、黄嘌呤、次黄嘌呤、5,6-二氢尿嘧啶或5-甲基胞嘧啶)或一个或多个经修饰的核苷(即,7-甲基鸟苷、8-侧氧基-脱氧鸟苷、黄苷、肌苷、二氢尿苷或5-甲基胞啶)。可通过酶促、化学或热学手段从核酸移除经修饰的核碱基或核苷酸。在一个实施例中,可裂解基团可包括在暴露于紫外光(即,溴脱氧尿苷)时,可在扩增(或合成)之后从引物移除的部分。在另一实施例中,可裂解基团可包括甲基化胞嘧啶。通常,甲基化胞嘧啶可由引物裂解,例如在诱导扩增(或合成)之后、在亚硫酸氢钠处理时。在一些实施例中,可裂解部分可包括限制位点。举例来说,引物或目标序列可包括对一种或多种限制酶具有特异性的核酸序列,并且在扩增(或合成)之后,引物或目标序列可用一种或多种限制酶处理使得移除可裂解基团。通常,可在一个或多个位置包括一个或多个可裂解基团以及样品的目标特异性引物、经扩增的序列、衔接子或核酸分子。如本文所用,“裂解”和其派生词一般是指可裂解基团从样品的目标特异性引物、经扩增的序列、衔接子或核酸分子裂解或以其它方式移除的任何过程。在一些实施例中,裂解步骤可以涉及化学、热学、光氧化或消化过程。如本文中所使用,术语“互补”和“补体”以及其派生词指可在反平行定向(如在杂交双螺旋中)的两个或更多个个别相应位置经历累积碱基配对的任何两个或更多个核酸序列(例如部分或全部模板核酸分子、目标序列及/或引物)。这类碱基配对可根据任何现有规则集合进行,例如根据沃森-克里克碱基配对规则(watson-crickbasepairingrules)或根据一些其它碱基配对范例。任选地,第一与第二核酸序列之间可以存在“完全”或“总体”互补性,其中第一核酸序列中的每个核苷酸可以经历与第二核酸序列上的相应的反平行位置中的核苷酸的稳定化碱基配对相互作用。“部分”互补性描述一个核酸序列的至少20%但少于100%的残基与另一个核酸序列残基互补的核酸序列。在一些实施例中,一个核酸序列的至少50%但少于100%的残基与另一个核酸序列中的残基互补。在一些实施例中,一个核酸序列的至少70%、80%、90%、95%或98%但少于100%的残基与另一个核酸序列中的残基互补。当一个核酸序列的至少85%的残基与另一个核酸序列中的残基互补时,序列被称为“基本上互补”。在一些实施例中,两个互补或基本上互补序列能够在标准或严格杂交条件下彼此杂交。“非互补”描述其中一个核酸序列的少于20%的残基与另一个核酸序列中的残基互补的核酸序列。当一个核酸序列的少于15%的残基与另一个核酸序列中的残基互补时,序列被称为“基本上非互补”。在一些实施例中,两个非互补或基本上非互补序列无法在标准或严格杂交条件下彼此杂交。“错配”存在于不互补的两个相对核苷酸中的任何位置。互补核苷酸包括在生理条件下在dna复制期间通过与彼此相对的dna聚合酶有效并入的核苷酸。在典型实施例中,在彼此位于反平行位置的核苷酸及/或聚核苷酸的核碱基之间,互补核苷酸可彼此形成碱基对,如通过特异性沃森-克里克型氢键形成的a-t/u和g-c碱基对,或通过某种其它类型的碱基配对范例形成的碱基对。其它人工碱基对的互补性可以是基于其它类型的氢键和/或碱基的疏水性和/或碱基之间的形状互补性。如本文中所使用,“dna条码”或“dna标记序列”和其派生词通常是指可充当‘用于区分或分离样品中多个经扩增的目标序列′的衔接子内的独特短(6-14个核苷酸)核酸序列。出于本发明的目的,dna条形码或dna标记序列可以并入衔接子的核苷酸序列中。如本文中所使用,当关于两种或更多种组分使用时,“接触”和其派生词通常是指用于促进或实现参考组分的接近、靠近、混合物或共混而未必需要这类组分的物理接触的任何过程,并且包括含有所述参考组分中的任一种或多种的溶液的彼此混合。参考组分可以任何具体顺序或组合接触并且组分的引述顺序不受限制。如本文中所使用,术语“测定核苷酸碱基序列”或术语“测定关于序列的信息”涵盖“序列测定”并且也涵盖其它程度的信息,如消除序列的一种或多种可能性。应注意,进行聚核苷酸的序列测定通常产生关于完美互补(100%互补)聚核苷酸的序列的等效信息,并且因此等效于直接对完美互补聚核苷酸进行序列测定。如本文中所使用,当关于核酸分子(例如目标序列或经扩增的目标序列)使用时,术语“末端”和其派生词可包括核酸分子的末端30个核苷酸、末端20和甚至更通常末端15个核苷酸。包含一连串相邻核苷酸的线形核酸分子通常包括至少两个末端。在一些实施例中,核酸分子的一端可包括3′羟基或其等效物,并且可称为“3′端”和其派生词。任选地,3′端包括未连接到单核苷酸戊糖环的5′磷酸基的3′羟基。典型地,3′端包括经定位与包括未连接的3′羟基的核苷酸相邻的一个或多个5′连接的核苷酸,通常经定位与3′羟基相邻的30个核苷酸,通常末端20个并且甚至更通常末端15个核苷酸。通常,一个或多个连接的核苷酸可表示成寡核苷酸中存在的核苷酸的百分比,或可以与未连接的3′羟基相邻的许多连接的核苷酸形式提供。举例来说,3′端可占寡核苷酸的核苷酸长度的小于50%。在一些实施例中,3′末端不包括任何未连接的3′羟基,但可包括任何能够充当核苷酸通过引物延伸和/或核苷酸聚合进行的连接的位点的部分。在一些实施例中,例如当参考目标特异性引物时,术语“3′端”可包括3′端处的末端10个核苷酸、末端5个核苷酸、末端4、3、2或更少个核苷酸。在一些实施例中,当参考目标特异性引物时,术语“3′端”可包括位于核苷酸位置10的核苷酸或更少的来自3′端的核苷酸。如本文中所使用,“5′端”和其派生词通常指核酸分子(例如目标序列或经扩增的目标序列)的末端,其包括自由5′磷酸基或其等效物。在一些实施例中,5′端包括未连接到相邻单核苷酸戊糖环的3′羟基的5′磷酸基。通常,5′端包括经定位与5′磷酸相邻的一个或多个连接的核苷酸,通常经定位与包括5′磷酸基的核苷酸相邻的30个核苷酸,通常末端20个并且甚至更通常末端15个核苷酸。通常,一个或多个连接的核苷酸可表示成寡核苷酸中存在的核苷酸的百分比,或可以与5′磷酸相邻的许多连接的核苷酸形式提供。举例来说,5′端可小于寡核苷酸的核苷酸长度的50%。在另一个例示性实施例中,5′端可包括与包括末端5′磷酸的核苷酸相邻的约15个核苷酸。在一些实施例中,5′端不包括任何未连接的5′磷酸基,但可包括任何能够充当与3′羟基或另一个核酸分子的3′端的连接位点的部分。在一些实施例中,例如当参考目标特异性引物时,术语“5′端”可包括5′端处的末端10个核苷酸、末端5个核苷酸、末端4、3、2或更少个核苷酸。在一些实施例中,当参考目标特异性引物时,术语“5′端”可包括位于核苷酸位置10的核苷酸或更少的来自5′端的核苷酸。在一些实施例中,目标特异性引物的5′端可仅包括非可裂解核苷酸,例如不含如本文中所披露的一个或多个可裂解基团的核苷酸,或可由所属领域的一般技术人员容易地测定的可裂解核苷酸。如本文中所使用,术语“杂交”符合其在所属领域中的用途,并且通常指用于使两个核酸分子经历碱基配对相互作用的方法。当一个核酸分子的任何部分与另一个核酸分子的任何部分碱基配对时,两个核酸分子分子称为杂交;未必需要两个核酸分子跨越其全部各别长度杂交并且在一些实施例中,至少一个核酸分子可包括不与另一个核酸分子杂交的部分。短语“在严格条件下杂交”和其派生词通常指可在存在高杂交温度和低离子强度的条件下进行目标特异性引物与目标序列的杂交的条件。在一个例示性实施例中,严格杂交条件包括在约60-68℃下含有约30mm硫酸镁、约300mmtris-硫酸盐(ph8.9)和约90mm硫酸铵的水性环境或其等效物。如本文中所使用,短语“标准杂交条件”和其派生词通常指可在存在低杂交温度和高离子强度的情况下进行引物与寡核苷酸(即,目标序列)的杂交的条件。在一个例示性实施例中,标准杂交条件包括在约50-55℃下含有约100mm硫酸镁、约500mmtris-硫酸盐(ph8.9)和约200mm硫酸铵的水性环境或其等效物。如本文中所使用,术语“接合”和其派生词通常指用于将两个或更多个分子共价连接在一起(例如使两个或更多个核酸分子彼此共价连接)的动作或方法。在一些实施例中,接合包括核酸的相邻核苷酸之间的结合口。在一些实施例中,接合包括形成第一核酸分子的末端与第二核酸分子的末端之间的共价键。在一些实施例中,例如其中待接合的核酸分子包括常规核苷酸残基的实施例,接合可包括形成一个核酸的5′磷酸基与第二核酸的3′羟基之间的共价键,从而形成经接合的核酸分子。在一些实施例中,可使用任何用于在相邻核苷酸之间使5′磷酸与3′羟基接合或结合的方法。在例示性实施例中,可使用酶,如连接酶。通常,在本发明中,经扩增的目标序列可与衔接子接合以产生衔接子接合的经扩增的目标序列。如本文中所使用,“连接酶”和其派生词通常指任何能够催化两个衬底分子的接合的试剂。在一些实施例中,连接酶包括能够催化核酸的相邻核苷酸之间的接口的接合的酶。在一些实施例中,连接酶包括能够催化一个核酸分子的5′磷酸与另一个核酸分子的3′羟基之间形成共价键,从而形成经接合的核酸分子的酶。适合的连接酶可包括(但不限于)t4dna连接酶、t4rna连接酶以及大肠杆菌(e.coli)dna连接酶。如本文中所使用,“钝端接合”和其派生词通常指两个钝端双链核酸分子彼此接合。“钝端”指其中核酸分子的一个股的末端中的基本上所有核苷酸与同一个核酸分子的另一个股中的相对核苷酸碱基配对的双股核酸分子的末端。如果核酸分子具有包括长度超过两个核苷酸的单股部分的末端(本文中称为“悬垂物”),那么其不是钝端的。在一些实施例中,核酸分子的末端不包括任何单股部分,使得末端的一个股中的每个核苷酸与同一个核酸分子的另一个股中的相对核苷酸碱基配对。在一些实施例中,变成彼此接合的两个钝端核酸分子的末端不包括任何重叠、共有或互补序列。通常,钝端接合不包括使用其它寡核苷酸衔接子帮助双股经扩增的目标序列与双股衔接子的接合,如2010年5月27日公开的mitra和varley,us2010/0129874中所描述的补丁寡核苷酸。在一些实施例中,钝端接合包括接口平移反应以密封在接合过程期间产生的接口。如本文中所使用,术语“衔接子”或“衔接子和其补体”以及其派生词通常指任何可与本发明的核酸分子接合的线形寡核苷酸。任选地,衔接子包括基本上不与样品内至少一个目标序列的3′端或5′端互补的核酸序列。在一些实施例中,衔接子基本上不与样品中任何目标序列的3′端或5′端互补。在一些实施例中,衔接子包括任何基本上不与经扩增的目标序列互补的单股或双股线形寡核苷酸。在一些实施例中,衔接子基本上不与样品的至少一个、一些或全部核酸分子互补。在一些实施例中,适合的衔接子长度在约10-100个核苷酸、约12-60个核苷酸和约15-50个核苷酸长度范围内。通常,衔接子可包括核苷酸和/或核酸的任何组合。在一些方面中,衔接子可在一个或多个位置包括一个或多个可裂解基团。在另一个方面中,衔接子可包括与引物(例如通用引物)的至少一部分基本上一致或基本上互补的序列。在一些实施例中,衔接子可包括条码或标签以辅助下游编目、鉴别或测序。在一些实施例中,当与经扩增的目标序列接合时,尤其在存在聚合酶和dntp的情况下在适合的温度和ph值下,单股衔接子可充当用于扩增的衬底。如本文中所使用,术语“聚合酶链反应”(“pcr”)指k.b.mullis,美国专利案第4,683,195号和第4,683,202号的方法,其以引用的方式并入本文中,其描述用于在不进行克隆或纯化的情况下增加基因组dna的混合物中相关聚核苷酸的片段的浓度的方法。这种用于扩增相关聚核苷酸的过程由以下组成:将大量过量的两种寡核苷酸引物引入含有所需相关聚核苷酸的dna混合物,接着是在dna聚合酶存在下热循环的精确序列。两种引物与相关双股聚核苷酸的其相应股互补。为了实现扩增,使混合物变性,并且然后将引物粘接到相关聚核苷酸分子内的其互补序列。在粘接之后,用聚合酶使引物延伸以形成一对新互补股。变性、引物粘接和聚合酶延伸的步骤可以重复多次(即,变性、粘接和延伸构成一个“循环”;可以存在众多“循环”)以获得所需相关聚核苷酸的高浓度的扩增的片段。所需相关聚核苷酸的扩增的片段(扩增子)的长度通过引物相对于彼此的相对位置测定,并且因此这一长度是可控制参数。借助于重复所述过程,所述方法被称为“聚合酶链反应”(在下文中“pcr”)。因为相关聚核苷酸的所需扩增的片段变为混合物中的主要核酸序列(就浓度来说),所以其被称为“pcr扩增的”。如本文中所定义,包括多种目标核酸分子的样品内的目标核酸分子经由pcr而扩增。在上文所论述的方法的一个改进中,目标核酸分子可以使用多种不同引物对、在一些情况下一种或多种引物对/相关标靶核酸分子而pcr扩增,由此形成多重pcr反应。使用多重pcr,有可能同时从样品扩增多种相关核酸分子以形成经扩增的目标序列。还可能通过数种不同方法(例如,用生物分析仪或qpcr定量,用经标记的探针杂交;并入生物素化的引物,接着进行抗生物素蛋白-酶结合物检测;将经32p标记的脱氧核苷酸三磷酸酯(例如dctp或datp)并入到经扩增的目标序列中)检测扩增的目标序列。任何寡核苷酸序列可用适合的引物集合扩增,从而实现目标核酸分子从基因组dna、cdna、福马林固定的链烷烃嵌入型dna、细针穿刺活检(fine-needlebiopsies)和多种其它来源的扩增。具体来说,由如本文中所披露的多重pcr过程产生的经扩增的目标序列本身是用于后续pcr扩增或多种下游分析或操作的有效衬底。如本文中所定义,“多重扩增”是指样品内的两种或更多种目标序列使用至少一种目标特异性引物的选择性并且非随机的扩增。在一些实施例中,进行多重扩增,使得一些或全部目标序列在单一反应容器内扩增。既定多重扩增的“重数”或“重”通常是指在所述单一多重扩增期间扩增的不同目标特异性序列的数目。在一些实施例中,重数可以是约12重、24重、48重、96重、192重、384重、768重、1536重、3072重、6144重或更多重。如本文中所使用,“循环测序”指包括向目标核酸或其扩增产物中添加测序引物、脱氧核苷酸三磷酸酯(dntp)、经染料标记的链封端核苷酸(例如双脱氧核苷酸三磷酸酯(ddntp-染料))以及dna聚合酶,接着进行热循环测序的过程。已明确标准循环测序程序。循环测序程序更详细地描述于例如美国专利案第5,741,676号和美国专利案第5,756,285号,其各自以全文引用的方式并入本文中。在某些实施例中,“循环测序”包含如所属领域的技术人员已知的dntp、测序引物(经标记或未经标记)、ddntp(经标记或未经标记)和dna聚合酶。应注意,经标记的测序引物可提供目标核酸或其扩增产物的序列的片段分析信息和/或测定。如本文中所使用,术语“pcr/循环测序”指用于通过pcr扩增dna,接着重复(或循环)若干次测序反应来测定dna的核苷酸序列的方法。这一循环与pcr类似,因为允许在可进行聚合酶延伸的预先选择的温度进行测序反应,即42℃-55℃,接着通过加热到95℃来停止延伸,并且最终在42℃-55℃下再次开始循环。循环测序使用热稳定dna聚合酶。如本文中所使用,术语“硫代磷酸酯键”指糖磷酸酯主链的磷酸酯键内包含代替非桥联氧原子的硫原子的核苷酸间键。术语硫代磷酸酯键指硫代磷酸酯核苷酸间键和二硫代磷酸酯核苷酸间键。“末端3′端处的硫代磷酸酯键”指3′端处的硫代磷酸酯键,也就是说,3′端处糖磷酸酯主链的最后一个磷酸酯键。末端3′端处的硫代磷酸酯键说明于图2中。如本文中所使用,术语“磷酸二酯键”可指键-po4-,其用于连接核苷酸单体,如在天然存在的dna中发现的核苷酸间键。此外,“磷酸二酯键”可指本发明的化学增强型引物的ncm或ncm连接子的部分。如本文中所使用,术语“核酸酶抗性键”指对由核酸酶进行的3′到5′方向的消化具有抗性的寡核苷酸序列,如引物。硫代磷酸酯和硼磷酸酯键是核酸酶抗性键的两个实例。实例不应解释为仅限于这些实例。如本文中所使用,术语“引物”和其派生物通常指可与相关目标序列杂交的任何聚核苷酸。在一些实施例中,引物也可以用于激活核酸合成。典型地,引物充当衬底,其上可由聚合酶聚合核苷酸;然而,在一些实施例中,引物可变得并入合成的核酸链中并且提供另一引物可杂交的位点以激活与所合成的核酸分子互补的新股的合成。引物可包含核苷酸或其类似物的任何组合,其可任选地连接以形成任何适合长度的线形聚合物。在一些实施例中,引物是单股寡核苷酸或聚核苷酸。(在本发明中,术语“聚核苷酸”和“寡核苷酸”在本文中可互换地使用并且未必指示两个核苷酸之间长度的任何差异)。在一些实施例中,引物是单股,但其也可以是双股。引物任选地天然产生,如在纯化的限制消化中,或可以合成方式产生。在一些实施例中,当暴露于扩增或合成条件时,引物充当用于扩增或合成的起始点;这类扩增或合成可以模板依赖性方式进行并且任选地形成与至少一部分目标序列互补的引物延伸产物。例示性扩增或合成条件可包括使引物与聚核苷酸模板(例如包括目标序列的模板)、核苷酸和诱导剂(如聚合酶)在适合的温度和ph值下接触,以诱导目标特异性引物的末端上核苷酸的聚合。如果是双股,在用于制备引物延伸产物之前,引物可任选地经处理以分离其各股。在一些实施例中,引物是寡脱氧核苷酸或寡核糖核苷酸。在一些实施例中,引物可包括一个或多个核苷酸类似物。目标特异性引物的确切长度和/或组成(包括序列)可影响许多特性,包括熔融温度(tm)、gc含量、次要结构的形成、重复核苷酸主结构、所预测的引物延伸产物的长度、跨越相关核酸分子的覆盖度的程度、单次扩增或合成反应中的引物数目、引物内是否存在核苷酸类似物或经修饰的核苷酸等。在一些实施例中,引物可在扩增或合成反应内与相容的引物配对以形成由正向引物和反向引物组成的引物对。在一些实施例中,引物对的正向引物包括基本上与核酸分子的一个股的至少一部分互补的序列,并且引物对中引物的反向引物包括基本上与所述股线的至少一部分一致的序列。在一些实施例中,正向引物和反向引物能够与核酸双螺旋的相对股杂交。任选地,正向引物激活第一核酸链的合成,并且反向引物激活第二核酸链的合成,其中第一和第二股基本上彼此互补,或可杂交以形成双股核酸分子。在一些实施例中,扩增或合成产物的一端由正向引物定义并且扩增或合成产物的另一端由反向引物定义。在一些实施例中,当需要扩增或合成冗长引物延伸产物(如扩增外显子、编码区或基因)时,可产生若干引物对而非跨越所需长度以实现所述区域的足够扩增。在一些实施例中,引物可包括一个或多个可裂解基团。在一些实施例中,引物长度在约10到约60个核苷酸、约12到约50个核苷酸和约15到约40个核苷酸长度范围内。典型地,当在存在dntp和聚合酶的情况下暴露于扩增条件时,引物能够与相应的目标序列杂交并且进行引物延伸。在一些情况下,具体核苷酸序列或引物的一部分在扩增反应开始时已知或可通过本文所披露的方法中的一种或多种测定。在一些实施例中,引物在引物内的一个或多个位置包括一个或多个可裂解基团。如本文中所使用,“目标特异性引物”和其派生物通常指单链或双股聚核苷酸,通常是寡核苷酸,其包括至少一个与包括目标序列的核酸分子的至少一部分至少50%互补,通常至少75%互补或至少85%互补,更通常至少90%互补,更通常至少95%互补,更通常至少98%或至少99%互补或一致的序列。在这类情况下,目标特异性引物和目标序列描述成彼此“相应”。在一些实施例中,目标特异性引物能够与其相应目标序列的至少一部分(或目标序列的补体)杂交;这类杂交可任选地在标准杂交条件下或在严格杂交条件下进行。在一些实施例中,目标特异性引物不能与目标序列或其补体杂交,但能够与包括目标序列的核酸链的一部分或其补体杂交。在一些实施例中,目标特异性引物包括至少一个与目标序列本身的至少一部分至少75%互补,通常至少85%互补,更通常至少90%互补,更通常至少95%互补,更通常至少98%互补或更通常至少99%互补的序列;在其它实施例中,目标特异性引物包括至少一个与除目标序列以外的核酸分子的至少一部分至少75%互补,通常至少85%互补,更通常至少90%互补,更通常至少95%互补,更通常至少98%互补或更通常至少99%互补的序列。在一些实施例中,目标特异性引物基本上不与样品中的其它目标序列互补;任选地,目标特异性引物基本上不与样品中的其它核酸分子互补。在一些实施例中,样品中不包括或对应于目标序列(或目标序列的补体)的核酸分子称为“非特异性”序列或“非特异性核酸”。在一些实施例中,目标特异性引物经设计以包括基本上与其相应目标序列的至少一部分互补的核苷酸序列。在一些实施例中,目标特异性引物与包括其相应目标序列的核酸分子的至少一部分至少95%互补或至少99%互补或一致(跨越其全部长度)。在一些实施例中,目标特异性引物可与其相应目标序列的至少一部分至少90%、至少95%互补、至少98%互补或至少99%互补或一致(跨越其全部长度)。在一些实施例中,正向目标特异性引物和反向目标特异性引物定义靶特异性引物对,其可用于经由模板依赖性引物延伸来扩增目标序列。通常,目标特异性引物对中的每个引物包括至少一个与包括相应目标序列的核酸分子的至少一部分基本上互补,但与样品中的至少一个其它目标序列小于50%互补的序列。在一些实施例中,扩增可在单次扩增反应中使用多个目标特异性引物对进行,其中每个引物对包括正向目标特异性引物和反向目标特异性引物,各自包括至少一个与样品中的相应目标序列基本上互补或基本上一致的序列,并且每个引物对具有不同的相应目标序列。在一些实施例中,目标特异性引物可在其3′端或其5′端与扩增反应中的任何其它目标特异性引物是基本上非互补性。在一些实施例中,目标特异性引物可包括扩增反应中与其它目标特异性引物的最小交叉杂交。在一些实施例中,目标特异性引物包括与扩增反应混合物中非特异性序列的最小交叉杂交。在一些实施例中,目标特异性引物包括最小自身互补性。在一些实施例中,目标特异性引物可包括位于3′端的一个或多个可裂解基团。在一些实施例中,目标特异性引物可包括位于目标特异性引物的中心核苷酸附近或周围的一个或多个可裂解基团。在一些实施例中,更多个目标特异性引物中的一个仅包括目标特异性引物的5′端处的非可裂解核苷酸。在一些实施例中,任选地在相同扩增反应中,与一个或多个不同目标特异性引物相比,目标特异性引物包括引物的3′端或5′端处的最小核苷酸序列重叠。在一些实施例中,单一反应混合物中的1、2、3、4、5、6、7、8、9、10种或更多种目标特异性引物包括以上实施例中的一个或多个。在一些实施例中,单一反应混合物中基本上所有的多种目标特异性引物包括以上实施例中的一个或多个。如本文中所使用,术语“化学增强型引物”指可在引物的末端5′端或引物内具有带负电部分的引物。引物还可以包括3′端处糖磷酸主链的最后一个磷酸键处的核酸酶抗性键。如本文中所使用,术语“测序引物”指用于起始对核酸进行的测序反应的寡核苷酸引物。术语“测序引物”指正向测序引物和反向测序引物。如本文中所使用,术语“延伸引物”指寡核苷酸,其能够粘接到与目标序列相邻的核酸区域并且通过使用目标序列作为在所属领域中众所周知的合适的条件下的核苷酸延伸的互补模板来充当用于寡核苷酸的延伸的起始引物。通常,测序反应使用至少一个延伸引物或一对延伸引物。配对将包括“上游”或“正向”引物和“下游”或“反向”引物,其待测序的核酸目标序列的区域。如本文中所使用,术语“扩增引物”指寡核苷酸,其能够粘接到与目标序列相邻的rna或dna区域,并且充当用于在所属领域中众所周知的合适的条件下的核酸合成的起始引物。通常,pcr反应使用一对扩增引物,其包括“上游”或“正向”引物和“下游”或“反向”引物,其限定待扩增的rna或dna的区域。如本文中所使用,术语“带尾引物”或“带尾扩增引物”或“带尾测序引物”指在3′端包括能够粘接到与目标序列相邻的rna或dna区域并且充当用于在所属领域中众所周知的合适的条件下的dna合成的起始引物的序列的引物。引物在其5′端包括不与目标序列互补的序列。如本文中所使用,当关于既定引物使用时,术语“延伸”和其派生词包含涉及一个或多个核苷酸在现有核酸分子的末端上的聚合的既定聚合酶的任何体内或体外酶促活性特征。典型地但未必,这类引物延伸以模板依赖性方式进行;在模板依赖性延伸期间,通过既定碱基配对规则进行碱基的排序和选择,所述规则可包括沃森-克里克型碱基配对规则,或(并且尤其在涉及核苷酸类似物的延伸反应的情况下)通过一些其它类型的碱基配对范例进行。在一个非限制性实例中,延伸通过聚合酶经由核酸分子的3′oh端上核苷酸的聚合进行。如本文所使用,术语“核酸序列”可指核酸物质本身,并且不限于以生物化学方式表征特异性核酸(例如dna或rna分子)的序列信息(即在五个基本字母a、c、g、t或u中选择的字母串)。除非另有指示,否则本文中展示的核酸以5′→3′定向呈现。如本文所使用,术语“迁移率依赖性分离”可指由与片段相关的电荷和尺寸引起的核酸片段的分离。如本文所使用,术语“荧光染料”指吸收既定激发波长的光能并且发出不同波长的光能的部分。所选择使用的荧光染料优选是可以光谱方式解析的。如本文中所使用,“可以光谱方式解析”意指染料在操作条件下可基于其光谱特征(具体来说,荧光发射波长)而被区分。举例来说,一个或多个末端核苷酸的一致性可与最大发光强度的不同波长或可能不同波长处的强度比率相关。如本文所使用,术语“核碱基”或“碱基”指能够与互补核碱基或核碱基类似物(例如嘌呤、7-脱氮嘌呤或嘧啶)形成沃森-克里克型氢键的含氮杂环部分。典型核碱基是天然存在的核碱基腺嘌呤、鸟嘌呤、胞嘧啶、5mc、尿嘧啶、胸腺嘧啶以及天然存在的核碱基的类似物,例如7-脱氮腺嘌呤、7-脱氮-8-氮杂腺嘌呤、7-脱氮鸟嘌呤、7-脱氮-8-氮鸟嘌呤、n6-δ2异戊烯基-腺嘌呤(6ia)、n6-δ2-异戊烯基-2-甲基硫腺嘌呤(2ms6ia)、n2-二甲基-鸟嘌呤(dmg)、7-甲基鸟嘌呤(7mg)、肌苷、水粉蕈素、硝基吡咯、硝基吲哚、2-氨基-嘌呤、2,6-二氨基-嘌呤、次黄嘌呤、假尿苷、假胞啶、假异胞苷、5-丙炔基-胞嘧啶核苷、异胞啶、异鸟嘌呤、2-硫代嘧啶、6-硫鸟嘌呤、4-硫胸腺嘧啶、4-硫尿嘧啶、o6-甲基鸟嘌呤、n6-甲基-腺嘌呤、o4-甲基胸腺嘧啶、5,6-二氢胸腺嘧啶、5,6-二氢尿嘧啶、4-甲基吲哚、吡唑并[3,4-d]嘧啶(参见例如美国专利案第6,143,877号和第6,127,121号以及pct公开申请案wo01/38584)和亚乙烯基腺嘌呤。核苷酸碱基的非限制性实例可见于例如fasman,《生物化学和分子生物学实践手册(practicalhandbookofbiochemistryandmolecularbiology)》,第385-394页,crcpress,bocaraton,fla.(1989)中。如本文中使用,术语“核苷酸”和其派生词包含任何可选择性结合于聚合酶或可通过聚合酶聚合的化合物,包括(但不限于)任何天然存在的核苷酸或其类似物。典型地但未必,核苷酸与聚合酶的选择性结合后面是核苷酸通过聚合酶向核酸链中的聚合;然而偶尔,核苷酸可以从聚合酶解离而不变得并入到核酸链中,这是在本文中被称为“非生产性”事件的事件。这类核苷酸不仅包括天然存在的核苷酸,而且包括可以与聚合酶选择性结合或可以通过聚合酶聚合的任何类似物(与其结构无关)。虽然天然存在的核苷酸典型地包含碱基、糖和磷酸酯部分,但本发明的核苷酸可以包括不具有这类部分中的任一个、一些或全部的化合物。在一些实施例中,核苷酸可以任选地包括包含三个、四个、五个、六个、七个、八个、九个、十个或更多个磷原子的磷原子链。在一些实施例中,磷链可以连接到糖环的任何碳,例如5′碳。磷链可以用介入o或s键联到糖。在一个实施例中,链中的一个或多个磷原子可以是具有p和o的磷酸酯基的一部分。在另一实施例中,链中的磷原子可以用介入o、nh、s、亚甲基、经取代亚甲基、亚乙基、经取代亚乙基、cnh2、c(o)、c(ch2)、ch2ch2或c(oh)ch2r(其中r可以是4-吡啶或1-咪唑)键联在一起。在一个实施例中,链中的磷原子可以具备具有o、bh3或s的侧基。在磷链中,具有除o以外的侧基的磷原子可以经磷酸酯基取代。在磷链中,具有除o以外的介入原子的磷原子可以是经取代的磷酸酯基。核苷酸类似物的一些实例描述于xu的美国专利第7,405,281号中。在一些实施例中,核苷酸包含标记并且在本文中称为“经标记的核苷酸”;经标记的核苷酸的标记在本文中称为“核苷酸标记”。在一些实施例中,标记可呈连接到末端磷酸基(即距离糖最远的磷酸基)的荧光染料形式。可以用于所公开的方法和组合物中的核苷酸的一些实例包括(但不限于)核糖核苷酸、脱氧核糖核苷酸、经修饰的核糖核苷酸、经修饰的脱氧核糖核苷酸、核糖核苷酸聚磷酸酯、脱氧核糖核苷酸聚磷酸酯、经修饰的核糖核苷酸聚磷酸酯、经修饰的脱氧核糖核苷酸聚磷酸酯、肽核苷酸、金属核苷酸、膦酸酯核苷和经修饰的磷酸酯-糖主链核苷酸,前述化合物的类似物、衍生物或变异体等。在一些实施例中,核苷酸可以包含非氧部分(如硫基或硼烷部分)代替氧部分,所述氧部分桥接核苷酸的α磷酸酯与糖、或核苷酸的α与β磷酸酯、或核苷酸的β与γ磷酸酯、或核苷酸的任何其它两种磷酸酯之间、或其任何组合。“核苷酸5′-三磷酸”指在5′位置具有三磷酸酯基并且有时表示为“ntp”或“dntp”和“ddntp”以具体指出核糖的结构特征的核苷酸。三磷酸酯基可包括多个氧的硫取代,例如α-硫基-核苷酸5′-三磷酸酯。关于核酸化学的综述,参见:shabarova,z.和bogdanov,a.,《核酸的高级有机化学(advancedorganicchemistryofnucleicacids)》,vch,newyork,1994。如本文中所使用,术语“聚核苷酸”、“核酸”或“寡核苷酸”指通过核苷间键接合的核苷(包括脱氧核糖核苷、核糖核苷或其类似物)的线形聚合物。每当聚核苷酸(如寡核苷酸)由一连串字母,如“atgcctg”表示时,应理解,除非另外指出,否则核苷酸按从左到右的5′→3′顺序并且“a”表示脱氧腺苷,“c”表示脱氧胞苷,“g”表示脱氧鸟苷,并且“t”表示脱氧胸苷。如在所属领域中标准的,字母a、c、g和t可用于指碱基本身、核苷或包含碱基的核苷酸。在天然存在的聚核苷酸中,核苷间键通常是磷酸二酯键,并且子单元称为“核苷酸”。在教示内容的某些实施例中,使用包含其它核苷间键的寡核苷酸引物,如硫代磷酸酯键。应了解,与非磷酸二酯键组成这类寡核苷酸引物的子单元中的一个或多个可不包含磷酸基。这类核苷酸的类似物视为属于如本文中所使用的术语“核苷酸”的范畴内并且包含一个或多个不是磷酸二酯键的核苷间键的核酸仍称为“聚核苷酸”、“寡核苷酸”等。如本文中使用,“聚合酶”和其派生词通常指可催化核苷酸(包括其类似物)聚合成核酸链的任何酶。典型地但未必,这类核苷酸聚合可以模板依赖性方式进行。这类聚合酶可以包括(但不限于)天然存在的聚合酶和其任何子单元和截断、突变聚合酶、变异聚合酶、重组、融合或以其它方式工程改造的聚合酶、经化学修饰的聚合酶、合成分子或组件以及保留催化这类聚合的能力的任何类似物、衍生物或其片段。任选地,聚合酶可以是包含一个或多个突变的突变型聚合酶,所述突变涉及用其它氨基酸替换一个或多个氨基酸,来自聚合酶的一个或多个氨基酸的插入或缺失或两个或更多个聚合酶的部分的连接。典型地,聚合酶包含可以进行核苷酸结合和/或核苷酸聚合催化的一个或多个活性位点。一些例示性聚合酶包括(但不限于)dna聚合酶和rna聚合酶。如本文中所使用,术语“聚合酶”和其变化形式也指包含至少两个彼此连接的部分的融合蛋白,其中第一部分包含可以催化核苷酸聚合成核酸链的肽并且所述第一部分连接到包含第二多肽的第二部分。在一些实施例中,第二多肽可以包括报导子酶或增强持续合成能力的结构域。任选地,聚合酶可具有5′外切核酸酶活性或末端转移酶活性。在一些实施例中,聚合酶可任选地再活化,例如通过使用热、化学物质或将新的量的聚合酶再添加到反应混合物中。在一些实施例中,聚合酶可包括可任选地再活化的热起始聚合酶或基于适体的聚合酶。如本文中所定义,“样品”和其派生词以其最广泛含义使用并且包括任何怀疑包括目标的样本、培养物等。在一些实施例中,样品包含dna、rna、pna、lna、嵌合、杂交或多重形式的核酸。样品可包括任何含有一个或多个核酸的基于生物、临床、手术、农业、大气压或水生的样本。所述术语还包括任何经分离的核酸样品,例如基因组dna、新鲜冷冻或福尔马林(formalin)固定的石蜡包埋的核酸样本。如本文所使用,“序列测定”、“测定核苷酸碱基序列”、“测序”和类似术语包括测定部分以及完全序列信息。也就是说,所述术语包括序列比较、指纹识别和关于目标多核苷酸的类似程度的信息,以及相关区域内目标多核苷酸的每个核苷的表达鉴别和次序。在某些实施例中,“序列测定”包含鉴别单核苷酸,而在其它实施例中,鉴别超过一个核苷酸。核苷、核苷酸和/或碱基的鉴别在本文中视为等效的。应注意,对聚核苷酸进行序列测定通常产生关于完美互补聚核苷酸的序列的等效信息,并且因此与对完美互补聚核苷酸直接进行序列测定等效。如本文中所用,术语“试剂盒”指用于传递物质的任何传递系统。在反应分析的情形下,这类传递系统包括允许从一个位置到另一个位置储存、输送或传递反应试剂(例如适合的容器中的寡核苷酸、酶、引物集等)和/或支持材料(例如缓冲剂、进行分析的书面说明)的系统。举例来说,试剂盒可包括一个或多个含有相关反应试剂和/或支持物质的外壳(例如盒子)。如本文所使用,术语“分部式试剂盒”指两个或更多个单独的容器的传递系统,每个单独的容器含有完整试剂盒组分的子部分。容器可共同或单独地购买和/或传递给既定接收方。举例来说,第一个容器可含有用于分析的酶,而第二个容器含有寡核苷酸。实际上,在术语“分部式试剂盒”中包括任何包含两个或更多个单独的容器的传递系统,所述容器各自含有完整试剂盒组分的子部分。相比之下,“组合试剂盒”指在单个容器中(例如在收纳各种所需组分的单个盒子中)含有反应分析的所有组分的传递系统。术语“试剂盒”包括分部式和组合式试剂盒。如所属领域的一般技术人员将了解,对模板、寡核苷酸、引物等的参考通常意指相关区域而非单一分子内基本上一致的核酸分子的群体或集合。举例来说,“模板”通常意指多个基本上一致的模板分子;“引物”通常意指多个基本上一致的引物分子等。如本文所用,术语“包含”、“包含着”、“包括”、“包括着”“具有”、“具有着”或其任何其它变化意图涵盖非排它性的包涵。举例来说,包括一列特征的过程、方法、物品或装置不一定仅限于那些特征,但可以包括没有明确列出或所述过程、方法、物品或装置所固有的其它特征。另外,除非有明确的相反陈述,否则“或”是指包容性的或,而非排他性的或。举例来说,通过以下中的任一项来满足条件a或b:a是真(或存在)且b是假(或不存在),a是假(或不存在)且b是真(或存在),以及a和b两者都是真(或存在)。用于校验ngs测序结果的方法。引入既定的ionampliseqtm图以及其它用于检测和表征在肿瘤组织中发生的可行突变的使用下一代测序(nextgenerationsequencing;ngs)技术的市售分析具有引起翻译肿瘤学研究革命的潜力。这种技术进一步描述于2011年4月28日提交的美国申请案第61/479,952号;2011年9月6日提交的第61/531,583号;2011年9月6日提交的第61/531,574号;2011年9月22日提交的第61/538,079号;2011年11月29日提交的第61/564,763号;2011年12月20日提交的第61/578,192号;2012年2月2日提交的第61/594,160号;2012年2月14日提交的第61/598,881号;2012年2月14日提交的第61/598,892号;2012年4月17日提交的第61/625,596号;2012年4月26日提交的第61/639,017号;2012年4月27日提交的第13/458,739号;2012年10月29日提交的第13/663,334号;2012年11月16日提交的第13/679,706号;以及名称为《目标核酸的检测、鉴别、验证和富集(detection,identification,validation,andenrichmentoftargetnucleicacids)》,代理人案号lt00974pro,同一日期提交中;并且每个公开案以全文引用的方式并入本文中。通过iontorrent获得的ionampliseqtm癌症热点图版本2(chpv2)包括50个基因中的207个可行突变目标,并且通过lifetechnologiescompendiabiosciencetm研究的更全面的iononcominetm癌症图(ocp)含有超过2000个突变。这些iontorrentampliseq癌症图的标志是需要少量的输入dna,其在临床样本材料受到限制(如细针穿刺活检、抽出物、lcm或ffpe样品)时是重要的。通常,10ng从这些来源获得的dna足以产生信息性测序资料。通常,与主要正常等位基因相比,在相对低等位基因频率(例如10至20%)下检测到致癌性或促癌性突变。需要新的方法来验证这些通过直系同源方法(如传统的用毛细电泳(ce)(如appliedbiosystems3500基因分析器)进行的染料-荧光桑格测序)获得的低频率突变的发现结果。本文中描述实现直接来自ampliseqtm文库起始物质的个别ionampliseq目标的扩增和桑格测序的工作流。这一工作流也可以与由大规模平行测序的其它下一代测序(ngs)方法产生的文库起始物质一起使用。所述方法需要1μl(约5%)原始ampliseqtm预扩增材料的保持器。使用这一等分试样的稀释物作为用于个别化pcr/测序反应的模板源。可从最初由10ngffpedna制备的iontorrentampliseqtm文库成功地扩增和桑格测序来自chpv2图的48个目标的随机选择。此外,所有个别24个目标的成功桑格再测序涵盖来自用oncomineampliseq图处理和预先扩增的相同样品的tp53外显子。综合而言,这一方法允许使用桑格ce测序进行来自材料局限性极高的样本的相关潜在突变的反映测试。其提供用于检验和跟踪通过桑格测序获得的ngs结果的反映溶液,尤其对于具有极有限量的可供使用的dna的样品,如从细针穿利活检、抽出物、福马林固定的链烷烃嵌入嵌入ffpe)和激光捕捉显微切割(lcm)中的任一种获得的样品。此外,这一工作流与典型的桑格测序方案相比提供其它优点,去除额外的操控和纯化。这一流水线在操作数量有限的样品时也是有利的。举例来说,典型的pcr反应使用过量的扩增引物,一些引物在pcr反应完成时仍未并入。这必须在进行测序反应之前移除过量引物,因为过量的扩增引物将干扰后续测序反应,并且可能产生异常序列梯。pcr反应进一步含有可干扰后续测序反应的过量的dntp。在当前工作流中,在开始循环测序反应之前向测序反应混合物中添加核酸酶,所述核酸酶可以是(但不限于)外切核酸酶i,利用其水解特性使pcr混合物中的单股dna降解,因此使扩增产物(扩增子)更高效地用于后续测序反应中。在过去,难以在电泳期间不牺牲输送量滞留时间的情况下获得测序引物附近的核酸序列的解析。迁移率系统的类型的调节,调节变性条件和温度可改良解析,但始终以增加电泳时间为代价。在进行尺寸依赖性移动性分离时,移除未并入的反应物的困难和长滞留时间促进核酸测序的低效率。存在可解决这些问题的经改良的direct扩增/测序工作流的若干优点。仅需要一次合成后净化;其可在同一个反应容器中极容易地进行。此外,化学增强型测序引物的性质产生可在不存在污染和使来自过量试剂的信号复杂化的情况下更易于检测的延伸产物,而不减缓电泳实验。申请人意外发现ampliseqtm引物设计可运用于桑格ce测序中。使用bigdyedirect测序的高级化学方法,其使如本文中和交叉参考申请案中所描述的工作流流水线化,实现更简单、耗时更短的测序分析,其也具有极高的5′解析。使用目标特异性核酸酶敏感性扩增引物的m13标签允许使用m13化学增强型测序引物,其在开始序列片段制备之前现场经受过量pcr扩增引物的核酸酶降解。此外,m13化学增强型测序引物的其它修饰允许在相关序列的碱基编号1处开始碱基判读。化学增强型测序引物的使用和桑格测序工作流的组合步骤的各种方面进一步描述于2008年2月4日提交的美国申请案第6i/026,085号;2009年2月3日提交的第12/365,140号;2010年10月28日提交的第61/407,899号;2010年10月29日提交的第61/408,553号;2011年10月28日提交的第13/284,839号;以及2012年2月15日提交的第13/397,626号中,其中每个公开案以全文引用的方式并入本文中。申请人还意外发现1ng基因组dna足以用于来自单个目标的序列的正向/反向对。此外,可稀释来自低复杂度ampliseqtm图(即chpv2和ocp)的预扩增(pa)材料并且用作re-pcr和桑格测序的模板源。尚未尝试将高复杂度ampliseqtm图(ccp和完全外显子组)用于re-pcr和测序,但可实现获取。提供用于测序至少一个扩增子的方法,其包括以下步骤:提供至少一个扩增子,其中所述至少一个扩增子包含相关序列和从第一激活序列并入的相对于相关序列位于5′的前导序列;使所述至少一个扩增子在第一反应混合物中扩增,所述第一反应混合物包括多种核酸酶敏感性扩增引物以形成经扩增的dna产物;使含有经扩增的dna产物的第一反应混合物与包含核酸酶和至少一种化学增强型引物的第二反应混合物接触,所述至少一种化学增强型引物引起多种核酸酶敏感性扩增引物由核酸酶降解;使核酸酶失活;在测序反应中用至少一种化学增强型引物激活经扩增的dna产物;以及制备至少一种化学增强型引物的延伸产物。在一些实施例中,延伸产物可以经荧光标记。在各种实施例中,可使用第一激活序列产生扩增子。在各种实施例中,第一激活序列可包括至少一个可裂解部分。在一些实施例中,前导序列可以是第一激活序列的一部分。在所述方法的各种实施例中,可在相同反应器中进行使第一反应混合物与第二反应混合物接触、使核酸酶失活以及制备化学增强型引物的延伸产物的步骤。在各种实施例中,可在不存在中间纯化步骤的情况下进行使至少一个扩增子扩增、使第一反应混合物与第二反应混合物接触、使核酸酶失活以及制备化学增强型引物的延伸产物的步骤。在所述方法的各种实施例中,所述至少一个扩增子进一步包括相对于相关序列位于3′的接续序列,其中接续序列与用于产生至少一个扩增子的第二激活序列互补。至少一个扩增子可具有约100个核苷酸到约400个核苷酸的长度。至少一个扩增子的相关序列可具有约100个核苷酸到约300个核苷酸的长度。在其它实施例中,至少一个扩增子的相关序列可具有约125个核苷酸到约275或约250个核苷酸的长度。所述至少一个扩增子可以是多个扩增子。在一些实施例中,多个扩增子可包括至少两个不同扩增子,第一个具有作为主要变异序列的相关序列,并且第二个扩增子具有来自样品核酸的相同区域的次要变异序列。在一些实施例中,所述方法进一步包括以下步骤:基于测序反应获得测序结果;以及基于所述结果测定至少相关序列的核苷酸碱基序列。测序结果可通过基于迁移率的分离方法获得。在一些实施例中,基于迁移率的分离方法可以是毛细电泳法。在一些实施例中,可比较所测定的至少序列相关的核苷酸碱基序列与从ngs测序方法获得的至少相关序列的第二核苷酸碱基序列。ngs测序方法可包括大规模平行测序技术,例如使用荧光团或半导体检测的合成测序和焦磷酸测序。在一些实施例中,ngs测序方法可以是半导体测序。在各种实施例中,扩增dna可包括聚合酶链反应扩增。在所选择的实施例中,测序反应可包括循环测序。在各种实施例中,第一反应混合物还可以包括聚合酶。聚合酶可以是热稳定聚合酶。在一些实施例中,聚合酶可以是taq聚合酶。第一反应混合物可进一步包括脱氧核苷酸三磷酸酯。在各种实施例中,第二反应混合物进一步包含聚合酶、脱氧核苷酸三磷酸酯和经染料标记的双脱氧核苷酸三磷酸酯。第二反应混合物的聚合酶可以是热稳定聚合酶。在一些实施例中,聚合酶是taq聚合酶。在用于测序至少一个扩增子的方法的各种实施例中,核酸酶可选自外切核酸酶i、exoiii、pfu和dnapoli。在用于测序至少一个扩增子的方法的各种实施例中,多个核酸酶敏感性扩增引物中的每一个可经配置以激活特定疾病病况的相关序列。在一些实施例中,多个核酸酶敏感性扩增引物可激活与特定疾病病况有关的一组序列。描述用于确定dna序列的另一种方法,其包括以下步骤:使用至少第一激活序列使包含核酸的样品扩增以提供多个扩增子,其中多个扩增子中的每一个包括相关序列和相对于从第一激活序列并入的相关序列位于5′的前导序列;使在包括多个核酸酶敏感性扩增引物的第一反应混合物中使所述多个扩增子的第一等分试样扩增,以形成经扩增的dna产物;使含有经扩增的dna产物的第一反应混合物与包括核酸酶和至少一种化学增强型引物的第二反应混合物接触,其中通过使核酸酶与第一反应混合物接触,核酸酶敏感性扩增引物由核酸酶降解;使核酸酶失活;在测序反应中用至少一种化学增强型引物激活经扩增的dna产物;以及制备化学增强型引物的延伸产物。在一些实施例中,延伸产物可以经荧光标记。在各种实施例中,可使用第一激活序列产生扩增子。第一激活序列可包括至少一个可裂解部分。在一些实施例中,前导序列可以是第一激活序列的一部分。在所述方法的各种实施例中,可在相同反应器中进行使第一反应混合物与第二反应混合物接触、使核酸酶失活以及制备化学增强型引物的延伸产物的步骤。在各种实施例中,可在不存在中间纯化步骤的情况下进行使多个扩增子扩增、使第一反应混合物与第二反应混合物接触、使核酸酶失活以及制备化学增强型引物的延伸产物的步骤。在所述方法的各种实施例中,多个扩增子中的每一个进一步包括相对于相关序列位于3′的接续序列,其中接续序列与用于产生扩增子的第二激活序列互补。多个扩增子中的每一个可具有约100个核苷酸到约400个核苷酸的长度。多个扩增子中的每一个的相关序列可具有约100个核苷酸到约300个核苷酸的长度。在其它实施例中,多个扩增子中的每一个的相关序列可具有约125个核苷酸到约275或约250个核苷酸的长度。在一些实施例中,多个扩增子可包括至少两个不同扩增子,第一个具有作为主要变异序列的相关序列,并且第二个扩增子具有来自样品核酸的相同区域的次要变异序列。在一些实施例中,所述方法进一步包括以下步骤:基于测序反应获得测序结果;以及基于所述结果测定至少相关序列的核苷酸碱基序列。测序结果可通过基于迁移率的分离方法获得。在一些实施例中,基于迁移率的分离方法可以是毛细电泳法。在一些实施例中,可比较至少相关序列的所测定的核苷酸碱基序列与从对多个扩增子的第二等分试样进行ngs测序方法获得的至少相关序列的第二核苷酸碱基序列。ngs测序方法可包括大规模平行测序技术,例如使用荧光团或半导体检测的合成测序和焦磷酸测序。在一些实施例中,ngs测序方法可以是半导体测序。在各种实施例中,扩增dna可包括聚合酶链反应扩增。在所选择的实施例中,测序反应可包括循环测序。在各种实施例中,第一反应混合物还可以包括聚合酶。聚合酶可以是热稳定聚合酶。在一些实施例中,聚合酶可以是taq聚合酶。第一反应混合物可进一步包括脱氧核苷酸三磷酸酯。在各种实施例中,第二反应混合物进一步包含聚合酶、脱氧核苷酸三磷酸酯和经染料标记的双脱氧核苷酸三磷酸酯。第二反应混合物的聚合酶可以是热稳定聚合酶。在一些实施例中,聚合酶是taq聚合酶。在用于确定dna序列的方法的各种实施例中,核酸酶可选自外切核酸酶i、exoiii、pfu和dnapoli。在用于确定dna序列的方法的各种实施例中,多个核酸酶敏感性扩增引物中的每一个可经配置以激活特定疾病病况的相关序列。在一些实施例中,多个核酸酶敏感性扩增引物可激活与特定疾病病况有关的一组序列。提供用于准备dna测序的另一种方法,其包括以下步骤:使用至少第一激活序列扩增包含核酸的样品以提供多个扩增子,其中多个扩增子中的每一个包括相关序列和从第一激活序列并入的相对于相关序列位于5′的前导序列;在第一反应混合物中使多个扩增子的等分试样扩增以形成经扩增的dna产物,所述第一反应混合物包括核酸酶敏感性扩增引物;使含有经扩增的dna产物的第一反应混合物与包含核酸酶和化学增强型引物的第二反应混合物接触,其中通过使核酸酶与第一反应混合物接触,核酸酶敏感性扩增引物由核酸酶降解;使核酸酶失活;在测序反应中用化学增强型引物激活经扩增的dna产物;以及制备化学增强型引物的延伸产物。描述用于测序和检验相关变异型核酸序列的另一种方法,其包括以下步骤:使用至少第一激活序列使包括核酸的样品扩增以提供多个扩增子,其中多个扩增子中的每一个包括相关序列和相对于从第一激活序列并入的相关序列位于5′的前导序列;将多个扩增子拆分成第一等分试样和第二等分试样;在包括核酸酶敏感性扩增引物的第一反应混合物中使多个扩增子的第一等分试样扩增以形成第一经扩增的dna产物;使含有第一经扩增的dna产物的第一反应混合物与包括核酸酶和化学增强型引物的第二反应混合物接触,其中通过使核酸酶与第一反应混合物接触,核酸酶敏感性扩增引物由核酸酶降解;使核酸酶失活;在测序反应中用化学增强型引物激活第一经扩增的dna产物;制备化学增强型引物的延伸产物;使用迁移率依赖性分离获得经延伸的化学增强型引物的至少相关序列的测序结果;以及测定经延伸的化学增强型引物的至少相关序列的核苷酸碱基序列;使扩增子的第二等分试样扩增以形成第二dna产物;使用ngs测序方法获得第二dna产物的至少相关序列的测序结果;以及通过比较其与经延伸的化学增强型引物的至少相关序列的核苷酸碱基序列来检验第二dna产物的核苷酸序列。在所述方法的各种实施例中,使多个扩增子的第二等分试样扩增以形成第二dna产物的步骤进一步包含接合接附子、结合于珠粒和接合条形码中的至少一个。对于上文所描述的方法中的任一种并且遍及本发明,核酸还可以使用其它方法扩增,如多股置换扩增、解螺旋酶移位扩增、接口平移、qβ复制酶扩增、滚环扩增和其它等温扩增方法。待扩增的核酸可包含例如rna、dna、cdna、基因组dna、病毒dna、质体dna、重组dna、扩增子dna、合成dna等。对于上文所描述的方法中的任一种并且遍及本发明,待测序的模板可在乳液的个别水性隔室(也称为“反应器”)中通过pcr合成。在一些实施例中,隔室可各自含有粒状负载物,如珠粒(其具有与其附接的适合的第一扩增引物)、模板的第一复本、第二扩增引物以及pcr反应所需的组分(例如核苷酸、聚合酶、辅因子等)。用于制备乳液的方法描述于例如美国专利案第6,489,103b1号、美国专利案第5,830,663号和美国专利申请公开案第us2004/0253731号中。用于在乳液的个别隔室内进行pcr以产生连接到微米粒子的模板的群体的方法描述于例如dressman,d.等人,《美国国家科学院院刊(proc.natl.acad.sci.)》,100(15):8817-8822,2003和pct公开案wo2005010145中。本文中所描述的所有专利案、申请案、公开案和文献以全文引用的方式并入本文中。根据各种实施例,扩增引物可包含带尾引物。带尾引物可用于例如产生目标特异性扩增子,其合并有能够粘接到通用引物或基因特异性引物的核酸序列。对于上文所描述的方法中的任一种并且遍及本发明,与双股聚核苷酸相比,适用于标的方法的核酸酶优先降解单股聚核苷酸,因此破坏过量的引物同时留下可用于后续步骤中的测序的完整的双股扩增子。在各种实施例中,核酸酶可包含例如外切核酸酶i。外切核酸酶i可从许多商业供应商获得,例如usbcorp.,cleveland,ohio。适合的反应条件可包括例如最佳时间、温度和缓冲液参数以实现核酸酶活性。在一些实施例中,举例来说,可通过向扩增反应产物中添加外切核酸酶i并且在约37℃下培育约10到约30分钟来降解过量的扩增引物。外切核酸酶i可按3′→5′方向水解单股dna。外切核酸酶i可对热失活敏感并且可通过加热来基本上100%失活,例如在约80℃下加热约15分钟。可用于标的方法和组合物中的其它热失活核酸酶包括(但不限于)exoiii、pfu或dnapoli。在各种实施例中,核酸酶的失活可在囊泡内和与测序反应相同的反应步骤中进行。在过量扩增引物可由核酸酶降解的反应条件下,化学增强型测序引物可基本上不由包含核酸酶(例如外切核酸酶i)的反应混合物降解。“基本上不降解”意指化学增强型测序引物进行的任何降解都不是可显著干扰后续测序反应或片段分析反应中用于产生测序和/或片段分析资料的过程的程度。在一些实施例中,化学增强型测序引物可包含更多个核酸酶抗性核苷酸间键中的一个。举例来说,核苷酸间键可以是硫代磷酸酯键。在一些实施例中,化学增强型测序引物可在末端3′端、末端5′端和/或一个或多个内部键位点处包含核酸酶抗性核苷酸间键。在一些实施例中,核酸酶抗性核苷酸间键是至少一个硫代磷酸酯键。合成在末端3′端上具有一个或两个硫代磷酸酯键的化学增强型测序引物以保护化学增强型测序引物避免外切核酸酶i消化。sp立体异构体可保护引物避免外切核酸酶i消化,但发现rp立体异构体不提供保护避免外切核酸酶i消化(资料未图示)。对于上文所描述的方法中的任一种并且遍及本发明,迁移率依赖性分离选自由电荷进行的分离和由尺寸进行的分离,其中由尺寸加电荷进行的分离选自凝胶电泳和毛细电泳并且由尺寸进行的分离是通过液体梯度和变性梯度培养基进行。测序反应产物可在筛分或非筛分培养基上分析。在这些教示内容的一些实施例中,举例来说,pcr产物可以通过电泳来分析;例如毛细电泳,如以下文献中所描述:h.wenz等人,(1998),《基因组研究(genomeres.)》8:69-80(还参见e.buel等人,(1998),《法医科学杂志(j.forensicsci.)》43:(1),第164-170页)),或平板凝胶电泳,如以下文献中所描述:m.christensen等人,(1999),《临床实验研究(scand.j.clin.lab.invest.)》59(3):167-177,或变性聚丙烯酰胺凝胶电泳(参见例如j.sambrook等人,(1989),《分子克隆:实验室手册(molecularcloning:alaboratorymanual)》,第二版,coldspringharborlaboratorypress,coldspringharbor,n.y.,第13.45-13.57页)。电泳中dna片段的分离主要基于不同的片段尺寸。测序反应产物也可以通过色谱分析;例如通过尺寸排阻色谱(sec)。类似地,可以类似方式进行片段分析,如所属领域的技术人员已知。对于上文所描述的方法中的任一种并且遍及本发明,ddntp中的每一个可用不同的荧光染料(ddntp-染料)标记。举例来说,ddntp可包含ddntp,可从appliedbiosystems,fostercity,california购得。在一些实施例中,化学增强型引物可用荧光染料标记。标记可连接到寡核苷酸序列和/或化学增强型引物的ncm区域。对于上文所描述的方法中的任一种并且遍及本发明,化学增强型引物可包括寡核苷酸序列、ncm并且不存在或至少一个核酸酶抗性键。在一些实施例中,化学增强型引物可包括位于末端3′端的一个核酸酶抗性键。化学增强型引物可包括位于末端5′端或化学增强型引物的寡核苷酸序列内的多个ncm。在一些实施例中,多个ncm可位于末端5′端。在各种实施例中,ncm可以是(cn)间隔基,其中n是1到9的任何整数。ncm可包括多个(cn)间隔基。在各种实施例中,化学增强型引物可具有下式的结构:(cn)x-oligo,其中(cn)x具有下式的结构:其中n的每个实例可独立地是1到9的整数;并且x可以是1到约30的整数;oligo具有下式的结构:其中b是核碱基;k是s或o;m是0或1;z是3到约100的整数;w是oh、f、ome或h;并且nt是具有下式的部分:在一些实施例中,化学增强型引物可具有如本发明中所描述的任何结构。可在本发明教示的范围内使用其它类型的化学增强型引物。举例来说,核酸酶抗性测序引物可包含烷基膦酸酯单体,ro-p(=o)(-me)(-or),如da-me-氨基膦酸酯和/或三酯单体,ro-p(=o)(-or′)(-or),如da-me-氨基磷酸酯(可从glenresearch,sterling,va购得),和/或锁核酸单体(可从exiqon,woburn,ma购得),和/或硼烷磷酸酯单体,ro-p(-bh3)(=o)(-or),如由以下文献描述:shaw,barbararamsey等人,《含硼adp和gdp类似物的合成:核苷5′-(p-硼烷二磷酸酯)(synthesisofboron-containingadpandgdpanalogues:nucleoside5′-(p-boranodisphosphates))》,《核苷和核酸化学中的观点(perspectivesinnucleosideandnucleicacidchemistry)》,第125-130,(2000)页等,在另一方法中,一种或多种化学增强型引物可用于接合延伸反应。在一些实施例中,用于接合延伸反应的化学增强型引物经荧光标记。在一些实施例中,接合延伸化学增强型引物在3′端经荧光标记。适用于方法中的聚合酶。本文所描述的方法中可使用多种核酸聚合酶。举例来说,核酸聚合酶可以是热稳定聚合酶或热可降解聚合酶。适合的热稳定聚合酶包括(但不限于)从水生栖热菌(thermusaquaticus)、嗜热栖热菌(thermusthermophilus)、沃氏火球菌(pyrococcuswoesei)、激烈火球菌(pyrococcusfuriosus)、海滨嗜热球菌(thermococcuslitoralis)和海栖热袍菌(thermotogamaritima)分离的聚合酶。适合的热可降解聚合酶包括(但不限于)大肠杆菌dna聚合酶i、大肠杆菌dna聚合酶i的克列诺片段(klenowfragment)、t4dna聚合酶、t5dna聚合酶、t7dna聚合酶等。可用于本文所描述的方法中的其它聚合酶的实例包括t7、t3、sp6rna聚合酶以及amv、m-mlv和hiv逆转录酶。可用于本文所描述的方法中的市售聚合酶的非限制性实例包括(但不限于)cs(appliedbiosystems)、amplitaqfs(appliedbiosystems)、amplitaqgold(appliedbiosystems)、kentaq1(abpeptide,st.louis,missouri)、taquenase(scientechcorp.,st.louis,missouri)、thermosequenase(amersham)、bst聚合酶、ventr(胞外-)dna聚合酶、readertmtaqdna聚合酶、venttmdna聚合酶(newenglandbiolabs)、deepventtmdna聚合酶(newenglandbiolabs)、pfuturbotmdna聚合酶(stratagene)、tthdna聚合酶、klentaq-1聚合酶、sequenasetm1.0dna聚合酶(amershambiosciences)和sequenase2.0dna聚合酶(unitedstatesbiochemicals)。方法的用途。任选地,所述方法进一步包括检测和/或鉴别经由经扩增的目标序列的核酸测序鉴别的样品中的突变。在一些实施例中,针对与癌症相关的突变引导目标序列或经扩增的目标序列。在一些实施例中,针对与选自由以下组成的群组的一种或多种癌症相关的突变引导目标序列或经扩增的目标序列:头颈癌、脑癌、乳癌、卵巢癌、子宫颈癌、结肠直肠癌、子宫内膜癌、胆囊癌、胃癌、膀胱癌、前列腺癌、睾丸癌、肝癌、肺癌、肾脏(肾细胞)癌、食道癌、胰脏癌、甲状腺癌、胆管癌、垂体肿瘤、威尔姆斯肿瘤(wilmstumor)、卡堡氏肉瘤(kaposisarcoma)、骨肉瘤、胸腺癌、皮肤癌、心脏癌、口腔和咽喉癌症、白血病、神经母细胞瘤和非霍奇金式淋巴瘤(non-hodgkinlymphoma)。在一个实施例中,突变可包括取代、插入、反转、点突变、缺失、错配和易位。在一个实施例中,突变可包括复本数的变化。在一个实施例中,突变可包括生殖系或体细胞突变。在一个实施例中,与癌症相关的突变位于美国专利公开案20120295819的表1或4中所提供或美国申请案第61/598,881号的表7中所提供的基因中的至少一种中,各自以全文引用的方式并入本文中。在一些实施例中,突变可以是美国专利公开案20120295819的表5中所提供或美国申请案61/598,881的表7中所提供的基因组座标中的任一个,各自以全文引用的方式并入本文中。在一些实施例中,针对与癌症相关的突变的目标序列可包括美国专利公开案20120295819的表10中提供的突变中的任一个或多个,其以全文引用的方式并入本文中。在一些实施例中,可在美国专利公开案20120295819的表16或表18中提供的基因组座标中的任一个或多个内发现突变,其以全文引用的方式并入本文中。在一些实施例中,与癌症相关的突变位于选自以下的基因中的至少一个中:abi1;abl1;abl2;acsl3;acsl6;aff1;aff3;aff4;akap9;akt1;akt2;alk;apc;arhgap26;arhgef12;arid1a;arnt;aspscr1;asxl1;atf1;atic;atm;axin2;bap1;bard1;bcar3;bcl10;bcl11a;bcl11b;bcl2;bcl3;bcl6;bcl7a;bcl9;bcr;birc3;blm;bmpr1a;braf;brca1;brca2;brd3;brd4;brip1;bub1b;card11;cars;casc5;cbfa2t3;cbfb;cbl;cblb;cblc;ccdc6;ccnb1ip1;ccnd1;ccnd2;cd74;cd79a;cdc73;cdh1;cdh11;cdk4;cdk6;cdkn2a;cdkn2b;cdkn2c;cdx2;cebpa;cep110;chek1;chek2;chic2;chn1;cic;ciita;clp1;cltc;cltcl1;col1a1;creb1;creb3l2;crebbp;crtc1;crtc3;csf1r;ctnnb1;cxcr7;cyld;cytsb;dclk3;ddb2;ddit3;ddr2;ddx10;ddx5;ddx6;dek;dgkg;dicer1;dnmt3a;egfr;eif4a2;elf4;ell;eln;eml4;ep300;eps15;erbb2;erbb4;erc1;ercc2;ercc3;ercc4;ercc5;erg;etv1;etv4;etv5;etv6;ewsr1;ext1;ext2;ezh2;fam123b;fanca;fancc;fancd2;fance;fancf;fancg;fas;fbxw7;fcrl4;fgfr1;fgfr1op;fgfr2;fgfr3;fh;fip1l1;flcn;fli1;flt1;flt3;fnbp1;foxl2;foxo1;foxo3;foxo4;foxp1;fus;gas7;gata1;gata2;gata3;gmps;gnaq;gnas;golga5;gopc;gpc3;gphngpr124;hip1;hist1h4i;hlf;hnf1a;hnrnpa2b1;hook3;hoxa11;hoxa13;hoxa9;hoxc11;hoxc13;hoxd13;hras;hsp90aa1;hsp90ab1;idh1;idh2;ikzf1;il2;il21r;il6st;irf4;itga10;itga9;itk;jak1;jak2;jak3;kdm5a;kdm5c;kdm6a;kdr;kdsr;kiaa1549;kit;klf6;klk2;kras;ktn1;laspl;lck;lcp1;lhfp;lifr;lmo2;lpp;maf;malt1;maml2;map2k1;map2k4;mdm2;mdm4;mecom;men1;met;mitf;mkl1;mlh1;mll;mllt1;mllt10;mllt3;mllt4;mllt6;mn1;mpl;mre11a;msh2;msh6;msi2;msn;mtcp1;mtor;muc1;myb;myc;mycl1;mycn;myh11;myh9;myst3;myst4;naca;nbn;ncoa1;ncoa2;ncoa4;nek9;nf1;nf2;nfe2l2;nfkb2;nin;nkx2-1;nlrp1;nono;notch1;notch2;npm1;nr4a3;nras;nsd1;ntrk1;ntrk3;numa1;nup214;nup98;olig2;omd;pafah1b2;palb2;patz1;pax3;pax5;pax7;pax8;pbrm1;pbx1;pcm1;pde4dip;pdgfb;pdgfra;pdgfrb;per1;phox2b;picalm;pik3ca;pik3r1;pim1;plag1;pml;pms1;pms2;pou2af1;pou5f1;pparg;ppp2r1a;prcc;prdm16;prf1;prkar1a;prrxl;psipl;ptch1;pten;ptpn11;rabep1;rad50;rad51l1;raf1;ranbp17;rap1gds1;rara;rb1;rbm15;recql4;rel;ret;rhoh;rnf213;ros1;rpn1;rps6ka2;runx1;runx1t1;sbds;sdhaf2;sdhb;setd2;sfpq;sfrs3;sh3gl1;slc45a3;smad4;smarca4;smarcb1;smo;socs1;src;srgap3;ss18;ss18l1;stil;stk11;stk36;sufu;syk;taf15;taf1l;tal1;tal2;tcf12;tcf3;tcl1a;tet1;tet2;tex14;tfe3;tfeb;tfg;tfrc;thrap3;tlx1;tlx3;tmprss2;tnfaip3;top1;tp53;tpm3;tpm4;tpr;trim27;trim33;trip11;tsc1;tsc2;tshr;usp6;vhl;was;whscll1;wrn;wt1;xpa;xpc;zbtb16;zmym2;znf331;znf384;和znf521。在一些实施例中,与癌症相关的突变位于选自以下的基因中的至少一个中:abl1;akt1;alk;apc;atm;braf;cdh1;cdkn2a;csf1r;ctnnb1;egfr;erbb2;erbb4;fbxw7;fgfr1;fgfr2;fgfr3;flt3;gnas;hnf1a;hras;idh1;jak2;jak3;kdr;kit;kras;met;mlh1;mpl;notch1;npm1;nras;pdgfra;pik3ca;pten;ptpn11;rb1;ret;smad4;smarcb1;smo;src;stk11;tp53;和vhl。在一些实施例中,经扩增的目标序列针对美国专利公开案20120295819的表5、7或18中提供的基因组座标中的任一个或多个,所述文献以全文引用的方式并入本文中。在一些实施例中,美国专利公开案20120295819的表2、3、6或17中提供的癌症目标特异性引物中的任一种或多种(所述文献以全文引用的方式并入本文中)可用于扩增样品中的目标序列,如本文所描述的方法所披露。在一些实施例中,来自美国专利公开案20120295819的表2、3、6或17的癌症目标特异性引物(其以全文引用的方式并入本文中)可包括2、3、4、5、6、7、8、9、10、20、40、60、80、100、150、200、400、500、800、1000、2000、3000、4000、5000、6000、7000、8000、9000、10,000、11,000、12,000、13,000或更多个目标特异性引物。在一些实施例中,经扩增的目标序列可包括在美国专利公开案20120295819的表5、7、10或18中提供的基因组座标(使用扩增子id目标特异性引物)处产生的经扩增的目标序列中的任一个或多个,所述文献以全文引用的方式并入本文中。在一些实施例中,与癌症相关的目标特异性引物中的至少一个与至少一个选自美国专利公开案20120295819的seqidno:1-103、143的核酸序列至少90%一致,所述文献以全文引用的方式并入本文中。在一些实施例中,与癌症相关的目标特异性引物中的至少一个跨越其全部长度与样品中的至少一个目标序列互补。在一些实施例中,与癌症相关的目标特异性引物中的至少一个包括3′端处的非可裂解核苷酸。在一些实施例中,3′端处的非可裂解核苷酸包括末端3′核苷酸。在一个实施例中,经扩增的目标序列针对具有与癌症相关的突变的个别外显子。在一些实施例中,本发明大体上涉及样品中超过一个目标序列的选择性扩增和与癌症相关的突变的检测和/或鉴别。在一些实施例中,经扩增的目标序列包括两个或更多个美国专利公开案20120295819的表2中提供的核苷酸序列,其以全文引用的方式并入本文中。在一些实施例中,经扩增的目标序列可包括使用美国专利公开案20120295819的表5中所提供或美国申请案61/598,881的表7中所提供的扩增子id目标特异性引物在基因组座标处产生的任一个或多个经扩增的目标序列,所述文献中的每一个以全文引用的方式并入本文中。在一个实施例中,经扩增的目标序列包括100、200、500、1000、2000、3000、6000、8000、10,000、12,000个或更多个来自美国专利公开案20120295819的表1-5或美国申请案61/598,881的表6和7的扩增子,所述文献以全文引用的方式并入本文中。在一些实施例中,本发明大体上涉及临床上可行突变的检测和任选的鉴别。如本文中所定义,术语“临床上可行突变”包括已知的或可由所属领域的一般技术人员与(但不限于)癌症治疗的预后相关联的突变。在一个实施例中,癌症治疗的预后包括与癌症对药物、药物组合或治疗方案起反应或不起反应相关的突变的鉴别。在一个实施例中,本发明大体上涉及多个目标序列从与癌症的发作、进展或缓解有关或相关的核酸分子群体的扩增。在一些实施例中,使用本文所披露的引物准则设计目标特异性引物。在一些实施例中,目标特异性引物是使用本文所披露的引物准则设计并且针对与乳癌相关的一种或多种基因。在一些实施例中,与乳癌相关的目标特异性引物包括选自一种或多种基因的至少一种目标特异性引物,所述一种或多种基因选自由以下组成的群组:aim1、ar、atm、bard1、bcas1、brip1、ccnd1、ccnd2、ccne1、cdh1、cdk3,cdk4,cdkn2a、cdkn2b、camk1d、chek2、diras3、egfr、erbb2、epha3、erbb4、etv6、gnrh1、kctd9、cdca2、ebf2、emsy、bnip3l、pnma2、dpysl2、adra1a、stmn4、trim35、pak1、aqp11、clsn1a、rsf1、kctd14、thrsp、ndufc2、alg8、kctd21、usp35、gab2、dnah9、znf18、myocd、stk11、tp53、jak1、jak2、met、pdgfra、pml、pten、ret、tmprss2、wnk1、fgfr1、igf1r、ppp1r12b、ptprt、gstm1、ipo8、myc、znf703、mdm1、mdm2、mdm4,mkk4、p14kb、ncor1、nbn、palb2、rad50、rad51、pak1,rsf1、ints4、zmiz1、sephs1、foxm1、sdccag1、igf1r、tshz2、rpsk6k1、ppp2r2a、mtap、map2k4、aurkb、bcl2、bub1、cdca3、cdca4、cdc20、cdc45、chek1、foxm1、hdac2、igf1r、kif2c、kifc1、kras、rb1、smad4、ncor1、utx、mthdfd1l、rad51ap1、ttk和ube2c。在一些实施例中,本发明大体上涉及针对与先天性或遗传性疾病相关的突变的目标序列的扩增。在一些实施例中,本发明可包括体细胞或胚系突变的目标序列的扩增。在一些实施例中,突变可以是常染色体显性或常染色体隐性。在一个实施例中,与先天性或遗传性疾病相关的突变位于美国专利公开案20120295819的表4中提供的基因或疾病中的至少一种中,所述文献以全文引用的方式并入本文中。在一些实施例中,本发明涉及与选自由以下组成的群组的一种或多种遗传性疾病相关的样品中目标序列的扩增:腺苷氨基水解酶不足(ada);无γ球蛋白血症,x连锁,1型;阿氏综合症(alagillesyndrome);所有肥大和扩张型心肌症;普秃症(alunc);亚尔培氏综合症(alperssyndrome);α-1-抗胰蛋白酶不足;α-东南亚地中海贫血(alpha-thalassemia-southeastasia);肌肉萎缩性侧索硬化-葛雷克氏症(amyotrophiclateralsclerosis-lougehrig′sdisease);男性荷尔蒙不敏感综合症;无虹膜;强直性脊柱炎;apc相关息肉病状;精氨基琥珀酸裂解酶不足;右心室发育不良/心肌病;伴有2型动眼运用不能的共济失调;伴有维生素e不足的共济失调;共济失调-毛细血管扩张症;自体免疫性多内分泌综合症;β-羟基异丁酰基coa脱酰酶不足(hibch不足);生物素酶不足;睑裂狭小-上睑下垂-倒转型内眦赘皮;疙疮综合症;短指;短指-高血压综合症;b1型短指;腮耳肾谱系障碍;brca1;躯干发育不良;卡纳万氏病(canavan);脑腱性黄瘤症;蜡样质-褐质病-巴通氏病(ceroid-lipofuscinoses-batton);2b型腓骨肌萎缩症;1b型恰克-马利-杜斯神经病(charcot-marie-toothneuropathytype1b);2a2型恰克-马利-杜斯神经病;察氏综合症(chargesyndrome);颌骨增大;无脉络膜;希特林蛋白缺乏症(citrindeficiency);i型瓜氨酸血症;科菲-洛雷综合症(coffin-lowrysyndrome);柯亨综合症(cohensyndrome);胶原蛋白4a5;常见可变免疫缺陷;先天性肾上腺增生;先天性白内障、面部畸形和神经病;1a型糖基化的先天性病症;先天性重肌无力综合症;科妮莉亚兰格综合症(corneliadelangesyndrome);囊肿性纤维化;胱氨酸症;毛囊角化病;结蛋白沉积性肌病;dfna2非综合型听力损失;戴-布二氏贫血(diamond-blackfananemia);双皮层综合症;杜恩氏综合症(duanesyndrome);杜兴氏/贝克尔肌肉萎缩症(duchenne/beckermusculardystrophy);远端型肌病;先天性角化不良;早发型家族性阿尔茨海默病(early-onsetfamilialalzheimerdisease);早发型原发性肌肉张力不足(dyt1);埃戴二氏病(ehlersdanlos);埃戴二氏综合症,传统型;埃戴二氏综合症,运动过度型;埃戴二氏综合症,脊柱后侧凸形式;x连锁型艾-德二氏肌肉萎缩症(emery-dreifussmusculardystrophyxlinked);单纯性大疱性表皮松懈;法布里病(fabrydisease);面肩胛臂肌肉萎缩症;家族性自主神经失调(hsaniii);家族性胰岛素过多(fhi);家族性肥大心肌病;家族性甲状腺素运载蛋白淀粉样变性;范康尼氏贫血(fanconianemia);脆性x;弗里德赖希共济失调(friedreichataxia);frmd7相关婴儿眼球震颤;法尼斯综合症(frynssyndrome);半乳糖血症;戈谢疾病(gaucherdisease);甘氨酸脑病;vi型糖原储积病;噬血细胞性淋巴组织细胞增生症;a型血友病;b型血友病;伴有免疫缺陷的肝静脉-闭塞疾病;遗传性出血性毛细血管扩张症;伴有压力麻痹的遗传性神经病;遗传性非息肉病性结肠癌;己糖胺酶a不足;hfe相关遗传性血色沉着病;霍尔特-奥拉姆综合症(holt-oramsyndrome);亨延顿氏病(huntingtondisease);羟甲基胆素合成酶(hmbs)不足;低碱性磷酸酯酶症;包涵体肌病2;色素失禁症;青少年息肉病综合症;卡尔曼综合症(kallmannsyndrome);雷伯氏先天性黑蒙(lebercongenitalamaurosis);雷伯氏先天性黑蒙10;李-法梅尼综合症(li-fraumenisyndrome);2a型臂-腰部肌肉萎缩症远端肌病;lis1相关无脑回;长qt综合症;洛维综合症(lowesyndrome);恶性高温敏感;枫糖浆尿病;mapt相关病症;麦克西克-考夫曼综合症(mckusick-kaufmansyndrome);mecp2-瑞特综合症(mecp2-rettsyndrome);门克斯氏病(menkes);异染性脑白质营养不良;甲基丙二酸酸血症;ii型粘脂储积症;1型多重内分泌赘瘤形成;2型多重内分泌赘瘤形成;先天性肌强直;1型强直性肌营养不良;2型强直性肌营养不良;指甲-髌骨综合症;线状体肌病;1型神经纤维瘤;2型神经纤维瘤;努南综合症(noonansyndrome);眼白化病,x连锁;1型眼皮肤白化病;2型眼皮肤白化病;眼咽型肌营养不良;1型眼萎缩;鸟氨酸转氨甲酰酶不足;成骨不全;帕金森病(parkinsondisease);潘瑞德综合症(pendredsyndrome);过氧化体生体合成,齐薇格型(zellweger);苯丙酮尿症;多囊性肾病;庞贝病-gsdii(pompedisease-gsdii);原发性睫运动困难;色素性视网膜炎;成视网膜细胞瘤;西斯瑞-科增综合症(saethre-chotzensyndrome);scn9a相关遗传性红斑性肢痛;shox相关单倍剂量不足;镰状细胞病;史密斯-来姆尼-奥皮兹综合症(smith-lemli-opitzsyndrome);史密斯-玛格尼斯综合症(smith-magenissyndrome);索多斯综合症(sotossyndrome);3a型痉挛性截瘫;7型痉挛性截瘫;8型痉挛性截瘫;1型痉挛性截瘫;4型痉挛性截瘫;脊髓性肌萎缩;2型脊髓小脑失调;3型脊髓小脑失调;7型脊髓小脑失调;1型脊髓小脑失调;斯蒂克勒综合症(sticklersyndrome);致死性骨发育不良;胸科主动脉动脉瘤和主动脉解剖;特雷彻柯林斯综合征(treachercollinssyndrome);三甲基胺尿症;复杂结节性硬化症;尤迪氏末端肌病(udddistalmyopathy);1型尤塞氏综合症(ushersyndrometype1);超长链酰基-辅酶a去氢酶不足;冯希派尔-林道氏病(vonhippel-lindau);沃登博格综合症(waardenburgsyndrome),1型;沃尔纳综合症(wernersyndrome);威尔姆斯肿瘤(wilmstumor);威尔逊病(wilsondisease);韦斯考特-奥德里奇氏病(wiskott-aldrich);先天性x连锁肾上腺发育不全;x连锁肾上腺脑白质营养不良;x连锁肌肉张力不足-帕金森氏症;x连锁青少年视网膜分层剥离;x连锁肌管性肌病;x连锁scids;以及齐薇格式综合症(zellwegersyndrome)。在一个实施例中,与先天性或遗传性疾病相关的突变可包括取代、插入、反转、点突变、缺失、错配和易位。在一些实施例中,与遗传性或先天性疾病相关的突变包括复本数变化。在一些实施例中,本发明大体上涉及至少一个目标序列的选择性扩增和与遗传性疾病相关的突变的检测和/或鉴别。在一些实施例中,与先天性或遗传性疾病相关的突变可位于选自由以下组成的群组的基因中的一个或多个中:abca4;abcc8;abcd1;acadvl;acta2;actc;actc1;acvrl1;ada;aipl1;aire;alk1;alpl;amt;apc;app;aptx;ar;arl6;arsa;asl;aspa;ass;ass1;atl;atm;atp2a2;atp7a;atp7b;atxn1;atxn2;atxn3;atxn7;bbs6;bckdha;bckdhb;best1;bmpr1a;brca1;brca2;brip1;btd;btk;c2orf25;ca4;calr3;capn3;cav3;ccdc39;ccdc40;cdh23;cep290;cerkl;cftr;chat;chd7;chek2;chm;chrna1;chrnb1;chrnd;chrne;clcn1;cnbp;cngb1;coh1;col11a1;col11a2;col1a1;col1a2;col2a1;col3a1;col4a5;col5a1;col5a2;col7a1;col9a1;crb1;crx;ctdp1;ctns;cyp21a2;cyp27a1;dax1;dbt;dcx;des;dhcr7;dj1;dkc1;dld;dmd;dmpk;dnaaf1;dnaaf2;dnah11;dnah5;dnai1;dnai2;dnal1;dnm2;dok7;dsc2;dsg2;dsp;dysf;dyt1;emd;eng;eya1;eys;f8;f9;fanca;fancc;fancf;fancg;fancj;fandc2;fbn1;fbxo7;fgfr1;fgfr3;fmo3;fmr1;foxl2;frg1;frmd7;fscn2;fxn;gaa;galt;gba;gbe1;gcsh;gdf5;gjb2;gjb3;gjb6;gla;gldc;gne;gnptab;gpc3;gpr143;gucy2d;hba1;hba2;hbb;hd;herg;hexa;hfe;hhf;hibch;hla-b27;hmbs;hplh1;hprp3;hr;htnb;htt;ikbkap;ikbkg;il2rg;impdh1;itgb4;jag1;jph3;kcne1;kcne2;kcnh2;kcnq1;kcnq4;kiaa0196;klhl7;kras;krt14;krt5;l1cam;lamb3;lamp2;ldb3;lmna;lmx18;lrat;lrrk2;mapt;mc1r;mecp2;med12;men1;mertk;mfn2;mkks;mlh1;mmaa;mmab;mmachc;mmadhc;mpz;msh2;mtm1;mtnd5;mttg;mtti;mttk;mttl1;mttq;mut;mybpc3;myh11;myh6;myh7;myl2;myl3;mylk2;myo7a;nd5;nd6;nemo;nf1;nf2;nipbl;nr0b1;nr2e3;nras;nsd1;oca2;ocrl;opa1;otc;pabpn1;pafah1b1;pah;park2;park7;parkin;pax3;pax6;pcdh15;pexl;pex2;pex10;pex13;pex14;pex19;pex26;pex3;pex5;pink1;pkd1;pkd2;pkd3;pkhd1;pkp2;plec1;plod1;pmm2;pmp22;polg;ppt1;prcd;prkag2;prnp;prom1;prpf3;prpf8;prph2;prpn;psen1;psen2;ptch1;ptpn11;rab7a;raf1;rai1;rapsn;rb1;rdh12;rds;recql3;ret;rho;ror2;rp1;rp2;rp9;rpe65;rpgr;rpgrip1;rpl11;rpl35a;rps10;rps17;rps19;rps24;rps26;rps6ka3;rps7;rpsl5;rs1;rsph4a;rsph9;ryr1;ryr2;sall4;sca3;scn5a;scn9a;sema4a;serpina1;serping1;sgcd;sh3bp2;shox;six1;six5;slc25a13;slc25a4;slc26a4;smad4;smn1;snca;snrnp200;sod1;sos1;sox9;sp110;spast;spata7;spg3a;spg4;spg7;taf1;tbx5;tcof1;tgfbr1;tgfbr2;tnfrsc13c;tnnc1;tnni3;tnnt1;tnnt2;tnxb;topors;tor1a;tp53;tpm1;trng;trni;trnk;trnl1;trnq;tsc1;tsc2;ttn;ttpa;ttr;tulp1;twist1;txndc3;tyr;ush1c;ush1h;ush2a;vcl;vhl;vps13b;was;wrn;wt1;和znf9。用作校验方法的输入的扩增子。本发明的校验和测序方法中使用的经预先扩增的核酸可从许多来源获得。扩增子可通过尺寸有限样品的pcr扩增产生,包括(但不限于)本文中称为ampliseq图或分析的预先扩增方法。扩增子也可以通过桥联扩增产生,如可用于测序的合成测序方法中。扩增子可经由乳液pcr产生,同时连接到珠粒或表面。扩增子可通过可增加尺寸有限样品的量的任何形式的扩增产生,所述扩增实现经由大规模平行过程进行的测序以及允许保留待用于本发明的重测序和校验方法中的经预先扩增的样品的等分试样。因为可通过许多方法产生扩增子,其结构的性质可变化。扩增子具有至少一个相关序列和相对于相关序列位于5′的前导序列。这一前导序列在用于预先扩增尺寸有限样品的过程期间引入。同样,5′前导序列本身可包括两个不同区域;包括5′前导序列的所有或一部分5′部分的过程衍生序列部分和包括5′前导序列的所有或一部分3′部分的序列特异性区域。5′前导序列的5′过程衍生序列区域可具有多种序列类型。具体序列取决于用于预先扩增的方法。这一5′过程衍生序列区域可以是“通用”引物序列、条码序列、拔出序列和衔接子,一种用于固定用于预先扩增有限样品的前驱体序列的序列,或某种组合。5′过程衍生序列可通过前驱体物质的聚合酶延伸或另一类型的合并(包括(但不限于)接合)来并入。这些过程衍生序列中的每一个可用于选择性更高地重新序列,确认或验证初始测序分析。5′前导序列的3′序列特异性区域可以是实际激活引物物质的特异性延伸并且因此提供尺寸有限样品的扩增的引物的部分。3′部分可用于聚集针对测序方法(例如ampliseqtmcancerhotspotpanelv.2)中待研究的预先选择的基因座集合的预先扩增的输出。或者,5′前导序列可仅具有一个序列特异性区域,其包括完整的5′前导序列。举例来说,通过具有目标序列特异性寡核苷酸序列的引物的延伸产生的扩增子将不具有过程衍生序列部分,其全部长度仅是一个目标序列特异性寡核苷酸序列。化学增强型引物。根据本发明教示的各种实施例,提供一种化学增强型引物,其包含寡核苷酸序列、带负电部分(ncm)和至少一个核酸酶抗性键。在一些实施例中,至少一个核酸酶抗性键包括(但不限于)至少一个硫代磷酸酯键(ps)或至少一个硼磷酸酯键。在其它实施例中,化学增强型引物中不存在核酸酶抗性键。在其它实施例中,化学增强型引物可包含寡核苷酸序列、带负电部分(ncm),其中寡核苷酸核苷酸键由磷酸二酯间核苷酸键组成。引物可用于激活测序反应中的目标核酸,本文中称为化学增强型测序引物,或对于片段分析,本文中称为化学增强型延伸引物。寡核苷酸序列可以是通用引物或基因特异性核苷酸序列。通用引物的实例包括(但不限于)m13(p/n402071和402072,appliedbiosystems)、us1(uniseq,plosmedicine3(10)e431(2006))、t7(p/n402126,但不含染料,appliedbiosystems)、sp6(p/n402128,但不含染料,appliedbiosystems)和t3(p/n402127,但不含染料,appliedbiosystems)。m13、t7、sp6和t3的序列展示于表1中。表1正向m135′tgtaaaacgacggccagt3′(seqidno:1)反向m135′caggaaacagctatgacc3′(seqidno:2)t75′taatacgactcactataggg3′(seqidno:3)sp65′atttaggtgacactatag3′(seqidno:4)t35′attaaccctcactaaaggga3′(seqidno:5)寡核苷酸序列还可以含有染料标记,如荧光标记。在本发明教示的各种实施例中,ncm可位于寡核苷酸序列的末端5′端处或寡核苷酸序列内。ncm的实例包括(但不限于)具有式结构的磷酸二酯部分(其通过使氨基磷酸酯(可从glenresearch购得)与含有寡核苷酸的适合的反应搭配物反应而引入化学增强型引物),本文中(c)n间隔基,其中n可以是1-12,氨基酸天冬氨酸和谷氨酸以及核苷酸和核苷酸类似物(datp、dctp、dgtp和dttp)。ncm可含有仅一个带负电单体或多个带负电部分,例如至少五个、十个、12个、15个、18个、20个、24个或更多个间隔基((cn))的重复单元,其中x是1与至少11、至少12、至少15、至少18、至少20、至少24或30个cn间隔基之间的任何整数,其中“n”是3或6,例如直链配置或分支链配置中的c3间隔基、c6间隔基或c3与c6间隔基的组合。个别或呈组合形式的c3和c6间隔基也可以通过形成双重物或三重物来形成分支链ncm,所述双重物或三重物是例如(c3)3-treb-m13或[(c3)2-treb]-treb-m13,其中ncm由(c3)3-treb或[(c3)2-treb]-treb表示,并且m13表示寡核苷酸序列,如所属领域的技术人员已知。ncm还可以含有染料标记,如荧光标记。在各种实施例中,至少没有、至少一个、至少两个或更多个硫代磷酸酯键可位于寡核苷酸序列的末端3′端。存在至少一个核酸酶抗性键可提供对由3′-5′核酸酶(如外切核酸酶i(p/nm0293s,newenglandbiolabs,ipswich,ma)、exoiii(p/nm0206s,newenglandbiolabs,ipswich,ma)、pfu(promega,p/nm7741,madison,wi)和dnapoli(p/nm0209s,newenglandbiolabs,ipswich,ma))进行的消化的抗性。化学增强型引物对核酸酶消化的抗性提供去除pcr测序方案中pcr净化步骤的优势。可在测序反应混合物中实现移除pcr步骤中残留的额外非核酸酶抗性扩增引物。pcr扩增反应对测序反应混合物内核酸酶的短暂暴露使非核酸酶抗性扩增引物降解,接着进行核酸酶的失活。化学增强型引物仍可用于测序反应,同时非核酸酶抗性扩增引物和核酸酶已分别被移除和失活。在一些实施例中,化学增强型引物具有式i的结构:其中b是核碱基;k是s或o;每个n独立地是1到12的整数;m是0或1;x是1到约50的整数;z是3到约100的整数;w是oh、f、ome或h;并且nt是具有下式的部分:对于具有式i的结构的化学增强型引物,oligo表示包含寡核苷酸的式i的化学增强型引物中的部分。寡核苷酸中的每个核苷酸包含核碱基b部分和核糖部分:式i的化学增强型引物可包含一个或多个b,其中b是天然存在的核碱基。在其它实施例中,式i的化学增强型引物可包含一个或多个b,其中b是核碱基类似物。式i的化学增强型引物可仅具有一个硫代磷酸酯键,其中m是0,其具有式i-a的结构:式i的化学增强型引物可经染料标记,包括荧光染料。式i的化学增强型引物可包括一个或多个经染料标记的b,并且表示为bf。在一些实施例中,化学增强型引物的3′末端核苷酸具有经荧光标记的b。化学增强型引物可含有3′经荧光标记的末端核苷酸,其中3′末端核苷酸的b是核碱基类似物。或者,化学增强型引物可含有5′末端核苷酸,其具有经荧光标记的b,其可表示为bf。在一些实施例中,其中化学增强型引物含有5′末端核苷酸(其含有经荧光标记的核碱基bf),经标记的核碱基是核碱基类似物。在其它实施例中,化学增强型引物可含有直接或间接连接到多个ncm中的一个和/或针对引物的5′末端核苷酸的连接子部分的经荧光标记的ncm。此外,式i的化学增强型引物可在位于寡核苷酸的内部位置的核苷酸的核碱基上经荧光标记,并且可选择经内部荧光标记的核苷酸位于寡核苷酸的非末端部分的任何位置。当式i的化学增强型引物含有荧光标记时,化学增强型引物可具有以下各式中的一个的结构:其中fl是染料标记并且bf是经染料标记的核碱基。fl和bf可各自表示荧光染料标记。对于式i的化学增强型引物,每个n可以独立地是1到12的整数。在一些实施例中,n是1、2、3、4、5、6、7、8或9。在一些实施例中,n是3。在其它实施例中,n是4。或者,n可以是6。在式i的化学增强型引物的一些实施例中,当x大于2时,选择n的第一实例是3并且选择n的第二实例是6。在式i的化学增强型引物的其它实施例中,当x大于2时,选择n的超过一个实例是3,并且选择n的超过一个实例是6。在其它实施例中,当x大于5时,选择多个n是3,并且选择第二多个n是6。式i的化学增强型引物可具有m=1或m=0。在一些实施例中,式i的化学增强型引物具有m=0。式i的化学增强型引物可具有x,其中x是1到约50的整数。在式i的化学增强型引物的一些实施例中,x是1、2、3、4、5、6、7、8、9或10。在其它实施例中,x是10、15、18、20或24。在一些实施例中,x是5、8、9、10或15。在其它实施例中,x是11、12、13、14、17或20。在其它实施例中,x是30。在其它实施例中,x是至少5、至少6、至少8、至少9、至少10、至少15、至少18、至少20或至少24。在一些实施例中,x是15。在其它实施例中,x是8或9。在一些实施例中,化学增强型引物包含部分的第二多个y,其中y是1-20的整数。在一些实施例中,当n的第一多个x具有第一整数的值时,那么n的第二多个y是1到20的整数。在一些实施例中,化学增强型引物可具有第一多个n,其中n是3并且x是15,和第二多个n,其中n是6并且x是5。预期n、x和y的所有组合可用于式i的化学增强型引物中。在式i的化学增强型引物中,z是3到约100的整数。在一些实施例中,z是5到50、5到40或5到约30的整数。在其它实施例中,z是5到25或5到20的整数。在式i的化学增强型引物的一些实施例中,k是s。在其它实施例中,k是o。在式i的化学增强型引物的一些实施例中,w是h或oh。式i、i-b、i-c、i-e、i-f或i-g的化学增强型引物可具有上文所披露的范围和选择的b、bf、fl、k、m、n、w、x和z的任何组合。式i-d的化学增强型引物可具有上文所披露的范围和选择的b、fl、k、m、n、w、x和z的任何组合。式i-a、i-h、i-j或i-k的化学增强型引物可具有上文所披露的范围和选择的b、bf、fl、k、m、n、w、x和z的任何组合。在其它实施例中,化学增强型引物是具有式ii的结构的化合物:其中b是核碱基;k是s或o;每个n独立地是1到12的整数;m是0或1;x是1到约50的整数;z是3到约100的整数;w是oh、f、ome或h;并且nt是具有下式的部分:式ii的化学增强型引物可称为双重物,并且表示ncm部分的分支链配置。式ii的化学增强型引物可包含一个或多个b,其中b是天然存在的核碱基。在其它实施例中,式ii的化学增强型引物可包含一个或多个b,其中b是核碱基类似物。式ii的化学增强型引物可仅具有一个硫代磷酸酯键,其中m是0。在一些实施例中,式ii的化学增强型引物可用染料标记,包括荧光染料。式ii的化学增强型引物可包括一个或多个经染料标记的b,并且表示为bf。在一些实施例中,化学增强型引物的3′末端核苷酸具有经荧光标记的b。化学增强型引物可含有3′经荧光标记的末端核苷酸,其中3′末端核苷酸的b是核碱基类似物。或者,化学增强型引物可含有5′末端核苷酸,其具有经荧光标记的b,其可表示为bf。在一些实施例中,其中化学增强型引物含有5′末端核苷酸(其含有经荧光标记的核碱基bf),经标记的核碱基是核碱基类似物。在其它实施例中,化学增强型引物可含有直接或间接连接到多个ncm中的一个和/或针对引物的5′末端核苷酸的连接子部分的经荧光标记的ncm。此外,式ii的化学增强型引物可在位于寡核苷酸的内部位置的核苷酸的核碱基上经荧光标记,并且可选择经内部荧光标记的核苷酸位于寡核苷酸的非末端部分的任何位置。对于式ii的化学增强型引物,n可以是1到9的整数。在一些实施例中,n是1、2、3、4、5、6、7、8或9。在一些实施例中,n是3。在其它实施例中,n是4。或者,n可以是6。在式ii的化学增强型引物的一些实施例中,当x大于2时,选择n的第一实例是3并且选择n的第二实例是6。在式ii的化学增强型引物的其它实施例中,当x大于2时,选择n的超过一个实例是3,并且选择n的超过一个实例是6。在其它实施例中,当x大于5时,选择多个n是3,并且选择第二多个n是6。式ii的化学增强型引物可具有m=1或m=0。在一些实施例中,式ii的化学增强型引物具有m=0。式ii的化学增强型引物可具有x,其中x是1到约50的整数。在式ii的化学增强型引物的一些实施例中,x是1、2、3、4、5、6、7、8、9或10。在其它实施例中,x是10、15、18、20或24。在一些实施例中,x是5、8、9、10或15。在其它实施例中,x是11、12、13、14、17或20。在其它实施例中,x是30。在其它实施例中,x是至少5、至少6、至少8、至少9、至少10、至少15、至少18、至少20或至少24。在一些实施例中,x是15。在其它实施例中,x是8或9。在一些实施例中,化学增强型引物包含部分的第二多个y,其中y是1-20的整数。在一些实施例中,当n的第一多个x具有第一整数的值时,那么n的第二多个y是1到20的整数。在一些实施例中,化学增强型引物可具有第一多个n,其中n是3并且x是15,和第二多个n,其中n是6并且x是5。预期n、x和y的所有组合可用于式ii的化学增强型引物中。在式ii的化学增强型引物中,z是3到约100的整数。在一些实施例中,z是5到50、5到40或5到约30的整数。在其它实施例中,z是5到25或5到20的整数。在式ii的化学增强型引物的一些实施例中,k是s。在其它实施例中,k是o。在式ii的化学增强型引物的一些实施例中,w是h或oh。式ii的化学增强型引物可具有上文所披露的范围和选择的b、k、m、n、w、x和z的任何组合。在其它实施例中,化学增强型引物是具有式iii的结构的化合物:其中b是核碱基;k是s或o;每个n独立地是1到12的整数;m是0或1;x是1到约50的整数;z是3到约100的整数;w是oh、f、ome或h;并且nt是具有下式的部分:式iii的化学增强型引物可称为三重物,并且表示ncm部分的分支链配置。式iii的化学增强型引物可包含一个或多个b,其中b是天然存在的核碱基。在其它实施例中,式iii的化学增强型引物可包含一个或多个b,其中b是核碱基类似物。式iii的化学增强型引物可仅具有一个硫代磷酸酯键,其中m是0。式iii的化学增强型引物可经染料标记,包括荧光染料。式iii的化学增强型引物可包括一个或多个经染料标记的b,并且表示为bf。在一些实施例中,化学增强型引物的3′末端核苷酸具有经荧光标记的b。化学增强型引物可含有3′经荧光标记的末端核苷酸,其中3′末端核苷酸的b是核碱基类似物。或者,化学增强型引物可含有5′末端核苷酸,其具有经荧光标记的b,其可表示为bf。在一些实施例中,其中化学增强型引物含有5′末端核苷酸(其含有经荧光标记的核碱基bf),经标记的核碱基是核碱基类似物。在其它实施例中,化学增强型引物可含有直接或间接连接到多个ncm中的一个和/或针对引物的5′末端核苷酸的连接子部分的经荧光标记的ncm。此外,式ii的化学增强型引物可在位于寡核苷酸的内部位置的核苷酸的核碱基上经荧光标记,并且可选择经内部荧光标记的核苷酸位于寡核苷酸的非末端部分的任何位置。对于式iii的化学增强型引物,n可以是1到9的整数。在一些实施例中,n是1、2、3、4、5、6、7、8或9。在一些实施例中,n是3。在其它实施例中,n是4。或者,n可以是6。在式iii的化学增强型引物的一些实施例中,当x大于2时,选择n的第一实例是3并且选择n的第二实例是6。在式iii的化学增强型引物的其它实施例中,当x大于2时,选择n的超过一个实例是3,并且选择n的超过一个实例是6。在其它实施例中,当x大于5时,选择多个n是3,并且选择第二多个n是6。式iii的化学增强型引物可具有m=1或m=0。在一些实施例中,式iii的化学增强型引物具有m=0。式iii的化学增强型引物可具有x,其中x是1到约30的整数。在式ii的化学增强型引物的一些实施例中,x是1、2、3、4、5、6、7、8、9或10。在其它实施例中,x是10、15、18、20或24。在一些实施例中,x是5、8、9、10或15。在其它实施例中,x是11、12、13、14、17或20。在其它实施例中,x是30。在其它实施例中,x是至少5、至少6、至少8、至少9、至少10、至少15、至少18、至少20或至少24。在一些实施例中,x是15。在其它实施例中,x是8或9。在式iii的化学增强型引物中,z是3到约100的整数。在一些实施例中,z是5到50、5到40或5到约30的整数。在其它实施例中,z是5到25或5到20的整数。在一些实施例中,化学增强型引物包含部分的第二多个y,其中y是1-20的整数。在一些实施例中,当n的第一多个x具有第一整数的值时,那么n的第二多个y是1到20的整数。在一些实施例中,化学增强型引物可具有第一多个n,其中n是3并且x是15,和第二多个n,其中n是6并且x是5。预期n、x和y的所有组合可用于式iii的化学增强型引物中。在式iii的化学增强型引物的一些实施例中,k是s。在其它实施例中,k是o。在式iii的化学增强型引物的一些实施例中,w是h或oh。式iii的化学增强型引物可具有上文所披露的范围和选择的b、k、m、n、w、x和z的任何组合。化学增强型引物的其它实施例由式iv表示:其中n的每个实例独立地是1到12的整数;x是1到50的整数;v是1到9的整数;t是0或1;linker包含3-100个原子;oligo具有下式的结构:其中b是核碱基;k是s或o;m是0或l;z是3到约100的整数;w是oh、f、ome或h;并且nt是具有下式的部分:式iv的化学增强型引物可包含一个或多个b,其中b是天然存在的核碱基。在其它实施例中,式iv的化学增强型引物可包含一个或多个b,其中b是核碱基类似物。式iv的化学增强型引物可经染料标记,包括荧光染料。具有式(cn)x-oligo的化学增强型引物可包括一个或多个经染料标记的b,并且表示为bf。在一些实施例中,当化学增强型引物具有至少一个经染料标记的b时,b可以是核碱基类似物。在一些实施例中,化学增强型引物的3′末端核苷酸具有经荧光标记的b,其可表示为bf。或者,化学增强型引物可含有5′末端核苷酸,其具有经荧光标记的b,其可表示为bf。此外,具有式(cn)x-oligo的化学增强型引物可在位于寡核苷酸的内部位置的核苷酸的核碱基上经荧光标记,并且可选择经内部荧光标记的核苷酸位于寡核苷酸的非末端部分的任何位置。在其它实施例中,化学增强型引物可含有直接或间接连接到多个ncm中的一个和/或与引物的5′末端核苷酸形成共价连接的ncm连接子部分的经荧光标记的ncm。linker是ncm连接子并且可包含3-100个原子,并且包括醚、酰胺、磷酸二酯和酯部分以形成ncm与寡核苷酸之间的共价键。linker可在寡核苷酸的5′端连接到核苷酸的核糖的5′碳。在一些实施例中,存在linker。在其它实施例中,ncm磷酸二酯部分直接连接到oligo。对于式iv的化学增强型引物,v可以是1到9的整数。在一些实施例中,v是1。在其它实施例中,v是2。在其它实施例中,v是3。对于式iv的化学增强型引物,v可以是1到12的整数。在一些实施例中,n是1、2、3、4、5、6、7、8或9。在其它实施例中,n是1到9的整数。在一些实施例中,n是3。在其它实施例中,n是4。或者,n可以是6。式iv的化学增强型引物具有x,其中x是1到约30的整数。在式iv的化学增强型引物的一些实施例中,x是1、2、3、4、5、6、7、8、9或10。在其它实施例中,x是10、15、18、20或24。在一些实施例中,x是5、8、9、10或15。在其它实施例中,x是11、12、13、14、17或20。在其它实施例中,x是至少5、至少6、至少8、至少9、至少10、至少15、至少18、至少20或至少24。在一些实施例中,x是15。在其它实施例中,x是8或9。在式iv的化学增强型引物的一些实施例中,当x大于2时,选择n的第一实例是3并且选择n的第二实例是6。在式iv的化学增强型引物的其它实施例中,当x大于2时,选择n的超过一个实例是3,并且选择n的超过一个实例是6。在其它实施例中,当x大于5时,选择多个n是3,并且选择第二多个n是6。在一些实施例中,化学增强型引物包含部分的第二多个y,其中y是1-20的整数。在一些实施例中,当n的第一多个x具有第一整数的值时,那么n的第二多个y是1到20的整数。在一些实施例中,化学增强型引物可具有第一多个n,其中n是3并且x是15,和第二多个n,其中n是6并且x是5。预期n、x和y的所有组合可用于式iv的化学增强型引物中。具有式iv的化学式的化学增强型引物具有m=1或m=0。在一些实施例中,式iv的化学增强型引物具有m=0。具有式iv的化学式的化学增强型引物具有z,其中z是3到约100的整数。在一些实施例中,z是5到50、5到40或5到约30的整数。在其它实施例中,z是5到25或5到20的整数。在式iv的化学增强型引物的一些实施例中,k是s。在其它实施例中,k是o。在式iv的化学增强型引物的一些实施例中,w是h或oh。式iv的化学增强型引物可具有上文所披露的范围和选择的b、n、t、v、x、m、y、z、k或w的任何组合。在一些实施例中,式iv的化学增强型引物是化学增强型引物(cn)x-oligo,其中(cn)x具有下式的结构:其中n的每个实例独立地是1到12的整数;并且x是1到约30的整数;并且oligo具有下式的结构:其中b、k、m、z、y、nt和w如上文关于式iv所定义。对于具有式(cn)x-oligo的化学增强型引物,v是1,t是0,不存在linker,并且ncm部分的链直接连接到oligo。具有式(cn)x-oligo的化学增强型引物可具有上文关于式iv所披露的范围和选择的b、n、x、m、z、k或w的任何组合。在其它实施例中,化学增强型引物由下式表示:(cn)x-oligo*,其中(cn)x具有下式的结构:其中n的每个实例独立地是1到12的整数;并且x是1到约30的整数;oligo*具有下式的结构:其中b、k、m、z、y、nt和w如上文关于式iv所定义。对于具有式(cn)x-oligo*的化学增强型引物,v是1,t是0,不存在linker,并且ncm部分的链直接连接到oligo*。具有式(cn)x-oligo*的化学增强型引物可具有上文关于式iv所披露的范围和选择的b、n、x、m、z、k或w的任何组合。具有(cn)x式vi-a1的化学式的化学增强型引物包括(但不限于):(cn)x-us1,其中n是1到9并且x是1到约30。在一些实施例中,(cn)x-us1是(c3)1-us1、(c3)2-us1、(c3)3-us1、(c3)4-us1、(c3)5-us1、(c3)6-us1、(c3)7-us1、(c3)8-us1、(c3)9-us1、(c3)10-us1、(c3)11-us1、(c3)12-us1、(c3)13-us1、(c3)14-us1、(c3)15-us1、(c3)16-us1、(c3)17-us1、(c3)18-us1、(c3)21-us1、(c3)24-us1、(c3)27-us1或(c3)30-us1。在一些实施例中,(cn)x-us1是正向引物并且可具有如上文所描述的任何x。在其它实施例中,(cn)x-us1是反向引物并且可具有如上文所描述的任何x。(cn)x-m13-正向,其中n是1到9并且x是1到约30。在一些实施例中,(cn)x-m13-正向是(c3)1-m13-正向、(c3)2-m13-正向、(c3)3-m13-正向、(c3)4-m13-正向、(c3)5-m13-正向、(c3)6-m13-正向、(c3)7-m13-正向、(c3)8-m13-正向、(c3)9-m13-正向、(c3)10-m13-正向、(c3)11-m13-正向、(c3)12-m13-正向、(c3)13-m13-正向、(c3)14-m13-正向、(c3)15-m13-正向、(c3)16-m13-正向、(c3)17-m13-正向、(c3)18-m13-正向、(c3)21-m13-正向、(c3)24-m13-正向、(c3)27-m13-正向或(c3)30-m13-正向。(cn)x-m13-反向,其中n是1到9并且x是1到约30。在一些实施例中,(cn)x-m13-反向是(c3)1-m13-反向、(c3)2-m13-反向、(c3)3-m13-反向、(c3)4-m13-反向、(c3)5-m13-反向、(c3)6-m13-反向、(c3)7-m13-反向、(c3)8-m13-反向、(c3)9-m13-反向、(c3)10-m13-反向、(c3)11-m13-反向、(c3)12-m13-反向、(c3)13-m13-反向、(c3)14-m13-反向、(c3)15-m13-反向、(c3)16-m13-反向、(c3)17-m13-反向、(c3)18-m13-反向、(c3)21-m13-反向、(c3)24-m13-反向、(c3)27-m13-反向或(c3)30-m13-反向。(cn)x-t7,其中n是1到9并且x是1到约30。在一些实施例中,(cn)x-t7是(c3)1-t7、(c3)2-t7、(c3)3-t7、(c3)4-t7、(c3)5-t7、(c3)6-t7、(c3)7-t7、(c3)8-t7、(c3)9-t7、(c3)10-t7、(c3)11-t7、(c3)12-t7、(c3)13-t7、(c3)14-t7、(c3)15-t7、(c3)16-t7、(c3)17-t7、(c3)18-t7、(c3)21-t7、(c3)24-t7、(c3)27-t7或(c3)30-t7。在一些实施例中,(cn)x-t7是正向引物并且可具有如上文所描述的任何x。在其它实施例中,(cn)x-t7是反向引物并且可具有如上文所描述的任何x。(cn)x-sp6,其中n是1到9并且x是1到约30。在一些实施例中,(cn)x-sp6是(c3)1-sp6、(c3)2-sp6、(c3)3-sp6、(c3)4-sp6、(c3)5-sp6、(c3)6-sp6、(c3)7-sp6、(c3)8-sp6、(c3)9-sp6、(c3)10-sp6、(c3)11-sp6、(c3)12-sp6、(c3)13-sp6、(c3)14-sp6、(c3)15-sp6、(c3)16-sp6、(c3)17-sp6、(c3)18-sp6、(c3)21-sp6、(c3)24-sp6、(c3)27-sp6或(c3)30-sp6。在一些实施例中,(cn)x-sp6是正向引物并且可具有如上文所描述的任何x。在其它实施例中,(cn)x-sp6是反向引物并且可具有如上文所描述的任何x。(cn)x-t3,其中n是1到9并且x是1到约30。在一些实施例中,(cn)xt3是(c3)1-t3、(c3)2-t3、(c3)3-t3、(c3)4-t3、(c3)5-t3、(c3)6-t3、(c3)7-t3、(c3)8-t3、(c3)9-t3、(c3)10-t3、(c3)11-t3、(c3)12-t3、(c3)13-t3、(c3)14-t3、(c3)15-t3、(c3)16-t3、(c3)17-t3、(c3)18-t3、(c3)21-t3、(c3)24-t3、(c3)27-t3或(c3)30-t3。在一些实施例中,(cn)x-t3是正向引物并且可具有如上文所描述的任何x。在其它实施例中,(cn)x-t3是反向引物并且可具有如上文所描述的任何x。(cn)x-gso,其中n是1到9,x是1到约30,并且gso是基因特异性寡核苷酸序列,其中基因特异性寡核苷酸包含50个或更少的核苷酸。在一些实施例中,(cn)xgso是(c3)1-gso、(c3)2-gso、(c3)3-gso、(c3)4-gso、(c3)5-gso、(c3)6-gso、(c3)7-gso、(c3)8-gso、(c3)9-gso、(c3)10-gso、(c3)11-gso、(c3)12-gso、(c3)13-gso、(c3)14-gso、(c3)15-gso、(c3)16-gso、(c3)17-gso、(c3)18-gso、(c3)21-gso、(c3)24-gso、(c3)27-gso或(c3)30-gso。在一些实施例中,(cn)x-gso是正向引物并且可具有如上文所描述的任何x。在其它实施例中,(cn)x-gso是反向引物并且可具有如上文所描述的任何x。具有式(cn)x-oligo*的化学增强型引物包括(但不限于):(cn)x-us1*,其中n是1到9并且x是1到约30。在一些实施例中,(cn)x-us1*是(c3)1-us1*、(c3)2-us1*、(c3)3-us1*、(c3)4-us1*、(c3)5-us1*、(c3)6-us1*、(c3)7-us1*、(c3)8-us1*、(c3)9-us1*、(c3)10-us1*、(c3)11-us1*、(c3)12-us1*、(c3)13-us1*、(c3)14-us1v、(c3)15-us1*、(c3)16-us1*、(c3)17-us1*、(c3)18-us1*、(c3)21-us1*、(c3)24-us1*、(c3)27-us1*或(c3)30-us1*。在一些实施例中,(cn)x-us1*是正向引物并且可具有如上文所描述的任何x。在其它实施例中,(cn)x-us1*是反向引物并且可具有如上文所描述的任何x。(cn)x-m13*-正向,其中n是1到9并且x是1到约30。在一些实施例中,(cn)x-m13*-正向是(c3)1-m13*-正向、(c3)2-m13*-正向、(c3)3-m13*-正向、(c3)4-m13*-正向、(c3)5-m13*-正向、(c3)6-m13*-正向、(c3)7-m13*-正向、(c3)8-m13*-正向、(c3)9-m13*-正向、(c3)10-m13*-正向、(c3)11-m13*-正向、(c3)12-m13*-正向、(c3)13-m13*-正向、(c3)14-m13*-正向、(c3)15-m13*正向、(c3)16-m13*-正向、(c3)17-m13*-正向、(c3)18-m13*-正向、(c3)21-m13*-正向、(c3)24-m13*-正向、(c3)27-m13*-正向或(c3)30-m13*-正向。(cn)x-m13*-反向,其中n是1到9并且x是1到约30。在一些实施例中,(cn)x-m13*-反向是(c3)1-m13*-反向、(c3)2-m13*-反向、(c3)3-m13*-反向、(c3)4-m13*-反向、(c3)5-m13*-反向、(c3)6-m13*-反向、(c3)7-m13*-反向、(c3)8-m13*-反向、(c3)9-m13*-反向、(c3)10-m13*-反向、(c3)11-m13*-反向、(c3)12-m13*-反向、(c3)13-m13*-反向、(c3)14-m13*-反向、(c3)15-m13*-反向、(c3)16-m13*-反向、(c3)17-m13*-反向、(c3)18-m13*-反向、(c3)21-m13*-反向、(c3)24-m13*-反向、(c3)27-m13*-反向或(c3)30-m13*-反向。(cn)x-t7*,其中n是1到9并且x是1到约30。在一些实施例中,(cn)x-t7*是(c3)1-t7*、(c3)2-t7*、(c3)3-t7*、(c3)4-t7*、(c3)5-t7*、(c3)6-t7*、(c3)7-t7*、(c3)8-t7*、(c3)9-t7*、(c3)10-t7*、(c3)11-t7*、(c3)12-t7*、(c3)13-t7*、(c3)14-t7*、(c3)15-t7*、(c3)16-t7*、(c3)17-t7*、(c3)18-t7*、(c3)21-t7*、(c3)24-t7*、(c3)27-t7*或(c3)30-t7*。在一些实施例中,(cn)x-t7*是正向引物并且可具有如上文所描述的任何x。在其它实施例中,(cn)x-t7*是反向引物并且可具有如上文所描述的任何x。(cn)x-sp6*,其中n是1到9并且x是1到约30。在一些实施例中,(cn)x-sp6*是(c3)1-sp6*、(c3)2-sp6*、(c3)3-sp6*、(c3)4-sp6*、(c3)5-sp6*、(c3)6-sp6*、(c3)7-sp6*、(c3)8-sp6*、(c3)9-sp6*、(c3)10-sp6*、(c3)11-sp6*、(c3)12-sp6*、(c3)13-sp6*、(c3)14-sp6*、(c3)15-sp6*、(c3)16-sp6*、(c3)17-sp6*、(c3)18-sp6*、(c3)21-sp6*、(c3)24-sp6*、(c3)27-sp6*或(c3)30-sp6*。在一些实施例中,(cn)x-sp6*是正向引物并且可具有如上文所描述的任何x。在其它实施例中,(cn)x-sp6*是反向引物并且可具有如上文所描述的任何x。(cn)x-t3*,其中n是1到9并且x是1到约30。在一些实施例中,(cn)xt3*是(c3)1-t3*、(c3)2-t3*、(c3)3-t3*、(c3)4-t3*、(c3)5-t3*、(c3)6-t3*、(c3)7-t3*、(c3)8-t3*、(c3)9-t3*、(c3)10-t3*、(c3)11-t3*、(c3)12-t3*、(c3)13-t3*、(c3)14-t3*、(c3)15-t3*、(c3)16-t3*、(c3)17-t3*、(c3)18-t3*、(c3)21-t3*、(c3)24-t3*、(c3)27-t3*或(c3)30-t3*。在一些实施例中,(cn)x-t3*是正向引物并且可具有如上文所描述的任何x。在其它实施例中,(cn)x-t3*是反向引物并且可具有如上文所描述的任何x。(cn)x-gso*,其中n是1到9,x是1到约30,并且gso*是基因特异性寡核苷酸序列,其中基因特异性寡核苷酸包含50个或更少的核苷酸。在一些实施例中,(cn)xgso*是(c3)1-gso*、(c3)2-gso*、(c3)3-gso*、(c3)4-gso*、(c3)5-gso*、(c3)6-gso*、(c3)7-gso*、(c3)8-gso*、(c3)9-gso*、(c3)10-gso*、(c3)11-gso*、(c3)12-gso*、(c3)13-gso*、(c3)14-gso*、(c3)15-gso*、(c3)16-gso*、(c3)17-gso*、(c3)18-gso*、(c3)21-gso*、(c3)24-gso*、(c3)27-gso*或(c3)30-gso*。在一些实施例中,(cn)x-gso*是正向引物并且可具有如上文所描述的任何x。在其它实施例中,(cn)x-gso*是反向引物并且可具有如上文所描述的任何x。化学增强型引物在其3′端包括预定数目的核苷酸,其与相等数目的相对于扩增子的相关序列位于5′的前导序列的核苷酸至少部分互补,所述核苷酸可接着在测序反应期间杂交以产生化学增强型引物的延伸产物。在一些实施例中,化学增强型引物的3′预定数目的核苷酸与扩增子的前导序列的5′端处的基因特异性序列至少部分互补。在一些实施例中,扩增子的前导序列的5′核苷酸(其与化学增强型引物的3′预定数目的核苷酸杂交)不是基因特异性。当扩增子的前导序列的5′核苷酸不是基因特异性序列时,前导序列的5′核苷酸可以是任何适合的标签、尾区、通用序列、条码或接合产物。使用化学增强型测序引物,已发现对于在3130、3730或3500毛细电泳平台(appliedbiosystems,fostercity,ca)中的任一个上使用pop7tm聚合物的测序结果工作流的pcr,可在整体上短约50%的时间内获得高质量和高精确度核酸序列结果。具体来说,通过使用化学增强型引物来提供5′序列解析的改良,其使得可阐明来自化学增强型测序引物的碱基1。增加输送量以及通过去除在开始测序反应之前的单独的pcr净化步骤来减少处理时间。(图1a和图1b)。总的来说,可发现使用不同方面的化学增强型引物,扩增、pcr净化和测序检测步骤可各自提供运行时间的节省。化学增强型引物的核酸酶抗性方面可提供减少的扩增和pcr净化时间要求,并且与标准测序引物可提供的相比,引物的ncm方面可实现更短操作时间内的有效分离。化学增强型测序引物和经改良的工作流可改良多形现象检测并且将等位基因特异性测序引物更高效地用于异型接合模糊度解析。用途的各种方面和化学增强型测序引物的合成进一步描述于2008年2月4日提交的美国申请案第61/026,085号;2009年2月3日提交的第12/365,140号;2010年10月28日提交的第61/407,899号;2010年10月29日提交的第61/408,553号;2011年10月28日提交的第13/284,839号;以及2012年2月15日提交的第13/397,626号中,并且其中每个的披露内容以全文引用的方式并入本文中。组合物。描述用于核酸测序的组合物,其包括:pcr扩增反应产物,其包含:从至少一个扩增子扩增的dna产物,其中扩增子包含相关序列和从第一激活序列并入的相对于相关序列位于5′的前导序列;非核酸酶抗性扩增引物;以及化学增强型引物,其中化学增强型引物包含寡核苷酸序列、ncm和没有或至少一个核酸酶抗性键。化学增强型引物可包括位于末端5′端或化学增强型引物的寡核苷酸序列内的多个ncm。ncm可以是(cn)间隔基,其中n可以是1到9的任何整数。在各种实施例中,ncm包含多个(cn)间隔基。在各种实施例中,化学增强型引物可具有式i的结构:其中b是核碱基;k是s或o;每个n独立地是1到9的整数;m是0或1;x是1到约30的整数;z是3到约100的整数;w是oh、f、ome或h;并且nt是具有下式的部分:在本发明的组合物的一些实施例中,化学增强型引物可以是本发明中所描述的任何化学增强型引物。在各种实施例中,化学增强型引物的寡核苷酸部分可包括通用引物。通用引物可选自m13、us1、t7、sp6和t3。通用引物可以是m13。在一些实施例中,化学增强型引物可包括一个核酸酶抗性键。在本发明的组合物的一些实施例中,组合物可进一步包括核酸酶。在其它实施例中,组合物可进一步包括聚合酶、脱氧核苷酸三磷酸酯、双脱氧核苷酸三磷酸酯和染料标记。在一些实施例中,双脱氧核苷酸三磷酸酯可包括标记有染料标记的双脱氧核苷酸三磷酸酯。经染料标记的双脱氧核苷酸三磷酸酯可包括经荧光染料标记的双脱氧核苷酸三磷酸酯。在一些实施例中,染料标记可连接到ncm或寡核苷酸序列。在本发明的组合物的一些实施例中,核酸酶可选自外切核酸酶i、exoiii、pfu和dnapoli。在一些实施例中,聚合酶可以是taq聚合酶。在一些实施例中,pcr扩增反应产物进一步包括经扩增的dna产物,其中dna产物是多个扩增子的扩增产物。在一些实施例中,用于核酸测序的组合物可进一步包含超过一种化学增强型测序引物。在一些实施例中,聚合酶可包含taq聚合酶,例如amplitaqgold聚合酶。在一些实施例中,核酸酶可包含外切核酸酶i。在一些实施例中,化学增强型测序引物可包含至少一个硫代磷酸酯键。在其它实施例中,化学增强型测序引物可包含末端3′端硫代磷酸酯键。在一些实施例中,化学增强型测序引物可包含染料,例如经荧光染料标记的寡核苷酸和/或ncm化合物内至少一个经荧光染料标记的ncm部分。根据各种实施例用于核酸测序的组合物可包含约0.01单位到约20单位(例如约0.1单位到约1.0单位,或约0.8单位)的量的聚合酶,例如dna聚合酶。组合物可包含具有约10单位到约20单位的上限和约0.01单位到约0.05单位的下限的范围内的量的聚合酶。根据各种实施例组合物可包含约1单位到约40单位(例如约2单位到约15单位,或约10单位)的量的核酸酶,例如外切核酸酶i。组合物可包含具有约10单位到约40单位的上限和约1单位到约2单位的下限的范围内的量的核酸酶。根据各种实施例,用于核酸测序的组合物可包含约0.1μm到约20μm(例如约1.0μm)的量的化学增强型测序引物。组合物可包含具有约10μm到约20μm的上限和约0.05μm到约0.1μm的下限的范围内的量的化学增强型测序引物。根据各种实施例,组合物可包含约20μm到约5000μm(例如约500μm)的量的dntp。组合物可包含具有约2000μm到约5000μm的上限和约20μm到约50μm的下限的范围内的量的dntp。根据各种实施例组合物可包含约0.03μm到约10μm(例如约3μm)的量的ddntp。组合物可包含具有约5μm到约10μm的上限和约0.01μm到约0.05μm的下限的范围内的量的ddntp。所有摩尔量都是以最终体积的最终浓度计。根据各种实施例,组合物可包含各约0.1μm到约20μm(例如约0.01μm或1.0μm)的量的一个或多个非核酸酶抗性扩增引物。组合物可包含具有各自从约10μm到约20μm的上限和各自从约0.05μm到约0.1μm的下限的范围内的量的一个或多个非核酸酶抗性扩增引物。所有摩尔量都是以最终体积的最终浓度计。根据各种实施例用于核酸测序的组合物可进一步包含pcr扩增产物。在一些实施例中,pcr扩增产物可包含经扩增的dna目标序列。在一些实施例中,pcr扩增产物可包含非核酸酶抗性扩增引物。非核酸酶抗性扩增引物可包含例如对由外切核酸酶进行的降解敏感的磷酸二酯键。在一些实施例中,pcr扩增产物可包含目标特异性扩增子,其合并有能够粘接到通用引物的核酸序列。试剂盒。本发明教示还涉及使用上述化学增强型引物组合物和方法的试剂盒。在一些实施例中,基本试剂盒可包含容器,其具有一种或多种如本发明中所描述的化学增强型引物。试剂盒还可以任选地包含使用说明书。所描述的试剂盒包括:聚合酶、核酸酶、至少一种脱氧核苷酸三磷酸酯和双脱氧核苷酸三磷酸酯。双脱氧核苷酸三磷酸酯可以是标记有染料标记的双脱氧核苷酸三磷酸酯。经染料标记的双脱氧核苷酸三磷酸酯可以是经荧光染料标记的双脱氧核苷酸三磷酸酯。在一些实施例中,核酸酶可选自外切核酸酶i、exoiii、pfu和dnapoli。在各种实施例中,试剂盒可包括如本发明中所描述的化学增强型引物。在其它实施例中,试剂盒可进一步包括多个核酸酶敏感性扩增引物。多个核酸酶敏感性扩增引物可经配置以激活特定疾病病况的相关序列。试剂盒中的多个核酸酶敏感性扩增引物可经配置以激活连接到特定疾病病况的一组序列。试剂盒还可以包含其它任选的试剂盒组分,如以下中的一种或多种:核酸酶、用于测序或片段分析的足够量的酶、用于促进测序反应或片段分析反应的缓冲液、dntp、经修饰的dntp、用于测序反应或片段分析反应期间的股延伸的dntp类似物和7-脱氮-dgtp、ddntp、染料标记、用于制备电泳用于测序或片段分析材料的负载溶液、作为模板对照物的基因组dna、用于确保材料在分离培养基中按预期迁移的尺寸标记物以及教导用户和限制使用错误的方案和手册。试剂盒中的各种试剂的量也可以取决于多种因素改变,例如最佳方法灵敏度。提供与自动检测器或分析器一起使用的用于手动应用的试剂盒或测试试剂盒属于这些教示内容的范围内。试剂盒可具有超过一种化学增强型引物,并且每种化学增强型引物中的ncm部分的数目可不同。用于质体测序的试剂盒可具有上文所列的组分中的任一种,但不包括核酸酶。实例。下文展示本发明教示内容的组合物和方法的实例。这些实例不限制本发明的教示内容,并且所属领域的一般技术人员将识别到反应中使用的组分可容易地用所属领域中已知的等效试剂替代。实例1间隔基+寡核苷酸序列合成,无硫代磷酸酯基团:使用标准胺基磷酸酯化学方法在abi型394dna合成器上制备在5′位置经一个或多个c6间隔基标记的18碱基型寡核苷酸。从chemgenescorp.(p/nclp-1120,wilmington,ma)获得c6间隔基胺基磷酸酯。用来自一个微摩尔管柱的完整三苯甲基制备经标记的18聚体。在合成完成时,寡核苷酸由nh4oh从支撑物裂解并且使用1.5ml/min的流动速率和0.1m乙酸三乙铵-水ph7.0和乙腈的溶剂梯度,使用abirp-300(c-8)管柱(4.6×220mm)通过hplc纯化,移除三苯甲基并且通过乙醇沉淀来分离产物。c3间隔基+寡核苷酸序列合成,无硫代磷酸酯基团:使用标准胺基磷酸酯化学方法在abi型394dna合成器上制备在5′位置经一个或多个c3间隔基(p/n10-1913-90,glenresearch)标记的18碱基型寡核苷酸。用来自一个微摩尔管柱的完整三苯甲基制备经标记的18聚体。在合成完成时,寡核苷酸由nh4oh从支撑物裂解并且使用1.5ml/min的流动速率和0.1m乙酸三乙铵-水ph7.0和乙腈的溶剂梯度,使用abirp-300(c-8)管柱(4.6×220mm)通过hplc纯化,移除三苯甲基并且通过乙醇沉淀来分离产物。经含有3′硫代磷酸酯键的一个或多个c-3间隔基标记的寡聚物的方案:使用标准胺基磷酸酯化学方法在abi型394dna合成器上制备在5′位置经一个或多个c-3间隔基标记的18碱基型寡核苷酸。用硫化剂(tetdp/n401267(appliedbiosystems,fostercity,ca),使用标准方法产生3′硫代磷酸酯键。由glenre研究(p/n10-1913-90)获得c3间隔基氨基磷酸酯。用来自一个微摩尔合成管柱的完整三苯甲基制备经标记的18聚体。在合成完成后,寡核苷酸由nh4oh从支撑物裂解并且使用1.5ml/min的流动速率和0.1m乙酸三乙铵-水ph7.0和乙腈的溶剂梯度,使用abirp-300(c-18)管柱(4.6×220mm)通过hplc纯化,移除三苯甲基并且通过乙醇沉淀来分离产物。注意事项:为了合成超过一个硫代磷酸酯键或将这个键置放于18聚体寡核苷酸链中的任何地方,使用硫化剂在这些位置进行氧化。实例2使用(也称为)传统的荧光染料终止子测序,使用来自ionampliseq全面癌症图v2(chpv2)和iononcomine癌症图(ocp)的初始经预先扩增的材料的次要部份(例如5%)进行后续(确认)分析。通过自动毛细电泳(ce)(如appliedbiosystems3500xl基因分析器)进行桑格测序和检测。肿瘤样品中基因突变(变异体)的分子分析变得越来越多地用于肿瘤表征和癌症患者的诊断和治疗性管理。通常,仅极有限量的肿瘤样品最初(即手术前)可供使用,例如通过福马林固定链烷烃嵌入型(ffpe)制剂中可疑的肿瘤组织或异常细胞丛集的细针穿刺活检。ionampliseqtm癌症图经设计以扩增来自少量输入dna(10ng)的许多致癌相关目标基因,以用于基于晶片的平台(例如iontorrentpgmtm仪器)上的后续测序。ionampliseqtmchpv2图涵盖207个基因座并且ocp图涵盖超过2000个目标。这些与基因座选择、扩增子尺寸和引物研究相关的图和披露内容进一步描述于2011年4月28日提交的美国申请案第61/479,952号;2011年9月6日提交的第61/531,583号;2011年9月6日提交的第61/531,574号;2011年9月22目提交的第61/538,079号;2011年11月29日提交的第61/564,763号;2011年12月20日提交的第61/578,192号;2012年2月2日提交的第61/594,160号;2012年2月14日提交的第61/598,881号;2012年2月14日提交的第61/598,892号;2012年4月17日提交的第61/625,596号;2012年4月26日提交的第61/639,017号;2012年4月27日提交的第13/458,739号;2012年10月29日提交的第13/663,334号;2012年11月16日提交的第13/679,706号;以及在同一日期提交的代理人案号lt00974pro的名称为《目标核酸的检测、鉴别、验证和富集(detection,identification,validation,andenrichmentoftargetnucleicacids)》的申请案中;并且所有披露内容以全文引用的方式并入本文中。偶尔,需要用正交方法(如传统桑格测序)确认由下一代测序(ngs)平台获得的测序结果。如果按孟德尔方式(mendelianfashion)遗传,当次要变异体(即编码或功能相关核苷酸变异体)不以如所预期的50%频率,而是以更低的频率(即5-25%之间,其通常在体细胞突变时发生,即自发发生或致病或促使癌发生的突变事件)产生时指示这类反映测试。对于单个目标的一对正向和反向桑格测序反应,通常需要5ng基因组dna,其可快速耗尽可从临床样本获得的量。因此,需要由ampliseq反应进行目标序列的富集、预先扩增、合并以用于桑格式再测序。通常设置以20μl的反应体积进行ampliseqtm预先扩增反应。在引物微调步骤(参见图1)之前移除1μl(即5%)这一材料的等分试样作为用于通过桑格测序进行的反映测试的潜在保留物不会对ngs测序文库制备过程中的后续步骤造成不利。或者,用户可设置具有21-22μl体积的初始ampliseqtm反应并且接着在预先扩增移除1μl之后。用于ampliseqtm反应的人类dna的典型输入量是10ng,其等效于3000个基因体复本或1500个细胞。预先扩增条件是:表2.dna类型chpv2ocp1和2经纯化的gdna17个循环15个循环ffpedna20个循环18个循环表1:用于ampliseq图的预先扩增环的次数和使用的材料。循环条件是:对于表1中展示的循环的数目,99℃2分钟(1×),接着[99℃,15秒,60℃4分钟]预先扩增材料来源于3个dna来源:80:20是2种corielldna的混合物(80%:20%)ffpe1(从ffpe样品本“1”提取的dna)ffpe5(从ffpe样本“5”提取的dna)预先扩增材料的1μl等分试样(pa)在1mlte缓冲液中以1∶1000稀释。假设预先扩增pcr反应中的100%功效,可计算用于桑格测序的后续pcr反应(bddpcr)的目标数目表3.由于预先扩增反应,存在足够的可用于反映测试的目标材料。先前目标有限样品不再受限制。除桑格测序以外,也可能可以使用其它检测方法,包括(但不限于)数字pcr、cast-pcr或其它等位基因特异性pcr方法、单个碱基延伸化学方法和检测(通过ce或质谱进行)。此外,可设计信息性或可行目标(例如tp53、kras、braf、egfr等)的图,其可通过作为后续普通测序之前的第一步骤桑格测序分析或通过桑格测序(或另一方法)独占地使用。所使用的pcr引物:针对单一pcr的一般适合性来评估chpv2图的扩增子和引物序列。由这一列表,总共48个目标(包括18个“困难”目标,其具有gc富集区域、短扩增子区域、均聚物a或均聚物t延伸)和其相应的pcr引物对,并且将m13正向序列(tgtaaaacgacggccagt)添加到ampliseq正向引物的5′端和将m13反向序列(caggaaacagctatgacc)添加到ampliseq反向引物的5′端。这些是用于本发明中所描述的方法中的核酸酶敏感性扩增引物。引物资料列举于本章节后的表8中。传递引物以100μm的浓度再悬浮于水中。通过组合10μl每个相应的(正向和反向)引物对并且接着用80μl低te稀释到100μl使得配对中的引物达到10μm的浓度来产生引物对(pp)主培养盘。主培养盘上引物对的定向如下:培养盘上的引物布局表4.由pp主培养盘,通过将10μm储备引物对在低te中进一步稀释到1μm并且将10μl稀释物按以下组成涂布到两组96孔盘(chpv2a和b)中来产生测试培养盘:表5.因此每个盘含有24个一致引物对的4个部分,使得可处理4个样品,其通常是:i)ceph-1347基因组dna(在te中稀释到1ng/μl的来自bigdyedirect测序试剂盒的对照性dna);这一样品通常位于管柱1-3中ii)na80:20材料(在chpv2或ocp(1和2)中预先扩增)始终位于管柱4-6中。iii)ffpe1材料(在chpv2或ocp(1和2)预先扩增)位于管柱7-9中iv)ffpe5材料(在chpv2或ocp(1和2)中预先扩增)位于管柱10-12中引物在盘上现场干燥并且接着在2周内用于使用直接测序试剂盒进行的pcr测序实验,其包括用于pcr扩增的试剂和后续循环测序化学物质。直接测序试剂盒使用经m13标记的pcr引物。这因为在后续测序反应中使用化学增强型引物(如上文章节中所描述)作为测序引物并且具有m13正向或反向序列而是有利的。这允许几乎在pcr扩增子的5′端立即进行序列读取。这最大化重要的序列信息,因为ampliseq引物由于大量分段ffpedna的短性质而被设计成极短(125-175nt)。在pcr之后,将直接测序试剂与化学增强型测序引物一起现场添加到扩增混合物中的扩增反应产物中。这种试剂不仅含有循环测序所需的典型试剂(聚合酶、dntp和经染料标记的ddntp),而且还含有核酸酶以通过现场移除过量扩增引物来去除对其它纯化操作的需要。表6.pcr和测序条件向测试盘(含有经排列的干燥引物对)中的3个管柱a-h(24个孔)中的每个孔中添加13μlveritifast热循环仪中的pcr:i:94℃10min(1x)ii:95℃3sec,60℃15sec,68℃45sec(8个循环)iii:95℃3sec,70℃50sec(28个循环)制备2种测序混合物:f(正向)和r(反向)表7.向新制的fastpcr盘中的每个孔中添加2μl正向测序混合物添加6.3μl来自pcr盘的pcr材料:正向seq向pcr盘(剩余约6.3μlpcr材料)的其余部分添加2μl反向测序混合物:反向seqveritifast热循环仪中的pcr:37℃20min(1x)80℃2min(1x)95℃1min(1x)95℃3sec;50℃5sec;60℃45sec(27个循环)通过添加55μlxterminator珠粒溶液混合物,接着剧烈涡旋30分钟以移除较小的分子污染物来纯化测序反应物。在珠粒旋转到孔的底部之后,将培养盘置放于appliedbiosystems3500xlgenetic分析器中以用于毛细电泳和序列碱基识别。用appliedbiosystemssequencescanner软件评估所得.ab1测序档案的质量并且接着使用appliedbiosystemsvariantreporter软件进一步分析以进行变异体的检测。图1展示通过桑格再测序和在具体直接测序技术中进行的校验分析的特定目标。chpv.2表明这些基因座是ionampliseqtmcancerhotspotpanelv.2的一部分并且ocp表明所指示的基因座是iononcominetm癌症图的一部分。图1展示对ionpgmtm(318个晶片)使用ionampliseq方法,所发现的由三个样品产生的变异体。第二栏表示在特定样品中发现的变异体的数目。对于特定基因座,右边的其余栏表示所观察的变异型序列的百分比。图1展示在使用本发明的方法经由桑格测序进行再测序时,由与图6相同的三个样品发现的变异型序列的校验。研究相同基因座并且确认变异体。图8a-8b是图5的chpv2pa的targetsangerce测试集a的qualitygrid的示意性图示(如在appliedbiosystemsvariantreportertm软体中所见)。图8a的下部在图8b中以更大的比例再现,并且说明对于由ampliseq到桑格测序的工作流获得的四个极具限制性的初始样品中的每一个,96个所得扩增子中的88个具有2x覆盖度(正向/反向),并且8个具有1x覆盖度。不存在脱扣。向右的箭头表示成功的正向延伸产物制备并且向左的箭头表示成功的反向延伸产物制备。图8a-8b是图5的chpv2pa的targetsangerce测试集b的qualitygrid的示意性图示(如在appliedbiosystemsvariantreportertm软体中所见)。图8a的下部在图9b中以更大的比例再现,并且说明对于由ampliseq到桑格测序的工作流获得的四个极具限制性的初始样品中的每一个,96个所得扩增子中的93个具有2x覆盖度(正向/反向),并且3个具有1x覆盖度。不存在脱扣。向右的箭头表示成功的正向延伸产物制备并且向左的箭头表示成功的反向延伸产物制备。图1展示电泳图,其说明检测样品ffpe-5的alk-2中的次要变异体的测序结果。左图(正向序列)和右图(反向序列)中的箭头明确展示在主要变异体信号峰下的大量次要变异体,其通过kbtm碱基识别可称为混合碱基。可比较这一目测比率与使用iontorrentsuitetm软体获得的所提供的ampliseq衍生结果的比率以分析次要与主要的比率,其指配次要变异体的比率是26.8%。图1展示电泳图,其说明检测样品na8020的egfr-6中的次要变异体的测序结果。左图(正向序列)和右图(反向序列)中的箭头明确展示在主要变异体信号峰下的可检测量的次要变异体,其通过kbtm碱基识别不可称为混合碱基。可比较这一目测比率与使用iontorrentsuitetm软体获得的所提供的ampliseq衍生结果的比率以分析次要与主要的比率,其指配次要变异体的比率是9.6%。图1是由对ionpgmtm(318晶片)使用ocpampliseqtm的三个样品的测序发现的tp53突变的出现频率的示意图。图1是图12的再测序样品的示意图,使用本发明的方法验证图12中展示的tp53突变。图8a-8b展示四个样品的来自ocpampliseqtm的24个tp53个别扩增子的qualitygrid(如在appliedbiosystemsvariantreportertm软件中所见)。图8a的下部在图14b中以更大的比例再现,并且说明对于由ampliseqtm到桑格测序的工作流获得的四个极具限制性的样品中的每一个,96个扩增子中的94个具有完全2x覆盖度(正向/反向)。不存在脱扣。向右的箭头表示成功的正向延伸产物制备并且向左的箭头表示成功的反向延伸产物制备。图1展示检测样品ffpe5的tp53中次要变异体的测序结果的电泳图.左图(正向序列)和右图(反向序列)中的箭头明确展示在主要变异体信号峰下的可检测量的次要变异体。可比较这一目测比率与使用iontorrentsuitetm软体获得的所提供的ampliseq衍生结果的比率以分析次要(c)与主要(t)的比率,其指配次要变异体的比率是17.9%。图1展示在与图15中所展示不同的位置检测tp53中的次要变异体的测序结果的电泳图,例如ffpe5。左图(正向序列)和右图(反向序列)中的箭头明确展示在主要变异体信号峰下的可检测量的次要变异体。可比较这一目测比率与使用iontorrentsuitetm软体获得的所提供的ampliseq衍生结果的比率以分析次要(c)与主要(t)的比率,其指配次要变异体的比率是21.8%。图1展示在与图15中所展示不同的第三位置检测tp53中的次要变异体的测序结果的电泳图,例如ffpe5。左图(正向序列)和右图(反向序列)中的箭头明确展示在主要变异体信号峰下的可检测量的次要变异体。可比较这一目测比率与使用iontorrentsuitetm软体获得的所提供的ampliseq衍生结果的比率以分析次要(c)与主要(g)的比率,其指配次要变异体的比率是20.2%。实例3毛细电泳样品制备和检测通过如所属领域的技术人员已知的解析核碱基序列的方法来分析经扩增的样品。举例来说,可以遵循仪器制造商的指导使用毛细管电泳。bigdyexterminator纯化试剂盒(appliedbiosystems,p/n4376486)可用于循环测序清理以防止未合并的经染料标记的终止子、dntp和盐与经染料标记的延伸产物共同注射到毛细电泳dna分析器中。简单来说,13μl测序反应混合物与45μlsam溶液和10μlxterminator溶液组合。在样品盘在1800rpm下涡旋20分钟之后,样品盘在1000xg下旋转2分钟。向每个孔中添加30μl70%乙醇并且盘在1650xg下离心15分钟。通过将盘倒置在纸巾上并且在180xg下离心1分钟来移除溶液。接着沉淀的测序反应溶解于10μl50μmedta中并且装载到配备有50em毛细管阵列的ab3500xl基因分析器(appliedbiosystems,fostercity,california)上。实例4毛细电泳方法和分析使用如仪器用户指南所描述的染料集合z,用现有appliedbiosystems仪器,例如appliedbiosystems3500x1基因分析器进行毛细电泳(ce)。存在shortreadseq_bdx_pop7、rapidseq_bdx_pop7、fastseq_bdx_pop7、stdseq_bdx_pop7操作模块。举例来说,bdxfastseq50_pop7xl_1参数是:烘箱温度:60℃,在60℃的操作温度下,在效能最佳化聚合物(pop-7tm聚合物)中,样品注射在1.6kv下进行5秒并且电泳在13.4kv下进行2520秒。其它ce仪器(如3500或3730xl基因分析器)的仪器参数(例如注射条件)的变化不同。使用对不同仪器具有特异性的版本的appliedbiosystems资料收集软件(如3500资料收集软件v1.0)来收集资料。用kb_3500_pop7_bdtv3direct.bcc和kb_3500_pop7_bdtv3direct.mob,通过appliedbiosystemskbtm碱基识别软件v1.4.1分析序列轨迹以测定正确的碱基识别。所属领域的技术人员了解,所使用的检测技术通常不是限制性的。实际上,各种检测手段都在所公开的方法和试剂盒的范围内,其限制条件为它们允许有待测定的扩增子的存在或不存在。虽然已经结合特定实施例描述了本发明的原理,但是应明确了解,这些描述仅仅是为了举例并且并不打算限制本发明的范围。已经出于说明和描述的目的提供了本文中已经公开的内容。这并不打算是穷尽性的或将本发明限制为所述的精确形式。许多修改以及变化对于所属领域的技术人员来说将是显而易见的。选择并描述所公开的内容以便最佳地解释所述领域所公开的实施例的原理和实际应用,由此使得所属领域的其它技术人员能够了解适合于所涵盖的具体用途的各个实施例和各种修改。公开内容的范围打算由以下权利要求书和其等效物限定。表8.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1