肠道病毒71型的新型病毒样颗粒、其制备方法及应用与流程
本发明属于生物医药领域,具体地说,本发明涉及肠道病毒71型的新型病毒样颗粒、其制备方法及应用。
背景技术:
肠道病毒71型(enterovirus71,ev71)是小rna病毒科肠道病毒属的成员之一,是无包膜的单正链rna病毒。成熟ev71病毒的衣壳由60个拷贝的vp1、vp2、vp3和vp4组成。
ev71是引起手足口病的最主要病原体。虽然ev71感染通常表现为轻微的自限性疾病,但也可能导致严重的神经系统并发症,如脑干脑炎、脊髓灰质炎样瘫痪和肺水肿等症状,甚至是死亡。ev71病毒样颗粒(virus-likeparticles,vlp)作为一种候选疫苗,已经在昆虫细胞表达系统和酵母表达系统中表达出来,大量临床前试验都证实了其可以在动物模型上诱导中和性抗体产生,并能提供保护来抵抗致死剂量的病毒感染。
为了尽快的将ev71病毒样颗粒推向临床应用,本领域技术人员致力于降低ev71病毒样颗粒的制备成本,以及降低ev71病毒样颗粒的临床应用风险。
技术实现要素:
本发明的目的在于提供一种肠道病毒71型的新型病毒样颗粒、其制备方法及应用。
本发明的第一方面,提供了一种肠道病毒71型病毒样颗粒,所述病毒样颗粒包括截短的vp1蛋白,与对应的野生型vp1蛋白相比,所述截短的vp1蛋白中至少截掉了野生型vp1蛋白的第x位至第y位氨基酸残基,其中,x为1~8之间的正整数,y为2~73之间的正整数。
在另一优选例中,x为1~8之间的正整数,如1、2、3、4、5、6、7、或8。
在另一优选例中,y为15~45之间的正整数。
在另一优选例中,y为20~73之间的正整数,如20、25、30、35、或40。
在另一优选例中,所述x为4。
在另一优选例中,所述y为30。
在另一优选例中,所述野生型vp1蛋白的氨基酸残基编号依据seqidno.3。
本发明的第二方面,提供了一种多核苷酸,所述多核苷酸包括编码本发明第一方面所述的病毒样颗粒的外壳蛋白的多核苷酸序列。
在另一优选例中,所述多核苷酸序列包括编码所述截短的vp1蛋白的多核苷酸序列。
在另一优选例中,所述截短的vp1蛋白的多核苷酸序列如seqidno.6所示。
本发明的第三方面,提供了一种表达载体,其特征在于,所述表达载体含有本发明第二方面所述的多核苷酸。
本发明的第四方面,提供了一种基因工程细胞,所述基因工程细胞表达本发明第一方面所述的肠道病毒71型病毒样颗粒,或者所述的基因工程细胞含有本发明第三方面所述的表达载体,或者在基因组中整合有本发明第二方面所述的多核苷酸。
在另一优选例中,所述基因工程细胞为真核细胞,并且所述细胞的基因组中整合有肠道病毒71型外壳蛋白的表达盒;或者所述细胞中含有表达载体,所述表达载体含有肠道病毒71型外壳蛋白的表达盒;
所述基因工程细胞在胞内表达所述肠道病毒71型外壳蛋白,且所述外壳蛋白自组装形成所述病毒样颗粒(vlp)。
在另一优选例中,所述细胞为酵母细胞,优选为毕赤酵母细胞。
在另一优选例中,所述的表达盒包括5'至3'可操作地连接的以下元件:启动子、起始密码子、所述外壳蛋白的orf序列和终止密码子。
本发明的第五方面,提供了一种药物组合物,所述的组合物含有本发明第一方面所述的病毒样颗粒(vlp)、本发明第二方面所述的多核苷酸或者本发明第三方面所述的表达载体或者本发明第四方面所述的基因工程细胞,以及药学上可接受的载体和/或辅料。
在另一优选例中,所述药物组合物包括疫苗组合物。
在另一优选例中,所述的疫苗组合物还含有佐剂。
在另一优选例中,所述的佐剂包括氧化铝、皂苷、quila、胞壁酰二肽、矿物油或植物油、基于囊泡的佐剂、非离子嵌段共聚物或deae葡聚糖、细胞因子(包括il-1、il-2、ifn-r、gm-csf、il-6、il-12、和cpg)。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1.ev71的3cd和vp1部分截短的p1蛋白在毕赤酵母中的共表达。(a)本研究中所使用的质粒示意图。trp2-l和trp2-r,trp区的上游和下游区域;paox1,醇氧化酶启动子;cyc1tt,cyc1转录终止区;ade2,磷酸核糖酰氨基咪唑羧化酶,用作筛选标记;vp1δ10-x,删掉vp1的第10位至第x位碱基。(b)ev71抗原在不同酵母克隆中的表达水平。不同酵母克隆的裂解液通过elisa法测定ev71抗原含量,通过bradford法测定总的可溶性蛋白(totalsolubleprotein,tsp)。空载体转化的酵母菌的裂解液来作为阴性对照(negativecontrol,ctr)。数据为三个复孔的平均值±sd。(c)抗vp0多抗作为检测抗体来进行westernblotting检测。(d)抗vp1多抗作为检测抗体来进行westernblotting检测。lane1,空载体转化的酵母菌;lane2,ye003转化的酵母菌;lane3,ye010转化的酵母菌;lane4,ye011转化的酵母菌。
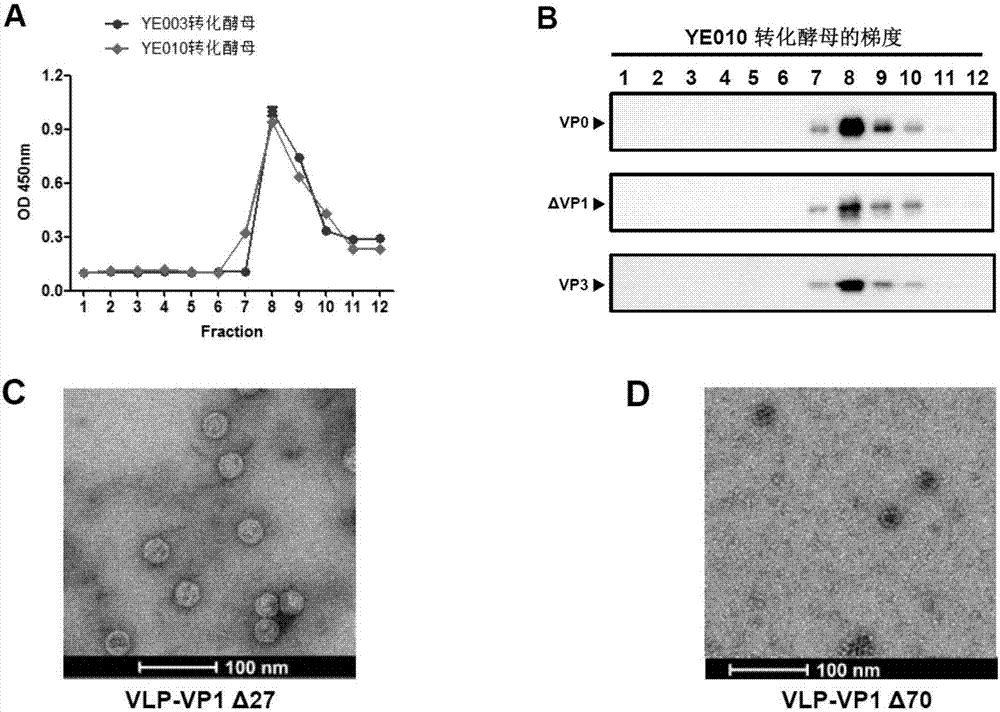
图2.vp1部分截短的vlps组装的鉴定。(a-b)蔗糖梯度分析。ye010重组酵母菌的裂解液进行蔗糖梯度超离,每个样品从顶部到底部收取12个梯度组份。然后这些梯度组分通过(a)elisa和(b)分别用抗vp0、抗vp1或抗vp3的抗体进行westernblotting来分析。(c-d)vp1部分截短的vlps的电镜分析。vlp-vp1δ27,vp4蛋白截短27aa形成的vlps;vlp-vp1δ70,vp1蛋白截短70aa形成的vlps。bar=100nm。
图3.vlp-vp1δ27在小鼠中诱导出高滴度的中和抗体。(a)vlp-vp1δ27的sds-page分析。vlp-fl,全长的vlps。(b)老鼠免疫后的ev71特异性的抗体反应。3组老鼠(每组6只)在第0周和第3周分别腹腔注射1ug/1剂的vlp-fl、vlp-vp1δ27或pbs。在第5周收集血清,用昆虫细胞来源的vlps作为包被抗原进行elisa试验来检测ev71特异性的抗体反应。抗血清1:1000稀释,用于elisa检测。每个符号代表一只老鼠,横线代表该组的几何平均值。(c)中和试验测定抗血清的中和滴度。对照抗原免疫老鼠的抗血清在最低稀释度1:16时没有显示任何中和活性,为了计算几何平均值,对照组的中和滴度定义为8。每个符号代表一只老鼠,横线代表该组的几何平均值。
图4.vlp-vp1δ27的母源免疫能保护幼鼠抵抗ev71的腹腔攻毒。(a-b)免疫vlp-fl、vlp-vp1δ27或pbs的母鼠生下的小鼠7日龄时腹腔注射ev71/mav-w。然后攻过毒的老鼠连续14天每天监测其(a)存活率和(b)临床症状。临床症状的评定标准为:0级,健康;1级,反应迟缓;2级,平衡失调,肌无力;3级,瘫痪;4级,死亡。每组老鼠的数量都标在括号里面。
具体实施方式
本发明人通过广泛而深入的研究,意外地发现,将肠道病毒71型vp1蛋白进行特定截短后,仍能够获得肠道病毒71型的新型病毒样颗粒,且该病毒样颗粒仍然具有较强的免疫原性强、而且显示了良好的特异性,能够显著降低临床应用的风险。在此基础上,完成了本发明。
在描述本发明之前,应当理解本发明不限于所述的具体方法和实验条件,因为这类方法和条件可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且不意图是限制性的,本发明的范围将仅由所附的权利要求书限制。
除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
虽然在本发明的实施或测试中可以使用与本发明中所述相似或等价的任何方法和材料,本文在此处例举优选的方法和材料。
肠道病毒71型及其病毒样颗粒
在过去的几年间,手足口病在亚太地区广泛流行,每年影响数百万儿童的身体健康。肠道病毒71型(enterovirus71,ev71)是引起手足口病的最主要的病原体之一。ev71感染有时会导致严重的神经系统并发症,甚至是死亡。
ev71病毒样颗粒(virus-likeparticles,vlps)作为一种候选疫苗,已经被大量试验证明其有效性。
ev71vlps由vp0、vp1和vp3三种结构蛋白组成,其中vp0蛋白包括vp2和vp4两部分。关于ev71vlps的制备,在外源表达系统中同时表达结构蛋白前体p1蛋白和蛋白酶3cd,3cd蛋白酶会切割p1蛋白形成vp0、vp1和vp3三种单体蛋白,60个拷贝的vp0、vp1和vp3会进一步自发组装成类似病毒构象的颗粒,即vlps。
在本发明的一个优选的实施方式中,ev71病毒样颗粒涉及的各蛋白的氨基酸序列如下:
vp2序列:
spsaeacgysdrvaqltignstittqeaaniivgygewpsycsdsdatavdkptrpdvsvnrfytldtklweksskgwywkfpdvltetgvfgqnaqfhylyrsgfcihvqcnaskfhqgallvavlpeyvigtvaggtgtedshppymqtqpgadgfelqhpyvldagipisqltvcphqwinlrtnncatiivpyinalpfdsalnhcnfgllvvpispldydqgatpvipititlapmcsefaglrqavtq(seqidno.1)
vp3序列:
gfptelkpgtnqflttddgvsapilpnfhptpcihipgevrnllelcqvetilevnnvptnatslmerlrfpvsaqagkgelcavfradpgrngpwqstllgqlcgyytqwsgslevtfmftgsfmatgkmliaytppggplpkdratamlgthviwdfglqssvtlvipwisnthyrahardgvfdyyttglvsiwyqtnyvvpigapntayiialaaaqknftmklckdasdilqtgtiq(seqidno.2)
vp4序列:
mgsqvstqrsgshensnsategstinyttinyykdsyaatagkqslkqdpdkfanpvkdiftemaaplk(seqidno.4)。
vp1序列:
gdrvadviessigdsvsraltqalpaptgqntqvsshrldtgkvpalqaaeigassnasdesmietrcvlnshstaettldsffsraglvgeidlplegttnpsgyanwdiditgyaqmrrkvelftymrfdaeftfvactptgqvvpqllqymfvppgapkpdsreslawqtatnpsvfvklsdppaqvsvpfmspasayqwfydgyptfgehkqekdleygacpnnmmgtfsvrtvgtskskyplvvriymrmkhvrawiprpmrnqnylfkanpnyagnsikptgtsrtaittl(seqidno.3)
为了降低vlp的制备成本和临床应用风险,本发明人分别对形成vlp的不同蛋白进行截短,来探究其对vlps组装和免疫原性的影响。本发明人的结果显示,针对vp1蛋白截短4-30位氨基酸(aminoacid,aa)后,vlps依然能组装,并且颗粒的大小、形态与全长vlps的相似。本发明人评价了vp1截短版本的vlps的免疫原性和体内保护效果。结果显示,截短的vlps诱导了和全长vlps水平相当的总igg反应和中和抗体反应。而且母源免疫/攻毒试验也证实了根据本发明的截短版本的vlps可以提供和全长vlps相似的体内保护效果。综上所述,这些结果证实vp1蛋白截短4-30位aa没有影响到ev71vlps的组装、免疫原性和疫苗效果。而采用相同的方法对vp1蛋白截短4-73位氨基酸后,却对vlps的组装和构象产生了影响。本发明的结果表明,包含截短4-30位aa的vp1蛋白的vlp保留了原始的组装和构象,并具有显著的免疫原性,采用截短的vp1蛋白还能够降低vlp的临床应用风险。
在本发明的一个优选的实施方式中,所述vp1蛋白的编码基因如下,其中下划线部分为本发明中截除的编码基因序列:
ggcgaccgggtggccgatgtgatcgagagcagcatcggcgacagcgtgtccagagccctgacacaggccctgcctgcccccaccggacagaacacacaggtgtccagccacagactggacaccggcaaggtgccagccctgcaggccgccgagatcggcgccagcagcaatgccagcgacgagagcatgatcgagacaagatgcgtgctgaacagccacagcaccgccgagacaaccctggacagcttcttcagcagagccggcctggtgggagagatcgacctgcccctggaaggcaccaccaaccccagcggctacgccaactgggacatcgacatcaccggctacgcccagatgcggcggaaggtggaactgttcacctacatgagattcgacgccgagttcaccttcgtggcctgcacccctaccggccaggtggtgcctcagctgctgcagtacatgttcgtgccccctggcgcccctaagcccgacagcagagaaagcctggcctggcagaccgccaccaacccttccgtgttcgtgaagctgagcgacccccctgcccaggtgtccgtgcctttcatgagccccgccagcgcctaccagtggttctacgacggctaccccaccttcggcgagcacaagcaggaaaaggacctggaatacggcgcctgccccaacaacatgatgggcaccttcagcgtgcggaccgtgggcaccagcaagagcaagtaccccctggtggtgcggatctacatgcggatgaagcacgtgcgggcctggatccccagacccatgcggaaccagaactacctgttcaaggccaaccccaactacgccggcaacagcatcaagcccaccggcaccagccggaccgccatcaccacactg(seqidno.6)
基因工程细胞
本发明提供了一种基因工程细胞,所述基因工程细胞表达根据本发明的肠道病毒71型病毒样颗粒。
在另一优选例中,所述基因工程细胞为真核细胞,并且所述细胞的基因组中整合有肠道病毒71型外壳蛋白的表达盒;或者所述细胞中含有表达载体,所述表达载体含有肠道病毒71型外壳蛋白的表达盒;
所述基因工程细胞在胞内表达所述肠道病毒71型外壳蛋白,且所述外壳蛋白自组装形成病毒样颗粒(vlp)。
在另一优选例中,所述细胞为酵母细胞,优选为毕赤酵母细胞。
在另一优选例中,所述的表达盒包括5'至3'可操作地连接的以下元件:启动子、起始密码子、所述外壳蛋白的orf序列和终止密码子。
本发明中,术语“可操作地连接”意指这样的构型,其中将调控序列置于相对于多核苷酸的编码序列的适当位置,使得调控序列指导编码序列的表达。
在本发明的一个优选的实施方式中,所述基因工程细胞中含有如下的经密码子优化的多核苷酸序列,该序列编码肠道病毒71型p1蛋白:
atgggcagccaggtgtccacccagagaagcggcagccacgagaacagcaacagcgccaccgagggcagcaccatcaactacaccaccatcaattactacaaggacagctacgccgccaccgccggcaagcagagcctgaagcaggaccccgacaagttcgccaaccccgtgaaggacatcttcaccgagatggctgcccccctgaagtcccctagcgccgaggcctgcggctacagcgatagagtggcccagctgaccatcggcaactccaccatcaccacccaggaagccgccaacatcatcgtgggctacggcgagtggccctcctactgcagcgattccgatgccaccgccgtggacaagcccaccagacccgacgtgtccgtgaaccggttctacaccctggacaccaagctgtgggagaagtccagcaagggctggtactggaagttccccgacgtgctgaccgagacaggcgtgttcggccagaacgcccagttccactacctgtatagaagcggcttctgcatccacgtgcagtgcaacgccagcaagttccaccagggagccctgctggtggccgtgctgcctgagtacgtgatcggcaccgtggctggcggcaccggcacagaggatagccaccccccctacatgcagacccagcctggcgccgatggcttcgagctgcagcacccctatgtgctggacgccggcatccccatcagccagctgaccgtgtgcccccaccagtggatcaacctgcggaccaacaactgcgccacaatcatcgtgccctacatcaacgccctgcccttcgacagcgccctgaaccactgcaacttcggactgctggtggtgcccatcagccccctggactacgatcagggcgccacccccgtgatccccatcaccatcaccctggcccccatgtgcagcgagttcgccggactgagacaggccgtgacccagggcttccccaccgagctgaagcccggcaccaaccagtttctgaccaccgacgacggcgtgtccgcccccatcctgcccaacttccaccccaccccctgcatccacatccccggcgaagtgcggaacctgctggaactgtgccaggtggaaaccatcctggaagtgaacaacgtgcccaccaacgccaccagcctgatggaacggctgcggttccctgtgtccgcccaggccggaaagggcgagctgtgcgccgtgttcagagccgaccccggcagaaacggcccctggcagtctacactgctgggccagctgtgcggctactacacccagtggtccggatctctggaagtgaccttcatgttcaccggcagcttcatggccaccggcaagatgctgatcgcctacacccctcctggcggccctctgcccaaggacagagccacagccatgctgggcacccacgtgatctgggacttcggcctgcagagcagcgtgaccctggtgatcccctggatcagcaacacccactaccgggcccacgcccgggacggcgtgttcgactactacaccacaggcctggtgtccatctggtatcagaccaactacgtggtgcctatcggagcccccaacaccgcctacatcattgccctggccgctgcccagaaaaacttcaccatgaagctgtgcaaggacgccagcgacatcctgcagaccggcaccatccagggcgaccgggtggccgatgtgatcgagagcagcatcggcgacagcgtgtccagagccctgacacaggccctgcctgcccccaccggacagaacacacaggtgtccagccacagactggacaccggcaaggtgccagccctgcaggccgccgagatcggcgccagcagcaatgccagcgacgagagcatgatcgagacaagatgcgtgctgaacagccacagcaccgccgagacaaccctggacagcttcttcagcagagccggcctggtgggagagatcgacctgcccctggaaggcaccaccaaccccagcggctacgccaactgggacatcgacatcaccggctacgcccagatgcggcggaaggtggaactgttcacctacatgagattcgacgccgagttcaccttcgtggcctgcacccctaccggccaggtggtgcctcagctgctgcagtacatgttcgtgccccctggcgcccctaagcccgacagcagagaaagcctggcctggcagaccgccaccaacccttccgtgttcgtgaagctgagcgacccccctgcccaggtgtccgtgcctttcatgagccccgccagcgcctaccagtggttctacgacggctaccccaccttcggcgagcacaagcaggaaaaggacctggaatacggcgcctgccccaacaacatgatgggcaccttcagcgtgcggaccgtgggcaccagcaagagcaagtaccccctggtggtgcggatctacatgcggatgaagcacgtgcgggcctggatccccagacccatgcggaaccagaactacctgttcaaggccaaccccaactacgccggcaacagcatcaagcccaccggcaccagccggaccgccatcaccacactg(seqidno.5),
其中,vp1蛋白的编码基因为第1696-第2586位;vp2蛋白的编码基因为第208-第969位;vp3蛋白的编码基因为第970-第1695位;vp4蛋白的编码基因为第1-第207位。
组合物和施用方法
本发明还提供了一种组合物,它含有:(i)本发明的重组病毒样颗粒(vlp)或本发明的可编码重组病毒样颗粒的多核苷酸,以及(ii)药学上或免疫学上可接受的赋形剂或佐剂。
本发明中,术语“含有”表示各种成分可一起应用于或存在于本发明的组合物中。因此,术语“主要由...组成”和“由...组成”包含在术语“含有”中。
本发明的组合物包括药物组合物和疫苗组合物。
本发明的组合物可以是单价的(仅含有一种重组病毒样颗粒或多核苷酸),也可以是多价的(含有多种重组病毒样颗粒或多核苷酸)。
本发明的药物组合物或疫苗组合物可制备成各种常规剂型,其中包括(但并不限于):注射剂、粒剂、片剂、丸剂、栓剂、胶囊、悬浮液、喷雾剂等。
(1)药物组合物
本发明的药物组合物包含(或含有)治疗有效量的本发明重组病毒样颗粒或多核苷酸。
本文所用的术语“治疗有效量”指治疗剂治疗、缓解或预防目标疾病或状况的量,或是表现出可检测的治疗或预防效果的量。该效果可通过例如抗原水平来检测。治疗效果也包括生理性症状的减少。对于某一对象的精确有效量取决于该对象的体型和健康状况、病症的性质和程度、以及选择给予的治疗剂和/或治疗剂的组合。因此,预先指定准确的有效量是没用的。然而,对于某给定的状况而言,可以用常规实验来确定该有效量。
为了本发明的目的,有效的剂量为给予个体约0.001毫克/千克至1000毫克/千克,较佳地约0.01毫克/千克至100毫克/千克体重的重组病毒样颗粒。
药物组合物还可含有药学上可接受的载体。术语“药学上可接受的载体”指用于治疗剂(例如本发明的重组病毒样颗粒)给药的载体。该术语指这样一些药剂载体:它们本身不诱导产生对接受该组合物的个体有害的抗体,且给药后没有过分的毒性。合适的载体可以是大的、代谢缓慢的大分子,如蛋白质、多糖、聚乳酸(polylacticacid)、聚乙醇酸等。这些载体是本领域普通技术人员所熟知的。在remington’spharmaceuticalsciences(mackpub.co.,n.j.1991)中可找到关于药学上可接受的载体或赋形剂的充分讨论。
组合物中药学上可接受的载体可包括液体,如水、盐水、甘油和乙醇。另外,这些载体中还可能存在辅助性的物质,如润湿剂或乳化剂、ph缓冲物质等。通常,可将组合物制成可注射剂,例如液体溶液或悬液;还可制成在注射前适合配入溶液或悬液、液体赋形剂的的固体形式。脂质体也包括在药学上可接受的载体的定义中。
(ii)疫苗组合物
本发明的疫苗(组合物)可以是预防性的(即预防疾病)或治疗性的(即在患病后治疗疾病)。
这些疫苗包含免疫性抗原(包括本发明重组病毒样颗粒),并且通常与“药学上可接受的载体”组合,这些载体包括本身不诱导产生对接受该组合物的个体有害的抗体的任何载体。合适的载体通常是大的、代谢缓慢的大分子,如蛋白质、多糖、聚乳酸、聚乙醇酸、氨基酸聚合物、氨基酸共聚物、脂质凝集物(如油滴或脂质体)等。这些载体是本领域普通技术人员所熟知的。另外,这些载体可起免疫刺激剂(“佐剂”)作用。另外,抗原也可以和细菌类毒素(如白喉、破伤风、霍乱、幽门螺杆菌等病原体的类毒素)偶联。
增强免疫组合物效果的优选佐剂包括但不限于:(1)铝盐(alum),如氢氧化铝、磷酸铝、硫酸铝等;(2)水包油型乳剂配方,例如,(a)mf59(参见wo90/14837),(b)saf,和(c)ribitm佐剂系统(ras)(ribiimmunochem,hamilton,mt),(3)皂素佐剂;(4)freund完全佐剂(cfa)和freund不完全佐剂(ifa);(5)细胞因子,如白介素(如il-1、il-2、il-4、il-5、il-6、il-7、il-12等)、干扰素(如γ干扰素)、巨噬细胞集落刺激因子(m-cfs)、肿瘤坏死因子(tnf)等;(6)细菌adp-核糖基化毒素(如大肠杆菌热不稳定毒素lt)的脱毒变异体;以及(7)作为免疫刺激剂来增强组合物效果的其它物质。
包括免疫原性组合物在内的疫苗组合物(例如,可包括抗原、药学上可接受的载体以及佐剂),通常含有稀释剂,如水,盐水,甘油,乙醇等。另外,辅助性物质,如润湿剂或乳化剂、ph缓冲物质等可存在于这类运载体中。
更具体地,包括免疫原性组合物在内的疫苗,包含免疫学有效量的免疫原性多肽,以及上述其它所需的组分。“免疫学有效量”指以单剂或连续剂一部分给予个体的量对治疗或预防是有效的。该用量可根据所治疗个体的健康状况和生理状况、所治疗个体的类别(如人)、个体免疫系统合成抗体的能力、所需的保护程度、疫苗的配制、治疗医师对医疗状况的评估、及其它的相关因素而定。预计该用量将在相对较宽的范围内,可通过常规实验来确定。
通常,可将疫苗组合物或免疫原性组合物制成可注射剂,例如液体溶液或悬液;还可制成在注射前适合配入溶液或悬液、液体赋形剂的固体形式。该制剂还可乳化或包封在脂质体中,以增强佐剂效果。
此外,本发明的疫苗组合物可以是单价的或多价疫苗。
(iii)给药途径和剂量
一旦配成本发明的组合物,可将其直接给予对象。待治疗的对象可以是哺乳动物,尤其是人。
当用作疫苗时,可用已知的方法将本发明的重组病毒样颗粒直接施用于个体。通常采用与常规疫苗相同的施用途径和/或模拟病原体感染路径施用这些疫苗。
给予本发明药物组合物或疫苗组合物的途径包括(但并不限于):肌内、皮下、皮内、肺内、静脉内、经鼻、经口服或其它肠胃外给药途径。如果需要,可以组合给药途径,或根据疾病情况进行调节。疫苗组合物可以单剂量或多剂量给予,且可以包括给予加强剂量以引发和/或维持免疫力。
应以“有效量”给予重组病毒样颗粒疫苗,即重组病毒样颗粒的量在所选用的给药路径中足以引发免疫应答,能有效促使保护宿主抵抗相关的疾病。
代表性的疾病包括(但并不限于):肠道病毒71型感染等。
在各疫苗剂份中所选用的重组病毒样颗粒的量,是按可引发免疫保护性应答而无明显的副作用的量而定。通常,在感染宿主细胞后,各剂的疫苗足以含有约1μg-1000mg,较佳地为1μg-100mg,更佳地10μg-50mg蛋白质。可用包括观察对象中的抗体滴定度和其它反应的标准研究方法来确定具体疫苗的最佳用量。可通过监控疫苗提供的免疫力水平来确定是否需要增强剂量。在评估了血清中的抗体滴定度后,可能需要选用增强剂量免疫接种。施用佐剂和/或免疫刺激剂就可提高对本发明的蛋白质的免疫应答。
优选方法是从肠胃外(皮下或肌内)途径通过注射给予免疫原性组合物。
此外,本发明的疫苗可以结合其它免疫调节剂一起给予,或者与其他治疗剂一起给予。
本发明的主要优点在于:
(1)首次实现了在基因工程细胞内部表达形成由截短型外壳蛋白(vp1)形成的肠道病毒71型病毒样颗粒(vlp);
(2)本发明的重组肠道病毒71型病毒样颗粒能够在宿主细胞内相对高表达,从而降低制备成本。
(3)本发明的重组肠道病毒71型病毒样颗粒能够特异性地与抗肠道病毒71型抗体结合,可以用于肠道病毒71型抗体的检测。
(4)本发明的重组肠道病毒71型病毒样颗粒能够诱发动物体产生抗肠道病毒71型的免疫反应。
下面结合具体实施例,进一步详陈本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如美国sambrook.j等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
材料和方法
1.细胞、病毒:
rd细胞(购自中国科学院细胞库)和vero细胞(购自中国科学院细胞库)均用含5%牛血清的dmem培养基进行培养。pichiapinktm酵母菌株购于美国invitrogen公司,并按照厂家说明书进行培养。本研究中用到的ev71毒株包括ev71/brcr(购自atccvr-1775),ev71/g081[1],ev71/g082[1],ev71/fy09-1[2],ev71/fy09-2[2],ev71/sz98[2]和鼠适应性病毒ev71/mav-w[3]。两株ca16毒株包括ca16/sz05(genbankid:eu262658)和ca16/gx08(genbankid:kc342228)[4]。
2.抗体
抗ev71vp0或vp1蛋白的兔血清[5],抗ca16vp3蛋白的兔血清(证实与ev71vp3存在强的交叉反应)[6],抗ev71vlps[7]的兔血清[3],抗ev71的单抗d5[1],以上抗体均为本实验室制备。
3.载体构建
缺失vp1第10个碱基至vp1最后一个碱基的p1基因从ye003[3]质粒上pcr扩增下来,用ageⅰ和sacⅱ酶切,插入已经做相同处理的质粒ye003上,构建了中间过渡质粒δye003;删掉前90bp或是前219bp的部分vp1基因片段采用同源重组的方法,克隆到过渡质粒δye003上,构建了质粒ye010和ye011。
4.毕赤酵母转化和菌株表达量检测
为了转化毕赤酵母,质粒ye010和ye011用aflⅱ分别线性化,然后分别电转入pichiapinktmstrain1。毕赤酵母的转化和随后的转化子的筛选根据厂家说明书进行操作。
根据说明书进行了小量培养表达试验。简单来说,转化的酵母菌落分别接种到5mlbmgy培养基中,30℃250rpm培养24hr,然后离心去除上清,用1ml4bmmy(含有0.5%甲醇)培养基重悬菌体,30℃250rpm诱导培养48hr。诱导结束后,分别离心收集菌体,用150ulbreakingbuffer重悬,加等体积0.5mm直径的酸洗玻璃珠(sigma)振荡研磨破碎,然后离心收集裂解液上清,用于检测。裂解液进行elisa检测来测定vlp表达量,并进行westernblotting检测目的蛋白,具体方法如下描述。裂解液中的总的可溶性蛋白(totalsolubleprotein,tsp)含量由bradford法来测定。
5.elisa检测和westernblotting
为了抗原定量,用昆虫细胞来源的ev71vlps[7]作为标准品进行了elisa检测,做法如下:抗ev71vlps的兔血清用pbs溶液1:10000稀释,50ul/孔,4度包被过夜,pbst洗板3次;次日,用pbst配成的5%脱脂奶粉(milk)200ul/孔,37度封闭1h,pbst洗板3次;酵母菌裂解液或vlp标准品用1%milk(溶于pbst)系列稀释后,50ul/孔,37度2h,pbst洗板3次;然后加d5单抗,10ng/孔,37度1h,pbst洗板3次;然后羊抗鼠igg偶联的hrp(sigma)用1%milk1:10000稀释,50ul/孔,37度1h,pbst洗板5次。tmb显色液显色,1n磷酸溶液终止,测定0d450。
蛋白质样品加入sdsloadingbuffer煮沸后在12%的sds-page胶中分离,再转印到pvdf膜上,然后膜用5%milk封闭1h,再添加特异性的一抗孵育2h,之后用pbst洗三次以除去非特异性结合,然后添加与一抗相应的hrp标记的二抗孵育1h,用pbst洗五次,最后添加化学发光底物进行曝膜。
6.截短的vlps的制备
为了制备vlps抗原,对选定的菌株进行培养和诱导。离心收集菌体细胞,用0.15mpbs重悬后,使用高压破碎仪(jnbio,中国)1800bar破碎菌体,然后12000rpm离心15min来除去菌体碎片。离心上清中的蛋白进行peg沉淀(peg终浓度10%,nacl终浓度200mm),4度搅拌过夜,然后12000rpm离心15min收集沉淀。沉淀用pbs重悬溶解,然后12000rpm离心15min去除不溶的杂质。澄清的上清加到5ml的20%蔗糖溶液上面,4℃27000rpm离心4h,弃掉上清,蛋白沉淀用0.15mpbs重悬,重悬液经离心澄清后加到10%-50%的蔗糖梯度上5面,4℃39000rpm离心3h,从上到下收集12层组份,然后进行elisa和westernblot检测分析,将富含目的抗原的组份混合并用0.15mpbs稀释后,4℃27000rpm离心4h,蛋白沉淀用0.15mpbs重悬,重悬液经离心澄清后即为vlps,并用elisa方法测定其含量。
7.电镜
纯化的vlps经0.5%醋酸铀负染后,用tecnaig2spirit透射电镜照射。
8.老鼠免疫及攻毒实验
动物实验经过了上海市巴斯德研究所动物委员会的批准。本实验中所使用的icr老鼠均是购买自上海实验动物中心(slac)公司。
免疫前,将抗原和
为了进行被动免疫和保护试验,免疫vlps或是对照抗原的雌性icr老鼠在最后一次免疫两周之后进行交配。免疫的母鼠生下的7日龄小鼠腹腔注射5.04×104tcid50的ev71/mav-w。对攻毒后的老鼠每天监测其存亡情况并进行临床症状打分。临床症状评定标准为:0级,健康;1级,反应迟缓;2级,平衡失调,肌无力;3级,瘫痪;4级,死亡。
9.抗体测定和中和试验
截短vlps免疫血清中ev71病毒特异性的抗体反应测定方法如下:elisa板子包被昆虫细胞来源的ev71vlps(50ng/孔),之后的每步操作后都需要用pbst洗板三次以除去非特异性结合,用5%milk封闭后,血清1000倍稀释后每孔加50ul,然后羊抗鼠igg偶联的hrp(sigma)作为二抗,tmb显色液显色,1n磷酸溶液终止,测定0d450。
血清样本在56℃孵育30min灭活补体后可进行中和试验。在96孔板中将50μl含有100tcid50的病毒液与50μl梯度稀释的血清混合,37℃孵育1h。然后每孔加入100μl含有15000个rd细胞的培养基,co2培养箱37℃培养72h,然后观察细胞病变,血清样本的中和滴度被定义为能完全保护细胞不产生细胞病变的最高稀释度。
10.统计
所有的统计分析均使用graghpadprism版本5来进行。截短vlps的表达,ev71特异性的igg抗体反应和中和滴度均是利用two-tailedstudent’st-test的方法来分析。
实施例1vp1截短的ev71vlps在毕赤酵母中的表达及其鉴定
本发明人构建的截短的vp1蛋白包括vp1蛋白分别截掉4-30aa或是4-73aa。质粒的示意图如图1a所示。质粒ye010用来共表达3cd和截掉了vp1蛋白4-30aa的p1蛋白,质粒ye011用来共表达3cd和截掉了vp1蛋白4-73aa的p1蛋白。
本发明人将ye010和ye011质粒分别转化酵母细胞,并用空载体转化的酵母细胞来作为阴性对照,ye003(未截短)[3]转化的酵母细胞来作为阳性对照。得到的各重组酵母克隆用elisa方法来测定ev71抗原含量,并按照抗原量由高到低的顺序分别进行了排列。如图1b所示,空载体转化的酵母没有检测出ev71抗原;质粒ye010转化的酵母克隆有ev71抗原表达;而质粒ye011转化的所有酵母克隆都没有检测到明显的抗原表达。
为检测截短的p1蛋白是否被3cd蛋白酶切割,分别用vp0和vp1蛋白特异性的抗血清作为检测抗体,用ye003重组酵母菌为阳性对照、空载体重组酵母为阴性对照,进行westernblotting,检测ye010和ye011重组的酵母菌裂解液。如图1c所示,用抗vp0的抗体检测时,空载体重组的酵母没有任何特异性条带,而ye003重组的酵母菌有一条分子量在40kd左右的阳性条带(vp0),ye010和ye011重组的酵母菌产生了一条和阳性对照同样位置的条带(vp0)。当用抗vp1的抗体检测时,如图1d所示,空载体重组的酵母没有任何特异性条带,ye010重组的酵母菌的目的条带位置在阳性条带的下方,这是由于vp1蛋白做了截短处理导致的。以上实验表明ye010重组的酵母菌所表达的截短的p1蛋白被有效地切割成了单体蛋白。但ye011重组的酵母菌没有检测到特异性条带,这可能是由于截掉的vp1蛋白的n端区域正是个很主要的抗原性区域,因此导致vp1抗体无法检测出来。
为了评价截短的ev71抗原是否组装成了vlps,本发明人选取了每种截短版本中表达量最高的克隆进行了大量培养,然后对裂解液进行了蔗糖梯度超速离心,离心结束后从顶部到底部收取12个梯度组份,对收取的每一层组份进行夹心elisa检测,并以ye003重组酵母菌(全长vlps)的梯度样品为阳性参照。如图2a所示,ye010重组酵母菌的梯度样品和ye003重组酵母菌的梯度样品有相似的反应图谱,反应最强的层数都是第8层,这就提示这些截短的抗原组装成了vlps。由于夹心elisa用的抗体可能不适合ye011重组酵母菌抗原的检测,故没有用夹心elisa检测ye011重组酵母菌的梯度样品。对ye010重组酵母菌的梯度样品进行了westernblotting分析,结果显示vp0、截短的vp1和vp3蛋白主要共沉降到第8层(图2b),结果与elisa结果相一致。
此外,对纯化样品进行电镜分析,结果显示ye010重组酵母菌的纯化产物呈现球形颗粒,直径为30nm,颗粒完整规则(图2c),颗粒的形态与全长vlps的形态相似。这些数据提示ye010重组的酵母菌的表达产物都组装成了vlps(命名为vlp-vp1δ27)。以上数据表明vp1蛋白截掉4-30aa不影响vlps的组装,并且截短后颗粒的形态与全长vlps的相似。ye011重组酵母菌的梯度样品的电镜分析显示其表达产物也呈现球形颗粒(命名为vlp-vp1δ70),但直径只有20nm左右(图2d),明显小于全长vlps的直径,表明vp1截掉4-73aa后,vlps虽能组装,但颗粒大小已经发生明显变化。
实施例2.vp1截短的ev71vlps诱导出高水平的中和抗体
截短的vlps从ye010重组的酵母菌中大量表达纯化出来。但无法从ye011重组酵母菌纯化出足够量、足够纯度的vlp-vp1δ70来进行后续试验。截短的vlps的蛋白组成由sds-page来测定,并以全长的vlps(命名为vlp-fl)为参照。如图3a所示,vlp-vp1δ27与vlp-fl相比,vp0和vp3的带型相似,而vp1带型不同。
为了研究vp1蛋白截短对vlps的免疫原性是否造成了影响,3组(每组6只)icr老鼠在第0周、第3周分别免疫vlp-fl、vlp-vp1δ27或pbs,其中vlp-fl为阳性对照组,pbs为阴性对照组。血清样品在第5周收集,用昆虫细胞来源的vlps作为包被抗原,进行elisa试验来检测ev71特异性的抗体反应。vlp-vp1δ27组老鼠血清的elisa分析表明,该组老鼠的免疫血清均有明显的抗体反应,与vlp-fl组老鼠血清的抗体反应水平相当,两者没有统计学差异,(图3b)。elisa结果表明,vp1截掉4-30aa后,vlps的免疫原性没有受到影响。
中和试验来评估每一只老鼠的免疫血清在体外阻止ev71感染的能力。如图3c所示,pbs组老鼠的抗血清即使在最低稀释度(1:16)时对ev71/g082也没有任何中和活性,因此为了分析计算,将对照组老鼠的血清的中和效价定义为1:8。vlp-vp1δ27组老鼠血清的中和试验结果表明,实验组老鼠的免疫血清能有效的中和同源株病毒ev71/g082,中和滴度的几何平均值与vlp-fl组相当,没有统计学差异(图3c)。中和结果表明,vp1截掉4-30aa对vlps诱发中和抗体的能力影响不大。
为测定交叉中和活性,将每一组的抗血清混合在一起,然后测定其对一系列肠道病毒株的交叉中和能力。如表1所示,pbs组老鼠血清在最低稀释度1:32时对所测试的所有病毒株都没有任何中和能力。vlp-vp1δ27组老鼠血清的交叉中和试验结果表明,实验组老鼠的免疫血清能有效的中和所有测试的ev71病毒株,并且中和滴度与vlp-fl组血清的水平相当,在部分实验组中甚至能够达到vlp-fl组的两倍。但是即使在最低稀释度1:32时对两株ca16病毒仍没有任何交叉中和活性(表1)。这些数据说明说明vp1截掉4-30aa后形成的截短vlps诱导的抗体是ev71特异性的,并显示出了良好的型别内的交叉中和活性,且交叉中和能力与全长vlps相当。
表1vp1截短的ev71vlps的免疫血清对一系列ev71和ca16毒株的中和.
最低的血清稀释度为1:32.
实施例3.vp1截短的vlps的母源免疫能保护幼鼠抵抗ev71的腹腔攻毒
为了评价vp1截短的vlps的保护效果,免疫过vlp-fl、vlp-vp1δ27或pbs的雌性icr老鼠和没有任何免疫的雄老鼠配上。新生的7日龄小鼠腹腔注射ev71/mav-w,然后观察14天的临床症状和死亡率。vlp-vp1δ27组小鼠均存活下来,且没有任何临床症状(图4a-b)。这些结果表明vp1截掉4-30aa后形成的截短的vlps能提供和vlp-fl相似的体内保护效果。
讨论
本发明的实验结果表明,vp1不同程度截短后,vlps依然可以组装,虽然表达水平、颗粒大小和结构有了差异和变化。截短的vlps的蔗糖梯度分析,抗原信号都主要分布在第八层,这和全长vlps的分布是一样的。并且截短vp1的4-30位氨基酸的vlps的电镜分析也观察到和全长vlps形态非常相似的颗粒。这些结果都表明,vp1截短第4-30位氨基酸并没有影响到vlps的组装。而对vp1蛋白第4-73位截短后,vlps虽能组装,但颗粒大小和构象已经发生明显变化。
动物免疫试验结果证实了vlp-vp1δ27诱导的总的igg抗体反应和中和抗体反应与vlp-fl的水平相当。随后的体内保护试验也证实了截短版本的vlps可以提供和全长vlps相似的保护效果。因此,vp1截短不但没有影响到组装,而且也没有影响到vlps颗粒外部的多数中和表位,即vlps颗粒表面的多数线性的和构象的中和表位并没有因为vp1截短而发生丢失。
结论
(1)vp1蛋白截掉4-30aa后没有影响到ev71vlps的组装及颗粒大小。
(2)vlp-vp1δ27可以诱导和全长vlps水平相当的总igg抗体反应和中和抗体反应。
(3)vlp-vp1δ27可以提供和全长vlps相似的体内保护效果,母源免疫都能保护小鼠抵抗致死剂量的ev71病毒的腹腔感染。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
参考文献:
1.ku,z.,etal.,developmentofmurinemonoclonalantibodieswithpotentneutralizationeffectsonenterovirus71.jvirolmethods,2012.186(1-2):p.193-7.
2.ku,z.,etal.,avirus-likeparticlebasedbivalentvaccineconfersdualprotectionagainstenterovirus71andcoxsackievirusa16infectionsinmice.vaccine,2014.32(34):p.4296-303.
3.zhang,c.,etal.,high-yieldproductionofrecombinantvirus-likeparticlesofenterovirus71inpichiapastorisandtheirprotectiveefficacyagainstoralviralchallengeinmice.vaccine,2015.33(20):p.2335-41.
4.cai,y.,etal.,activeimmunizationwithacoxsackievirusa16experimentalinactivatedvaccineinducesneutralizingantibodiesandprotectsmiceagainstlethalinfection.vaccine,2013.31(18):p.2215-21.
5.liu,q.w.,etal.,characterizationofenterovirus71capsidsusingsubunitprotein-specificpolyclonalantibodies.journalofvirologicalmethods,2013.187(1):p.127-131.
6.liu,q.w.,etal.,detection,characterizationandquantitationofcoxsackievirusa16usingpolyclonalantibodiesagainstrecombinantcapsidsubunitproteins.journalofvirologicalmethods,2011.173(1):p.115-120.
7.ku,z.,etal.,neutralizingantibodiesinducedbyrecombinantvirus-likeparticlesofenterovirus71genotypec4inhibitinfectionatpre-andpost-attachmentsteps.plosone,2013.8(2):p.e57601。
- 还没有人留言评论。精彩留言会获得点赞!