以叶酸为靶向基团的光敏药物的合成和应用的制作方法
本发明涉及简称为FA-Pyro的光敏药物的合成以及在肿瘤光动力治疗方面的应用。
背景技术:
目前,临床上治疗癌症的方法主要包括放疗、化疗和手术治疗三种手段。然而,这些传统的治疗方法在杀伤肿瘤组织的同时,也会损伤机体正常的组织、造成全身的毒性。光动力治疗(Photodynamic Therapy,PDT),作为临床上应用的一种微创型治疗策略越来越受到重视。
PDT发挥治疗作用需要结合下列三要素:1、能够在肿瘤组织中富集的光敏剂;2、激发该光敏剂所须的特定波长的光;3、氧气(O2)。当通过特定波长的光激发光敏剂时,其利用组织中的O2产生单线态氧,从而产生一系列的光化学及光生物学过程导致肿瘤组织不可逆的光敏损伤(Dolmans et al.,2003;Dougherty et al.,1998;Sharman et al.,1999)。研究发现,PDT还具备其它重要特性,例如:PDT可以重复给药治疗而不会产生耐药性问题(Hopper,2000;Nseyo et al.,1998);能够激活机体的抗肿瘤免疫反应(Anzengruber et al.,2015;Castano et al.,2006;Mroz and Hamblin,2008;Triesscheijn et al.,2006);PDT由于其光学特性也可以作为诊断试剂,从而实现肿瘤的诊断和治疗一体化(Josefsen and Boyle,2012)。因此,PDT已经成为一种越来越重要的肿瘤治疗方法。
然而,由于缺乏理想的光敏剂,限制了光动力治疗作为一线的肿瘤治疗方法的应用。(Detty et al.,2004;Fayter et al.,2010;Kinsella et al.,2001。尽管,USFDA已经批准了一些光敏类药物进入临床使用,并且很多的光敏剂正在进行临床前研究(Agostinis et al.,2011),目前,这些都不是理想的用于光动力治疗的光敏药物。这些光敏药物普遍不能有效的产生活性氧簇(reactive oxygen species,ROS)或者由于有限的肿瘤富集能力使得其对正常的组织产生损伤(Majumdar et al.,2014)。虽然PDT治疗可以通过光照的选择进行局部的治疗,但是使光敏剂在肿瘤组织中靶向高效的富集对于提高光动力治疗效果非常的关键(Kuimova et al.,2007;Mitsunaga et al.,2011;Sharman et al.,2004)。光敏剂在肿瘤组织中高效的靶向富集具有能够精确的杀伤肿瘤细胞,降低给药剂量,避免皮肤毒性等优势(Celliet al.,2010;Stefflova et al.,2007)。
焦脱镁叶绿酸a(Pyropheophorbide a,Pyro)是一种非常有潜力的光敏剂。与正在临床上使用的光敏药物photofrin相比(消光系数:1170L mol-1cm-1,630nm)(Van Geel et al.,1995),Pyro的单线态氧荧光量子产率约为50%,并且在更长的波长(668nm)下的消光系数是Photofrin的3倍以上(3.79×104L mol-1cm-1)(Jasinski,2009;Lovell et al.,2010;Sun and Leung,2002)。但是,Pyro肿瘤定位能力有限,水溶性差等缺点使得其会对正常的组织造成损伤,导致严重的光毒性,阻碍了其在临床上的应用(Jasinski,2009)。
将Pyro和与具有肿瘤靶向能力的配体相连接能够选择性的将Pyro投递到肿瘤组织,从而能够更高效的进行靶向光动力治疗。此外,Pyro和靶向配体相连接还能够显著改善Pyro的水溶性,提高其药代动力学性质(Bird et al.,1995;Kuimova et al.,2007;Majumdar et al.,2014;Mitsunaga et al.,2011;Spring et al.,2014)。
研究发现,叶酸受体普遍高表达于多数肿瘤细胞表面(Detty et al.,2004;Low and Kularatne,2009;Sudimack and Lee,2000),叶酸与叶酸受体的亲和力高达0.1~1nM(Kamen and Capdevila,1986;Kamen and Smith,2004;McHugh and Cheng,1979),此外,叶酸不具有免疫原性和具有更好的肿瘤组织穿透能力(Hilgenbrink and Low,2005;Lu and Low,2002;Mahato et al.,2011;Schneider et al.,2005;Xin et al.,1992)。因此,小分子叶酸可以作为理想的肿瘤靶向分子。目前,叶酸作为靶向配体已经被广泛的应用于肿瘤成像和治疗领域(Amato et al.,2013;Naumann et al.,2013)。叶酸和异硫氰酸荧光素连接物(folate-FITC,EC17),已经进入到了临床II的实验,其作为一种荧光探针在卵巢癌手术治疗过程中提供实时的指导(Tummers et al.,2016;Van Dam et al.,2011)。99mTc和叶酸相连接(Etarfolatide)也已经进入临床III期实验(Palmer et al.,2013)。叶酸和tubulysin的连接物,EC1456),在临床I期的实验中体现出对实体瘤的良好的治疗效果。(Srinivasarao et al.,2015).在文献报道中,通过多肽作为连接物将叶酸和Pyro相连接,对叶酸阳性的皮下肿瘤体现出了良好的选择能力(Stefflova et al.,2007)。
因此,我们选择小分子叶酸作为靶向集团和Pyro相连接。由于叶酸的水溶性以及linker中的亲水基团,连接物能够提高Pyro的水溶性质和药代动力学特性,进而提高光动力治疗效果。
技术实现要素:
一种以叶酸为靶向配基的光敏衍生物,其结构为:
一种以叶酸为靶向配基的光敏衍生物,其结构为:
一种以叶酸为靶向配基的光敏衍生物,其结构式如下:
R1或R5为链烯基、烷基、杂环之一,所述链烯基和烷基还可以被-CH(CH3)OR3取代,所述R3选自:1-甲氧基-OCH3、1-丙氧基-(CH2)2CH3、1-戊氧基-(CH2)4CH3、1-己氧基-(CH2)5CH3、顺式-3-己烯氧基-(CH2)2CH=CHCH2CH3、反式-3-己烯氧基-(CH2)2CH=CHCH2CH3、环己基氧基-(C6H11)、2-己基氧基-(CH(CH3))(CH2)3CH3、1-庚基氧基-(CH2)6CH3、1-辛基氧基-(CH2)7CH3、1-壬基氧基-(CH2)8CH3、1-癸基氧基-(CH2)9CH3、1-十二烷基氧基-(CH2)11CH3。R2可以为H、CO2Me:
进一步地R1为:
其中R4选自:1-甲氧基-OCH3、1-丙氧基-(CH2)2CH3、1-戊氧基-(CH2)4CH3、1-己氧基-(CH2)5CH3、顺式-3-己烯氧基-(CH2)2CH=CHCH2CH3、反式-3-己烯氧基-(CH2)2CH=CHCH2CH3、环己基氧基-(C6H11)、2-己基氧基-(CH(CH3))(CH2)3CH3、1-庚基氧基-(CH2)6CH3、1-辛基氧基-(CH2)7CH3、1-壬基氧基-(CH2)8CH3、1-癸基氧基-(CH2)9CH3、1-十二烷基氧基-(CH2)11CH3。
进一步地R1为CHCH2。
最优选化合物分子式如下:
本发明还提供所述光敏衍生物在制备治疗肿瘤药物中的用途。
本发明光敏衍生物的制备方法,其合成路线为:
在本发明中,我们合成并对上述衍生物的理化性质进行了一系列的表征。我们还在体外对该化合物在不同叶酸受体表达量的细胞系的药物活性进行了研究。构建了小鼠的肿瘤模型,利用活体成像系统研究了该药物在小鼠体内的药代动力学性质和对皮下瘤的治疗效果。上述衍生物在肿瘤组织中高效的富集有效地提高了光动力治疗的效果并且减少了药物在正常组织器官中的积累。静脉给药后,仅仅经过1到2轮的光动力治疗,能够100%的清除种植的皮下肿瘤并且在观测时间段没有肿瘤复发。这些卓越的治疗效果提示该化合物具有非常好的临床使用潜力。
此外本发明通过固相合成和液相合成相结合的方式,以非常简单实用的方式得到了该靶向光敏药物。
本发明中最优选化合物FA-Pyro具有很好的药代动力学性质,在肿瘤组织中有较强的富集能力,具有很好的选择杀伤叶酸受体高表达的肿瘤细胞的能力和对实体瘤的治疗效果,是能够用于肿瘤光动力治疗的光敏类药物。
附图说明
图1是FA-Pyro的合成路线图
图2是FA-Pyro光谱性质图
图3是FA-Pyro介导的光动力治疗对肿瘤细胞的杀伤能力评价图
图4是FA-Pyro介导的光动力治疗选择性杀伤能力和相关机制研究图
图5是Pyro和FA-Pyro在小鼠体内药代动力学研究图
图6是FA-Pyro对小鼠异种移植瘤治疗效果的研究图
具体实施方式
下述实施例用于进一步说明本发明但不意味着限制本发明
实施例1
简称为Pyro-Maleimide的化合物和简称为FA-Pyro的化合物的合成(附图1)。
该合成过程综合了固相合成方法和液相合成方法,简化了后处理过程的基础上便于大量制备。其中FA-Pyro的合成采用了经典的巯基和马来酰亚胺反应的方式,使得该化合物的产率得以大大提高。
1、简称为FA-Cys-SH的化合物的合成
FA-Cys-SH采用Fmoc为基础的固相合成的方法进行合成。称取1g 2-chlorotrityl chloride树脂(1g,0.5mmol,1.0eq)于固相合成器中,加入10ml二氯甲烷(DCM)溶胀20min。将Fmoc-Cys(Trt)-OH(351mg,0.6mmol,1.2eq)和N,N-二异丙基乙胺(DIEA,198μl,1.2mmol,2.4eq)用8ml DCM溶解后加入到固相合成器中,室温反应4h。配置封闭液(二氯甲烷:甲醇:水=17:1:2),将树脂封闭液加入到固相合成器中,室温封闭30min。分别用DCM和N,N-二甲基甲酰胺(DMF)洗树脂5次,20%哌啶DMF溶液脱Fmoc基团30min。DMF洗树脂5次,叶酸(FA,264.84mg,0.6mmol,1.2eq)和O-苯并三氮唑-四甲基脲六氟磷酸盐(HBTU,379mg,1mmol,2eq),DIEA(247.9μL,1.5mmol,3eq)溶于8ml DMSO中,加入到反应体系中,室温反应过夜。DMSO洗5次,每次10min,DCM洗5次。加入树脂切割液(三氟乙酸/三异丙基硅烷/苯酚/水(90%:5%:2.5%:2.5%))反应1h,将FA-Cys-SH从树脂上切下来。乙醚沉淀3次,水洗3次,甲醇洗5次,真空干燥后即得产物FA-Cys-SH。
HRMS(ESI):calcd for C22H24N8O7S[M+Na]+567.1386,found 567.1385.1H NMR(400MHz,DMSO)δ8.66(s,1H),8.33–8.09(m,2H),7.66(d,J=8.1Hz,3H),6.64(d,J=8.3Hz,3H),4.49(s,3H),4.44–4.34(m,2H),4.34–4.23(m,1H),2.92–2.57(m,4H),2.28(ddd,J=11.9,10.8,7.1Hz,6H),2.07–1.65(m,5H),1.24(s,3H),0.85(t,J=6.9Hz,1H).
2、简称为Pyro-Maleimide的化合物的合成
将Pyro(100mg,0.187mmol,1.0eq),1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl,179mg,0.936mmol,5.0eq)和N-羟基琥珀酰亚胺(NHS,43mg,0.374mmol,2.0eq)溶于3ml DMSO中,室温反应4h。HPLC检测反应进程,当Pyro完全活化后,直接向反应体系中加入N-(2-氨乙基)马来酰亚胺盐酸盐(66mg,0.374mmol,2.0eq)和三乙胺(TEA,26μl,0.187mmol,1.0eq)继续反应4h后,用DCM(3x 20mL)萃取.合并有机层,无水MgSO4干燥,硅胶柱层析纯化后即得黑色固体产物Pyro-Maleimide,收率90%。
HRMS(ESI):calcd for C39H40N6O4[M+H]+657.3189,found 657.3185.1H NMR(400MHz,CDCl3)δ9.50–9.34(m,1H),8.60(s,1H),8.05(dd,J=17.4,11.8Hz,1H),6.54(s,1H),6.33(d,J=16.9Hz,1H),6.22(d,J=11.1Hz,1H),5.61–5.47(m,1H),5.31(d,J=19.3Hz,1H),5.11(d,J=18.0Hz,1H),4.56(s,1H),4.38(s,1H),3.68(s,1H),3.53(s,2H),3.45(s,4H),3.28(s,2H),3.24–3.13(m,1H),2.79–2.62(m,1H),2.54–2.43(m,1H),2.29–2.16(m,1H),1.85(d,J=6.7Hz,3H),1.69(t,J=7.3Hz,3H),1.60(s,2H),1.29(s,2H),0.90(d,J=7.8Hz,3H);13C NMR(400MHz,CDCl3)δ196.38,172.83,171.92,171.89,170.80,148.88,145.00,141.59,137.49,136.25,135.86,134.02,131.69,130.05,129.16,127.85,127.55,124.87,122.58,106.07,103.77,100.00,97.07,93.07,51.76,49.87,48.05,38.66,37.45,32.79,30.10,23.09,19.27,17.34,12.14,11.56,11.23.
3、简称为FA-Pyro的化合物的合成
将化合物1(30mg,0.055mmol,1.0eq)和化合物3(40mg,0.061mmol,1.1eq)溶于1ml DMSO中,再加入TEA(10μL,0.072mmol,1.3eq)后,室温搅拌1h后,产物用乙醚和乙酸乙酯1:1的混合溶液沉淀,产物溶于DMSO后,高效液相色谱分离纯化的黑色固体,收率85%。
HRMS(ESI):calcd for C61H64N14O11S[M+H]+1201.4678,found 1201.4678.1HNMR(400MHz,DMSO)δ9.47(s,1H),9.20(s,1H),8.67(s,1H),8.33(s,1H),8.05–7.88(m,3H),7.85–7.65(m,2H),7.40(dd,J=7.2,0.7Hz,3H),6.61(d,J=4.8Hz,1H),6.35(d,J=8.5Hz,3H),6.14(d,J=17.7Hz,1H),5.96(d,J=11.7Hz,1H),5.11–4.97(m,2H),4.88(d,J=20.3Hz,1H),4.31(d,J=7.6Hz,1H),4.18–4.01(m,6H),3.77–3.63(m,2H),3.46(d,J=8.9Hz,3H),3.38(s,4H),3.19(s,8H),2.98(s,7H),2.43(s,2H),2.05(dd,J=16.9,11.3Hz,5H),1.86–1.62(m,6H),1.55(d,J=7.1Hz,4H),1.38(t,J=7.3Hz,4H),0.99(s,4H),0.87(t,J=6.9Hz,4H),0.61(t,J=6.3Hz,1H);13C NMR(400MHz,DMSO)δ228.28,195.34,180.18,178.64,176.74,175.03,174.19,173.88,172.35,172.19,166.34,166.29,163.48,161.47,161.15,161.11,161.07,156.22,154.03,153.84,152.71,150.71,150.66,149.80,149.78,148.44,148.40,148.38,148.21,147.85,144.48,140.58,137.01,135.73,135.05,134.80,129.98,128.94,122.66,121.36,121.30,111.11,106.01,103.93,96.30,93.69,52.27,51.94,51.32,51.21,51.17,51.02,49.33,47.58,47.47,47.30,45.78,45.36,35.97,32.25,29.89,29.86,22.85,18.46,17.36,11.91,11.55,10.69,8.57.
实施例2
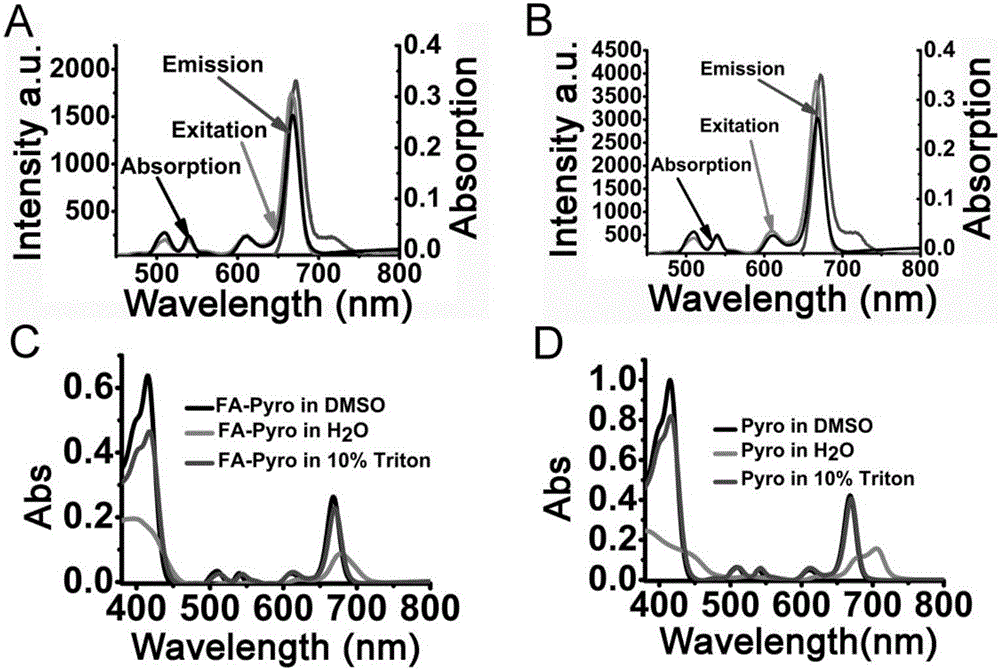
FA-Pyro和Pyro的光谱性质(附图2)。
(1)UV-Vis光谱
FA-Pyro和Pyro的吸收光谱用USA Cary 5000扫描波长范围300–850。FA-Pyro和Pyro的浓度分别为10μM。
(2)荧光激发和发射光谱
荧光发射光谱使用665nm为激发光,记录发生光谱范围为600-900nm。荧光激发光谱使用675为发射光,记录激发光范围为450-800nm。FA-Pyro和Pyro的浓度记录为5μM。The photomultiplier tube(PMT)电压700V,扫描速度2400nm/min。
实验结果及结论:
FA-Pyro和Pyro的光谱性质即吸收光谱和荧光光谱性质如图2A和2B所示:在DMSO中,FA-Pyro的光谱性质和Pyro相似,Q带的最大的吸收波长为668nm(ε=2.63×104L mol-1cm-1),最大的荧光激发和发射波长分别为667nm和673nm。在水中,可以看到Pyro在Q带有两个明显的不成形的峰,表明其在水中聚集作用很明显,尽管FA-Pyro在水溶液中也有聚集但聚集程度要比Pyro小的多。如图2C和2D所示,Triton X-100能够模拟脂质破坏该化合物的聚集作用,证实该化合物在体内具有更好好的荧光和治疗效果。
实施例3
化合物FA-Pyro对肿瘤细胞杀伤能力(附图3)。
1)KB(人口腔表皮癌细胞)和A549(人肺支气管癌细胞)细胞系的培养
液氮中取出细胞,置于37℃水浴锅中迅速解冻,然后1000rpm/min,离心5min。换弃上清,加入预热的完全培养基,置于5%CO2,37℃培养箱中培养过夜。第二天更换培养基。继续培养至细胞铺满皿底。传代培养2-3次。
2)药物与细胞孵育
取对数期的细胞,以5×103个细胞/孔的细胞密度100μL细胞悬液加入96孔板中,37℃培养箱孵育24h。吸去培养基后,加入含有不同FA-Pyro浓度的新鲜培养基继续培养6h后,用660nm,40-mW/cm2的功率密度给予不同的光照剂量(0min,2.5min,5min,10min,20min)。继续培养24h后,更换含0.5mg/mL MTT的新鲜培养基继续孵育4h。酶联免疫检测仪在490nm处测量各孔的吸光值。
实验结果及结论:
如图3A和3B所示,FA-Pyro对肿瘤细胞的杀伤作用具有很好的药物浓度依赖性和光照剂量的依赖性;此外,当单纯的给予相当剂量的光照或者只给予该光敏药物FA-Pyro均不会对细胞产生杀伤作用。如图3C,为了探讨不同剂量的光照对细胞是否有毒副作用,我们使用660nm,40mW/cm2的光照射不同时间(0-20min),我们发现,这些光照剂量下,光不会对细胞产生杀伤作用。如图3D中,我们使用显微镜直观的观察PDT治疗前后细胞的形态变化,发现在PDT后,细胞形态明显变圆,并且细胞内有很多小泡,证实细胞正经历程序性细胞死亡的过程。
实施例4
FA-Pyro的选择性杀伤能力和作用机制的研究(附图4)。
分别取对数期的叶酸受体高表达的KB细胞和叶酸受体低表达A549细胞,分别以5×103个细胞/孔的细胞密度100μL细胞悬液加入96孔板中,37℃培养箱孵育24h。更换含有不同浓度的FA-Pyro,继续培养12h后,给予不同的光照剂量(0min,5min,15min,20min),继续培养4h后,更换含0.5mg/mL MTT的新鲜培养基继续孵育4h。酶联免疫检测仪在490nm处测量各孔的吸光值。为了验证光敏剂作用的膜结合属性,在光照前,替换成不含有药物的新鲜培养基,给予相同剂量的光照,对比细胞的存活率变化。验证该药物对细胞的杀伤作用是否依赖单线态氧来发挥作用,5×103个细胞培养到对数生长期后,更换含有5μM FA-Pyro的新鲜培养基继续孵育4h后,将细胞与不同终浓度的NaN3(6.25mM,12.5mM,25mM,50mM)孵育20min后,用新鲜的培养基洗涤3次后,给予光照(660nm,40mW/cm2,10min)。细胞继续培养24h后,更换含0.5mg/mL MTT的新鲜培养基继续孵育4h。酶联免疫检测仪在490nm处测量各孔的吸光值。
实验结果及结论:
如图4A和4B所示,FA-Pyro能够以浓度和照射剂量依赖的能力选择性的杀伤叶酸阳性的KB细胞,而对叶酸受体表达量低的阴性细胞的杀伤能力有限。进一步证实了叶酸配体在该药物发挥作用过程中的重要性。如图4C,无论在光照前是否将培养基中游离的光敏药物去除,该光敏药物的杀伤能力没有变化,说明,培养基中游离的光敏药物不会对细胞产生杀伤作用,只有与细胞膜结构相互作用的药物才能对细胞产生杀伤能力。通常活性氧簇的产生是PDT诱发细胞死亡的主要因素,我们使用不同浓度的单线态氧的捕获剂叠氮钠对FA-Pyro产生的单线态氧进行淬灭。有图4D所示,随着叠氮钠浓度的升高,FA-pyro的细胞杀伤能力在减弱,证明光敏药物FA-Pyro是通过产生单线态氧对细胞起到杀伤作用。
实施例5
化合物FA-Pyro在小鼠体内药代动力学分析(附图5)。
6周龄的雌性BALB/c裸鼠在右后侧皮下接种3×106KB cells。7天后,以0.3μmol/只的药物剂量通过尾静脉注射入小鼠体内,不同时间段(0h,1h,2h,4h,6h,9h,12h,24h)通过活体成像仪观察药物在小鼠体内的代谢和肿瘤富集情况。Xenogen IVIS imager(Cy 5.5filter(λexc:615-665nm,λem:695-770nm)。在成像时,小鼠用吸入型麻醉剂异氟烷麻醉。
实验结果及结论:
如图5A所示,当只给小鼠注射Pyro后,Pyro很快就会在小鼠的肝脏中有大量的积累,一直持续到24h,并且在监测过程中,并没有在肿瘤组织中有大量的累积。并且刚刚注射到小鼠体内时,Pyro没有体现出很强的荧光强度,只有过了几小时后,Pyro的荧光才渐渐显示出来。相反,FA-Pyro在注射后就表现出很强的荧光信号,并且在10min时主要在肝部,肾脏积累。3h时,正常组织细胞的荧光信号逐渐减弱,9h时,FA-Pyro在肿瘤组织部位体现出很强的荧光信号,并且一直持续到24h。FA-Pyro具有更好的药代动力学特性并且在肿瘤组织中的累积能力更强。
实施例6
化合物FA-Pyro对小鼠异种移植瘤的治疗效果研究(附图6)。
(1)6周龄的雌性BALB/c裸鼠在右后侧皮下接种3×106KB cells。7天后,小鼠肿瘤体积达到50mm3时,随机将小鼠分为4组,每组5只小鼠。(1)阴性对照;(2)0.3μmol FA-Pyro/只小鼠,不光照;(3)0.3μmol FA-Pyro/只小鼠,94J/cm2(156mW/cm2,10min);(4)注射相同体积的PBS溶液,94J/cm2。通过检测小鼠肿瘤体积的生长情况,记录治疗效果。治疗组在治疗16天后,5只中有4只小出现肿瘤复发的情况,给予第二次得光动力治疗,并且每隔一天检测小鼠的肿瘤体积。在监测的45天中,小鼠肿瘤没有再次复发。
(2)6周龄的雌性BALB/c裸鼠在后部两侧皮下接种3×106KB cells。当肿瘤体积达到100mm3时,随机分成两组,每组5只小鼠。(1)PBS;(2)0.3umol FA-Pyro。4h后实验组对左侧的肿瘤光照10min(680nm,156mW/cm2),通过小鼠肿瘤体积和体重的变化来监测治疗效果。肿瘤体积的计算公式:V=length×width2×0.5(Euhus et al.,1986)。
实验结果及结论
如图6A和6B所示,在对照组即缺少光和药物FA-Pyro之一均不会对肿瘤细胞的生长起到治疗作用。所有对照组小鼠的肿瘤体积很快超过了500mm3。在实验组即FA-Pyro和光同时存在的情况下,治疗1到2天后,小鼠的肿瘤显著的缩小,几天后小鼠的异种移植瘤逐渐消失,同时肿瘤组织部位会产生水肿现象,但是也会逐渐的消退。一些小鼠在治疗16到18天后,会有肿瘤复发的现象,然而,对这些小鼠给予第二次PDT后,截止至我们检测的45天内,小鼠肿瘤没有再次复发。如图6C,我们通过小鼠的体重变化观察药物对小鼠生存状态的影响,在我们检测的时间短内,小鼠的体重呈平稳状态,证明在PDT过程中,并未对小鼠的生长状态产生影响。
如图6D所示,在小鼠的背部两侧种植肿瘤后,只对其中一侧的肿瘤细胞进行PDT治疗,只有同时给予FA-Pyro和光照的情况下,FA-Pyro才能起到对肿瘤的治疗作用。二者缺一均不能对肿瘤细胞产生杀伤所用。这些结果证明,FA-Pyro在对肿瘤治疗过程方面具有很大的潜力,并且对机体没有严重的毒副作用。
测定结果(见图2-6)
由图2的数据可以看出,FA-Pyro具有和Pyro相似的光谱性质,但是FA-Pyro的水溶性更好,在水溶液中的聚集程度较小。
由图3-4的数据可以看出,FA-Pyro对肿瘤细胞具有很好的杀伤效果,在叶酸受体表达量不同的细胞系之间具有选择杀伤能力,其主要通过单线态氧的形式在线粒体发挥光敏作用。
由图5-6的数据可以得出如下结论:FA-Pyro明显改善了Pyro在小鼠体内的药代性质,使药物在肿瘤组织中的富集量增加,正常组织中清除速度加快。通过异种移植瘤的治疗试验可以看出,FA-Pyro能够的杀伤肿瘤组织,而对小鼠的正常长没有影响。结论:
我们将小分子靶向配基叶酸(FA)和光敏剂焦脱镁叶绿酸a(Pyro)连接在一起以增加Pyro的肿瘤靶向能力和在肿瘤组织中的选择性累积能力。研究发下,该化合物FA-Pyro能够有效的杀伤叶酸受体高表达的肿瘤细胞。并且在肿瘤组织中的富集量大大的增加。对小鼠异种移植瘤的光动力治疗发现,该药物能够100%的清除小鼠的移植瘤。这些PDT治疗结果表明,该简单的小分子光敏药物在肿瘤治疗领域具有良好的临床应用前景。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺