一种草莓ARF4启动子融合GUS基因的载体构建方法与流程
本发明属于分子生物学和生物技术领域,涉及一种草莓ARF4启动子融合GUS基因的载体构建方法。
背景技术:
生长素是植物体重要的生长调节分子,参与植物根和茎的生长和发育、器官的衰老、维管束组织的形成和分化发育,维持顶端优势,胚胎中轴的建立,植物的向地和向光反应以及刺激花器官生长等生长和发育诸多过程,在植物整个生命周期过程中发挥重要的作用。现有的研究表明,生长素信号转导过程涉及了2类转录因子:一类是生长素响应因子(auxin response factors, ARF)家族,另一类是Aux/IAA转录因子家族。作为一类调控生长素响应基因表达的转录因子,ARF能够特异地与生长素响应基因启动子区域的生长素响应元件(AuxREs)TGTCNC结合,激活或抑制基因的表达。ARF4基因是ARF基因家族中的一员。关于ARF4基因的研究主要集中在一些模式植物上,拟南芥中ARF4受TAS3产生的ta-siRNA负调控,即拟南芥中miR390指导TAS3的生物合成,而TAS3通过产生的ta-siRNA负调控靶基因ARF4来影响植株发育时限、侧根发育等。因此,在草莓中对ARF4基因进行研究将有助于人们深入理解ARF基因家族在植物的生长发育、信号转导、胁迫响应等过程中的综合作用。植物的生长发育和生命周期是不同的基因在时间和空间上有序表达的结果。基因的表达调控受多种内外因子的影响。根据基因调控在同一事件中发生的先后次序,又可将其分为转录水平调控、转录后水平调控、翻译水平调控及蛋白质加工水平的调控等。植物基因调控主要是在转录水平上进行的,受多种顺式作用元件和反式作用因子的相互协调作用。植物基因启动子是重要的顺式作用元件,是RNA聚合酶能够识别并与之结合,从而起始基因转录的一段DNA序列,通常位于结构基因的5' 端上游。一个典型的启动子包含CAAT-box和TAAT-box,它们分别是依赖DNA和RNA聚合酶的识别和结合位点,一般位于转录起始位点上游几十个碱基处。在核心启动子上游通常会有一些特殊的DNA序列,即顺式作用元件,转录因子与之结合从而激活或抑制基因的转录。一旦RNA聚合酶定位并结合在启动子上即可启动基因转录,因此启动子是基因表达调控的重要元件,它与RNA聚合酶及其他蛋白辅助因子等反式作用因子的相互作用是启动子调控基因转录的实质。因此,对植物启动子的研究有助于了解基因转录调控表达模式及其调控机制,并应用于基因工程中提高或改进外源目的基因的表达。GUS报告基因就是β-葡萄糖苷酸酶基因。该基因产物为β-葡萄糖苷酸酶,属水解酶类,相当稳定而不易降解。根据GUS基因检测所用的底物不同,可以选择三种检测方法:组织化学法、分光光度法和荧光法,其中最为常用的是组织化学法。组织化学法检测以5-溴-4-氯-3-吲哚-β-葡萄糖苷酸(X-Gluc)作为反应底物,将被检材料用含有底物的缓冲液浸泡。若组织细胞发生了GUS基因的转化,并表达出GUS,在适宜的条件下,该酶就可将X-Gluc水解生成蓝色产物。这是由其初始产物经氧化二聚作用形成的靛蓝染料,它使具GUS活性的部位或位点呈现蓝色,用肉眼或在显微镜下可看到,且在一定程度下根据染色深浅可反映出GUS活性。因此将启动子与GUS报告基因构建为融合载体并导入植物体中,通过检测GUS活性就可以反映出启动子调控基因的转录活性。因此,要研究ARF4基因启动子的转录活性,首先要获得ARF4基因启动子与GUS报告基因融合的植物表达载体,从而才能深层次了解 ARF4基因启动子调控基因的转录活性,为全面揭示ARF4基因功能奠定基础。
技术实现要素:
本发明的目的是提供一种草莓ARF4启动子融合GUS基因的载体构建方法。
本发明的目的是这样实现的,包括草莓ARF4基因启动子的DNA序列如序列表中‘艳丽’草莓ARF4基因启动子序列,其特征是,草莓ARF4基因启动子的克隆方法如下:以草莓幼嫩叶片为材料,利用CTAB法提取DNA,设计特异性引物扩增ARF4基因启动子:
上游引物PRO-ARF4-F:5'- AACTGCAGTACGGCTTCAAGGTTAAG-3';
下游引物PRO-ARF4-R:5'- GCTCTAGA TCTCTCTCTCTCTGCT-3';
以上述提取的DNA为模板,进行聚合酶链式PCR反应,产物经凝胶回收后连接到pGM-T载体,转化TOP10感受态细胞,进行序列测定,得到序列如序列表中‘艳丽’草莓ARF4基因启动子序列所示,命名为pGM-ARF4-Pro。
所用的草莓品种为‘艳丽’草莓。
含草莓ARF4启动子融合GUS报告基因的植物表达载体的构建,方法如下:
提取草莓叶片中的DNA;
以DNA为模板,通过设计的特异引物,PCR扩增得到上游和下游分别引入Pst I酶和Xba I酶切位点的ARF4基因启动子;
其中,所述的特定引物是:
上游引物PRO-ARF4-F:5'- AACTGCAGTACGGCTTCAAGGTTAAG-3';
下游引物PRO-ARF4-R:5'- GCTCTAGA TCTCTCTCTCTCTGCT-3';
将带有酶切位点的ARF4基因启动子,连接到克隆载体pGM-T上,转化TOP10感受态细胞, 得到重组质粒pGM-ARF4-Pro,提取阳性质粒pGM-ARF4-Pro;
用限制性内切酶Pst I酶和Xba I酶分别对提取的阳性重组质粒pGM-ARF4-Pro和表达载体pRI201-AN-GUS进行双酶切,将得到的ARF4基因启动子片段替换pRI201-AN-GUS中的35S启动子,构建草莓ARF4启动子融合GUS报告基因的植物表达载体pRI201-AN-GUS-ARF4-Pro。
本发明的有益效果:
1. 本发明构建的草莓ARF4启动子融合GUS报告基因的植物表达载体,为首次报道,可直接用于农杆菌介导的遗传转化,获得ARF4基因启动子过表达新种质,为该启动子的功能鉴定奠定了基础。
2. ARF4基因启动子可以驱动ARF4基因的表达,利用转基因和GUS组织染色技术,有助于揭示ARF4 基因启动子驱动GUS基因强弱,从而间接了解驱动ARF4基因的表达强弱;同时采用不同处理,如不同种类激素处理等,可以明确影响ARF4 基因启动子转录活性的各种因素,从而为通过调控启动子的转录活性来调节基因的表达提供理论依据。
附图说明
图1为植物表达载体pRI201-AN-GUS-ARF4-Pro构建方法示意图
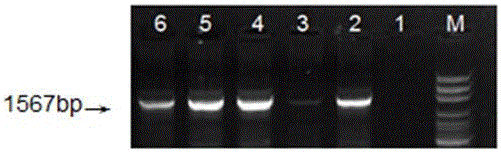
图2为以草莓叶片DNA为模板的ARF4基因启动子克隆后的电泳图;
其中,M:100 bp Marker;1:清水对照;2,4,5,6:ARF4基因启动子
图3为以阳性pGM-ARF4-Pro重组质粒为模板的ARF4基因启动子克隆后的电泳图;
其中,M:100 bp Marker;1-10:ARF4基因启动子
图4为用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)软件对克隆的‘艳丽’草莓ARF4基因启动子序列中的核心作用元件进行分析的结果
图5为以阳性pRI201-AN-GUS-ARF4-Pro重组质粒为模板克隆ARF4启动子的电泳图;
其中,M:100bp Marker;泳道1、2、3、4、6、7、8、10为扩增所得的目的片段
图6为阳性pRI-201-GUS-ARF4-Pro重组质粒双酶切的电泳图;
其中M:100 bp marker;泳道1:pRI-201-GUS;泳道2:pRI-201-GUS-ARF4-Pro
图7为构建ARF4启动子融合GUS报告基因植物表达载体后扩增AFR4基因启动子的电泳图;
其中M:100 bp marker;泳道1、2:AFR4基因启动子
图8为构建ARF4启动子融合GUS报告基因植物表达载体后扩增GUS基因片段的电泳图;
其中M:100 bp marker;泳道1、2、3、4:GUS基因片段。
具体实施方式
下面结合实例对本发明做进一步说明
实施例1:草莓ARF4基因启动子序列的克隆
植物材料为‘艳丽’草莓。
1. 草莓DNA的提取
将草莓幼嫩叶片(0.05~0.1 g)在液氮中研碎,迅速移入1.5 ml离心管中。
加入600 μL 预热的2% CTAB提取缓冲液(预热前加入0.4% β-巯基乙醇)于65°C保温20~30 min,期间颠倒几次。
加入600 μL 氯仿/异戊醇(24:1),轻轻颠倒若干次,10 000 r/min离心10 min。
把上清液(约500 μL)移入新的1.5 ml离心管,加入等体积的氯仿/异戊醇,轻轻颠倒若干次,10 000 r/min离心10 min。
取上清液(约300 μL)加入新的1.5 mL离心管,加入二倍体积冰冷的无水乙醇,颠倒混匀。
挑出沉淀,放到含350 μL TE缓冲液的1.5 mL离心管中,当大部分沉淀溶解后,10000 r/min离心10 min。
将上清(约300 μL)加入新的1.5 mL离心管,加入1μL RNase,轻轻混匀后在37°C水浴1 h。
冷却至室温,加入1/3体积的3 M NaAc,混匀后再加入二倍体积冰冷的无水乙醇,颠倒混匀,–20°C放置1 h,10 000 r/min离心10 min。
弃上清,用70%乙醇洗涤DNA沉淀2次。
在超净工作台上风干DNA。加入100μL TE溶解DNA,于冰箱中保存。
2. 利用Primer Primers 5.0软件分析设计引物并扩增ARF4基因启动子
上游引物PRO-ARF4-F:5'-AACTGCAGTACGGCTTCAAGGTTAAG-3';
下游引物PRO-ARF4-R:5'- GCTCTAGA TCTCTCTCTCTCTGCT-3';
以提取的草莓叶片DNA为模板,进行PCR反应;
PCR反应体系为:取1 μL DNA加入PreMix Taq (Ex Taq version 2.0 plus dye) 10 μL,正反向引物各0.5 μL,最后用水补足到20 μL;
PCR反应程序:95℃ 3 min;95℃ 30 s,59℃ 30 s,72℃ 1.5 min,35个循环;72℃延伸5 min,4℃保存;
PCR产物琼脂糖凝胶电泳检测图如图2所示,从图2可见一条目的条带,大小为1567 bp。
实施例2:重组载体pGM-ARF4-Pro的构建
植物材料为‘艳丽’草莓。
1. DNA的提取
方法同实施例1的步骤1。
2. PCR扩增ARF4基因启动子并与pGM-T连接
上游引物PRO-ARF4-F:5'- AACTGCAGTACGGCTTCAAGGTTAAG-3';
下游引物PRO-ARF4-R:5'- GCTCTAGA TCTCTCTCTCTCTGCT-3';
以提取的叶片DNA为模板,通过引物,进行PCR扩增反应,在目的基因上游和下游分别引入Pst I和XbaI 酶切位点,使用AxyPrep DNA凝胶回收试剂盒回收PCR产物。
回收后,将回收的PCR产物与pGM-T载体进行连接,操作步骤按天根公司产品pGM-T试剂盒说明书进行。
连接反应体系为:取7 μL回收的PCR产物,1 μL T4 DNA连接酶, 10×T4 DNA连接酶Buffer 1μL,pGM-T载体1μL;
连接反应程序:16℃连接16 h;
然后转化大肠杆菌TOP10感受态细胞,在表面涂有24 μg·mL-1异丙基-β-D-硫代吡喃半乳糖苷(IPTG)和40 μg·mL-1 5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)的含Amp(60 μg·mL-1)的LB培养基平板上,37℃培养12-16 h。挑取单个白色克隆,分别涂布于新的含有Amp(60 μg·mL-1) 的LB培养基平板上(二转),37℃培养12-16 h,之后进行菌落PCR扩增,如图3所示。将验证正确的菌株培养后,送北京华大公司测序,得到序列如序列表中‘艳丽’草莓ARF4基因启动子序列所示,用DNAMAN软件将测序序列与二倍体森丽草莓ARF4基因启动子序列进行比对,正确后分析ARF4基因启动子序列的核心作用元件,如图4所示,序列分析正确后证明重组载体pGM-ARF4-Pro构建成功。
实施例3:草莓ARF4启动子融合GUS报告基因的植物表达载体的构建
1.使用天根公司离心柱型质粒小提中量试剂盒(TIANprep Midi Plasmid Kit)分别提取pGM-ARF4和pRI201-AN-GUS载体的质粒DNA,具体操作如下:
1)柱平衡步骤:向吸附柱CP4中(吸附柱放入收集管中)加入500 μL的平衡液BL,1 2000 r/min离心1 min,倒掉收集管中的废液,将吸附柱重新放回收集管中;
2)取15 mL过夜培养的菌液加入离心管中,1 2000 r/min离心1 min,尽量吸除上清;
3)向留有菌体沉淀的离心管中加入500 μL溶液P1(使用前加入RNaseA),使用涡旋振荡器彻底悬浮细菌细胞沉淀;
4)向离心管中加入500 μL溶液P2,温和地上下翻转6~8次使菌体充分裂解。此时菌液变得清亮粘稠,所用时间不应超过5min,以免质粒受到破坏。如果菌液没有变清亮,可能是由于菌体过多,裂解不彻底,应减少菌体量;
5)向离心管中加入700 μL溶液P3,立即温和地上下翻转6~8次,充分混匀,此时会出现白色絮状沉淀。1 2000 r/min离心10 min,此时在离心管底部形成沉淀。P3加入后应立即混合,避免产生局部沉淀。如果上清中还有微小白色沉淀,可再次离心后取上清;
6)将上一步收集的上清液分次加入吸附柱CP4中(吸附柱放入收集管中,其容量为750~800 μL),注意尽量不要吸出沉淀。1 2000 r/min离心1 min,倒掉收集管中的废液,将吸附柱CP4放入收集管中;
7)向吸附柱CP4中加入500 μL去蛋白液PD,1 2000 r/min离心1min,倒掉收集管中的废液,将吸附柱CP4 重新放回收集管中;
8)向吸附柱CP4中加入700 μL漂洗液PW(先检查是否已加入无水乙醇),1 2000 r/min离心1 min,倒掉收集管中的废液,将吸附柱CP4放入收集管中;
9)向吸附柱CP4中加入500 μL漂洗液PW,1 2000 r/min离心1 min,倒掉收集管中的废液;
10)吸附柱CP4放入收集管中,1 2000 r/min离心2 min,目的是将吸附柱中残余的漂洗液去除。将吸附柱CP4开盖,置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液;
11)将吸附柱CP4置于一个干净的离心管中,向吸附膜的中间部位悬空滴加100 μL洗脱缓冲液EB,室温放置2~5 min,1 2000 r/min离心2 min,将质粒溶液收集到离心管中;
12)将洗脱缓冲液重复加到吸附柱CP4中以增加质粒的回收效率。
2. 取上述带有酶切位点的pRI201-AN-GUS质粒 (TaKaRa,Japan)和ARF4启动子质粒pGM-ARF4-Pro,均用Pst I和Xba I进行双酶切,双酶切体系(20 μL):pGM-ARF4-Pro/pRI201-AN-GUS 16 μL,10×M Buffer 2 μL,Pst I和Xba I各1 μL;37℃酶切,4 h;
用AxyPrepDNA凝胶回收试剂盒回收pRI201-AN-GUS较大片段和ARF4启动子的pGM-ARF4-Pro较小片段。用T4 DNA连接酶(NEB)连接两个回收产物,连接反应体系(10 μL):10×Ligase Buffer l μL,pRI201-AN-GUS大片段1 μL, ARF4启动子的pGM-ARF4-Pro较小片段7 μL,T4 DNA连接酶1 μL;16℃连接,16 h。
然后转化大肠杆菌TOP10感受态细胞,涂布于含 Kan (50 μg·mL-1)的LB培养基平板上,37℃培养12-16 h。挑取单个白色克隆,分别涂布于新的含有Kan (50 μg·mL-1) 的LB培养基平板上(二转),37℃培养12-16 h。利用上游引物PRO-ARF4-F和下游引物PRO-ARF4-R,进行菌落PCR扩增,如图5所示,证明草莓ARF4启动子融合GUS报告基因的植物表达载体pRI201-AN-GUS-ARF4-Pro构建成功。
3. 提取pRI201-AN-GUS-ARF4-pro的质粒DNA
方法同实施例3的步骤1。
对提取的质粒用Pst I和Xba I双酶切,双酶切体系(20 μL):pRI201-AN-GUS-ARF4-pro的质粒DNA 16 μL,10×H Buffer 2 μL,Nde I和Sal I各1 μL;37℃酶切,4 h;琼脂糖凝胶电泳如图6所示,两条谱带,说明双酶切反应成功,进一步证明草莓ARF4启动子融合GUS报告基因的植物表达载体pRI201-AN-GUS-ARF4-Pro构建成功。同时分别以重组质粒pRI201-AN-GUS-ARF4-pro为模板扩增ARF4基因启动子(如图7所示)和GUS报告基因(如图8所示),均能获得目的片段,再次证明草莓ARF4启动子融合GUS报告基因的植物表达载体pRI201-AN-GUS-ARF4-Pro构建成功。
序列表
<110>沈阳农业大学
<120>一种草莓ARF4启动子融合GUS基因的载体构建方法
<160>1
<210>1
<211>1567
<212>DNA
<213>‘艳丽’草莓ARF4基因启动子
<400>1
tacggcttca aggttaagtt aaatagttaa gtaaaagaca atatggatgc catataatac 60
ctactgagtc ttaaagattt ggttgcataa taattgatac taattgctat ggctttttag 120
ccaaattgct accatagctt ttaccttgat gtcaatttgt taccctaact tttaattcag 180
ccaatttgtt atcctaaatt ttcataatta gccaatttgc taccctaaat attatttctg 240
ccgatttact accttatgtt atgaaaatta gccaatttgt tacatttttg tcattttata 300
atttagtcat tttttcatcc aaacatgaat taattctgaa aattgaagct taaagttgat 360
caatattgaa atttcgataa ataaattggt taatcttgaa actttaaagt agcaaatttg 420
atggaagggt agcaaattgg cttaaataaa acctagggta gcaaattggc taatttagaa 480
aaattaagat aacaaattgg ctgaaatgaa agttagggta ataaattgac accaaaacgt 540
aaaaactagg gtaacaaatt aacaattatg ccaatagata tcagagatag gttgatggtg 600
acacatcatc taaggtggag tcaagtgaat gttgaaggtg gaggagtggg tgagagaaga 660
cagtcttgat tgaataagtt ttgtagttgt gcaagctaga ataaaaagaa aaagaaaatc 720
ttgatcaaat gtggatcgag tatgggattg atatatgact tgagggatga tggttataga 780
gaaaggttgt atctggccat gataaaaatt gttatgtgtg tcttgaccaa aaaaattaaa 840
agaaaaagtt tttataagtg gatgactagt tctgatgaca cgagcatttt gtgacaaatt 900
tattcgtaaa aaacagaact aatgttctaa ataaaatcgt tagattctgc atgctaattg 960
agttattcaa gtgtgaaatg tgagtcttaa catgtttaga gcataattta ttttcttttc 1020
agaacttgat tcttcttttt tatgccgtat tgtcgatgca ttcctagctc ctaaccccac 1080
ttctattatt catactccat aggcaagtta aagggtggct cataggttag gtagagttct 1140
gtttcttacc ataatgtgat acaaacttgg tttaaatctg ttcctgaaaa tagatgaaaa 1200
gaaaaacgaa tattgctctt actgtcttgc ctttcttagc tcttgttgtg ttgaatgaaa 1260
ccccccttct gtggagggaa accggttgag atgacagttt tctttaataa cttcataaat 1320
actcagtcgg gaagaagaag atgacaattt tccattttat tgaaattttt tctttgaaga 1380
aaaataaagg caatggaaac cccttttttg tcttttcatt cttgcccaga ccttcctttt 1440
gtcttggtgg agggccttca cctacagttg tttagtgaga actgatgaga tggaaaattg 1500
gagtaattta aaagctttaa agagataaag aagggcaaag gcaaaggaaa aagcagagag 1560
agagaga 1567
- 还没有人留言评论。精彩留言会获得点赞!