一种缓释生长因子多细胞球培养膜板及其构建方法与流程
本发明涉及生物医学领域,尤其是一种缓释生长因子多细胞球培养膜板及其构建方法。
背景技术:
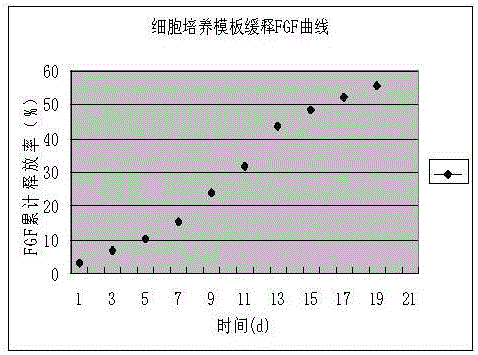
:肝衰竭是多种因素引起的严重肝脏损害,导致其合成、解毒、排泄和生物转化等功能发生严重障碍或失代偿,出现以凝血机制障碍和黄疸、肝性脑病、腹水等为主要表现的一组临床症候群。急性肝衰蝎是临床亟待解决的治疗难题。尽管内科综合治疗措施取得了较大进展,患者病死率依然高达50%-80%。肝移植可以显著降低病死率,但因供体短缺,大多数患者在等待供肝的过程中死亡。因此生物人工肝与肝细胞移植等细胞水平的新治疗方法得到了研究与发展,在大量动物实验和一些临床实验中获得良好效果,成为有前途的肝病治疗途径。实际上无论是肝细胞移植还是生物人工肝支持治疗,其核心原材料都是肝细胞,对肝功能衰竭患者的治疗作用几乎完全依赖于所用肝细胞的生物学功能。人体中的绝大多数细胞生活在三维的环境中,细胞必须通过细胞-细胞以及细胞-细胞外基质之间的相互作用,获得各种生化和机械信号,才能维持其正常的生理活动。大量研究表明,细胞与细胞外基质以及细胞与细胞之间的相互作用对于调控细胞的迁移、增殖和分化有重要的作用。一般使用的二维单层培养的细胞缺乏这样的信号传递,不能很好地模拟体内细胞的微环境。相反,在三维的多细胞球中细胞与外部环境的相互作用可大部分得到重建,因此,和细胞单层相比,多细胞球能更好地模拟体内细胞的微环境。正因为此,多细胞球在基因及功能表达等很多方面更接近于正常人体细胞。通常的细胞培养有贴壁、悬浮两种生长方式。悬浮生长限于少数几类细胞,如白细胞、淋巴组织细胞以及腹水癌细胞等。大部分的细胞如肝细胞为贴壁生长,虽然肝细胞失去接触抑制的特性,但是在普通培养条件下,细胞仍然以二维生长为主。因此,为实现肝细胞的三维生长,创造避免贴壁的生长条件是现阶段亟待解决的技术问题。技术实现要素:本发明所要解决的技术问题在于提供一种缓释生长因子多细胞球培养膜板。本发明所要解决的另一技术问题在于提供上述缓释生长因子多细胞球培养膜板的构建方法。为解决上述技术问题,本发明的技术方案是:一种缓释生长因子多细胞球培养膜板,是聚酸酐包载由海藻酸钠保护的成纤维细胞生长因子(FGF)和肝细胞生长因子(HGF)所得到的,所述海藻酸钠具有网状结构,成纤维细胞生长因子(FGF)和肝细胞生长因子(HGF)嵌在该网状结构的孔隙中。上述缓释生长因子多细胞球培养膜板中所述聚酸酐是一类新型的医用高分子材料,具有生物降解特性。具有(Ⅰ)所示分子结构,据R基的不同,可将聚酸酐分为脂肪族聚酸酐、芳香族聚酸酐、杂环族聚酸酐、聚酰酸酐、聚酰胺酸酐、可交联的酸酐、含磷聚酸酐等。优选的,上述缓释生长因子多细胞球培养膜板,所述聚酸酐为芳香族聚酸酐P(CPP-SA)(聚酸酐〔聚1,3-双(对羧基苯氧基)丙烷-癸二酸]),具有(Ⅱ)所示分子结构,优选的,上述缓释生长因子多细胞球培养膜板,所述膜板中各成分的用量比按重量份数计为聚酸酐94.8-97.8份、海藻酸钠0.5-2份、成纤维细胞生长因子0.01-0.1份和肝细胞生长因子0.01-0.1份。上述缓释生长因子多细胞球培养膜板的构建方法,具体步骤如下:(1)配置有机相:将聚酸酐〔聚1,3-双(对羧基苯氧基)丙烷-癸二酸](P(CPP-SA))与表面活性剂双十二烷基二甲基溴化铵(DDDA·Br)以20-40:1-1.5的质量比混合;室温下溶于二甲基甲酰胺(DMF)和二氯甲烷体积比为1-2:1-5的混合溶液中,至聚酸酐完全溶解,得有机相溶液A备用;(2)配置水相:成纤维细胞生长因子(FGF)溶于0.8%海藻酸钠溶液中配成600ng/mLFGF多糖保护溶液;肝细胞生长因子(HGF)溶于0.8%海藻酸钠溶液中配成600ng/mLHGF多糖保护溶液;按体积比0.1-1:1-0.1将FGF多糖保护溶液和HGF多糖保护溶液进行混合,得水相溶液B备用;(3)有机相溶液A和水相溶液B按体积比20-50:1-2投放,在2℃-6℃水浴中,通风橱内磁力搅拌下缓慢滴加水相溶液B到有机相溶液A中,30min后放入室温下通风橱内磁力搅拌8h,乳化后制得油包水微球乳液;(4)将乳化后制得的油包水微球乳液在室温下,通风橱内环境湿度为50%-70%的条件下浇铸在干净的玻璃皿基底上,待有机溶剂和水完全挥发后,得到有序的凹孔状具有缓释生长因子的多细胞球培养膜板。优选的,上述缓释生长因子多细胞球培养膜板的构建方法,具体步骤如下:(1)配置有机相:将聚酸酐〔聚1,3-双(对羧基苯氧基)丙烷-癸二酸](P(CPP-SA))与表面活性剂双十二烷基二甲基溴化铵(DDDA·Br)以20:1的质量比混合;室温下溶于二甲基甲酰胺(DMF)和二氯甲烷体积比为1:3的混合溶液中,至聚酸酐完全溶解,得有机相溶液A备用;(2)配置水相:成纤维细胞生长因子(FGF)溶于0.8%海藻酸钠溶液中配成600ng/mLFGF多糖保护溶液;肝细胞生长因子(HGF)溶于0.8%海藻酸钠溶液中配成600ng/mLHGF多糖保护溶液;按体积比1:1将FGF多糖保护溶液和HGF多糖保护溶液进行混合,得水相溶液B备用;(3)有机相溶液A和水相溶液B按体积比25:2投放,在4℃水浴中,通风橱内磁力搅拌下缓慢滴加水相溶液B到有机相溶液A中,30min后放入室温下通风橱内磁力搅拌8h,乳化后制得油包水微球乳液;(4)将乳化后制得的油包水微球乳液在室温下,通风橱内环境湿度为65%的条件下浇铸在干净的玻璃皿基底上,待有机溶剂和水完全挥发后,得到有序的凹孔状具有缓释生长因子的多细胞球培养膜板。本发明的有益效果是:上述缓释生长因子多细胞球培养膜板,利用聚酸酐对生物体具有良好的生物相容性,特别是聚酸酐降解过程具有表面溶蚀性,首次以具有表面溶蚀性能的聚酸酐为模板材料,包载经海藻酸钠保护的细胞生长因子,利用乳化、溶剂挥发技术制备出具有凹槽空间(孔径5μm-100μm)、而且缓慢释放细胞因子的三维多细胞球培养膜板。不同于现有技术中聚酸酐包载生长因子,本发明采用聚酸酐制备细胞培养模板,而使用海藻酸钠包载生长因子后制备凹槽,用于细胞培养。通过对多孔膜板制备、影响因素、细胞因子释放、体外细胞毒性试验等研究,证明所述多细胞球培养膜板具有适宜多细胞球立体培养的凹槽空间,可以缓慢释放活性细胞因子,无细胞毒性,可以促进细胞三维增殖培养,为进一步多细胞球立体培养研究奠定了基础。附图说明图1是多细胞球培养膜板结构放大图;图2为缓释生长因子多细胞球培养膜板红外光谱图(IR);图3是缓释生长因子多细胞球培养膜板扫描电镜图,可以看到在多细胞球培养膜板中存在着有序的周期性结构,形成孔洞比较均一的凹槽状,约为12μm左右,孔洞呈单层排布,孔深约为2.8μm左右,孔洞和玻璃皿基底之间也存在一层较薄的聚酸酐层面;图4是聚酸酐浓度0.2mg/ml扫描电镜;图5是聚酸酐浓度0.8mg/ml扫描电镜;图6是聚酸酐浓度3.2mg/ml扫描电镜;图7是DMF-CH2CL2(1:3)溶剂凹孔状膜板扫描电镜;图8是DMF-CHCL3(1:3)溶剂凹孔状膜板扫描电镜;图9是湿度为20%时凹孔状膜板扫描电镜;图10是湿度为40%时凹孔状膜板扫描电镜;图11是湿度为60%时凹孔状膜板扫描电镜;图12是多细胞球培养膜板缓释FGF生长因子曲线;图13是多细胞球培养膜板缓释HGF生长因子曲线。图14是多细胞球培养膜板体外累积释放FGF曲线和HGF曲线,A:缓释FGF生长因子曲线;B:缓释HGF生长因子曲线。具体实施方式下面结合具体实施例对本发明所述技术方案作进一步的说明。下述实施例所用仪器与材料为:聚酸酐〔聚1,3-双(对羧基苯氧基)丙烷-癸二酸]P(CPP-SA))(Wcpp:Wsa=75:25):GCP相对分子质量测定:P(CPP-SA)聚酸酐的重均相对分子质量Mw≥20000。天津市第三中心医院肝胆疾病研究所研制,制备方法见文献[于美丽聚酸酐-比柔比星控释植入剂的研究及应用[J].生物医学工程学杂志2002;19(2):69-79;于美丽抗膀胱癌纳米控释植入剂的制备及动物实验研究[J].中华临床杂志2002;2(10):41-43];双十二烷基二甲基溴化铵(DDDA·Br)购于SIGMA-ALDRICH,美国;二甲基甲酰胺(DMF)分析纯、二氯甲烷分析纯(含水量≤0.05%)、三氯甲烷分析纯(含水量≤0.02%)、海藻酸钠分析纯购自天津市基准化学试剂有限公司;成纤维细胞生长因子fibroblastgrowthfactor,(FGF)、肝细胞生长因子Hepatocytegrowthfactor(HGF)购自天津市联星生物技术有限公司;成纤维细胞生长因子(FGF)检测试剂盒、人肝细胞生长因子定量测定(HGF)ELISA试剂盒购自上海裕平生物科技有限公司。NCTCclone929(小鼠成纤维细胞L-929)中国食品药品检定研究院。离心机Eppendorff德国,真空干燥机Yamato日本,扫描电镜Phenom,FEICompany,美国,酶标仪(芬兰雷勃公司,MK3)。实施例1缓释生长因子多细胞球培养膜板结构表征配置有机相:将400mg聚酸酐P(CPP-SA)与20mg双十二烷基二甲基溴化铵(DDDA·Br)室温下溶于500ml二甲基甲酰胺(DMF)和二氯甲烷体积比为1:3的混合溶液中,使聚酸酐完全溶解,聚酸酐浓度为0.8mg/ml,DDDA·Br浓度为0.04mg/ml。配置水相:成纤维细胞生长因子(FGF)溶于0.8%海藻酸钠溶液中配成20ml浓度为600ng/mLFGF海藻酸钠保护溶液。肝细胞生长因子(HGF)溶于0.8%海藻酸钠溶液中配成20ml600ng/mLHGF海藻酸钠保护溶液。按体积比1:1混合FGF海藻酸钠保护溶液和HGF海藻酸钠保护溶液40ml。在4℃水浴中,通风橱内磁力搅拌下缓慢滴加水相溶液到有机相溶液中,有机相溶液和水相溶液的体积比25:2,30min后放入室温下通风橱内磁力搅拌8h,乳化后制得油包水微球乳液;将制备的乳化后制得油包水微球乳液在室温下,通风橱内环境湿度为65%的条件下(温度25℃)浇铸在干净的玻璃皿基底上,待有机溶剂和水完全挥发后,得到有序的凹孔状具有缓释生长因子的多细胞球培养膜板,将所制备的缓释生长因子多细胞球培养膜板进行预处理干燥后喷金,进行扫描电镜分析,观察多孔膜板结构,如图1所示。实施例2缓释生长因子多细胞球培养膜板的构建A.有机相配置:将聚酸酐〔聚1,3-双(对羧基苯氧基)丙烷-癸二酸](P(CPP-SA))与表面活性剂双十二烷基二甲基溴化铵(DDDA·Br)以40:1.5的质量比混合;室温下溶于二甲基甲酰胺(DMF)和二氯甲烷体积比为1:1的混合溶液中,至聚酸酐完全溶解,得有机相溶液A备用;B.水相配置:成纤维细胞生长因子(FGF)溶于0.8%海藻酸钠溶液中配成600ng/mLFGF多糖保护溶液;肝细胞生长因子(HGF)溶于0.8%海藻酸钠溶液中配成600ng/mLHGF多糖保护溶液;按体积比0.1:1混合FGF多糖保护溶液和HGF多糖保护溶液,得水相溶液B备用;C.有机相溶液A和水相溶液B按体积比20:1投放,在4℃水浴中,通风橱内磁力搅拌下缓慢滴加水相溶液B到有机相溶液A中,30min后放入室温下通风橱内磁力搅拌8h,乳化后制得油包水微球乳液;D.将乳化后制得的油包水微球乳液在室温下,通风橱内环境湿度为50%的条件下浇铸在干净的玻璃皿基底上,待有机溶剂和水完全挥发后,得到有序的凹孔状具有缓释生长因子的多细胞球培养膜板。实施例3缓释生长因子多细胞球培养膜板的构建A.有机相配置:将聚酸酐〔聚1,3-双(对羧基苯氧基)丙烷-癸二酸](P(CPP-SA))与表面活性剂双十二烷基二甲基溴化铵(DDDA·Br)以30:1的质量比混合;室温下溶于二甲基甲酰胺(DMF)和二氯甲烷体积比为2:5的混合溶液中,至聚酸酐完全溶解,得有机相溶液A备用;B.水相配置:成纤维细胞生长因子(FGF)溶于0.8%海藻酸钠溶液中配成600ng/mLFGF多糖保护溶液;肝细胞生长因子(HGF)溶于0.8%海藻酸钠溶液中配成600ng/mLHGF多糖保护溶液;按体积比1:0.1混合FGF多糖保护溶液和HGF多糖保护溶液,得水相溶液B备用;C.有机相溶液A和水相溶液B按体积比50:2投放,在4℃水浴中,通风橱内磁力搅拌下缓慢滴加水相溶液B到有机相溶液A中,30min后放入室温下通风橱内磁力搅拌8h,乳化后制得油包水微球乳液;D.将乳化后制得的油包水微球乳液在室温下,通风橱内环境湿度为60%的条件下浇铸在干净的玻璃皿基底上,待有机溶剂和水完全挥发后,得到有序的凹孔状具有缓释生长因子的多细胞球培养膜板。实施例4配置0.2mg/ml、0.8mg/ml、3.2mg/ml浓度聚酸酐观察凹孔状膜板的形貌变化。溶剂的选择对于凹孔状膜板的形貌和柔韧度起到了很大的作用,实验选择二氯甲烷、三氯甲烷、二甲基甲酰胺(DMF)和二氯甲烷体积比1:3混合物、二甲基甲酰胺(DMF)和三氯甲烷体积比1:3混合物,进行了多细胞球培养膜板的比较研究。一定的湿度条件是制备凹孔状膜板的先决条件,实验利用饱和氯化钠溶液控制环境湿度,湿度50%-75%条件下控制所成凹孔状膜板孔径的大小。1.多细胞球培养膜板缓释FGF和HGF生长因子测定多细胞球培养膜板是由聚酸酐包载海藻酸钠保护的成纤维细胞生长因子(FGF)和肝细胞生长因子(HGF)组成,海藻酸钠具有网状结构,FGF和HGF嵌在网状孔隙中可以保持良好的生物活性,聚酸酐具有表面溶蚀性,在细胞培养体系中可以缓慢释放FGF和HGF。以PBS缓冲液100mL作为溶出介质,放入2x2cm2多细胞球培养膜板。温度37±0.5℃。分别于各时间点(0d,2d,4d,6d,8d,10d,12d,14d,16d,18d,20d)取样100μL。每次取样后,立即补充同温度的PBS缓冲液100μL。多细胞球培养膜板缓释FGF测定:按照人成纤维细胞生长因子21(fgf-21)ELISA试剂盒说明书进行。多细胞球培养膜板缓释HGF测定:按照人肝细胞生长因子定量测定(HGF)ELISA试剂盒检测说明书检测。2.多细胞球培养膜板体外细胞毒性试验多细胞球培养膜板体外细胞毒性试验依据GB/T16886.5-2003医疗器械生物学评价第5部分——体外细胞毒性试验方法进行。采用四唑盐(MTT)比色法,0.22μm滤器过滤的含10%胎牛血清MEM培养液为浸提介质;样品2.0g,加浸提介质10.0ml,37℃浸提24h后得到浸提原液;细胞株:NCTCclone929;浸提介质为空白对照,30cm2的高密度聚乙烯加入浸提介质5.0ml,置37℃,浸提24h为阴性对照,含5%二甲基亚砜的浸提介质为阳性对照。细胞悬液制备:将正常传代培养的L-929细胞,经0.25%胰酶消化制成浓度为1×104/ml的细胞悬液,接种于96孔板,每孔200μl,每组6孔,置5%CO2培养箱内37℃培养24h。浸提液交换:细胞培养24h后,弃去原培养液,空白组用浸提介质交换,阴性对照组用浸提比例为6cm2/ml高密度聚乙烯浸提液交换,阳性对照组用含5%二甲基亚砜的浸提介质交换,试验样品组用浸提液进行交换。置5%CO2培养箱内37℃,培养72h。吸光度的测定:更换培养液后,取培养72h的孔板,每孔加入40μl5g/L四唑盐(MTT)溶液继续培养4h后弃去孔内液体,加入150μL二甲基亚砜,置振荡器上振荡10min,在酶标仪570nm和630nm处测定各孔吸光度。按下式计算相对增殖率(RGR)。A—样品组(阴性、阳性组)吸光度A0—空白对照组吸光度细胞毒性评价等级级别相对增殖率%级别相对增殖率%0级≥1003级30~491级80~994级0~292级50~79结果如下:1.缓释生长因子多细胞球培养膜板IR光谱图和扫描电镜结果,见图2、3。2.缓释生长因子多细胞球培养膜板影响因素3.聚酸酐溶液浓度的影响聚酸酐溶液浓度与所制成凹孔状膜板的孔径大小呈负相关。环境湿度为55%,二甲基甲酰胺(DMF)和二氯甲烷体积比为1:3的混合溶液为溶剂,聚酸酐浓度分别为0.2mg/ml、0.8mg/ml、3.2mg/ml制成凹孔状膜板的SEM图如下,分别为图4-6,由SEM图可观察到随着聚酸酐溶液浓度越大,所得到孔径越小。这是由于随着聚酸酐浓度增加,溶液粘度增大导致对流作用变弱,水分子间碰撞融合几率变小,水分子周围的聚酸酐浓度增大,相邻水分子间融合速度减小,制得的凹孔状膜板孔洞的尺寸也随之变小。4.溶剂的影响溶剂的选择对于凹孔状膜板的形貌和柔韧度起到了很大的作用,实验选择二氯甲烷、三氯甲烷、二甲基甲酰胺(DMF)和二氯甲烷1:3混合物、二甲基甲酰胺(DMF)和三氯甲烷1:3混合物,进行了多细胞球培养膜板的比较研究。分别选择二氯甲烷和三氯甲烷为溶剂所制备的凹孔状膜板柔韧度差,为提高膜板柔韧度,实验分别选择二甲基甲酰胺(DMF)和二氯甲烷1:3混合物、二甲基甲酰胺(DMF)和三氯甲烷1:3混合物为溶剂,聚酸酐溶液浓度1.2mg/ml,环境湿度为55%,制成凹孔状膜板的SEM如图5和图6。由于溶剂的沸点二氯甲烷低于三氯甲烷,用二甲基甲酰胺(DMF)和二氯甲烷1:3混合物制备的凹孔状膜板孔洞(图7)小于由二甲基甲酰胺(DMF)和三氯甲烷1:3混合物为溶剂的孔洞(图8),但孔洞的有序性高于二甲基甲酰胺(DMF)和三氯甲烷1:3混合物为溶剂的凹孔状膜板。孔洞的有序性以及大小差异是由于溶剂的挥发速度不同所导致的,而溶剂的挥发速度又取决于其分子量以及饱和蒸汽压,通常情况下,溶剂的挥发速度随其饱和蒸汽压的降低而降低,因此,低饱和蒸汽压的溶剂挥发的速度慢,相邻水分子间有更多机会合并形成孔洞尺寸较大。较大尺寸孔洞会打乱水分子间原有的均匀排列,因此降低凹孔状膜板孔洞的有序性。选择具有合适挥发速度的溶剂对有序多孔膜的形成至关重要。5.湿度的影响二甲基甲酰胺(DMF)和二氯甲烷体积比为1:3的混合溶液为溶剂,聚酸酐浓度为1.2mg/ml,不同湿度对凹孔状膜板结构形成以及有序性的影响,如图9-11所示,在湿度为20%时凹孔状膜板孔洞尺寸偏小,孔洞数目较少;在40%湿度下凹孔状膜板孔洞尺寸变大且数目增多,形成较为有序的六方密堆积排列;在60%湿度凹孔状膜板中有比较大孔洞存在,一致性稍差。这种现象是由于环境湿度小时,浮在液面上的微乳液中水滴挥发快,凹孔状膜板孔洞较小;在45%湿度下,空气中水分子会抵消挥发导致的损失,形成更大尺寸的孔洞;当在60%及以上的湿度时,大量的空气中的水蒸气由于有机溶剂挥发导致的溶液表面温度降低而冷凝在液面上,使水分子聚集形成较大尺寸的孔洞。6.多细胞球培养膜板缓释FGF和HGF生长因子根据多细胞球培养膜板各个时间点释放液的吸光度值,分别经标准曲线得出FGF和HGF浓度,绘制出多细胞球培养膜板体外累积释放FGF曲线和HGF曲线。结果显示,20d的累积释放率FGF达到55.7%,HGF达到48.2%(见图12,图13),由于聚酸酐具有表面溶蚀性,因此释放初期基本无突释。7.多细胞球培养膜板体外细胞毒性试验结果72h阴性对照组RGR为98.8%,细胞毒性反应为1级;阳性对照组RGR为4.2%,细胞毒性反应为4级。试验系统反应成立。多细胞球培养膜板浸提液细胞相对增殖率RGR为73.4%,细胞毒性反应为2级。综上所述,本发明所述缓释生长因子多细胞球培养膜板的最优化构建条件如下:聚酸酐〔聚1,3-双(对羧基苯氧基)丙烷-癸二酸](P(CPP-SA))与表面活性剂双十二烷基二甲基溴化铵(DDDA·Br)以20:1的质量比投料,成纤维细胞生长因子(FGF)溶于0.8%海藻酸钠溶液中配成600ng/mLFGF多糖保护溶液。肝细胞生长因子(HGF)溶于0.8%海藻酸钠溶液中配成600ng/mLHGF多糖保护溶液。1:1混合FGF多糖保护溶液和HGF多糖保护溶液聚酸酐和1:1混合FGF多糖保护溶液和HGF多糖保护溶液按25:2体积比投放,温度25℃,湿度65%。根据多细胞球培养膜板各个时间点释放液的吸光度值,分别经标准曲线得出FGF和HGF浓度,绘制出多细胞球培养膜板体外累积释放FGF曲线和HGF曲线。结果显示,20d的累积释放率FGF达到55.7%,HGF达到48.2%(见图14),由于聚酸酐具有表面溶蚀性,因此释放初期基本无突释。上述参照实施例对该一种缓释生长因子多细胞球培养膜板及其构建方法进行的详细描述,是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下的变化和修改,应属本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- UCP1在人重组FGF21蛋白活性检测中的应用的制造方法与工艺
- UCP3在人重组FGF21蛋白活性检测中的应用的制造方法与工艺
- 原核表达载体及rbFGF‑2表达方法与工程菌和应用与流程
- 一种利用鱼卵母细胞提取物诱导成纤维细胞重编程为成骨细胞样细胞的试剂盒及方法与流程
- 控制影响角化细胞和/或成纤维细胞和真皮的皮肤失调和皮肤老化的组合产品和美容组合物的制造方法与工艺
- 在CHO细胞中rhIL‑12表达系统的构建方法与制造工艺
- 人皮肤成纤维细胞诱导为神经细胞的方法与应用与制造工艺
- 一种制备人皮肤成纤维细胞膜片的细胞培养基和使用方法与制造工艺
- 检测人FGFR3基因突变的引物组及其试剂盒的制造方法与工艺
- 一种氧调控性碱性成纤维细胞生长因子修饰细胞的方法与制造工艺