一种双二氢吡唑螺环类化合物及其合成方法与流程
本发明属于有机合成领域,涉及一种双二氢吡唑螺环类化合物及其合成方法。
背景技术:
二氢吡唑类化合物广泛地存在于除草剂、杀虫剂、杀菌剂以及医药中,而二氢吡唑类螺环化合物以及类似物也具有多样性的生物活性,在医药、农药等领域具有极大的研究价值。尽管有大量关于二氢吡唑类螺环化合物的方法,但是这些方法都是基于螺环的一个环构建另一个二氢吡唑环,因此,发展简单实用的高效合成方法同时构建螺环化合物的两个环具有重要的研究意义。
1,3-偶极环加成反应是合成碳环和杂环化合物的最有效的工具之一,利用这类环加成反应可以非常简洁地从便宜易得的原料合成结构复杂的碳环和杂环化合物。目前,1,3-偶极环加成反应已被用于合成环戊烷、环戊烯、四氢呋喃、四氢吡咯、噁唑烷、异噁唑烷、二氢吡唑、四氢噻吩等碳环和杂环化合物,在构建多样性化合物库中发挥着重要作用。
技术实现要素:
本发明的目的是提供一种双二氢吡唑螺环类化合物及其合成方法。
本发明提供的双二氢吡唑螺环类化合物,如式ⅲ所示,
所述式ⅲ中,r为苯基、卤素取代的苯基、烷基取代的苯基、烷氧基取代的苯基、萘基、呋喃基、烷基中的任意一种。r1为苯基、卤素取代的苯基、三氟甲基取代的苯基、烷基取代的苯基、甲氧基取代的苯基、萘基、乙酯基中的任意一种。r2为烷基、环己基、苯基中的任意一种。
所述卤素取代的苯基中,所述卤素均选自氟、氯、溴中的至少一种;所述卤素取代的苯基中,卤素取代基的个数为1。
所述三氟甲基取代的苯基中,三氟甲基取代基的个数为1。
所述烷基取代的苯基中,烷基取代基的个数为1,烷基取代基中的碳原子数为1-4;所述甲氧基取代的苯基中,甲氧基取代基的个数为1-2。
本发明提供的制备式ⅲ所示化合物的方法,包括如下步骤:在碱存在的情况下,将式ⅰ所示化合物和式ⅱ所示化合物混匀于溶剂中进行1,3-偶极环加成反应,反应完毕得到所述式ⅲ所示化合物;
所述式i中,r为苯基、卤素取代的苯基、烷基取代的苯基、烷氧基取代的苯基、萘基、呋喃基、烷基中的任意一种。所述式ⅱ中,r1为苯基、卤素取代的苯基、三氟甲基取代的苯基、烷基取代的苯基、甲氧基取代的苯基、萘基、乙酯基中的任意一种。r2为烷基、环己基、苯基中的任意一种。其中,所述卤素取代的苯基中,所述卤素均选自氟、氯、溴中的至少一种;所述卤素取代的苯基中,卤素取代基的个数为1。所述三氟甲基取代的苯基中,三氟甲基取代基的个数为1。所述烷基取代的苯基中,烷基取代基的个数为1,烷基取代基中的碳原子数为1-4;所述甲氧基取代的苯基中,甲氧基取代基的个数为1-2。
该反应为碱促进的腈亚胺前体与联烯之间的双[3+2]环加成反应,其反应方程式如下所示:
所述碱试剂选自胺和碳酸盐中的至少一种;其中,所述胺选自三乙胺和二异丙基乙基胺中的至少一种;所述碳酸盐选自碳酸铯、碳酸钠和碳酸钾中的至少一种。优选碳酸铯。
所述溶剂选自二氯甲烷、1,2-二氯乙烷、三氯甲烷、乙酸乙酯、四氢呋喃和乙腈中的至少一种,优选乙酸乙酯。
所述式i和式ⅱ所示化合物的投料摩尔比为2.0-4.0:1,具体可为2.0:1、2.2:1、2.4:1、3.0:1、4.0:1,优选为2.2:1;所述碱试剂的投料摩尔用量为式ⅱ所示化合物投料摩尔用量的100-300%,具体可为100%、110%、220%或300%,优选220%。
所述反应步骤中,时间为24小时-72小时,具体可为24小时、48小时或72小时,优选为48小时;温度为0℃-40℃,具体可为0℃、15℃、25℃或40℃,优选25℃。
本发明具有以下优点:
1.本发明为合成二氢吡唑螺环类化合物提供了一种简单易行的新方法,增加了化合物的多样性。
2.本发明提供的方法采用环加成的方式进行反应,属于原子经济性反应。
3.本发明不需要使用过渡金属催化剂,产品中不会存在重金属残留污染物。
附图说明
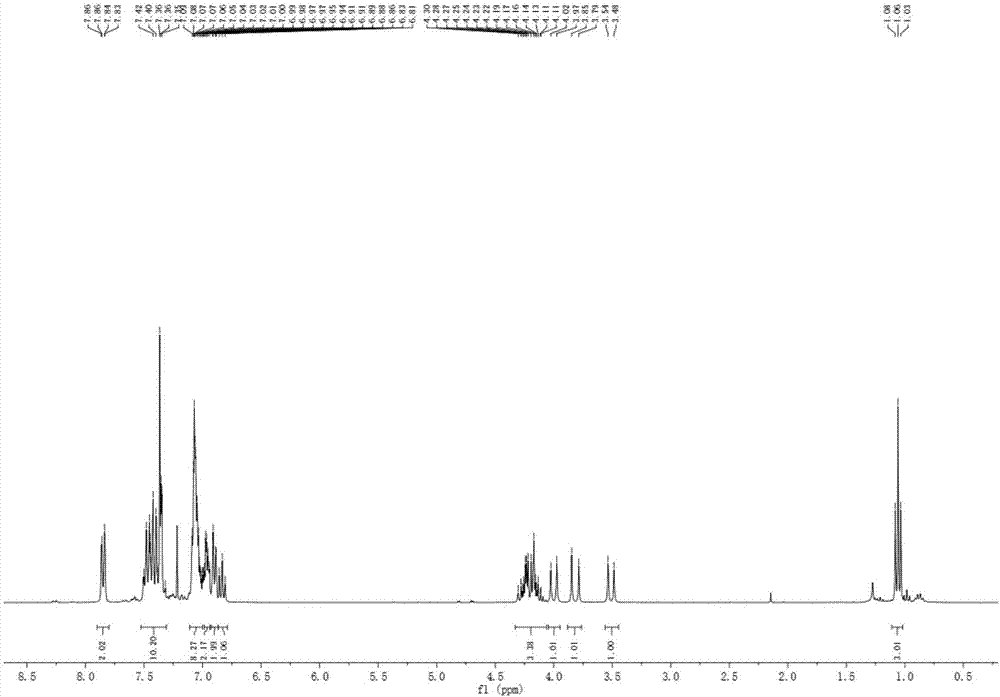
图1为实施例1制备所得式ⅳ所示化合物的核磁氢谱。
图2为实施例2制备所得式ⅴ所示化合物的核磁氢谱。
图3为实施例3制备所得式ⅵ所示化合物的核磁氢谱。
图4为实施例4制备所得式ⅶ所示化合物的核磁氢谱。
图5为实施例5制备所得式ⅷ所示化合物的核磁氢谱。
图6为实施例6制备所得式ⅸ所示化合物的核磁氢谱。
具体实施方式
下述实施例中所用的式i所示化合物腈亚胺前体均是按照文献(a)russ.j.gen.chem.,2014,84:586-592.(b)org.lett.,2016,18:564-567.报道的方法制备而得,具体合成方法如下:
10mmol苯肼和10mmol酰氯溶于5ml吡啶中在室温下搅拌,tlc检测反应完全后通过硅胶柱纯化得到白色固体酰肼。
10mmol酰肼和12.5mmol的三苯基膦溶于20ml乙腈溶液中,加入13mmol四氯化碳,混合物在室温下搅拌,tlc检测反应完全后通过硅胶柱纯化得到白色固体。
下述实施例中所用式ⅱ所示化合物是按照文献(a)j.am.chem.soc.,2007,129:5843-5845.报道的方法制备而得,具体合成方法如下:
30mmol卤代烷烃,27.3mmol酯基甲叉三苯基膦在80ml三氯甲烷中加热回流至反应完全(通过tlc检测),减压旋转蒸发除去溶剂后加入100ml二氯甲烷和60mmol三乙胺,搅拌1小时后缓慢加入27.3mmol乙酰氯,反应搅拌过夜后,减压旋转蒸发除去溶剂,加入石油醚过滤,并用乙醚洗,滤液减压旋转蒸发除去溶剂后再通过硅胶柱纯化,得到无色液体。
实施例1、式(ⅳ)所示双二氢吡唑螺环类化合物的合成
将0.0506g式ⅰ-1所示化合物(0.22mmol)、0.0202g式ⅱ-1所示化合物(0.10mmol)和0.0717g碳酸铯(0.22mmol)投入到用烘箱干燥过的10ml的史莱克管内,加入2ml乙酸乙酯进行环加成反应,25℃下搅拌48小时,用旋转蒸发仪浓缩反应液后过柱(乙酸乙酯:石油醚=1:10,v/v),得到53.1mg产品,为式ⅳ所示化合物,收率90%。
(ⅳ)1hnmr(300mhz,cdcl3)δ7.86–7.83(m,2h),7.53–7.31(m,10h),7.11–7.00(m,8h),6.99–6.94(m,2h),6.91–6.88(m,2h),6.85–6.81(m,1h),4.33–4.06(m,3h),4.00(d,j=15.3hz,1h),3.82(d,j=18.2hz,1h),3.51(d,j=15.3hz,1h),1.06(t,j=7.1hz,3h);13cnmr(75mhz,cdcl3)δ168.2,149.1,144.4,143.2,143.1,133.8,131.8,130.5,129.8,129.1,128.6,128.5,128.2,127.8,127.7,126.7,126.0,125.8,122.8,120.24,120.19,115.4,87.1,83.4,62.0,39.3,36.0,13.5.
由上可知,所得产物结构正确,为式ⅳ所示化合物。
实施例2、式(ⅴ)所示双二氢吡唑螺环类化合物的合成
将0.0581g式ⅰ-2所示化合物(0.22mmol)、0.0202g式ⅱ-1所示化合物(0.10mmol)和0.0717g碳酸铯(0.22mmol)投入到用烘箱干燥过的10ml的史莱克管内,加入2ml乙酸乙酯进行环加成反应,25℃下搅拌48小时,用旋转蒸发仪浓缩反应液后过柱(乙酸乙酯:石油醚=1:10,v/v),得到47.4mg产品,为式ⅴ所示化合物,收率72%。
(ⅴ)1hnmr(300mhz,cdcl3)δ7.95–7.84(m,1h),7.56–7.46(m,3h),7.45–7.41(m,2h),7.40–7.34(m,3h),7.28–7.25(m,2h),7.24–7.19(m,3h),7.18–7.13(m,2h),7.12–7.09(m,1h),7.08–7.01(m,4h),6.97–6.93(m,2h),6.63–6.60(m,1h),4.46(d,j=18.9hz,1h),4.28–4.18(m,2h),4.00(d,j=14.7hz,1h),3.89(d,j=18.9hz,1h),3.53(d,j=14.7hz,1h),1.11(t,j=7.2hz,3h);13cnmr(75mhz,cdcl3)δ168.4,147.9,143.3,142.7,140.4,134.2,133.6,132.0,130.9,130.6,130.5,130.0,129.8,129.1,128.24,128.17,128.02,127.99,127.9,127.8,126.7,126.6,126.2,126.1,125.4,122.2,120.6,119.1,116.5,88.6,82.7,61.9,41.0,37.2,13.4.
由上可知,所得产物结构正确,为式ⅴ所示化合物。
实施例3、式(ⅵ)所示双二氢吡唑螺环类化合物的合成
将0.0616g式ⅰ-3所示化合物(0.22mmol)、0.0202g式ⅱ-1所示化合物(0.10mmol)和0.0717g碳酸铯(0.22mmol)投入到用烘箱干燥过的10ml的史莱克管内,加入2ml乙酸乙酯进行环加成反应,25℃下搅拌48小时,用旋转蒸发仪浓缩反应液后过柱(乙酸乙酯:石油醚=1:10,v/v),得到60.1mg产品,为式ⅴ所示化合物,收率87%。
(ⅵ)1hnmr(300mhz,cdcl3)δ8.36–8.33(m,1h),8.13–7.91(m,4h),7.71–7.69(m,1h),7.62–7.55(m,5h),7.52–7.31(m,7h),7.27–7.24(m,1h),7.18–7.06(m,7h),6.91–6.86(m,1h),4.45(d,j=18.0hz,1h),4.41–4.20(m,2h),4.17–4.10(m,2h),3.67(d,j=15.2hz,1h),1.15(t,j=7.1hz,3h);13cnmr(75mhz,cdcl3)δ168.1,149.4,144.4,143.1,133.8,133.5,133.0,132.8,132.4,130.6,129.3,128.6,128.3,128.0,127.9,127.7,127.6,127.5,127.3,127.2,126.7,126.5,126.4,126.0,125.8,125.2,125.0,123.9,123.2,123.1,120.5,120.3,115.6,87.4,83.5,62.0,39.3,36.3,13.5.
由上可知,所得产物结构正确,为式ⅵ所示化合物。
实施例4、式(ⅶ)所示双二氢吡唑螺环类化合物的合成
将0.0431g式ⅰ-4所示化合物(0.22mmol)、0.0202g式ⅱ-1所示化合物(0.10mmol)和0.0717g碳酸铯(0.22mmol)投入到用烘箱干燥过的10ml的史莱克管内,加入2ml乙酸乙酯进行环加成反应,25℃下搅拌48小时,用旋转蒸发仪浓缩反应液后过柱(乙酸乙酯:石油醚=1:10,v/v),得到33.5mg产品,为式ⅴ所示化合物,收率64%。
(ⅶ)1hnmr(300mhz,cdcl3)δ7.31–6.98(m,12h),6.96–6.79(m,4h),4.19(q,j=7.3hz,2h),3.88(d,j=15.1hz,1h),3.62(d,j=18.4hz,1h),3.27(d,j=15.1hz,1h),3.06(d,j=18.4hz,1h),2.45(t,j=7.3hz,2h),1.83–1.64(m,2h),1.41–1.27(m,1h),1.27–1.17(m,1h),1.13(t,j=7.3hz,3h),1.06(t,j=7.3hz,3h),0.97–0.83(m,1h),0.76–0.56(m,1h),0.42(t,j=7.3hz,3h);13cnmr(75mhz,cdcl3)δ169.2,153.8,146.3,144.2,143.6,134.3,130.7,128.4,127.6,127.4,126.4,122.9,121.1,118.9,114.7,88.0,81.1,61.6,40.0,34.9,31.6,28.4,19.8,18.4,13.6,13.5,13.2
由上可知,所得产物结构正确,为式ⅶ所示化合物。
实施例5、式(ⅷ)所示双二氢吡唑螺环类化合物的合成
将0.0506g式ⅰ-1所示化合物(0.22mmol)、0.0216g式ⅱ-2所示化合物(0.10mmol)和0.0717g碳酸铯(0.22mmol)投入到用烘箱干燥过的10ml的史莱克管内,加入2ml乙酸乙酯进行环加成反应,25℃下搅拌48小时,用旋转蒸发仪浓缩反应液后过柱(乙酸乙酯:石油醚=1:10,v/v),得到47.2mg产品,为式ⅴ所示化合物,收率78%。
(ⅷ)1hnmr(300mhz,cdcl3)δ7.89–7.85(m,2h),7.59–7.45(m,3h),7.45–7.35(m,4h),7.30–7.25(m,4h),7.17–6.77(m,11h),4.38–4.18(m,2h),4.13(d,j=18.5hz,1h),3.97(d,j=18.5hz,1h),3.86(d,j=14.3hz,1h),3.48(d,j=14.3hz,1h),2.13(s,3h),1.12(t,j=7.1hz,3h);13cnmr(75mhz,cdcl3)δ168.1,148.9,143.8,143.2,142.6,137.5,133.9,131.7,130.4,130.3,129.8,129.0,128.5,128.2,127.7,127.3,127.0,125.9,125.7,125.6,122.6,119.8,119.7,115.9,88.4,82.3,61.9,38.6,34.4,19.4,13.4.
由上可知,所得产物结构正确,为式ⅷ所示化合物。
实施例6、式(ⅸ)所示双二氢吡唑螺环类化合物的合成
将0.0506g式ⅰ-1所示化合物(0.22mmol)、0.0250g式ⅱ-3所示化合物(0.10mmol)和0.0717g碳酸铯(0.22mmol)投入到用烘箱干燥过的10ml的史莱克管内,加入2ml乙酸乙酯进行环加成反应,25℃下搅拌48小时,用旋转蒸发仪浓缩反应液后过柱(乙酸乙酯:石油醚=1:10,v/v),得到40.9mg产品,为式ⅸ所示化合物,收率64%。
(ⅸ)1hnmr(300mhz,cdcl3)δ7.93–7.90(m,2h),7.55–7.42(m,10h),7.38–7.33(m,2h),7.25–7.06(m,13h),7.02–6.99(m,2h),6.93–6.88(m,1h),4.37(d,j=18.2hz,1h),4.24(d,j=15.3hz,1h),3.99(d,j=18.3hz,1h),3.73(d,j=15.3hz,1h);13cnmr(75mhz,cdcl3)δ167.2,150.0,149.6,144.6,143.1,143.0,133.5,131.6,130.6,129.6,129.2,128.7,128.5,128.3,127.9,127.84,127.76,126.8,126.0,125.9,125.8,123.1,121.2,120.5,120.4,115.4,87.5,83.3,39.4,36.2.
由上可知,所得产物结构正确,为式ⅸ所示化合物。
实施例7、式(ⅳ)所示双二氢吡唑螺环类化合物的合成
将0.0759g式ⅰ-1所示化合物(0.33mmol)、0.0202g式ⅱ-1所示化合物(0.10mmol)和0.0111g碳酸铯(0.11mmol)投入到用烘箱干燥过的10ml的史莱克管内,加入2ml乙酸乙酯进行环加成反应,15℃下搅拌24小时,用旋转蒸发仪浓缩反应液后过柱(乙酸乙酯:石油醚=1:10,v/v),得到33.0mg产品,为式ⅳ所示化合物,收率40%。
- 还没有人留言评论。精彩留言会获得点赞!