一种固定化石油降解菌的制备方法及基于该固定化石油降解菌处理石油污染物的方法与流程
本发明属于石油污染治理技术领域,尤其涉及一种固定化石油降解菌的制备方法及基于该固定化石油降解菌处理石油污染物的方法。
背景技术:
随着海洋溢油、运输泄漏、石油及产品离岸排放等事故逐年增多,对近海海域生态环境产生了巨大破坏。修复受石油污染海域的生态环境成为急需解决的环境和社会问题。如何实现石油污染海域的生态恢复成为当前关注的重点之一。虽然目前国内外在生物修复石油污染海域的生态修复已有较为成熟的研究,但在实际污染治理事件中仍然无法得到应用,究其原因有:(一)在海洋环境中,由于波浪和潮汐的作用导致微生物无法富集,单位空间上的生物量很少;(二)、海洋中营养物质不足,致使微生物无法正常地生存繁殖,生物活性降低,从而降解率大大降低;(三)、生态修复后代谢产物对海洋环境产生未知的影响及菌群群落发生变化。因此,如何通过提高生物量、生物活性等来修复实际海域污染具有重要的指导意义。
已知本领域技术中采用固定化微生物法修复石油污染海水,可以提高单位被污染水域内的微生物量,加强生物修复技术的效果,达到修复石油污染海域的生态效果。目前,从提高生物量角度,主要是采用固定化技术。然而固定化生物修复技术更多的是在研究无机固定化载体,利用无机载体多孔隙的结构富集微生物,吸附石油,增大石油和微生物的接触面积,进而提高石油降解率。然而无机固定化载体因不能提供足够的营养物质(如:氮、磷),导致其降解率不高。例如中国专利cn106520750a公开了一种固定化微生物溢油修复剂及其制备方法。该修复剂以海藻酸钠-cacl2-生物基活性碳为载体包埋微生物制成,包埋的微生物的浓度为8×108-6×109cell/g。制备方法为:将生物基活性碳与微生物种子液混合进行吸附,形成混合悬浊液;在混合悬浊液中加入30~40℃的已灭菌的海藻酸钠溶液,混匀后得到粘稠状混合液,粘稠状混合液加入到cacl2溶液中分散成球,交联12h~24h,得到固定化微生物。又例如中国专利cn105695445a公开了一种用于含油污水处理的固定化微生物,该固定化材料包括海藻酸钠、cacl2、纳米二氧化硅以及低聚木糖,包埋的微生物的浓度为3~4×109cell/g。该固定化微生物菌剂的制备方法:将培养后的石油降解菌液3000rpm下离心4-5min,去除上层清液,收集底部浓缩菌液,用无菌水将其调节至od600为1;将一定量的海藻酸钠、纳米二氧化硅以及低聚木糖加入上述浓缩菌液中,混合均匀,用注射器吸取混合液,逐滴滴入到3.5~4.0%cacl2溶液中,得固定化微球,交联12~14h后,用无菌水清洗固定化菌剂。
但上述方法中,采用的包埋法制备工艺较复杂,制备过程不易控制;包埋环境导致微生物活性低;包埋材料较昂贵,限制了大范围的应用。从而导致在固定化微生物菌剂处理石油污染物时,降解率较低,处理效果较差。
技术实现要素:
本发明针对上述的的技术问题,提出一种固定化石油降解菌的制备方法及基于该固定化石油降解菌处理石油污染物的方法。
为了达到上述目的,本发明采用的技术方案为:
一种固定化石油降解菌的制备方法,包括以下步骤:
步骤一:制备固定化载体:取农业废弃物经破碎处理后,过筛得到粒径2~5mm的固定化载体,取固定化载体浸泡于乙醇和水的混合溶液中,取出后将所述固定化载体清洗并浸泡于蒸馏水中,除去杂质,清洗后烘干;
步骤二:制备固定化石油降解菌:取海水水样,对其中的石油降解菌进行富集、分离、纯化和筛选后得到石油降解菌;取所述固定化载体置于固定化培养基中,所述固定化培养基的ph值为7.2~7.5,经灭菌处理,加入所述石油降解菌,所述固定化培养基内石油降解菌的浓度为4×107cfu/ml~6×107cfu/ml,经固定化2~5天后取出得到固定化石油降解菌。
作为优选,所述固定化培养基包括1000ml蒸馏水、10~13g蛋白胨、4~4.5g牛肉膏、l5~20gnacl、1~3ml浓度为1.11g/l的cacl2、1~3ml浓度为1.52g/l的feso4、2~5ml浓度为3.60g/l的mgso4和1~5ml柴油,调节所述固定化培养基的ph至7.2~7.5。
作为优选,所述固定化培养基中固定化载体的添加量为:每50ml固定化培养基添加0.2~0.5g固定化载体。
作为优选,所述乙醇和水的体积比为(2:1)~(3:1);所述固定化载体在乙醇和水的混合溶液中的浸泡时长为1~2h。
作为优选,所述石油降解菌的富集方法包括以下步骤:取富集培养基,加入海水水样,添加1~10ml柴油,经恒温培养5~7天后,取出液体,置于新的富集培养基中,重复操作3~5次,获取得到石油降解菌富集培养基;其中所述富集培养基包括:1l蒸馏水、2~4g酵母膏、0.6gna2hpo4、0.5gkh2po4、3gnh4no3、1~3ml浓度为1.11g/l的cacl2、1~3ml浓度为1.52g/l的feso4、2~5ml浓度为3.60g/l的mgso4和30gnacl;调节所述富集培养基的ph至7.2~7.5。
作为优选,所述石油降解菌的分离、纯化方法包括以下步骤:取所述石油降解菌富集培养基经高压灭菌锅于121℃灭菌20min,取出30~50ml倒入培养皿中,待冷却凝固,经培养后得到培养液,取培养液稀释105~109倍,划于培养皿中进行恒温培养,得到分离的多个菌落,分别挑选单个菌落用接种环稀释106倍,划于新的盛有石油降解菌富集培养基的培养皿上,经培养后观察所述培养皿,如所述培养皿含有两种以上形态的菌落,再将不同形态的菌落继续平板划线,进行培养,重复上述步骤,直至每个培养皿均仅含有一种单一菌株。
作为优选,将经分离、纯化的每一株石油降解菌置于富集培养基内培养富集后,取菌液加入经灭菌处理后的海水,所述菌液占海水的体积分数为1%~3%,按照每升海水加入5~10ml柴油的量添加所述柴油,选取柴油降解率在60%以上的石油降解菌。
作为优选,所述的农业废弃物为秸秆或木屑。
作为优选,所述石油降解菌包括食烷菌、假单胞菌、食单胞菌和甲基杆菌中的一种或几种。
作为优选,所述固定化石油降解菌的制备方法,具体包括以下步骤:
步骤一:制备固定化载体:取秸秆或木屑经破碎处理后,过6目筛,得到粒径为3mm的固定化载体,取固定化载体浸泡于体积比为(2:1)~(3:1)的乙醇和水的混合溶液中,浸泡1~2h,取出后将所述固定化载体清洗并浸泡于蒸馏水中,浸泡2~3h,再用蒸馏水除去杂质,清洗2~3遍,于60℃条件下烘干24h;
步骤二:制备石油降解菌:取富集培养基,加入海水水样,添加1~10ml柴油,于30℃、160r/min的恒温培养箱里培养5~7d,取出10ml液体,置于新的富集培养基中,重复操作3~5次,直到富集到足够量的石油降解菌为止;其中所述富集培养基包括:1l蒸馏水、2~4g酵母膏、0.6gna2hpo4、0.5gkh2po4、3gnh4no3、1~3ml浓度为1.11g/l的cacl2、1~3ml浓度为1.52g/l的feso4、2~5ml浓度为3.60g/l的mgso4和30gnacl;调节所述富集培养基的ph至7.2~7.5;
取所述石油降解菌富集培养基经高压灭菌锅于121℃灭菌20min,取出30~50ml倒入培养皿中,待冷却凝固,置于30℃的恒温培养箱24h,若无杂菌,于无菌操作台中取富集后的培养液稀释105~109倍,划于培养皿中于30℃的恒温培养箱培养4天后,得到分离的多个菌落,分别挑选单个菌落用接种环稀释106倍,划于新的盛有石油降解菌富集培养基的培养皿上,4天后观察所述培养皿,如所述培养皿含有两种以上形态的菌落,再将不同形态的菌落继续平板划线,于30℃的恒温培养箱培养4天,重复上述步骤,直至每个培养皿均仅含有一种单一菌株;
将经分离、纯化的每一株石油降解菌置于富集培养基内培养富集后,取菌液加入经灭菌处理后的海水,所述菌液占海水的体积分数为1%~3%,按照每升海水加入5~10ml柴油的量添加所述柴油,选取柴油降解率在60%以上的石油降解菌;
步骤三:制备固定化石油降解菌:取所述固定化载体置于固定化培养基中,每50ml固定化培养基添加0.2~0.5g固定化载体,所述固定化培养基的ph值为7.2~7.5,于121℃的条件下,灭菌20min后取出、放至室温,加入所述石油降解菌,所述固定化培养基内石油降解菌的浓度为5.35×107cfu/ml,经固定化培养3天后取出得到固定化石油降解菌。
一种基于上述固定化石油降解菌处理石油污染物的方法,包括取固定化石油降解菌加入海水中以降解石油污染物的步骤。
与现有技术相比,本发明的优点和积极效果在于:
(1)本发明采用农业废弃物,优选秸秆或木屑作为载体,有效地回收利用农业废弃物,实现废物资源化利用,同时基于农业废弃物合理设计固定化石油降解菌的制备方法,优化载体粒径、培养基ph值、菌液投加量和固定化时间的参数条件,使石油降解菌的固定化效果最佳。
(2)本发明以农业废弃物即农业垃圾作为载体,不仅可以使农业废弃物得到有效利用,而且通过研究发现农业废弃物释放出的氮和磷营养元素可以供石油降解菌生存,提高生物活性,增加富集生物量,从而提高降解率。
(3)本发明制备的固定化石油降解菌在处理石油污染物时,不会对海洋生态环境造成二次污染,能够适应海洋环境,修复海洋石油污染,为海洋生态修复奠定了基础。
附图说明
图1为本发明实施例所提供的制备固定化石油降解菌的流程图;
图2为本发明实施例所提供的实施例1~9制备的固定化石油降解菌的生物量的柱状图;
图3为本发明实施例所提供的实施例1~9制备的固定化石油降解菌的酶活性的柱状图;
图4为本发明实施例所提供的固定化载体不同时间的氮释放量及其释放速率;
图5为本发明实施例所提供的固定化载体不同时间的磷释放量及其释放速率;
图6为本发明实施例所提供不同粒径的固定化载体所制备的固定化石油降解菌的生物量;
图7为本发明实施例所提供木屑和秸秆分别制备的固定化石油降解菌在不同时间阶段的柴油降解率变化曲线;
图8为本发明实施例所提供不同环境条件下不同种类固定化石油降解菌针对柴油降解率的柱状图;
图9为本发明实施例所提供不同环境条件下不同种类固定化石油降解菌的群落结构变化图。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
一种固定化石油降解菌的制备方法,如图1所示,包括以下步骤:
步骤一:制备固定化载体:取农业废弃物经破碎处理后,过筛得到粒径2~5mm的固定化载体,取固定化载体浸泡于乙醇和水的混合溶液中,取出后将所述固定化载体清洗并浸泡于蒸馏水中,除去杂质,清洗后烘干;
步骤二:制备固定化石油降解菌:取海水水样,对其中的石油降解菌进行富集、分离、纯化和筛选后得到石油降解菌;取所述固定化载体置于固定化培养基中,所述固定化培养基的ph值为7.2~7.5,经灭菌处理,加入所述石油降解菌,所述固定化培养基内石油降解菌的浓度为4×107cfu/ml~6×107cfu/ml,经固定化2~5天后取出得到固定化石油降解菌。
需要具体说明的是,所述石油降解菌的固定化效果受多因素的影响,其中主要有固定化载体的选择、ph、微生物接种量、固定化时间等。本发明上述提供的方法选择适宜的固定化载体,可以使得固定在载体上的石油降解菌的数量多、生物活性高。微生物对ph值有一定的适应性,过酸或过碱都会影响其活性,进而影响固定化效果。微生物接种量对固定化效果的影响作用在于:在一定范围内,随着接种量的增大,固定化培养基中微生物浓度增大,固定在载体上的降解菌的数量增多;但若继续增大接种量,由于营养物质是有限的,使得固定在载体上的降解菌的活性下降。菌的固定化时间的影响作用也不容忽视,在一定的固定化时间范围内,随着固定化时间的延长,固定在载体上的降解菌的数量增多;但若固定化时间继续增加,柴油降解菌过度生长和繁殖,导致微生物活性下降。固定化时间过长,其对原油的降解率反而下降。
在一优选实施例中,所述固定化载体的粒径为3mm,所述固定化培养基的ph值为7.2~7.5,所述固定化培养基内石油降解菌的浓度为5.35×107cfu/ml,固定化时间即所述培养3天后取出得到固定化石油降解菌。在该参数条件下,固定化石油降解菌的生物量达到2.015×109cfu/g,生物活性为1.16mg/g。
在一可选实施例中,所述固定化培养基包括1000ml蒸馏水、10~13g蛋白胨、4~4.5g牛肉膏、l5~20gnacl、1~3ml浓度为1.11g/l的cacl2、-1~3ml浓度为1.52g/l的feso4、2~5ml浓度为3.60g/l的mgso4和1~5ml柴油,调节所述固定化培养基的ph至7.2~7.5。
在一可选实施例中,所述固定化培养基中固定化载体的添加量为:每50ml固定化培养基添加0.2~0.5g固定化载体。
在一可选实施例中,所述乙醇和水的体积比为(2:1)~(3:1);所述固定化载体在乙醇和水的混合溶液中的浸泡时长为1~2h。
在一可选实施例中,所述石油降解菌的富集方法包括以下步骤:取富集培养基,加入海水水样,添加1~10ml柴油,经恒温培养5~7天后,取出液体,置于新的富集培养基中,重复操作3~5次,获取得到石油降解菌富集培养基;其中所述富集培养基包括:1l蒸馏水、2~4g酵母膏、0.6gna2hpo4、0.5gkh2po4、3gnh4no3、1~3ml浓度为1.11g/l的cacl2、1~3ml浓度为1.52g/l的feso4、2~5ml浓度为3.60g/l的mgso4和30gnacl;调节所述富集培养基的ph至7.2~7.5。
在一可选实施例中,所述石油降解菌的分离、纯化方法包括以下步骤:取所述石油降解菌富集培养基经高压灭菌锅于121℃灭菌20min,取出30~50ml倒入培养皿中,待冷却凝固,经培养后得到培养液,取培养液稀释105~109倍,划于培养皿中进行恒温培养,得到分离的多个菌落,分别挑选单个菌落用接种环稀释106倍,划于新的盛有石油降解菌富集培养基的培养皿上,经培养后观察所述培养皿,如所述培养皿含有两种以上形态的菌落,再将不同形态的菌落继续平板划线,进行培养,重复上述步骤,直至每个培养皿均仅含有一种单一菌株。
在一可选实施例中,将经分离、纯化的每一株石油降解菌置于富集培养基内培养富集后,取菌液加入经灭菌处理后的海水,所述菌液占海水的体积分数为1%~3%,按照每升海水加入5~10ml柴油的量添加所述柴油,选取柴油降解率在60%以上的石油降解菌。
在一可选实施例中,所述的农业废弃物为秸秆或木屑。
在一可选实施例中,所述石油降解菌包括食烷菌、假单胞菌、食单胞菌和甲基杆菌中的一种或几种。
在一可选实施例中,所述固定化石油降解菌的制备方法,具体包括以下步骤:
步骤一:制备固定化载体:取秸秆或木屑经破碎处理后,过6目筛,得到粒径为3mm的固定化载体,取固定化载体浸泡于体积比为(2:1)~(3:1)的乙醇和水的混合溶液中,浸泡1~2h,取出后将所述固定化载体清洗并浸泡于蒸馏水中,浸泡2~3h,再用蒸馏水除去杂质,清洗2~3遍,于60℃条件下烘干24h;
步骤二:制备石油降解菌:取富集培养基,加入海水水样,添加1~10ml柴油,于30℃、160r/min的恒温培养箱里培养5~7d,取出10ml液体,置于新的富集培养基中,重复操作3~5次,直到富集到足够量的石油降解菌为止;其中所述富集培养基包括:1l蒸馏水、2~4g酵母膏、0.6gna2hpo4、0.5gkh2po4、3gnh4no3、1~3ml浓度为1.11g/l的cacl2、1~3ml浓度为1.52g/l的feso4、2~5ml浓度为3.60g/l的mgso4和30gnacl;调节所述富集培养基的ph至7.2~7.5;
取所述石油降解菌富集培养基经高压灭菌锅于121℃灭菌20min,取出30~50ml倒入培养皿中,待冷却凝固,置于30℃的恒温培养箱24h,若无杂菌,于无菌操作台中取富集后的培养液稀释105~109倍,划于培养皿中于30℃的恒温培养箱培养4天后,得到分离的多个菌落,分别挑选单个菌落用接种环稀释106倍,划于新的盛有石油降解菌富集培养基的培养皿上,4天后观察所述培养皿,如所述培养皿含有两种以上形态的菌落,再将不同形态的菌落继续平板划线,于30℃的恒温培养箱培养4天,重复上述步骤,直至每个培养皿均仅含有一种单一菌株;
将经分离、纯化的每一株石油降解菌置于富集培养基内培养富集后,取菌液加入经灭菌处理后的海水,所述菌液占海水的体积分数为1%~3%,按照每升海水加入5~10ml柴油的量添加所述柴油,选取柴油降解率在60%以上的石油降解菌;
步骤三:制备固定化石油降解菌:取所述固定化载体置于固定化培养基中,每50ml固定化培养基添加0.2~0.5g固定化载体,所述固定化培养基的ph值为7.2~7.5,于121℃的条件下,灭菌20min后取出、放至室温,加入所述石油降解菌,所述固定化培养基内石油降解菌的浓度为5.35×107cfu/ml,经培养3天后取出得到固定化石油降解菌。
一种基于上述固定化石油降解菌处理石油污染物的方法,包括取固定化石油降解菌加入海水中以降解石油污染物的步骤。
为了更清楚详细地介绍本发明实施例所提供的一种固定化石油降解菌的制备方法及基于该固定化石油降解菌处理石油污染物的方法,下面将结合具体实施例进行描述。
实施例1:
一种固定化石油降解菌的制备方法:
步骤一:制备固定化载体:取秸秆经破碎处理后,过6目筛,得到粒径为3mm的固定化载体,取固定化载体浸泡于体积比为2:1的乙醇和水的混合溶液中,浸泡1~2h,取出后将所述固定化载体清洗并浸泡于蒸馏水中,浸泡2~3h,再用蒸馏水除去杂质,清洗2~3遍,于60℃条件下烘干24h;
步骤二:制备石油降解菌:取富集培养基,加入海水水样,添加1~10ml柴油,于30℃、160r/min的恒温培养箱里培养5~7d,取出10ml液体,置于新的富集培养基中,重复操作3~5次,直到富集到足够量的石油降解菌为止;其中所述富集培养基包括:1l蒸馏水、2~4g酵母膏、0.6gna2hpo4、0.5gkh2po4、3gnh4no3、1~3ml浓度为1.11g/l的cacl2、1~3ml浓度为1.52g/l的feso4、2~5ml浓度为3.60g/l的mgso4和30gnacl;调节所述富集培养基的ph至7.2~7.5;
取所述石油降解菌富集培养基经高压灭菌锅于121℃灭菌20min,取出30~50ml倒入培养皿中,待冷却凝固,置于30℃的恒温培养箱24h,若无杂菌,于无菌操作台中取富集后的培养液稀释105~109倍,划于培养皿中于30℃的恒温培养箱培养4天后,得到分离的多个菌落,分别挑选单个菌落用接种环稀释106倍,划于新的盛有石油降解菌富集培养基的培养皿上,4天后观察所述培养皿,如所述培养皿含有两种以上形态的菌落,再将不同形态的菌落继续平板划线,于30℃的恒温培养箱培养4天,重复上述步骤,直至每个培养皿均仅含有一种单一菌株;
将经分离、纯化的每一株石油降解菌置于富集培养基内培养富集后,取菌液加入经灭菌处理后的海水,所述菌液占海水的体积分数为1%~3%,按照每升海水加入5~10ml柴油的量添加所述柴油,选取柴油降解率在60%以上的石油降解菌;
步骤三:制备固定化石油降解菌:取0.2g所述固定化载体置于固定化培养基中,每50ml固定化培养基添加0.2~0.5g固定化载体,所述固定化培养基的ph值为7.2~7.5,于121℃的条件下,灭菌20min后取出、放至室温,加入2.68×109cfu所述石油降解菌,所述固定化培养基内石油降解菌的浓度为5.35×107cfu/ml,在130rpm、29℃的条件下固定化3天后取出得到固定化石油降解菌;所述固定化培养基包括1000ml蒸馏水、10~13g蛋白胨、4~4.5g牛肉膏、l5~20gnacl、1~3ml浓度为1.11g/l的cacl2、1~3ml浓度为1.52g/l的feso4、2~5ml浓度为3.60g/l的mgso4和1~5ml柴油。
脱氢酶含量检测试验:将固定化石油降解菌取出,用灭菌生理盐水洗去固定化菌表面固定不牢固的微生物,然后将固定化菌投加入25ml灭菌生理盐水中,在3000r/min的速度下震荡,使微生物从载体上脱离;然后,稀释柴油降解菌;再分别吸取恰当的两种不同稀释倍数的稀释液1ml于灭菌培养皿中,然后将约15ml的已灭菌的琼脂培养基倒入培养皿中,混合均匀。将培养皿在30℃的条件下培养2天,观察各平板的菌落数。
取培养液2ml放于具塞试管中,依次加入2ml的tris-hcl缓冲液(ph为7.6)和2ml的0.5%ttc,置于37℃恒温培养箱中培养3h;取出后,准确加入5ml甲苯,振摇,静置数分钟,取上层有机溶液在492nm波长处测定吸光度,计算脱氢酶含量。
检测结果:本实施例中固定在固定化载体上的生物量为2.015×109cfu/g载体,脱氢酶含量为1.16mg/g。
实施例2:
一种固定化石油降解菌的制备方法:与实施例1相区别的是,所述乙醇和水的体积比为3:1,所述步骤三中固定化培养基的ph值为7.5,加入1.6×109cfu所述石油降解菌,所述固定化培养基内石油降解菌的浓度为3.2×107cfu/ml。其余步骤条件均与实施例1一致。
脱氢酶含量检测试验:方法同实施例1所述方法一致。
检测结果:本实施例中固定在固定化载体上的生物量为2×107cfu/g载体,脱氢酶含量为0.85mg/g。
实施例3:
一种固定化石油降解菌的制备方法:与实施例1相区别的是,所述步骤三中固定化培养基的ph值为7.2,加入1.6×109cfu所述石油降解菌,所述固定化培养基内石油降解菌的浓度为3.2×107cfu/ml。其余步骤条件均与实施例1一致。
脱氢酶含量检测试验:方法同实施例1所述方法一致。
检测结果:本实施例中固定在固定化载体上的生物量为2×107cfu/g载体,脱氢酶含量为0.85mg/g。
实施例4:
一种固定化石油降解菌的制备方法:与实施例1相区别的是,加入1.6×109cfu所述石油降解菌,所述固定化培养基内石油降解菌的浓度为3.2×107cfu/ml;固定化时间为2天。其余步骤条件均与实施例1一致。
脱氢酶含量检测试验:方法同实施例1所述方法一致。
检测结果:本实施例中固定在固定化载体上的生物量为1.2×107cfu/g载体,脱氢酶含量为0.16mg/g。
实施例5:一种固定化石油降解菌的制备方法:与实施例1相区别的是,加入1.6×109cfu所述石油降解菌,所述固定化培养基内石油降解菌的浓度为3.2×107cfu/ml;固定化时间为5天。其余步骤条件均与实施例1一致。
脱氢酶含量检测试验:方法同实施例1所述方法一致。
检测结果:本实施例固定在载体上的生物量为4.6×108cfu/g载体,脱氢酶含量为0.41mg/g。
实施例6:
一种固定化石油降解菌的制备方法:与实施例1相区别的是,所述固定化载体的粒径为1~2mm;加入1.6×109cfu所述石油降解菌,所述固定化培养基内石油降解菌的浓度为3.2×107cfu/ml;其余步骤条件均与实施例1一致。
脱氢酶含量检测试验:方法同实施例1所述方法一致。
检测结果:本实施例中固定在固定化载体上的生物量为9.7×108cfu/g载体,脱氢酶含量为0.96mg/g。
实施例7:
一种固定化石油降解菌的制备方法:与实施例1相区别的是,所述固定化载体的粒径为5mm;加入1.6×109cfu所述石油降解菌,所述固定化培养基内石油降解菌的浓度为3.2×107cfu/ml;其余步骤条件均与实施例1一致。
脱氢酶含量检测试验:方法同实施例1所述方法一致。
检测结果:本实施例中固定在固定化载体上的生物量为8.5×108cfu/g载体,脱氢酶含量为0.75mg/g。
实施例8:
一种固定化石油降解菌的制备方法:与实施例1相区别的是,所述固定化载体的粒径为2mm;加入1.6×109cfu所述石油降解菌,所述固定化培养基内石油降解菌的浓度为3.2×107cfu/ml;其余步骤条件均与实施例1一致。
脱氢酶含量检测试验:方法同实施例1所述方法一致。
检测结果:本实施例中固定在固定化载体上的生物量为2.0×108cfu/g载体,脱氢酶含量为0.6mg/g。
实施例9:
一种固定化石油降解菌的制备方法:与实施例1相区别的是,所述固定化载体的粒径为2mm;加入4×109cfu所述石油降解菌,所述固定化培养基内石油降解菌的浓度为8×107cfu/ml;其余步骤条件均与实施例1一致。脱氢酶含量检测试验:方法同实施例1所述方法一致。
检测结果:本实施例中固定在固定化载体上的生物量为3.17×108cfu/g载体,脱氢酶含量为0.86mg/g。
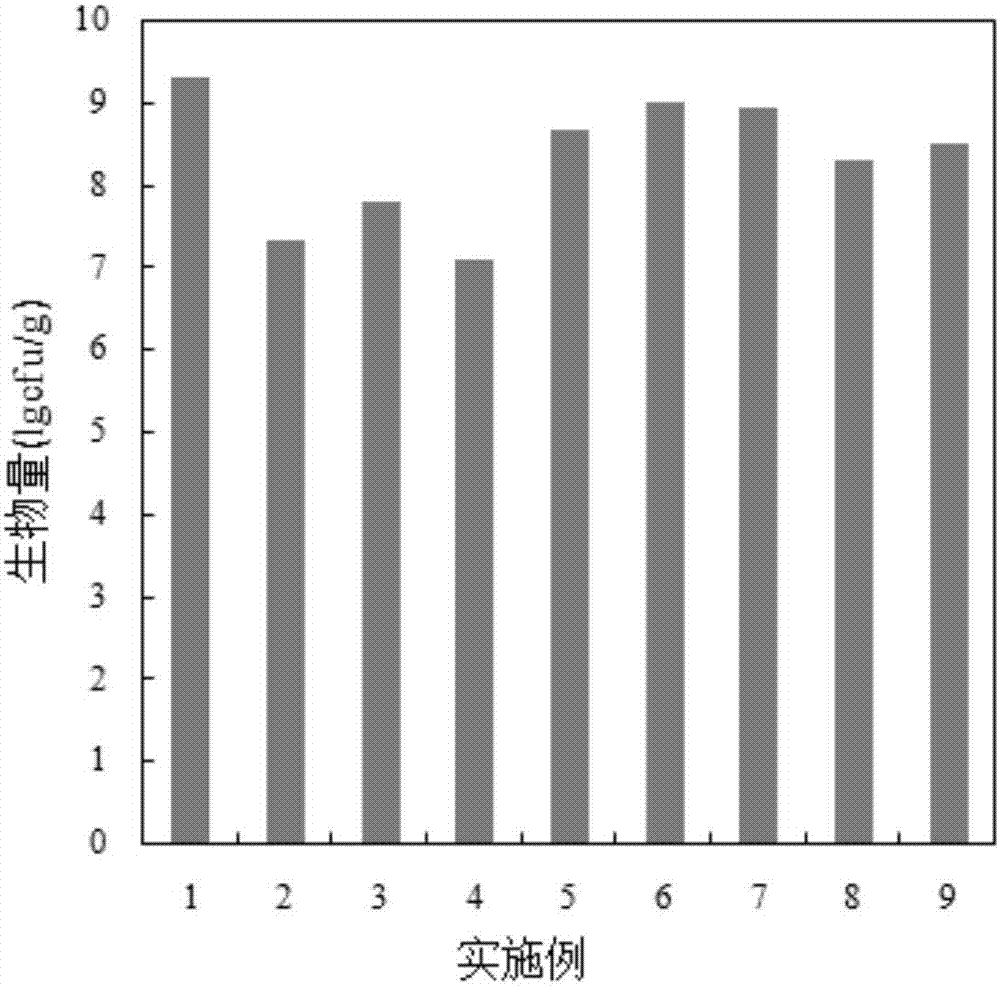
针对实施例1~9所检测的固定在固定化载体上的生物量的柱状图见图2所示,脱氢酶含量的柱状图如图3所示;由图2和图3数值可知,实施例1为最优选实施方式。其生物量和生物活性均最高。
实施例10:
分别取实施例1~9所述的所述的固定化石油降解菌处理石油污染物的方法,包括取固定化石油降解菌加入海水中以降解石油污染物的步骤。具体操作方法为:取固定化石油降解菌均匀散布在石油烃污染的海水中。
在(1-10ml柴油)/50ml海水环境下,模拟海水进行降解性能检测,其中实施例1~9所制备的固定化石油降解菌均使海水在7天内实现修复。
实验例1:氮释放量和磷释放量检测试验:
检测方法:称取经预处理后的玉米秸秆0.25g,分别加入到含250ml水的250ml锥形瓶中,置于高压灭菌锅中121℃,20min灭菌后冷却至室温,于30℃恒温培养箱中存放20天。在存放过程中,分别测不同时间的氮磷释放量。
检测结果:如图5所示,木屑和玉米秸秆的氮释放量最高值分别为14.15mg/g和16.92mg/g,磷释放量最高值分别有0.25mg/g和0.232mg/g。具体如图4所示,表明本发明采用秸秆作为固定化载体可以释放出氮,并且在前四天释放速率较快,之后的释放速率在逐渐降低;在4~7天磷释放速率基本维持在较高水平,在7~12天磷释放速率有所降低,在12~16天维持在一个较稳定的磷释放速率。可为石油降解菌提供营养物质。
实验例2:不同固定化载体粒径的固定化石油降解菌固定化生物量检测:
实验方法:以秸秆为例,取秸秆破碎成4种大小不同的粒径,即分别为1~2mm、2~3mm、4mm和5mm,分别在装有四个25ml的固定化培养基的锥形瓶中分别加入0.1g不同粒径的秸秆(固定化培养基的ph值为7.2),高压灭菌后加入1.6×109cfu(即3.2×107cfu/ml)的石油降解菌,在130rpm、29℃的条件下固定5天,考察载体粒径大小对固定化效果的影响。
实验结果:如图6所示,可知得到粒径为4mm的固定化载体上固定的降解菌数量最多。
实验例3:固定化载体表面生物量密度检测试验:
检测方法:各取0.25g的木屑和玉米秸秆分别放入含100ml固定化培养基的100ml锥形瓶中,然后将锥形瓶放入灭菌锅中,于121℃进行高压灭菌20min。取出锥形瓶并冷却至室温,每个锥形瓶分别加入5ml筛选出来的优势菌群的固定化石油降解菌混合菌液,例如所述石油降解菌混合菌液可以为食烷菌、假单胞菌、食单胞菌和甲基杆菌中的一种或几种,但本发明所选取的石油降解菌混合菌液种类并不局限于此,凡是能够实现对石油进行降解处理的石油降解菌均在本发明的保护范围内。随后将含有废弃物载体和菌的锥形瓶置于30℃,160r/min的摇床中恒温培养7天,得到固定化石油降解菌。测定固定化载体表面生物量密度。
检测结果:木屑和玉米秸秆载体的表面微生物量密度分别为0.0242gvss/(g载体)和0.0097gvss/(g载体)。表明固定化载体的固定化效果明显。
实验例4:固定化石油降解菌的柴油降解率检测:
检测方法:各取0.25g的木屑和玉米秸秆分别放入含100ml固定化培养基的100ml锥形瓶中,然后将锥形瓶放入灭菌锅中,于121℃进行高压灭菌20min。取出锥形瓶并冷却至室温,每个锥形瓶分别加入5ml筛选出来的优势菌群的固定化石油降解菌混合液,例如所述石油降解菌混合菌液可以为食烷菌、假单胞菌、食单胞菌和甲基杆菌中的一种或几种,但本发明所选取的石油降解菌混合菌液种类并不局限于此,凡是能够实现对石油进行降解处理的石油降解菌均在本发明的保护范围内。随后将含有废弃物载体和菌的锥形瓶置于30℃,160r/min的摇床中恒温培养7天,得到固定化石油降解菌。测定一段时间的柴油降解率。
检测结果:如图7所示,木屑固定化菌20天的柴油降解率为73.39%,玉米秸秆固定化菌20天的柴油降解率为52.28%。表明固定化石油降解菌对柴油具有较好的降解效果。
实验例5:
检测方法:对im(模拟海水中的固定化降解菌)、sm(固定化降解菌和原海水中的土著菌)、m(模拟海水中的游离菌)和c(原海水中的土著菌)四种石油降解菌群进行分析,测定四种条件下的降解率。检测结果:如图8所示,对于15天的降解率,im的降解率可达到47.40%,sm的降解率为47.00%。而m的降解率仅为14.10%,c的降解率为12.96%;固定化石油降解菌对柴油降解具有明显的促进作用。
其中所述的固定化石油降解菌可以为食烷菌、假单胞菌、食单胞菌和甲基杆菌中的一种或几种,但本发明所选取的固定化石油降解菌种类并不局限于此,凡是能够实现对柴油进行降解处理的固定化石油降解菌均在本发明的保护范围内。
具体如图9所示,图中1为食烷菌、2为假单胞菌、3为食单胞菌、4为甲基杆菌,其中纵坐标为相对丰度比例(%)。通过高通量宏基因组微生物测序分析方法对im(模拟海水中的固定化降解菌)、sm(固定化降解菌和原海水中的土著菌)、m(模拟海水中的游离菌)、c(原海水中的土著菌)降解10天后的菌群变化进行研究。结果显示,与只有原海水中的土著菌进行对比,在有固定化石油降解菌的环境下,食烷菌受到抑制,而假单胞菌、食单胞菌以及甲基杆菌的相对丰度比例有所上升。同时土著菌和固定化石油降解菌对假单胞菌有明显的促进作用。
- 还没有人留言评论。精彩留言会获得点赞!