人源化二肽基肽酶IV(DPP4)动物的制作方法
本申请要求2014年5月30日提交的美国临时专利申请No.62/005,476、2014年9月17日提交的美国临时专利申请No.62/051,626、以及2014年10月30日提交的美国临时专利申请No.62/072,692的优先权,每一专利申请的公开内容均以引用方式全文并入本文。
技术领域:
本发明涉及包含编码二肽基肽酶IV(DPP4)蛋白的核酸序列的非人动物,所述二肽基肽酶IV(DPP4)蛋白包含人序列。本发明涉及包含DPP4基因的转基因非人动物,所述DPP4基因全部或部分是人的。本发明涉及表达人DPP4蛋白或人源化DPP4蛋白的非人动物。本发明还涉及产生和使用包含人DPP4核酸序列或人源化DPP4核酸序列的非人动物的方法。
背景技术:
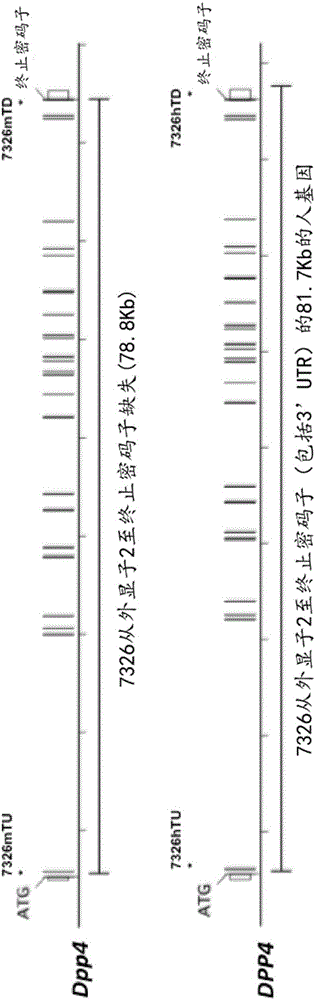
:二肽基肽酶IV(DPP4)是治疗多种人类疾病、障碍和病症的治疗靶标,所述疾病、障碍和病症包括例如高血糖症(参见例如,Gerich(2013)PathogenesisandManagementofPostpandrialHyperglycemia:RoleofIncretin-BasedTherapies,Intl.J.Gen.Med.6:877-895(Gerich,2013年,“餐后高血糖的发病机理和管理:基于肠降血糖素的疗法的作用”,《国际全科医学杂志》,第6卷,第877-895页))和中东呼吸综合征冠状病毒(MERS-CoV)感染(参见例如,Rajetal.(2013)DipeptidylPeptidase4isaFunctionalReceptorfortheEmergingHumanCoronovirus-EMC,Nature495(7440):251-254(Raj等人,2013年,“二肽基肽酶4是新兴的人冠状病毒-EMC的功能受体”,《自然》,第495卷,第7440期,第251-254页))。对特异性靶向人DPP4蛋白的治疗性分子的药代动力学(PK)和药效动力学(PD)的评价通常在非人动物如啮齿动物(例如小鼠或大鼠)中进行。然而,在某些非人动物中如果这些治疗性分子也不靶向内源Dpp4蛋白,则在不能适当地确定此类分子的PD。而且,在其中物种特异性拮抗剂不与内源Dpp4蛋白相互作用的某些非人动物中,在疾病的非人动物模型中评价人DPP4特异性小分子、肽或蛋白质(即,生物)拮抗剂的体内治疗功效是有问题的。此外,在其中治疗靶分子本身不与内源Dpp4蛋白相互作用的某些非人动物中,评价靶向与人DPP4蛋白特异性相互作用的分子的小分子、肽或蛋白质(即,生物)拮抗剂的体内治疗功效也是有问题的。因此,存在对包含人DPP4基因或人源化DPP4基因的非人动物如啮齿动物(例如小鼠或大鼠)的需要。例如,存在对其中非人动物的Dpp4基因全部或部分人源化或用包含编码人DPP4蛋白或人源化DPP4蛋白的序列的人DPP4基因置换(例如,在内源非人基因座处置换)的非人动物如啮齿动物(例如小鼠或大鼠)的需要。也存在对这样的包含DPP4基因(例如,人DPP4基因或人源化DPP4基因)的非人动物的需要:其中所述DPP4基因在非人调控元件(例如,内源调控元件)的控制下,例如DPP4基因的5’侧翼区中的调控元件(例如,启动子和一个或多个增强子)或3’非翻译区中的调控元件。也存在对这样的包含DPP4基因(例如,人DPP4基因或人源化DPP4基因)的非人动物的需要:其中所述DPP4基因在人调控元件的控制下,例如人DPP4基因的5’侧翼区中的调控元件(例如,启动子或一个或多个增强子)或3’非翻译区中的调控元件。还存在对这样的人源化非人动物的需要:所述人源化非人动物在免疫细胞(例如T细胞)表面上,和/或在一种或多种组织(例如胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞表面上表达人DPP4蛋白或人源化DPP4蛋白,表达水平类似于表达功能性Dpp4蛋白但不包含人DPP4基因或人源化DPP4基因的年龄匹配的非人动物的免疫细胞(例如T细胞)表面上,和/或一种或多种组织(例如胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞表面上的Dpp4蛋白表达水平。此外,存在对这样的人源化非人动物的需要:所述人源化非人动物在免疫细胞(例如T细胞)表面上,和/或在一种或多种组织(例如胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中细胞表面上表达人DPP4蛋白或人源化DPP4蛋白,表达水平高于或低于表达功能性Dpp4蛋白但不包含人DPP4基因或人源化DPP4基因的年龄匹配的非人动物的免疫细胞(例如T细胞)表面上,和/或一种或多种组织(例如胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞表面上的Dpp4蛋白的水平。在本说明书通篇中,引用了各种专利、专利申请和其他类型的出版物(例如,期刊论文、电子数据库条目等)。本文所引用的所有专利、专利申请和其他出版物的公开内容,出于所有目的,均据此以引用方式全文并入本文。技术实现要素:本发明提供了包含编码DPP4蛋白的核酸序列的非人动物,所述DPP4蛋白包含人序列。本发明提供了包含DPP4基因的转基因非人动物,所述DPP4基因全部或部分是人的。本发明提供了表达人DPP4蛋白或人源化DPP4蛋白的非人动物。本发明提供了内源非人动物Dpp4基因被置换(全部或部分置换)的非人动物。本发明提供了在内源非人Dpp4基因座处包含DPP4人源化(全部或部分人源化)的非人动物。本发明提供了具有人DPP4基因或人源化DPP4基因的非人动物,其中所述非人动物不表达内源Dpp4蛋白,并且其中所述非人动物在免疫细胞(例如T细胞)表面上,和/或在一种或多种组织(包括胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞表面上表达人DPP4蛋白或人源化DPP4蛋白,表达水平类似于表达功能性内源Dpp4蛋白但不包含置换的年龄匹配的非人动物的免疫细胞(例如T细胞)表面上,和/或一种或多种组织(包括胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞表面上存在的Dpp4蛋白的水平。在一个方面,本发明提供了包含人DPP4核酸序列或人源化DPP4核酸序列的非人动物。在一个方面,本发明提供了经遗传修饰的非人动物,该非人动物在内源Dpp4基因座处用编码人DPP4蛋白或人源化DPP4蛋白的基因对编码内源Dpp4基因的基因进行了置换。本发明提供了在内源Dpp4基因座处用人Dpp4基因置换内源Dpp4基因的啮齿动物,例如小鼠或大鼠。在一个实施例中,啮齿动物对于在内源Dpp4基因座处用编码人DPP4蛋白或人源化DPP4蛋白的基因置换内源Dpp4基因而言是杂合的。在一个实施例中,啮齿动物对于在内源Dpp4基因座处用编码人DPP4蛋白或人源化DPP4蛋白的基因置换内源Dpp4基因而言是纯合的。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个方面,提供了包含内源啮齿动物Dpp4基因的人源化的经遗传修饰的啮齿动物(例如小鼠或大鼠),其中该人源化包括在内源啮齿动物Dpp4基因座处用编码人DPP4基因的至少一个外显子的核酸序列置换编码Dpp4基因的外显子的啮齿动物基因以形成经修饰的DPP4基因,其中所述经修饰的DPP4基因的表达处于内源啮齿动物Dpp4基因座处的啮齿动物调控元件的控制下。在一个实施例中,啮齿动物对于编码人DPP4基因的至少一个外显子的核酸序列是杂合的以形成经修饰的DPP4基因。在一个实施例中,啮齿动物对于编码人DPP4基因的至少一个外显子的核酸序列是纯合的以形成经修饰的DPP4基因。在一个实施例中,啮齿动物是小鼠或大鼠。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,编码人DPP4蛋白或人源化DPP4蛋白的人DPP4基因包含人DPP4基因的外显子2至外显子26。在一个实施例中,人源化DPP4蛋白包含人DPP4蛋白的细胞外结构域。在一个实施例中,人源化DPP4蛋白包含小鼠Dpp4蛋白的跨膜结构域和胞质结构域。在一个实施例中,啮齿动物是不能够表达小鼠Dpp4蛋白的小鼠。在一个实施例中,啮齿动物是小鼠,其中用编码人DPP4的外显子2至外显子26的人DPP4序列的毗邻基因组片段置换编码小鼠Dpp4的外显子2至外显子26的小鼠Dpp4序列的毗邻基因组片段。在一个方面,提供表达人DPP4蛋白或人源化DPP4蛋白的经遗传修饰的啮齿动物(例如小鼠或大鼠),其中该表达人DPP4蛋白或人源化DPP4蛋白的啮齿动物包含正常的免疫系统,即,表达人DPP4蛋白或人源化DPP4蛋白的啮齿动物的血液、血浆或血清中的免疫细胞(例如T细胞)的数量类似于表达功能性内源Dpp4蛋白的啮齿动物的血液、血浆或血清中的免疫细胞(例如T细胞)的数量。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,表达人DPP4蛋白或人源化DPP4蛋白的啮齿动物的血液具有与表达功能性内源Dpp4蛋白的啮齿动物(例如野生型小鼠或大鼠)大约相同数量的免疫细胞(例如T细胞)。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,在T细胞的表面上表达人DPP4或人源化DPP4的小鼠的血液中存在的T细胞量是表达功能性内源Dpp4蛋白但在内源小鼠Dpp4基因座处不用人DPP4基因置换内源Dpp4基因的年龄匹配的小鼠的血液中存在的T细胞量的至少约20%、30%、40%、50%、60%、70%、80%、90%、100%、110%、120%、130%、140%、150%、160%、170%、180%、190%或200%。在一个实施例中,在T细胞的表面上表达人DPP4蛋白或人源化DPP4蛋白的小鼠的血液中的T细胞量是表达功能性内源Dpp4蛋白但在内源小鼠Dpp4基因座处不用人DPP4基因置换内源Dpp4基因的年龄匹配的小鼠血液中存在的T细胞量的在约20%与约200%之间、约40%与约160%之间或约80%与约120%之间。在一个方面,提供了表达人DPP4蛋白或人源化DPP4蛋白的经遗传修饰的啮齿动物(例如小鼠或大鼠),其中该啮齿动物在表达功能性内源Dpp4蛋白且年龄匹配的啮齿动物的免疫细胞(例如T细胞)表面上,和/或一种或多种组织(例如胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞的表面上表达人DPP4蛋白或人源化DPP4蛋白。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,表达人DPP4蛋白或人源化DPP4蛋白的啮齿动物的免疫细胞(例如T细胞)在其表面上具有与表达功能性内源Dpp4蛋白的啮齿动物(例如野生型小鼠或大鼠)的免疫细胞(例如T细胞)大约相同水平的DPP4蛋白。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,该小鼠在免疫细胞(例如T细胞)表面上表达人DPP4蛋白或人源化DPP4蛋白,表达水平为表达功能性内源Dpp4蛋白但在内源小鼠Dpp4基因座处不用人DPP4基因置换内源Dpp4基因的年龄匹配的小鼠的免疫细胞(例如T细胞)表面上的Dpp4蛋白水平的至少约20%、30%、40%、50%、60%、70%、80%、90%、100%、110%、120%、130%、140%、150%、160%、170%、180%、190%或200%。在一个实施例中,该小鼠在免疫细胞(例如T细胞)表面上表达人DPP4蛋白或人源化DPP4蛋白,表达水平为表达功能性内源Dpp4蛋白但在内源小鼠Dpp4基因座处不用人DPP4基因置换内源Dpp4基因的年龄匹配的小鼠的免疫细胞(例如T细胞)表面上存在的小鼠Dpp4蛋白水平的约20%与约200%之间、约40%与约160%之间或约80%至约120%之间。在一个实施例中,表达人DPP4蛋白或人源化DPP4蛋白的啮齿动物的一种或多种组织(例如胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞在其表面上具有与表达功能性内源Dpp4蛋白的啮齿动物(例如野生型小鼠或大鼠)的一种或多种组织(例如胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞大约相同水平的DPP4蛋白。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,该小鼠在一种或多种组织(例如胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞表面上表达人DPP4蛋白或人源化DPP4蛋白,表达水平为表达功能性内源Dpp4蛋白但在内源小鼠Dpp4基因座处不用人DPP4基因置换内源Dpp4基因的年龄匹配的小鼠的一种或多种组织(例如胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞表面上的Dpp4蛋白水平的至少约20%、30%、40%、50%、60%、70%、80%、90%、100%、110%、120%、130%、140%、150%、160%、170%、180%、190%或200%。在一个实施例中,该小鼠在一种或多种组织(例如胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞表面上表达人DPP4蛋白或人源化DPP4蛋白,表达水平为表达功能性内源Dpp4蛋白但在内源小鼠Dpp4基因座处不用人DPP4基因置换内源Dpp4基因的年龄匹配的小鼠的一种或多种组织(例如胎盘、肾、肺、肝、骨骼肌、心脏、脑和/或胰腺)中的细胞表面上存在的小鼠Dpp4蛋白水平的约20%与约200%之间、约40%与约160%之间或约80%与约120%之间。在一个方面,提供包含人源化DPP4基因的经遗传修饰的啮齿动物,所述人源化DPP4基因包含用人DPP4细胞外结构域编码序列对啮齿动物Dpp4细胞外结构域编码序列的置换,其中该人源化DPP4基因包含啮齿动物Dpp4跨膜序列和啮齿动物Dpp4胞质序列,其中该人源化DPP4基因处于内源Dpp4基因座处的内源啮齿动物Dpp4调控元件的控制下。在一个实施例中,啮齿动物对于人源化DPP4基因是杂合的。在一个实施例中,啮齿动物对于人源化DPP4基因是纯合的。在一个实施例中,啮齿动物是小鼠或大鼠。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,小鼠不能够表达小鼠Dpp4蛋白。在一个实施例中,内源啮齿动物Dpp4基因座处的啮齿动物调控元件或序列来自小鼠或大鼠。在一个实施例中,啮齿动物调控元件或序列是啮齿动物Dpp4基因座处的内源啮齿动物调控元件或序列并且来自小鼠或大鼠。在一个方面,提供表达人DPP4蛋白或人源化DPP4蛋白的非人动物如啮齿动物(例如小鼠或大鼠),其中所述非人动物表达来自内源非人Dpp4基因座的人DPP4蛋白或人源化DPP4蛋白。在一个实施例中,非人动物是啮齿动物。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,啮齿动物对于表达人DPP4蛋白或人源化DPP4蛋白的内源非人Dpp4基因座是杂合的。在一个实施例中,啮齿动物对于表达人DPP4蛋白或人源化DPP4蛋白的内源非人Dpp4基因座是纯合的。在一个方面,提供表达来自内源小鼠Dpp4基因座的人DPP4蛋白或人源化DPP4蛋白的经遗传修饰的小鼠,其中已用人DPP4基因完全或部分置换了内源小鼠Dpp4基因。在一个实施例中,内源小鼠Dpp4基因座处包括外显子2至外显子26中的终止密码子在内的约78.8kb被缺失,并用包含人DPP4基因的外显子2至外显子26以及3′非翻译序列的一部分的约81.8kb人DPP4基因序列置换。在一个具体的实施例中,该人DPP4基因包含人BACRP11-68L22的人DPP4基因的外显子2至外显子26以及3′非翻译序列的一部分。在一个具体的实施例中,该DPP4基因包含小鼠Dpp4基因5’调控元件、小鼠Dpp4外显子1(包括小鼠Dpp4蛋白的前两个氨基酸Met和Lys以及小鼠Dpp43’调控元件(例如,3’非翻译区))以及人DPP4基因外显子2至外显子26,即,除了来源于小鼠Dpp4外显子1的前两个氨基酸外的人DPP4蛋白编码序列。在一个方面,提供包含编码人DPP4蛋白或人源化DPP4蛋白的核苷酸序列的经遗传修饰的小鼠,其中编码人DPP4蛋白或人源化DPP4蛋白的核苷酸序列全部或部分置换编码内源小鼠Dpp4蛋白的内源核苷酸序列。在一个实施例中,小鼠对于编码人DPP4蛋白或人源化DPP4蛋白的核苷酸序列是杂合的。在一个实施例中,小鼠对于编码人DPP4蛋白或人源化DPP4蛋白的核苷酸序列是纯合的。在一个方面,提供用于产生人源化DPP4啮齿动物的方法,包括用包含编码人DPP4蛋白或人源化DPP4蛋白的人DPP4基因序列的一个或多个外显子的人DPP4基因序列置换编码啮齿动物Dpp4蛋白的啮齿动物Dpp4基因序列,其中所述置换发生在内源啮齿动物Dpp4基因座处,并且包含编码人DPP4蛋白或人源化DPP4蛋白的人DPP4基因序列的一个或多个外显子的人DPP4基因序列有效地连接至内源啮齿动物Dpp4基因座处的啮齿动物调控元件或序列。在一个实施例中,啮齿动物对于编码人DPP4蛋白或人源化DPP4蛋白的核苷酸序列是杂合的。在一个实施例中,啮齿动物对于编码人DPP4蛋白或人源化DPP4蛋白的核苷酸序列是纯合的。在一个实施例中,啮齿动物是小鼠或大鼠。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,啮齿动物调控元件或序列来自小鼠。在一个实施例中,啮齿动物调控元件或序列来自大鼠。在一个实施例中,啮齿动物调控元件或序列是啮齿动物Dpp4基因座处的内源啮齿动物调控元件或序列。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,置换啮齿动物Dpp4基因序列的人DPP4基因序列包含人DPP4基因序列的至少一个外显子。在其他实施例中,置换啮齿动物Dpp4基因序列的人DPP4基因序列包含人DPP4基因序列的至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个、至少23个、至少24个或至少25个外显子。在一个实施例中,置换啮齿动物Dpp4基因序列的人DPP4基因序列包含人DPP4基因序列的所有26个外显子。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,置换啮齿动物Dpp4基因序列的人Dpp4基因序列或人源化Dpp4基因序列编码的蛋白质与人DPP4具有约85%、90%、95%、96%、97%、98%或约99%同一性。在一个实施例中,置换啮齿动物Dpp4基因序列的人Dpp4基因序列或人源化Dpp4基因序列包含编码人DPP4蛋白的细胞外结构域的至少一个人DPP4基因序列外显子。在其他实施例中,置换啮齿动物Dpp4基因序列的人DPP4基因序列包含编码人DPP4蛋白的细胞外结构域的至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个或至少23个人DPP4基因序列外显子。在一个实施例中,置换啮齿动物Dpp4基因序列的人DPP4基因序列包含编码人DPP4蛋白的细胞外结构域的所有24个人DPP4基因序列外显子。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个实施例中,置换啮齿动物Dpp4基因序列的人Dpp4基因序列或人源化Dpp4基因序列编码的DPP4蛋白的细胞外结构域与人DPP4蛋白的细胞外结构域具有约85%、90%、95%、96%、97%、98%或约99%同一性。在一个实施例中,置换发生在内源啮齿动物Dpp4基因座处,并且包含编码人DPP4蛋白或人源化DPP4蛋白的人DPP4基因序列的一个或多个外显子的人DPP4基因序列有效连接至内源啮齿动物Dpp4基因座处的内源啮齿动物调控元件或序列。在一个方面,提供产生人源化DPP4小鼠的方法,包括用编码人DPP4蛋白或人源化DPP4蛋白的人DPP4基因序列置换编码小鼠Dpp4蛋白的小鼠Dpp4基因序列。在一个实施例中,置换发生在内源小鼠Dpp4基因座处,并且编码人DPP4蛋白或人源化DPP4蛋白的人DPP4基因有效连接至内源小鼠Dpp4基因座处的小鼠调控元件或序列。在一个实施例中,置换发生在内源小鼠Dpp4基因座处,并且编码人DPP4蛋白或人源化DPP4蛋白的人DPP4基因有效连接至内源小鼠Dpp4基因座处的内源小鼠调控元件或序列。在多个方面,本文所述的经遗传修饰的非人动物如啮齿动物(例如小鼠或大鼠)包含在其种系中的遗传修饰。在一个方面,提供包含如本文所述的遗传修饰的非人动物如啮齿动物(例如小鼠或大鼠)胚胎。在一个方面,提供包含供体细胞的非人动物如啮齿动物(例如小鼠或大鼠)宿主胚胎,所述供体细胞包含如本文所述的遗传修饰。在一个方面,提供包含如本文所述的遗传修饰的多能或全能非人动物如啮齿动物(例如小鼠或大鼠)细胞。在一个实施例中,细胞是啮齿动物细胞。在一个实施例中,细胞是小鼠细胞。在一个实施例中,细胞是啮齿动物胚胎干(ES)细胞。在一个实施例中,细胞是小鼠ES细胞。在一个方面,提供非人动物如啮齿动物(例如小鼠或大鼠)卵,其中所述非人动物卵包含异位非人动物染色体,其中所述异位非人动物染色体包含如本文所述的遗传修饰。在一个实施例中,非人动物是啮齿动物。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。在一个方面,经遗传修饰以包含人DPP4基因的小鼠胚胎、卵或细胞是C57BL品系小鼠的,所述品系选自C57BL/A、C57BL/An、C57BL/GrFa、C57BL/KaLwN、C57BL/6、C57BL/6J、C57BL/6ByJ、C57BL/6NJ、C57BL/10、C57BL/10ScSn、C57BL/10Cr和C57BL/Ola。在另一个实施例中,小鼠是129品系,选自为129P1、129P2、129P3、129X1、129S1(例如,129S1/SV、129S1/Svlm)、129S2、129S4、129S5、129S9/SvEvH、129S6(129/SvEvTac)、129S7、129S8、129T1、129T2的品系(参见例如,Festingetal.(1999)Revisednomenclatureforstrain129mice,MammalianGenome10:836(Festing等人,1999年,品系129小鼠的修订命名),还参见Auerbachetal(2000)EstablishmentandChimeraAnalysisof129/SvEv-andC57BL/6-DerivedMouseEmbryonicStemCellLines(Auerbach等人,2000年,129/SvEv来源和C57BL/6来源的小鼠胚胎干细胞系的建立和嵌合体分析))。在一个具体的实施例中,经遗传修饰的小鼠是前述129品系和前述C57BL/6品系的杂种。在另一个具体的实施例中,小鼠是前述129品系的杂种,或前述BL/6品系的杂种。在一个具体的实施例中,所述杂种的129品系是129S6(129/SvEvTac)品系。在另一个实施例中,小鼠是BALB品系,例如BALB/c品系。在另一个实施例中,小鼠是BALB品系和另一前述品系的杂种。在一个实施例中,小鼠是Swiss或SwissWebster小鼠。在各个方面,包含人DPP4核酸序列或人源化DPP4核酸序列的非人动物选自哺乳动物和鸟类。在一个实施例中,非人动物是哺乳动物。在一个实施例中,哺乳动物是啮齿动物。在一个实施例中,啮齿动物是小鼠或大鼠。在一个方面,提供包含具有人DPP4基因或其片段的核酸序列的啮齿动物,其中所述人DPP4基因或其片段包含人DPP4基因的至少一个外显子,并且其中人DPP4基因或其片段编码人DPP4蛋白或人源化DPP4蛋白。在一个实施例中,人DPP4基因或其片段包含人DPP4基因的至少2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、18个、20个、21个、22个、23个、24个或25个外显子。在一个实施例中,人DPP4基因或其片段包含人DPP4基因的所有26个外显子。在一个实施例中,核酸序列还包含人DPP4基因的5’侧翼区。在一个实施例中,人DPP4基因或其片段有效连接至人DPP4基因的5’侧翼区。在一个实施例中,人DPP4基因的5’侧翼区包含至少1kb的长度(例如,至少1、2、3、4、5、10、20、30、40、50kb或更大的长度)。在一个实施例中,人DPP4基因的5’侧翼区包含至少10kb的长度。在一个实施例中,人DPP4基因的5’侧翼区包含至少40kb的长度。在一个实施例中,人DPP4基因或其片段的表达处于人DPP4基因的5’侧翼区的控制下。在一个实施例中,人DPP4蛋白或人源化DPP4蛋白包含SEQIDNO:24的氨基酸序列或其片段。在一个实施例中,啮齿动物在T细胞表面上表达人DPP4蛋白或人源化DPP4蛋白,表达水平为表达功能性内源啮齿动物Dpp4蛋白但不包含人DPP4基因或其片段且年龄匹配的啮齿动物的T细胞表面上存在的啮齿动物Dpp4蛋白水平的至少约20%(例如,至少约20%、30%、40%、50%、60%、70%、80%、90%、95%、98%、99%或更大)。在一个实施例中,啮齿动物在选自胎盘、肾、肺、肝、骨骼肌、心脏、脑和胰腺的一种或多种组织中的细胞表面上表达人DPP4蛋白或人源化DPP4蛋白,表达水平为表达功能性内源啮齿动物Dpp4蛋白但不包含人DPP4基因或其片段且年龄匹配的啮齿动物的一种或多种组织的表面上存在的啮齿动物Dpp4蛋白水平的至少约20%(例如,至少约20%、30%、40%、50%、60%、70%、80%、90%、95%、98%、99%或更大)。在一个实施例中,啮齿动物表达功能性内源啮齿动物Dpp4蛋白。在一个实施例中,啮齿动物是小鼠或大鼠。在一个方面,本文提供用于产生人源化转基因啮齿动物的方法,包括将包含人DPP4基因序列的一个或多个外显子的核酸序列整合进啮齿动物的染色体,其中所述人DPP4基因序列的一个或多个外显子编码人DPP4蛋白或人源化DPP4蛋白。在一个实施例中,人DPP4基因或其片段包含人DPP4基因的至少2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、18个、20个、21个、22个、23个、24个或25个外显子。在一个实施例中,人DPP4基因或其片段包含人DPP4基因的所有26个外显子。在一个实施例中,核酸序列还包含人DPP4基因的5’侧翼区。在一个实施例中,人DPP4基因序列有效连接至人DPP4基因的5’侧翼区。在一个实施例中,人DPP4蛋白或人源化DPP4蛋白包含SEQIDNO:24的氨基酸序列或其片段。在一个实施例中,啮齿动物是小鼠或大鼠。在另外的方面,提供了用于确定人特异性DPP4拮抗剂在本文所述的任何人源化DPP4啮齿动物中的体内治疗功效的方法,所述方法包括向所述啮齿动物施用DPP4拮抗剂,其中所述啮齿动物感染有中东呼吸综合征冠状病毒(MERS-CoV);以及与未施用所述DPP4拮抗剂的感染有MERS-CoV的对照啮齿动物相比,确定所述DPP4拮抗剂是否治疗或预防MERS-CoV感染的一种或多种症状。在一个实施例中,DPP4拮抗剂选自小分子、肽和抗体。在一个实施例中,DPP4拮抗剂是MERS-CoV蛋白的抗体。在一个实施例中,MERS-CoV蛋白是MERS-CoV刺突蛋白。在一个实施例中,啮齿动物感染有MERS-CoV的一个或多个毒株,所述毒株选自:Al-Hasa_1、Al-Hasa_2、Al-Hasa_3、Al-Hasa_4、Al-Hasa_12、Al-Hasa_15、Al-Hasa_16、Al-Hasa_17、Al-Hasa_18、Al-Hasa_19、Al-Hasa_21、Al-Hasa_25、Buraidah_1、EMC/2012、FRA/UAE、Hafr-Al-Batin_1、Hafr-Al-Batin_2、Hafr-Al-Batin_6、Jeddah_1、Jordan-N3/2012、Munich、Riyadh_3、Riyadh_4、Riyadh_5、Riyadh_14、Taif_1、Wadi-Ad-Dawasir_1、Riyadh_9、KFU-HKU1、KFU-HKU13、Qatar3、Qatar4、England1、England-Qatar/2012、Bisha_1、Riyadh_1和Riyadh_2。在一个实施例中,在MERS-CoV感染之前施用拮抗剂。在一个实施例中,在MERS-CoV感染之后施用拮抗剂。在一个实施例中,与MERS-CoV感染同时施用拮抗剂。在一个实施例中,MERS-CoV感染的症状是病毒滴度或RNA水平。在一个实施例中,通过一种或多种选自以下的方法测定病毒滴度或RNA水平:qPCR、RNA印迹、噬菌斑测定和原位杂交。在一个实施例中,MERS-CoV感染的症状是肺部炎症。在一个实施例中,通过组织化学方法评估肺部炎症。在一个实施例中,MERS-CoV感染的症状是体重减轻。在一个实施例中,啮齿动物是小鼠或大鼠。在一个实施例中,啮齿动物是小鼠。在一个实施例中,啮齿动物是大鼠。除非从实施例或方面的上下文中明确或明显排除,否则本文所述的每个方面和实施例能够一起使用。附图说明图1A至图1B提供用于人源化Dpp4基因座的策略的图示,未按比例绘制。图1A是示出跨越外显子2至外显子26中的终止密码子的78.8kb小鼠Dpp4基因(上图)被缺失,并用跨越外显子2至外显子26以及3′非翻译区的一部分的81.7kb人DPP4基因(下图)置换的示意图,如图所示。图1B是示出人源化DPP4小鼠包含(i)小鼠Dpp4基因5’侧翼区(包括调控序列,例如启动子和转录起始位点)和外显子1(包括起始ATG密码子),(ii)跨越外显子2至外显子26的人DPP4基因(包括终止密码子)以及3′非翻译区的一部分(包括loxP位点),和(iii)刚好从3′开始到终止密码子的小鼠Dpp4基因3’非翻译区的示意图,如图所示。图2示出在人源化DPP4小鼠中表达的人源化DPP4蛋白的氨基酸序列(SEQIDNO:17)。图3示出感染后4天,对从模拟(PBS)感染或MERS-CoV(Jordan毒株)感染的F0人源化DPP4小鼠的肺组织获得的RNA进行实时PCR的结果。图4示出感染后4天,来自模拟(PBS)感染或MERS-CoV(Jordan毒株)感染的F0人源化DPP4小鼠的肺的气道(10倍放大和40倍放大)和肺泡(40倍放大)的H&E染色。图5是小鼠Dpp4(mDpp4)氨基酸序列(SEQIDNO:25)与由转基因MAID7326/7327小鼠编码的人DPP4(hDPP4)蛋白(SEQIDNO:26)的序列比对。序列之间不同的非同源残基以下划线标出,序列之间不同的同源残基用粗体和斜体表示,并且空位用连字符示出。两个序列之间相同的残基用无格式的文本示出。图6是展示人DPP4的基因、序列和染色体信息的表。图7是示出BAC(BACRP11-345J9和BACRP11-68L22)每一者的人DPP4基因和侧翼基因组序列的覆盖度的示意图。还示出人DPP4内的位置和人TaqManTM引物-探针组退火所在的启动子区域(对上游组是7333hTU,且对下游组是7333hTD)。图8是展示用于人TaqManTM等位基因获得测定法的引物-探针组的表,其中7333hTU指上游组,并且7333hTD指下游组。图9是由转基因MAID7333和7334小鼠编码的人源化DPP4蛋白的氨基酸序列(SEQIDNO:24)。图10A是示出感染后2天和4天(dpi),感染小鼠中MERS-CoV基因组(UpERNA)的定量PCR测量结果的柱形图。图10B是示出在感染后2和4天,感染小鼠中MERS-CoVmRNA转录物(前导RNA)的定量PCR测量结果的柱形图。图10C是在感染后2天和4天,定量受感染的小鼠肺的MERS-CoV病毒滴度的柱形图。均质化的小鼠肺中的MERS-CoV水平通过半数组织培养感染剂量(TCID50)测定法来定量并表示为每mL的菌斑形成单位(pfu)。图10D是来自MERS-CoV感染小鼠的肺的用苏木精和伊红染色的组织学图像的图。示出了PBS处理小鼠、感染后2天和感染后4天的小鼠的气道(10X)、脉管系统(10X)和间质(40X)。图11A是示出病毒感染前用抗MERS-CoV刺突蛋白抗体(Ab2或Ab4)预处理小鼠的肺,对来自该肺的MERS-CoV基因组(UpERNA)进行定量PCR测量所得结果的柱形图。图11B是示出病毒感染前用抗MERS-CoV刺突蛋白抗体预处理小鼠的肺,对来自该肺的MERS-CoVmRNA转录物(前导RNA)进行定量PCR测量所得结果的柱形图。RNA使用针对MERS-CoV基因组的引物进行定量,并且与hIgG1同种型对照处理的小鼠进行比较。将所有样品与设定为100%的hIgG1对照进行比较。图11C是示出病毒感染前用抗MERS-CoV刺突蛋白抗体预处理的小鼠的肺中的病毒滴度的柱形图。病毒滴度通过噬菌斑测定法进行定量并记录为pfu/mL。图12A是使用抗MERS-CoV刺突蛋白抗体(Ab2或Ab4)预处理的感染MERS-CoV的B6/hDPP4小鼠的肺的组织学图像的分图。小鼠肺的苏木精和伊红染色的切片显示出来自各组的代表性小鼠的气道、脉管系统和间质。图12B是示出图12A中所示的小鼠肺的组织学评分的柱形图。所述分值是每个试验组和时间点中所有小鼠的平均分值。图13A是示出来自受感染的肺的MERS-CoV基因组(UpERNA)的定量PCR测量结果的柱形图。比较病毒感染前一天或病毒感染后一天注射的抗MERS-CoV刺突蛋白抗体(Ab2或Ab4)的效果。图13B是示出来自受感染的肺的MERS-CoVmRNA转录物(前导RNA)的定量PCR测量结果的柱形图。比较病毒感染前一天或病毒感染后一天注射的抗MERS-CoV刺突蛋白抗体(Ab2或Ab4)的效果。对于图13A至图13B,RNA使用针对MERS-CoV基因组的引物进行定量,并且与hIgG1同种型对照处理的小鼠进行比较。将所有样品与设定为100%的hIgG1对照进行比较。图13C是示出病毒感染后用抗MERS-CoV刺突蛋白抗体(Ab2或Ab4)处理的小鼠的肺中的病毒滴度的柱形图。病毒滴度通过噬菌斑测定进行定量并记录为pfu/mL肺。比较病毒感染前一天或病毒感染后一天注射的抗体的效果。图14A是感染后1天,使用抗MERS-CoV刺突蛋白Ab2抗体处理的感染MERS-CoV的B6/hDPP4小鼠的肺的组织学图像的图。小鼠肺的苏木精和伊红染色的切片显示出来自各组的代表性小鼠的气道、脉管系统和间质。图14B是示出图14A的小鼠肺的组织学评分的柱形图。图15示出在人源化DPP4小鼠中,重量随用MERS-CoV感染后的时间变化的剂量响应研究。每组使用4-5只小鼠。图16示出在杂合和纯合人源化DPP4小鼠中,重量随用MERS-CoV(1×106pfu/小鼠;每组4-5只小鼠)感染后的时间变化的剂量响应研究。图17示出相对于经PBS处理的对照,在暴露于高剂量的病毒(1×106pfu/小鼠)的人源化DPP4小鼠中在第7天通过组织学检查所看到的病变(炎症)。具体实施方式DPP4基因和蛋白DPP4基因编码II型跨膜蛋白三肽基肽酶IV(DPP4)(也称为CD26、腺苷脱氨酶复合蛋白-2(ADCP2)、腺苷脱氨酶结合蛋白(ADABP)和TP103),其具有丝氨酸外肽酶活性,并且在T细胞的激活以及在若干其他细胞类型中的细胞内信号传导级联中发挥重要作用。人DPP4.NCBI基因ID:1803;主要来源:HGNC:3009;RefSeq转录物:NM_001935.3;UniProtID:P27487;基因组装配:GRCh38;位置:chr2:162,848,755-162,931,052-链。(参见图6)。人DPP4基因位于染色体2,在2q24.3。人DPP4基因具有26个外显子并编码长度为766个氨基酸的II型跨膜多肽,包括N端6个氨基酸的胞质结构域、22个氨基酸的跨膜结构域和C端738个氨基酸的细胞外结构域。人DPP4蛋白的细胞外结构域(即,胞外域)由人DPP4基因的编码外显子3至26编码。小鼠Dpp44.NCBI基因ID:13482;主要来源:MGI:94919;RefSeq转录物:NM_010074.3;UniProtID:P28843;基因组装配:GRCh38;位置:chr2:62,330,073-62,412,591-链。小鼠DPP4基因位于染色体2,在235.85cM。小鼠Dpp4基因具有26个外显子并编码长度为760个氨基酸的II型跨膜多肽,包括N端6个氨基酸的胞质结构域、22个氨基酸的跨膜结构域和C端732个氨基酸的细胞外结构域。小鼠Dpp4蛋白的细胞外结构域(即,胞外域)由小鼠DPP4基因的编码外显子3至26编码。DPP4蛋白的物种特异性如以下实例2中所述,人DPP4蛋白而不是小鼠DPP4蛋白是中东呼吸综合征冠状病毒(MERS-CoV)感染的功能性受体。通常在非人动物如啮齿动物(例如小鼠或大鼠)中针对药代动力学(PK)和药效动力学(PD),对以物种特异性方式靶向人DPP4蛋白,或以物种特异性方式靶向分子(诸如与人DPP4蛋白相互作用的MERS-CoV)的候选治疗性分子进行评价。还在其中DPP4发挥作用的人疾病、障碍和病症的非人动物如啮齿动物(例如小鼠或大鼠)模型中测试这种治疗性分子的体内治疗功效。然而,不能在啮齿动物(具体为小鼠)中适当地评价对人DPP4蛋白具有特异性的治疗性分子(例如,人特异性DPP4抑制剂)的药效动力学和/或体内治疗功效,因为这些治疗性分子的靶标缺失。而且,不能在啮齿动物(具体为小鼠)中适当地评价对与人DPP4蛋白特异性相互作用的靶标(例如,人DPP4特异性MERS-CoV)具有特异性的治疗性分子的体内治疗功效,因为这些治疗性靶分子的靶标(例如,受体、相互作用配偶体)缺失。因此,在多个实施例中,为在非人动物如啮齿动物(例如小鼠或大鼠)中评估人特异性DPP4蛋白拮抗剂或抑制剂的药效动力学和/或体内治疗功效,需要用人DPP4蛋白或人源化DPP4蛋白置换内源Dpp4蛋白。在多个实施例中,为在非人动物如啮齿动物(例如小鼠或大鼠)中评估与人DPP4蛋白特异性相互作用的靶分子的小分子、肽或生物拮抗剂或抑制剂的体内治疗功效,需要用人DPP4蛋白或人源化DPP4蛋白置换内源Dpp4蛋白。另外,在多个实施例中,为了避免其中内源Dpp4蛋白不正常表达的细胞和组织中人DPP4蛋白或人源化DPP4蛋白的过表达或低表达,和/或人DPP4蛋白或人源化DPP4蛋白的不适当表达的潜在问题,可取的是将人DPP4基因全部或部分插入非人动物如啮齿动物(例如小鼠或大鼠)的基因组的内源DPP4基因座,并且至少部分地在内源Dpp4调控元件的控制下在非人动物如啮齿动物(例如小鼠或大鼠)中表达人DPP4蛋白或人源化DPP4蛋白。在一些实施例中,可取的是用人DPP4基因或其片段靶向置换内源(例如,小鼠或大鼠)Dpp4基因。在其他实施例中,将人DPP4基因或其片段随机插入啮齿动物(例如,小鼠或大鼠)基因组中而不是用人DPP4基因或其片段置换内源Dpp4基因。在一些实施例中,在其中人DPP4基因或其片段已随机插入基因组的啮齿动物(例如小鼠或大鼠)中,内源啮齿动物Dpp4的表达得以保持。本文提供了在内源Dpp4基因座中或在一个或多个其他基因座中包含人DPP4基因或其片段(即,包含置换内源Dpp4基因座中或在一个或多个其他基因座的人DPP4基因或其片段)的非人动物如啮齿动物(例如小鼠或大鼠)。本文还提供了在内源Dpp4基因座中和在一个或多个另外的基因座二者中包含人DPP4基因或其片段(即包含置换内源Dpp4基因座和一个或多个另外的基因座的人DPP4基因或其片段)的非人动物如啮齿动物(例如小鼠或大鼠)。在一些实施例中,人DPP4基因的片段含有200千碱基(kb)或更少的核苷酸,例如180kb、160kb、140kb、120kb、100kb、80kb、70kb、60kb、50kb、40kb、30kb、20kb、10kb、5kb、2.5kb、1kb或更少的核苷酸,例如,1000个、800个、600个、400个、200个或更少的核苷酸。具有人DPP4的细胞和非人动物的产生为了用人DPP4基因或片段靶向置换内源非人Dpp4基因或片段,生成了靶向构建体。参见,例如Valenzuelaetal.NatureBiotech,21.6(2003):652-659(Valenzuela等人,《自然生物技术》,第21卷,第6期,2003年,第652-659页)、US6,586,251和US8,759,105。例如,靶向构建体包含侧接置换用人DPP4基因或其片段的同源臂。在一些实施例中,该置换用人DPP4基因或其片段包含整个人DPP4基因。在其他实施例中,该置换用人DPP4基因或其片段包含人DPP4基因的一部分。例如,该置换用人DPP4基因或其片段包含人DPP4基因的一个或多个外显子,例如人DPP4基因的1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个或26个外显子。例如,该置换用人DPP4基因或其片段包含人DPP4基因的外显子1至26。在其他实施例中,该置换用人DPP4基因或其片段包含人DPP4基因的外显子2至26。例如,该置换用人DPP4基因或其片段包含人DPP4基因的外显子2上游的内含子1至外显子26。在一些实施例中,该置换用人DPP4基因或其片段还包含人调控元件,例如人DPP4基因下游的人3’非翻译区(UTR)的一部分,例如下游区的至少1kb(例如,至少1Kb、2Kb、3Kb、4Kb、5Kb、10Kb、20Kb、30Kb、40Kb或更多),和/或人DPP4基因上游的人启动子或增强子区,例如上游区的至少10kb(例如,至少10Kb、20kb、30kb、40kb、50kb或更多)。同源臂是与侧接所需的遗传修饰/置换,例如侧接待置换的内源Dpp4基因或片段的内源染色体核酸序列同源的序列。同源核酸序列可以是两个或更多个核酸序列,所述核酸序列或相同或足够相似以便它们能够彼此杂交或进行分子间交换。由于同源臂与相应的内源序列之间的同源性,同源臂使得靶向构建体指向基因组内的特定染色体位置,例如内源Dpp4基因座。参见,例如Valenzuelaetal.NatureBiotech,21.6(2003):652-659(Valenzuela等人,《自然生物技术》,第21卷,第6期,2003年,第652-659页)、US6,586,251和US8,759,105。任选地,靶向构建体还包含,例如在两个同源臂之间的选择标记。示例性的选择标记包括抗生素抗性标记(例如,新霉素或卡那霉素)和荧光蛋白。在一些实施例中,选择标记被敲入(floxed),即侧接在两个loxP位点之间。可通过添加Cre重组酶移除敲入的选择标记,所述Cre重组酶催化敲入区段(例如包括选择标记)的切除。载体/构建体可通过使用各种载体和/或构建体产生本发明的转基因非人动物(如啮齿动物,例如小鼠或大鼠)。在一些实施例中,靶向构建体是一段环状双链DNA,例如细菌人工染色体(BAC)、质粒或源自P1的人工染色体(PAC)的形式。为产生内源Dpp4基因座被靶向置换的非人细胞,将含有本文所述的人DPP4基因或片段的靶向构建体引入到非人(如啮齿动物,例如小鼠或大鼠)细胞,例如胚胎干(ES)细胞。为产生包含随机插入到基因组中的人DPP4基因或片段的非人细胞,将包含人DPP4基因或其片段的环状DNA构建体(例如BAC)引入进非人(如啮齿动物,例如小鼠或大鼠)细胞,例如ES细胞中。在一些情况下,环状DNA构建体(例如BAC)还含有人DPP4调控元件,例如人DPP4基因的上游和/或下游的人启动子或增强子区。例如,环状DNA构建体含有人DPP4基因的ATG起始密码子上游的启动子/增强子区的至少10kb(例如,至少10kb、20kb、30kb、40kb、50kb或更多)。此外或作为另外一种选择,环状DNA构建体含有人DPP4基因下游的非翻译区的至少1kb(例如,至少1kb、2kb、3kb、4kb、5kb、10kb、20kb、30kb、40kb或更多)。例如,人DPP4基因或片段有效连接至人DPP4调控元件。在一些实施例中,环状DNA构建体(例如BAC)中的人DPP4基因或其片段包含整个人DPP4基因。在其他实施例中,人DPP4基因或其片段包含人DPP4基因的一部分。例如,人DPP4基因或其片段包含人DPP4基因的一个或多个外显子,例如人DPP4基因的1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个或26个外显子。例如,人DPP4基因或其片段包含人DPP4基因的外显子1至26。在其他实施例中,人DPP4基因或其片段包含人DPP4基因的外显子2至26。例如,人DPP4基因或其片段包含人DPP4基因的外显子2上游的内含子1至外显子26。例如,通过电穿孔或脂质介导的转染完成引入进细胞的步骤。任选地,在引入进细胞中之前,使环状DNA构建体(例如BAC)线性化。例如,用稀切限制酶(例如SgrDI、SfiI、NotI、PacI或Swal)进行线性化。在靶向构建体包含抗生素选择标记(例如新霉素)的情况下,任选在含有新霉素/G418的培养基中选择已吸收靶向构建体的细胞。选择在含有新霉素/G418的培养基中存活和/或增殖的细胞,该细胞对于靶向构建体呈阳性。在一些实施例中,针对已将人DPP4基因或其片段并入到它们的基因组中(例如随机插入到基因组中或(例如,通过靶向构建体)靶向至内源Dpp4基因座)的那些细胞对细胞群进行筛选。用于筛选的方法包括定量PCR和荧光原位杂交。参见,例如US6,586,251B2和US8,759,105B2。例如,筛选的方法包括检测人DPP4基因或片段的存在。在一些实施例中,筛选的方法包括检测内源Dpp4基因或片段拷贝数的丢失和/或人DPP4基因或片段的拷贝数的获得。用于筛选的示例性方法描述于实例1和3中。在其中靶向构建体包含敲入的选择标记的一些实施例中,任选还用Cre-表达载体(例如瞬时表达Cre重组酶)电穿孔被正确靶向的细胞,以移除敲入的选择标记。为产生转基因动物,将含有人DPP4基因或其片段的阳性ES细胞克隆(例如不带有敲入的选择标记)引入到啮齿动物胚胎中,例如小鼠或大鼠胚胎,诸如8-细胞期小鼠胚胎。例如通过囊胚注射技术、聚集技术、核移植和克隆和/或方法完成该引入步骤。参见,例如US8,759,105B2、US7,294,754、US7,576,259和US7,659,442。例如,ES细胞克隆是对ES细胞群体引入DNA并进行后续选择之后,从其单个细胞衍生得到的细胞亚群。在一些情况下,对来自转基因非人动物的DNA以如上所述的相似方式进行筛选以确认人DPP4基因/片段通过种系的遗传性(transmittance)。在一些实施例中,本文所述的人源化DPP4啮齿动物对人DPP4等位基因是杂合的。正因为如此,这些啮齿动物具有一个人DPP4等位基因和一个野生型啮齿动物DPP4等位基因。在其他实施例中,人源化DPP4啮齿动物对人DPP4等位基因是纯合的。人源化DPP4啮齿动物的用途人源化DPP4啮齿动物(例如小鼠或大鼠)可用于评价用于治疗高血糖症的人特异性DPP4拮抗剂(例如小分子抑制剂、肽抑制剂或生物抑制剂)的药效动力学(PD)。可根据本领域已知的标准程序在人源化DPP4啮齿动物(例如小鼠或大鼠)中进行药代动力学(PK)和PD测定。人源化DPP4啮齿动物(例如小鼠或大鼠)可用于评价人特异性DPP4拮抗剂(例如小分子抑制剂、肽抑制剂或生物抑制剂)在治疗高血糖症方面的体内治疗功效。人源化DPP4啮齿动物(例如小鼠或大鼠)可用于测试在MERS-CoV感染的治疗或预防(或防治)中对与人DPP4特异性相互作用的靶分子如MERS-CoV(例如MERS-CoV的刺突蛋白(S),例如MERS-CoV的刺突蛋白的受体结合结构域)具有特异性的拮抗剂(例如小分子抑制剂、肽抑制剂或生物抑制剂,例如中和抗体)的治疗功效。在一些实施例中,对于人DPP4等位基因是杂合的啮齿动物用于测试一种或多种拮抗剂在MERS-CoV感染的治疗或预防(或防治)中的体内治疗功效。在其他实施例中,对于人DPP4等位基因是纯合的DPP4啮齿动物用于测试一种或多种拮抗剂在MERS-CoV感染的治疗或预防(或防治)中的体内治疗功效。示例性MERS-CoV毒株包括MERS-CoVJordan毒株(GenBank登录号KC776174.1,MERS-CoV-Hu/Jordan-N3/2012)和MERS-CoVEMC/2012毒株(GenBank登录号JX869059.2)。在一些实施例中,本文所述的MERS-CoV病毒包含MERS-CoV临床分离株。在其他实施例中,本文所述的MERS-CoV病毒包含与本文所述的临床分离株具有相同刺突蛋白受体结合结构域(RBD)序列的毒株。示例性临床分离株在下表中示出。该表示出了在若干MERS-CoV临床分离株的刺突蛋白的受体结合结构域(RBD)中的氨基酸序列变异。对美国国家生物技术信息中心(NCBI)保藏的MERS-CoV临床分离株序列在第367-606位氨基酸处进行比对,并且与EMC/2012毒株的该序列进行比较。带有A431P、S457G、S460F、A482V、L506F、D509G和V534A置换(其中数字之前的氨基酸(单字母名称)是EMC/2012毒株的氨基酸,并且数字之后的氨基酸(单字母名称)是临床分离株的氨基酸)的临床分离株在表中示出。表I在一些实施例中,在啮齿动物MERS-CoV感染前(例如,至少1小时、2小时、4小时、6小时、12小时、24小时、48小时、2天、3天、4天、5天、6天、7天或更早以前)施用拮抗剂。在其他实施例中,在啮齿动物MERS-CoV感染后(例如至少1小时、2小时、4小时、6小时、12小时、24小时、48小时、2天、3天、4天、5天、6天、7天或更久以后)施用拮抗剂。在一些实施例中,其中在MERS-CoV感染后给啮齿动物施用拮抗剂,施用拮抗剂后啮齿动物中相较于对照水平的较低病毒滴度或RNA水平(例如病毒UpE或前导序列RNA水平),例如降低至少5倍(例如至少5倍、10倍、50倍、100倍、500倍、1000倍、104倍、105倍、106倍、107倍或更多倍),表明拮抗剂可有效用于治疗MERS-CoV感染。例如,对照水平是在施用拮抗剂前啮齿动物中的病毒滴度或RNA水平。在其他例子中,对照水平是未用拮抗剂处理的受病毒感染啮齿动物中的病毒滴度或RNA水平。在一些实施例中,其中在MERS-CoV感染之前给啮齿动物施用拮抗剂,施用拮抗剂后啮齿动物中相较于对照水平的较低病毒滴度或RNA水平(例如病毒UpE或前导序列RNA水平),例如降低至少5倍(例如至少5倍、10倍、50倍、100倍、500倍、1000倍、104倍、105倍、106倍、107倍或更多倍),表明拮抗剂可有效用于预防MERS-CoV感染。例如,对照水平是未用拮抗剂处理的受MERS-CoV感染啮齿动物中的病毒滴度或RNA水平。在一些实施例中,可通过在含有苯酚的溶液,例如含有苯酚和异硫氰酸胍的溶液(例如(生命技术公司(LifeTechnologies,Inc)))中均质化,通过从啮齿动物肺中提取RNA来确定啮齿动物肺中的病毒RNA水平。例如,可按照制造商使用说明使用Magnalyzer(罗氏公司(Roche))将肺均质化。在一些实施例中,可使用定量PCR(qPCR)评估MERS-CoVRNA的水平,所述qPCR使用靶向MERS-CoV基因组的引物和/或靶向MERS-CoVmRNA转录物的引物。例如,快速病毒一步母液混合液(Fastvirusone-stepmastermix)(美国应用生物系统公司(AppliedBiosystems))可按照制造商使用说明通过使用获自生命技术公司的引物的双链体而用于qPCR中,所述引物双链体靶向包膜基因上游基因组区(UpE)或核壳信使RNA的前导序列(前导引物),并与内源对照诸如啮齿动物(例如大鼠)18SrRNA相比较。例如,可在7500DX快速实时定量PCR仪(7500fastDXreal-timePCRinstrument)(美国应用生物系统公司(AppliedBiosystems))上读取快速光学反应板(fastopticalreactionplate)(美国应用生物系统公司)中的qPCR反应。在一些例子中,可使用ΔCt方法分析qPCR数据,其中未感染对照设定为1。例如,在拮抗剂是抗MERS-CoV的抗体的情况下,可相对于用对照拮抗剂(例如同种型匹配的对照抗体)处理的受感染小鼠中的RNA检测水平表示检测到的MERS-CoVRNA百分比。在一些实施例中,啮齿动物肺中的病毒滴度可通过这样来测定:将啮齿动物肺在缓冲液(例如磷酸盐缓冲盐水(PBS))中均质化,离心(例如以10,000rpm)。可通过在哺乳动物细胞诸如Vero细胞(例如VeroE6细胞)上进行噬菌斑测定来分析上清液,从而定量在用拮抗剂处理后残留的病毒水平。可使用标准的噬菌斑测定法,例如在Pageetal.(2012)Inductionofalternativelyactivatedmacrophagesenhancespathogenesisduringsevereacuterespiratorysyndromecoronavirusinfection,JVirol86:13334–13349(Page等人,2012年,“严重急性呼吸综合征冠状病毒感染过程中诱导替代性活化巨噬细胞可增强发病”,《病毒学杂志》,第86卷,第13334–13349页)中描述的噬菌斑测定。在一些例子中,可通过静置板3天等待噬菌斑出现的方式改进Page等人所述的噬菌斑测定法。在一些实施例中,与对照肺样本相比,在MERS-CoV感染之前或之后用拮抗剂处理的啮齿动物的肺样品中有较少炎症(例如间质炎症或血管周围炎症)、较少炎性细胞和/或较少细支气管呈袖套征(例如通过组织学分析确定的),可表明拮抗剂对治疗或预防MERS-CoV感染有效。例如,对照肺样品可来自未经拮抗剂处理的(例如感染之前和/或之后未处理的)受MERS-CoV感染的啮齿动物。本文所述的啮齿动物可用于有效测试针对MERS-CoV的药物和疫苗,例如用以在人体临床试验前证明安全性和功效。它们使得能例如在测试的数周内快速鉴定和/或验证治疗剂/预防剂。定义同源氨基酸残基是共有相似特征或特性的残基。氨基酸残基的特征或特性基于例如多肽主链的结构(例如,片层或螺旋构型)、残基的电荷或疏水性和/或侧链的体积。例如,同源残基在侧链特性(例如,极性、电荷、大小、芳香性和/或疏水性)方面相似。术语“约”指设定值加上或减去另一量;从而确立值的范围。在某些实施例中,“约”指相对于基准(或核心或参照)值或量加上或减去最多15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%,0.75%、0.5%、0.25%或0.1%的范围。例如,约指所引用数字,例如核苷酸碱基的数量之下和之上+/-5%的范围。如本文所用,术语“有效连接”指所述的组分(例如核苷酸序列)的位置处于允许其以其预期方式发挥作用的关系。如本文所用,术语“蛋白质”包括多肽、肽、多肽的片段和融合多肽。如本文所用,“核酸”指两个或多个脱氧核糖核苷酸和/或核糖核苷酸以单链或双链的形式共价连接在一起。关于基因置换的术语“置换”指将外源遗传物质置于内源基因座处,从而用直系同源或同源核酸序列置换内源基因的全部或一部分。在一个实例中,用相应的人基因或其片段置换内源非人基因或其片段。相应的人基因或其片段是作为被置换的内源非人基因或其片段的直系同源物或同系物,或在结构和/或功能上与被置换的内源非人基因或其片段基本上同一或相同的人基因或片段。如本文所用,术语“啮齿动物”指啮齿目的任何成员。啮齿动物的例子包括但不限于,小鼠、大鼠、松鼠、草原犬鼠、豪猪、海狸、豚鼠和仓鼠。在一个实施例中,啮齿动物是大鼠。在另一个实施例中,啮齿动物是小鼠。除非本文另有定义,否则本文使用的所有技术和科学术语的含义与本发明所属领域的普通技术人员通常所理解的含义相同。如本文所用,单数术语“一个”、“一种”和“该”包括复数指代,除非上下文另有明确说明。预期在本说明书中通篇给出的每个上限值包括每个下限值,如同这种下限值在本文明确地写出一样。在本说明书中通篇给出的每个下限值将包括每个上限值,如同这种上限值在本文明确地写出一样。在本说明书中通篇给出的每个数值范围将包括属于该较宽的数值范围内的每个较窄的数值范围,如同这种较窄的数值范围在本文明确地写出一样。以下实例仅出于说明的目的提供,而不旨在以任何方式限制本发明。实例实例1用人DPP4基因置换内源小鼠Dpp4基因用81.8kb人DPP4基因(含有人DPP4基因的外显子2至外显子26以及3’非翻译区的一部分)置换78.8kb小鼠DPP4基因座,该小鼠基因座跨越外显子2至外显子26中的终止密码子。参见图1A和1B。使用基因工程技术构建在单个靶向步骤中用人DPP4基因置换小鼠基因的靶向构建体(参见Valenzuelaetal.(2003)High-throughputengineeringofthemousegenomecoupledwithhigh-resolutionexpressionanalysis,NatureBiotech,21(6):652-659(Valenzuela等人,2003年,“结合高分辨率表达分析对小鼠基因组进行高通量工程改造”,《自然生物技术》,第21卷,第6期,第652-659页))。小鼠和人DPP4DNA分别获自细菌人工染色体(BAC)克隆RP23-362N15和RP11-68L22。简而言之,将通过缺口修复克隆和floxedneo选择盒产生的SgrDI线性化靶向构建体电转化到VGB6小鼠胚胎干(ES)细胞(来源于C57BL/6N小鼠)中,其中该缺口修复克隆含有与82kb人DPP4序列侧接的小鼠Dpp4上游同源臂和下游同源臂,该82kb人DPP4序列从外显子2上游的内含子1延伸至外显子26,包括终止密码子和3’非翻译区的一部分(整个人DPP4基因的基因组坐标:GRCh38:chr2:162,848,755-162,931,052(-链))。用瞬时Cre表达载体进一步电转化正确靶向的ES细胞(MAID7326),以去除药物选择盒。利用法将不含药物盒的被靶向ES细胞(MAID7327)克隆引入8细胞期SW小鼠胚胎中(参见美国专利No.7,294,754、No.7,576,259、No.7,659,442以及Poueymirouetal.(2007)F0generationmicethatareessentiallyfullyderivedfromthedonorgene-targetedEScellsallowingimmediatephenotypicanalysesNatureBiotech.25(1):91-99(Poueymirou等人,2007年,“基本上完全衍生自基因靶向的供体ES细胞的F0代小鼠可用于直接的表型分析”,《自然生物技术》,第25卷,第1期,第91-99页))。利用等位基因修饰测定法对小鼠等位基因的丢失和人等位基因的获得进行基因型分析,从而鉴定携带人源化DPP4基因的(完全衍生自供体ES细胞的F0代小鼠)(参见Valenzuela等人,2003年)。利用天然等位基因损失(loss-of-native-allele,LONA)测定法来鉴定正确靶向的ES细胞克隆(Valenzuela等人2003年),其中通过两个TaqManTM定量聚合酶链反应(qPCR)来确定未经修饰的天然Dpp4基因的拷贝数,该聚合酶链反应对作为缺失靶标的小鼠Dpp4基因是特异性的。qPCR测定法包括以下引物-探针组(书写顺序为5’至3’):上游正向引物TCGCCACTGTGCCTAACATAG(SEQIDNO:1);上游反向引物CCGGGACTAAACTGGAACATTC(SEQIDNO:2);上游探针FAM-TCAGTCAACTTCTTCTGGGTTGTTTCC-BHQ(SEQIDNO:3);下游正向引物CAGCTCTGGTGGAGAACTAGAC(SEQIDNO:4):下游反向引物GGAGGTCCTCGGTCTTTAGAAG(SEQIDNO:5);下游探针FAM-TCACACTTAGGCTTATAAACCATTCCCGT-BHQ(SEQIDNO:6);其中FAM是指5-羧基荧光素荧光探针,BHQ是指黑洞猝灭剂型的荧光猝灭剂(生物搜索技术公司(BiosearchTechnologies))。从已吸收靶向载体且并入ES细胞克隆基因组的ES细胞克隆中纯化DNA,按照制造商建议将该纯化的DNA在384孔PCR板(美国生命技术公司的MicroAmpTM384孔光学反应板(MicroAmpTMOptical384-WellReactionPlate))中与TaqManTM基因表达母混合液(TaqManTMGeneExpressionMasterMix,美国生命技术公司)混合,然后使所得溶液在AppliedBiosystemsPrism7900HT中循环,AppliedBiosystemsPrism7900HT在PCR过程中收集荧光数据,并确定阈值循环(Ct)以及累积荧光达到预设阈值的PCR循环分数。每个DNA样品都运行以下反应:上游DPP4-特异性qPCR和下游DPP4-特异性qPCR,以及非靶向参照基因的两个qPCR。计算每个DPP4-特异性qPCR和每个参照基因qPCR之间的Ct值差值(ΔCt),然后计算所有测定样品的每个ΔCt与中值ΔCt之间的差值,从而得到每个样品的ΔΔCt值。每个样品中的DPP4基因拷贝数通过以下公式计算:拷贝数=2×2-ΔΔCt。丢失一个天然拷贝的正确靶向克隆的Dpp4基因拷贝数等于1。通过TaqManTMqPCR测定法确认了人DPP4基因序列在人源化等位基因中置换了缺失的小鼠Dpp4基因序列,其中TaqManTMqPCR测定法包括以下引物-探针组(书写序为5’至3’):人上游正向引物GCGGTCTCCCTCTTCTAACG(SEQIDNO:7);人上游反向引物GCAAGCCGAGCAGATCAAG(SEQIDNO:8);人上游探针FAM-ACTCCCACCTGCAAATCCTGCTGC-BHQ(SEQIDNO:9);人下游正向引物AACCGCACTGGCATATGGA(SEQIDNO:10);人下游反向引物TACAAGGTAGTCTGGGATTACTAACAAAA(SEQIDNO:11);人下游探针FAM-ACATTTATCTAGAAAGGCTC-BHQ(SEQIDNO:12)。将相同的LONA测定法用于测定从源于被靶向ES细胞的小鼠的尾部活检组织中纯化DNA,以确定小鼠的DPP4基因型并确认人源化DPP4等位基因已通过种系传递。将对于所述置换是杂合的两只小鼠进行繁育而产生对于用人DPP4基因置换内源小鼠Dpp4基因是纯合的小鼠。将对于所述置换是纯合的小鼠用于表型分析。小鼠Dpp4基因座与含有人DPP4基因的序列的上游结合点被设计在5’-AGGAGAGAAGCCAACAAGATCATAAGATCATGCTCAGGGCCAAAATTCAAGGGCTTCTGC(CGTCGACG)(SEQIDNO:13)内,其中人DPP4序列为斜体,SgrDI限制性酶切位点带括号。含有人DPP4基因的序列与floxedneo选择盒的下游结合点被设计在5’-ctcgag(ataacttcgtataatgtatgctatacgaagttat)atgcatggcctccgcgccgggttttggcgcctcccgcggg(SEQIDNO:14)内,其中人DPP4序列为斜体,neo盒序列为小写,loxP位点带括号。floxedneo选择盒的序列与小鼠Dpp4基因座的下游结合点被设计在5’-atgtctgga(ataacttcgtataatgtatgctatacgaagttat)gctagtaactataacggtcctaaggtagcgagctagcCAGCATAGCTCTCCATAGCTTATTTAAGACCACATTTGTTCTCATTATCTCAAAAGTGCACTGTTAAGATGAAGATCTTA(SEQIDNO:15)内,其中neo盒序列为小写,loxP位点带括号。移除neo选择盒之后,含有人DPP4基因的序列、移除neo选择盒之后剩下的loxP位点以及小鼠Dpp4基因座的结合点被设计在5’-ctcgag(ataacttcgtataatgtatgctatacgaagttat)gctagtaactataacggtcctaaggtagcgagctagcCAGCATAGCTCTCCATAGCTTATTTAAGACCACATTTGTTCTCATTATCTCAAAAGTGCACTGTTAAGATGAAGATCTTAATAATGTTGCATTGAGACATTTCAGGCTGCTTTCTCCAGTTTTACACCTGCAATCCTAACTAAGGATGCCTGTCCCCAGAAC(SEQIDNO:16)内,其中人DPP4序列为斜体,neo盒序列为小写,loxP位点带括号。图2示出了MAID7326/7327中由人源化DPP4核酸序列编码的DPP4的氨基酸序列(SEQIDNO:17)与人DPP4相同,因为小鼠Dpp4密码子1仅仅编码DPP4的前两个氨基酸Met和Lys,这两个氨基酸与由人DPP4密码子1编码的氨基酸相同。实例2用MERS-CoV感染人源化DPP4小鼠中东呼吸综合征冠状病毒(MERS-CoV)是引发严重急性呼吸疾病的新型病毒。MERS-CoV的受体是二肽基肽酶IV(DPP4)(参见Rajetal.(2013)DipeptidylPeptidase4isaFunctionalReceptorfortheEmergingHumanCoronavirus-EMC,Natuere495(7440):251-254(Raj等人,2013年,“二肽基肽酶4是新兴人类冠状病毒EMC的受体”,《自然》,第495卷,第7440期,第251-254页))。体内测试抗病毒分子需要易受MERS-CoV感染的动物模型,例如小动物模型,诸如啮齿动物(如小鼠或大鼠)。然而,最近的研究表明,小鼠Dpp4不支持MERS-CoV感染(参见例如Cockrelletal.(2014)MouseDipeptidylPeptidaseisNotaFunctionalReceptorforMiddleEastRespiratorySyndromeCoronavirus(MERS-CoV)Infection,J.Virol.88(9):5195-5199(Cockrell等人,2014年,“小鼠二肽基肽酶不是中东呼吸综合征冠状病毒(MERS-CoV)感染的功能性受体”,《病毒学杂志》,第88卷,第9期,第5195-5199页);Colemanetal.(2014)Wild-TypeandInnateImmune-DeficientMiceareNotSusceptibletotheMiddleEastRespiratorySyndromeCoronavirus,J.Gen.Virol.95(2):408-412)(Coleman等人,“野生型和先天免疫缺陷小鼠不易受中东呼吸综合征冠状病毒感染”,《普通病毒学杂志》,第95卷,第2期,第408-412页)),至少部分原因是MERS-CoV刺突蛋白与人DPP4而非小鼠DPP4相互作用(参见例如Coleman等人,2013年和Raj等人,2013年)。将小鼠DPP4序列和人DPP4序列进行序列比较,发现先前已被鉴定为MERS-CoV刺突(S)蛋白与其受体之间的接触位点的氨基酸在两个物种之间存在差异。此外,在小鼠细胞中表达人DPP4允许MERS-CoV病毒进入和增殖,从而意味着病毒进入是感染小鼠细胞的限制步骤,并且小鼠DPP4与MERS-CoV糖蛋白之间相互作用的缺乏限定了体外物种向性。参见例如Luetal.(2013)MolecularbasisofbindingbetweennovelhumancoronavirusMERS-CoVanditsreceptorCD26,Nature.500(7461):227-31(Lu等人,2013年,“新型人类冠状病毒MERS-CoV及其受体CD26之间结合的分子基础”,《自然》,第500卷,第7461期,第227-231页);Cockrelletal.(2014)MouseDipeptidylPeptidaseisNotaFunctionalReceptorforMiddleEastRespiratorySyndromeCoronavirus(MERS-CoV)Infection,J.Virol.88(9):5195-5199(Cockrell等人,2014年,“小鼠二肽基肽酶不是中东呼吸综合征冠状病毒(MERS-CoV)感染的功能性受体”,第88卷,第9期,第5195-5199页)。因此,正常小鼠品系不能用于测量靶向MERS-CoV的治疗剂的功效。Zhaoetal.(2014)RapidGenerationofaMouseModelforMiddleEastRespiratorySyndrome,Proc.Natl.Acad.Sci.USA111(13):4970-4975(Zhao等人,2014年,“用于中东呼吸综合征的模型的快速产生”,第111卷,第13期,第4970-4975页)已通过腺病毒转导在小鼠中表达了人DPP4,从而可感染MERS-CoV。然而,这种腺病毒模型存在若干局限性,包括:(a)该病毒被快速从感染的小鼠中清除;(b)随时间推移人DPP4表达丢失;(c)病毒转导的DPP4的组织分布不能反映在小鼠或人中所观察到的表达;(d)腺病毒感染可诱导干扰素响应。为了产生用于MERS-CoV感染的小鼠模型,按照上述实例1的方法产生人源化DPP4小鼠。如图1B所示,用人DPP4的对应序列置换小鼠Dpp4的外显子2至外显子26。由于剩下的小鼠Dpp4编码外显子1仅仅编码与对应人DPP4外显子1中的氨基酸相同的Dpp4的前两个氨基酸Met和Lys,因此在人源化DPP4小鼠中表达的DPP4蛋白完全是人DPP4蛋白(参见图2,SEQIDNO:17)。因此,人源化DPP4小鼠在内源小鼠调控序列(即,5’侧翼区(启动子和增强子)和3’非翻译区序列)的控制下表达完整的人DPP4。可以预计,与小鼠Dpp4在缺乏人DPP4核酸序列的野生型小鼠中的表达一样,人源化DPP4在相同细胞和组织中以相同或相似水平表达。通过鼻内方式感染两组F0代人源化DPP4小鼠:一组用MERS-CoV(Jordan毒株)处理,一组用PBS模拟处理。感染后4天,使用复制型MERS-CoV基因组的特异引物,通过实时PCR对肺中的MERS-CoVRNA进行定量。将数据归一化至从模拟感染的小鼠的肺获得的PCR产物的量(任意地设为1)。图3显示,可从MERS-CoV感染的人源化DPP4小鼠的肺中扩增MERS-CoVRNA。还对来自模拟感染和MERS-CoV感染的小鼠的肺组织进行H&E染色。图4显示,人源化DPP4小鼠的MERS-CoV感染不影响气道,但是导致肺泡壁增厚并且肺泡细胞间的间隙缩小,这表明肺中产生了与MERS-CoV感染相关的炎症。此外,通过鼻内方式用MERS-CoV(例如,2×105pfu的MERS-CoV(Jordan))接种6至8周龄的小鼠。一直到接种后4天未观察到疾病死亡或疾病临床征象。接种后第2天和第4天,对小鼠实施安乐死,并对小鼠的肺进行解剖。为了获得病毒RNA水平,将肺在中均质化,提取RNA,并使用MERS-CoV特异引物,通过实时PCRMERS-CoV分析(图10A和10B)。一组引物对包膜基因上游病毒基因组区(UpE)是特异的,另一组引物对核壳mRNA的前导序列是特异的(前导引物)。用小鼠18SrRNA作为内源对照。为了获得病毒滴度,将肺在磷酸盐缓冲液(PBS)中均质化,通过离心使其澄清,然后在VeroE6细胞上滴定(图10C)。例如,通过噬菌斑测定法在VeroE6细胞上分析上清液,以定量肺中存在的病毒水平。例如,按照Pageetal.(2012)Inductionofalternativelyactivatedmacrophagesenhancespathogenesisduringsevereacuterespiratorysyndromecoronavirusinfection,JVirol86:13334–13349(Page等人,2012年,“严重急性呼吸综合征冠状病毒感染过程中诱导替代性活化巨噬细胞可增强发病”,《病毒学杂志》,第86卷,第13334-13349页)中所述进行噬菌斑测定法,其中将板静置3天以待噬菌斑出现。在感染后第2天和第4天,肺中明显出现稳健的MERS-CoV复制。使用MERS-CoV前导序列特异性引物组(被设计成仅扩增复制MERS-CoV)进行RNA定量,结果表明在感染后第2天收集的肺中具有高水平的MERS-CoV复制RNA,并且该水平维持到感染后第4天(图10A至图10B)。在VeroE6细胞上进行的肺匀浆物噬菌斑测定法将MERS-CoV(Jordan)水平定量为感染后第2天为约7.27×104pfu/mL肺,感染后第4天为约3.75×105pfu/mL肺(图10C),这说明感染的人源化DPP4小鼠的肺中存在活跃的MERS-CoV复制。此外,针对病理变化,对通过鼻内方式接种MERS-CoV(Jordan毒株)或PBS(模拟感染)的人源化DPP4小鼠的肺进行了分析(图10D)。在感染后第2天,发现整个肺中细支气管细胞结构产生变化,细支气管周围炎症明显。此时,观察到极少的血管周围炎症或对肺泡结构的影响。在感染后第4天,观察到间质浸润现象,伴随血管周围呈袖套征并且大量肺泡增厚。此外,细支气管也发生变化。参见图10D。这种病理现象与MERS-CoV感染的人中所见的间质性肺炎和明显肺部疾病的放射影像一致。以上数据表明,人源化DPP4小鼠(诸如本文所述的那些小鼠)易受MERS-CoV感染。这些数据还证明,本文所述的人源化DPP4小鼠是MERS-CoV感染的体内模型,其可重演在人的MERS-CoV感染中可观察到的病理现象(例如,病理后遗症)。因此,人源化DPP4小鼠是可用于评估体内MERS-CoV治疗的MERS-CoV可靠模型。例如,人源化DPP4小鼠是用于测量靶向MERS-CoV的治疗性分子的药代动力学、药效动力学和治疗功效的合适宿主动物。图5示出了小鼠Dpp4(SEQIDNO:25)与人DPP4(由7326/7327转基因小鼠编码)(SEQIDNO:26)的蛋白序列比对结果。接下来,在人源化DPP4小鼠中进行了体重随用MERS-CoV感染后的时间变化的剂量响应研究。如上所述用MERS-CoV(Jordan毒株)或PBS(模拟感染)感染小鼠,并在7天周期内分析体重减轻情况,体重减轻是有效感染的征象。如图14所示,人源化DPP4小鼠表现出有效感染(即显现疾病病理现象),感染后第4天开始出现体重减轻。每组使用4至5只小鼠。图15显示,人源化DPP4等位基因杂合的小鼠同样易受MERS-CoV感染,因为与纯合体比较时这些小鼠表现出相似程度的体重减轻。这一结果非常重要,其表明可使用杂合小鼠进行研究。另外,使用杂合小鼠可避免与功能性小鼠Dpp4敲除有关的任何潜在问题,这些问题可能潜在地存在于纯合人源化DPP4小鼠中。还根据上述方法针对炎症对这些小鼠的肺进行组织学检查。如图16所示,暴露于高剂量病毒(每只小鼠1×106pfu)的hDPP4小鼠表现出比PBS对照更强的病理现象。实例3通过随机插入BAC产生含有人DPP4基因的转基因小鼠产生含有人DPP4基因的转基因小鼠,该基因序列和基因组信息在图6中示出。使用含有人DPP4基因的两个不同重叠BAC:BACRP11-68L22和BACRP11-345J9(图7)。这两个BAC都含有人DPP4基因的编码区,以及DPP4基因的ATG起始密码子上游超过40kb的启动子区和DPP4基因的终止密码子下游的几千碱基(图7)。为了产生BAC转基因小鼠,将每个BACDNA电转化到VGB6小鼠胚胎干(ES)细胞(来源于C57BL/6N小鼠)中。通过法用SW小鼠胚胎将含有人DPP4基因的编码区以及该基因的启动子区的ES细胞引入8细胞期SW小鼠胚胎中(参见例如美国专利No.7,294,754、No.7,576,259、No.7,659,442以及Poueymirouetal.(2007)F0generationmicethatareessentiallyfullyderivedfromthedonorgene-targetedEScellsallowingimmediatephenotypicanalysesNatureBiotech.25(1):91-99(Poueymirou等人,2007年,“基本上完全衍生自基因靶向的供体ES细胞的F0代小鼠可用于直接的表型分析”,《自然生物技术》,第25卷,第1期,第91-99页))。将人等位基因获得测定法用于筛选含有人DPP4基因以及该基因启动子区的拷贝的ES细胞克隆。还将人等位基因获得测定法用于鉴定携带人源化DPP4基因以及该基因启动子区的(完全衍生自供体ES细胞的F0代小鼠)。简而言之,利用标准方法从ES细胞克隆中提取基因组DNA,并使用两组引物-探针在TaqManTM定量PCR(qPCR)测定法中测试所提取的基因组DNA,以检测人DPP4编码序列上游的人DNA序列(7333hTU)和下游的人DNA序列(7333hTD)(图8)。每组引物-探针在人DPP4基因和侧翼区(例如启动子区域)内的退火位置在图7中示出。TaqManTMqPCR测定法中高于背景的荧光读数指示存在人DPP4基因和人DPP4基因的至少40kb的5’侧翼区,它们已整合到转基因小鼠基因组中。7333hTU引物-探针组(书写顺序为5’至3’)为:人上游正向引物TGGCTTATTCTCTATTCCTCACCTA(SEQIDNO:18);人上游探针FAM-TGCTTTCCCTCCTCCCTTCTGA-BHQ(SEQIDNO:19);人上游反向引物GGCCTTAGCCCAGAAACTG(SEQIDNO:20)。7333hTD引物-探针组(书写顺序为5’至3’)为:人下游正向引物TGCAGACTTGTCTTGACATTCATA(SEQIDNO:21);人下游探针CAL-AGCCTCTGCAGACACAGGAATGGC-BHQ(SEQIDNO:22);人下游反向引物TCTGGGCACTGGTGTACTC(SEQIDNO:23);其中FAM和CAL分别是指5-羧基荧光素荧光探针和CAL橙色荧光探针,BHQ是指黑洞猝灭剂型的荧光猝灭剂(生物搜索技术公司)。例如,按照制造商建议将来源于ES细胞克隆的基因组DNA在384孔PCR板(美国生命技术公司的MicroAmpTM384孔光学反应板)中与TaqManTM基因表达母混合液(TaqManTMGeneExpressionMasterMix,美国生命技术公司的)合并,然后使所得溶液在AppliedBiosystemsPrism7900HT中循环,AppliedBiosystemsPrism7900HT在PCR过程中收集荧光数据,并确定阈值循环(Ct)以及累积荧光达到预设阈值的PCR循环分数。每个DNA样品都运行以下反应:上游DPP4-特异性qPCR和下游DPP4-特异性qPCR,以及非DPP4参照基因的两个qPCR。计算每个DPP4-特异性qPCR和每个参照基因qPCR之间的Ct值差值(ΔCt),然后计算所有测定样品的每个ΔCt与中值ΔCt之间的差值,从而得到每个样品的ΔΔCt值。每个样品中的DPP4基因拷贝数通过以下公式计算:拷贝数=2×2-ΔΔCt。含有至少一拷贝的整合到染色体中的人DPP4和启动子区的克隆具有等于或大于一个的DPP4基因拷贝数。将相同的人等位基因获得测定法用于测定从来源于ES细胞的小鼠尾部活检组织中纯化的DNA,以确定人源化DPP4等位基因以及人5’侧翼区已通过种系传递。使用本文所述的BAC插入和筛选方法,含有编码人DPP4的DNA的两只转基因小鼠得以确认。将BACRP11-68L22用于产生ES细胞克隆和被称为MAID7333的转基因小鼠,将BACRP11-345J9用于产生ES细胞克隆和被称为MAID7334的转基因小鼠。MAID7333和MAID7334小鼠中由人源化DPP4核酸序列编码的蛋白质具有图9所示的氨基酸序列(SEQIDNO:24),该氨基酸序列与人DPP4(由转录物NM_001935.3编码)相同。实例4处理MERS-CoV病毒感染的人源化DPP4小鼠测试含有人源化DPP4基因和侧翼启动子区的转基因小鼠的被MERS-CoV感染的能力以及用作评估治疗性分子用于治疗或预防MERS-CoV的模型的能力。通过腹膜内注射(ip)用200μg针对MERS-CoV刺突蛋白的抗体或同种型对照处理转基因MAID7333小鼠(例如,通过实例3中所述的方法产生)。注射抗体后一天,通过鼻内方式用MERS-CoV感染小鼠。感染后第四天,收集小鼠的肺,利用实时PCR(RT-PCR)测量病毒RNA水平。具体地讲,测量MERS-CoV的基因组RNA(UpE)或复制RNA(前导序列)(特异于复制型MERS-CoV基因组)的水平。RT-PCR数据在下表中示出。抗体UpE1前导序列1抗MERS-CoV刺突蛋白1(Ab1)0.3568395620.273565089抗MERS-CoV刺突蛋白2(Ab2)0.2544932020.206006238抗MERS-CoV刺突蛋白3(Ab3)1.9895483161.112094283(IgG1)同种型对照104.0889287101.2578723(IgG4)同种型对照1001001平均值(同种型对照的百分比)用抗体处理转基因小鼠使病毒RNA水平(UpE和前导序列两者)降低了约50倍至约500倍。本文所述的数据表明,通过靶向整合法(实例1)和随机BAC插入法(实例3)产生的含有人DPP4的转基因小鼠易受MERS-CoV感染。此外,抗MERS-CoV抗体阻断了转基因小鼠的体内感染。因此,含有人DPP4的转基因小鼠(例如,通过本文所述的方法产生的小鼠)可用于评价靶向MERS-CoV病毒的治疗剂(例如抗体)的功效。实例5抗MERS-CoV抗体对人源化DPP4小鼠中的MERS-CoV感染的预防效果使用本文所述的人源化DPP4小鼠评价两种单克隆抗体的体内预防能力。先通过腹膜内注射为小鼠注射一系列剂量的抗MERS-CoV抗体:200μg、20μg或2μg抗MERS-CoV刺突蛋白抗体2(Ab2)、抗MERS-CoV刺突蛋白抗体4(Ab4)或200μg人IgG1(hIgG1)同种型对照抗体,24小时后,通过鼻内方式用1×105pfuMERS-CoV(Jordan毒株)感染小鼠。Ab2和Ab4是完全人抗MERS-CoV刺突蛋白抗体。如上所述,从小鼠肺中提取RNA,并利用定量PCR进行分析。例如,利用ΔCt法对qPCR数据进行分析,其中将未感染对照设为1。相对于在用同种型匹配对照抗体处理的受感染小鼠中检测到的RNA水平来表示检测到的MERS-CoVRNA百分比(图11A至图11B)。此外,如上所述确定小鼠肺的病毒滴度。与同种型匹配对照抗体相比,两种抗体都以每只小鼠200μg的剂量使肺中的MERS-CoV特异性RNA水平显著下降超过2log(图11A至图11B)。与相同剂量的Ab4相比,20μg剂量的Ab2对降低MERS-CoVRNA水平更加有效。与同种型对照处理的小鼠相比,2μg剂量的任一种抗体对降低病毒RNA水平没有效果。当分析肺的MERS-CoV滴度时(图11C),200μg和20μg剂量的Ab2使病毒水平降低到接近测定法中的检测水平(2×103pfu/ml)。200μg剂量的Ab4与Ab2的效果相当,但20μg和2μg剂量的Ab4表现出病毒抑制的剂量依赖性抑制作用。这些数据表明,抗MERS-CoV抗体(例如,Ab2和Ab4)可有效阻断体内MERS-CoV感染。在感染后第4天,还对来源于在感染前24小时用Ab2、Ab4或hIgG1同种型对照抗体处理的小鼠的肺进行组织学分析(图12A)。例如,对间质炎症、细支气管周围炎症和血管周围炎症程度进行评分(0至5)。还分析了其他组织学特征,诸如细支气管上皮和肺泡损伤、胸膜变化和支气管血管周围炎症程度。对于每个实验组将每只小鼠的总体炎症进行平均,分值表示为每组和每个时间点的所有小鼠的平均分值(图12B)。来源于用hIgG1同种型对照预处理的小鼠的肺部表现出显著的肺部病理现象,间质炎症加重、血管周围呈袖套征并且肺泡隔增厚。用200μgAb2或Ab4处理的小鼠的炎症减轻,间质中炎性细胞病灶极少、细支气管袖套征较轻并且肺泡壁增厚较少。在用20μgAb2和Ab4预处理的小鼠中,相较于较高剂量抗体组,血管周围袖套征和间质炎症水平中等。用2μg抗体预处理的组与hIgG1同种型对照具有相似的病理现象,表现出显著的间质炎症和明显的血管周围炎症。盲法组织学评分表明,经处理的小鼠的炎症分值降低(图12B)。这些发现表明,在MERS-CoV感染、确证小鼠中的病毒RNA水平和病毒滴度之后,抗MERS-CoV抗体(诸如,Ab2和Ab4)可导致肺部病理现象的剂量依赖性减轻。因此,抗MERS-CoV抗体(诸如,Ab2和Ab4)在MERS-CoV感染的体内模型中是有效的,当在感染前(例如感染前1天)注射这些抗体时,这些抗体可阻断体内MERS-CoV感染和疾病。实例6用抗体处理已感染MERS-CoV的人源化DPP4小鼠为了确定抗MERS-CoV抗体(例如,Ab2和Ab4)的治疗效果(例如,感染后抑制MERS-CoV复制和肺部病理现象的能力),用MERS-CoV感染人源化DPP4小鼠。感染后24小时,通过腹膜内注射为小鼠注射500μghIgG1同种型对照或者500μg或200μgAb2。感染后第4天,对小鼠实施安乐死,并分析小鼠肺部的病毒RNA、病毒滴度和肺部病理现象。与用对照抗体处理的小鼠相比,500μg和200μg剂量的Ab2都使小鼠肺部中的病毒RNA水平降低约10倍(图13A至图13B)。相同小鼠的肺部滴度证实,肺中的病毒水平显著降低,其中感染后第4天病毒水平下降大于2log(图13C)。这些数据表明,感染后(例如,感染后24小时),抗MERS-CoV抗体(例如,Ab2)显著抑制了病毒复制。还对感染后24小时用hIgG1对照抗体、500μgAb2或200μgAb2处理的小鼠进行了组织学分析(图14A至图14B)。用对照抗体处理的小鼠表现出与实例2和实例5中的对照相似的病理现象,间质炎症显著、血管周围呈袖套征以及肺泡隔增厚。用200μg或500μgAb2处理的小鼠的整个肺中间质炎症减轻,仅具有血管周围炎症病灶。盲法组织学评分表明,经处理的小鼠的炎症分值降低(图14B)。以上数据表明,即使在感染后(例如,感染后24小时)才给予抗体,抗MERS-CoV抗体(例如,Ab2)的治疗剂量也能减轻MERS-CoV诱发的肺部病理现象。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1