治疗肝细胞癌的药物及胰高血糖素样肽‑1受体激动剂和/或二肽基肽酶4抑制剂的应用的制作方法
本发明涉及一种肝细胞癌的药物及胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂的应用。
背景技术:
肝细胞癌(hcc)是第五大最常见的癌症和全球癌症死亡的第三大原因。流行病学研究表明,ii型糖尿病(t2d)与hcc的风险高3倍相关。重要的是,多种t2d相关的病理状况,如高血糖,已被确定为hcc的重要诱导和预后因素。在发达国家,近10%的成年人患有糖尿病,且患病率每年都在增加。此外,69.5%的t2d患者具有非酒精性脂肪肝病(nafld),其使患者易于形成hcc。nafld具有从脂肪变性,脂肪性肝炎(nash),纤维化到肝硬化的广泛的病理学谱。临床研究报道约27%的nash相关性肝硬化进一步发展为hcc。随着nafld和糖尿病发病率在世界各地的稳定增加,预计大量的人口将发生hcc的风险更高。
胰高血糖素样肽-1(glp-1)是可通过二肽基肽酶-4(dpp-4)降解的肠降血糖素激素,可以改善t2d患者的系统性血糖控制。长效glp-1r激动剂艾塞那肽(ex-4)和dpp-4抑制剂已经用于通过激活glp-1r信号传导维持血糖稳态。胰高血糖素样肽-1受体(glp-1r)受多种t2d相关病理状况调节,并且在许多组织如胰腺,结肠,乳腺,肝和肺中广泛表达。以前的研究表明nash患者具有低肝脏水平的glp-1r,表明受损的glp-1r信号传导。glp-1r的活化显示降低肝脂质含量,降低丙氨酸转氨酶(alt)水平,减少氧化应激,从而减轻nafld。
随着glp-1r基于药物在临床中的广泛使用,对glp-1r活化和患者中不同癌症的关联的争论越来越多。例如,据报道,glp-1r激动剂和dpp-4抑制剂在β细胞中发挥抗细胞凋亡作用,并刺激胰腺炎,胰腺癌和甲状腺癌。相反,其他研究显示与glp-1r活化相关的胰腺癌风险没有显着升高,并且ex-4显示抑制乳腺,前列腺和结肠癌细胞的增殖。尽管糖尿病和hcc的显着关联,glp-1r活化在肝癌发生中的结果仍然未确定。
技术实现要素:
本发明所要解决的技术问题是:提供一种肝细胞癌的药物及胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂在制造用于预防或治疗肝细胞癌的药物中的应用、在制造用于肝移植手术后肝功能恢复的药物中的应用以及在制造用于预防肝移植手术后肝癌再发的药物中的应用。
为了解决上述技术问题,本发明采用的技术方案为:一种治疗肝细胞癌的药物,该药物包括胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂。
进一步的,所述的胰高血糖素样肽-1受体激动剂选自利拉鲁肽、艾塞那肽中的任意一种或几种。
进一步的,所述的二肽基肽酶4抑制剂选自西格列汀、利拉利汀、沙格列汀和维格列汀的任意一种或几种。
进一步的,还包括药学上可接受的载体。
本发明还提供胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂在制造用于预防或治疗肝细胞癌的药物中的应用。
本发明还提供胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂在制造用于肝移植手术后肝功能恢复的药物中的应用。
本发明还提供胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂在制造用于预防肝移植手术后肝癌再发的药物中的应用。
进一步的,该药物被腹膜内或静脉内给药。
本发明的有益效果在于:胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂通过组织特异性方式施加差异效应,抑制癌细胞增殖并增加癌细胞凋亡,同时使肝细胞被保护免于凋亡,从而治疗减弱肥胖依赖性和非依赖性肝癌发生。
附图说明
图1表示ex-4处理在体内抑制den诱导的hcc形成。
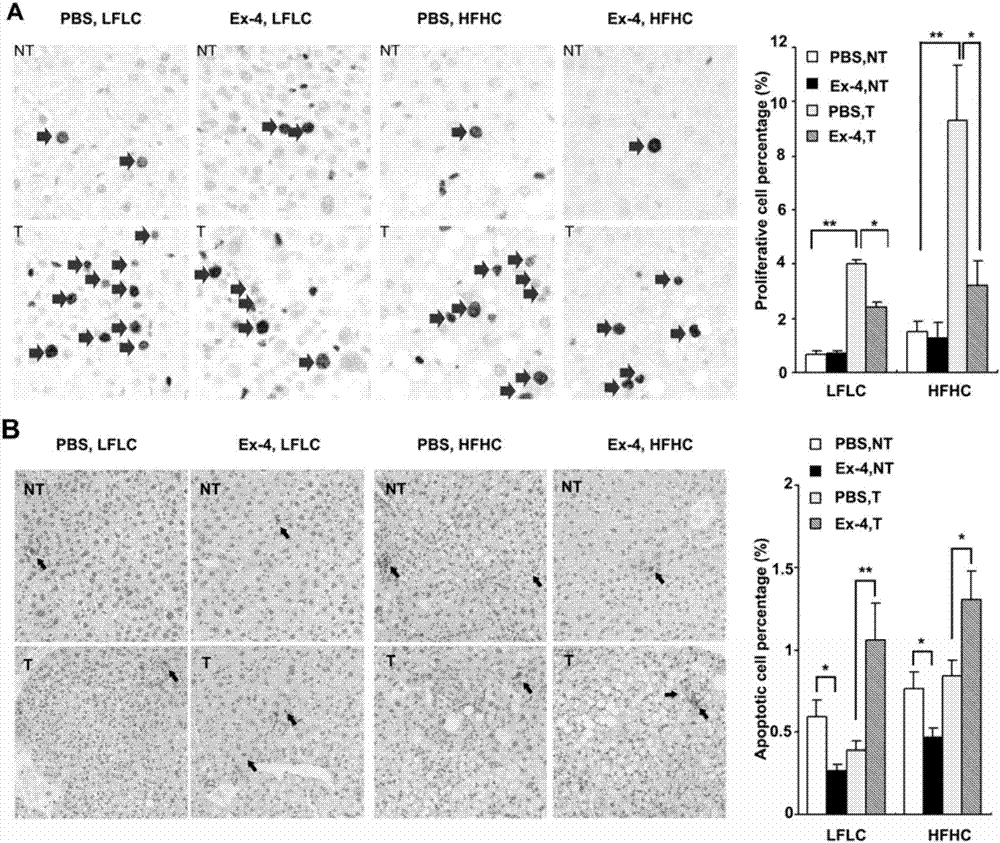
图2表示ex-4处理降低肿瘤细胞增殖并增强凋亡。
图3表示ex-4刺激hcc中的glp-1r信号传导。
图4表示ex-4使来自hfhc喂养的小鼠的肿瘤中的egfr-stat3信号传导失活。
图5表示ex-4抑制hepg2和huh7细胞生长及其伴随的egfr信号传导。
图6表示pka和egfr活性介导ex-4对stat3活化和肝癌细胞生长的抑制作用。
具体实施方式
为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式并配合附图予以说明。
肠促胰素治疗药物的以下两类中:(1)胰高血糖素样肽-1(glp-1)受体激动剂,包括利拉鲁肽(liraglutide)、艾塞那肽每日2次制剂和艾塞那肽每周1次制剂;(2)二肽基肽酶4(dpp-4)抑制剂,包括西格列汀(sitagliptin)、利拉利汀(linagliptin)、沙格列汀(saxagliptin)和维格列汀(vildagliptin),dpp-4抑制剂可限制内源性glp-1的降解。这2类药物具有某些共性,如葡萄糖依赖性刺激胰岛素分泌,低血糖发生率低。
本发明提供一种治疗肝细胞癌的药物,该药物包括胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂。
进一步的,所述的胰高血糖素样肽-1受体激动剂选自利拉鲁肽、艾塞那肽中的任意一种或几种。
进一步的,所述的二肽基肽酶4抑制剂选自西格列汀、利拉利汀、沙格列汀和维格列汀的任意一种或几种。
进一步的,还包括药学上可接受的载体。
本发明还提供胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂在制造用于预防或治疗肝细胞癌的药物中的应用。
本发明还提供胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂在制造用于肝移植手术后肝功能恢复的药物中的应用。
本发明还提供胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂在制造用于预防肝移植手术后肝癌再发的药物中的应用。
进一步的,该药物被腹膜内或静脉内给药。
以下实施例通过研究ex-4在消耗低脂低碳水化合物(lflc)或高脂高碳水化合物(hfhc)饮食的二乙基亚硝胺(den)处理的小鼠中的效果,证明了肠促胰素治疗药物中的胰高血糖素样肽-1受体激动剂和/或二肽基肽酶4抑制剂可治疗肝细胞癌。
实施例
为了检查hcc中glp-1r活化的影响,我们在小鼠中建立了hcc模型,其中施用den用于hcc诱导,并且饲喂低脂和低碳水化合物(lflc)或高脂和高碳水化合物(hfhc)饮食用于nash发展,旨在模拟从nash到hcc的病理进展。hfhc和den治疗的小鼠具有临床相关性,因为所得的病理状况高度类似于人类糖尿病和hcc。在这里我们发现,ex-4治疗的glp-1r激活显着降低lflc和hfhc喂养的小鼠中的hcc多重性。特别感兴趣的是,ex-4以组织特异性方式施加差异效应,其由多种信号传导级联介导。这些信息定义了glp-1r激活在保护肝脏免于发展hcc中的关键作用,并且提供了基于这种肿瘤抑制效应的新的机械学见解。
将雄性c57bl/6n小鼠在22~24℃下在12小时光-暗循环下饲养。在出生后第14天的小鼠腹膜内注射单剂量的den(5mg/kg体重)。在10周龄时,将小鼠分成2组,并喂食lflc或hfhc饮食。hfhc饮食由高脂肪饮食(研究饮食d12331,58%kcal来自脂肪)和高碳水化合物饮料(42g/l碳水化合物,55%果糖和45%蔗糖)组成,其被证明诱导nash。为了激活glp-1r信号传导,以10nmol/kg体重的剂量或等量体积的(磷酸盐缓冲液)pbs作为对照从3个月龄到处死每日腹膜内注射ex-4(wako)。为了监测ex-4的抗糖尿病作用,如前所述进行口服葡萄糖耐量试验(ogtt)。在处死前,将小鼠用氯胺酮和xyline安乐死,并通过心脏穿刺放血。分离肿瘤,计数并称重。将解剖组织在液氮中快速冷冻或固定在福尔马林中用于组织学分析。
免疫组化染色增殖和凋亡
肝切片中的增殖细胞如先前所述通过ki67抗体(labvision)染色。通过tunel染色(roche)分析凋亡。使用光学显微镜(zeiss)获得图像。在两个实验中,通过imagej计数在至少四个独立视野中的阳性染色的细胞,并计算增殖或凋亡指数作为针对总肝细胞的阳性细胞(每组n=5)。
实时pcr和western印迹
从肝组织提取总rna并转录成cdna。使用sybrgreenmix(takara),使用特异性引物制备实时pcr。在appliedbiosystems7900htfastreal-timepcrsystem(appliedbiosystems)上进行pcr。在补充有蛋白酶抑制剂和磷酸酶抑制剂的ripa裂解缓冲液中提取蛋白质。裂解的蛋白质变性,分离并转移到pvdf膜。用于检测的抗体在补充方法中列出。通过imagej定量条带的强度。
体外细胞生长测定和分子信号分析
hepg2和huh7细胞在补充有10%fbs,青霉素和链霉素的高葡萄糖dmem培养基中培养。用3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2h-四唑溴化物(mtt)测定(sigma)测定具有指定治疗的活细胞数。对于分子实验,将人egfr基因克隆并插入cmv启动子下游的表达质粒pcdna3.1(+)中。使用
统计
数据表示为平均值±标准误差平均值(sem)。组之间的差异通过anova,随后是学生t检验来确定。与p<0.05的比较被认为是统计学显着的。
结果
(1)ex-4治疗减弱肥胖依赖性和非依赖性肝癌发生
鉴于ex-4在减轻糖尿病症状以及t2d和hcc形成的密切关联方面的已证明的功效,我们假设ex-4可能对肥胖症诱导的肝癌发生发挥保护作用。为了解决这个问题,我们检查了在用hfhc饮食喂养的den注射的c57bl/6n小鼠中ex-4的体内功能(图1a)。这种动物模型可以模拟人类中糖尿病相关hcc的自然发展,因为den是肝癌的一种已经确定的致癌物,并且hfhc饮食先前已显示在小鼠中诱导脂肪性肝炎和纤维化。同时,另一组注射den的小鼠被给予lflc饮食用于肥胖和瘦模型之间的比较。
我们首先评估不同组的小鼠使用ogtt的饮食相关血糖反应。简言之,记录刺激后血糖浓度的时间依赖性变化(图1b),并且将各个测量曲线下的面积用于直接比较(图1c)。在pbs治疗的对照中,hfhc喂养的小鼠的血糖水平可以高于lflc喂养的小鼠的血糖水平。虽然ex-4不干扰lflc喂养的小鼠中的葡萄糖体内平衡,但它显着降低了喂食hfhc的小鼠中的血糖水平(图1b-c,p<0.01)。此外,与lflc喂养组相比,ex-4还显着降低了hfhc喂养的小鼠中血清甘油三酯,胆固醇和空腹胰岛素的水平(图1d,p<0.05)。在35周龄时,处死所有小鼠并检查体重和肝重量。与lflc饮食相比,hfhc饮食显着增加pbs处理的小鼠的身体和肝脏质量(图1e,白色条,p<0.001和p<0.05)。值得注意的是,这种hfhc依赖性体重增加和肝肿大基本上被ex-4处理所消除(图1e,黑色柱,p<0.001和p<0.05)。另外,ex-4处理显著降低了hfhc引起的肝脏中的甘油三脂和脂肪酸含量(图1f,黑色柱,p<0.001和p<0.05)。这些结果说明了ex-4抑制hfhc诱导的肥胖的有效性,这与ex-4在糖尿病患者中的辅助作用一致。
我们接下来检查用于den诱导的hcc的解剖的小鼠肝脏(图1f),并且量化单独组中的肿瘤多样性和质量(图1g)。在pbs处理的小鼠中,den的致癌作用被hfhc饮食显着增强,所得肿瘤数量和重量分别比lflc饲养小鼠中发现的肿瘤数量和重量高3至6倍(图1g,白色条,p<0.001和p<0.05)。与之形成鲜明对比的是,在ex-4处理的小鼠中,hfhc饮食仅将hcc丰度增加到有限程度(图1g,黑色柱)。重要的是,当与pbs处理的对照相比时,在lflc-和hfhc-喂养的小鼠中,ex-4使hcc多样性显着降低高达78%(图1f-gp<0.01和p<0.0001)。与这些结果一致,ex-4还在另一个den处理的m/db瘦小鼠模型中将hcc发病率限制45%,在hbx转基因小鼠模型中将58%限制在其中病毒蛋白hbx可诱导hcc形成的补充图1)。这种体内信息证明了ex-4对肥胖相关和不相关的肝癌发生的强抑制功能。
(2)ex-4抑制细胞增殖并增加hcc中的凋亡
为了描述ex-4在hcc中的抗肿瘤发生作用,我们比较了解剖的小鼠肝脏的非肿瘤和肿瘤组织中生长和垂死细胞的比例。通过染色对于细胞增殖的核标记物ki67,我们发现在lflc-和hfhc喂养的小鼠中,ex-4处理显着地将增殖的肿瘤细胞的百分比降低高达3倍(图2a,p<0.05和p<0.05)。值得注意的是,ex-4没有改变任何一个饮食组的非肿瘤组织中的肝细胞增殖。接下来,我们使用tunel试剂盒测量相同组织中的细胞凋亡水平。结果表明,在lflc-和hfhc喂养的小鼠中,ex-4使凋亡肿瘤细胞的数量显着增加高达2.7倍(图2b,p<0.01和p<0.05)。有趣的是,ex-4的作用在非肿瘤组织中也是不同的,其中肝细胞被保护免于细胞凋亡。总之,我们的数据表明ex-4通过限制细胞增殖和驱动凋亡来抵消肝癌的发生。
(3)glp-1r表达在来自小鼠hcc模型和人肝癌细胞的肿瘤中上调
鉴于ex-4的上述组织特异性功能,我们进一步检查了在相同的小鼠肝样品中glp-1r的非肿瘤和肿瘤表达,glp-1r是ex-4的体内分子靶标和功能性介质。qrt-pcr分析显示,在lflc和hfhc喂养的小鼠中,肿瘤组织中的glp-1r转录物水平比非肿瘤组织中的glp-1r转录物水平高>2倍(图3a,p<0.05和p<0.05),表明在hcc细胞中对ex-4治疗的更大易感性。值得注意的是,在用lflc或hfhc饮食喂养的ex-4处理的小鼠中,在肿瘤组织中的这种glp-1r诱导不太明显(图3a),显示glp-1r表达以及致瘤性在长期处理实施例4。此外,我们对两个永生化人正常肝细胞系(miha和lo2)和六个人类hcc细胞系(bel7402,hep3b,hepg2,huh7,plc5和sk-hep1)进行了相同的qrt-pcr分析。结果显示,与正常对照相比,glp-1r在hcc中显着上调(图3b,全部p<0.05)。结果表明相对于正常对应物,glp-1r在hcc细胞中的过表达。
先前的研究已经证明glp-1r的活化与camp-pka信号传导相关。为了确定在hcc中由glp-1r激活产生的分子反应,我们测量了肝组织中的细胞内camp含量和pka活性。由于我们对肥胖相关的hcc和来自lflc喂养的小鼠的肿瘤样品不足的主要兴趣,我们使用来自hfhc喂养的小鼠的组织样品用于进一步的实验。结果显示在肿瘤组织中ex-4上调camp含量26%,pka活性50%(图3c,p<0.05和p<0.01),而在非肿瘤组织中未检测到显着变化来自相同的小鼠(图3d)。为了证实这些结果,我们进一步检查了pka最佳活性所需的pka催化亚基(pka-c)的磷酸化状态(27)。如图所示。3e,ex-4与pbs处理的对照相比显着增强了肿瘤中的pka-c磷酸化(p<0.05)。与camp和pka活性结果(图3c和d)一致,ex-4对非肿瘤组织中的pka-c磷酸化没有显着影响(图3f)。这些实验证明ex-4,glp-1r,camp和pka在hcc中的阳性结合。
(4)ex-4在体内减弱egfr-stat3信号传导
鉴于glp-1r信号传导的激活,我们接下来试图确定肝癌发生中camp-pka信号传导的下游的分子途径。以前的报告表明,pka磷酸化丝氨酸残基的egfr以降低其激酶活性,如通过减少y1173自磷酸化所示,并导致stat3的去磷酸化。当egfr的停靠位点(y1068)被磷酸化时,egfr可以在y705募集并磷酸化stat3以刺激其下游信号传导(30-32)。我们确定相对于来自pbs处理的小鼠的非肿瘤,肿瘤中egfr(y1068/1173)以及其靶stat3(y705)的磷酸化水平显着增强(图4a,p<0.05,p<0.05和p<0.05),表明hcc中egfr-stat3通路的活化。引人注目的是,与pbs处理的对照相比,ex-4显着减少了egfr(y1068/1173)磷酸化,并且消除了肿瘤中的stat3(y705)磷酸化(图4b,p<0.01,p<0.01和p<0.05)与camp-pka的ex-4依赖性诱导(图3c和e)并行。重要的是,在相同的肿瘤组织中,包括c-myc,细胞周期蛋白d1,存活蛋白,bcl-2和bcl-xl的stat3-调节的基因的蛋白和转录水平一致地被ex-4抑制(图4c,p<0.05),说明ex-4在转录水平的多种功能效应。除了egfr-stat3信号转导,我们还检查了ex-4在由erk1/2,mtor,β-连环蛋白和炎症细胞因子tnf-α和il-6调节的自噬和其它致癌途径中的潜在作用。然而,在肿瘤样品或人肝癌hepg2细胞中未检测到显着的ex-4依赖性变化。共同地,这些体内数据表明ex-4关闭egfr-stat3调节的级联以抑制hcc形成。
(5)ex-4以剂量和时间依赖性方式灭活egfr/stat3
为了研究hcc中ex-4的时间作用和有效浓度,我们在两种肝癌细胞模型,hepg2和huh7中评估了ex-4的体外功能,其在我们的筛选中表达最高水平的glp-1r(图2)。使用mtt测定,我们发现ex-4显着降低hepg2和huh7细胞的生长速率,并且生长减少的程度与药物剂量(图5a)和治疗时间(图5b)正相关。然后我们检查ex-4是否影响这两种hcc细胞系中的egfr(y1173)磷酸化及其靶stat3(y705)磷酸化。类似于mtt结果(图5a-b),egfr(y1173)和stat3(y705)的酪氨酸磷酸化水平以剂量和时间依赖性方式被ex-4显着下调(图5c-d)。这些体外结果与我们的体内证据高度一致(图2和4),证实细胞生长停滞和egfr/stat3失活的相关性。
(6)pka和egfr信号传导介导ex-4的肿瘤抑制作用
为了评估camp/pka在ex-4的抗肿瘤发生作用中的强制作用,我们用pka特异性抑制剂h89,与或不与ex-4一起处理hepg2和huh7细胞,然后通过mtt测定。在dmso处理的hepg2细胞中,ex-4的应用减少了egfr(y1173)和stat3(y705)的酪氨酸磷酸化(图6a,p<0.05),这在期望的范围内。相比之下,在h89处理的hepg2细胞中,磷酸化egfr(y1173)和stat3(y705)的基础水平显着增加,并且对ex-4处理变得不敏感(图6a,p<0.05)。这种对egfr和stat3的h89依赖性作用也在huh7细胞中保守(图6b,p<0.05)。在功能重要性方面,在hepg2和huh7细胞中,h89显着降低了细胞生长的ex-4-依赖性抑制(图6c)。这些结果清楚地证明了pka在介导ex-4功能中的上游和关键作用。
为了进一步验证ex-4作用中egfr/stat3信号传导的必要性,我们在使用或不使用ex-4处理的情况下在hepg2和huh7细胞中过表达egfr,然后通过相同的mtt测定法测量细胞生长。在空载体(pcdna)转染的hepg2细胞中,ex-4以预期的方式抑制egfr(y1173)和stat3(y705)的酪氨酸磷酸化(图6d,p<0.05)。相反,在egfr转染的hepg2细胞中,无论ex-4处理如何,egfr(y1173)和stat3(y705)的磷酸化均适度增加(图6d,p<0.05)。在huh7细胞中也获得了一致的结果(图6e,p<0.05)。egfr的这种异位过表达随后减少了ex-4在hepg2和huh7细胞中的抗增殖作用(图6f),证实了egfr在ex-4效应中的强制性作用。
几乎没有实验报告记录glp-1r活化和癌症的关系,并且结果主要来自裸鼠中的体外研究或异种移植模型(19-22)。在这项研究中,我们调查通过激动剂ex-4施用在致癌诱导和hfhc饲养的小鼠hcc模型中的glp-1r活化的影响,其概括了肥胖和人类hcc的大多数临床特征)。在这里我们第一次报告ex-4治疗可以有效抑制hcc发展(图1),其通过抑制细胞增殖并在肿瘤而非非肿瘤细胞中诱导凋亡来实现(图2)。机制上,ex-4治疗靶向glp-1r上调camp依赖性pka活性(图3),这继而导致egfr和stat3的失活,并最终导致多种效应基因的下调,包括c-myc,细胞周期蛋白d1,存活蛋白,bcl-2和bcl-x1(图4)。这种体内模型来源的调节机制(图6g)是固体,因为在两种人肝癌细胞模型中分别验证了在ex-4处理后pka和egfr的不可或缺的作用和功能效应(图5-6)。总之,我们的发现证实了ex-4在肥胖相关的hcc中的有效抑制作用,说明了基于肠降血糖素的治疗作为治疗糖尿病和hcc的新的药理学方法的潜在临床应用。
由于t2d成为多种癌症(包括hcc,前列腺癌和胰腺癌)的重要危险因素,更多的研究集中在抗糖尿病药物的肿瘤调节功能。例如,二甲双胍(t2d治疗的一线药物)据报道降低hcc风险,并发现噻唑烷二酮可降低t2d患者的肝癌和结肠直肠癌发病率。在这里,我们集中于t2d相关的hcc,并且显示ex-4在体内和体外都表现出抗肿瘤发生作用(图1-2,5a-b)。尽管已知ex-4可改善糖尿病并发症,但应注意,ex-4的肿瘤抑制效应不仅仅依赖于致肿瘤发生的代谢状况如高血糖和肝脂肪变性的抑制。这一观点得到我们的体内数据的支持,ex-4治疗也减弱了lflc喂养的小鼠中的肿瘤发展,而没有显着改变它们的葡萄糖耐量(图1b-c)。此外,我们还确定ex-4在den诱导的hcc(m/db瘦小鼠)和hbx诱导的hcc(hbx-转基因小鼠)中的肿瘤抑制效应(补充图1)。此外,在没有另外的脂质补充物的dmem培养基中培养的hepg2和huh7细胞也响应于ex-4,并显示显着降低的增殖(图5a-b)。这些数据显示ex-4可以在高血糖肥胖和正常血糖贫乏条件下抑制肝癌发生。
hcc形成是细胞增殖和凋亡失调的结果。在这里我们确定ex-4以组织特异性方式影响这两种细胞过程。我们的体内数据清楚地证明了ex-4在肿瘤中而不在非肿瘤组织中的抗增殖和促凋亡作用(图2)。我们假设ex-4的这种肿瘤特异性功能归因于glp-1r在不同组织中的差异表达。基于以前的研究,glp-1r在人体中广泛表达,但其在肝中的表达仍在争论中。enref_38我们进行qrt-pcr以检查glp-1r的mrna表达,在肝癌组织和细胞系中glp-1r的高表达(图3a-b)。与我们的假设一致,与glp-1r缺陷型bel-7402和plc5细胞(数据)相比,ex-4的抗肿瘤作用在glp-1r丰富的hepg2和huh7细胞中最突出(图5-6)未示出)。虽然肿瘤样品具有更高的glp-1r表达,但是应该注意到,在没有ex-4处理的情况下,glp-1r相关的信号传导在肿瘤中没有显着活化,如通过非肿瘤和肿瘤组织(图3c-d)。这些集体的结果表明ex-4的抗肿瘤活性由glp-1r介导,其可以作为预测和监测ex-4在糖尿病hcc患者中的反应的生物标志物。
以前的研究报道了camp和pka在不同癌症中的多效性作用。尽管细胞内camp含量显示抑制hcc发展(38),但是pkc在hcc中的功能仍然是有争议的。据报道,pka的上调可抑制hcc形成(39)。然而,其他研究显示pka的抑制减少了前列腺素e2诱导的肝癌细胞的粘附和迁移率。pka在癌症发展中的不同作用可能是由于在亚细胞微区中分离的pka的不均匀活化通过pka锚定蛋白。在这项研究中,我们确定了pka活性的ex-4依赖性上调与其上游因子camp的诱导(图3c),并且这两种事件与体内肿瘤多样性的减少相关(图3,1f-g)。特别重要的是,对camp和pka活性的ex-4的刺激限于肿瘤而不是非肿瘤组织(图3c-f),证明了ex-4的肿瘤特异性效应。这个信息与先前报道的camp在hcc中的抗肿瘤发生作用一致,并且支持pka保护肝脏抵抗hcc形成的观念。
egfr被发现是突变体组成型活性致癌v-erbb酪氨酸激酶的原癌基因。临床研究先前已证明egfr在40%至70%的hcc患者中的上调,并且egfr抑制剂显示在人肝癌细胞和大鼠肝癌发生模型中发挥强拮抗作用。我们的研究提供了体内和体外证据,egfr-stat3失活有助于ex-4的抗肿瘤作用(图4-6)。基因表达分析显示ex-4处理的小鼠具有多个stat3调节的基因(例如c-myc,细胞周期蛋白d1,存活蛋白,bcl-2和bcl-xl)的较低表达。这些基因与肝癌预后差,临床病理特征和存活率高度相关。egfr-stat3-bcl-xl轴的功能重要性已经通过在颈部和头部癌症的鳞状细胞癌中联合靶向这三种分子的增强的抗肿瘤效应来证明。这些基因的抑制与ex-4的抗肿瘤效应和由ex-4调节的stat3信号传导证实。
总之,我们已经确定ex-4在肥胖依赖性和非依赖性hcc中的保护作用,其中ex-4调节camp-pka-egfr-stat3分子轴以组织特异性方式抵消肝癌发生。鉴于这些重要的发现和ex-4在糖尿病患者中的良好确立的益处,未来的研究有必要验证ex-4治疗与降低的hcc风险在不同临床队列中的关联。此外,精益小鼠hcc模型中ex-4的分子表征是必要的,以描绘glp-1r激活在无糖尿病hcc中的抗肿瘤机制,这将有助于确定glp-1r激动剂作为新型hcc-靶向药物。
以下为上述实施例的附图说明。
图1-ex-4处理在体内抑制den诱导的hcc形成。(a)实验方案。(b)ex-4改善了用hfhc饮食喂养的小鼠的血糖控制,如ogtt结果所示。(c)计算ogtt曲线下面积(auc),并以平均值±sem表示。(d)ex-4处理改善了血清甘油三酯,胆固醇和空腹胰岛素水平。(e)ex-4减弱hfhc诱导的体重增加和肝肿大。(f)代表性图片显示在ex-4处理的小鼠的肝脏中较少的肿瘤结节。(g)在具有lflc或hfhc饮食的小鼠中,ex-4减少了肿瘤数目和总肿瘤重量。数据表示为平均值±sem。(b-c),每组n=7。(d-g)n=10/组。*p<0.05;**p<0.01;***p<0.001。
图2-ex-4处理降低肿瘤细胞增殖并增强凋亡。(a)ki67染色和(b)tunel染色在具有不同饮食和处理的小鼠的非肿瘤(nt)和肿瘤(t)切片上进行。阳性染色细胞的百分比表示为平均值±sem。*p<0.05;*p<0.01。
图3-ex-4刺激hcc中的glp-1r信号传导。(a)与非肿瘤(nt)样品相比,肿瘤(t)样品中glp-1r表达增强。(b)2个永生化肝细胞(白色柱)和6个肝癌细胞系(黑色柱)中的glp-1rmrna水平。通过lo2和个体hcc细胞系之间的比较计算统计学显著性。(c-d)ex-4仅在(c)肿瘤而非(d)非肿瘤中激活c-amp和pka信号传导。结果表示为camp含量或pka活性对蛋白质量。(e)肿瘤(t)和(f)非肿瘤(nt)裂解物中不同的(e-f)ex-4调节的pka催化亚基(pka-c)。代表性印迹显示在左图中,并且带强度定量表示为在右图中的磷酸化对总蛋白(p/t)比。数据以平均值±sem表示。(a)每组n=10。(b)在每个hcc细胞系中一式三份。(c-f)n=4或5每组。*p<0.05,**p<0.01。
图4-ex-4使来自hfhc喂养的小鼠的肿瘤中的egfr-stat3信号传导失活。(a)与非肿瘤组织相比,肿瘤中egfr-stat3信号传导增强。左图中显示了来自hfhc喂养的小鼠的配对的非肿瘤(nt)和肿瘤(t)样品中的egfr(y1173,y1068)和stat3(y705)磷酸化的代表性蛋白质印迹,并且带强度定量表示为磷酸化总蛋白(p/t)比率。(b)ex-4降低y1173和y1068处的egfr磷酸化,以及肿瘤裂解物中y705处的stat3磷酸化。(c)在肿瘤样品(pbs组中n=10;ex-4组中n=7)中,stat3靶向基因的蛋白和mrna表达水平被ex-4抑制,数据显示为平均值±sem。*p<0.05;**p<0.01。
图5-ex-4治疗停止hepg2和huh7细胞生长伴随egfr信号传导的抑制。(a-b)ex-4处理以mtt测定显示的(a)剂量和(b)时间依赖性方式降低hepg2或huh7细胞数目。(c)剂量-和(d)时间依赖性ex-4处理后,(c-d)egfr(y1173)和stat3(y705)磷酸化被抑制。定量条带强度,相对于总蛋白的水平标准化,并且表示为与空白或时间零组相比的倍数变化。数据表示为来自三个单独实验的平均值±sem。*p<0.05;**p<0.01。
图6-pka和egfr活性介导ex-4对stat3活化和肝癌细胞生长的抑制作用。(a-b)通过h89处理的pka的失活减弱了hepg2和huh7细胞中egfr(y1173)和stat3(y705)磷酸化的ex-4-依赖性抑制。(c)通过h89处理减弱ex-4处理的活细胞减少。将结果计算为与dmso处理的细胞相比的细胞生长的百分比,并且表示为来自三个单独实验的平均值±sem。(d-e)在hepg2和huh7细胞中egfr过表达消除了ex-4对stat3磷酸化的抑制。(f)ex-4处理的活细胞减少在egfr过表达的hepg2和huh7细胞中减弱。(g)描述了ex-4在肝脏中的抗肿瘤发生作用的示意图。*p<0.05;**p<0.01。
综上所述,本发明的有益效果在于:施用ex-4在瘦和肥胖den处理的小鼠中显着降低hcc多样性,其中抑制的增殖和诱导的细胞凋亡被限制于肿瘤细胞。ex-4的抗肿瘤发生作用与glp-1r的高表达和camp和pka的活化有关。重要的是,ex-4也下调egfr和stat3,其位于camp-pka信号传导的下游,导致包括c-myc,细胞周期蛋白d1,存活蛋白,bcl-2和bcl-x1的多个stat3靶向基因的抑制。ex-4的生长抑制作用在glp-1r丰富的肝癌细胞系hepg2和huh7中一致,其中pka和egfr两者在介导ex-4功能中发挥必要的作用。总之,ex-4通过camp-pka-egfr-stat3信号传导引起针对肥胖依赖性和非依赖性hcc的保护功能,表明其作为减少糖尿病患者中的hcc风险的新方法的施用。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等同变换,或直接或间接运用在相关的技术领域,均同理包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!