酪氨酸激酶抑制剂DCC‑2036的新应用的制作方法
本发明属于药物化学领域,具体涉及酪氨酸激酶抑制剂DCC-2036的新应用,尤其是涉及酪氨酸激酶抑制剂DCC-2036在制备预防或治疗三阴性乳腺癌的药物中的应用。
背景技术:
女性乳腺是由皮肤、纤维组织、乳腺腺体和脂肪组成的,乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤。三阴性乳腺癌(triple negative breast cancer,TNBC)是指癌组织免疫组织化学检查结果为雌激素受体(ER)、孕激素受体(PR)和原癌基因Her-2均为阴性的乳腺癌。这类乳腺癌占所有乳腺癌病理类型的10.0%~20.8%,每年全世界有大约一百万的乳腺癌新增病例,其中超过170000的患者是三阴性乳腺癌。三阴乳腺癌侵袭性强、复发早、进展快、生存时间短等临床生物学行为,对内分泌治疗及针对HER-2、ER、PR的靶向治疗药物不敏感,且预后较其他类型差,是导致乳腺癌患者死亡的主要原因。TNBC的发病机制及临床治疗已经成为国际上乳腺癌研究的新热点。
目前用于乳腺癌化疗的药物主要有阿霉素、紫杉醇、吉西他滨、顺铂和5-氟尿嘧啶(5-FU)等,这些药物虽已广泛应用于乳腺癌的治疗,但由于其毒副作用及患者的耐药性限制了这些药物的治疗效果。近年来,随着分子靶向治疗药物的出现及其在临床的广泛应用,靶向治疗在肿瘤的综合治疗中发挥了日渐重要的作用。由于靶向治疗特异性强,效果显著,基本不损伤正常组织,因此肿瘤分子靶向治疗是肿瘤治疗中最具前景的治疗方案。然而,三阴性乳腺癌由于不表达雌激素受体、孕激素受体、人类表皮生长因子受体2,所以对大多数内分泌治疗及针对HER-2、ER、PR表达阳性的乳腺癌靶向治疗药物(如他莫昔芬、赫赛汀)不敏感,而目前也没有找到其他特别有效的靶点,故预后较其他类型乳腺癌差。因此,寻找TNBC新的靶点和靶向治疗药物成为乳腺癌研究亟待解决的问题。
蛋白酪氨酸激酶在细胞内的信号转导通路中占据重要地位,调节着细胞的生长、分化、死亡等一系列理化过程。编码酪氨酸激酶的基因发生过度扩增或突变,可导致酪氨酸激酶活性的持续增高进而诱发肿瘤,是以酪氨酸激酶为靶点的肿瘤靶向治疗的理论基础,以酪氨酸激酶为靶点进行药物研发逐步成为国际抗肿瘤药物研究的热点。目前为止,已有多种蛋白酪氨酸激酶抑制剂及抗体进入I-Ⅱ期临床试验阶段,个别已经上市,并取得了令人鼓舞的治疗效果。1998年,美国FDA正式批准Herceptin用于治疗某些HER2阳性的转移性乳腺癌。2001年,Novartis公司研发的针对酪氨酸激酶Bcr-Abl的抑制剂Gleevec因对慢性粒细胞性白血病(chronic myelogenous leukemia,CML)具有很好疗效而提前上市。2002年,AstraZeneca公司研发的IressaTM(ZD1839)被美国FDA批准用于治疗经标准含铂类方案和紫杉萜化疗后继续恶化的终未期非小细胞肺癌患者。Herceptin、Gleevec及Iressa的成功应用进一步证实了以特定靶点尤其是以酪氨酸激酶为靶点进行抗肿瘤药物的研发是最有可能获得突破性进展的抗肿瘤药物研究领域,具有十分广阔的前景。因此,酪氨酸激酶抑制剂也极有可能成为治疗TNBC的有效药物。
DCC-2036(Rebastinib)是由塔夫茨医学中心根据ABL1结构靶向设计的第三代酪氨酸激酶抑制剂。DCC-2036结构式如式1所示,分子量553.59g/mol,DCC-2036能靶向结合到ABL1的残基(Arg386/Glu282),从而控制非活性和活性构象之间的开关,有效抑制ABL1的磷酸化。DCC-2036是一种多靶点抑制剂,除了ABL,DCC-2036对FLT3、TIE2、SRC、PDGFRα、FYN、AXL、MER等多种酪氨酸激酶的活性均有较好的抑制作用(表1)。但未见DCC-2036治疗三阴性乳腺癌方面的应用。
表1 DCC-2036的体外激酶抑制谱(IC50<100nM)
技术实现要素:
有鉴于此,本发明提供了酪氨酸激酶抑制剂DCC-2036的新应用,即酪氨酸激酶抑制剂DCC-2036在制备预防或治疗三阴性乳腺癌的药物中的应用的应用。
本发明以酪氨酸激酶抑制剂DCC-2036作为研究对象,首先考察DCC-2036对三阴性乳腺癌细胞系MDA-MB-231和HS-578T增殖的影响。结果显示DCC-2036可显著抑制三阴性乳腺癌细胞系MDA-MB-231和HS-578T的增殖,其抑制效应优于大部分TNBC临床一线治疗药物的作用,如顺铂、吉西他滨、拉帕替尼、他莫昔芬、5-FU、吉非替尼。同时,还发现DCC-2036虽然也能抑制Luminal A亚型(ER+、PR+、HER2-)的乳腺癌细胞株MCF-7和基底/三阴性乳腺非致瘤上皮细胞株MCF-10A的增殖,但是显然不如TNBC细胞对药物的敏感性高。此外,还考察了DCC-2036对MDA-MB-231和MCF-7细胞的上皮间质转化(EMT)标志物表达的影响(EMT标志物的变化在一定程度上能反映细胞侵袭转移能力的改变)。结果显示DCC-2036可显著抑制MDA-MB-231和MCF-7细胞的EMT,但是DCC-2036对MDA-MB-231细胞EMT的抑制作用依旧强于MCF-7。因此本发明提供了酪氨酸激酶抑制剂DCC-2036在制备抑制TNBC细胞的增殖和侵袭转移的药物中的应用。
进一步,在一些实施方案中采用AnnexinV-FITC/PI双染流式检测技术检测不同浓度DCC-2036对TNBC细胞株细胞凋亡的影响。结果显示,DCC-2036可诱导TNBC细胞系MDA-MB-231、HS-578T和Luminal A亚型细胞系MCF-7细胞的凋亡,呈剂量依赖性的方式,并且DCC-2036对于TNBC细胞系的凋亡诱导作用要高于Luminal A亚型细胞系。因此本发明提供了酪氨酸激酶抑制剂DCC-2036在制备诱导TNBC细胞凋亡的药物中的应用。
为探明DCC-2036对抗三阴性乳腺癌的关键靶点和具体分子机制,以DCC-2036 3.75μM处理30小时前后的MDA-MB-231细胞株进行芯片杂交,分析和筛选出差异表达的增殖、凋亡、侵袭转移相关基因谱。基因芯片结果显示有12种酪氨酸激酶在3.75μM DCC-2036处理MDA-MB-231细胞30小时后发生了下调。结合DCC-2036的激酶抑制谱(表1),推测AXL和FYN有可能是DCC-2036作用于TNBC的关键靶点。进一步采用Real-time PCR的方法检测发现DCC-2036处理MDA-MB-231细胞后AXL和FYN的mRNA水平下调,表明DCC-2036显著降低AXL和FYN mRNA水平,与芯片结果一致。
在另一实施方案中,本发明采用Real-time PCR的方法对经DCC-2036处理的五种不同的细胞系进行AXL和FYN的定量PCR分析,其中MCF-7、T47D为Luminal A亚型乳腺癌细胞,MDA-MB-231、HS-578T为Basal亚型/TNBC细胞,MCF-10A为Basal亚型/三阴性乳腺非致瘤上皮细胞。同时采用免疫印迹法检测AXL的表达。结果显示,AXL在Luminal A细胞中表达非常低,在TNBC细胞中的表达远远高于在Luminal A细胞和MCF-10A中的表达,相差倍数明显高于FYN在不同亚型乳腺癌细胞中的表达。
进一步采用Western Blot检测方法对乳腺癌细胞系的不同亚型中的AXL的磷酸化水平和总水平进行检测。结果显示DCC-2036处理MDA-MB-231和HS-578T细胞后AXL的磷酸化水平和蛋白总量均发生了下调,且磷酸化水平下降更快,但是DCC-2036处理MCF-7细胞后AXL的磷酸化水平和蛋白总量反而发生了上调。表明AXL是DCC-2306作用于TNBC的关键靶点之一,其在不同亚型乳腺癌细胞中的表达差异也造成了细胞对DCC-2036的药物敏感性不同。
本发明还采用免疫印迹法分析了DCC-2036在TNBC细胞中对AXL下游信号通路的影响。结果显示,P-Akt、P-IκBα、P-P65、P65均发生下调,伴随IκBα激酶的上调,说明AXL下游的PI3K/Akt-NFκβ信号通路发生了下调。进一步核质分离后进行IκBα和p65的重定位。结果显示核质分离后DCC-2036抑制了IκBα的降解和p65的入核。同时,DCC-2036处理细胞后β-catenin的入核也减少。因此本发明提供了酪氨酸激酶抑制剂DCC-2036在制备抑制IκBα的降解的药物中的应用,以及酪氨酸激酶抑制剂DCC-2036在制备抑制p65、β-catenin的入核的药物中的应用。
PARP(poly ADP-ribose polymerase)是DNA修复酶,是细胞凋亡核心成员半胱天冬酶(caspase)的切割底物。本发明采用免疫印迹分析和台盼蓝染色法检测过表达AXL后DCC-2036对TNBC细胞的影响,结果显示AXL过表达后PARP切割减少,表明AXL质粒转染TNBC细胞可减少DCC-2036在MDA-MB-231细胞中诱导的细胞凋亡。同时台盼蓝计数结果显示死亡细胞百分率减少。表明AXL是DCC-2036作用于TNBC细胞的关键靶点之一。因此本发明提供的所述预防或治疗三阴性乳腺癌的药物关键靶点为酪氨酸激酶AXL。
优选的,本发明所述药物包括有效剂量的酪氨酸激酶抑制剂DCC-2036。
进一步,优选的,本发明所述药物还包括药学上可接受的辅料。
本领域技术人员可将所述式1所示化合物直接或间接加入制备不同剂型时所需的药学上可接受的各种常用辅料,如填充剂、崩解剂、润滑剂、粘合剂等,以常规药物制剂方法,制成常用口服制剂或注射制剂。
优选的,所述口服制剂为片剂、胶囊剂、颗粒剂。
优选的,所述注射制剂为注射液或粉针剂。
由上述技术方案可知,本发明提供了酪氨酸激酶抑制剂DCC-2036的新应用,尤其是酪氨酸激酶抑制剂DCC-2036在制备预防或治疗三阴性乳腺癌的药物中的应用。实验表明酪氨酸激酶抑制剂DCC-2036可抑制TNBC细胞系MDA-MB-231和HS-578T的增殖和侵袭转移并诱导细胞发生凋亡,且其对细胞增殖的抑制作用优于大部分TNBC临床一线治疗药物的作用,如顺铂、吉西他滨、拉帕替尼、他莫昔芬、5-FU、吉非替尼。同时,实验还证明受体酪氨酸激酶AXL是DCC-2036在TNBC细胞中发挥作用的关键靶点,酪氨酸激酶抑制剂DCC-2036通过靶向AXL进而调控其下游信号通路在TNBC中发挥其抗肿瘤作用,靶向治疗特异性强,效果显著,基本不损伤正常组织,为推进DCC-2036用于临床治疗TNBC提供了重要的理论基础和实验依据,为临床药物耐受性TNBC提供了潜在的治疗靶点。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
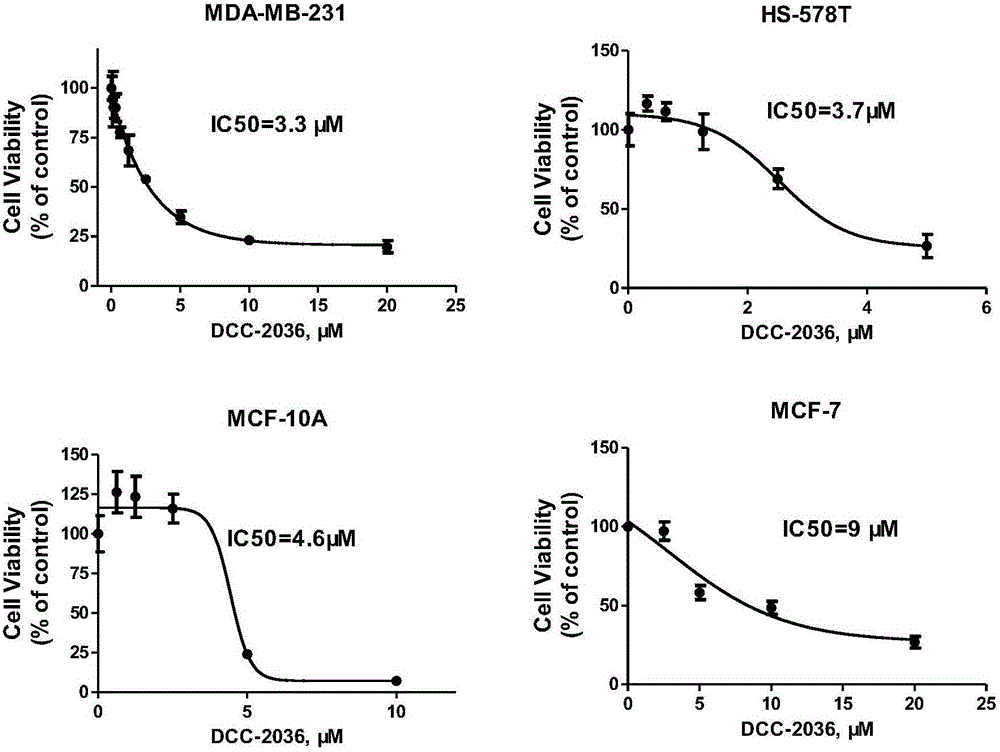
图1示实施例1DCC-2036对MDA-MB-231、HS-578T、MCF-10A和MCF-7细胞的细胞活力的影响结果图;
图2示实施例2DCC-2036对TNBC细胞周期分布的影响结果图,其中图A为经0μM DCC-2036处理后细胞周期分布图;图B为经3.75μM DCC-2036处理后细胞周期分布图;图C为三次独立实验的结果统计图,t检验,*P<0.05,数据表示为平均值±SD;
图3示实施例3DCC-2036对MDA-MB-231细胞凋亡的影响结果图,其中图A-D分别为0μM、2.5μM、3.75μM、5μM浓度的DCC-2036处理细胞后AnnexinV-FITC/PI双染流式细胞仪检测的散点图,左下象限显示正常活细胞,左上象限代表坏死细胞,右下象限为早期凋亡细胞,右上象限为晚期凋亡细胞;图E为结果统计图,单因素方差分析,**P<0.01,***P<0.0001,数据表示为平均值±SD;
图4示实施例3DCC-2036对HS-578T细胞凋亡的影响结果图,其中图A-D分别为0μM、2.5μM、3.75μM、5μM浓度的DCC-2036处理细胞后AnnexinV-FITC/PI双染流式细胞仪检测的散点图,左下象限显示正常活细胞,左上象限代表坏死细胞,右下象限为早期凋亡细胞,右上象限为晚期凋亡细胞;图E为结果统计图,单因素方差分析,**P<0.01,***P<0.0001,数据表示为平均值±SD;
图5示实施例3DCC-2036对MCF-7细胞凋亡的影响结果图,其中图A-E分别为0μM、2.5μM、3.75μM、5μM、10μM浓度的DCC-2036处理细胞后AnnexinV-FITC/PI双染流式细胞仪检测的散点图,左下象限显示正常活细胞,左上象限代表坏死细胞,右下象限为早期凋亡细胞,右上象限为晚期凋亡细胞;图F为结果统计图,单因素方差分析,**P<0.01,***P<0.0001,数据表示为平均值±SD;
图6示实施例4DCC-2036对不同细胞EMT标志物表达的影响结果图,其中图A为对MDA-MB-231细胞EMT相关蛋白的表达水平的影响图;其中图B为对MCF-7细胞EMT相关蛋白的表达水平的影响图;
图7示实施例5基因芯片结果聚类分析图,其中样品2,4,6为药物处理组(MDA-MB-231细胞暴露于3.75μM DCC-2036 30小时),样品1,3,5为对照组(即未经DCC-2036处理的MDA-MB-231细胞);
图8示实施例5Real-time PCR结果图,t检验,***P<0.0001,数据表示为平均值±SD;
图9示实施例6AXL和FYN在乳腺癌细胞系的不同亚型中的表达结果图;其中,图A为AXL的Real-time PCR结果图、图B为FYN的Real-time PCR结果图、图C为AXL的Western Blot检测结果图;单因素方差分析,***P<0.0001,数据表示为平均值±SD,Luminal A乳腺癌细胞系(MCF-7,T47D),基底/三阴性乳腺癌细胞系(MDA-MB-231,HS-578T),基底/三阴性乳腺上皮细胞系(MCF-10A);
图10示实施例6DCC-2036对不同亚型乳腺癌细胞系中的AXL的磷酸化水平和总水平的影响图;其中,图A为MDA-MB-231的AXL的磷酸化水平和总水平图、图B为HS-578T的AXL的磷酸化水平和总水平图、图C为MCF-7的AXL的磷酸化水平和总水平图;
图11示实施例7免疫印迹检测DCC-2036在TNBC细胞中对AXL下游信号通路的影响结果图;其中图A为MDA-MB-231细胞、图B为HS-578T细胞;
图12示实施例7DCC-2036处理的MDA-MB-231细胞核质分离后免疫印迹检测IκBα、p65和β-catenin的重定位结果图;其中图A为胞浆、图B为胞核;
图13示实施例8过表达AXL后DCC-2036对TNBC细胞的影响图;图A为Western Blot检测结果图、图B为台盼蓝染色结果统计图。
具体实施方式
本发明公开了一种酪氨酸激酶抑制剂DCC-2036的新应用。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及产品已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法进行改动或适当变更与组合,来实现和应用本发明技术。
为了进一步理解本发明,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
如无特殊说明,本发明实施例中所涉及的试剂均为市售产品,均可以通过商业渠道购买获得。DCC-2036购自selleck公司。
实施例1:DCC-2036对三阴性乳腺癌细胞系MDA-MB-231和HS-578T增殖的影响
采用MTS法在细胞水平上观察DCC-2036对TNBC细胞株增殖的影响,具体方法为:取对数生长期的TNBC细胞(MDA-MB-231和HS-578T)、Luminal A亚型(ER+、PR+、HER2-)的乳腺癌细胞株MCF-7和基底/三阴性乳腺非致瘤上皮细胞株MCF-10A分别接种于96孔板,每孔3×103个细胞。24小时后细胞贴壁,设空白组(仅加培养液)、对照组和药物系列组,每组设3个重复孔,每孔容积为100μL。于第72小时终止培养。在终止培养前4小时,加MTS/PMS每20μL/孔。继续培养4小时,用酶标仪读取490nm处吸光度值(A值)。按下列公式计算细胞活力(Cell Viability),细胞活力=(药物处理组A值-空白组A值)/(对照组A值-空白组A值)×100%。实验重复3次。绘制Cell Viability vs药物浓度曲线,计算IC50。结果见图1。数据来自三次重复的实验,并表示为平均值±标准偏差(SD)。
表2不同药物对MDA-MB-231和HS-578T的增殖的影响
注:表2中IC 50值表示在72小时孵育后导致细胞生长抑制50%的浓度,是3次实验的平均值。*表示数据引自Liu W,et al,Arch.Pharm.Chem.Life Sci.2011,344,451–458.
图1结果显示DCC-2036可显著抑制三阴性乳腺癌细胞系MDA-MB-231和HS-578T的增殖,IC50分别为3.3μM和3.7μM,其抑制效应优于大部分TNBC临床一线治疗药物的作用,如顺铂、吉西他滨、拉帕替尼、他莫昔芬、5-FU、吉非替尼(表2)。同时,还发现DCC-2036虽然也能抑制Luminal A亚型(ER+、PR+、HER2-)的乳腺癌细胞株MCF-7和基底/三阴性乳腺非致瘤上皮细胞株MCF-10A的增殖,IC50分别为9μM和4.6μM,但是显然不如TNBC细胞对药物的敏感性高。
实施例2 DCC-2036对细胞周期分布的影响
取TNBC细胞(MDA-MB-231)经不同浓度(0μM和3.75μM)的DCC-2036处理30小时后用胰酶消化收集细胞,PBS洗两遍,弃上清,加入1ml 70%预冷乙醇中,吹打均匀,4℃固定12小时以上。PBS洗涤去乙醇两遍,离心后0.5mlPBS重悬细胞,加入碘化丙啶(PI)和RNaseA至终浓度50g/ml,37℃温浴30分钟,用流式细胞仪测定细胞周期分布。结果见图2。
图2结果显示DCC-2036可诱导MDA-MB-231细胞G1期阻滞。3.75μM DCC-2036处理MDA-MB-231细胞30小时后细胞的G1期增加。
实施例3:DCC-2036对TNBC细胞株凋亡的影响
采用AnnexinV-FITC/PI双染流式检测技术检测不同浓度DCC-2036对TNBC细胞株细胞凋亡的影响。具体方法为:分别以0μM、2.5μM、3.75μM、5μM(和10μM)浓度的DCC-2036处理TNBC细胞系MDA-MB-231细胞、HS-578T细胞和Luminal A亚型细胞系MCF-7细胞24小时,消化收集细胞,用1×Binding buffer洗一遍,加入Annexin V-FITC染料避光孵育20分钟。在上流式细胞仪检测前加入PI染料。细胞的凋亡率通过FACS Calibur flow cytometer和CellQuest Pro软件(Becton Dickinson)来评估,结果见图3-5。
图3-5的结果显示,DCC-2036可诱导TNBC细胞系MDA-MB-231、HS-578T和Luminal A亚型细胞系MCF-7细胞的凋亡,呈剂量依赖性的方式,但是很显然DCC-2036对于TNBC细胞系的凋亡诱导作用要高于Luminal A亚型细胞系。MCF-7细胞在5μM作用下细胞死亡率仅为36%左右,10μM作用下细胞死亡率才47%左右,而MDA-MB-231细胞和HS-578T细胞在5μM作用下细胞死亡率分别达到了52%和67%左右。
实施例4:DCC-2036对EMT标志物表达的影响
通过Western印迹检测DCC-2036对细胞EMT相关蛋白的表达水平的影响。具体方法为:分别以0μM、2.5μM、3.75μM、5μM(和10μM)浓度的DCC-2036处理MDA-MB-231细胞和MCF-7细胞30小时后收集细胞于裂解液中,冰上裂解30分钟,离心10分钟收集上清并用BCA法进行蛋白定量,配平后的蛋白于SDS-PAGE胶分离后转移至PVDF膜。在室温下,膜在封闭液中(5%脱脂牛奶)封闭60分钟后,相应一抗孵育一小时,4℃过夜。第二天室温下孵育二抗一小时,抗体结合由化学荧光系统检测。结果见图6。
图6结果显示,DCC-2036可抑制MDA-MB-231和MCF-7细胞的上皮间质转化(EMT)。上皮性标志物E-cadherin增加,间叶性标志物N-cadherin、Vimentin减少,调控EMT的转录抑制因子TCF/ZEB1、Snail、Slug减少。DCC-2036对于MDA-MB-231细胞的EMT抑制作用依旧强于MCF-7细胞。
实施例5:DCC-2036作用于TNBC的关键靶点分析、筛选与验证
为探明DCC-2036对抗三阴性乳腺癌的关键靶点和具体分子机制,以DCC-2036 3.75μM处理30小时前后的MDA-MB-231细胞株进行芯片杂交(Homo sapiens 12×135K Array,Roche-Nimblegen,上海康成),分析和筛选出差异表达的增殖、凋亡、侵袭转移相关基因谱,结果见图7。
基因芯片结果显示有12种酪氨酸激酶(STK1,EPHA2,AXL,ROR1,ABL2,MET,FYN,WEE1,PLK4,TTK,PRKX,MST1R)在3.75μM DCC-2036处理MDA-MB-231细胞30小时后发生了下调。结合DCC-2036的激酶抑制谱(表1,AXL IC50=42nM,FYN IC50=12nM,均小于100nM),推测AXL和FYN有可能是DCC-2036作用于TNBC的关键靶点。
进一步采用Real-time PCR的方法将3.75μM DCC-2036处理30小时后的细胞中RNA通过Trizol方法提取,RNA经反转录后进行AXL和FYN的定量PCR分析。荧光定量PCR通过罗氏公司的Light cycle 480进行检测。结果显示通过Real-time PCR检测发现DCC-2036处理MDA-MB-231细胞后AXL和FYN的mRNA水平下调,表明DCC-2036显著降低AXL和FYN mRNA水平,与芯片结果一致(图8)。
实施例6
为了明确DCC-2036对TNBC细胞与Luminal A细胞作用敏感性不同的原因,也进一步明确DCC-2306作用于TNBC的关键靶点,本发明采用Real-time PCR的方法对经DCC-2036处理的五种不同的细胞系进行AXL和FYN的定量PCR分析,其中MCF-7、T47D为Luminal A亚型乳腺癌细胞(ER+,PR+,HER2-),MDA-MB-231、HS-578T为Basal亚型/TNBC细胞(ER-,PR-,HER2-),MCF-10A为Basal亚型/三阴性乳腺非致瘤上皮细胞(ER-,PR-,HER2-)。同时采用免疫印迹法检测AXL的表达,结果见图9。
图9结果显示,AXL在Luminal A细胞中表达非常低,在TNBC细胞中的表达远远高于在Luminal A细胞和MCF-10A中的表达,同样,FYN在TNBC细胞中的表达也远高于在Luminal A细胞和MCF-10A中的表达,但是相差倍数不如AXL悬殊。
进一步采用Western Blot检测方法对乳腺癌细胞系的不同亚型中的AXL的磷酸化水平和总水平进行检测,具体方法为:将MDA-MB-231,HS-578T和MCF-7细胞经DCC-2036处理30小时,提取蛋白,定量后进行SDS-PAGE电泳、转膜、相应一抗和二抗孵育,抗体结合由化学荧光系统检测,β-actin作为内参,结果见图10。
图10结果显示,DCC-2036处理MDA-MB-231和HS-578T细胞后AXL的磷酸化水平和蛋白总量均发生了下调,且磷酸化水平下降更快,但是DCC-2036处理MCF-7细胞后AXL的磷酸化水平和蛋白总量反而发生了上调。因此,推断AXL是DCC-2306作用于TNBC的关键靶点之一,其在不同亚型乳腺癌细胞中的表达差异也造成了细胞对DCC-2036的药物敏感性不同。
实施例7 DCC-2036在TNBC细胞中对AXL下游信号通路的影响。
采用免疫印迹分析DCC-2036在TNBC细胞中对AXL下游PI3K/Akt信号通路和NFκβ信号通路相关蛋白的改变。具体方法为以0μM、2.5μM、3.75μM、5μM浓度的DCC-2036处理MDA-MB-231和HS-578T细胞30小时后提取细胞中P-Akt,P-IkBα,P-p65及其总蛋白,定量后进行SDS-PAGE电泳、转膜、相应一抗和二抗孵育,抗体结合由化学荧光系统检测,β-actin作为内参,结果见图11。
结果显示,P-Akt、P-IκBα、P-P65、P65均发生下调,伴随IκBα激酶的上调,说明AXL下游的PI3K/Akt-NFκβ信号通路发生了下调。
进一步核质分离后进行IκBα和p65的重定位。具体方法为以0μM、3.75μM浓度的DCC-2036处理MDA-MB-231细胞30小时,然后通过免疫印迹检查细胞质(左)和核(右)提取物。肌动蛋白(actin)和层粘连蛋白B(LamininB)分别作为细胞质和核提取的标记物,结果见图12。
结果显示核质分离后DCC-2036抑制了IκBα的降解和p65的入核。同时,DCC-2036处理细胞后β-catenin的入核也减少。
实施例8:过表达AXL后DCC-2036对TNBC细胞的影响
分别用人AXL质粒或载体质粒GV143(上海吉凯公司)转染MDA-MB-231细胞,然后以0μM、5μM浓度的DCC-2036处理MDA-MB-231细胞30小时,消化收集的细胞,一部分用免疫印迹分析PARP和AXL的蛋白质的水平,另一部分用台盼蓝染色法检测细胞死亡率。其中台盼蓝染色法的具体方法为取少量消化收集的细胞与0.4%的台盼兰染液按照1:1混合,加入血球计数板,显微镜下蓝染的即为死细胞,计算死细胞的百分数。实验重复三次,取平均值,**P<0.01,结果见图13。
结果显示AXL过表达后PARP切割减少,表明AXL质粒转染TNBC细胞可减少DCC-2036在MDA-MB-231细胞中诱导的细胞凋亡。同时台盼蓝计数结果显示死亡细胞百分率减少,再一次证实AXL是DCC-2036作用于TNBC细胞的关键靶点之一。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种快速检测BCR/ABL基因融合的探针组、试剂盒及方法与流程
- 酪氨酸激酶抑制剂的制造方法与工艺
- 芳香族酰胺类衍生物、其制备方法及其在医药上的应用与制造工艺
- 包含5α‑还原酶抑制剂的药物组合物的制造方法与工艺
- 作为脾酪氨酸激酶抑制剂的二氮杂螺烷酮取代的噁唑衍生物的制造方法与工艺
- 包含热弹性感觉剂和TRPA1受体抑制剂的皮肤接合剃刮助剂的制造方法与工艺
- 检测EGFR耐药性突变的方法和组合物与制造工艺
- 5‑溴‑7‑氮杂吲哚啉‑2‑酮类化合物及其制备方法与制造工艺
- 3‑[(3‑{[4‑(4‑吗啉基甲基)‑1H‑吡咯‑2‑基]亚甲基}‑2‑氧代‑2,3‑二氢‑1H‑吲哚‑5‑基)甲基]‑1,3‑噻唑烷‑2,4‑二酮和EGFR TYR激酶抑制剂的组合的制造方法与工艺
- 一种抗癌药物的晶体化合物及其制备方法与制造工艺
- Flt3蛋白在制备肝癌对索拉菲尼疗效评估试剂盒中的应用
- 用于治疗癌症的雄激素受体抑制剂与akt抑制剂的组合的制作方法
- 一种药物中间体2-芳酰基吲哚衍生物的合成方法
- 一种作用于EGFR敏感突变激酶EGFR<sup>L858R</sup>,EGFR<sup>(d746-750)</sup>的6-取代氨基嘌呤类化合物及 ...的制作方法
- 一种6-溴喹啉的制备方法
- 一种基于巢式复合cold-pcr的t790m突变检测方法
- 具抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂irsf和irsh及其制备方法和应用
- 具抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂irsf和irsh及其制备方法和应用
- 一种多维替尼的制备方法
- 具有抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂nxgf和nxgh及其制备方法和应用