EGFR抑制剂在制备治疗MUC1阳性肿瘤药物中的应用的制作方法
本发明属于肿瘤治疗领域,更具体地讲,涉及靶向muc1-egfr-abcb1信号通路的抑制剂在制备治疗muc1阳性肿瘤药物中的应用。
背景技术:
肿瘤治疗往往伴随着耐药性和肿瘤复发,肿瘤细胞中atp结合蛋白家族成员(atpbindingcassette,abcs)的过表达是肿瘤细胞获得多药耐药能力而导致药物抵抗的主要原因。abcs是一类依赖于atp的转运蛋白,可选择性将底物包括药物从细胞内泵出细胞外。其中abcb1又称p-糖蛋白或多药耐药蛋白1(mdr1)常被发现在肿瘤中过表达。用于肿瘤治疗中的许多药物如紫杉醇(paclitaxel)、长春新碱(vincristine)、阿霉素(doxorubicin)和依托泊苷(etoposide)都是abcb1的底物。因此,abcb1过表达是导致肿瘤产生耐药的重要原因。
表皮生长因子受体(epidermalgrowthfactorreceptor,egfr)是一种酪氨酸激酶受体蛋白,属于erbb家族。egfr过表达或突变引起下游信号通路异常激活将导致细胞恶性转化,并通过调控atp结合蛋白家族成员abcb1和abcg2导致肿瘤细胞耐药。egfr抑制剂已广泛用于egfr阳性肿瘤的靶向治疗,尤其是应用于由于egfr异常激活的非小细胞肺癌(non-small-celllungcancer,nsclc)的靶向治疗。egfr的抑制剂的治疗是基于egfr基因的过表达或者突变激活,但是在宫颈癌和肺原发黏液表皮样癌中,egfr的突变并不常见,因此egfr的抑制剂尚未应用到宫颈癌和肺原发黏液表皮样癌的治疗中。
黏蛋白1(muc1)是一种约120-225kda的高分子量糖蛋白,muc1基因全长约4kb,编码产物最初为单一的肽链形式,继而在内质网中被剪切为n端亚基和c端亚基,二亚基在细胞膜上形成稳定的异源二聚体。n端亚基约含1000-2200个氨基酸,由20个氨基酸为单位的重复序列组成,c端亚基包括58个氨基酸的胞外功能域、28个氨基酸的跨膜功能域和72个氨基酸的胞内功能域(muc1-cd)。muc1广泛表达于呼吸系统、消化系统、生殖系统等分泌型上皮细胞管腔表面,以防止细胞脱水、受外界ph变化、细菌、病毒及粉尘颗粒或污染等损伤。临床研究发现在70%以上的nsclc中,muc1异常高表达(其表达水平达正常细胞的50-100倍)与nsclc的恶性程度及治疗预后不良呈正相关。更有临床研究报道muc1表达在nsclc早期就有相关性。此外,muc1在细胞中的异常分布即去极性表达模式亦与nsclc的发展程度、肿瘤的大小及淋巴结的转移密切相关。一项基于细胞系和临床样本的基因表达芯片研究表明,muc1调控的基因表达模式可能作为判断nsclc患者预后的标志物。近期有研究报道muc1在肺腺癌中过表达与paclitaxel耐药相关。在宫颈癌中muc1可独立或者联合其他标志蛋白作为组织学及恶性程度的鉴定指标,已经有文献报道在正常的宫颈鳞状上皮细胞内muc1不表达,在具有炎症的宫颈鳞癌上皮和宫颈鳞状癌中表达,且在宫颈鳞状癌组织中muc1的表达与浸润程度成正相关。同时文献报道muc1与muc16一起可以共同作为宫颈腺癌预后的指标。
世界范围内,宫颈癌对女性而言是重要的健康问题,在女性中是第四常见肿瘤。最新统计全球每年新增53万宫颈癌患者,每年有26.6万患者死亡。85%的宫颈癌发生在发展中国家,在中国,宫颈癌情况不容乐观,全国每年新增13.15万的患者,死亡人数有3.3万人。
宫颈癌起源于子宫颈,主要分为(1)鳞状细胞癌(squamouscellcarcinoma):包括非角化鳞癌,角化鳞癌,疣状鳞癌等;(2)腺癌(adenocarcinoma):包括内膜样腺癌、粘液腺癌、透明细胞癌、浆液性腺癌;(3)其他类型:腺样囊腺癌、腺鳞癌、小细胞未分化癌、类癌等。其中鳞状细胞癌约为80-85%,腺癌约占15%,但是腺癌的发生比例在逐步增加。
早期宫颈癌以化疗为主,进展期以放化疗为主,一线化疗药物以顺铂,卡铂,紫杉醇为或顺铂/紫杉醇,卡铂/紫杉醇联合治疗。但是传统治疗策略无靶向治疗且副作用特别大,且进展期及复发的后的宫颈癌对化疗药物具有耐药性,1年存活率仅为20%或者更低。
2015年世界卫生组织(worldhealthorganization,who)公布的肿瘤的死亡率是880万,其中肺癌占169万,肺癌是最常见的原发性恶性肿瘤,是导致死亡人数最高的肿瘤。且伴随着工业化进程导致环境改变以及生活方式的改变,肺癌的发病率每年都在增加,且由于肺癌早期诊断较难,且治疗手段有限导致死亡率也不断上升。
绝大部分肺癌起源于支气管粘膜上皮,又称支气管肺癌。肺癌主要分为小细胞肺癌(smallcelllungcancer,sclc)和非小细胞肺癌(non-smallcelllungcancer,nsclc)两大类,非小细胞肺癌又分为鳞癌(squamous-cellcarcinoma),腺癌(adenocarcinoma)和大细胞肺癌(large-cellcarcinoma)等不同类型。
肺黏液表皮样癌是一种比较罕见的涎腺型恶性肿瘤,主要发生在支气管,分为低分化和高分化,以手术治疗为主。有研究可用卡铂联合长春瑞滨或卡铂联合紫杉醇治疗高分化的肺黏液表皮样癌。
技术实现要素:
本发明的第一个目的在于提供靶向muc1-egfr-abcb1信号通路的抑制剂与abcb1底物化疗药物联合用药在制备治疗muc1阳性肿瘤药物中的应用。
本发明的第二个目的在于提供muc1抑制剂在制备治疗muc1阳性肿瘤药物中的应用。
为实现本发明第一个目的,本发明公开以下技术方案:靶向muc1-egfr-abcb1信号通路的抑制剂与abcb1底物化疗药物联合用药在制备治疗muc1阳性肿瘤药物中的应用,其特征在于,所述靶向muc1-egfr-abcb1信号通路的抑制剂是指muc1抑制剂、egfr抑制剂和abcb1抑制剂中的一种或几种,所述muc1阳性肿瘤是指化疗药物能够激活muc1-egfr-abcb1信号通路的肿瘤。
作为一个优选方案,所述肿瘤是指宫颈癌、肺黏液表皮样癌、卵巢癌、胃癌和胰腺癌。
作为一个优选方案,所述muc1抑制剂是指抑制muc1表达的方法shrna或抑制muc1功能的muc1抑制剂go203。
作为一个优选方案,所述egfr抑制剂是指吉非替尼、厄洛替尼、埃克替尼、凡德他尼、拉帕替尼、来那替尼、阿法替尼、培利替尼、达克替尼、卡纳替尼、西妥昔单抗和帕尼单抗,或它们的药学上可接受的盐。
作为一个优选方案,所述abcb1抑制剂是指抑制abcb1表达的方法shrna或抑制abcb1功能的abcb1抑制剂维拉帕米。
作为一个优选方案,所述abcb1底物化疗药物是指紫杉醇、长春新碱、阿霉素或依托泊苷。
为实现本发明第二个目的,本发明公开以下技术方案:muc1抑制剂在制备治疗muc1阳性肿瘤药物中的应用,其特征在于,所述muc1阳性肿瘤是指化疗药物能够激活muc1-egfr-abcb1信号通路的肿瘤。
作为一个优选方案,所述muc1抑制剂是指抑制muc1表达的方法shrna或抑制muc1功能的muc1抑制剂go203。
作为一个优选方案,所述肿瘤是指宫颈癌、肺黏液表皮样癌、卵巢癌、胃癌和胰腺癌。
本发明的优点在于:本发明揭示了在muc1阳性肿瘤中,化疗药物诱导muc1表达并激活muc1-egfr-abcb1信号通路,最终导致细胞将药物泵出膜外而产生耐药的分子机制,发现化疗的同时靶向抑制egfr可有效抑制muc1阳性肿瘤细胞增殖、控制移植瘤的生长,并有效阻止了移植瘤的复发。提示靶向muc1-egfr-abcb1信号通路的抑制剂与abcb1底物化疗药物联合用药在制备治疗muc1阳性肿瘤药物中的应用具有广阔的前景。
附图说明
图1.hela229细胞内沉默muc1后耐药性检测。(a)通过转入不同的shmuc1片段进行muc1基因沉默;通过westernblot检测基因沉默效果。(b-e)hela229/shctl和hela229/shmuc1细胞在不同浓度的paclitaxel(b),vincristine(c),doxorubicin(d),etoposide(e)处理48小时,通过cck8检测细胞的活率。(f)hela229/shctl和hela229/shmuc1细胞经paclitaxel处理48小时后,流式检测凋亡情况。(g)hela229/shctl和hela229/shmuc1细胞用vincristine处理48小时后,流式检测凋亡情况。
图2.muc1在肿瘤细胞内形成获得性耐药的过程中表达上调。(a)q-pcr检测hela229细胞在不同浓度paclitaxel处理48小时后muc1的mrna表达水平。(b)westernblot检测hela229细胞在不同浓度paclitaxel处理48小时后muc1的蛋白表达水平。(c)q-pcr和westernblot检测hela229和hela229/tr细胞内muc1的mrna(左图)和蛋白水平(右图)。(d)q-pcr和westernblot检测nci-h292和nci-h292/tr细胞内muc1的mrna(左图)和蛋白水平(右图)。(e)westernblot检测hela229/tr细胞muc1沉默效果。(f)hela229/shctl、hela229/shmuc1细胞按照6000/孔接种于96孔板内,第二天给予不同浓度的紫杉醇处理,48小时后通过cck8assay检测细胞活率。(g)westernblot检测nci-h292/tr细胞muc1沉默效果。(h)nci-h292shctl、nci-h292shmuc1细胞按照10000/孔接种于96孔板内,第二天给予不同浓度的紫杉醇处理,48小时后通过cck8assay检测细胞活率。
图3.muc1通过调控abcb1而导致耐药。(a)q-pcr和westernblot检测hela229和hela229/tr细胞内abcb1的mrna和蛋白水平。(b)q-pcr和westernblot检测nci-h292和nci-h292/tr细胞内abcb1的mrna和蛋白水平。(c)左图q-pcr检测hela229/tr/shctl和hela229/tr/shmuc1细胞内abcb1mrna的表达。β-actin为内参。右图westernblot检测hela229/tr/shctl和hela229/tr/shmuc1细胞abcb1蛋白表达。(d)左图q-pcr检测nci-h292/tr/shctl和nci-h292/tr/shmuc1细胞内abcb1mrna的表达。β-actin为内参。右图westernblot检测nci-h292/tr/shctl和nci-h292/tr/shmuc1细胞中abcb1蛋白表达。(e)cck8检测联合使用abcb1抑制剂verapamil和paclitaxel对hela229/tr细胞的细增殖的影响。(f)cck8检测联合使用abcb1抑制剂zosuquidar和paclitaxel对hela229/tr细胞的细增殖的影响。(g)cck8检测联合使用abcb1抑制剂verapamil和paclitaxel对nci-h292/tr细胞的细增殖的影响。(h)cck8检测联合使用abcb1抑制剂zosuquidar和paclitaxel对nci-h292/tr细胞的细增殖的影响。
图4.muc1激活egfr并诱导其入核调控abcb1。(a)hela229/shctl及hela229/shmuc1细胞用paclitaxel(10nm)和erlotinib(5μm)处理72小时。westernblot检测abcb1、egfr磷酸化、egfr以及muc1表达水平。(b)hela229/tr用erlotinib(20μm)处理48小时,westernblot检测abcb1、egfr磷酸化、egfr以及muc1表达水平。(c)nci-h292/tr用erlotinib(10μm)处理48小时,westernblot检测abcb1、egfr磷酸化、egfr以及muc1表达水平。(d上)hela229/tr用erlotinib(20μm)处理48小时,q-pcr检测abcb1mrna表达水平。(d下)nci-h292/tr用erlotinib(10μm)处理48小时,q-pcr检测abcb1mrna表达水平。(e)hela229细胞用5μmerlotinib和10nmpaclitaxel处理12小时后,免疫荧光检测egfr和muc1-c的定位情况。dapi用于细胞核的染色。
图5.egfr抑制剂erlotinib抑制耐药株对药物的耐药性。(a)联合使用erlotinib和paclitaxel处理hela229和hela229/tr细胞48小时,cck8检测细胞活率。(b)联合使用erlotinib和paclitaxel处理nci-h292和nci-h292/tr细胞48小时,cck8检测细胞活率。
图6.erlotinib与paclitaxel联用阻止移植瘤的生长与复发。(a)在6周的雌性裸鼠腋下皮下接种2.5x106个hela229/shctl和hela229/shmuc1细胞,等到肿瘤体积大于4mmx4mm时将小鼠随机分成2组,一组为对照组给pbs,一组给予40mg/kgpaclitaxel治疗,每三天给药一次,并记录肿瘤大小,给药15天,然后观察30天。肿瘤体积v=length*width2/2,bar值为每组6只s.e.m值。(b)第45天小鼠肿瘤拍照。(c)小鼠组织tunel染色检测凋亡。(d)在雌性裸鼠皮下接种2.5x106个hela229/shctl和hela229/shmuc1细胞,等到肿瘤长到4mmx4mm后,将hela229/shctl细胞分为6组,hela229/shmuc1细胞则分为2组,分别给予相应治疗。每三天给药,并使用游标卡尺测量肿瘤大小。给药15天后,继续观察21天,取出肿瘤拍照。
图7.联合使用egfr的抑制剂geftinib,erlotinib增加化疗药物的对肿瘤细胞的增殖抑制作用。(a)联合使用geftinib和paclitaxel,通过cck8检测不同天hela229细胞的增殖情况。(b)联合使用geftinib和vincristine,通过cck8检测不同天hela229细胞的增殖情况。(c)联合使用geftinib和etoposide,通过cck8检测不同天hela229细胞的增殖情况。(d)联合使用geftinib和doxrubucin,通过cck8检测不同天hela229细胞的增殖情况。(e)联合使用erlotinib和paclitaxel,通过cck8检测不同天hela229细胞的增殖情况。(f)联合使用erlotinib和vincristine,通过cck8检测不同天hela229细胞的增殖情况。(g)联合使用erlotinib和etoposide,通过cck8检测不同天hela229细胞的增殖情况。(h)联合使用erlotinib和doxrubucin,通过cck8检测不同天hela229细胞的增殖情况。
图8.联合使用muc1的抑制剂g203增加化疗药物的对肿瘤细胞的增殖抑制作用。(a)联合使用g203和paclitaxel,通过cck8检测不同天hela229细胞的增殖情况。(b)联合使用g203和vincristine,通过cck8检测不同天hela229细胞的增殖情况。(c)联合使用g203和etoposide,通过cck8检测不同天hela229细胞的增殖情况。(d)联合使用g203和doxrubucin,通过cck8检测不同天hela229细胞的增殖情况。
图9.联合使用abcb1的抑制剂verapamil增加化疗药物的对肿瘤细胞的增殖抑制作用。(a)联合使用verapamil和paclitaxel,通过cck8检测不同天hela229细胞的增殖情况。(b)联合使用verapamil和vincristine,通过cck8检测不同天hela229细胞的增殖情况。(c)联合使用verapamil和etoposide,通过cck8检测不同天hela229细胞的增殖情况。(d)联合使用verapamil和doxrubucin,通过cck8检测不同天hela229细胞的增殖情况。
具体实施方式
下面结合具体实施例,进一步阐述本发明。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
(1)细胞株的培养:宫颈癌hela229细胞系和肺黏液表皮样癌细胞系nci-h292分别由中科院上海细胞库和上海富衡生物技术公司提供。hela229和nci-h292培养于rpmi1640(corning,ny,usa)中,含10%胎牛血清(fetalbovineserum,gibco,grandisland,ny,usa),同时添加100u/ml青霉素和100μg/ml链霉素。
(2)耐药株的构建:为了构建paclitaxel耐药株细胞,将hela229细胞株培养于含5nmpaclitaxel(paclitaxel,sigma-aldrich,st.louis,mo,usa)的培养基中连续培养3代后,将paclitaxel浓度提高至10nm,继续培养3代。之后提高paclitaxel浓度至15nm、20nm、25nm培养,最后维持在含25nm的paclitaxel的培养基中,形成耐药株hela229/tr。nci-h292细胞通过不同浓度的paclitaxel(2.5nm、5nm、10nm)分别处理3代后,维持在10nm的paclitaxel浓度中,形成耐药株nci-h292/tr。
(3)hela229/shctl及hela229/shmuc1稳转细胞株的构建:将细胞接种至6cm培养皿中(5×105/盘),约24小时后当细胞处于对数生长期(50-60%汇合)时,按x-tremegenehpdnatransfectionreagent(rocheappliedscience,basel,switzerland)说明书进行转染。具体如下:分别转染prnau6-ctl-shrna、prnau6-muc1-shrna-a及prnau6-muc1-shrna-b质粒各2μg加x-tremegenehp5ul。靶向muc1序列,prnau6-muc1-shrna-a:5’-aaggtaccatcaatgtccacg-3’,prnau6-muc1-shrna-b:5’-aagttcagtgcccagctctac-3。ctl-shrna序列为5’-cgcttaccgattcagaatgg-3’。细胞转染48h后用胰酶消化重悬,离心并将细胞沉淀接种于15cm培养皿中,用含500μg/mlg418的选择性rpmi1640培养基继续培养,视细胞的生长状况更换培养基,直到两周左右。待出现明显克隆后,将单克隆挑出移至24孔板中培养,待长满后扩盘,取一部分细胞保种培养,另一部分细胞收集蛋白行westernblot检测表达。筛选出的稳转细胞株用含500μg/mlg418的rpmi1640培养基维持培养。
(4)hela229tr/shmuc1及nci-h292tr/shmuc1细胞株构建:pgiz-puromycinlentiviralplasmids质粒来自thermoscientificopenbiosystemsgipzlentiviralshrnamirlibrary。目标序列为:shmuc1-1:5’-ccagcaccgactactacca-3’;shmuc1-2:5’-gaaatgtttttgcagattt-3’;shctl:5’-ctcgcttgggcgagagtaa-3’。shrna质粒与包装质粒(pm2gandpspax2)共同转染于292t细胞内,48小时后收集含病毒颗粒的上清,加入1μg/mlpolybrene(santacruzbiotechnology,santacruz,ca,usa),感染hela229/tr,nci-h292/tr细胞。48小时后,hela229/tr细胞通过3μg/mlpuromycin,nci-h292/tr细胞通过1.5μg/mlpuromycin进行稳转细胞系筛选1周。
(5)细胞增殖曲线:使用cellcountingkit(dojindo)简称cck8(cck-8/wst-8)试剂盒检测细胞数目。wst-8(化学名:2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2h-四唑单钠盐)在电子耦合试剂存在的情况下,可以被线粒体内的脱氢酶还原生成高度水溶性的橙黄色的甲臜产物(formazan),通过酶标仪检测450nm波长处检测吸光值,od值与细胞的增殖数目及药物处理后细胞活力成正比。通过cck8实验,可以通过相对od值间接反映活细胞数量和细胞活力。将细胞用胰酶消化、重悬后计数,96孔每孔接种1000个hela229,待细胞贴壁后,按照cck8说明书操作,每孔添加10ulcck8,培养箱培养2小时,使用酶标仪(synergyh4hybridreader,biotek)检测450nm的od值,每天相同时间检测od值,计算相对od值,代表相对生长速度。
(6)细胞药物活力检测实验:将细胞用胰酶消化后,重悬计数。hela229及hela229/tr细胞每孔接种6000个,nci-h292细胞每孔接种10000个,第二天贴壁后,轻轻吸取上清,加入含有不同浓度药物的培养基,继续培养48小时或更长时间,按时间点终止细胞生长,加入10μlcck8,37℃培养箱培养2h,通过酶标仪检测450nm的od值。细胞存活率计算方法如下:药物处理组od值/无药物对照组od值。第n天细胞药物中增殖率=第n天药物处理组od值/第0天药物处理组的od值。
(7)流式细胞凋亡检测:将细胞接种至6cm培养皿中(3×105/盘),每种细胞每个时间点分别种3盘。37℃,5%co2培养24小时,吸去培养基,加入含有10nmpaclitaxel的完全培养基,于5%co2细胞培养箱中37℃恒温培养,分别于24小时、48小时收集上清,并用不含edta的胰酶消化细胞,合并上清和消化所得细胞,1000rpm离心5min,重悬至流式管中,1ml冰浴pbs洗一次,离心同前。分别加入annexinv和pi进行染色,室温避光10分钟,用facscalibar(美国becktondickinson公司)流式细胞仪进行检测分析annexinv阳性、pi阴性细胞。
(8)免疫荧光实验操作:将盖玻片用酒精浸泡5min后,然后置于6孔板内,于无菌操作台内紫外照射30min以上,直至玻片上酒精完全风干。将细胞接种于6孔板内,第二天贴壁后进行相应处理,加入药物处理或者转染相应质粒。48小时后,轻轻吸去上清,用室温pbs2ml洗细胞一遍;用1ml4%多聚甲室温固定细胞30min,用室温pbs在摇床上洗5min;用4℃冰甲醇透化细胞10-20min;用室温pbs在摇床洗细胞三次,每次5分钟。在片子上加50ul的2%bsa室温处理1小时进行封闭,为防止蒸发,片子放于湿盒内。将封闭液吸干净后,孵育抗体。抗体按照说明书提供的稀释比例用2%bsa稀释。每张片子50ul,4℃湿盒孵育过夜。第二天将一抗吸干,pbs2ml在摇床上洗3次,每次5min;按照二抗说明书,一般1:5用2%bsa稀释,37℃湿盒内1-2小时,避光操作;将二抗吸干,pbs2ml摇床上洗3次,每次5min。在洗细胞期间,将所需使用的载玻片用酒精浸泡、擦干;在载玻片上滴上10μl的封片剂(含dapi染料vectashieldmountingmediumwithdapi,h-1200),然后将6孔板内的玻片倒置于玻片封片剂上。待其晾干后,用指甲油封片,可进行免疫荧光显微镜下观察。
(9)裸鼠荷瘤治疗实验:在2组4-6周雌性balb/c裸鼠皮下分别接种hela229/shctl-b和hela229/shmuc1-b细胞。细胞用pbs重悬、计数。每只ep管装1ml的细胞悬浮液,浓度为12.5x106的细胞,将ep管用封口膜封上,放入固体冰袋上,准备足够的1ml注射器。两组小鼠分别接种35只裸鼠,每只裸鼠接种200ul悬液含2.5x106个细胞。在每组裸鼠中有24只左右的肿瘤达到4mmx4mm的时候,随机分组,并进行编号,每组6只。称量每只裸鼠重量(裸鼠重量约在15-20g),记录,计算出给药体积。对照:pbs;治疗组:paclitaxel40mg/kg。paclitaxel为医用紫杉醇(四川太极制药有限公司)。每三天给药一次,并用游标卡尺测量最长直径(长),和最短直径(宽),并记录重量。体积为宽*宽*长/2。连续给药两周,制作生长曲线,停止给药后的两周取组织标本。
(10)裸鼠荷瘤联合治疗实验:在2组4-6周雌性balb/c裸鼠皮下分别接种hela229/shctl-b和hela229/shmuc1-b细胞。等到肿瘤体积达到4mmx4mm后,随机分组,hela229/shctl-b组分为6组,每组6只,hela229/shmuc1-b组分为两组,每组6只。hela229/shctl-b组6组:组1:pbs;组2:paclitaxel40mg/kg;组3:verapamil20mg/kg;组4:verapamil20mg/kg联合paclitaxel40mg/kg;组5:erlotinib50mg/kg;组6:erlotinib50mg/kg联合paclitaxel40mg/kg。hela229/shmuc1-b组分为2组:组1:pbs;组2:paclitaxel40mg/kg。paclitaxel为医用紫杉醇(四川太极制药有限公司),erlotinib购于selleckchemicals公司。每三天给药一次,并用游标卡尺测量最长直径(长),和最短直径(宽),并记录重量。体积为宽*宽*长/2。连续给药两周,制作生长曲线,停止给药后的三周取组织标本。
(11)统计学分析:文章所有数据均用平均值±标准误表示,统计学分析使用t-test,当p<0.05时定义为有显著统计学差异。
实施例1.muc1调控肿瘤细胞的化疗药物敏感性。
为了研究muc1在宫颈癌和肺黏液表皮样癌发生中的作用,我们首先在宫颈癌和肺黏液表皮样癌系hela229中转入prnau6.1-ctlshrna和两个prnau6.1-muc1shrna-a,prnau6.1-muc1shrna-b质粒,通过g418抗性筛选出阳性克隆,并通过westernblot检测muc1的表达。westernblot结果显示我们获得hela229/shctl和hela229/shmuc1各两株(图1a)。利用这四株细胞,我们分别检测了muc1在小细胞化疗常用药耐受性中的作用。结果显示,在paclitaxel(图1b)、长春新碱(vincristine)(图1c)、阿霉素(doxorubicin)(图1d)及依托泊苷(etoposide)(图1e)4种药物中,沉默muc1后hela229/shmuc1与hela229/shctl细胞相比细胞活率显著降低,即沉默muc1后上述化疗药物的敏感性增加。进一步对paclitaxel(图1f)和vincristine(图1g)两种药物诱导凋亡的检测发现,处理不同时间后,沉默muc1的细胞凋亡增加。所述结果说明沉默muc1导致hela229细胞对上述4种药物耐药性下降,敏感性增加。
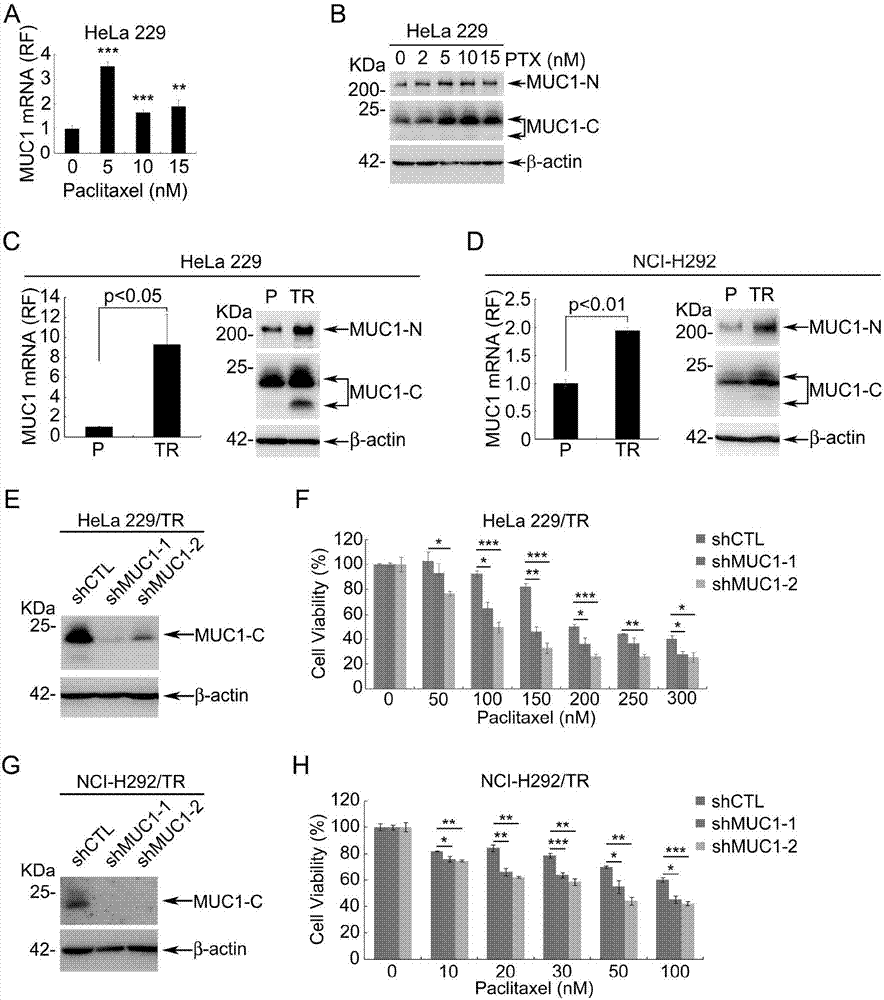
实施例2.muc1在肿瘤细胞形成获得性耐药的过程中表达上调。
为了证明muc1在肿瘤细胞中对化疗敏感性的调控作用,我们检测了在paclitaxel作用下,muc1的表达。结果显示,hela229细胞在短时间的paclitaxel作用下,muc1的mrna(图2a)和蛋白水平(图2b)都明显增加。我们进一步构建了paclitaxel耐药细胞株:hela229/tr和nci-h292/tr。对两株细胞的检测发现,与母本细胞株相比hela229/tr(图2c)和nci-h292/tr(图2d)细胞中muc1mrna和蛋白水平都明显增加。一方面说明化疗药物paclitaxel上调muc1mrna水平、进而增加muc1的蛋白表达,另一方面说明muc1可能是细胞耐药所必需的。为了证明这一推测,用含shmuc1的pgiz-puromycin慢病毒感染hela229/tr和nci-h292/tr细胞以沉默muc1基因,通过westernblot检测muc1蛋白水平(图2e、2g),加入不同浓度的paclitaxel处理48小时后,通过cellcountingkit(cck8)检测细胞存活率,结果显示不论是hela229/tr(图2e、2f)还是nci-h292/tr(图2g、2h)细胞沉默muc1后,细胞株对paclitaxel作用下的活率均出现下降。进一步证明muc1在肿瘤细胞中对paclitaxel敏感性的调控作用。
实施例3.muc1通过调控abcb1而导致耐药。
为了进一步研究muc1的耐药性机制,我们检测了与耐药性密切相关的abc家族蛋白成员abcb1的表达。结果显示,在hela229(图3a)和nci-h292(图3b)耐药株abcb1的mrna和蛋白表达水平都明显增加。用含shmuc1的pgiz-puromycin慢病毒感染hela229/tr和nci-h292/tr细胞以沉默muc1基因,通过q-pcr和westernblot检测了abcb1的mrna和蛋白表达水平。结果显示,沉默muc1后hela229/tr(图3c)和nci-h292/tr(图3d)的abcb1的mrna和蛋白表达下降,说明muc1直接调控abcb1的表达。为了进一步验证abcb1在细胞耐药中的作用,我们利用abcb1的抑制剂verapamil或zosuquidar与紫杉醇联合使用,检测对hela229/tr和nci-h292/tr细胞的抑制情况。结果表明,不论是verapamil(图3e、3g)或zosuquidar(图3f、3h)抑制abcb1后,耐药株hela229/tr(图3e、3f)和nci-h292/tr(图3g、3h)对紫杉醇的耐药性明显下降。
实施例4.muc1激活egfr并诱导egfr入核调控abcb1。
为了证明muc1对abcb1的调控作用与egfr的信号通路的关系,我们首先利用hela229/shctl和hela229/shmuc1细胞,观察egfr的抑制剂erlotinib作用下,paclitaxel诱导的abcb1的变化。结果如图4a所示:1)在hela229/shctl细胞中,erlotinib作用下,paclitaxel诱导的abcb1的上调被抑制;2)在muc1表达的hela229/shctl细胞中,egfr磷酸化在paclitaxel诱导下明显上升,提示在paclitaxel处理后muc1激活egfr;3)erlotinib不仅抑制了egfr磷酸化,还抑制了muc1的表达。进一步用erlotinib处理hela229/tr(图4b)和nci-h292/tr(图4c)细胞,可见erlotinib导致abcb1的蛋白水平显著下降。同时,通过q-pcr证明hela229/tr(图4d上)和nci-h292/tr(图4d下)细胞中,erlotinib抑制了abcb1的mrna水平。这些结果提示muc1激活egfr并增强了abcb1的转录调控。muc1是否影响了egfr的核定位呢?我们利用hela229细胞检测了paclitaxel对egfr细胞内定位的影响。结果发现,paclitaxel诱导了muc1和egfr进入细胞核,而抑制剂erlotinib有效地抑制了这一过程(图4e)。
实施例5.利用egfr抑制剂erlotinib抑制muc1-egfr-abcb1信号通路可有效抑制细胞增殖。
由于egfr抑制剂erlotinib能够抑制muc1和abcb1的表达,我们进一步研究erlotinib是否影响hela229和nci-h292细胞对paclitaxel的耐药性。在hela229和nci-h292细胞内,联合使用erlotinib和paclitaxel能够有效的抑制hela229/tr(图5a)和nci-h292/tr(图5b)耐药株细胞的增殖,增加了细胞对paclitaxel的敏感性。
实施例6.利用erlotinib与paclitaxel联用有效阻止移植瘤的生长和复发。
为了验证muc1在体内对宫颈癌和肺黏液表皮样癌耐药性的影响,我们在6周的雌性nudemice腋下皮下接种hela229/shctl和hela229/shmuc1细胞,等到肿瘤体积大于4mmx4mm时将小鼠随机分成2组,一组为对照组给pbs,一组给予40mg/kgpaclitaxel治疗,每三天给药一次,并记录肿瘤大小,给药15天,然后观察30天。结果发现,hela229/shctl肿瘤长得比hela229/shmuc1肿瘤快。在给药初期hela229/shctl肿瘤对paclitaxel敏感,表现为肿瘤生长抑制,但是给药停止后,肿瘤开始复发,且肿瘤平均增殖速度明显增加,而hela229/shmuc1肿瘤在paclitaxel处理后,体积明显减小至消失,后续观察中并未有肿瘤的复发(图6a、6b)。说明抑制muc1表达不仅抑制了肿瘤的生长,而且抑制了肿瘤的复发。tunel染色检测凋亡结果显示,paclitaxel治疗后hela229/shmuc1肿瘤凋亡明显增加(图6c)。
根据前述实验,erltotinib能在体外抑制muc1导致的paclitaxel耐药,为了进一步研究抑制剂在体内的情况,我们在裸鼠皮下接种hela229/shctl和hela229/shmuc1细胞,等到肿瘤长到4x4mm后,将hela229/shctl细胞分为6组,分别给予组1:pbs,组2:paclitaxel(40mg/kg),组3:verapamil(20mg/kg),组4:verapamil(20mg/kg)和paclitaxel(40mg/kg)联用,组5:erlotinib(50mg/kg),组6:erlotinib(50mg/kg)和paclitaxel(40mg/kg)联用。hela229/shmuc1细胞则分为2组,分别为组1:pbs,组2:paclitaxel(40mg/kg)。每三天给药,并使用游标卡尺测量肿瘤大小。给药15天后,继续观察21天,将小鼠实行安乐死后,取出肿瘤并拍照。结果显示,不论是paclitaxel、verapamil,还是erlotinib单独使用均不能抑制hela229/shctl肿瘤,而抑制muc1-egfr-abcb1中的任何一个环节,同时联用paclitaxel则能够有效抑制肿瘤生长和复发(图6d)。说明靶向抑制muc1-egfr-abcb1中的任何一个环节联合paclitaxel治疗肿瘤细胞能够提高muc1阳性宫颈癌细胞对paclitaxel的敏感性。
实施例7.利用muc1的抑制剂go203分别与四种化疗药物联用,有效抑制hela229细胞的增殖,效果优于任何一种化疗药物单用。
go203(g203)能够有效的抑制muc1-c端的二聚化,抑制muc1的功能,cp-2为对照肽段。我们通过药物增殖实验研究了muc1的抑制剂g203能否增加hela229细胞对化疗药物的敏感性。实验结果显示与联合使用cp-2相比,联合使用g203能够增加paclitaxel(图8a),vincristine(图8b),etoposide(图8c),doxrubucin(图8d)的对宫颈癌和肺黏液表皮样癌的生长抑制作用。
实施例8.利用egfr的抑制剂erlotinib和geftinib分别与四种化疗药物联用,有效抑制hela229细胞的增殖,效果优于任何一种化疗药物单用。
因为muc1通过egfr影响abcb1的表达降低hela229细胞对多种宫颈癌和肺黏液表皮样癌治疗药物的耐药性,我们进一步研究egfr的抑制erlotinib和geftinib对hela229细胞耐药性的影响。(图7a-d)显示在hela229细胞内联合使用egfr的抑制剂geftinib能够增加宫颈癌和肺黏液表皮样癌治疗药物paclitaxel(a),vincristine(b),etoposide(c),doxrubucin(d)对肿瘤细胞的增殖抑制作用。(图7e-h)显示在hela229细胞内联合使用egfr的抑制剂erlotinib能够增加宫颈癌和肺黏液表皮样癌治疗药物paclitaxel(e),vincristine(f),etoposide(g),doxrubucin(h)对肿瘤细胞的增殖抑制作用。说明抑制egfr的活性,能够有效抑制宫颈癌和肺黏液表皮样癌细胞对多种化疗药物的耐药性。
实施例9.利用abcb1的抑制剂维拉帕米(verapamil)分别与四种化疗药物联用,有效抑制hela229细胞的增殖,效果优于任何一种化疗药物单用。
由于muc1通过影响abcb1的表达水平降低导致宫颈癌和肺黏液表皮样癌的耐药性降低,我们进一步研究直接抑制abcb1是否能够增加宫颈癌和肺黏液表皮样癌对多种化疗药物的敏感性。实验显示,联合使用abcb1的抑制剂verapamil能够增加宫颈癌和肺黏液表皮样癌治疗药物paclitaxel(a),vincristine(b),etoposide(c),doxrubucin(d)对肿瘤细胞的增殖抑制作用。
结论:
1、利用egfr抑制剂erlotinib与紫杉醇(paclitaxel)联用治疗muc1阳性的宫颈癌和肺黏液表皮样癌。肿瘤细胞发生化疗药物耐受是导致宫颈癌和肺黏液表皮样癌治疗失败的主要原因,本发明利用宫颈癌和肺黏液表皮样癌细胞系研究耐药细胞的变化特征,以揭示宫颈癌和肺黏液表皮样癌细胞内导致耐药发生的信号转导的分子机制,并寻找有效的、针对性治疗方案。我们发现muc1在宫颈癌和肺黏液表皮样癌中与药物敏感性呈负相关,在宫颈癌和肺黏液表皮样癌接受化疗处理并形成获得性耐药的过程中表达上调。muc1表达上调后进一步激活egfr并与之相互作用,通过调控abcb1而导致细胞对药物抵抗。利用egfr抑制剂erlotinib不仅抑制化疗药物诱导的muc1上调以及egfr磷酸化,并且抑制abcb1的表达水平(图4)。利用erlotinib与化疗药物联合处理肿瘤细胞,不仅能有效抑制细胞增殖(图5),控制移植瘤的生长(图6),而且有效阻止了移植瘤的复发(图6)。
2、利用egfr抑制剂erlotinib与四种abcb1底物化疗药物:紫杉醇(paclitaxel)或长春新碱(vincristine)或阿霉素(doxorubicin)或依托泊苷(etoposide)联用治疗muc1阳性的宫颈癌和肺黏液表皮样癌(图7e-h)。
3、利用egfr其他抑制剂例如gefitinib与abcb1底物化疗药物:紫杉醇(paclitaxel)或长春新碱(vincristine)或阿霉素(doxorubicin)或依托泊苷(etoposide)联用治疗muc1阳性的宫颈癌和肺黏液表皮样癌(图7a-d)。
4、利用抑制muc1表达的方法例如shrna与abcb1底物化疗药物:紫杉醇(paclitaxel)或长春新碱(vincristine)或阿霉素(doxorubicin)或依托泊苷(etoposide)联用治疗muc1阳性的宫颈癌和肺黏液表皮样癌(图1b-e)。
5、利用muc1抑制剂(例如go203)抑制muc1功能与abcb1底物化疗药物:紫杉醇(paclitaxel)或长春新碱(vincristine)或阿霉素(doxorubicin)或依托泊苷(etoposide)联用治疗muc1阳性的宫颈癌和肺黏液表皮样癌(图8a-d)。
6、利用muc1抑制剂(例如go203)抑制muc1功能单独可治疗muc1阳性的宫颈癌和肺黏液表皮样癌。
7、利用abcb1抑制剂与abcb1底物化疗药物:紫杉醇(paclitaxel)或长春新碱(vincristine)或阿霉素(doxorubicin)或依托泊苷(etoposide)联用治疗muc1阳性的宫颈癌和肺黏液表皮样癌(图9a-d)。
8、利用egfr抑制剂erlotinib、gefitinib与abcb1底物paclitaxel(paclitaxel)或长春新碱(vincristine)或阿霉素(doxorubicin)或依托泊苷(etoposide)联用治疗muc1阳性的其它肿瘤,如卵巢癌、胃癌、胰腺癌等。在这些肿瘤中,只要化疗药物能够激活muc1-egfr-abcb1信号通路,就可以用上述方法治疗。
9、抑制muc1表达和功能的方法例如shrna或抑制剂与abcb1底物紫杉醇(paclitaxel)或长春新碱(vincristine)或阿霉素(doxorubicin)或依托泊苷(etoposide)联用治疗muc1阳性的其它肿瘤,如卵巢癌、胃癌、胰腺癌等。在这些肿瘤中,只要化疗药物能够激活muc1-egfr-abcb1信号通路,就可以用上述方法治疗。
10、抑制abcb1表达和功能的方法例如shrna或抑制剂与abcb1底物紫杉醇(paclitaxel)或长春新碱(vincristine)或阿霉素(doxorubicin)或依托泊苷(etoposide)联用治疗muc1阳性的其它肿瘤,如卵巢癌、胃癌、胰腺癌等。在这些肿瘤中,只要化疗药物能够激活muc1-egfr-abcb1信号通路,就可以用上述方法治疗。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
sequencelisting
<110>上海交通大学医学院
<120>egfr抑制剂在制备治疗muc1阳性肿瘤药物中的应用
<130>/
<160>6
<170>patentinversion3.5
<210>1
<211>21
<212>dna
<213>人工合成
<400>1
aaggtaccatcaatgtccacg21
<210>2
<211>21
<212>dna
<213>人工合成
<400>2
aagttcagtgcccagctctac21
<210>3
<211>20
<212>dna
<213>人工合成
<400>3
cgcttaccgattcagaatgg20
<210>4
<211>19
<212>dna
<213>人工合成
<400>4
ccagcaccgactactacca19
<210>5
<211>19
<212>dna
<213>人工合成
<400>5
gaaatgtttttgcagattt19
<210>6
<211>19
<212>dna
<213>人工合成
<400>6
ctcgcttgggcgagagtaa19
- 还没有人留言评论。精彩留言会获得点赞!
- 用于提高蛋白质稳定性和产量的方法以及可用于生产这种稳定蛋白质的细胞系的制作方法
- <sup>18</sup>F标记肿瘤抑制剂Monastrol的前体化合物及制备方法和用途的制作方法
- 一种新的多肽——生长抑制因子ING1s10.01和编码这种多肽的多核苷酸的制作方法
- 具有细胞凋亡诱导效应的吲哚衍生物的制作方法
- 杂环基吡啶基磺酰胺衍生物,它们的制备和作为药剂的应用的制作方法
- 能提高p53活性的有取代哌啶及其用途的制作方法
- 一种使用[2+4]第尔斯-阿尔德反应制备环己烷羧酸的方法
- 一种抗肿瘤多药耐药抑制剂色满和色烯衍生物及其制备方法和应用的制作方法
- 酪氨酸蛋白激酶抑制剂的制作方法
- 红霉素衍生物及其作为肿瘤细胞增殖抑制剂的用途的制作方法
- 一种RNA抑制剂及其在肿瘤中的应用的制作方法与工艺
- 固氮鱼腥藻细胞受ALS抑制剂类除草剂损伤的修复方法与流程
- 一种修复细胞DNA损伤的抑制剂及其制作方法和应用与流程
- 一种修复细胞DNA损伤的抑制剂及其制作方法和应用与流程
- TLR3抑制剂在制备防治肿瘤转移产品中的应用的制作方法与工艺
- 一种提高酵母细胞对复合抑制剂耐受能力的方法与流程
- 免疫检查点抑制剂在中枢神经系统肿瘤中的用途的制造方法与工艺
- 作为MIDH1抑制剂用于治疗肿瘤的1‑环己基‑2‑苯基氨基苯并咪唑的制造方法与工艺
- 具有细胞渗透性的BCL‑XL抑制剂的抗体药物缀合物的制造方法与工艺
- 用于增强干细胞功能的内含抑制素纳米粒子制剂、以及含有其的功能增强干细胞及其制备方法与流程
- 一种靶向锚定剂及其制备方法和应用与流程
- 一种超低分子量插层抑制剂及其制备方法与流程
- 具有胶原特异结合能力的神经再生抑制分子的拮抗蛋白CBD-PlexinB1LBD及应用的制作方法与工艺
- 具有胶原特异结合能力的神经再生抑制分子的拮抗蛋白CBD-EphA4LBD及应用的制作方法与工艺
- 一种KDM1A小分子抑制剂在抑制肿瘤细胞生长和转移中的应用的制作方法与工艺
- 一种抑制多药耐受基因表达的靶向抗肿瘤纳米药物的制作方法与工艺
- MALT1靶向抑制物在制备MALT1依赖性肿瘤治疗药物中的应用的制作方法与工艺
- 作为ASGPR靶向剂的被取代的‑6,8‑二氧杂双环[3.2.1]辛烷‑2,3‑二醇化合物的制作方法与工艺
- 小分子C‑Myc抑制剂的制作方法与工艺
- 一种RNA抑制剂及其在肿瘤中的应用的制作方法与工艺