一种达玛烷类化合物制备方法及其抗肿瘤用途与流程
本发明属于药物化学研究领域。具体涉及一种化学合成的四环三萜类化合物20(R)-达玛烷-[12-β-羟基-20,25-环氧]-3-O-β-D-吡喃葡萄糖苷。英文名:
20(R)-Dammarane-[12-beta-ol-20,25-epoxy]-3-O-beta-D-glucopyranside(简称:20(R)-DEG),其制备方法及其抗肿瘤的用途。
技术背景
含有手性的化合物药物,其对映体的活性和毒性常有巨大的差异,往往其R型具高效、低毒,而其S型则低效(或无效)高毒,反之亦然。手性化合物及其药物的例子不胜枚举。因此在国内外新药研究中,手性化合物的拆分,是常见的创新点,具有重要意义。
本发明人在追踪研究三七抗肿瘤的活性皂苷的过程中,从三七叶中分离得到一个四环三萜单体化合物:达玛烷-[12-羟基-20,25-环氧基]-3-O-β-D-吡喃葡萄糖苷(简称:DEG),并申请了中国发明专利(申请号:CN 201510067046.X)。该化合物于1993年由赵平等从三七根中分离得到的[1.云南植物研究1993:15(4):409-412]。鉴于天然DEG含量很低,为了扩大药物来源,发明人对DEG进行了化学合成。
发明人在研究合成DEG的过程中,发现它是一个外消旋体,是由C20甲基所产生的光学异构体混合体物。
在以往的记载中,均没有查到关于DEG光学异构体的陈述,也没有关于DEG的C20甲基导致DEG光学异构体的记载。
技术实现要素:
本发明公开了一种DEG的光学异构体,即:式I,20(R)-达玛烷-[12-β-羟基-20,25-环氧]-3-O-β-D-吡喃葡萄糖苷。英文名:
20(R)-Dammarane-[12-beta-ol-20,25-epoxy]-3-O-beta-D-glucopyranside,简称20(R)-DEG。
DEG经以往的C18HPLC检测,呈现单一正态峰,但经手性柱HLPC检测,则呈现2个峰,表明为存在手性化合物。随将DEG经手性柱HPLC拆分,得到了20(R)-DEG和另一个分子量与其相同,可能是其对映体的化合物。体外细胞实验和动物实验均证明,20(R)-DEG具有较好的抗癌活性。
具体地,发明人是通过下述方法实现发明的:
A.DEG合成。
参考刘惟瑳等[2.沈阳药学院学报1988:5(1):14-15]的合成方法,将4乙酰溴代beta-D葡萄糖与达玛烷-3β,12β-二醇,在碳酸银催化下缩合,得到达玛烷-[12-beta-羟基-20,25-环氧]-3-O-beta-D-四乙酰葡萄糖苷,再脱去保护基,得到DEG。合成路线如下:
B.DEG拆分。
DEG的手性拆分是用DAICELAD-H手性柱得以实现的。将涂敷直链淀粉-三(3,5-二甲苯基氨基甲酸酯)硅胶为填料的半制备型手性柱,以正己烷/异丙醇/二乙胺=80/30/0.1→30/15/0.1作为流动相,用示差折光检测器检测,进行HPLC拆分。在此手性分离系统,DEG得到了良好的分离,并获得高纯度20(R)-DEG,如下式:
C.20(R)-DEG结构确证。
通过对20(R)-DEG的核磁共振1H-NMR和13C-NMR的解析,及其HMBC,HMQC, NOESY的综合解析。确证了20(R)-DEG的结构及其立体构型。综合解析的研究结果表明,20(R)-DEG与DEG在C17,C18,C21,C23,C27等存在着较大的差异,其他C则高度重合。
D.20(R)-DEG抗癌活性。
药理学体外细胞水平抑瘤实验是用MTT法完成的;而整体动物体内抑瘤实验,则是用NU/NU雌性裸鼠完成的。体内外药理实验结果表明,20(R)-DEG抗癌效果明显地好于DEG,从而证明DEG的抗癌活性主要来自于20(R)-DEG。
综上所述,本发明的目的之一,是阐述20(R)-DEG制备方法及其结构。本发明目的之二,是阐述20(R)-DEG的抗癌作用及其医药用途。
附图说明
图1DEG手性柱HPLC色谱图。
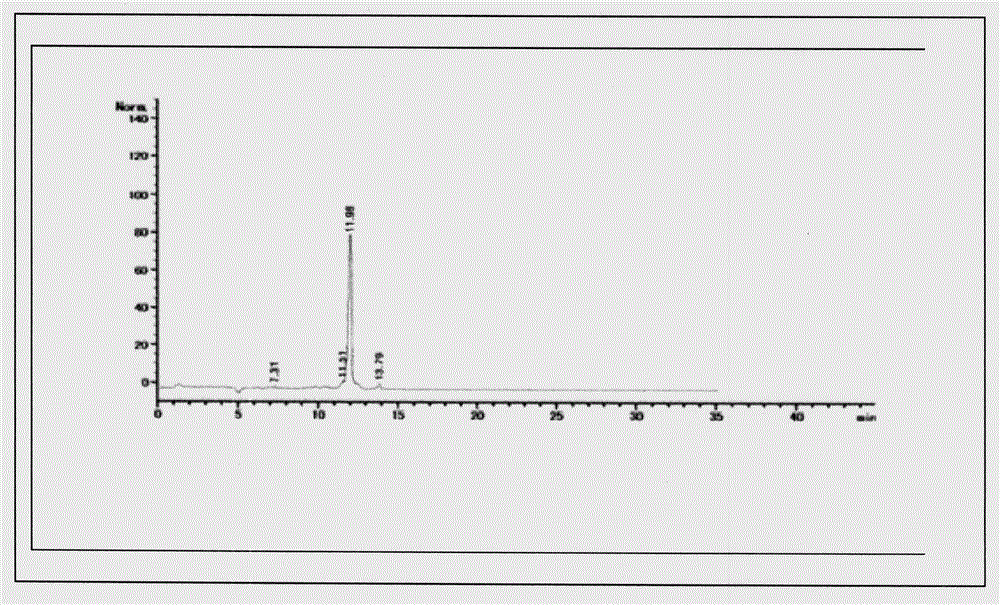
图2 20(R)-DEG色谱图
具体实施方式
实施例1
DEG的合成:
分别取达玛烷-3β,12β-二醇,英文:dammarane-3beta,12beta-diol(又名:人参二醇,成都曼斯特生物科技有限公司)820mg和四乙酰溴代葡萄糖(阿法埃莎<天津>化学有限公司)1420mg置于反应瓶中,再取30ml无水乙醚和10ml二氯甲烷溶解置于同一反应瓶中,在35℃恒温搅拌令其溶解,再加入1580mg AgCO3,在避光条件下35℃恒温反应8小时,过滤,滤液<45℃减压浓缩得到反应产物。反应产物经过硅胶柱层析,洗脱剂用氯仿/甲醇/水=60/10/1→15/10/1得到达玛烷-[12-beta-羟基-20,25-环氧]-3-O-beta-D-四乙酰溴代葡萄糖苷450mg。
将达玛烷-[12-beta-羟基-20,25-环氧]-3-O-beta-D-四乙酰溴代葡萄糖苷450mg置于反应容器中,溶解于5ml甲醇中,在常温下搅拌,慢慢滴加蒸馏水至微浑浊,再加入10ml三乙胺,继续搅拌反应5小时,反应产物常温减压浓缩后再次经过硅胶柱层析,用氯仿/乙酸乙酯/甲醇=40/5/4洗脱,分别接取流份,得到产品DEG(达玛烷-[12-β-羟基-20,25-环氧]-3-O-β-D-吡喃葡萄糖苷)167mg。
DEG的数据如下:
13C NMR(400MHz,C5D5N):
δ39.1,26,8,88.7,40.1,56.2,18.5,35,7,37.0,50.2,39.7,31.3,70.3,49.7,51.4,31.2,25.3,55.0,16.7,16.4,77.1,27.4,35.8,30.0,36.6,73.1,33.3,19.7,28.2,15.8,17.3,107.0,75.7,78.871.9,78.4,63.1。
1H MNR(400MHz,C5D5N):
1.48,3.75,1.26,1.94,0.98,0.89,1.23,1.25,1.19,0.951.03,0.88,δ4.89。
实施例2
DEG的拆分:
将DEG,经过手性柱检测,出现2个峰(见附图1)。随用半制备手性柱对DEG进行拆分。具体地说,是经过下述方法完成的。
色谱条件:美国Agilent 1260型高效液相色谱工作站;
色谱柱:DAICELAD-H,20×250mm,5μm;(购于北京绿百草科技发展有限公司,日本大赛璐公司出品)
检测波长:206nm
流动相:正己烷/异丙醇/二乙胺=80/30/0.1→30/15/0.1,在40min内运行完梯度。
流速:2.0ml/min
柱温:35℃
进样体积:200μl
方法:将DEG溶解甲醇,配成1mg/ml甲醇溶液,上述系统进行制备分离,按峰收集,得到20(R)-DEG(见附图2)。
实施例3
20(R)-DEG的结构鉴定:
20(R)-DEG为类白色粉末。mp168~169℃;IR(cm-1) 3410,3243,2955,2932,1452,1389;FAB-MS(m/z),623[M+H]+,主要碎片峰495[623-128(C8H16O,侧链)]+,461[623-162(Glc)]+,提示有一个6碳糖,据此推测其分子量为622,分子式为C36H62O8;20(R)-DEG的13C NMR、1H MNR、HMBC,HMQC、NOE谱经和DEG数据比对,在C17,C21,C23,C27存在着较大的差别。另外,C21-H分别和C13-H与C18-H存在NOESY。经过对核磁图谱的综合解析碳氢归属相关,确定了20(R)-DEG的立体结构。
20(R)-DEG核磁光谱的碳氢归属及其相关关系如下:
13C NMR(400MHz,C5D5N,C位):δ39.1(C1),26,8(C2),88.7(C3),40.1(C4),56.4(C3),18.5(C6),35,9(C7),39.7.0(C8),50.2(C9),37.1(C10),31.8(C11),70.3(C12),49.7(C13),51.4(C14),31.4(C15),25.4(C16),55.0(C17),15.8(C18),16.4(C19),76.9(C20),19.6(C21),35.8(C22),16.4(C23),36.5(C24),73.1(C25),33.2(C26),27.3(C27),28.2(C28),16.8(C29),17.3(C30),106.9(Cg1),75.8(Cg2),78.7(Cg3)71.8(Cg4),78.4(Cg5),63.1(Cg6)
1H MNR(400MHz,C5D5N,C位):4.04(2H,m,C1),4.25(2H,m,C2),3.37(1H,dd,C3),0.83(1H,C5),1.47(2H,m,C6),1.34(2H,m,C7),1.48(1H,m,C9),2.10(2H,m,C11),3.76(1H,m,C12),1.78H,m,C13),1.46(2H,m,C15),1.76(2H,m,C16),2.00(1H,m,C17),0.99(3H,s,C18),0.89(3H,s C19),1.21(3H,s C21),1.16(2H,m,C22),1.53(2H,m,C23),1.34(2H,m,C24),1.25(3H,s,C26),1.21(3H,s,C27),1.22(3H,s,C28),1.03(3H,s,C29),0.88(3H,s,C30),6.03(1H,s,12-OH),δ4.90(1H,d,J=7.8Hz,Cg1)。
HMBC(400MHz,C5D5N,C位):C1-H(C2,C3,C5,),C2-H(C1,C3,C4),C3-H(C1,C28,C29,),C5-H(C1,C28,C29,),C6-H(C5,C8,),C7-H(C5,C8,C19,),C9-H(C11,C14,C18,),C11-H(C8,C12,C13,),C12-H(C11),C13-H(C12,C14,C17),C15-H(C16,C30),C16-H(C14,C15,C17),C17-H(C13,C16,C20,C21,C22),C18-H(C7,C9),C19-H(C1,C4,C9),C20-H(C17,C20,C22),C22-H(C20,C25),C23-H(C20),C24-H(C23,C26,C27),C26-H(C24,C27),C27-H(C22,C24,),C28-H(C3,C5,C29),C29-H(C3,C4,C28),C30-H(C14,C15)。
HMQC(400MHz,C5D5N,C位):C3-H(C3),C5-H(C5),C13-H(C13),C19-H(C19),C21-H(C21),C26-H(C26),C27-H(C27),C28-H(C28),C29-H(C29),C30-H(C30),Cg1-H(Cg1),Cg2-H(Cg2),Cg3-H(Cg3),Cg4-H(Cg4),Cg5-H(Cg5),Cg6-H(Cg6)。
NOESY(400MHz,C5D5N,C位):当照射C21-H时,C13-H和C18-H都有明显加强,表明具有NOE效应。如下:
实施例4
20(R)-DEG体外对肿瘤细胞的抑制作用:
用MTT方法在,人转移性结肠癌细胞(SW620),人胃腺癌细胞(BGC-823),人非小细胞肺癌细胞A549,人乳腺癌细胞(MCF-7),人前列腺癌细胞(PC-3)等5种肿瘤细胞上,对20(R)-DEG的抗癌效果进行了评价,以多西紫杉醇和DEG作为对照药物,并进行抗癌效果的比较。
实验方法:取生长良好的细胞200μl加入96孔板中,置CO2培养箱中培养24小时。加入受试药物20μl/孔,培养48小时。再将20μl MTT加入96孔板中,反应4小时,吸去上清液,再加入20μl DMSO/孔,用酶联免疫检测仪在波长570nm处测定每孔的吸光值,测定药物对细胞的杀伤作用。计算药物抑制50%肿瘤细胞生长所需的浓度(IC50)。结果如下表1。
结果表明,在五个瘤株上均表现出,20(R)-DEG体外抗癌效果IC50浓度略高于多西紫杉醇,但明显低于DEG,以此判断DEG的抗癌活性主要源于20(R)-DEG。
表1:20(R)-DEG对五种癌细胞的抑制IC50值
实施例5
20(R)-DEG对躶鼠体内肿瘤细胞的抑制作用
为了评价20(R)-DEG对动物的抗癌活性,用整体动物裸鼠对其进行了评价。
实验方法:
动物:NU/NU雌性裸鼠,分组,每组10只。
移植肿瘤:取生长良好的细胞接种在前肢皮下,在移植肿瘤后第6~10天,肿瘤重量为100~300mg左右。
给药:腹腔注射隔日一次给药,共给7天。每隔一天称裸鼠体重,计算肿瘤重量。抑瘤率%=对照组体重-药物组体重/对照组体重结果见表2。
结果:从表2可以看出,20(R)-DEG的抑瘤剂量稍大于多西紫衫醇。相同剂量下,20(R)-DEG抑瘤率明显高于DEG。这一结果与体外细胞抑瘤一致,进一步说明DEG的抗癌活性主要是由20(R)-DEG贡献的。
表2 20(R)-DEG对人转移性结肠癌SW620移植瘤的治疗作用
- 还没有人留言评论。精彩留言会获得点赞!