一种含α‑萘基二芳酮化合物的制备方法与流程
本发明属于医药化工中间体及相关化学技术领域,涉及到一种含α-萘基二芳酮化合物的制备方法。
背景技术:
二芳酮结构普遍存在于生物活性分子中,同时,二芳酮类化合物也是合成天然产物、有机功能材料的重要中间体。因此,开发高效、高选择性合成二芳酮化合物的方法,具有重要的意义和应用价值。目前,合成二芳酮化合物的方法主要有以下三种方法:Friedel–Crafts酰基化反应、卤代芳烃插羰偶联反应和芳烃sp2碳–氢键直接酰基化反应。
作为最传统的酰基化方法,Friedel–Crafts酰基化反应是通过Lewis酸(如AlCl3、FeCl3和TiCl4等)或强的质子酸(如氢氟酸、硫酸等)催化酰基化试剂与芳香烃发生亲电取代反应;Friedel–Crafts酰基化反应存在酸催化剂的后处理、底物要求富电性、反应温度高、区域选择性差等不足[Sartori,G.,Maggi,R.Chem.Rev.,2006,106,1077]。过渡金属催化的插羰偶联反应,是近年确立的选择性高、环境友好的羰基化合物的合成方法;然而,该方法通常使用毒性较大的CO作为重要的羰基源,这与当前人们追求绿色、环境友好的理念不符[Wu,X.F.,Neumann,H.,Beller,M.Chem.Soc.Rev.,2011,40,4986]。芳烃sp2碳–氢键直接酰基化反应,是最近开发的合成二芳酮的一种原子经济性好、区域选择性高的新方法;在定位基的作用下,人们不断开发出可以替代CO的酰基源,从而实现二芳酮的简便合成,这些新型酰基源包括:醛、苄醇、二酮、苯甲酰甲酸、苄胺、烯烃与甲苯等[Zhang,Q.,Yang,F.,Wu,Y.Chem.Commun.,2013,49,6837;Zhou,W.,Li,H.,Wang,L.Org.Lett.,2012,14,4594]。
技术实现要素:
本发明提供了一种含α-萘基二芳酮化合物的新颖制备方法,该方法的合成路线短、底物易得、条件温和、便于操作,并且收率较高。
本发明的技术方案:
一种含α-萘基二芳酮化合物的制备方法,以1-氯甲基萘衍生物为原料,在碱、金属催化剂和配体的作用下与苯乙腈类化合物反应,于无水有机溶剂中与苯乙腈类化合物在20℃~80℃条件下,反应12小时;将所生成产物在氧化剂的作用下转化为二芳酮类化合物,合成路线如下:
R1选自氢(H)、烷基(alkyl)、苯基(Ph);
R2选自氢(H)、甲氧基(OMe)、甲基(Me);
R3选自氢(H)、溴(Br)、甲氧羰基(CO2Me)、甲基(Me)、硝基(NO2);
R4选自氢(H)、卤素(halogen)、苯基(Ph)、甲氧基(OMe)、烷基(alkyl)、三氟甲氧基(OCF3)、烯基(alkenyl);
1-氯甲基萘衍生物与碱的摩尔比为1:1~1:10;
1-氯甲基萘衍生物与金属催化剂的摩尔比为1:0.05~1:0.1;
1-氯甲基萘衍生物与苯乙腈类化合物的摩尔比为1:1~1:30;
1-氯甲基萘衍生物与氧化剂的摩尔比为1:2~1:50;
1-氯甲基萘衍生物的摩尔浓度为0.01mmol/mL~2mmol/mL。
金属催化剂包括二(乙酰丙酮)钯、二(三苯基膦)二氯化钯、四(三苯基膦)钯、三(二亚苄基丙酮)二钯、醋酸钯、三氟乙酸钯、氯化钯、二(乙腈)二氯化钯。优选四(三苯基膦)钯、三(二亚苄基丙酮)二钯、氯化钯、醋酸钯。
氧化剂包括过碳酸钠、双氧水、过二硫酸钾、高锰酸钾、二氧化锰、过氧化钠、过氧化叔丁基醚、氧气、空气。优选过碳酸钠、氧气、空气。
溶剂包括四氢呋喃、乙二醇二甲醚、三氯甲烷、二氯甲烷、乙醚、二甲基亚砜、四氯化碳、甲苯、N,N-二甲基甲酰胺、正己烷等,优选四氢呋喃、正己烷、乙二醇二甲醚、1,4-二氧六环。
碱包括氢氧化钾、碳酸钠、碳酸钾、碳酸氢钠、氢化钠、醋酸钠、甲醇钠、磷酸钾、叔丁醇钠、碳酸铯。优选氢化钠、叔丁醇钠、碳酸铯。
配体包括三苯基膦、三(对甲基苯基)膦、三(2-呋喃基)膦、三环己基膦、二苯基叔丁基膦、三叔丁基膦、三乙基膦、三(邻甲基苯基)膦、二甲基苯基膦、三正丁基膦。优选三苯基膦、三(对甲基苯基)膦、三(2-呋喃基)膦、二苯基叔丁基膦。
分离方法包括重结晶、柱层析等。重结晶方法使用的溶剂包括苯、乙醇、石油醚、乙腈、四氢呋喃、氯仿、正己烷、丙酮、乙酸乙酯、二氯甲烷;用柱层析方法进行产物分离时,可以使用硅胶或氧化铝作为固定相,展开剂一般为极性与非极性的的混合溶剂,如乙酸乙酯-石油醚、乙酸乙酯-正己烷、二氯甲烷-石油醚、甲醇-石油醚。
本发明的有益效果是合成路线短、条件温和、操作简便、有实现工业化的可能性,并且以较高收率得到二芳酮产物;利用该方法所合成的二芳酮化合物的萘环上甲基可以近一步官能化,进而得到药物中间体、光学材料等功能性分子。
附图说明
图1是实施例1中4-甲基-(4′-甲基苯基)-1-萘基甲酮的1H核磁谱图。
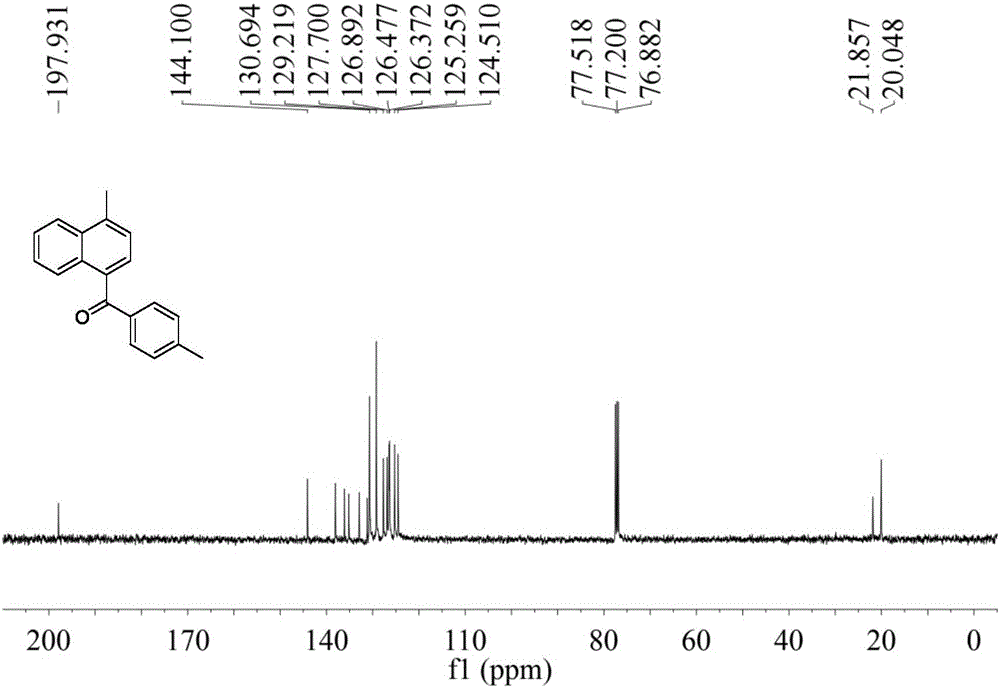
图2是实施例1中4-甲基-(4′-甲基苯基)-1-萘基甲酮的13C核磁谱图。
图3是实施例2中4-甲基-(4′-甲氧基苯基)-1-萘基甲酮的1H核磁谱图。
图4是实施例2中4-甲基-(4′-甲氧基苯基)-1-萘基甲酮的13C核磁谱图。
图5是实施例3中4-甲基-(4′-溴苯基)-1-萘基甲酮的1H核磁谱图。
图6是实施例3中4-甲基-(4′-溴苯基)-1-萘基甲酮的13C核磁谱图。
图7是实施例4中2-(4′-甲基-1′-萘基)-萘基甲酮的1H核磁谱图。
图8是实施例4中2-(4′-甲基-1′-萘基)-萘基甲酮的13C核磁谱图。
图9是实施例5中4-甲基-(4′-三氟甲氧基苯基)-1-萘基甲酮的1H核磁谱图。
图10是实施例5中4-甲基-(4′-三氟甲氧基苯基)-1-萘基甲酮的13C核磁谱图。
图11是实施例6中(4′-苄基-1′-萘基)-苯甲酮的1H核磁谱图。
图12是实施例6中(4′-苄基-1′-萘基)-苯甲酮的13C核磁谱图。
图13是实施例7中(4′-丙基-1′-萘基)-苯甲酮的1H核磁谱图。
图14是实施例7中(4′-丙基-1′-萘基)-苯甲酮的13C核磁谱图。
图15是实施例8中(3′,4′-二甲基-1′-萘基)-苯甲酮的1H核磁谱图。
图16是实施例8中(3′,4′-二甲基-1′-萘基)-苯甲酮的13C核磁谱图。
具体实施方式
本发明所述的含α-萘基二芳酮化合物的制备方法,具有原料价格低廉、反应步骤少、反应条件温和、便于操作和反应收率高等优点。
下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。在本领域内的技术人员对本发明所做的简单替换或改进均属于本发明所保护的技术方案之内。
实施例1:4-甲基-(4′-甲基苯基)-1-萘基甲酮的合成
在25mL反应器中,加入叔丁醇钠(0.058g,0.6mmol)和四(三苯基膦)钯(0.017g,0.015mmol),氮气置换3次后,加入四氢呋喃5mL,搅拌下加入4-甲基苯乙腈(0.079g,0.6mmol)和1-氯甲基萘(0.053g,0.3mmol),30℃下搅拌12h后,将反应液在空气中继续搅拌10h。柱层析分离(硅胶,200-300目;展开剂,石油醚:乙酸乙酯=50:1)得到4-甲基-(4′-甲基苯基)-1-萘基甲酮0.064g,产率82%。
4-甲基-(4′-甲基苯基)-1-萘基甲酮
淡黄色油状液体;IR(neat)ν2955,2924,2854,1656,1604,1513,1456,1284,1254,1178,973,833,762cm-1;1H NMR(400MHz,CDCl3)δ2.40(s,3H),2.74(s,3H),7.22(d,J=8.0Hz,2H),7.33(d,J=7.2Hz,1H),7.44–7.50(m,2H),7.54(dd,J=6.8,7.6Hz,1H),7.75(d,J=8.0Hz,2H),8.06(d,J=8.4Hz,1H),8.13(d,J=8.4Hz,1H);13C NMR(100MHz,CDCl3)δ20.0,21.9,124.5,125.3,126.4,126.5,126.9,127.7,129.2,130.7,131.2,132.9,135.2,136.1,138.1,144.1,197.9;HRMS(EI,m/z)calcd for C19H16O:260.1201[M]+;found:260.1194.
实施例2:4-甲基-(4′-甲氧基苯基)-1-萘基甲酮的合成
操作同实施例1,由1-氯甲基萘与4-甲氧基苯乙腈反应得到4-甲基-(4′-甲氧基苯基)-1-萘基甲酮0.070g,产率84%。
4-甲基-(4′-甲氧基苯基)-1-萘基甲酮
淡黄色固体,mp 77.8-78.3℃;IR(KBr)ν3071,2932,2839,1651,1598,1509,1254,1170,1029,973,878,845,768cm-1;1H NMR(400MHz,CDCl3)δ2.73(s,3H),3.83(s,3H),6.89(d,J=8.4Hz,2H),7.32(d,J=7.2Hz,1H),7.42–7.48(m,2H),7.53(dd,J=7.2,8.0Hz,1H),7.83(d,J=8.8Hz,2H),8.06(dd,J=7.6,8.0Hz,2H);13C NMR(100MHz,CDCl3)δ20.0,55.6,113.7,124.5,125.3,126.3,126.5,126.8,127.1,131.1,131.4,132.9,135.5,137.7,163.8,196.9;HRMS(EI,m/z)calcd for C19H16O2:276.1150[M]+;found:276.1151.
实施例3:4-甲基-(4′-溴苯基)-1-萘基甲酮的合成
操作同实施例1,由1-氯甲基萘与4-溴苯乙腈反应得到4-甲基-(4′-溴苯基)-1-萘基甲酮0.071g,产率73%。
4-甲基-(4′-溴苯基)-1-萘基甲酮
黄色固体,mp 75.7-76.0℃;IR(KBr)ν3067,2923,2860,1656,1583,1514,1396,1283,1254,1070,1010,974,875,841,763cm-1;1H NMR(400MHz,CDCl3)δ2.76(s,3H),7.34(d,J=7.2Hz,1H),7.45(d,J=7.2Hz,1H),7.50–7.59(m,4H),7.71(d,J=8.0Hz,2H),8.08(d,J=8.0Hz,1H),8.15(d,J=8.4Hz,1H);13C NMR(100MHz,CDCl3)δ20.1,124.6,125.2,126.3,126.6,127.2,128.3,128.4,131.1,131.8,132.0,133.0,134.2,137.5,138.4,138.9,197.0;HRMS(EI,m/z)calcd for C18H13OBr:324.0150[M]+;found:324.0148.
实施例4:2-(4′-甲基-1′-萘基)-萘基甲酮的合成
在25mL反应器中,加入氢化钠(0.048g,1.2mmol)、醋酸钯(0.003g,0.015mmol)和三(对甲苯基)膦(0.009g,0.030mmol),氮气置换3次后,加入无水1,4-二氧六环5mL,搅拌下加入2-萘乙腈(0.100g,0.6mmol)和1-氯甲基萘(0.053g,0.3mmol),45℃下搅拌12h后,向反应液中通入氧气继续搅拌10h,柱层析分离(硅胶,200-300目;展开剂,石油醚:乙酸乙酯=100:1)得到2-(4′-甲基-1′-萘基)-萘基甲酮0.066g,产率74%。
2-(4′-甲基-1′-萘基)-萘基甲酮
黄色油状液体;IR(neat)ν3057,1655,1626,1591,1513,1464,1289,1185,1118,978,821,762cm-1;1H NMR(400MHz,CDCl3)δ2.77(s,3H),7.36(d,J=7.2Hz,1H),7.46–7.59(m,5H),7.79(d,J=8.4Hz,1H),7.87(d,J=8.0Hz,1H),7.90(d,J=8.4Hz,1H),8.05–8.10(m,2H),8.20(d,J=8.4Hz,1H),8.24(s,1H);13C NMR(100MHz,CDCl3)δ20.1,124.6,125.3,125.7,126.50,126.53,126.9,127.1,127.9,128.1,128.5,128.7,129.8,131.3,132.5,132.9,133.0,135.1,135.8,136.1,138.4,198.2;HRMS(EI,m/z)calcd for C22H16O:296.1201[M]+;found:296.1208.
实施例5:4-甲基-(4′-三氟甲氧基苯基)-1-萘基甲酮的合成
在25mL反应器中,加入氢化钠(0.024g,0.6mmol)、醋酸钯(0.003g,0.015mmol)和三(2-呋喃基)膦(0.007g,0.030mmol),氮气置换3次后,加入无水乙二醇二甲醚5mL,搅拌下加入4-三氟甲氧基苯乙腈(0.121g,0.6mmol)和1-氯甲基萘(0.053g,0.3mmol),60℃下搅拌12h后,向反应液中通入氧气继续搅拌10h,柱层析分离(硅胶,200-300目;展开剂,石油醚:乙酸乙酯=10:1)得到4-甲基-(4′-三氟甲氧基苯基)-1-萘基甲酮0.060g,产率61%。
4-甲基-(4′-三氟甲氧基苯基)-1-萘基甲酮
黄色油状液体;IR(neat)ν3074,2926,2861,1660,1601,1591,1514,1503,1254,1167,1017,975,877,837,767cm-1;1H NMR(400MHz,CDCl3)δ2.76(s,3H),7.27(d,J=8.4Hz,2H),7.34(d,J=7.2Hz,1H),7.46(d,J=7.2Hz,1H),7.51–7.60(m,2H),7.90(d,J=8.8Hz,2H),8.08(d,J=8.4Hz,1H),8.17(d,J=8.4Hz,1H);13C NMR(100MHz,CDCl3)δ20.1,120.5(q,J=257.2Hz),124.6,125.2,126.3,126.5,126.6,127.3,128.3,131.1,132.5,133.0,134.2,137.1,139.0,152.7,196.5;HRMS(EI,m/z)calcd for C19H13O2F3:330.0868[M]+;found:330.0869.
实施例6:(4′-苄基-1′-萘基)-苯甲酮的合成
在25mL反应器中,加入叔丁醇钠(0.115g,1.2mmol)、醋酸钯(0.003g,0.015mmol)和三(2-呋喃基)膦(0.007g,0.030mmol),氮气置换3次后,在氮气保护中加入无水四氢呋喃5mL,搅拌下加入苯乙腈(0.070g,0.6mmol)和1-[氯基(苯基)甲基]萘(0.076g,0.3mmol),30℃下搅拌12h后,向反应液中加入0.073g过碳酸钠继续搅拌10h,柱层析分离(硅胶,200-300目;展开剂,石油醚:乙酸乙酯=100:1)得到(4′-苄基-1′-萘基)-苯甲酮0.077g,产率80%。
(4′-苄基-1′-萘基)-苯甲酮
淡黄色固体,mp 92.9-93.4℃;IR(KBr)ν3060,3026,2920,1658,1595,1580,1513,1494,1448,1282,1254,876,849,765,710cm-1;1H NMR(400MHz,CDCl3)δ4.49(s,2H),7.21(d,J=7.2Hz,3H),7.28(dd,J=7.6,8.0Hz,3H),7.41–7.51(m,5H),7.57(dd,J=7.2,7.6Hz,1H),7.88(d,J=7.6Hz,2H),8.07–8.09(m,1H),8.14–8.16(m,1H);13C NMR(100MHz,CDCl3)δ39.5,124.7,125.9,126.5,126.6,126.7,127.0,127.8,128.6,128.7,128.9,130.6,131.6,132.5,133.3,135.5,138.5,140.0,140.5,198.2;HRMS(EI,m/z)calcd for C24H18O:322.1358[M]+;found:322.1349.
实施例7:(4′-丙基-1′-萘基)-苯甲酮的合成
在25mL反应器中,加入碳酸铯(0.391g,1.2mmol)、醋酸钯(0.003g,0.015mmol)和三苯基膦(0.008g,0.030mmol),氮气置换3次后,在氮气保护中加入无水1,4-二氧六环5mL,搅拌下加入苯乙腈(0.070g,0.6mmol)和1-氯1-丙基萘(0.061g,0.3mmol),40℃下搅拌12h后,将反应液在空气中继续搅拌10h,柱层析分离(硅胶,200-300目;展开剂,石油醚:乙酸乙酯=100:1)得到(4′-丙基-1′-萘基)-苯甲酮0.043g,产率52%。
(4′-丙基-1′-萘基)-苯甲酮
黄色油状液体;IR(neat)ν3060,2959,2930,2870,1658,1560,1579,1514,1448,1275,1252,1176,878,799,763,714cm-1;1H NMR(400MHz,CDCl3)δ1.06(t,J=7.4Hz,3H),1.79–1.85(m,2H),3.11(t,J=7.6Hz,2H),7.34(d,J=7.2Hz,1H),7.44(dd,J=7.6,8.0Hz,2H),7.49(d,J=7.6Hz,2H),7.53–7.60(m,2H),7.86(d,J=7.2Hz,2H),8.13(d,J=8.4Hz,1H),8.17(d,J=8.4Hz,1H);13C NMR(100MHz,CDCl3)δ14.5,24.0,35.7,124.4,124.6,126.4,126.6,126.9,128.1,128.5,130.6,131.6,132.3,133.2,134.8,138.7,142.8,198.3;HRMS(EI,m/z)calcd for C20H18O:274.1358[M]+;found:274.1359.
实施例8:(3′,4′-二甲基-1′-萘基)-苯甲酮的合成
操作同实施例7,由(2′-甲基)-1-氯甲基萘与苯乙腈反应得到得到(3′,4′-二甲基-1′-萘基)-苯甲酮0.059g,产率75%。
(3′,4′-二甲基-1′-萘基)-苯甲酮
淡黄色固体,mp 90.8-91.2℃;IR(KBr)ν3061,2923,1656,1560,1578,1511,1447,1280,1253,1207,1024,866,753,715cm-1;1H NMR(400MHz,CDCl3)δ2.48(s,3H),2.66(s,3H),7.40–7.46(m,4H),7.50–7.59(m,2H),7.85(d,J=7.6Hz,2H),8.07(d,J=8.4Hz,1H),8.10(d,J=8.8Hz,1H);13C NMR(100MHz,CDCl3)δ15.2,20.9,124.2,125.9,126.3,126.4,128.5,129.9,130.5,131.1,132.0,133.17,133.21,134.2,135.4,138.8,198.4;HRMS(EI,m/z)calcd for C19H16O:260.1201[M]+;found:260.1198.
- 还没有人留言评论。精彩留言会获得点赞!