CYP2C19和ABCB1基因检测试剂盒的制作方法
本发明属于生物
技术领域:
,涉及一种用于氯吡格雷个体户用药相关基因snp位点检测的技术,具体而言是利用多重pcr技术、单碱基延伸技术和质谱技术,对与氯吡格雷相关的6个基因多态位点进行检测的产品和用途。
背景技术:
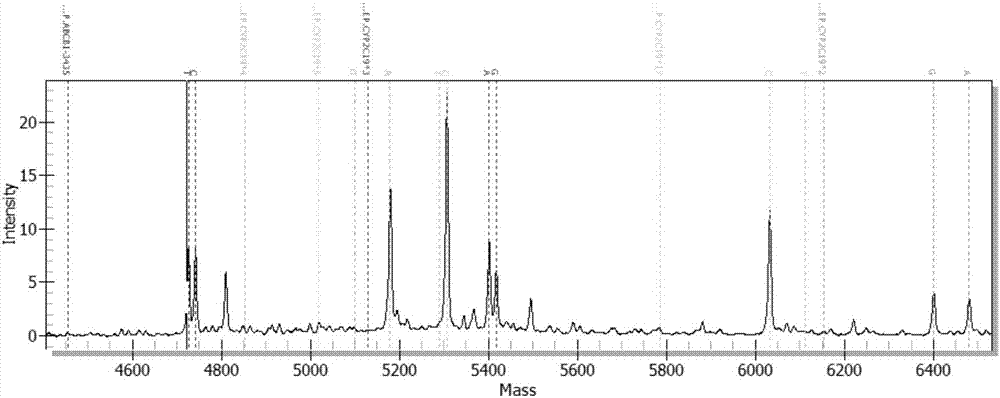
:氯吡格雷(clopidogel)是一种新型噻吩吡啶类的抗血小板药物,能和阿司匹林联合使用是预防和治疗急性冠脉综合征(acs)缺血事件反复发作、接受金属支架或药物释放支架植入手术的经皮冠脉介入治疗(pci)患者以及急性心肌梗死的标准疗法。氯吡格雷为药物前体(prodrug),本身无活性,氯吡格雷约50%经胃肠道吸收后在肝脏内迅速代谢,血浆中原形药物浓度极低。氯吡格雷在小肠的吸收受到abcb1基因编码的质子泵p糖蛋白(p‐glycoprtein,p‐gp)调控,大部分药物前体通过酯酶代谢为无活性物质(主要是sr‐26334),进入体内经肝脏药物代谢酶(主要是cyp3a4、cyp3a5、cyp2c19)氧化产生具有活性的代谢物(主要是sr‐6334),该活性代谢产物不可逆的阻断血小板膜上的二磷酸腺苷(adp)受体,从而阻止了血小板聚集,即发挥抗血小板作用。然而,在服用包括氯吡格雷在内的血小板抑制剂的患者中,心血管事件反复发作的绝对危险性仍然相对较高。在氯吡格雷的临床治疗存在个体差异,表现为氯吡格雷抵抗(clopidogrelresistance,cr),甚至表现为无反应。其中部分原因由于患者对于氯吡格雷代谢酶基因存在基因多态性(snp)而导致代谢酶的活性降低或完全丧失,从而影响了氯吡格雷的疗效。陈劲松等(氯吡格雷反应性差异的分子机制研究进展,《医学综述》,2011年第3期)报道了参与氯吡格雷代谢的主要药物代谢酶包括:cyp1a2、cyp2b6、cyp2c9、cyp2c19、cyp3a等,其中cyp1a2、cyp2b6、cyp2c19参与氯吡格雷第一阶段转化,cyp2c9、cyp2c19、cyp2b6、cyp3a参与第二阶段转化。其中,cyp2c19酶蛋白在氯吡格雷的代谢活化中起重要作用,编码该酶蛋白的基因cyp2c19在人体内呈多态性表达。虽然cyp2c19的突变体有cyp2c19*2、cyp2c19*3、cyp2c19*4、cyp2c19*5,但其中与氯吡格雷代谢相关的最主要突变体为cyp2c19*2,其次是cyp2c19*3。随着对cyp2c19的多态性位点与氯吡格雷代谢的相关性的研究深入,祝锦等(氯吡格雷药物基因组学研究进展,《中国新药杂志》,2013年第15期)报道了中国人群的氯吡格雷抵抗主要受cyp2c19*2、cyp2c19*3的位点多态性影响。通过对该位点进行基因检测以及通过选择适当的个性化治疗方案可以帮助携带cyp2c19*2、cyp2c19*3等位基因的患者减少危险,增加氯吡格雷的有效性和安全性。但对于其他snp位点(如abcb1、cyp2b6)是否影响氯吡格雷的代谢还有待研究。蔡泓敏等(cyp2c19基因多态性与氯吡格雷抗凝作用的相关性研究,《中国药物应用于监测》,2013年第5期)、张园等(氯吡格雷低反应性与cyp2c19基因多态性分布的研究,《内蒙古医学杂志》,2014年第2期)分别报道了在我国人群中服用氯吡格雷的患者检测cyp2c19*2和*3、cyp2c19*1和*2具有临床指导意义。此外,有研究表明,abcb1基因也与氯吡格雷抵抗的机制有关。abcb1转运蛋白家族(atpbindingcassettetransporterfamily)是一类跨膜蛋白,其主要功能是利用atp水解产生的能量将与其结合的底物等主动转出质膜,abcb1基因在人类多药耐药基因族中起主导作用,其表达受各种因素的影响,属于可调控基因。刘俊等(基因型检测在氯吡格雷个体化抗血小板治疗中的应用价值,《中国药房》,2014年第12期)报道了cyp2c19和abcb1基因多态性与氯吡格雷疗效存在明显关联性,尤其是cyp2c19基因多态性是导致氯吡格雷疗效差异的重要影响因素。这说明在我国人群中服用氯吡格雷的患者检测cyp2c19*2和*3以及abcb1基因型具有临床指导意义。目前,氯吡格雷药物代谢基因多态性位点检测的实验方法为pcr‐荧光探针法和pcr毛细电泳片段分析法等,这些技术不同程度地存在实验周期长、单位实验通量成本较高、多个子平台(子系统)之间衔接的兼容性差、结果判定的主观性较大等缺点。中国专利申请201410067924、“焦磷酸测序氯吡格雷个体化用药基因多态性检测试剂盒及其检测方法”公开了一种通过焦磷酸测序法来检测氯吡格雷个体化用药基因多态性的方法,包括针对cyp2c19*2、cyp2c19*3的多态性位点设计多重pcr扩增引物和测序引物,通过对用药者的上述位点进行检测,达到指导心脑血管疾病需要长期抗凝者根据个体基因类型合理选择氯吡格雷及其剂量进行治疗。然而,该方法仍然属于传统的pcr测序检测方法,该方法耗时耗力,且针对的检测位点过少,难以满足临床需要。近年来基于多重pcr反应的核酸质谱技术具有灵敏度高、准确度高及分辨率高等特点,为生命科学等领域提供了一种强有力的分析测试手段,并正扮演着越来越重要的作用。中国专利申请201610123251、“用于检测与氯吡格雷药物抵抗反应相关的基因位点高效分型的试剂盒”公开了一种多重荧光pcr技术来检测与氯吡格雷药物抵抗反应相关的基因位点的方法,方法包括针对cyp2c19*2、cyp2c19*3的多态性位点,设计扩增引物和单碱基延伸引物,能够测试受试者的基因是否变异,从而为受试者合理用药提供依据。然而,该方法所针对的位点过少,且不涉及abcb1基因的多态性位点,因此检测结果存在一定的遗漏。作为最接近的现有技术,中国专利申请201210196926.3、发明名称“用于检测华法林用药剂量相关的基因snp的引物系统及其用途”,基于该引物系统所制备的产品,能实现同时对与华法林用药剂量相关的7处基因多态位点(即cyp2c9*2、cyp2c9*3、cyp2c9*6、vkorc1基因、cyp4f2基因、ggcx基因、calu基因)进行检测。使用该产品,对华法林服用者在7处基因多态位点的基因型进行检测,检测结果结合其他临床指标,可为临床医师合理制定华法林剂量提供参考,避免药物不良反应。由于以上位点并不包括abcb1(3435c>t),同时没有针对于氯吡格雷相关的所有cyp2c19位点进行研究,同时在核酸质谱检测过程中,多重扩增过程的干扰作用,对于最终获得的延伸产物也存在影响,因此发明人为之试图寻找新的cyp2c19位点与abcb1位点组合,并重新设计新的引物系统。综合所述,目前存在的技术问题是:缺乏一次能同时有效检测氯吡格雷抵抗相关的多个基因多态位点的方法和产品,常见的检测技术,如测序、实时荧光定量pcr等,均需对位点逐一进行检测,当位点较多时操作复杂,费用较高;又如,已知的核酸质谱检测技术,又未能公开以上联合位点以及具体引物系统,同时又因为同一核酸质谱检测过程中,多重pcr对于延伸产物的干扰。因此目前需要一种不同于以往的检测技术,能在同一体系中针对同一个体的cyp2c19与abcb1的多个snp进行检测,通过该技术的检测信息,为合理用药提供参考依据。技术实现要素:本发明原理在于,针对现有同时有效检测氯吡格雷抵抗相关的多个基因多态位点(cyp2c19*2、*3)的需要,提出检测snp位点扩展到*4、*5尤其是*17位点以及abcb1的snp位点,以便合理选择抗血小板治疗方案。其中,*4、*5可保证检测覆盖中国境内所有人群,abcb1(3435c>t)的snp位点可协同检测cyp2c19*2、*3位点的准确率,而检测cyp2c19*17则可避免氯吡格雷过度用药所带来的副作用。因此,本发明人通过优化摸索,排除多重引物的干扰,从而成功获得用于核酸质谱检测的引物系统。具体而言,提供了一种联合多重pcr技术、单碱基延伸技术和质谱检测技术,在多重pcr中同时扩增多达5‐6个含snp的dna片段;在单碱基延伸过程中,对多重pcr的纯化产物进行多重单碱基延伸,延伸引物在6个snp处分别延伸一个核苷酸,使得所延伸的核苷酸类型,分别与snp处的基因型相关;单碱基延伸产生由延伸引物和延伸产物组成的待检混合物,以质谱对待检混合物进行检测,通过质谱峰确定待检混合物中各物质分子量,并与预先计算的各延伸引物和延伸产物的理论分子量进行比对,从而确定待检混合物是否包含特定的物质,进而确定各snp处的基因型。因此,本发明第一个目的是提供一种检测与氯吡格雷抵抗相关的6种snp位点的引物系统或引物组,其序列包括如表1所示。表1.引物系统编号序列(5'→3')针对位点用途seqidno:1actgcagcattgctgagaacabcb1‐3435(rs1045642)pcr引物seqidno:2aaggcatgtatgttggcctcabcb1‐3435(rs1045642)pcr引物seqidno:3agtgcaagctcacggttgtccyp2c19*4(rs28399504)pcr引物seqidno:4gagcacaaggaccacaaaagcyp2c19*4(rs28399504)pcr引物seqidno:5catgaggagtaacttctccccyp2c19*5(rs56337013)pcr引物seqidno:6taaaaacagctccatgcgggcyp2c19*5(rs56337013)pcr引物seqidno:7gactgtaagtggtttctcagcyp2c19*3(rs4986893)pcr引物seqidno:8aacatcaggattgtaagcaccyp2c19*3(rs4986893)pcr引物seqidno:9aggtcttctgatgcccatcgcyp2c19*17(rs12248560)pcr引物seqidno:10aacaaagttttagcaaacgcyp2c19*17(rs12248560)pcr引物seqidno:11gcaataattttcccactatccyp2c19*2(rs4244285)pcr引物seqidno:12tccatcgattcttggtgttccyp2c19*2(rs4244285)pcr引物seqidno:13ctttgctgccctcacabcb13435c>t(rs1045642)延伸引物seqidno:14accacaaaaggatccacyp2c19*4(rs28399504)延伸引物seqidno:15ctctcccacacaaatcccyp2c19*5(rs56337013)延伸引物seqidno:16attgtaagcaccccctgcyp2c19*3(rs4986893)延伸引物seqidno:17gtgtcttctgttctcaaagcyp2c19*17(rs12248560)延伸引物seqidno:18agtaatttgttatgggttcccyp2c19*2(rs4244285)延伸引物其中,所述6个与氯吡格雷抗性相关的snp分别是:abcb1基因rs1045642位点(abcb13435c>t)、cyp2c19基因rs28399504位点(cyp2c19*4)、cyp2c19基因rs56337013位点(cyp2c19*5)、cyp2c19基因rs4986893位点(cyp2c19*3)、cyp2c19基因rs12248560位点(cyp2c19*17)、cyp2c19基因rs4244285位点(cyp2c19*2)。其中,各位点对应的延伸引物及延伸产物分子量如表2所示。在一个实施方案中,上述pcr引物序列为核心序列,其在5'端可包括保护碱基序列,优选5‐15个碱基。在一个具体实施方案中,保护碱基序列选自在5'端加入10bp的tag(acgttggatg),保护碱基的序列使得pcr引物(即核心引物)的分子量增大,可以避免反应剩余的pcr引物一并进入质谱检测过程中,以避免干扰检测效果。另外,在一个具体实施方案中,延伸引物的5'端也可以适量增加碱基序列(如上述保护碱基序列)。增加碱基序列的目的是当两个基因多态位点对应的延伸引物及产物的分子量接近时,通过给其中一个延伸引物或两个延伸引物都增加碱基,改变引物及其产物的分子量,与其他延伸引物及产物的分子量之间拉大差距,提高检测效果。而且,增加后的引物及产物分子量,一定不超出检测窗口。表2.延伸引物及延伸产物分子量例如,pcr引物seqidno:1为5'‐actgcagcattgctgagaac‐3’。在另一个具体实施方案中,延伸引物的5'端也可以增加作为接头的碱基序列。本发明第二个目的是提供了由上述引物系统所制备的用于检测氯吡格雷抵抗相关的基因多态位点的产品。在一个实施方案中,该产品为检测试剂盒,包括:(1)用于pcr的反应试剂,包括:特异性pcr引物,耐高温的dna聚合酶,dntps,pcr反应缓冲液;(2)用于pcr产物纯化的试剂;(3)用于单碱基延伸反应的试剂,包括:延伸引物,耐高温的单碱基延伸酶,ddntps,延伸反应缓冲液。在一个具体实施方案中,该试剂盒还可包括:阴性质控品,阳性质控品,纯化用树脂,点样及质谱检测用靶片,外切酶,人基因组dna提取试剂等试剂。在另一个具体实施方案中,用于pcr产物纯化的试剂:碱性磷酸酶,或碱性磷酸酶和外切酶exoi,或电泳凝胶回收试剂,或pcr产物纯化柱。其中当包括碱性磷酸酶和外切酶exoi的纯化试剂时,所使用的pcr引物无需包括保护碱基。本发明第三个目的是使用上述引物、产品或试剂盒来检测氯吡格雷抵抗相关的基因多态位点的方法,包括如下步骤:(1)多重pcr:使用特异性的pcr引物,在一个反应体系中,对6处与氯吡格雷抵抗相关的基因多态位点所在dna区域同时进行扩增,得到含6处基因多态位点所在dna区域的pcr产物;(2)pcr产物纯化:对步骤(1)得到的pcr产物进行纯化,以减少对后续反应的干扰;(3)单碱基延伸:使用7条特异性的延伸引物,在一个反应体系中,对步骤(2)得到的纯化后pcr产物进行多重单碱基延伸,延伸引物在对应的snp位点处延伸一个核苷酸,该核苷酸与snp位点处的基因型互补配对;(4)延伸产物纯化:对步骤(3)得到的延伸产物进行纯化,以获得高纯的延伸产物,避免盐离子等杂质对后续检测的影响;(5)质谱仪检测:将步骤(4)得到的纯化产物点在含有基质的靶片上,放入质谱仪进行进行检测;在一个实施方案中,步骤2的纯化过程可以选自碱性磷酸酶消化、碱性磷酸酶和外切酶exoi消化、切胶纯化、pcr纯化柱过柱等。在一个具体实施方案中,当使用碱性磷酸酶消化、或碱性磷酸酶和外切酶exoi消化进行纯化后,进行高温酶失活处理。本发明第四个目的是提供前述试剂盒在检测6个氯吡格雷抵抗相关的snp的用途。在上述任意一个方案中,所述引物系统或引物组、检测产品、检测氯吡格雷抵抗相关的基因多态位点的方法,其中所述snp位点选自cyp2c19*2、*3、*4、*5和abcb1(3435c>t)的5个基因多态位点。在另一实施方案中,所述snp位点还包括cyp2c19*17,该位点通过涉及与减少氯吡格雷用药副作用以及合理选择抗血小板治疗方案,从而属于氯吡格雷抵抗相关的基因多态位点。技术效果1、敏感:本发明综合了多重pcr、单碱基延伸、质谱检测等技术为一体,既可通过pcr技术放大检测模板,又可通过质谱技术检测微量样本,综合了两种技术的优点,远远优于单独使用pcr检测多态性snp,因此它的检测灵敏度很高。2、特异:单碱基延伸又称为“微测序”,使用特异性探针对dna分子进行识别,具有测序技术的高准确性,特异性好、假阳性低等特点;特别的,不同于测序技术延伸数百个碱基,该技术仅延伸单个碱基,出错概率更低;3、本发明首次提出可以利用核酸飞行质谱技术检测2种不同类别的氯吡格雷抵抗的snp位点,具体是首次将cyp2c19与abcb1位点置于同一检测体系中。4、中国是多民族人口大国,少数民族中除了蒙古人种(即黄色人种)之外,在边疆地区还分布少量的高加索人种(即白色人种,如俄罗斯族、塔吉克族等)、棕色人种等;而随着对外交流日益频繁,世界各国往来中国的人们也日益增多。因此仅仅以中国黄色人种为主体进行研究,已经不能适应对患者的氯吡格雷抵抗的用药诊断需要。因此,本发明还在现有研究的基础上,丰富了已有文献中关于氯吡格雷抵抗的多态性位点主要为cyp2c19*2、cyp2c19*3的信息,本发明增添了cyp2c19*4、cyp2c19*5、cyp2c19*17以及abcb1的多态性位点,能够较全面覆盖中国境内所有类型的位点检测。5、由于本发明涉及对多个基因的多种snp位点的检测,可以分别得到具有不同snp位点的检测结果,因此患者可以是单个snp位点发生变异,也可以是多个snp位点发生变异。这表示患者可以携带一个或多个snp变异,从而为选择合适剂量提供参考信息。实践中发现,pcr测序法或荧光定量pcr法,每增加一个检测snp位点的反应,就要增加相应的费用和时间。相比之下,质谱法检测优势在于无论多少个待检位点,只要能在一个反应管内反应,则花费的试剂和时间是不变的,这也是本发明同时检测多个snp位点的优势。6、本发明克服了在同一体系中多重pcr体系中存在的干扰延伸产物的影响,从而克服了以往技术一次检测snp位点过少的缺陷。7、本发明还具有成本低廉,简便安全,检测速度快,可在5‐6小时内完成数百个样本的高通量检测。原理与定义本发明提供了一种联合pcr、单碱基延伸和质谱检测等技术,检测患者氯吡格雷抵抗基因多态性的检测方案。其原理在于:使用特异性pcr引物,对待测模板进行扩增,得到含待检snp位点的pcr产物;pcr产物经过纯化处理后,进行单碱基延伸,在延伸引物后延伸一个核苷酸,该核苷酸与模板互补配对(如模板为核苷酸a,将在对应的延伸引物上延伸t);在单碱基延伸步骤中,采用ddntp代替dntp,因此,在延伸一个碱基后,延伸引物将终止延伸;在质谱检测过程中,单碱基延伸产物在脱盐纯化后,点至含基质的靶片上,并在真空环境中被激光激发,通过飞行管至检测器。不同物质通过飞行管的时间与其分子量呈负相关,即分子量越大,飞行时间越慢,到达检测器的时间越晚。术语“保护碱基”,指在pcr引物的5’端额外增加的碱基。保护碱基的序列使得pcr引物的分子量增大,可以避免反应剩余的pcr引物进入质谱检测窗口,以避免干扰检测效果。此外,延伸引物的5’端也可以适量增加碱基序列,但其作用并非如同pcr引物的保护碱基,使其超出检测窗口,而是适当调整延伸引物的分子量,使延伸引物及其产物在检测窗口内处于一个合理的位置。例如,当两个基因多态位点对应的延伸引物及产物的分子量接近时,通过给其中一个延伸引物增加碱基,改变引物及其产物的分子量,与其他延伸引物及产物的分子量之间拉大差距,以避免局部区域质谱峰过于集中而产生干扰和分辨不清,从而提高检测效果。因此,增加碱基后的延伸引物及产物的分子量,一定不会超出检测窗口。上述延伸引物的额外碱基可称为引物接头。术语“碱性磷酸酶消化”,其作用是降解pcr反应后体系中残余dntp,其原理是使dntp的5’-p末端转换成5’-oh末端,从而失去与引物结合使引物延伸的能力,避免了对下一步单碱基延伸的影响。术语“外切酶exoi消化”,其作用是从单链dna的一端开始按序催化水解组成dna的dntp之间的3,5-磷酸二酯键,使单链dna最终水解为dntp。在本技术方案中用于降解pcr反应后剩余的pcr引物。由于外切酶可以将单链的pcr引物切除,并不会再检测窗口中出现,因此在使用该外切酶时,所使用的pcr引物无需包括保护碱基。术语“单碱基延伸”,又被称之为微测序(minisequence),指在体系中加入延伸引物和ddntp,ddntp与延伸引物的3’连接形成延伸产物,即引物延伸了一个碱基。ddntp与普通dntp不同的是,在脱氧核糖的3’位置缺少了一个羟基,不能与后续的ddntp形成磷酸二酯键,因而,延伸引物仅可连接一个ddntp,故而称之为单碱基延伸。单碱基延伸与测序过程非常相似,测序体系中加入的是dntp和ddntp的混合物,测序引物连接dntp后将继续延伸,只有连接ddntp后方可终止延伸,因此测序产生的是长短不一的核苷酸片段的混合物;单碱基延伸体系中只加入ddntp,延伸引物只能连接一个ddntp,并终止延伸,因此,单碱基延伸反应产生的是延伸引物仅延伸一个碱基的核苷酸片段。术语“ddntp”是一种特殊的核苷酸,本技术方案共采用四种,它们之间存在分子量差异,如ddctp,ddatp,ddgtp,ddttp的分子量分布是247.2、271.2、287.2、327.1da,其中ddttp为修饰后的分子量。当延伸引物根据snp位点的基因型而延伸不同的核苷酸时,将形成分子量差异。可以通过质谱检测,分辨出这种差异(质谱检测核酸的最小灵敏度约为9da)。例如,某snp位点若为g/a多态,对应的延伸引物长度为22个碱基(分子量为6153da),当该snp位点是g基因型时,延伸引物将延伸一个c核苷酸并终止延伸,形成23个碱基长、分子量为6400.2da的延伸产物;当该snp位点处为a基因型,延伸引物将延伸一个t核苷酸并终止延伸,形成23个碱基长、分子量为6480.1da的延伸产物,两种产物间存在80.1da的分子量差异。即对该snp位点而言,使用此6153da的延伸引物,g基因型将对应6400.2da的质谱峰,a基因型将对应6480.1da的质谱峰。在实际检测过程中,使用者可通过软件对6153da、6400.2da、6480.1da三处进行观察:若6153da处出现质谱峰,则表明有部分或全部延伸引物未与ddntp结合;不论6153da处是否有质谱峰,若6400.2da与6480.1da处仅出现一处质谱峰,则该snp位点的基因型为纯合型,并与质谱峰的位置对应,如前所述,6400.2da的质谱峰对应g基因型,6480.1da的质谱峰对应a基因型;若6400.2da与6480.1da两处均出现质谱峰,则该snp位点的基因型为杂合型;若6400.2da与6480.1da两处均未出现质谱峰,则实验失败。术语“纯化”,指用于减少待检体系内其他物质对后续反应的影响的处理步骤。本发明的pcr产物纯化有两种方式:一是分离杂质并丢弃,而是使杂质失去活性。其中,切胶纯化、过纯化柱等都是通过电泳、纯化柱等分离介质,并回收相对较纯的pcr产物,属于第一种纯化方式,该方式一般耗时较长、操作复杂,尤其是样本量大时,更难以提高批量处理能力;碱性磷酸酶的作用是降解(亦称消化)dntp,使之不能继续作为dna聚合酶或单碱基延伸酶的底物参与pcr或单碱基延伸反应,从而不干扰后续反应,属于第二种纯化方式。应当指出的是,单独的外切酶exoⅰ不起纯化作用,当它与碱性磷酸酶混合使用时,其作用是预先将单链dna(在反应完成的pcr产物体系中,主要是剩余的pcr引物)降解成dntp,再由碱性磷酸酶令dntp继续降解。由于pcr引物被降解,不会进入最后的质谱检测步骤,因此,如果计划纯化步骤中增加外切酶exoⅰ处理,则无需使用具有保护碱基的pcr引物。此外,在单碱基延伸步骤之前,由于外切酶和碱性磷酸酶都通过高温灭活,其不降解在单碱基延伸步骤中加入的单链的延伸引物、ddntp等,因此对后续实验不会产生影响。术语“检测窗口”,指可用于质谱检测核苷酸分子量的范围,通常涉及引物的设计参考范围。为避免不同延伸引物与产物间由于分子量接近而存在干扰,从而可在一个相对较宽的检测窗口,如4000-9000da,实现对多种物质的同时检测。术语“snp”基因型,表示物种基因组中单核苷酸多态性的类型。其中,在实际检查中,作为对照的用于检测的基因型既可来自于对于物种的基因组中,也可来自克隆入质粒的载体工具,而后者具有可复制和保存便捷、来源稳定易得而受到实际使用者的欢迎。术语“检测产品”,指用于检测snp位点基因型的任何常规产品,包括:检测试剂、检测芯片(如基因芯片、液体芯片等)、检测载体,以及检测试剂盒等。术语“snp变异频率”,指snp位点发生变异的概率。理论上,本发明能同时检测单个个体中同时存在6个snp位点。但实践中研究者发现,不同snp位点在不同种族或不同个体中存在一定的变异频率。比如cyp2c19基因多态性存在种族性差异,中国人群cyp2c19失去功能型基因型主要是cyp2c9*2和cyp2c9*3型,snp变异频率分别为24%-25%和2%-3%,cyp2c19*17频率仅为1.2%-3%,其中cyp2c19*2频率与非裔美国人近似,而比欧裔美国人高(chenl,etal.pharmacogenomics,2008,9(6);zhouqetal.pharmacogenomicsj,2009,9(6))。cyp2c19*4等位基因主要在高加索人群中被发现,也是抗痉挛药物弱代谢的等位基因之一,可解释高加索人群3%的弱代谢(fregusonr.j.etal.anewgeneticdefectinhumancyp2c19:mutationoftheinitiationcodonisresponsibleforpoormetabolismofs-mephenytoin.jpharmacolexpther,1998,284(1):356-361)。cyp2c19*5是罕见的突变基因,在高加索人群和中国白族人群中被发现,发生频率非常低(白族人0.25%,高加索人低于0.9%),但也可以引起弱代谢(ibeanug.c.etal.anadditionaldefectiveallele,cyp2c19*5,contributestothes-mephenytoinpoormetabolizerphenotypeincaucasians.pharmacogenetics,1998,8(2):129-135)。但未有关于利用*4、*5等位基因用于检测尤其是中国人群中氯吡格雷抵抗相关基因多态位点(snp)的报道。关于cyp2c19*17,cyp2c19*17为上游‐806c>t多态性形成的等位基因,它起促进药物代谢作用,因为含‐806c>t的调控元件可结合肝核蛋白,可加快cyp2c19的转录速率,从而提高cyp2c19对药物的代谢效率。根据dirksibbing(cytochrome2c19*17allelicvariant,plateletaggregation,bleedingevents,andstentthrombosisinclopidogrel‐treatedpatientswithcoronarystentplacement.circulation,2010,121(4):512)等人的研究结果显示,白人的cyp2c19*17等位基因频率为22.9%,显著高于国人7.98%。虽然,通常认为cyp2c19*17与氯吡格雷抵抗无关(tantryus,etal.circcardiovascgenet,2012,3),但该影响是确实存在的,对于携带cyp2c19*17的患者应用阿司匹林加氯吡格雷双联抗栓导致的出血事件正受到密切关注。根据一项关于肠溶阿司匹林致cahd患者上消化道出血的研究(accf/acg/aha2008expertconsensusdocumentonreducingthegastrointestinalrisksofantiplatelettherapyandnsaiduse:areportoftheamericancollegeofgardiologyfoundationtaskforceonclinicalexpertconsensusdocuments.j.amcollcardiol.2008,52(18):1502‐17)显示,导致患者上消化道出血的发生与阿司匹林联用剂量存在效应关系,患者即使服用较低剂量阿司匹林也会引起上消化道出血;另一原因与其双联抗血小板有关,血小板对伤口的愈合起着关键作用,氯吡格雷为adp受体拮抗剂,抑制血小板聚集的同时,还可抑制血小板释放血管前生长因子。虽然氯吡格雷或许不是上消化道出血事件的直接原因,但其抗血管生长作用可能抑制了胃糜烂和其他药物或者幽门螺杆菌感染所致的小溃疡的愈合,在酸存在的情况下,这可能会导致一些没有临床症状的轻微胃黏膜损伤延迟愈合,甚至加剧为有明显临床症状的溃疡和出血。因此,在氯吡格雷给药中,如果忽视了cyp2c19*17导致消化道过度出血的影响,那么在发挥氯吡格雷抗血小板作用、预防心血管事件的过程中,有可能伴随消化道或其他器官的抗血小板而导致出现过度出血事件。因此,针对氯吡格雷用药的患者,本发明除了检测cyp2c19*2、*3位点之外,首次提出联合检测*4、*5尤其是*17位点以及abcb1的snp位点,以便合理选择抗血小板治疗方案。其中,*4、*5可保证补充检测中国境内所有人群,abcb1的snp位点可协同检测cyp2c19*2、*3位点的准确率,而cyp2c19*17则可避免氯吡格雷过度用药所带来的副作用。由于cyp2c19*17位点通过涉及与减少氯吡格雷用药副作用以及合理选择抗血小板治疗方案,从而也属于氯吡格雷抵抗相关的基因多态位点。由此可见,本发明的术语“氯吡格雷抵抗相关的多态性位点”包括抑制氯吡格雷活性的多态性位点,也包括强化氯吡格雷活性的多态性位点(如cyp2c19*17),由于这些位点都与抗血小板治疗方案相关,因此该术语也可称为“抗血小板治疗方案相关的多态性位点”。应当指出的是,鉴于以上核酸质谱的特殊性,例如,其需先通过pcr反应扩增出含snp位点的片段,然后通过延伸引物延伸出snp位点的碱基;各snp的pcr反应、延伸反应间无明显干扰;各snp的延伸引物、产物间分子量要有足够大的差异以便实现区分等,因此,并非所有的已知snp均可以用来进行核酸质谱的检测,也并不是所有针对snp位点设计的引物均可用以进行多重pcr反应和多重单碱基延伸反应。例如,cláudiam.b等人(optimizationofamultiplexminisequencingprotocolforpopulationstudiesandmedicalgenetics,genet.mol.res4(2005)115-125)指出,在进行多重pcr反应前需首先对单重pcr的反应效果进行验证,如果单重pcr扩增效率低则需要放弃,另外,若pcr产物长度偏长,多重pcr效果会比较差,也需要放弃。nissumm等人(high-throughputgeneticscreeningusingmatrix-assistedlaserdesorption/ionizationmassspectrometry,psychiatrgenets12(2002)109-117)也报道了通过maldi-tofms高通量检测snp的过程中,发现只能获得90%的准确率,其中在标准实验条件下,竟然有5%的情况不能实施pcr扩增过程,而在单碱基延伸过程中,由于自身引物自身配对、引物二聚体的形成以及扩增产物过低等因素,也导致有5%的情况难以实现单碱基延伸过程,因此必须进一步优化核酸质谱实验条件(如扩增引物、实验参数等),否则将影响maldi-tofms在核酸质谱检测snp的应用。此外,在核酸质谱检测过程中,多重扩增过程的干扰作用,对于最终获得的延伸产物也存在影响。saschasauer等人(typingofsinglenucleotidepolymorphismsbymaldimassspectrometry:principlesanddiagnosticapplications,clinicachimicaacta363(2006)95-105)和heyiyang等人(multiplexsingle-nucleotidepolymorphismgenotypingbymatrix-assistedlaserdesorption/ionizationtime-of-flightmassspectrometry,analyticalbiochemistry314(2003)54–62)在利用maldi质谱技术研究核酸质谱检测过程中提出,所设计的多重引物应具有相近的熔解温度(tm值)并彼此间的相互作用力较弱。如果引物之间的相互作用力过于强烈(δg的最小值为-10kcal/mol),那么必须放弃该理论设计的引物而重新进行设计;当同一反应体系中存在多重反应引物,那么多重扩增的规模主要受限于引物之间的相互作用程度,从而影响核酸质谱检测过程;此外,为了准确区分不同碱基之间的差异,特别是腺嘌呤(a)和胸腺嘧啶(t)(4种碱基中这二者分子量之间差值最小,为9da),要求的寡核苷酸长度一般不超过40个碱基,实际应用中,质谱检测窗口的分子量范围一般为4000~9000da,即要求所涉及的延伸引物和产物的分子量尽量分布在4000~9000范围之内。同时,要避免各延伸引物及其延伸产物之间的叠合。由此可见,并非所有已知的snp均可应用于核酸质谱尤其是多重核酸质谱的检测,其实际效果会受到多种实验因素的影响,因此需要通过实验来验证snp的可行性以及筛选不同引物的组合。附图说明图1为实施例四中,对c1样本6个位点的检测结果。图2为实施例四中,对c2样本6个位点的检测结果。图3为实施例四中,对c3样本6个位点的检测结果。图4为实施例四中,对c4样本6个位点的检测结果。图5为实施例四中,对c5样本6个位点的检测结果。图6为实施例四中,对c6样本6个位点的检测结果。图7为实施例四中,对c7样本6个位点的检测结果。图8为实施例四中,对c8样本6个位点的检测结果。图9为实施例四中,对c9样本6个位点的检测结果。图10为实施例四中,对c10样本6个位点的检测结果。图11为实施例四中,对c1样本abcb1‐3435位点的检测结果,从左至右三条虚线分别是延伸引物、突变型(t)延伸产物、野生型(c)延伸产物的理论峰值,检测结果显示该样本为tc杂合。图12为实施例四中,对c1样本cyp2c19*17位点的检测结果,从左至右三条虚线分别是延伸引物、野生型(c)延伸产物、突变型(t)延伸产物、的理论峰值,检测结果显示该样本为cc纯合。图13为实施例四中,对c1样本cyp2c19*2位点的检测结果,从左至右三条虚线分别是延伸引物、野生型(g)延伸产物、突变型(a)延伸产物的理论峰值,检测结果显示该样本为ga杂合。图14为实施例四中,对c1样本cyp2c19*3位点的检测结果,从左至右三条虚线分别是延伸引物、突变型(a)延伸产物、野生型(g)延伸产物的理论峰值,检测结果显示该样本为gg纯合。图15为实施例四中,对c1样本cyp2c19*4位点的检测结果,从左至右三条虚线分别是延伸引物、突变型(g)延伸产物、野生型(a)延伸产物的理论峰值,检测结果显示该样本aa纯合。图16为实施例四中,对c1样本cyp2c19*5位点的检测结果,从左至右三条虚线分别是延伸引物、突变型(t)延伸产物、野生型(c)延伸产物的理论峰值,检测结果显示该样本为cc纯合。图17为对6个位点均为野生型的质粒a1‐a6的检测结果,其中:峰1(4742.1)表示abcb1‐3435位点野生型(c),峰2(5179.3)表示cyp2c19*4位点野生型(a),峰3(5306.5)表示cyp2c19*5位点野生型(c),峰4(5417.6)表示cyp2c19*3位点野生型(g),峰5(6032)表示cyp2c19*17位点野生型(c),峰6(6400.2)表示cyp2c19*2位点野生型(g),图18为对6个位点均为突变型的质粒b1‐b6的检测结果,其中:峰1(4726.1)表示abcb1‐3435位点突变型(t),峰2(5099.4)表示cyp2c19*4位点突变型(g),峰3(5290.5)表示cyp2c19*5位点突变型(t),峰4(5401.6)表示cyp2c19*3位点突变型(a),峰5(6111.9)表示cyp2c19*17位点突变型(t),峰6(6480.1)表示cyp2c19*2位点突变型(a),图19为对照实施例一中,对c3样本abcb1‐3435位点的测序结果,显示为ag(反向测序)杂合。图20为对照实施例一中,对c3样本cyp2c19*17位点的测序结果,显示为ct杂合。图21为对照实施例一中,对c3样本cyp2c19*2位点的测序结果,显示为tc(反向测序)杂合。图22为对照实施例一中,对c3样本cyp2c19*3位点的测序结果,显示为g纯合。图23为对照实施例一中,对c3样本cyp2c19*4位点的测序结果,显示为a纯合。图24为对照实施例一中,对c3样本cyp2c19*5位点的测序结果,显示为c纯合。实施例下面结合具体实施例对本发明作进一步详细说明。实施例一:引物设计及合成。针对cyp2c19基因rs4244285(cyp2c19*2681g>a)、rs4986893(cyp2c19*3636g>a)、rs28399504(cyp2c19*41a>g)、rs56337013(cyp2c19*51297c>t)、rs12248560(cyp2c19*17‐806c>t)和abcb1基因rs1045642(3435c>t)等6个与药物代谢相关基因多态位点设计对应特异性pcr引物核心序列(seqidno:1至seqidno:12)和特异性延伸引物核心序列(seqidno:13至seqidno:18)。其中,为了避免pcr引物进入质谱仪检测窗口而干扰检测效果,每条pcr引物的5'端可以在核心序列(seqidno:1至seqidno:12)的基础上增加一定数目的碱基,常见如10bp的tag(acgttggatg),以使pcr引物的分子量增大,从而超出质谱仪检测窗口。相关引物在上海捷瑞生物工程有限公司进行合成。实施例二:样本dna提取。收集临床患者,共10例。其中,样本采集、dna提取等按照说明书要求,采集人静脉血,并以edta抗凝管收集。按照说明书要求,采集的血液在2‐8℃保存不应超过一周,‐20℃保存不应超过一个月,并可采用冰壶加冰或泡沫箱加冰密封进行运输,建议尽量采用新鲜血液进行基因组dna提取。由于本试剂盒不提供人基因组dna提取试剂,因此采用商业化的核酸提取试剂盒(如qiagen公司的dneasybloodandtissuekit),从每位患者的200μl全血中提取人基因组dna,以nanodrop2000(thermo公司)定量,并标化至30ng/μl(分别为c1‐c10)。其中,该试剂盒推荐对浓度为30ng/μl的人基因组dna进行检测,但对比实验表明,本试剂盒对浓度低至10ng/μl的人基因组dna也能检测出阳性结果。按照说明书要求,提取后的人基因组dna,在2‐8℃保存不应超过一周,‐20℃保存不应超过两年,‐80℃可长期保存,应避免反复冻融,并置于冰盒中进行运输。实施例三:生物学实验。使用abi9700型pcr仪,按说明书对6个与氯吡格雷抵抗基因相关的基因和abcb1基因多态位点进行检验。试剂盒中用于pcr、pcr产物纯化和单碱基延伸的组分见表3:表3.试剂盒组成序号组分名称主要成分包装规格1反应液idntps、tris、mgcl2270μl/管×1管2酶ipcr酶、ung酶22μl/管×1管3扩增引物pcr引物100μl/管×1管4反应液iitris、mgcl2170μl/管×1管5酶iisap酶30μl/管×1管6反应液iiiddntps、tris、mgcl2100μl/管×1管7酶iii延伸酶4μl/管×1管8延伸引物延伸引物100μl/管×1管9阳性质控品—50μl/管×1管10阴性质控品—50μl/管×1管其中各引物对浓度均为500nmol/l。按说明书,具体操作方法如下:1.pcr扩增1.1在pcr配液区,按照待检样本数,准备对应数量的pcr反应管/孔,并标记样本编号。建议在每次pcr反应中,阳性质控品、阴性质控品和空白实验共同进行分析。;1.2从试剂盒中取出pcr引物混合液、pcr反应液,使其自然解冻,涡旋振荡使其充分混匀,瞬时离心至管底;1.3根据样本数目,按表4的比例取出各组分,置于一个离心管中混匀后,向每个pcr反应管/孔中加入4μl。建议适当放大配制体积,避免因移液器吸头残留等因素造成最后不够分装的现象。表4.pcr反应体系组分名称单反应体积反应液i2.78μl酶i0.22μl扩增引物1.00μl合计4.00μl1.4在pcr扩增区内向每个已加入pcr混合物的pcr管/孔中加入1μl待测样本,混匀后瞬时离心。此时每份pcr反应体系总体积为5μl。其中,阴,阳性质控分别加入阴性质控品和阳性质控品,空白对照加入纯化水。1.5将加入pcr混合物、待测样本的pcr管/孔置于pcr扩增仪内,按表5的程序进行pcr扩增反应。表5.pcr反应热循环程序2.sap酶消化2.1从试剂盒中取出sap反应所需的各组分,室温融化后振荡混匀,瞬时离心后使用。2.2在pcr配液区,根据样本数目,按表6的比例取出各组分,置于一个离心管中混匀后,向每个pcr反应产物中加入2μlsap混合物。建议适当放大配制体积,避免因移液器吸头残留等因素造成最后不够分装的现象。表6.sap酶消化反应体系组分名称单反应体积反应液ii1.7μl酶ii0.3μl合计2.0μl2.3将加入sap混合物的pcr管/孔置于pcr扩增仪内,按下表7的程序进行反应。表7.sap酶消化反应程序温度(℃)时间(分)循环数3740185514hold3.延伸3.1在pcr配液区,根据样本数目,按表8的比例取出延伸反应各组分,置于一个离心管中混匀后,向每管sap酶消化产物中加入2μl,混匀后瞬时离心,此时每管内液体体积为9μl。由于分装过程中,移液器吸头残留等因素可能造成不足以分装出所需的份数,建议适当放大配制体积。表8.延伸反应体系组分名称单反应体积反应液iii1.019μl酶iii0.041μl延伸引物0.940μl合计2.000μl3.2将装有延伸混合物、sap酶消化产物的pcr管/孔置于pcr扩增仪内,执行下表9程序。表9.延伸反应程序4.纯化延伸反应完毕后,在pcr扩增区向每pcr管/孔延伸产物中加入41μl纯水和15mg树脂,颠倒混匀30分钟,13000rpm离心10min。5.点样将纯化后的产物点样至靶片。实施例四:上机检测及结果判读。使用北京毅新博创生物科技有限公司生产的clin‐tof型飞行时间质谱仪对点样后的靶片进行检测和结果判断。另外,分别设置以上位点的野生型对照a1‐a6、突变型对照b1‐b6。其中,野生型对照a1‐a6、突变型对照b1‐b6分别来自市售或实验室保藏的人工质粒。本发明中所用的野生型对照质粒a1‐a6和突变型对照质粒b1‐b6,为在商品化质粒pmd18‐tvector(takara公司)的基础上,根据《分子克隆》记载的常规方法,用引物和正常人dna进行pcr后,将pcr产物插入pmd18‐tvector,即构建野生型质粒a1‐a6,再分别定点突变,即构建6个突变型质粒b1‐b6。所述质粒a1‐a6和b1‐b6可长期保存于‐20℃甘油中,用时活化并提取质粒dna。如前述表2所示,6条延伸引物及它们在6个基因多态位点上根据各自基因型产生的延伸产物具有不同的分子量,这些分子量对应各自的质谱峰,若在某分子量处出现质谱峰,则判断为存在与该分子量对应的物质(延伸引物或产物):判断标准:(1)若野生型和突变型对应的质谱峰均未出现,无论延伸引物对应的质谱峰是否存在,均判断为实验失败;(2)若野生型或突变型对应的质谱峰仅出现一个,则判断为所出现质谱峰对应的基因型的纯合型;(3)若野生型或突变型对应的质谱峰均出现,则判断为杂合型。质谱结果如图1‐19所示,其中图18为6个snp位点均为野生型的质粒a1‐a6的质谱图,图19为6个snp位点均为突变型的质粒b1‐b6的质谱图。以前述表2所示各位点延伸引物及延伸产物的分子量检查样本c1‐c10的质谱结果(图1‐10),确定各snp位点的基因型,结果如表10所示:表10.样本c1‐c10格snp位点基因型c1c2c3c4c5c6c7c8c9c10abcb1‐3435tctctctttctcccccyp2c19*17ccctcccctccccyp2c19*2gagagaggaagaggacyp2c19*3gagggggggggcyp2c19*4aaaaaaaaaacyp2c9*5cccccccccc即在10例患者中,共检测出rs1045642位点tc杂合型5例,tt纯合突变型2例,rs12248560位点ct杂合型2例,rs4244285位点ga杂合型5例,aa纯合突变2例,rs4986893位点ag杂合型1例。对照实施例一、pcr测序验证一、根据实施例1,使用以下如表11所示引物,对各位点进行测序:表11.各位点测序引物二、样本dna来源为使不同实验之间产生的数据具有可比性,测序验证采用实施例二中从10例患者体内采集的静脉血中提取的人基因组dna(c1‐c10)。三、测序鉴定1、pcr反应体系为25μl2、反应条件:反应在abi公司9700热循环仪上进行,反应条件为94℃预变性5分钟,94℃变性30秒,56℃退火30秒,72℃延伸40秒,35个循环,反应结束后再72℃延伸7分钟,4℃保存。1、pcr产物纯化和测序(1)向装有pcr产物的96孔板中加入50微升洗涤缓冲液,混匀。(2)将其转移到millipore纯化板中,放到真空泵上抽滤约3分钟,看到纯化板中没有水即可。(3)向纯化板中再次加入50微升的洗涤缓冲液,继续抽滤,直到纯化板中没有水为止。(4)将纯化板从真空泵上取下,向板中加入20微升的去离子水,静置15分钟。(5)再震荡15分钟,然后吸到一新96孔板内。测序反应所需试剂应为新鲜配制,需要经高压灭菌的试剂必须灭菌后方可使用。测序反应所需的器材(如384孔板、tip头等)同样应为洁净无菌的。(6)为了保证测序样本及反应试剂的新鲜,加样时应在冰上操作。(7)测序反应体系为5μl,各种试剂加入量如下:pcr产物3‐10ng,bigdyev3.10.25μl,5*bigdyebuffer0.875μl,引物1.6pmol;(8)样品放于pcr仪上做如下反应:步骤:95℃,5分;95℃,10秒;60℃,4分;重复30个循环;4℃保持直到准备纯化。(9)在每个孔中加入20μl80%乙醇,4,000rpm离心30min;(10)将样品板放在折好的纸巾上,在离心机中倒甩,倒甩时速率1000rpm;(11)在每孔中加入30μl70%乙醇,4000rpm离心10min,倒甩;(12)重复第11步的操作2次;(13)将样品板放于干净的抽屉中,避光干燥30min;(14)加人5μl甲酰胺,封膜,离心后置于‐20℃冰箱中;(15)测序仪前95℃变性5分钟,放置冰上2分钟,离心后上样;(16)使用abi3730xl型遗传分析仪进行序列测定。四、结果对c1‐c10样本,使用上表所述的引物,分别对rs1045642,rs12248560,rs4244285,rs4986893,rs28399504,rs56337013(分别编号序列1‐6)进行测序,共计60次测序。根据测序的附图19‐24,最终测序结果如表12所示:表12.各位点测序结果汇总患者编号序列1序列2序列3序列4序列5序列6c1tccgagacc2tccgaagacc3tcctgagacc4tcggacc5tcgagacc6tccagacc7tcctggacc8ccagacc9ccggacc10ccgagac经过比较,表10的结果与表12完全一致,说明本发明检测方法的准确性。对照实施例二、大范围用药人群的氯吡格雷抵抗测试1、检测样本对北京、广州两地的医院149例需要接受皮冠状动脉介入治疗pci的中外患者(如冠状动脉粥样硬化性心脏病,等),收集患者的血样,按照实施例一‐四的方法进行测试。其中测试组a:扩增引物仅仅包含seqidno:7‐8和11‐12,延伸引物仅仅包括seqidno:16和18。测试组b:包含本发明所有引物系统。2、检测结果对于测试组a,cyp2c19*2有72例(48.3%),cyp2c19*3有23例(15.4%)。在以上两种snp类型中,其中有9例是同时为cyp2c19*2/*3(6.0%)。另外,经计算,约有31.23%的患者adp(二磷酸腺苷)抑制率小于20%,adp抑制率介于20%‐50%的患者约44.87%。而对于测试组b,除了以上cyp2c19*2、*3的检测数据之外,另有5例为cyp2c19*4,3例为cyp2c19*5,1例为abcb1多态性。在以上类型中,其中有2例同时为cyp2c19*2/*4,1例同时为cyp2c19*2/*3/*4,1例同时为cyp2c19*2/*5。由此,经计算,所述149例患者中,对adp(二磷酸腺苷)抑制率小于20%的数量应为37.79%,adp抑制率介于20%‐50%的患者约40.54%,即adp抑制率处于正常范围的患者数量相比于测试组a明显减少。此外,对于测试组b中,cyp2c19*17共有18例,其中8例为cyp2c19*2,1例为cyp2c19*3,1例为cyp2c19*2/*4,9例为未含有上述5种基因多态性的患者。因此,根据以上检测结果,对于未检测出以上位点的患者,在pci术前常规服用阿司匹林300mg、波利维(硫酸氢氯吡格雷)300mg,急性心肌梗死pci术后服用拜阿司匹林300mg/天,服用1个月后减量为100mg/天,长期维持;波利维75mg/天,至少口服12个月。对于这9例仅含有cyp2c19*17的患者,应下调阿司匹林和波利维剂量,合理应用抗血小板药物,必要时联用ppi和胃黏膜保护剂可减少出血。对于所有接受抗血小板治疗的患者,都需要进行出血监测,尽早发现患者出血迹象。而对于含有以上多种多态性位点的患者,则需要根据氯吡格雷抵抗和氯吡格雷强反应(即cyp2c19*17的强化血小板影响),合理选择抗血小板的治疗方案。由此可见,相比于仅仅针对cyp2c19*2/*3两种等位基因进行检测,本发明更能全面适应中国境内患者对于氯吡格雷抵抗用药筛查的需要,有利于合理选择抗血小板的治疗方案。sequencelisting<110>北京毅新博创生物科技有限公司<120>cyp2c19和abcb1基因检测试剂盒<130>2016<160>18<170>patentinversion3.5<210>1<211>20<212>dna<213>人工合成序列<400>1actgcagcattgctgagaac20<210>2<211>20<212>dna<213>人工合成序列<400>2aaggcatgtatgttggcctc20<210>3<211>20<212>dna<213>人工合成序列<400>3agtgcaagctcacggttgtc20<210>4<211>20<212>dna<213>人工合成序列<400>4gagcacaaggaccacaaaag20<210>5<211>20<212>dna<213>人工合成序列<400>5catgaggagtaacttctccc20<210>6<211>20<212>dna<213>人工合成序列<400>6taaaaacagctccatgcggg20<210>7<211>20<212>dna<213>人工合成序列<400>7gactgtaagtggtttctcag20<210>8<211>20<212>dna<213>人工合成序列<400>8aacatcaggattgtaagcac20<210>9<211>20<212>dna<213>人工合成序列<400>9aggtcttctgatgcccatcg20<210>10<211>19<212>dna<213>人工合成序列<400>10aacaaagttttagcaaacg19<210>11<211>20<212>dna<213>人工合成序列<400>11gcaataattttcccactatc20<210>12<211>20<212>dna<213>人工合成序列<400>12tccatcgattcttggtgttc20<210>13<211>15<212>dna<213>人工合成序列<400>13ctttgctgccctcac15<210>14<211>16<212>dna<213>人工合成序列<400>14accacaaaaggatcca16<210>15<211>17<212>dna<213>人工合成序列<400>15ctctcccacacaaatcc17<210>16<211>17<212>dna<213>人工合成序列<400>16attgtaagcaccccctg17<210>17<211>19<212>dna<213>人工合成序列<400>17gtgtcttctgttctcaaag19<210>18<211>20<212>dna<213>人工合成序列<400>18agtaatttgttatgggttcc20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1