用于检测伤口感染病原菌的引物组合及集成装置的制作方法
本发明属于微生物检测领域,涉及一种用于检测伤口感染病原菌的引物组合及集成装置。
背景技术:
由病原菌导致的伤口感染及传染病目前仍是威胁全球人类健康的主要疾病,伤口感染和传染病的控制主要从发现、诊断、治疗和预防几个方面进行,其中病原菌的诊断对于尽早确认、尽早控制伤口感染和传染病非常重要。由病原菌导致的伤口感染诊断、感染性腹泻诊断、进出口食品和化妆品的检验检疫、流行病学调查等具有重要的社会意义,它们对病原菌检测提出了更高的要求,如何实现病原菌的快速、准确和高效的检测是我国当前面临的重大课题。
目前我国对于病原菌的诊断主要依靠分离培养生化鉴定。但该方法存在如下不足:(1)实验周期长,难以及时满足临床需求,而尽早了解病原菌对于临床治疗至关重要;(2)难以检出需要特殊培养的细菌,如某些厌氧或微需氧菌等;(3)易导致空气中细菌对标本的污染,致使假阳性结果出现;(4)由于实验室保护条件的限制,实验室工作人员在分离病原菌时存在着被感染的高风险。
当伤口(包括自然创口和手术切口)微生物污染达到一定程度时,会发生伤口部位的感染。伤口感染影响患者预后及延长住院时间,监测伤口感染细菌构成与其耐药性,对临床预防和治疗药物选择具有重要价值。
“民以食为天”。食品在生产、加工、贮存、运输和销售等各个环节都有可能受到环境中病原菌的污染,而这些病原菌会导致各种食源性疾病,甚至死亡。近年来我国对外贸易发展迅速,各种食品的进出口量迅猛增加,进出口检验检疫面临巨大压力。同时由于食品保质期的限制,对进出口检验检疫速度提出了更高的要求。
感染性腹泻在我国发病率居各类传染病之首,长期以来严重危害人民健康,并具有发病急、传播快等特点,对其进行快速诊断以确定传染源是传染病防治工作面临的首要问题。目前我国基层疾控单位采用的传统检测方法已不能满足复杂多变的疫情处理工作。
为了判断伤口是否被细菌感染、食品是否安全,预防和控制食源性传染病的传播以及快速诊断病原菌性食物中毒,必须要有一种能够快速、准确、及时、高效的检测病原菌的方法。
随着免疫学和分子生物技术的发展,免疫荧光技术、单克隆抗体技术、生物传感器技术、基因探针技术和pcr技术等已被应用于病原菌检测领域。这些技术灵敏度高、 特异性强,在微生物检测方面具有较好的应用前景。然而,这些检测技术一次实验一般只能检测一种微生物,而致病菌种类很多,尚不能满足实际检测工作的需要。
链置换技术是一种新型的恒温核酸扩增技术,该技术主要利用4种不同的特异性引物识别靶序列上6个特定区域,并利用一种具有链置换活性的dna聚合酶(bst酶),在恒温条件下快速扩增核酸,保证了扩增的高特异性和高效率。由于链置换技术独特的核酸扩增机制,它的产物是由多个重复靶序列的茎环状dna和花椰菜状dna所组成的混合物,在琼脂糖凝胶电泳中会呈现出链置换反应典型的阶梯状条带;同时,核酸大量生成时,从dntps中析出的焦磷酸根离子与反应体系中的mg2+结合,产生肉眼可见的扩增反应副产物-白色焦磷酸镁沉淀;另外,由于扩增产物大量生成,加入荧光染料(如sybrgreen和evagreen)后,可在紫外灯下观察到明显荧光。因此,链置换反应扩增结果不但观察方式多样,且结果鉴定简便,非常适合现场快速检测。
鉴于链置换技术具有众多优势,现已逐渐应用于病原菌的检测。但目前已有的方法只能在一个系统中针对某一种致病菌进行检测,在需要快速筛查多个致病菌时,需要分别对其进行检测,仍有较大的工作量。
生物芯片技术是九十年代建立的一种全新的分析检测技术,它伴随着人类基因组计划的开展逐步发展起来。该技术综合运用了分子生物学技术、集成电路制造技术、计算机技术、半导体技术、共聚焦激光扫描技术、荧光标记技术等,使样品的检测具有敏感度高、特异性强、大规模集成化、自动化、操作简便、快速、高效率等优点。目前,生物芯片技术主要应用于生命科学与医学研究和生物制药等方面。利用生物芯片技术实现对多种病原菌的快速检测鉴定也是一个蓬勃发展的科研领域,在临床医疗中具有广阔的应用前景。
技术实现要素:
本发明的目的是提供一种用于检测伤口感染病原菌的引物组合及集成装置。
本发明首先保护一种引物组合,为如下(a1)或(a2)或(a3):
(a1)由引物组ⅰ、引物组ⅱ和引物组ⅲ组成;
(a2)由所述引物组ⅰ、所述引物组ⅱ、所述引物组ⅲ中的任意两个组成;
(a3)所述引物组ⅰ或所述引物组ⅱ或所述引物组ⅲ;
所述引物组ⅰ由引物a1、引物a2、引物a3、引物a4、引物a5和引物a6组成;
所述引物a1为如下(b1)或(b2);
(b1)序列表的序列1所示的单链dna分子;
(b2)将序列1经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列1具有相同功能的dna分子;
所述引物a2为如下(b3)或(b4);
(b3)序列表的序列2所示的单链dna分子;
(b4)将序列2经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列2具有相同功能的dna分子;
所述引物a3为如下(b5)或(b6);
(b5)序列表的序列3所示的单链dna分子;
(b6)将序列3经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列3具有相同功能的dna分子;
所述引物a4为如下(b7)或(b8);
(b7)序列表的序列4所示的单链dna分子;
(b8)将序列4经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列4具有相同功能的dna分子;
所述引物a5为如下(b9)或(b10);
(b9)序列表的序列5所示的单链dna分子;
(b10)将序列5经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列5具有相同功能的dna分子;
所述引物a6为如下(b11)或(b12);
(b11)序列表的序列6所示的单链dna分子;
(b12)将序列6经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列6具有相同功能的dna分子;
所述引物组ⅱ由引物b1、引物b2、引物b3、引物b4、引物b5和引物b6组成;
所述引物b1为如下(c1)或(c2);
(c1)序列表的序列7所示的单链dna分子;
(c2)将序列7经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列7具有相同功能的dna分子;
所述引物b2为如下(c3)或(c4);
(c3)序列表的序列8所示的单链dna分子;
(c4)将序列8经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列8具有相同功能的dna分子;
所述引物b3为如下(c5)或(c6);
(c5)序列表的序列9所示的单链dna分子;
(c6)将序列9经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列9具有相同功能的dna分子;
所述引物b4为如下(c7)或(c8);
(c7)序列表的序列10所示的单链dna分子;
(c8)将序列10经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列10具有相同功能的dna分子;
所述引物b5为如下(c9)或(c10);
(c9)序列表的序列11所示的单链dna分子;
(c10)将序列11经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列11具有相同功能的dna分子;
所述引物b6为如下(c11)或(c12);
(c11)序列表的序列12所示的单链dna分子;
(c12)将序列12经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列12具有相同功能的dna分子;
所述引物组ⅲ由引物c1、引物c2、引物c3、引物c4、引物c5和引物c6组成;
所述引物c1为如下(d1)或(d2);
(d1)序列表的序列13所示的单链dna分子;
(d2)将序列13经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列13具有相同功能的dna分子;
所述引物c2为如下(d3)或(d4);
(d3)序列表的序列14所示的单链dna分子;
(d4)将序列14经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列14具有相同功能的dna分子;
所述引物c3为如下(d5)或(d6);
(d5)序列表的序列15所示的单链dna分子;
(d6)将序列15经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列15具有相同功能的dna分子;
所述引物c4为如下(d7)或(d8);
(d7)序列表的序列16所示的单链dna分子;
(d8)将序列16经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列16具有相同功能的dna分子;
所述引物c5为如下(d9)或(d10);
(d9)序列表的序列17所示的单链dna分子;
(d10)将序列17经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列17具有相同功能的dna分子;
所述引物c6为如下(d11)或(d12);
(d11)序列表的序列18所示的单链dna分子;
(d12)将序列18经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列18具有相同功能的dna分子。
本发明还保护所述引物组合在制备试剂盒中的应用;所述试剂盒的用途为如下(g1)或(g2):
(g1)鉴定伤口感染病原菌;
(g2)用于检测待测样本中是否含有哪种或哪几种伤口感染病原菌。
所述伤口感染病原菌为创伤弧菌和/或溶藻弧菌和/或金黄色葡萄球菌。
本发明还保护含有所述引物组合的试剂盒;所述试剂盒的用途为如下(g1)或(g2):
(g1)鉴定伤口感染病原菌;
(g2)用于检测待测样本中是否含有哪种或哪几种伤口感染病原菌。
所述试剂盒还可包括反应试剂。所述反应试剂包括dntps、dutp、ung、evagreen、bsa、dtt、bstdnapolymerasebuffer、tris-hcl、mgso4、m-mlvreversetranscriptase、rnasinplus、bstdnapolymerase和betaine中一种或任意组合。
所述反应试剂具体可为链置换扩增试剂。链置换扩增试剂(26微升体系)具体为:含5.0ubst酶,0.3mmdutp,0.2mmdntps,0.1mg/mlbsa,1×evagreen,2.0mbetaine,10mmmgso4,0.5u/mluracil-dnaglycosylase,余量为水。
所述试剂盒还可包括反应载体。所述反应载体具体可为适合进行微纳升体系(1nl-10μl)的反应的容器。所述反应载体具体可为微流体芯片、微阵列芯片、ep管、96孔板或384孔板等。
所述微流体芯片包括芯片底座、薄膜胶层和盖片,所述芯片底座上部通过所述薄膜胶层与所述盖片粘贴在一起,并冲压紧密压合成一体;
位于所述芯片底座上,在所述芯片底座中心设置一中心定位孔,位于所述中心定位孔周围的底座上设置有一条以上的微流控通道,每条所述微流控通道均包括一波浪形的微管道,所述微管道各波峰均远离所述中心定位孔,各波谷邻近所述中心定位孔,在所述微管道的每一波峰位置处均连接有一反应池;所述微管道一端均设置有进样孔,所述微管道的另一端均设置出气孔,紧邻所述出气孔的微通道上设置有一缓冲通道。
所述伤口感染病原菌为创伤弧菌和/或溶藻弧菌和/或金黄色葡萄球菌。
本发明还保护所述试剂盒的制备方法,包括将各条引物单独包装的步骤。
本发明还保护一种检测待测菌是否为创伤弧菌或溶藻弧菌或金黄色葡萄球菌的方法,包括如下步骤:
(1)提取待测菌的基因组dna;
(2)以步骤(1)提取的基因组dna为模板,分别所述引物组合中的每个引物组 进行环介导等温扩增,然后进行如下判断:
如果采用所述引物组ⅰ可以实现以所述基因组dna为模板的特异性扩增,待测菌为或候选为创伤弧菌;
如果采用所述引物组ⅱ可以实现以所述基因组dna为模板的特异性扩增,待测菌为或候选为溶藻弧菌;
如果采用所述引物组ⅲ可以实现以所述基因组dna为模板的特异性扩增,待测菌为或候选为金黄色葡萄球菌。
本发明还保护一种检测待测样本中是否含有伤口感染病原菌的方法,包括如下步骤:
(1)提取待测样本的总dna;
(2)以步骤(1)提取的总dna为模板,分别采用所述引物组合中的每个引物组进行环介导等温扩增,然后进行如下判断:
如果采用所述引物组ⅰ可以实现以所述总dna为模板的特异性扩增,待测样本中含有或疑似含有创伤弧菌;
如果采用所述引物组ⅱ可以实现以所述总dna为模板的特异性扩增,待测样本中含有或疑似含有溶藻弧菌;
如果采用所述引物组ⅲ可以实现以所述总dna为模板的特异性扩增,待测样本中含有或疑似含有金黄色葡萄球菌。
所述伤口感染病原菌为创伤弧菌和/或溶藻弧菌和/或金黄色葡萄球菌。
所述待测样本具体可为伤口分泌物、排泄物、肠积液、呕吐物、土壤、水样、食品或化妆品等。
本发明还保护包埋有所述引物组ⅰ、所述引物组ⅱ和所述引物组ⅲ的微流体芯片;
所述微流体芯片包括芯片底座、薄膜胶层和盖片,所述芯片底座上部通过所述薄膜胶层与所述盖片粘贴在一起,并冲压紧密压合成一体;
位于所述芯片底座上,在所述芯片底座中心设置一中心定位孔,位于所述中心定位孔周围的底座上设置有一条以上的微流控通道,每条所述微流控通道均包括一波浪形的微管道,所述微管道各波峰均远离所述中心定位孔,各波谷邻近所述中心定位孔,在所述微管道的每一波峰位置处均连接有一反应池;所述微管道一端均设置有进样孔,所述微管道的另一端均设置出气孔,紧邻所述出气孔的微通道上设置有一缓冲通道;
所述微流体芯片中,至少一个反应池内包埋有所述引物组ⅰ中的各条引物,至少一个反应池内包埋有所述引物组ⅱ中的各条引物,至少一个反应池内包埋有所述引物组ⅲ中的各条引物,上述三个引物组分别包埋在不同的反应池内。
一个反应池内,引物a1和引物a2各包埋0.01nmol、引物a3和引物a4各包埋5nmol、 引物a5和引物a6各包埋0.05nmol。一个反应池内,引物b1和引物b2各包埋0.01nmol、引物b3和引物b4各包埋5nmol、引物b5和引物b6各包埋0.05nmol。一个反应池内,引物c1和引物c2各包埋0.01nmol、引物c3和引物c4各包埋5nmol、引物c5和引物c6各包埋0.05nmol。
所述微流体芯片中,至少一个反应池内包埋有阳性质控,至少一个反应池内包埋有阴性质控,阳性质控、阴性质控与所述三个引物组分别包埋在不同的反应池内。
阳性质控为能产生荧光信号的标准质控品指标核酸探针,阴性质控为不能产生荧光信号的标准质控品指标探针或者是空白探针。
在各反应池内可以采用低聚糖或低熔点生物相融性材料进行引物包埋。
所述阳性质控具体可为酿酒酵母,accc20034。所述阴性质控具体可为1g/100ml的琼脂糖水溶液。
本发明还保护一种用于同时检测多种伤口感染病原菌的检测集成装置,其特征在于包括如下部件:以上任一所述的包埋有所述引物组ⅰ、所述引物组ⅱ和所述引物组ⅲ的微流体芯片。
所述检测集成装置还包括如下部件:检测集成装置硬件;
所述检测集成装置硬件包括光学检测模块、加热温控模块、运动控制模块、信号处理系统、微流体芯片;所述微流体芯片在所述运动控制模块驱动下进行旋转运动,由所述信号处理系统向所述运动控制模块传输运动控制信号;所述微流控芯片周围设置所述加热温控模块,所述加热温控模块连接至所述信号处理系统,由所述信号处理系统控制所述加热温控模块的输出温度;位于所述微流体芯片上方还设置有所述光学检测模块,所述光学检测模块将采集到的实时荧光检测信号传输至所述信号处理系统。
反应平台及检测平台主要包括水浴锅、荧光定量pcr仪、微纳升体系流体芯片检测系统和普通pcr仪。产物检测方法包括用凝胶电泳显示所述扩增产物、用荧光扫描显示所述扩增产物、用染料sybrgreen或evagreen显示所述扩增产物、通过生成焦磷酸镁白色沉淀显示所述扩增产物、通过监测溶液浊度变化检测所述扩增产物。
所述检测集成装置还包括如下组件:反应试剂。
所述反应试剂包括dntps、dutp、ung、evagreen、bsa、dtt、bstdnapolymerasebuffer、tris-hcl、mgso4、m-mlvreversetranscriptase、rnasinplus、bstdnapolymerase和betaine中一种或任意组合。
所述反应试剂具体可为链置换扩增试剂。链置换扩增试剂(26微升体系)具体为:含5.0ubst酶,0.3mmdutp,0.2mmdntps,0.1mg/mlbsa,1×evagreen,2.0mbetaine,10mmmgso4,0.5u/mluracil-dnaglycosylase,余量为水。
本发明提供的引物组合及集成装置的优势:快速、并行、低样品试剂消耗。
本发明克服了目前ep管、孔板方法只能在一个单元体系中针对单一种病原菌进行检测,而不能同时对多种病原菌进行快速鉴定判断的缺陷。
与现有技术相比,本发明具有如下优点:
(1)每个引物组应用八个区段,六条引物,根据是否扩增就能判断靶标物质的存在与否,特异性强。
(2)利用本发明的多种病原菌快速检测引物组,能在同一反应体系中和同一反应温度条件下,实现同时对创伤弧菌、溶藻弧菌和金黄色葡萄球菌的快速检测,同一检测样品的dna提取液中只要含有这3种病原菌的基因组dna中的一种或几种,即可快速检测、准确判断出来,从而克服现有技术只能在一个封闭反应系统中检测单一种致病菌指标、而不能同时对多种致病菌进行检测的缺陷,大大提高检测效率。
(3)本发明的快速检测方法整个扩增反应过程最快可在50min内完成,产物扩增效率高,对上述3种致病菌的检测简便、准确。
(4)本发明的快速检测方法中,链置换反应扩增可在恒定温度下完成,且允许的温度波动范围较大(±1.5℃),因此对温控的仪器设备要求不高,水浴锅、板式加热器、荧光定量pcr仪、微纳升体系流体芯片检测系统和普通pcr仪均可满足要求。
(5)本发明的快速检测方法灵敏度高,3种致病菌的阳性扩增检出结果最低限优于10拷贝/反应体系基因组dna。
(6)本发明的快速检测方法对实验室条件要求低、适应性较强,且判定方法简便,可采用观察电泳条带、观察浊度或观察荧光等不同方法判定结果。
(7)与常规的平板培养法相比,本发明的快速检测方法可大大缩短检测周期,减少检测环节,从而降低因检测环节过多或人员技术水平和经验差异造成的误判的几率,使检测结果更为准确可靠,并可为伤口感染、感染性腹泻诊断、食品安全突发事件的处置、食品和化妆品检验检疫提供重要的技术支持。
本发明可以达到的具体性能指标如下:
1、系统适应的微流体腔体样品检测范围为1nl-10μl。
2、系统检测的灵敏度对应被测样品10个分子拷备数/体系。
3、系统温度控制范围0℃-100℃,等温扩增应用的可控有效扩增温度范围为50℃-65℃,温控精度0.1℃。
4、系统检测信号的实时采样频率范围≤200khz。
5、系统适应的微流体芯片几何形状大小为直径(或边长)1mm-200mm,厚度0.1mm-100mm。
6、系统并行检测病原菌指标≥3个,包括但不限于创伤弧菌、溶藻弧菌、金黄色葡萄球菌。
本发明涉及一种多种伤口感染病原菌快速并行检测方法,以检测包括创伤弧菌、溶藻弧菌和金黄色葡萄球菌在内的多种细菌。本发明还涉及所述伤口感染病原菌检测用引物组及试剂,微流体芯片和集成检测系统。本发明克服现有技术的不足,使用微量样本即可实现多种伤口感染病原菌快速、准确、高效的并行检测,灵敏度达到10核酸片段拷贝/指标。本发明可以用于伤口感染病原菌检测、细菌学分类与流行病学调查等领域,具有较大的社会效益与经济效益。
附图说明
图1为本发明的微流控芯片结构示意图。
图2为本发明的微流控芯片封装示意图。
图3为本发明的便携式微流控芯片病原菌检测集成装置的结构示意图。
图4为本发明的临床样本检测结果图示。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。琼脂糖:biowest,132030。accc的全称为中国农业微生物菌种保藏管理中心,网址为http://www.accc.org.cn/htdocs/pages.asp?id=3。创伤弧菌:accc01745。溶藻弧菌:accc02676。金黄色葡萄球菌:accc01332。
实施例1、制备各个引物组
用于检测创伤弧菌的引物组由如下六条引物组成(5’→3’):
引物a1(序列表的序列1):acaacgatctctgcctaga;
引物a2(序列表的序列2):ccaataccatttctgtgctaag;
引物a3(序列表的序列3):tgacagctccagccgttaacttatggtgagaacggtgacaa;
引物a4(序列表的序列4):cgtagccgagtggcatcccgcaccacactgttcga;
引物a5(序列表的序列5):aaccacccgcaaccg;
引物a6(序列表的序列6):ttgaccgtaaacgcagacaaaa。
用于检测溶藻弧菌的引物组由如下六条引物组成(5’→3’):
引物b1(序列表的序列7):tgaggtcatcatcactatgg;
引物b2(序列表的序列8):aaatcgcctaaagctttgg;
引物b3(序列表的序列9):tgggcgtattgatcattccaacgagcttgcagcacgcgtact;
引物b4(序列表的序列10):cggttaacggtgttttcactattttgtccgtttggttgccaat;
引物b5(序列表的序列11):ccactgggtcacttgcggta;
引物b6(序列表的序列12):gggcagtggaacgagca;
用于检测金黄色葡萄球菌的引物组由如下六条引物组成(5’→3’):
引物c1(序列表的序列13):gtgcctttacagatagcatg;
引物c2(序列表的序列14):gaaaaagtgtacgagttcttga;
引物c3(序列表的序列15):gtttcataaccttcagcaagctttccatacagtcatttcacgca;
引物c4(序列表的序列16):gaggtcattgcagcttgcttacttcgatcactggaccgcg;
引物c5(序列表的序列17):aactcatagtggccaaca;
引物c6(序列表的序列18):gtacctgttatgaaagtgttca。
用于检测创伤弧菌的引物组命名为引物组ⅰ,用于检测溶藻弧菌的引物组命名为引物组ⅱ,用于检测金黄色葡萄球菌的引物组命名为引物组ⅲ。
实施例2、制备微纳升体系流体芯片
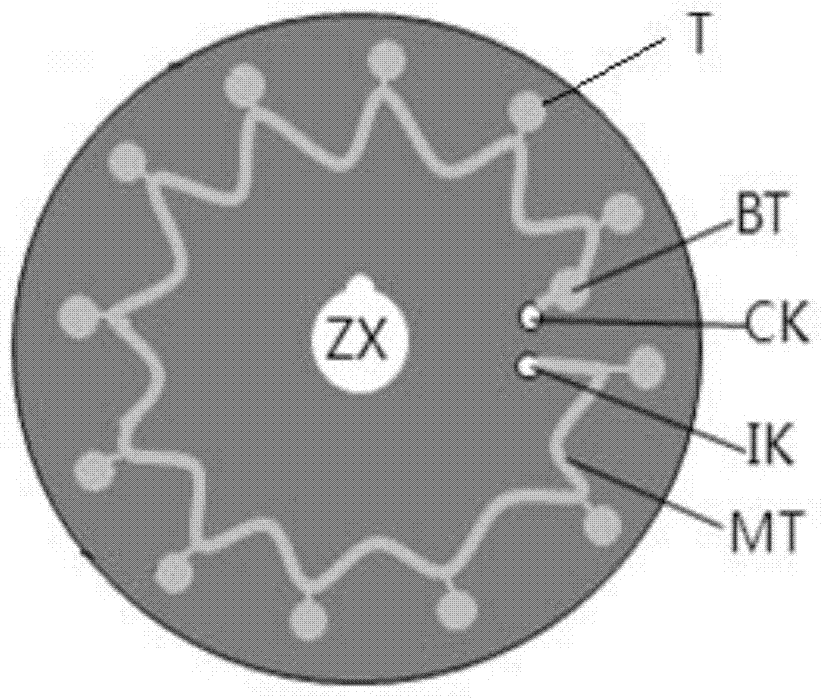
如图1所示,微流体芯片mc采用三层夹心结构,其包括芯片底座bc、薄膜胶层jm和盖片gp,芯片底座bc上部通过薄膜胶层jm与盖片gp粘贴在一起,并冲压紧密压合成一体。其中,薄膜胶层jm具有双面胶合特性,厚度≤10μm;底座bc、盖片gp为透明材料,厚度≤1mm。
如图2所示,位于芯片底座bc上,在芯片底座bc中心设置一中心定位孔zx,中心定位孔zx的边缘设置一定位凹槽。位于中心定位孔zx周围的底座上设置有一条以上的微流控通道,每条微流控通道均包括一波浪形的微管道mt,微管道mt的各波峰均远离中心定位孔zx,各波谷邻近中心定位孔zx,在微管道mt的每一波峰位置处均连接有一反应池t。微管道mt的一端均设置有进样孔ik,进样孔ik与移液器枪头紧密配合,在进样过程中通过预置一段空气柱在移液器顶端,来保证微流控芯片加样结束拔出移液器枪头后,进样孔ik没有液体泄露,有利于进样孔的密封;微管道mt的另一端均设置出气孔ck,紧邻出气孔ck的微通道mt上设置有一缓冲通道bt,用于收集多余液体,保证出气孔ck在进样中没有液体泄露,有利于出气孔ck的密封。至少一个反应池内包埋有引物组ⅰ中的各条引物,至少一个反应池内包埋有引物组ⅱ中的各条引物,至少一个反应池内包埋有引物组ⅲ中的各条引物,至少一个反应池内包埋有阳性质控pt,至少一个反应池内包埋有阴性质控nt。阳性质控为能产生荧光信号的标准质控品指标核酸探针,阴性质控为不能产生荧光信号的标准质控品指标探针或者是空白探针,通过阳性质控pt和阴性质控nt对核酸特异性检测识别结果进行有效性指示。其中,在各反应池内可以采用低聚糖或低熔点生物相融性材料进行引物包埋。
在一个优选的实施例中,芯片直径为60mm左右,进样孔ik和出气孔ck直径均为1mm左右,适合用移液器枪头向芯片注入样品和试剂。
在一个优选的实施例中,微流体芯片可以根据使用要求设置成不同形状,例如圆形、椭圆形等。
在一个优选的实施例中,芯片底座bc采用普通机械加工或注塑加工制成,并采用超声、低浓度酒精和纯净水等清洗干净。
用于进行实施例4和实施例5的微纳升体系流体芯片具体如下:
采用一条微流控通道,该微流控通道上设置有12个反应池,按照由进样孔至出气孔的方向,第四个反应池内包埋有引物组ⅰ中的各条引物(引物a1和引物a2各0.01nmol、引物a3和引物a4各5nmol、引物a5和引物a6各0.05nmol),第六个反应池内包埋有引物组ⅱ中的各条引物(引物b1和引物b2各0.01nmol、引物b3和引物b4各5nmol、引物b5和引物b6各0.05nmol),第八个反应池内包埋有引物组ⅲ中的各条引物(引物c1和引物c2各0.01nmol、引物c3和引物c4各5nmol、引物c5和引物c6各0.05nmol),第十个反应池内包埋有阳性质控(阳性质控即酿酒酵母,accc20034,每个反应池包埋100ng),剩余的反应池内均包埋有阴性质控(阴性质控即1g/100ml的琼脂糖水溶液,每个反应池包埋2μl)。
实施例3、微纳升体系流体芯片检测集成装置
如图3所示,微纳升体系流体芯片检测集成装置硬件包括光学检测模块ods、加热温控模块pid、运动控制模块mcd、信号处理系统sps、微流体芯片mc。微流体芯片mc通过中心定位孔zx固定在运动控制模块mcd上,并通过运动控制模块mcd控制其进行旋转运动;微流控芯片mc周围设置加热温控模块pid,微流控芯片mc与加热温控模块pid之间保持亚毫米的空气层,加热温控模块pid电连接至信号处理系统sps;在微流体芯片mc上方还设置有光学检测模块ods,光学检测模块ods与信号处理系统sps连接。光学检测模块ods将采集到的实时荧光检测信号传输至信号处理系统sps;信号处理系统sps将运动控制信号传输至运动控制模块mcd,运动控制模块mcd根据接收到的运动控制信号控制旋转速度,带动微流控芯片mc转动;同时,信号处理系统sps将温度控制信号输送至加热温控模块pid,加热温控模块pid根据接收到的温度控制信号控制对微流体芯片mc的加热温度。
在一个优选的实施例中,加热温控模块pid根据接收到的温度控制信号可以保证微流体芯片mc为恒定温度(如65℃)或为周期循环性变温(例如:94℃高温15秒钟→60℃低温30秒钟→72℃温度45秒钟;例如:94℃高温15秒钟→60℃低温30秒钟→72℃温度45秒钟),满足等温链置换反应和聚合酶链式反应的温控要求。
在一个优选的实施例中,光学检测模块ods采用白光成像或单色激发光诱导荧光或光吸收等方法,通过凝胶电泳显示扩增产物或激发光诱导荧光显示扩增产物或生成 焦磷酸镁白色沉淀显示扩增产物或通过监测溶液浊度变化检测扩增产物。
在一个优选的实施例中,反应载体mc可以为微流控芯片、微阵列芯片、pcr管、96孔板或384孔板等。
本发明提供的微流控芯片mc和微纳升体系流体芯片检测集成装置组合使用,可进行多种伤感细菌快速并行分子诊断。
实施例4、集成装置的应用
待测样本分别为创伤弧菌、溶藻弧菌或金黄色葡萄球菌。
1、样品处理
取0.1克待测样本,置于装有1l营养肉汤培养基的锥形瓶中,37℃、100rpm振荡培养8小时。
2、dna抽提
(1)完成步骤1后,取1ml培养体系,先置于冰浴中静置孵育5分钟,然后在室温下3000rpm离心10分钟,收集上清液。
(2)取步骤(1)得到的上清液,在室温下10000rpm离心5分钟,收集沉淀。
(3)将步骤(2)得到的沉淀转移至ep管(装有1毫升粒径为0.5mm的玻璃珠)中,加入50μl1×te(ph8.0),在室温下10000rpm振荡15分钟,然后12000rpm离心5min,收集上清液,-20℃保存。
3、制备反应混合液
将链置换扩增试剂与步骤2的(3)得到的上清液等体积混合,得到52μl的反应混合液。步骤2的(3)得到的上清液即为模板dna溶液,26微升模板dna溶液中模板dna的浓度为1000个拷贝数/μl。
链置换扩增试剂(26微升体系):含5.0ubst酶(neb,m0275l),0.3mmdutp(fermentas,r0133),0.2mmdntps(neb,4030),0.1mg/mlbsa(经科宏达,5004),1×evagreen(上海开放科技,31000),2.0mbetaine(sigma,14300),10mmmgso4,0.5u/mluracil-dnaglycosylase(fermentas,en0362),余量为水。
4、将52微升步骤3得到的反应混合液从进样口注入微纳升体系流体芯片中,用封口膜密封进样口和出样口,形成密闭反应体系。
5、完成步骤4后,将微纳升体系流体芯片置于微纳升体系流体芯片检测集成装置上,设置反应程序如下:37℃反应3分钟,65℃反应47分钟。
反应过程中,微纳升体系流体芯片检测集成装置将实时检测显示荧光信号。
待测样本为金黄色葡萄球菌时的荧光信号监测结果见图4。只有包埋有引物组ⅲ的第八个反应池和包埋阳性质控的第十个反应池显示阳性的扩增曲线,其他反应池均 显示为阴性。
待测样本为创伤弧菌时,只有包埋有引物组ⅰ的第四个反应池和包埋阳性质控的第十个反应池显示阳性的扩增曲线,其他反应池均显示为阴性。
待测样本为溶藻弧菌时,只有包埋有引物组ⅱ的第六个反应池和包埋阳性质控的第十个反应池显示阳性的扩增曲线,其他反应池均显示为阴性。
进行六次重复试验,结果均与上述结果一致。
通过16sdna测序方法检测各个待测样本,结果与上述结果一致。
实施例5、集成装置的灵敏度
待测样本分别为创伤弧菌、溶藻弧菌或金黄色葡萄球菌。
1、样品处理
同实施例4的步骤1。
2、dna抽提
同实施例4的步骤2。
3、取步骤2得到的上清液,采用1×te(ph8.0)进行梯度稀释,得到各个稀释液。
4、制备反应混合液
将链置换扩增试剂与步骤3得到的稀释液等体积混合,得到52μl的反应混合液。26微升步骤3得到的稀释液中模板dna的浓度分别为10、100、1000或10000个拷贝数/μl。
链置换扩增试剂的配方同实施例4的步骤3。
5、将52微升步骤4得到的反应混合液从进样口注入微纳升体系流体芯片中,用封口膜密封进样口和出样口,形成密闭反应体系(每个反应池内的反应体系的体积约为1-2μl)。
6、完成步骤5后,将微纳升体系流体芯片置于微纳升体系流体芯片检测集成装置上,设置反应程序如下:37℃反应3分钟,65℃反应47分钟。
检测创伤弧菌的灵敏度为10个拷贝数/体系(体系指的是反应池中的体系)。
检测溶藻弧菌的灵敏度为10个拷贝数/体系(体系指的是反应池中的体系)。
检测金黄色葡萄球菌的灵敏度为10个拷贝数/体系(体系指的是反应池中的体系)。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种荧光定量PCR技术检测意大利蜜蜂王浆主蛋白MRJP 2基因表达的方法与流程
- 一种用于对不同银杏进行基因分型的SNP引物及检测方法与流程
- 用于基因甲基化检测的引物和探针、采样方法、试剂盒与流程
- 一种基于荧光PCR检测ESR1基因突变的引物及探针的制造方法与工艺
- 转基因甜菜GTSB77品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 一种基于单核苷酸多态性的葡萄球菌种水平鉴定和菌株分型一体化方法与流程
- 一套毛花猕猴桃和中华猕猴桃物种间杂交子代的鉴定引物的制造方法与工艺
- 检测黄杉大小蠹的引物、试剂盒及检测方法与流程
- 环介导等温扩增技术检测铜绿假单胞菌的引物和试剂盒的制造方法与工艺
- 一种用于鉴定浙贝母的引物对及其应用的制造方法与工艺