用于检测DPYD*2A遗传多态性的引物、探针及检测试剂盒的制作方法
本发明涉及体外核酸检测,尤其是涉及采用荧光定量pcr(fq-pcr)技术检测dpyd*2a基因多态性的引物、探针及检测试剂盒。
背景技术:
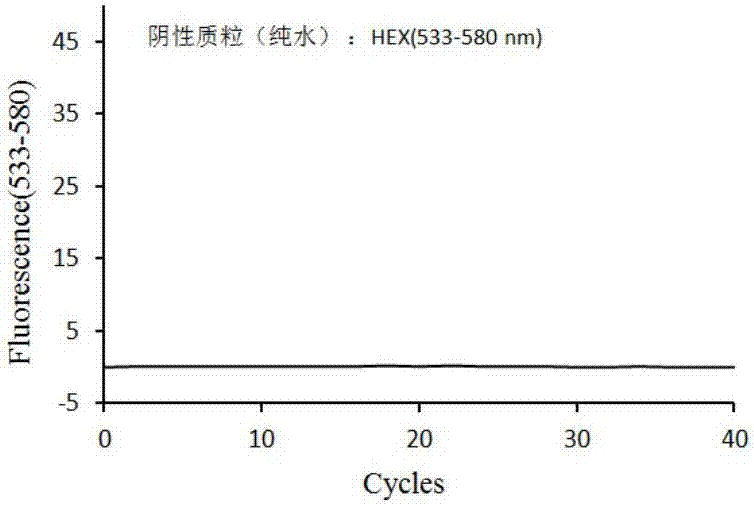
:二氢嘧啶脱氢酶(dihydropymidinedehydrogenase,dpd)是氟尿嘧啶(5-fu)药物代谢途径中的关键性酶之一,可催化5-fu在形成细胞毒作用的核酸之前代谢成无抗癌活性的代谢产物,是5-fu代谢失活的限速酶。dpd由二氢嘧啶脱氢酶基因(dpyd)编码产生,dpyd基因定位于染色体lp22上,全长约950kb,包括23个外显子。dpyd序列上碱基的突变可能引起dpd结构及活性的改变,dpd活性缺乏与氟化嘧啶类化疗药物毒性反应密切相关,而dpyd突变则对dpd结构及活性起着重要的作用。氟尿嘧啶(5-fu)、卡培他滨和替加氟都为嘧啶类似物,属抗代谢类抗肿瘤药物。卡培他滨为5-fu的前体,在体内可活化代谢为5-fu,用于结肠癌和对紫杉醇及多柔比星等无效的晚期乳腺癌的治疗。替加氟为5-fu的衍生物,在体内经肝脏活化转变为5-fu而发挥抗肿瘤作用。85%的5-fu经二氢嘧啶脱氢酶(dpd)代谢灭活。dpd酶活性低下的结肠癌和胃癌患者应用5-fu、卡培他滨或替加氟后出现体内5-fu蓄积,引起严重粘膜炎、粒细胞减少症、神经系统症状甚至死亡。dpyd基因14外显子1986位a>g多态性(dpyd*2a)是最常见的引起酶活性下降的遗传变异,等位基因携带率为3%。约40%低dpd酶活性的个体携带dpyd*2a等位基因,其中有60%的患者应用5-fu治疗后出现4级严重的粒细胞减少;而在dpd酶活性正常患者中,5-fu所致严重毒副反应的发生率仅为10%。因此,对dpyd*2a多态性进行检测可预测5-fu治疗导致致命性毒性反应发生风险。fda已批准在5-fu说明书中增加在用药前对dpyd多态性进行检测的建议。cpic指南也建议在应用5-fu、卡培他滨和替加氟前对dpyd多态性进行检测,携带dpyd*2a等位基因的患者慎用5-fu、卡培他滨和替加氟,或降低用药剂量,以避免严重不良反应或毒性的发生。目前常用的基因分型方法大致可分为三类:一是基于凝胶电泳的技术,如pcr反应结合限制性酶切片段长度多态性分析(rflp)、多重pcr、等位基因特异性扩增等;二是基于荧光标记杂交反应的基因分型技术,包括寡核苷酸连接分析,焦磷酸法dna测序、直接杂合子测序以及等位基因特异性引物延伸等。以上二种方法都是在pcr扩增反应之后,再采取不同的方法检测多态性位点。三是基因芯片技术,基因芯片是通过微加工技术,将数以万计、乃至百万计的特定序列的dna片段(基因探针),有规律地排列固定于硅片、玻片等支持物上,构成的一个二维dna探针阵列,利用这类芯片与标记的生物样品进行杂交,可对样品的基因表达谱生物信息进行快速定性和定量分析。基因芯片技术由于高通量等优点在snp检测中得到大量应用,但也存在检测时条件难以控制、重复性差、准确性低、易出现假阳性、假阴性结果、灵敏度较低等缺点。此外,还有磁珠/pcr荧光探针法、怛温扩增法、pcr溶解曲线法、pcr+导流杂交法等方法。上述各种方法都具有各自的优缺点及适用性。目前采用荧光定量pcr法对dpyd*2a基因多态性的检测主要有染料法与探针法两种方式。染料法即在反应体系中加入双链dna嵌入染料如sybrgreeni以指示目标片段的扩增。然而由于染料不具序列物异性,因此只能进行单重pcr,这不仅使通量变低,而且必须依靠熔解曲线分析区分目标片段与二聚体。而目前探针法同样为的单重pcr,通量低。技术实现要素:本发明的第一目的在于提供用于检测基因dpyd*2a(rs3918290)多态性的引物。本发明的第二目的在于提供用于检测基因dpyd*2a(rs3918290)多态性的探针。本发明的第三目的在于提供用于检测基因dpyd*2a(rs3918290)多态性的检测试剂盒。所述用于检测基因dpyd*2a(rs3918290)多态性的引物如下:dpyd*2a-f:5’-cagtgagaaaacggctgcat-3’dpyd*2a-r:5’-catcagcaaagcaactggca-3’。所述用于检测基因dpyd*2a(rs3918290)多态性的特异识别探针序列及标记的荧光染料如下:fam-5’-tgactttccagacaacgtaagtgtg-3’bhq1hex-5’-tgactttccagacaacataagtgtgat-3’-bhq1。所述用于检测基因dpyd*2a(rs3918290)多态性的检测试剂盒采用两种不同荧光基团标记的探针在同一反应管内同时指示两个目标片段(目标片段分别含rs3918290的g型基因、a型基因)的存在情况。所述检测试剂盒包括反应体系(pcrmix):10mmol/ltris-hclph8.0,50mmol/lkcl,(1.5~3.0)mmol/lmgcl2,2.0mmol/ldntp溶液,0.001mmol/ledta,0.01mmol/lddt,0.005%tween20,1utaqhs,0.5uung酶,1μmol/ldpyd*2a-f,1μmol/ldpyd*2a-r,1μmol/lfam标记探针,1μmol/lhex标记探针;阴性对照:灭菌超纯水。本发明采用荧光定量pcr(fq-pcr)技术检测dpyd*2a基因多态性,fq-pcr的工作原理是利用taq酶的5’→3’外切酶活性,在pcr反应系统中加入一个荧光标记的探针。该探针可与引物包含序列内的dna模板发生特异性杂交,探针的5’端标以荧光报告基团,靠近3’端标以荧光淬灭基团,两者之间构成能量传递结构。当探针保持完整时,5’端荧光报告基团所激发出的荧光信号被3’端淬灭基因吸收或抑制,不出现荧光信号变化。当pcr反应体系中有目的基因存在,就会扩增出特异核酸片段,荧光探针即会根据碱基配对的原理与之杂交。当pcr进入延伸(复制)期,tap酶从引物3’端开始,随新链延伸沿dna模板移动,当移动到探针结合的位置时,其5’→3’端外切酶活性作用,将探针切断(切口平移效应)。荧光报告基团和淬灭基团间的能量传递结构被破坏,淬灭基团的淬灭作用被解除,荧光报告基团的荧光信号释放出来。不同的等位基因探针由于标记的荧光染料不同,因此所发荧光信号不同,可通过对荧光信号的检测判断样本的基因型。本发明利用不同的荧光基团标记的探针可同时检测样品中dpyd*2a(rs3918290)多态性,实现单管封闭可同时检测多个snp位点,克服传统荧光法检测通量不高的缺陷,减少了交叉污染的几率;操作简便,检测快速,检测结果直观,根据不同的荧光信号产生的扩增曲线即可定性判断待测样本中各种基因型,无需繁琐的分析过程。本发明提供的检测试剂盒具有灵敏度高、分型准确、操作简便快捷等优点,可对肿瘤患者进行有效的用药指导,提高药物的疗效、降低药物不良反应,为实现肿瘤患者个体化治疗提供依据。附图说明图1为采用纯水为阴性对照时,fam(465-510nm)检测频道无扩增曲线。图2为采用纯水为阴性对照时,hex(533-580nm)检测频道无扩增曲线。图3为采用rs3918290的g型基因的阳性质粒作对照,fam检测频道有一条扩增曲线。图4为采用rs3918290的g型基因的阳性质粒作对照,hex检测通道无扩增曲线。图5为采用rs3918290的a型基因的阳性质粒作对照,hex检测频道有一条扩增曲线。图6为采用rs3918290的a型基因的阳性质粒作对照,fam检测通道无扩增曲线。图7为采用rs3918290分别为g、a型基因的两种阳性质粒为模板的反应管内,fam检测频道有扩增曲线。图8为采用rs3918290分别为g、a型基因的两种阳性质粒为模板的反应管内,hex检测频道有扩增曲线。具体实施方式以下实施例将结合附图对本发明作进一步的说明。一、材料1、仪器实时荧光pcr仪、移液器、离心机。2、引物、探针设计本发明设计了一对高效特异引物用于目标基因的检测,一对标记的荧光染料的探针检测相应的dpyd*2a多态性位点。引物、探针系列如下:引物:dpyd*2a-f:5’-cagtgagaaaacggctgcat-3’dpyd*2a-r:5’-catcagcaaagcaactggca-3’。探针:fam-5’-tgactttccagacaacgtaagtgtg-3’bq1hex-5’-tgactttccagacaacataagtgtgat-3’-bhq1。3、试剂10mmol/ltris-hclph8.0,50mmol/lkcl,2.5mmol/lmgcl2,2.0mmol/ldntp溶液,0.001mmol/ledta,0.01mmol/lddt,0.005%tween20,1utaqhs,0.5uung酶。二、方法1、样本选择医院体检人群样本130例。2、基因组dna提取用常规分子生物学方法或市售试剂合从抗凝全血中提取人基因组。3、实时荧光pcr扩增与检测实时荧光pcr反应体系:10mmol/ltris-hclph8.0,50mmol/lkcl,2.5mmol/lmgcl2,2.0mmol/ldntp溶液,0.001mmol/ledta,0.01mmol/lddt,0.005%tween20,1utaqhs,0.5uung酶,1μmol/l引物及荧光探针,30ng人基因组dna。实时荧光pcr反应在rochelightcycler480ⅱ仪器上按以下条件进行扩增检测:第一阶段:95℃2min。第二阶段:95℃20sec,62℃20sec(荧光采集),72℃20sec(40cycles)2个荧光检测频道分别为fam、hex。三、结果分析阴性对照:以纯水作模板的反应管内应无任何扩增曲线产生。阳性对照:阳性对照品为分别克隆到载体puc57上的二个dna片段(每个载体中dna片段分别含rs3918290的g型基因、a型基因),同一反应管内加入二种阳性质粒为模板,fam、hex检测频道均应有扩增曲线产生。结果判定:样本反应管中fam检测频道有扩增曲线产生则判定存在snp位点上rs3918290g型基因,hex检测频道有扩增曲线产生则存在snp位点上rs3918290a型基因,若fam、hex检测频道同时有扩增曲线产生则snp位点上rs3918290存在g、a两种基因型。为验证本发明的准确性,进行了130份基因组样本的验证实验,与测序结果对比,符合率达100%。结果如下表:结果(基因型)本发明检测结果(例)测序结果(例)符合率(%)g/g128128100g/a22100采用纯水为阴性对照时,fam(465-510nm)检测频道无扩增曲线如图1所示产生,采用纯水为阴性对照时,hex(533-580nm)检测频道无扩增曲线如图2所示产生。图3和图4的结果表明,在实验条件下含荧光基团fam的探针只对snp位点上rs3918290的g型基因的目标片段有特异结合,荧光基团hex的探针不结合基因snp位点为g的目标片段,两种探针不存在交叉反应。图5和图6的结果表明,在实验条件下含荧光基团hex的探针只对rs3918290的a型基因的目标片段有特异结合,荧光基团fam的探针不结合snp位点为a的目标片段,两种探针不存在交叉反应。图7和图8的结果表明,同一反应管同时存在二种基因型,反应体系不影响试剂盒的灵敏性、特异性。序列表<110>庄江兴,厦门市同普生物科技有限公司<120>用于检测dpyd*2a遗传多态性的引物、探针及检测试剂盒<130>2017<160>4<170>patentinversion3.3<210>1<211>20<212>dna<213>人工序列<400>1cagtgagaaaacggctgcat20<210>2<211>20<212>dna<213>人工序列<400>2catcagcaaagcaactggca20<210>3<211>25<212>dna<213>人工序列<400>3tgactttccagacaacgtaagtgtg25<210>4<211>27<212>dna<213>人工序列<400>4tgactttccagacaacataagtgtgat27当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种荧光定量PCR技术检测意大利蜜蜂王浆主蛋白MRJP 2基因表达的方法与流程
- 一种用于对不同银杏进行基因分型的SNP引物及检测方法与流程
- 用于基因甲基化检测的引物和探针、采样方法、试剂盒与流程
- 一种基于荧光PCR检测ESR1基因突变的引物及探针的制造方法与工艺
- 转基因甜菜GTSB77品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 一种基于单核苷酸多态性的葡萄球菌种水平鉴定和菌株分型一体化方法与流程
- 一套毛花猕猴桃和中华猕猴桃物种间杂交子代的鉴定引物的制造方法与工艺
- 检测黄杉大小蠹的引物、试剂盒及检测方法与流程
- 环介导等温扩增技术检测铜绿假单胞菌的引物和试剂盒的制造方法与工艺
- 一种用于鉴定浙贝母的引物对及其应用的制造方法与工艺