一种可见光催化的2‑亚胺噻唑啉类衍生物的合成方法与流程
(一)技术领域
本发明涉及一种可见光催化的2-亚胺噻唑啉类衍生物的合成方法。
(二)
背景技术:
含氮杂环化合物由于具有广谱的生物活性如杀虫、除菌、抗病毒、消炎、抗肿瘤等,一直都引起化学家的广泛重视。自20世纪70年代以来,人们对噻唑啉类杂环化合物的研究日趋活跃,由于其独特的结构特征在农药和医药方面得到了一系列的应用。众所周知,2-亚胺噻唑啉类及其衍生物是一类重要的医药化工中间体,广泛应用于天然产物的合成,近年来其在生物制药行业的应用也受到越来越多的关注。2-亚胺噻唑啉类作为一些生物和医学活性化合物中的核心结构,代表性的例子如:化合物a,化合物b可以作为孕酮受体的键合配体,可有效地治疗黄体缺乏及由此而引发的小儿病症[u.s.patent6,353,006,mar5,2002.]、化合物c及其衍生物用于放射防护剂的合成[(a)j.radiat.res.2001,42,401.(b)j.radiat.res.2002,43,293.]、化合物d(噻虫啉)是一种新的对刺吸口器害虫有高效的杀虫剂也用于合成新烟碱类杀虫剂,它还可以作为杀菌剂使用[science2003,59,1016.]、化合物e,化合物f(egyt-4201)被广泛的应用于抗抑郁活性药物的合成[(a)chem.commun.1992,57,415.(b)drugdev.res.1991,22,385.]、化合物g被发现作为一种消炎药[u.s.patent6,762,200,jul13,2004.]。某些噻唑啉类化合物还具有治疗由糖尿病引起的白内障、抗甲状腺活性、抗惊厥、抑制胃酸分泌及抗炎等作用,对其开展研究有重大的意义和价值。
目前主要的合成方法主要有:(1)n-(羟烷基)硫脲衍生物分子内的环化[(a)j.am.chem.soc.1934,56,719.(b)tetrahedronlett.1999,40,3125.(c)tetrahedron.2001,57,7137.],该反应路线是在强酸(浓盐酸)、有机膦类化合物(路易斯酸)或强碱(氢氧化钠)的反应条件下,经过多步反应,且反应温度较高,选择性低,收率适中;(2)硫脲及其衍生物和1,2-二卤代烷基的环化,其反应时间长达65小时以上,原料制备复杂,反应温度高,底物范围扩展小[j.org.chem.1961,26,4110.];(3)2-氨基-2-二氢噻唑和亲电试剂的反应,亲电试剂一般选用杂多烯如异硫氰酸酯、异氰酸酯,低温下反应,噻唑啉类易异构化成2-亚胺噻唑烷类[(a)chem.abstr.1977,87,135171.(b)j.org.chem.1986,51,1910.(c)j.phys.chem.1970,74,769.];(4)氮杂环丙烷和杂多烯及硫氰酸盐(硫氰酸)的[3+2]环加成反应,该反应一般要求无水无氧,过渡金属催化其成本较高[(a)j.org.chem.1972,37,4401.(b)j.am.chem.soc.1958,80,3458.(c)j.am.chem.soc.1995,117,4700.];(5)β-卤代胺和异硫氰酸酯及硫氰酸酯的环化反应,反应在强碱性环境,反应时间长,苯作为溶剂,毒性大,反应选择性低,底物范围窄,污染严重[(a)j.heterocycl.chem.1997,34,157.(b)tetrahedronasymm.1997,8,3903.]。综上所述:这些反应需要在强酸、强碱、路易斯酸、过渡金属或有机小分子的催化下反应,反应条件往往比较苛刻、成本较高、反应时间较长、选择性中等且环境污染严重。
因此研究一种新型绿色高效的合成2-亚胺噻唑啉类衍生物的方法尤为重要。
(三)
技术实现要素:
本发明的目的是提供一种利用可见光催化氧化饱和氮杂环丙烷与异硫氰酸酯反应得到2-亚胺噻唑啉类衍生物的方法,该方法具有反应条件温和、底物范围广、绿色环保、原子经济性高、步骤经济性等优点。
为实现上述发明目的,本发明采用如下技术方案:
一种式(i)所示的2-亚胺噻唑啉类衍生物的合成方法,所述合成方法是:在反应溶剂中,以式(ii)所示的饱和氮杂环丙烷和式(iii)所示的异硫氰酸酯类化合物为原料,在氮气保护、光照条件以及光催化剂和氧化剂作用下反应制得式(i)所示的2-亚胺噻唑啉类衍生物;所述的反应溶剂选自下列任意一种:四氢呋喃、n,n-二甲基甲酰胺、甲苯、二氯甲烷、1,2-二氯乙烷、三氯甲烷、乙腈、乙醚、二甲基亚砜、乙二醇二甲醚;所述的光催化剂选自下列任意一种:ru(bpy)3(bf4)2、ru(bpy)3cl2·6h2o、ru(bpy)3(pf6)2、ir(ppy)3、[ir(ppy)2bpy]bf4、[ir(ppy)2bpy]pf6、ru(bpz)3(pf6)2、ir[df(cf3)ppy]2(dtbbpy)pf6、eosiny;所述氧化剂选自下列任意一种:四氟硼酸苯基重氮盐、硝酸铈铵,1-氯甲基-4-氟-1,4-重氮化二环2.2.2辛烷双(四氟硼酸)盐(selectfluor);反应式如下:
其中r1为氢原子、烷基或苯基;r2为氢原子、烷基或苯基;r3为烷基、环烷基、芳基、苄基、取代苄基或取代芳基;所述取代芳基的芳环上被单取代,所述取代基选自c1~c5的烷基、氟、氯、溴或c1~c5的烷氧基;所述取代苄基的苯环上被单取代,所述取代基选自c1~c5的烷基、氟、氯、溴或c1~c5的烷氧基。
进一步,所述的烷基优选c1~c5的烷基。
进一步,所述的环烷基优选为c3~c6的环烷基。
本发明中,所述的c1~c5烷基可以是甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、1-甲基丁基、2-甲基丁基、3-甲基丁基、2,2-二甲基丙基、1,1-二甲基丙基、1-乙基丙基、1-甲基-2-甲基丙基等。所述的c1~c5烷氧基可以是甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基、正戊氧基、1-甲基丁氧基、2-甲基丁氧基、3-甲基丁氧基、2,2-二甲基丙氧基、1,1-二甲基丙氧基、1-乙基丙氧基、1-甲基-2-甲基丙氧基等。所述的c3~c6的环烷基可以是环丙烷、环丁烷、环戊烷、环己烷等。所述的芳基可以是苯基或萘基,优选苯基。所述的取代芳基可以是取代苯基或取代萘基,优选为取代苯基。
本发明优选:r1为氢原子;r2为苯基;r3为c1~c5的烷基、c3~c6的环烷基、苯基、苄基、取代苄基或取代苯基;所述取代苯基的苯环上被单取代,所述取代基选自c1~c5的烷基、氟、氯、溴或c1~c5的烷氧基;所述取代苄基的苯环上被单取代,所述取代基选自c1~c5的烷基、氟、氯、溴或c1~c5的烷氧基。
进一步,所述光催化剂优选为ru(bpy)3(bf4)2、ir(ppy)2(dtbbpy)pf6、ru(bpy)3cl2·6h2o、ir[df(cf3)ppy]2(dtbbpy)pf6、ru(bpz)3(pf6)2、ir(ppy)3或eosiny;更优选为ru(bpy)3(bf4)2或ru(bpy)3cl2·6h2o;最优选为ru(bpy)3(bf4)2。
进一步,所述的氧化剂最优选为phn2bf4。
进一步,所述的反应溶剂优选下列之一:1,2-二氯乙烷、二氯甲烷、乙醚、三氯甲烷、乙二醇二甲醚、二甲基亚砜;更优选下列之一:1,2-二氯乙烷、乙醚或乙二醇二甲醚;最优选为1,2-二氯乙烷。
进一步,所述式(ii)所示的饱和氮杂环丙烷类化合物和式(iii)所示的异硫氰酸酯类化合物的投料摩尔比为1:1-6,优选为1:1-4,最优选为1:1。
进一步,所述光催化剂与式(ii)所示的饱和氮杂环丙烷类化合物的投料摩尔比为0.001~0.05:1,优选为0.02:1。
进一步,所述氧化剂与式(ii)所示的饱和氮杂环丙烷类化合物的投料摩尔比为1~6:1,优选为2-3:1,最优选为3:1。
进一步,所述的反应时间优选4-12h,更优选为10-12h,最优选10h。
进一步,所述的光源优选下列之一:25~45w白光节能灯、7~14w蓝色led灯;更优选为25~45w白光节能灯;最优选为30w白光节能灯。
所述的反应在家庭用的白光照射和磁力搅拌下进行,反应结束后采用气相色谱、柱色谱等方法分析、分离纯化即可得到目标产物。
本发明具体推荐所述的2-亚胺噻唑啉类衍生物的合成方法按照如下步骤进行:在反应容器中,依次加入式(ii)所示的饱和氮杂环丙烷、ru(bpy)3(bf4)2、phn2bf4,真空换氮,在氮气保护下加入无水1,2-二氯乙烷、式(iii)所示的异硫氰酸酯类化合物,在30w家庭用的白光节能灯照射下室温搅拌10h,反应完毕后,经柱色谱法分离提纯得到式(i)所示的2-亚胺噻唑啉类衍生物;其中式(ii)所示的饱和氮杂环丙烷类化合物和式(iii)所示的异硫氰酸酯类化合物、ru(bpy)3(bf4)2、phn2bf4的投料摩尔比为1:1:0.02:3。
本方法中所使用催化剂的合成方法来源于以下文献:(1)inorg.chem.1991,30,1685.(2)inorg.synth.1990,28,338.(3)j.am.chem.soc.2010,132,8572.(4)j.am.chem.soc.2004,126,2763.(5)chem.mater.2005,17,5712.(6)beilsteinj.org.chem.2015,11,61。
与现有技术相比,本发明的有益效果在于:本发明方法反应条件温和、操作简单、收率良好;而且采用可见光催化氧化具有丰富、便宜、无污染、环境友好等特点。
(四)附图说明
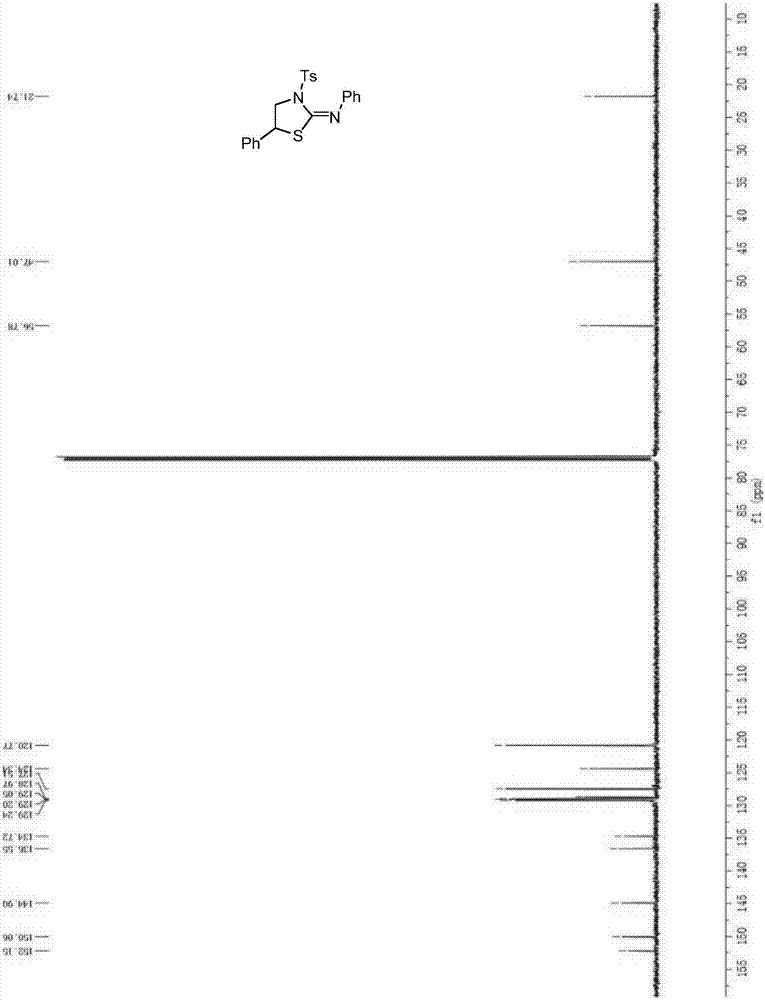
图1为产物n,5-二苯基-3-对甲苯磺酰基噻唑-2-亚胺的1hnmr谱图。
图2为产物n,5-二苯基-3-对甲苯磺酰基噻唑-2-亚胺的13cnmr谱图。
(五)具体实施方式
以下具体实施实例来说明本发明的技术方案,但本发明的保护范围不限于此。
本发明实施例使用的催化剂的结构式如下:
实施例1
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol苯基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n,5-二苯基-3-对甲基苯磺酰基噻唑-2-亚胺112.6mg,收率为91.9%。
产物表征数据如下:
1hnmr(500mhz,cdcl3)δ8.00(d,j=8.3hz,2h),7.40-7.33(m,7h),7.29(d,j=1.9hz,1h),7.26(s,1h),7.08(t,j=7.4hz,1h),6.80(dd,j=8.3,0.9hz,2h),4.82(dd,j=8.5,6.4hz,1h),4.62(dd,j=10.4,6.4hz,1h),4.07(dd,j=10.4,8.6hz,1h),2.50(s,3h).13cnmr(126mhz,cdcl3)δ152.1,150.1,144.9,136.5,134.7,129.3,129.2,129.1,128.7,127.5,124.3,120.8,56.8,47.0,21.7.
产物n,5-二苯基-3-对甲基苯磺酰基噻唑-2-亚胺的氢谱和碳谱见图1和图2。
实施例2
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水乙二醇二甲醚(dme)、0.3mmol苯基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌12h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n,5-二苯基-3-对甲基苯磺酰基噻唑-2-亚胺66.8mg,收率为54.6%。
实施例3
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水乙醚、0.3mmol苯基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌12h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n,5-二苯基-3-对甲基苯磺酰基噻唑-2-亚胺75.7mg,收率为61.8%。
实施例4
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3cl2·6h2o、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol苯基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n,5-二苯基-3-对甲基苯磺酰基噻唑-2-亚胺83.6mg,收率为68.3%。
实施例5
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、1.2mmol苯基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n,5-二苯基-3-对甲基苯磺酰基噻唑-2-亚胺73.8mg,收率为60.3%。
实施例6
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.6mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol苯基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n,5-二苯基-3-对甲基苯磺酰基噻唑-2-亚胺88.2mg,收率为72.1%。
实施例7
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol苯基异硫氰酸酯,在35w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n,5-二苯基-3-对甲基苯磺酰基噻唑-2-亚胺98.8mg,收率为80.7%。
实施例8
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol苯基异硫氰酸酯,在7w蓝色的led灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n,5-二苯基-3-对甲基苯磺酰基噻唑-2-亚胺70.2mg,收率为57.4%。
实施例9
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol对甲氧苯基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n-(4-甲氧基苯基)-5-苯基-3-对甲基苯磺酰基噻唑-2-亚胺116.4mg,收率为88.9%。产物表征数据如下:
1hnmr(500mhz,cdcl3)δ8.00(d,j=8.2hz,2h),7.71-7.12(m,7h),6.79(dd,j=28.2,8.9hz,4h),4.81(dd,j=8.3,6.6hz,1h),4.60(dd,j=10.3,6.4hz,1h),4.06(dd,j=10.2,8.7hz,1h),3.80(d,j=27.7hz,3h),2.47(d,j=19.3hz,3h).13cnmr(126mhz,cdcl3)δ156.61,151.74,144.82,143.38,136.66,134.88,129.22,129.21,129.05,128.73,127.53,121.87,114.21,77.29,77.03,76.78,56.66,55.44,47.04,29.72,21.73.
实施例10
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol苄基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n-(苄基)-5-苯基-3-对甲基苯磺酰基噻唑-2-亚胺98.1mg,收率为77.5%。产物表征数据如下:
1hnmr(500mhz,cdcl3)δ7.86(d,j=8.2hz,2h),7.45-7.28(m,5h),7.28(s,2h),7.27-7.23(m,1h),7.19(d,j=8.0hz,2h),7.17–7.11(m,2h),4.86(dd,j=8.2,6.5hz,1h),4.56(dd,j=10.3,6.3hz,1h),4.44(d,j=15.2hz,1h),4.36(d,j=15.2hz,1h),4.01(dd,j=10.2,8.4hz,1h),2.46(d,j=34.0hz,3h).
13cnmr(126mhz,cdcl3)δ144.39,139.44,129.15,129.08,129.01,128.78,128.12,127.59,127.50,126.59,77.29,77.03,76.78,59.41,56.51,47.23,21.65.
实施例11
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol正丁基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n-(正丁基)-5-苯基-3-对甲基苯磺酰基噻唑-2-亚胺92.9mg,收率为79.7%。产物表征数据如下:
1hnmr(500mhz,cdcl3)δ8.00-7.84(m,2h),7.41-7.33(m,5h),7.32-7.27(m,2h),4.79(dd,j=8.4,6.3hz,1h),4.50(dd,j=10.2,6.3hz,1h),3.93(dd,j=10.2,8.4hz,1h),3.22(dt,j=13.2,6.7hz,1h),3.13-3.06(m,1h),2.46(s,3h),1.59-1.43(m,2h),1.20(ddd,j=11.4,7.3,3.6hz,2h),0.88(t,j=7.4hz,3h).
13cnmr(126mhz,cdcl3)δ149.28,144.38,137.04,135.14,129.05,129.01,129.00,128.65,127.56,77.29,77.03,76.78,56.29,55.94,46.92,32.76,21.64,20.38,13.87.
实施例12
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol对氟苯基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n-(4-氟苯基)-5-苯基-3-对甲基苯磺酰基噻唑-2-亚胺110.3mg,收率为86.3%。产物表征数据如下:
1hnmr(500mhz,cdcl3)δ7.98(d,j=8.3hz,2h),7.38(s,1h),7.37-7.31(m,6h),7.00-6.90(m,2h),6.76(ddd,j=6.9,5.2,2.8hz,2h),4.82(dd,j=8.5,6.5hz,1h),4.61(dd,j=10.4,6.5hz,1h),4.08(dd,j=10.4,8.5hz,1h),2.61-2.38(m,3h).13cnmr(126mhz,cdcl3)δ145.00,136.43,134.71,129.27,129.16,129.10,128.84,127.49,122.19,122.12,115.75,115.57,77.29,77.03,76.78,56.80,47.09,21.75.
实施例13
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol对溴苯基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n-(4-溴苯基)-5-苯基-3-对甲基苯磺酰基噻唑-2-亚胺128.6mg,收率为88.0%。产物表征数据如下:
1hnmr(500mhz,cdcl3)δ8.00-7.89(m,2h),7.41-7.33(m,7h),7.25-7.21(m,2h),6.86-6.66(m,2h),4.83(dd,j=8.5,6.5hz,1h),4.62(dd,j=10.4,6.5hz,1h),4.08(dd,j=10.4,8.5hz,1h),2.50(s,3h);13cnmr(126mhz,cdcl3)δ152.79,148.93,145.06,136.32,134.59,132.02,129.28,129.15,129.11,128.86,127.47,122.63,117.37,77.40,77.29,77.03,76.78,56.84,47.11,21.75.
实施例14
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol环己基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n-(环己基)-5-苯基-3-对甲基苯磺酰基噻唑-2-亚胺106.5mg,收率为85.9%。产物表征数据如下:
1hnmr(500mhz,cdcl3)δ7.93(d,j=8.3hz,2h),7.38-7.29(m,5h),7.28(s,2h),4.78(dd,j=8.5,6.3hz,1h),4.47(dd,j=10.3,6.3hz,1h),3.89(dd,j=10.2,8.5hz,1h),2.78(dd,j=8.7,4.8hz,1h),2.48(d,j=25.0hz,3h),1.71-1.50(m,5h),1.48-1.33(m,2h),1.27(d,j=5.3hz,3h).13cnmr(126mhz,cdcl3)δ129.25,129.02,128.90,128.62,127.58,77.29,77.03,76.78,0.01.
实施例15
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol2-甲基苯基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n-(2-甲基苯基)-5-苯基-3-对甲基苯磺酰基噻唑-2-亚胺118.7mg,收率为93.8%。产物表征数据如下:
1hnmr(500mhz,cdcl3)δ7.98(d,j=8.3hz,2h),7.46-7.31(m,7h),7.17-7.06(m,2h),7.00(td,j=7.4,1.0hz,1h),6.69(d,j=7.7hz,1h),4.82(dd,j=8.2,6.5hz,1h),4.65(dd,j=10.3,6.4hz,1h),4.14(dd,j=10.3,8.3hz,1h),2.48(s,3h),1.95(s,3h).
13cnmr(126mhz,cdcl3)δ151.69,149.17,144.72,136.79,135.22,130.34,129.37,129.32,129.01,128.93,128.69,127.41,126.33,124.33,119.64,77.29,77.03,76.78,65.32,56.97,46.79,30.13,29.68,29.11,21.65,17.40,14.07,11.09.
实施例16
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmolα-甲基苄基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌10h。反应完毕后,经柱色谱法(柱色谱展开剂乙酸乙酯/石油醚=1:10-20)分离提纯得到n-(α-甲基苄基)-5-苯基-3-对甲基苯磺酰基噻唑-2-亚胺113.1mg,收率为86.5%。产物表征数据如下:
1hnmr(500mhz,cdcl3)δ7.93(dd,j=28.3,8.3hz,2h),7.47-7.34(m,2h),7.34-7.30(m,4h),7.29–7.23(m,4h),7.22-7.15(m,2h),4.80(ddd,j=32.5,8.5,6.3hz,1h),4.52(ddd,j=13.9,10.3,6.3hz,1h),4.12(dt,j=8.8,5.2hz,1h),3.95(ddd,j=14.0,10.2,8.6hz,1h),2.45(d,j=10.8hz,3h),1.48-1.35(m,3h).
13cnmr(126mhz,cdcl3)δ148.93,145.11,145.04,144.36,144.27,136.89,136.72,135.28,135.19,129.15,129.05,129.02,129.01,128.96,128.69,128.65,128.19,128.09,127.57,127.54,126.61,126.57,126.47,126.37,99.98,77.29,77.03,76.78,65.53,65.36,56.17,56.05,47.28,47.15,25.07,24.65,21.62.
实施例17(比较例)
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2为苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol苯基异硫氰酸酯,在30w家庭用的白光节能灯照射下室温搅拌4h或6h。反应完毕后,用tlc检测不到产物的生成。
实施例18(比较例)
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2苯基的饱和氮杂环丙烷、0.006mmolru(bpy)3(bf4)2、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol苯基异硫氰酸酯,在无光照室温条件下搅拌10h。反应完毕后,用tlc检测不到产物的生成。
实施例19(比较例)
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2苯基的饱和氮杂环丙烷、0.9mmolphn2bf4,真空换氮三次,在氮气保护下加入4ml无水1,2-二氯乙烷、0.3mmol苯基异硫氰酸酯、,在30w家庭用节能灯白光照射下室温搅拌10h。反应完毕后,用tlc检测不到产物的生成。
实施例20(比较例)
在25mlschlenk管中,依次加入0.3mmolr1为氢、r2苯基的饱和氮杂环丙烷、0.3mmol苯基异硫氰酸酯、0.006mmolru(bpy)3(bf4)2,真空换氮三次,在氮气保护下加入4ml1,2-二氯乙烷,在30w家庭用节能灯白光照射下室温搅拌10h。反应完毕后,用tlc检测不到产物的生成。
- 还没有人留言评论。精彩留言会获得点赞!