一株枯草芽孢杆菌及其在后发酵茶渥堆中降解赭曲霉A的应用的制作方法
技术领域
本发明涉及微生物学及生物降解领域,尤其涉及枯草芽孢杆菌及其在后发酵茶渥堆中降解赭曲霉毒素A的应用。
背景技术:
后发酵茶,又称黑茶,包括普洱茶、青砖茶、茯砖茶和六堡茶等,主产自云南、湖北、湖南、广西等省,是我国传统的边销和侨销茶类,是国内西北、西南部边疆等地少数民族和新、马、港、澳甚至俄罗斯等地人民日常生活必不可少的饮料。渥堆是茯砖茶、普洱茶(熟茶)等后发酵茶风味品质形成的关键工序。渥堆过程自然接种的各种微生物在茶叶中大量生长繁殖,如曲霉属、青霉属真菌等具有代谢产生赭曲霉毒素A的能力。
赭曲霉毒素A(Ochratoxin A,OTA)是一种能对肾脏、肝脏和神经系统造成损害的真菌毒素,1993年,国际癌症研究机构(IARC)将其定义为2B类致癌物。
OTA易在后发酵茶中存在,如2013年Haas etal.报导了的普洱茶中赭曲霉毒素A的含量在0.65-94.7μg/kg dw之间,检测频率为11.11%。赭曲霉毒素A等真菌毒素的存在给后发酵茶的饮用带来巨大的安全风险,引起了社会的广泛关注。
OTA的化学性质稳定,采用加热、吸附等方法尚不能有效控制OTA的总量,虽然采用氧化、酸碱处理等方法可以有效降解转化OTA,但对食品的营养成分和功能成分会带来极大的破坏,因此目前唯有利用微生物本身或其代谢产物来降解OTA的生物脱毒法具有良好的应用潜力。研究报道显示,乳酸杆菌(Lactobacillus sp.)、黑曲霉(Aspergillus niger)、枯草杆菌(Bacillus subtilis) 等在葡萄酒等食品中OTA的降解效果显著,但在后发酵茶中赭曲霉毒素A的生物降解研究至今未见报道。
技术实现要素:
本发明的目的在于克服现有技术之缺陷,提供了一株枯草芽孢杆菌及其在后发酵茶渥堆中降解赭曲霉毒素A的应用,该枯草芽孢杆菌适应后发酵茶渥堆环境(酸性、高温、厌氧)且具有降解赭曲霉毒素A能力,利用该菌降解后发酵茶渥堆过程中产生的赭曲霉毒素A(OTA),以保障后发酵茶的饮用安全。
本发明的目的之一在于提供了一株枯草芽孢杆菌,本发明的枯草芽孢杆菌 (Bacillus subtilis),菌代号为DTMo1,在后发酵茶渥堆过程中从渥堆茶样中分离纯化而来。
菌株DTMo1的微生物学特征如下:是芽孢杆菌属的一种。单个细胞 0.4~0.5×0.4~0.8微米,着色均匀。无荚膜,周生鞭毛,能运动。革兰氏阳性菌,无芽孢、异养、好氧,菌体呈短杆状,菌落表面粗糙不透明,污白色或微黄色,在液体培养基中生长时,常形成皱醭。
表一
菌株DTMo1的理化特征如下:需氧菌,可利用蛋白质、多种糖及淀粉,分解色氨酸形成吲哚。异养、好氧。葡萄糖、蔗糖、麦芽糖、甘露醇发酵为阳性,乳糖发酵为阴性。
表二
菌株DTMo1的16S rRNA序列如SEQ ID NO:1所示,利用引物27F (5'-AGAGTT TGATCCTGGCTCAG-3')和1492R(5'-TAC GGCTACCTTGTTACGACTT-3')经PCR扩增该菌株的16S rRNA基因。将16S rRNA序列在GenBank中序列分析及同源性比较,GenBank accession number为 MG256170,通过比对菌株DTMo1与Bacillus subtilis strain NBRC 13719的相似性为99%。总之,经过对菌株的形态学鉴定、生理生化实验和16S rRNA序列分析及同源性比较,因此确定菌株枯草芽孢杆菌DTMo1为枯草芽孢杆菌。
基于以上信息,将菌株DTMo1鉴定为枯草芽孢杆菌(Bacillus subtilis)。该菌现已保藏于中国典型培养物保藏中心(CCTCC),地址:湖北省武汉市武昌区八一路299号武汉大学校内,武汉大学保藏中心,邮编:430072,保藏编号CCTCCNO:M2017708,保藏日期2017年11月22日。
本发明的目的之二在于提供该株枯草芽孢杆菌在后发酵茶渥堆中降解赭曲霉毒素A的应用。
在本发明的一个具体实施方式中,所述应用包括以下步骤:
步骤1、将枯草芽孢杆菌菌株经活化处理后制成菌悬液;
步骤2、将步骤1中活化好的菌悬液接种至LB液体培养基扩繁,发酵液离心去除上清液,蒸馏水反复冲洗得到发酵菌种,用蒸馏水稀释将枯草芽孢杆菌菌株配制成单位体积含不同数量细菌数的菌悬液,供后续茶叶渥堆发酵接种用;
步骤3、取后发酵茶渥堆的茶样,添加赭曲霉毒素A溶液;
步骤4、向后发酵茶渥堆后期的茶样中接种不同浓度的枯草芽孢杆菌菌悬液,混合均匀,于28-35℃发酵3-7天,经过发酵后,茶样直接烘干备用。
优选地,所述步骤1中菌悬液的浓度为106~1010CFU/ml。
优选地,所述步骤3中取后发酵茶渥堆后期的茶样,添加10μg/ml的赭曲霉毒素A溶液使茶样中赭曲霉毒素A含量为5μg/ml,喷施蒸馏水使含水量≥ 40%,调节茶样pH值为≤6。
优选地,所述步骤4中接种量为106~108CFU/g,温度在28℃~35℃之间,发酵3-7天后,渥堆茶样中赭曲霉毒素A的降解率达到88.61%,且经枯草芽孢杆菌脱毒发酵后,发酵茶样主要品质成分变化小。
本发明具有以下有益效果:
本发明提供的枯草芽孢杆菌能适应后发酵茶渥堆环境(酸性、高温、厌氧) 且具有降解赭曲霉毒素A能力,利用该菌降解后发酵茶渥堆过程中产生的赭曲霉毒素A(OTA),以保障后发酵茶的饮用安全,渥堆茶样中赭曲霉毒素A的降解率高达88.61%,且经该保藏菌发酵降解赭曲霉毒素A后,发酵茶样主要品质成分变化较小。
附图说明
图1为本发明实施例提供的菌株DTMo1在LB培养基上的形态;
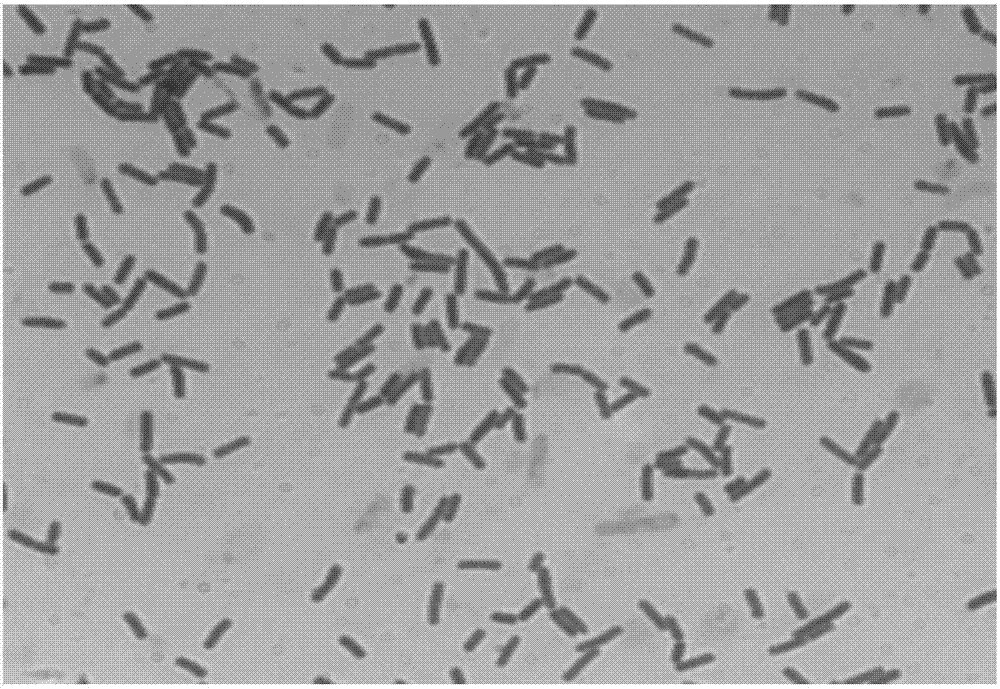
图2为本发明实施例提供的菌株DTMo1的光学显微形态观察;
图3为本发明实施例1提供的液体培养发酵开始OTA液相色谱检测图;
图4为本发明实施例1提供的培养3天后发酵液中OTA液相色谱检测图;
图5为本发明实施例4提供的液体培养发酵开始OTA液相色谱检测图;
图6为本发明实施例4提供的培养3天后发酵液中OTA液相色谱检测图。
具体实施方式
实施例1菌株DTMo1的筛选
(1)将在后发酵茶渥堆过程中从渥堆茶样中分离纯化而来的菌株DTMo1 经活化处理后制成菌悬液,浓度约为106CFU/ml。
(2)将配制好的LB液体培养基经高温灭菌后,分装至200ml的三角瓶中,每瓶体积50ml,再向三角瓶中添加20ml的10μg/ml的OTA溶液与100μL的菌悬液,密封于28-35℃摇床中振荡培养,摇床转速为200r/min。设置对照组,空白对照体系不添加OTA,添加等体积蒸馏水,其他条件相同。
(3)菌液培养3d后,每隔2天提取5mL培养基中的OTA,HPLC测定OTA 的含量,利用HPLC检测该菌株降解OTA的能力。
(4)OTA提取及HPLC检测
取5ml培养液,加入900μL甲醇-蚁酸(25:1),90min后震荡提取物,并用0.45μm的滤膜过滤,滤液用氮吹仪吹干后溶解在0.5mL甲醇中,贮藏在 4℃用于HPLC检测,直至色谱分析,每个浓度重复三次。
HPLC检测条件:分离柱Agilent HC-C18色谱柱,5μm,4.6×250mm,荧光检测器,激发波长330nm,发射波长460nm;等梯度程序,流动相为乙腈:水:醋酸(57%,41%,2%),流速1mL/min。
筛选获得对OTA降解能力最好的菌株DTMo1,培养基中OTA的含量变化见图3-4,其中图3液体培养发酵开始OTA液相色谱检测图,图4培养3天后发酵液中OTA液相色谱检测图。
OTA降解率(%)=(C-C0)/C×100% (1)
(1)式中:C为发酵液中OTA的初始浓度(μg/ml);C0为3天后发酵液中 OTA的浓度(μg/ml)。
OTA出峰时间为30.30min左右,液体培养基中OTA加标回收率为85%,根据公式(1)得出菌株DTMo1对OTA的降解率为91.3%。
实施例2、菌株DTMo1的鉴定
菌株DTMo1的16S rRNA序列如SEQ ID NO:1所示,利用引物27F (5'-AGAGTT TGATCCTGGCTCAG-3')和1492R(5'-TAC GGCTACCTTGTTACGACTT-3')经PCR扩增该菌株的16S rRNA基因。将16S rRNA序列在GenBank中序列分析及同源性比较,GenBank accession number为 MG256170,通过比对菌株DTMo1与Bacillus subtilis strain NBRC 13719的相似性为99%。菌株DTMo1,经过对菌株的形态学鉴定、生理生化实验和16S rRNA 序列分析及同源性比较,通过比对菌株DTMo1与Bacillus subtilis strain NBRC 13719的相似性为99%,因此确定菌株枯草芽孢杆菌DTMo1为枯草芽孢杆菌。
菌株DTMo1的微生物学特征如下:是芽孢杆菌属的一种。单个细胞 0.7~0.8×2~3微米,着色均匀。无荚膜,周生鞭毛,能运动。革兰氏阳性菌,无芽孢、异养、好氧,菌体呈短杆状,。菌落表面粗糙不透明,污白色或微黄色,在液体培养基中生长时,常形成皱醭。
菌株DTMo1的理化特征如下:需氧菌,可利用蛋白质、多种糖及淀粉,分解色氨酸形成吲哚。异养、好氧。葡萄糖、蔗糖、麦芽糖、甘露醇发酵为阳性,乳糖发酵为阴性。
图1为菌株DTMo1在LB培养基上的形态,图2菌株DTMo1的光学显微下观察的形态。
实施例3、枯草芽孢杆菌的培养
枯草芽孢杆菌菌株DTMo1接种于LB液体培养基中,摇床转速为200r/min,温度28-35℃,72h培养后即得枯草芽孢杆菌DTMo1的发酵液。将发酵液离心去除上清液,将沉淀用蒸馏水反复冲洗得到发酵菌种。用蒸馏水稀释将枯草芽孢杆菌DTMo1配制成单位体积含不同数量细菌数的菌悬液,供后续茶叶渥堆发酵接种用。
所述LB培养基的配方为:胰蛋白胨10g、酵母粉5g、氯化钠10g(固体培养基加1.5%的琼脂),加蒸馏水至1L,121℃灭菌20min。
实施例4、菌株DTMo1对后发酵茶渥堆过程中OTA的降解作用
将菌株DTMo1经活化处理后制成菌悬液,浓度约为106CFU/ml。
取后发酵茶渥堆后期的茶样,添加10μg/ml的OTA溶液使茶样中OTA含量为5μg/ml,喷施蒸馏水使含水量保持在40%,调节茶样pH值分别为5、6,然后分别接种浓度为104、105、106菌悬液,混合均匀,于28-35℃发酵3-7天,分析菌株DTMo1降解OTA的能力。
取经过发酵后的茶样干燥、粉碎,5g粉碎样于250mL三角瓶中,加100mL 浓度为1%(w/v)碳酸氢钠溶液,在振荡器上振荡30min,静置10min后用定量滤纸(Whatman No.1)过滤。取10mL样品提取液于一玻璃试管内,加入10 mL磷酸盐缓冲液,混合。
净化:选用SPE-C18固相萃取小柱,吸附剂容量500mg。先后用10mL磷酸盐缓冲液和5mL蒸馏水活化柱子,然后将20mL提取液通过SPE-C18固相萃取小柱,流速控制在60滴/分。再用3mL甲醇洗脱,收集洗脱液。40℃下氮气吹干,流动相溶液定容至0.4mL,经0.22μm微孔滤膜过滤后供高效液相色谱仪检测。
HPLC检测条件:分离柱为Agilent HC-C18色谱柱,5μm,4.6×250mm,荧光检测器,激发波长330nm,发射波长460nm;流动相为乙腈:甲醇:0.15mol/L 磷酸(1/1/1,v/v/v),流速0.8mL/min,进样量20μL。
茶样中OTA出峰时间为30.41min左右,茶样中OTA加标回收率为82.6%,
OTA降解率(%)=(C-C0)/C×100% (1)
(1)式中:C为发酵液中OTA的初始浓度(μg/ml);C0为3天后发酵液中 OTA的浓度(μg/ml)。
根据公式(1)得出菌株DTMo1在接种量为106CFU/g,茶样含水量40%,温度28℃时,发酵7d,OTA的降解率高达88.61%。
实施例5不同发酵时间、pH值菌株DTMo1对茶叶渥堆过程中OTA的降解率的影响
实验方法如实施例4所示,其中:
处理1:PH值为5,接种量104CFU/ml,发酵时间3天,降解率68.10%;
处理2:PH值为5,接种量104CFU/ml,发酵时间7天,降解率72.35%;
处理3:PH值为5,接种量105CFU/ml,发酵时间3天,降解率70.09%;
处理4:PH值为5,接种量105CFU/ml,发酵时间7天,降解率73.61%;
处理5:PH值为5,接种量106CFU/ml,发酵时间3天,降解率79.48%;
处理6:PH值为5,接种量106CFU/ml,发酵时间7天,降解率80.26%;
处理7:PH值为6,接种量104CFU/ml,发酵时间3天,降解率69.11%;
处理8:PH值为6,接种量104CFU/ml,发酵时间7天,降解率83.40%;
处理9:PH值为6,接种量105CFU/ml,发酵时间3天,降解率69.73%;
处理10:PH值为6,接种量105CFU/ml,发酵时间7天,降解率83.79%;
处理11:PH值为6,接种量106CFU/ml,发酵时间3天,降解率71.30%;
处理12:PH值为6,接种量106CFU/ml,发酵时间7天,降解率88.61%;
由以上可知,处理12组的降解率最高,即PH值为6,接种量106CFU/ml,发酵时间7天,降解率88.61%;
表三
实施例6:经该保藏菌发酵降解赭曲霉毒素后,发酵茶样主要品质成分变化较小。
接种菌株DTM01(按106CFU/g茶样)经不同时间发酵后茶叶主要成分的变化如下表
表四
由上表可知,经菌株DTM01对茶样进行后期发酵处理,茶样主要成分变化幅度较小,说明在茶叶渥堆过程中添加适量菌株DTM01,在显著降低OTA含量的同时,对渥堆茶叶品质影响不大。
综合上述实验结果表明,本发明提供的枯草芽孢杆菌能适应后发酵茶渥堆环境(酸性、高温、厌氧)且具有降解赭曲霉毒素A能力,利用该菌降解后发酵茶渥堆过程中产生的赭曲霉毒素A(OTA),以保障后发酵茶的饮用安全,渥堆茶样中赭曲霉毒素A的降解率高达88.61%,且经该保藏菌发酵降解赭曲霉毒素后,发酵茶样主要品质成分变化较小。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
菌株DTMo1的16S rRNA序列如SEQ ID NO:1
Atataatgcaatcgagcggacagatgtgagcttgctctctgatgttagcggcggacaggtgagtaacacgtgcctaacctgcctgtaag actggcataactccgggaaaccggggctaataccgaatggttgtttgaaccgcatggttcaaacataaaaggtggcttcggctaccacttacaga tggacccgcggcgcattagctagttggtgaggtaacggctcaccaaggcaacgatgcgtagccgacctgagagggtgatcagccacactgcg actgagacacggcccagactcctacggaaggcagcagtagggaatcttccgcaatggacgaaagtctgacggagcaacgccgcgtgagtga tgaaggtgttcggatcgtaaagctctgttgttagggaagaacaagtaccgttcgaatagggcggtaccttgacggtacctaaccagaaagccac ggctaactacgtgccagcagccgcggtaatacgtaggtggcaagcgttgtccggaattattgggcgtaaagggctcgcaggcggtttcttaagt ctgatgtgaaagcccccggctcaaccggggagggtcattggaaactggggaacttgagtgcagaagaggagagtggaattccacgtgtagcg gtgaaatgcgtagagatgtggaggaacaccagtggcgttggcgactctctggtctgtaactgacgctgaggagcgaaagcgtggggagcgaa caggattagataccctggtagtccacgccgtaaacgatgagtgctaagtgttagggggtttccgccccttagtgctgcagctaacgcattaagca ctccgcctggggagtacggtcgcaagactgaaactcaaaggaattgacgggggcccgcacaagcggtggagcatgtggtttaattcgaagca acgcgaagaaccttaccaggtcttgacatcctctgacaatcctagagataggacgtccccttcgggggcagagtgacaggtggtgcatggttgt cgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaacccttgatcttagttgccagcattcagttgggcactctaaggtgact gccggtgacaaaccggaggaaggtggctatgacgtcaaatcatcatgccccttatgacctgggctacacacgtgctacaatggtcagaacaaa gggcagcgaaaccgcgaggttaagccaatcccacaaatctgttctcagttcggatcgcagtctgcaactcgactgcgtgaagctggaatcgcta gtaatcgcggatcagcatgccgcggtgaatacgttcccgggccttgtacacaccgcccgtcacaccacgagagtttgtaacacccgcagtcgg 。
- 还没有人留言评论。精彩留言会获得点赞!