心血管疾病生物标记的检测方法与流程
本发明涉及一种生物检测方法,特别涉及一种生物标记的检测方法。
背景技术:
通过检测病患血液中的肌钙蛋白(troponini)与排钠肽(nt-probnp)等相关心血管疾病生物标记(cardiovasculardiseasebiomarkers)的含量,可作为评估急性胸痛与心脏衰竭的指标。
目前常见的检测方法为酶联结免疫吸附分析法(enzyme-linkedimmunosorbentassay,elisa)或电化学氧化还原法进行检测具有生物标记(biomarker)的配体液,需要先将蛋白质接上标签(labeling),并且需要冲洗的过程,检测时间长且较不灵敏。以场效晶体管制做生物感测器,具有无须标记,不需冲洗以及灵敏度高的优点。然而,所欲量测的生物标记通常是处于高盐浓度环境(例如人体血液)中,为了避免该配体液的高盐浓度产生的屏蔽效应(screeningeffect)导致无法量测,通常会先稀释该配体液才以场效晶体管进行后续检测而容易造成检测误差且不方便。此外,以电化学氧化还原法进行量测时,其所使用的电化学感测器因缺乏增益效果,不易观察到细微的电信号,所以有时会施加较大的电压,导致键结于电化学感测器上的受体(receptor)被破坏而失去功能。
技术实现要素:
本发明的目的在于提供一种生物标记的检测方法。
本发明的生物标记的检测方法,包含准备步骤及检测步骤。
该准备步骤包括准备生物感测晶体管,该生物感测晶体管包括基体及与 该基体彼此间隔设置的反应电极,该基体具有源极、与该源极间隔设置的漏极、及位于该源极与该漏极之间的栅极端,该反应电极具有相对该栅极端并与该栅极端间隔设置的电极本体、及设置于该电极本体表面且与该电极本体相互键结的受体。
该检测步骤包括将能与该受体(抗体(antibody)或适体(aptamer))产生反应并具有生物标记的配体液结合于该受体上,并施加可调制脉波宽度与高度的脉波电压于该反应电极,以令该反应电极与该栅极端之间产生压差,并于该脉波宽度内量测运算自该基体产生的检测电流,得到第一感测指标。
较佳地,该生物标记包括肌钙蛋白及排钠肽。
较佳地,该受体包括抗体及适体。
较佳地,该检测步骤的该脉波宽度不大于10-3秒。
较佳地,还包含实施于该检测步骤后的转换步骤,将该检测电流相对该脉波宽度进行积分转换,得到第二感测指标。
较佳地,该检测步骤包括连续性地施加该脉波电压。
较佳地,该准备步骤中的该生物感测晶体管选自高速电子迁移率场效晶体管、硅基场效晶体管、纳米线场效晶体管、纳米碳管场效晶体管、石墨烯场效晶体管,或二硫化钼场效晶体管,该电极本体与该受体相互键结的表面是由金所构成。
较佳地,该反应电极与该基体的顶面,并与该栅极端位于同一个平面。
本发明的有益效果在于:该检测步骤是将能与该受体(抗体(antibody)或适体(aptamer))产生反应并具有生物标记的配体液结合于该受体上,并施加可调制脉波宽度与高度的脉波电压于该反应电极,以令该反应电极与该栅极端之间产生压差,并于该脉波宽度内量测运算自该基体产生的检测电流,得到第一感测指标。由此,本发明可以克服屏蔽效应,直接于高盐浓度下检测该配体液中的心血管疾病生物标记。
附图说明
图1是一俯视示意图,说明本发明生物感测晶体管的一实施例。
图2是一电流对时间的关系图,说明本发明一个反应电极有键结一排钠肽抗体于一缓冲液中量测而得的电流值。
图3是一电流对时间的关系图,说明本发明该反应电极有键结排钠肽抗体,对参考蛋白液、及具体例1~5于一脉冲宽度内所量测而得的电流值,具体例1~5分别表示不同的排钠肽浓度配制于参考蛋白液,参考蛋白液为bsa配制于缓冲液中而成。
图4是一电荷对时间的关系图,说明图3的电流对时间作积分的曲线图。
图5是一电荷变化值对排钠肽浓度的关系图,辅助说明图4所述具体例1~5的电荷变化值。
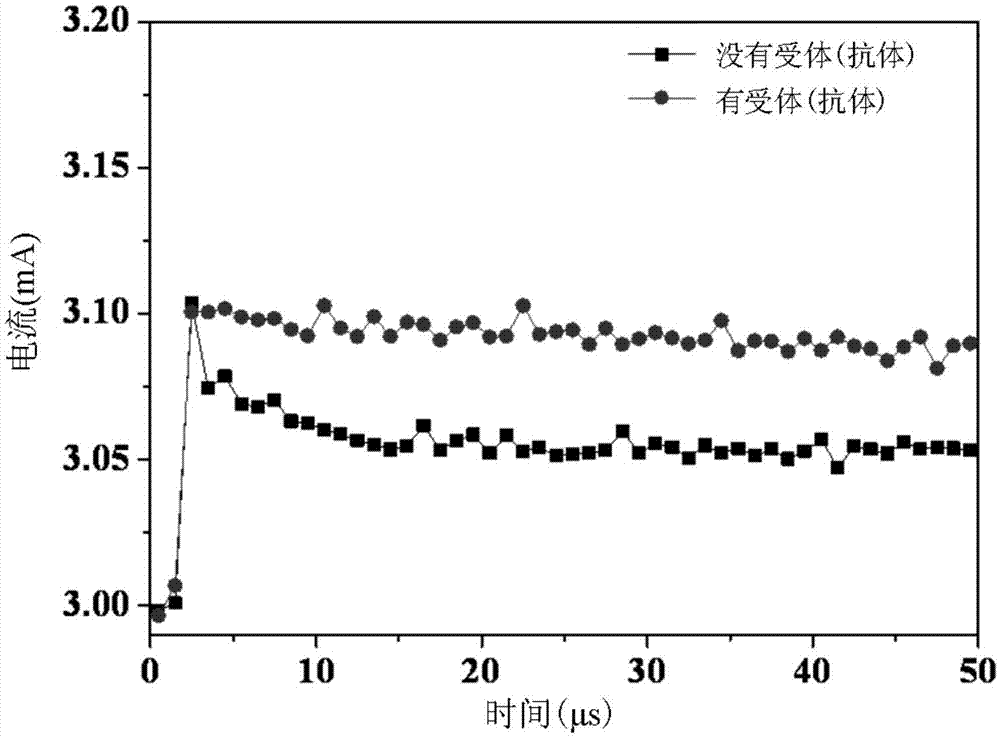
图6是一电流对时间的关系图,说明本发明该反应电极有无键结排钠肽抗体于一缓冲液中量测而得的电流值。
图7是一电流对时间的关系图,说明本发明该反应电极有键结排钠肽抗体于含有不同排钠肽浓度的人体血清中量测而得的电流值,具体例6~12分别表示不同的排钠肽浓度,于一脉冲宽度内所量测而得的电流值。
图8是一电荷对时间的关系图,说明图7的电流对时间作积分的曲线图。
图9是一电荷对浓度的关系图,辅助说明图8所述具体例6~12于50μs的电荷值。
图10是一电流对时间的关系图,说明本发明该反应电极有键结肌钙蛋白抗体,对参考蛋白液、及具体例13~15于一脉冲宽度内所量测而得的电流值,具体例13~15分别表示不同的排钠肽浓度配制于参考蛋白液。
图11是一电荷对时间的关系图,说明图10的电流对时间作积分的曲线图。
图12是一电荷变化值对浓度的关系图,辅助说明图11所述具体例13~15 的电荷变化值。
图13是一电流对时间的关系图,说明本发明该反应电极有键结肌钙蛋白抗体于含有不同肌钙蛋白浓度的人体血清中量测而得的电流值,具体例16~19分别表示不同的肌钙蛋白浓度,于一脉冲宽度内所量测而得的电流值。
图14是一电荷对时间的关系图,说明图13的电流对时间作积分的曲线图。
图15是一电荷对浓度的关系图,辅助说明图14所述具体例16~19于50μs的电荷值。
图16是一电流对时间的关系图,说明本发明该反应电极有键结肌钙蛋白适体于含有不同肌钙蛋白浓度的人体血清中量测而得的电流值,具体例20~23分别表示不同的肌钙蛋白浓度,于一脉冲宽度内所量测而得的电流值。
图17是一电荷对时间的关系图,说明图16的电流对时间作积分的曲线图。
图18是一电荷对浓度的关系图,辅助说明图17所述具体例20~23于50μs的电荷值。
具体实施方式
下面结合附图及实施例对本发明进行详细说明。
<发明详细说明>
参阅图1,本发明的生物感测晶体管2,包含一个基体21,及一个与该基体21彼此间隔设置的反应电极22。
该基体21包括一个基板211、一个设置于该基板211的源极212、一个与该源极212间隔设置的漏极213,及一个位于该源极212与该漏极213之间的栅极端214。该反应电极22包括一个设置于该基体21的顶面而相对该栅极端214彼此相间隔且位于同一个平面的电极本体221,该电极本体221的表面是由金 属材料所构成且与该基体21无电连接。
生物感测晶体管2可选自高速电子迁移率场效晶体管(highelectronmobilitytransistor,hemt)、纳米碳管场效晶体管、石墨烯场效晶体管,或二硫化钼场效晶体管,但不限于此。本实施例的该生物感测晶体管2使用类似高速电子迁移率场效晶体管(hemt)为例作说明,其结构是以一硅基材作为该基板211,并于该基板211上依序形成一氮化镓(gan)层及一氮化铝镓(algan)层,并通过曝光显影制程形成该源极212、该漏极213及该栅极端214而构成该基体21,其中,该栅极端214不具有如一般高速电子迁移率场效晶体管(hemt)所述的金属层,本实施例通过与该基体21无电连接的该反应电极22取代该栅极端214的金属层,而构成本实施例的该生物感测晶体管2。要说明的是,该电极本体221的表面选自可与后续所选用的受体键结的材料所构成,并非特定。于本实施例中,该电极本体221的表面选自金为材料构成。
本发明生物标记的检测方法是利用前述该生物感测晶体管2进行检测。现将该检测方法说明如下:
该生物标记的检测方法包含:一个准备步骤3及一个检测步骤4。
该准备步骤3是准备一个如图1所示的生物感测晶体管2,并将一受体23键结于该电极本体221的表面上,接着,进行该检测步骤4,将一具有预定浓度且能与该受体23产生反应的心血管疾病生物标记的配体液滴加在该电极本体221上,令该心血管疾病生物标记键结于该受体23上。接着,施加一具有可调制脉波宽度与高度的脉波电压v于该反应电极22上,令该反应电极22与该基体21的栅极端214之间产生一压差,并于该脉波宽度内量测运算该基体21产生的检测电流i,以得到一由该心血管疾病生物标记产生的第一感测指标。
具体地说,本发明该生物标记的检测方法主要用于检测可评估急性胸痛的肌钙蛋白(troponini)及用于作为心脏衰竭指标的排钠肽(nt-probnp)的心 血管疾病生物标记,因此,该受体23则须选自能分别与金及该心血管疾病生物标记产生键结的抗体或适体。而该配体液的调配可选用含有牛血清蛋白(bovineserumalbumin,bsa)的缓冲溶液,以调配成具有不同浓度的心血管疾病生物标记的配体液,或是,也可以直接取用人体血清作为配体液而量测血清中的心血管疾病生物标记的浓度。
该检测步骤4会先给予该基体21一固定电压后,再对该反应电极22施加该脉波电压v,从而使该反应电极22与该基体21的栅极端214之间产生压差。因此,当具有预定浓度的该心血管疾病生物标记键结于该受体23时,通过施加该脉波电压v产生的压差而能使该反应电极22与该基体21的栅极端214之间具有一电容效应,而得到由该电容效应所贡献的电流值。也就是说,通过该检测步骤4将不同配体液滴于该受体23后直接进行检测,可得到不同浓度的心血管疾病生物标记随时间产生的不同检测电流i,作为该第一感测指标。
值得一提的是,利用此电容效应进行检测时,能量测该受体23与该心血管疾病生物标记在反应未达平衡状态前的动态信息,也就是说,通过量测反应未达平衡状态前的动态信息,而能克服现有因为须在平衡状态时量测,该配体液因高盐浓度于平衡时产生的屏蔽效应,也无须将例如人类血液的高盐浓度的配体液进行繁复的稀释步骤,有关详细的分析数据容后说明。
此外,该检测步骤4所施加的脉波电压v的脉波宽度与高度的大小,取决于使用者所欲分析的检测时间及检测所需的电压大小,并没有特别的限制,也可为连续性地施加该脉波电压v,较佳地,于本发明中,该脉波宽度选用小于该受体23与该心血管疾病生物标记在反应未达平衡的时间,适用于本发明的脉波宽度为不大于10-3秒,而脉波高度则选用0.5v,但脉波高度并不限于0.5v。
值得一提的是,于该检测步骤4得到该检测电流i后,还可视需求实施一个转换步骤5,用于将该第一感测指标的检测电流i相对该脉波宽度(t)进行积 分转换,此时便为对电流与时间进行积分,而得到电荷量,从而得知特定时间于该基体21的源极212所累积的总电荷量,以作为第二感测指标。
为了可更清楚的说明本发明生物标记的检测方法,以下以23个具体例进行说明,所述具体例1~23是根据上述实施方式配合以下流程实施。
<具体例1>
本发明生物标记的检测方法的一具体例1是使用如图1所示的该生物感测晶体管2,并于该反应电极22已键结有抗体(antibody)(受体)23的生物感测器2进行量测。要说明的是,为了确保该受体23确实键结于该反应电极22的电极本体221上,因此,该具体例1在进行量测前,会先确认该受体23确实键结于该反应电极22的电极本体221上。首先,取磷酸盐缓冲溶液(phosphatebuffersaline,pbs)滴至该生物感测晶体管2的反应电极22与基体21上,使该缓冲溶液覆盖且连结该反应电极22的电极本体221与该基体21的栅极端214,并施加脉波宽度与高度分别为50μs及0.5v的脉波电压v于该反应电极22上,量测该基体21的源极212而得到一由pbs缓冲溶液所贡献而无键结该受体23的电流值。接着,移除pbs缓冲溶液,再将该受体23滴至该反应电极22的电极本体221上,让该受体23与反应电极22反应键结,随后于该反应电极22与该基体21的之间滴上pbs缓冲溶液,并以上述相同条件的脉波电压v量测该基体21的源极212而得到一由该受体23所贡献的电流值。
当该电极本体221键结有该受体23(抗体)所贡献的电流值与该电极本体221无键结该受体23(抗体)而由pbs缓冲溶液所贡献的电流值不同时,便可判定该受体23确实键结于该反应电极22的电极本体221上。
接着,以pbs缓冲溶液配制含有牛血清蛋白(bsa)的参考蛋白液,并将该参考蛋白液滴至该反应电极22与该基体21的间隙之间,再脉波宽度与脉波高度分别为50μs及0.5v的脉波电压v于该反应电极22,并于该基体21的源极212量测得到一第一电流i1。
再以洗脱缓冲溶液(elutionbuffer)将该反应电极22与该基体21之间的牛血清蛋白溶液清净,再重新以前述含有牛血清蛋白的参考蛋白液作为溶剂,并以排钠肽(nt-probnp)的心血管疾病生物标记作为溶质,调配浓度为100fm的排钠肽(nt-probnp)配体液。
随后,将浓度为100fm的排钠肽配体液滴至该反应电极22的电极本体221与该基体21的栅极端214之间。随后对该基体21的源极212与漏极213施加0.5v的电压,并在时间经过2μs时,给予该反应电极22一个脉波宽度与高度分别为50μs及0.5v的脉波电压v,并量测该基体21的源极212而得到一第二电流i2。
最后,将该第二电流i2扣除该第一电流i1便得到该检测电流i,作为第一感测指标。
要说明的是,该具体例1选用含有牛血清蛋白的溶液作为溶剂的目的在于,因血清蛋白是血液中最大量的蛋白质,使该配体液更接近于实际的人体血液环境,且先行滴上该参考蛋白液量测该第一电流i1的步骤,能作为一背景值,因此,通过量测该配体液所贡献的第二电流i2减去该参考蛋白(bsa)所产生的第一电流i1,便能得到仅是由该心血管疾病生物标记与该受体23结合后所贡献的检测电流i。
<具体例2~5>
本发明生物标记的检测方法的一具体例2~5的实施条件大致上相同于该具体例1,其不同处在于,该具体例2~5所配制的配体液浓度分别为1pm、10pm、100pm,及1nm的排钠肽配体液。
<具体例6>
本发明生物标记的检测方法的一具体例6的实施条件大致相同于该具体例1,其不同处在于,是选用人体血清(serum)作为溶剂,以调配具有浓度为180.9pg/ml的排钠肽的心血管疾病生物标记的人体血清配体液,并直接以该 电极本体221键结有受体23(抗体)与电极本体221无键结受体23(抗体),于人体血清配体液中量测其电流值,以判定受体23确实键结于反应电极22的电极本体221上,接着,将人体血清配体液滴至该反应电极22的电极本体221与该基体21的栅极端214之间,以直接量测该基体21的源极212便得到该检测电流i,作为第一感测指标。
<具体例7~12>
本发明生物标记的检测方法的一具体例7~12的实施条件大致上相同于该具体例6,其不同处在于,该具体例7~12分别量测具有浓度为269.2pg/ml、660.8pg/ml、1848pg/ml、3008pg/ml、4596pg/ml,及5000pg/ml的排钠肽的人体血清配体液。
<具体例13>
本发明生物标记的检测方法的一具体例13的实施条件大致相同于该具体例1,其不同处在于,以含有牛血清蛋白的参考蛋白液作为溶剂,并以肌钙蛋白(troponini)的心血管疾病生物标记作为溶质,调配浓度为1pm的肌钙蛋白配体液进行量测。
<具体例14~15>
本发明生物标记的检测方法的一具体例14~15的实施条件大致上相同于该具体例13,其不同处在于,该具体例14~15的配体液浓度分别为10pm及100pm的肌钙蛋白配体液。
<具体例16>
本发明生物标记的检测方法的一具体例16的实施条件大致相同于该具体例6,其不同处在于,直接于该电极本体211键结受体23(抗体)后,而将具有浓度小于0.006ng/ml的肌钙蛋白的心血管疾病生物标记的人体血清配体液滴至该反应电极22的电极本体221与该基体21的栅极端214之间,而直接量测该基体21的源极212便得到该检测电流i,作为第一感测指标。
<具体例17~19>
本发明生物标记的检测方法的一具体例17~19的实施条件大致上相同于该具体例16,其不同处在于,该具体例17~19分别量测具有浓度为0.006ng/ml、0.033ng/ml,及1.886ng/ml的肌钙蛋白的人体血清配体液。
<具体例20>
本发明生物标记的检测方法的一具体例20的实施条件大致相同于该具体例16,其不同处在于,以适体(aptamer)作为受体23,而将其键结于电极本体211上,并将具有浓度小于0.006ng/ml的肌钙蛋白的心血管疾病生物标记的人体血清配体液滴至该反应电极22的电极本体221与该基体21的栅极端214之间,而直接量测该基体21的源极212便得到该检测电流i,作为第一感测指标。
<具体例21~23>
本发明生物标记的检测方法的一具体例21~23的实施条件大致上相同于该具体例20,其不同处在于,该具体例21~23分别量测具有浓度为0.033ng/ml、1.886ng/ml,及33.7ng/ml的肌钙蛋白的人体血清配体液。
<数据分析>
参阅图2~图5,图2~图5为所述具体例1~5的量测结果。由图2可知电极本体221键结有受体23所贡献的电流值与电极本体221无键结受体23所贡献的电流值不同,而能判定受体23确实键结于电极本体221上,图3是以抗体作为受体23键结于电极本体221,而量测参考蛋白液(bsa),及于参考蛋白液(bsa)中量测心血管疾病生物标记的排钠肽浓度(所述具体例1~5)的电流对时间曲线图。
由图3可知,于2μs施加脉波电压v时,产生一明显的电流峰值,随后,电流曲线则趋于平缓,具有此电流曲线特征是因为该反应电极22与该基体21为彼此间隔设置,因此,当施加脉波电压v于该反应电极22时,便会对该基 体21的栅极端214产生一因电容效应的充电现象,从而具有明显的电流峰值。
一般来说,在时间小于10-3秒时,该受体(抗体)23与心血管疾病生物标记的反应为未达平衡状态,本发明通过此电容效应的充电现象而能在小于50μs内,观察此电流峰值至电流曲线趋于平缓状态的过程,得知所述具体例1~5的受体(抗体)与心血管疾病生物标记在未达平衡状态的相互反应的电流变化值。由图3观察所述具体例1~5的电流变化可知,具有不同浓度的排钠肽确实具有不同电流曲线,且所述电流曲线随排钠肽浓度越大而逐渐降低,具有明显趋势。
图3以电流变化曲线作为第一感测指标,还可进一步地通过转换步骤,而得到以电荷作为指标的第二感测指标。
图4显示有图3所述具体例1~5的各曲线电流值相对时间进行积分转换而得到相对时间的电荷曲线。由图4可知,随着时间越长,排钠肽浓度越小所累积的总电荷量越多。由电荷量等于电流承以时间(q=i×t)可知,电荷量与电流成正比,因此,图4所显示的电荷曲线确实符合图3的结果。
图5是图4所述具体例1~5的电荷值扣除参考蛋白液(bsa)所贡献的电荷值,且进一步地对所述具体例1~5所载的排钠肽浓度取对数。由图5可知,排钠肽浓度越大,其扣除参考蛋白液(bsa)后,其电荷变化量的绝对值越大,且呈一具有相当线性程度的趋势。由图4与图5可知,将所述具体例1~5所得到的电流转换成电荷也具有明显的趋势,而能作为第二感测指标。
参阅图6~图9,图6~图9为该具体例6~12于电极本体211键结抗体作为受体23,而于人体血清中量测心血管疾病生物标记的排钠肽浓度。
由图6可知,电极本体221键结有受体23(抗体)与电极本体221无键结受体23(抗体),于人体血清中量测其电流值不同,而能判定受体23确实键结于反应电极22的电极本体221上。
由图7与图8可知,相同于图3与图4的量测结果,于人体血清中量测不同 浓度的排钠肽时,随着排钠肽浓度越大,其电流指标或电荷指标逐渐降低,而具有明显趋势。
图9是对图8在50μs取其相对应的电荷值,而可清楚得知,在特定时间下,人体血清中其排钠肽浓度越大,则具有越低的电荷值。要说明的是,本发明是选取50μs为例作说明,但并不限于此,特定时间的选取可视情况自由选择。
参阅图10~图12,图10~图12为该具体例13~15于电极本体211键结抗体作为受体23,而于参考蛋白液(bsa)中改以量测心血管疾病生物标记的肌钙蛋白浓度。
由图10~图12量测结果可知,相同于图3~图5的量测结果,改以量测心血管疾病生物标记的肌钙蛋白浓度时,随着肌钙蛋白浓度越大,其电流指标或电荷指标逐渐降低,也具有明显趋势。
参阅图13~图15,图13~图15为该具体例16~19于电极本体211键结抗体作为受体23,并改以在人体血清中量测心血管疾病生物标记的肌钙蛋白浓度。
由图13~图15量测结果可知,相同于图7~图9的量测结果,于人体血清中量测肌钙蛋白浓度时,其电流指标或电荷指标仍是随着肌钙蛋白浓度变大而降低,其中,图15是对图14在50μs取其相对应的电荷值,而可清楚得知,在特定时间下,人体血清中的肌钙蛋白浓度越大,其电荷值越低。
参阅图16~图18,图16~图18为该具体例20~23于电极本体211键结适体作为受体23,而于人体血清中量测心血管疾病生物标记的肌钙蛋白浓度。
由图16~图18量测结果可知,将适体取代抗体作为受体23而于人体血清中量测肌钙蛋白浓度时,其量测结果也相同于图13~图15随着肌钙蛋白浓度变大,其电流指标或电荷指标随着降低,其中,图18是对图17在50μs取其相对应的电荷值,而可清楚得知,在特定时间下,人体血清中的肌钙蛋白浓度越大,其电荷值越低。
综上所述,本发明生物标记的检测方法,通过该反应电极22与该栅极端214彼此间隔设置的该生物感测晶体管2进行心血管疾病生物标记的检测,利用施加可调制脉波宽度与高度的脉波电压v,令该反应电极22与间隔设置的该栅极端214产生压差并具有电容效应,得到由该电容效应所贡献的检测电流,便可反推得到心血管疾病生物标记的浓度。此外,该检测方法还能量测该受体23与心血管疾病生物标记在未达平衡状态的相互反应的电流变化值,因此,可以克服屏蔽效应,直接于高盐浓度下检测该配体液中的心血管疾病生物标记,且该生物感测晶体管2具有增益效果,而易观察细微的电信号,所以确实能达成本发明的目的。
- 还没有人留言评论。精彩留言会获得点赞!