白介素17在抵御流感病毒侵染中的应用的制作方法
本发明涉及生物
技术领域:
,尤其涉及白介素17在抵御流感病毒侵染中的应用。
背景技术:
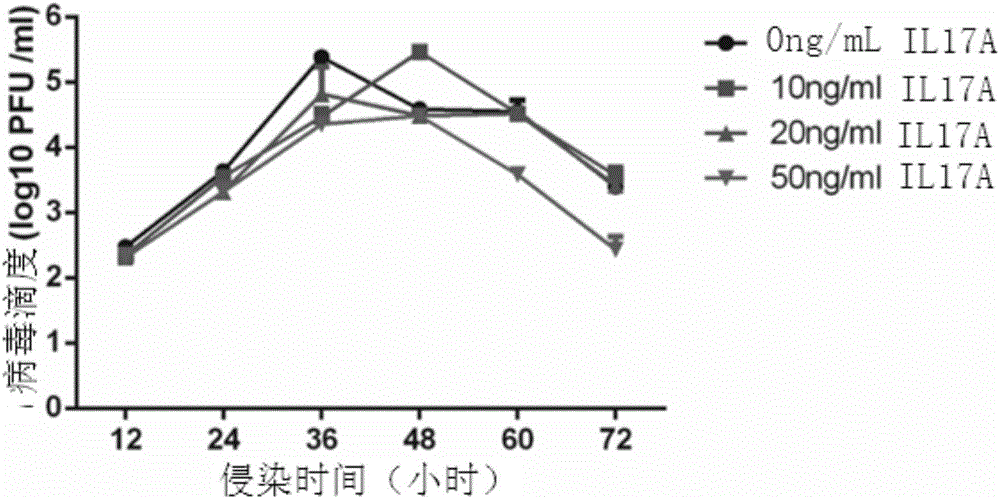
:白介素种类很多且功能各异,但最近研究发现的一类新型白介素却对炎症反应的发生发展起着不可忽视的作用,这一类白介素被人们命名为白介素-17,白介素-17的发现为以前一些有争议的炎症现象提供了合理的解释,同时也使得人们对于炎症信号网络的认识更加细致深入。科学家从小鼠的T细胞淋巴瘤细胞中首先发现了白介素-17A,通过生物信息学手段,很快发现在基因组中还含有其他五个和白介素-17A同源的基因,由此,人们将这六个同源的细胞因子归入一个新的白介素家族:白介素-17家族。该家族的细胞因子被分别命名为白介素-17A到白介素-17F。同时,人们还找到了它们的受体家族:白介素-17受体A到白介素-17受体E。这些白介素-17细胞因子可以结合到相对应的受体成员上从而介导不同的炎症反应。白介素-17A一方面会诱导炎症因子以及趋化因子的表达,从而招募更多的免疫细胞到达炎症部位加剧机体的炎症反应,另一方面,白介素-17A还会诱导一些组织修复相关因子的表达从而加速机体的恢复。虽然白介素-17A在宿主抗感染和组织修复过程中起到扩大免疫防御反应保护自身机体的作用,但是,在很多自身免疫病病人和肿瘤病人当中,白介素-17A又是高表达的,由于它可以诱导很多炎症因子的表达,过高的白介素-17A水平对于疾病的病理发展起到恶化作用。很多动物实验也证明,白介素-17A缺失或者抗体中和白介素-17A,可以有效的抑制多种自身免疫病病理程度。针对白介素-17A的治疗性抗体目前正处于研发之中。除了白介素-17A以外,该家族的另一个成白介素-17E又具有异于白介素-17A的功能。在机体遭受过敏原刺激时,白介素-17E会被炎症部位的多种细胞分泌出来扩大机体的体液免疫反应。很多临床病人样本和动物模型试验证明,白介素-17E对人体抵抗寄生虫感染非常重要,与此同时,它对于机体的过敏反应却起到促进作用,这样白介素-17E就加剧了哮喘等呼吸道疾病的发病程度。最近,科学家又发现,在人体遭遇肠道或皮肤炎症时,肠道上皮细胞和皮肤角质层细胞会分泌白介素-17C,白介素-17C又会作用于它的分泌细胞使之快速的对外来刺激做出早期反应。这样,这种由白介素-17C介导的早期炎症反应加之随后白介素-17A介导的淋巴细胞侵润,共同构成了宿主的粘膜免疫防线,为机体清除病原微生物维持自身稳态提供了重要屏障。同样,白介素-17C的持续存在也会导致多种自身免疫病的发生。白介素-17家族的细胞因子就如同一把双刃剑,在急性炎症反应中,它们可以快速的分泌出来保护机体不受外源有害物质的危害,而当人体产生由于多种遗传和环境因素所导致的慢性炎症时,它们又会加速多种慢性疾病的病程。所以,白介素-17家族细胞因子和人类的健康息息相关,科学家所要做的就是研究清楚它们对于不同炎症反应的调控机制,这会为防治许多炎症相关重大疾病提供宝贵的参考依据和治疗策略。技术实现要素:本发明的一个目的是提供IL-17蛋白的新用途。本发明提供IL-17蛋白在制备抑制流感病毒侵染细胞产品中的应用;或本发明提供IL-17蛋白在制备抗流感病毒产品中的应用;或本发明提供IL-17蛋白在制备抑制流感病毒在细胞中生长产品中的应用。或本发明提供IL-17蛋白在提高感染流感病毒的细胞中IL-13、IL-15和IL-17F的表达量中的应用;或本发明提供IL-17蛋白在制备提高感染流感病毒的细胞中IL-13、IL-15和IL-17F的表达量产品中的应用。上述应用中,所述IL-17蛋白为IL-17A蛋白。IL-17A前体氨基酸序列为序列1,成熟肽的氨基酸序列为序列2。在本发明的实施例中用的IL17A成熟肽(R&D货号:BA12416)。上述应用中,所述流感病毒为A/PR8;或,所述细胞为肿瘤细胞;或,所述肿瘤细胞为腺癌细胞;或,所述腺癌细胞为A549细胞。本发明的另一个目的是提供一种产品。本发明提供的产品,包括IL-17蛋白;所述产品具有如下1)-4)中至少一种功能:1)抑制流感病毒侵染细胞;2)抗流感病毒;3)抑制流感病毒在细胞中生长;4)提高感染流感病毒的细胞中IL-13、IL-15和IL-17F的表达量。上述产品中,所述IL-17蛋白为IL-17A蛋白。上述产品中,所述流感病毒为A/PR8;或,所述细胞为肿瘤细胞;或,所述肿瘤细胞为腺癌细胞;或,所述腺癌细胞为A549细胞。上述中,所述产品为试剂盒。本发明的实验证明,本发明发现白介素17A可以抵挡流感病毒侵染细胞,为流感病毒的防治等具有重大价值。附图说明图1为在293T细胞中的差异基因的GO富集分析;1.免疫细胞间的相关因子2.无颗粒白细胞粘附和渗出3.IL17A和IL17F上皮细胞调节因子4.喘气气管炎性因子5.IL17A和IL17FT细胞调节因子。图2为实施例2中白介素-17的孵育鉴定结果。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。以下的实施例便于更好地理解本发明,但并不限定本发明。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。实施例1、白介素17与流感病毒关系的发现一、细胞培养及传代293T、A549细胞用含10%FBS、1‰双抗的DMEM培养于37℃5%CO2培养箱中。1、细胞培养至95%以上汇合度时,准备进行传代;2、弃去原培养基,用PBS清洗细胞表面培养基残夜及少量死细胞;3、加入适量胰酶,按细胞贴壁能力不同消化相应时间。光学显微镜下观察,待细胞变圆后,弃去胰酶;4、加入新鲜培养基,将细胞轻轻吹打成细胞悬液,吸取适量细胞悬液至新的细胞培养皿中,补添新鲜培养基至8-10mL总体积,37℃、5%CO2培养箱放置培养;5、次日给细胞更换新鲜培养基,培养至95%以上汇合度进行下次传代。二、病毒感染1、将上述一培养的293T、A549细胞至90%汇合度时,准备进行感染;2、配置病毒感染液:DMEM,2μg/μlTPCK处理的胰酶,按照特定MOI加入流感病毒毒株A/PR8(记载该毒株的已发表的文献:Li,J.,Zheng,W.,Hou,L.,Chen,C.,Fan,W.,Qu,H.,Jiang,J.,Liu,J.,Gao,G.F.,Zhou,J.,Sun,L.,andLiu,W.(2016),Differentialnucleocytoplasmicshuttlingofthenucleoproteinofinfluenzaavirusesandassociationwithhosttropism,CellularMicrobiology,doi:10.1111/cmi.12692)液;3、弃去细胞培养基,PBS清洗细胞表面残夜;4、加入配置的病毒感染液,细胞于37℃5%CO2培养箱放置培养1h;5、弃去病毒感染液后,再用PBS清洗细胞表面1次,加入未加病毒的感染液继续培养。6、根据实验需要,收集病毒培养上清检测病毒,或者收集细胞裂解液进行蛋白检测,或者加入Trizol进行RNA提取。三、Real-timePCR1、293T、A549细胞培养于6孔板中(1x106个/孔),待细胞长至90%以上汇合度时,弃去细胞培养基,PBS清洗细胞表面残夜;2、配置A/PR8病毒感染液(是上述二得到的病毒),加入6孔板中(MOI=1),感染1h后,PBS清洗细胞1次,未感染组为感染0h的样品;3、感染后4、8、12h弃去感染液,加PBS洗1遍;4、每孔加入1mLTRIZOL,溶解细胞后收集到RNase-free的1.5mLEp管中;5、加入200μl氯仿,用手轻轻震荡混匀后室温静置2min;6、4℃12000rpm离心15min,小心吸取上层水相400μl与一新的1.5mLEp管中;7、加入同等体积的异丙醇,轻轻颠倒混匀后室温静置5min;8、4℃12000rpm离心15min,弃上清;9、取1mLDEPC水配置的75%乙醇加入Ep管,轻轻地吹弹起白色RNA沉淀,轻轻吹洗几次;10、4℃8000rpm离心5min,弃上清;11、重复步骤9,再清洗沉淀1次;12、其上清后,室温晾干至白色消失即可;13、加入50μlDEPC水,室温静置5min,充分溶解RNA;14、琼脂糖核酸电泳鉴定提取的RNA质量;15、NanoDrop测定提取的RNA浓度、260/280及260/230;16、取2μgRNA进行反转录,50μl总体积反转录体系为:加入DEPCH2O补齐至50μl。17、反转录出cDNA后,进行real-timePCR,20μl总体积反应体系为:(上游:5’-GCAGGCACAAACTCATCCAT-3’下游:5’-CAGGCTCAGCAGCAGTAGCA-3’)18、反应程序为:95℃30s;[95℃5s,60℃30s]×40个循环;在60℃收集荧光。19、收集数据,根据2-△△Ct法进行数据分析。四、RNA-Seq样本制备1、293T、A549细胞铺于6孔板中,待细胞长至90%汇合度时进行感染;2、用含2μg/mLTPCK处理胰酶的DMEM感染液稀释A/PR8(是上述二得到的病毒),以MOI=1的感染剂量分别感染293T、A549;3、感染8h后,弃去感染液,用PBS清洗细胞表面1次,每孔加入1mLTRIZOL,静置半分钟,轻轻吹打细胞至细胞完全溶解,收集TRIZOL细胞裂解液至1.5mL的RNase-freeEp管中;4、每管加入200μl氯仿,轻轻振荡混匀后,4℃12000rpm离心15min;5、取上清水相400μl至新的RNase-freeEp管中,再加入400μl异丙醇,颠倒混匀,静置5min后,4℃12000rpm离心15min,RNA沉淀离于管底;6、小心移去上清液,防止RNA沉淀丢失;7、每管加入900μl70%乙醇(DEPC水配置),用移液器轻轻吹起RNA沉淀,充分洗涤沉淀表面,4℃12000rpm离心15min;8、可重复步骤7;9、尽可能吸弃上清,防止RNA沉淀丢失,室温静置干燥,直至乙醇完全挥发,白色消失;10、加入50μlDEPC水将RNA溶解;11、取出1μlRNA进行琼脂糖核酸电泳观察RNA条带,并观察有无基因组DNA污染;12、取出1.5μlRNA于微量核酸浓度测定仪测定浓度及观察260/280、260/230比值。13、DNase处理剩余RNA并纯化后,-80℃低温保存或进行RNA-Seq测定。RNA-Seq测定结果显示,利用cDNA微矩阵技术检测A/PR8毒株感染A549细胞后的转录组学变化,发现了456个上调基因和346个下调基因,其中大部分基因参与天然免疫、炎症反应和胞内运输等过程。利用高通量测序方法(RNA-Seq)对A型流感病毒感染A549和293T细胞后的mRNA转录组学变化进行检测,以未感染细胞作为阴性对照,与人cDNA文库进行比对后。对两种细胞系中检测到的上调基因和下调基因分别进行GO富集分析,根据差异基因富集的分类条目而为下一步的功能分析做基础。如图1所示,在A549细胞中上调基因和下调基因分别进行GO富集分析后,选取p-value值最小前10个分类条目。p-value值越小,即-log10(p-value)越大,表示基因在此GO分析条目中越富集。从图中来看,在A549细胞中,上调基因主要参与炎性因子及炎性因子调节因子的过程。GO富集分析表明,在流感病毒感染的293T细胞中,IL-17A在肠上皮细胞或巨噬细胞中细胞因子产生的差异调节也富集在前5个Pathway通路中,表明了IL-17A在调节A549细胞中的病毒繁殖或炎症反应的潜在作用。实施例2、白介素-17在抑制流感病毒生长中的应用IL-17A前体氨基酸序列为序列1,成熟肽的氨基酸序列为序列2。1、IL17A孵育A549细胞将A549细胞分如下两组培养细胞:待感染A549细胞:A549细胞(记载于“S-SWang,Zh-DZhao,Y-HBi,LSun,X-LLiu*,W-JLiu*.2013.Tyrosine132phosphorylationofinfluenzaAvirusM1proteiniscrucialforvirusreplicationbycontrollingitsnuclearimport.JournalofVirology,87(11):6182-91”一文中,公众可从中国科学院微生物研究所获得。)在DMEM细胞培养液中培养24h,至90%汇合度;待感染不同浓度IL17A孵育A549细胞:将A549细胞在含有IL17A的细胞培养基中,培养24h,至90%汇合度。含有不同浓度的IL17A的细胞培养基为将IL17A(R&D货号:BA12416,是成熟肽)与DMEM细胞培养液混匀,得到培养基,且IL17A在含有IL17A的细胞培养基中的浓度分别为10ng/mL,20ng/mL和50ng/mL。2、病毒感染第一组-待感染A549细胞病毒感染组:将100ul流感病毒毒株A/PR8(记载该毒株的已发表的文献:Li,J.,Zheng,W.,Hou,L.,Chen,C.,Fan,W.,Qu,H.,Jiang,J.,Liu,J.,Gao,G.F.,Zhou,J.,Sun,L.,andLiu,W.(2016),Differentialnucleocytoplasmicshuttlingofthenucleoproteinofinfluenzaavirusesandassociationwithhosttropism,CellularMicrobiology,doi:10.1111/cmi.12692)、2μg/μlTPCK处理25%胰酶(Gibco,货号25200-056)、2mlDMEM(Gibco,货号31600034)待感染A549细胞病毒混匀,其中,MOI值为0.1;于37℃5%CO2培养箱放置培养,收集上清液。第三组-待感染不同浓度IL17A孵育A549细胞组:将100ul流感病毒毒株A/PR8、2μg/μlTPCK处理25%胰酶(Gibco胰酶,货号25200-056)、2mlDMEM(Gibco,货号31600034)待感染不同浓度IL17A孵育A549细胞混匀,其中,MOI值为0.1;于37℃5%CO2培养箱放置培养,收集上清液。第二组-待感染A549细胞未感染组:将2μg/μlTPCK处理25%胰酶(Gibco胰酶,货号25200-056)、2mlDMEM(Gibco,货号31600034)待感染A549细胞混匀;于37℃5%CO2培养箱放置培养,收集上清液。第四组-待感染不同浓度IL17A孵育A549细胞未感染组:将2μg/μlTPCK处理25%胰酶(Gibco胰酶,货号25200-056)、2mlDMEM(Gibco,货号31600034)待感染不同浓度IL17A孵育A549细胞混匀;于37℃5%CO2培养箱放置培养,收集上清液。上述实验分组如表1所示。表1A549细胞IL17A孵育A549细胞病毒感染第一组第三组病毒未感染第二组第四组3、病毒滴度检测取样时间节点:分别在培养第0h、8h、12h、16h、24h、48h、72h取细胞上清液。将第一组和第三组培养8h、12h、16h、24h、36h、48h、72h取细胞上清液进行TCID50检测(检测方法是常规公知)。结果如图2(横坐标为病毒感染时间,纵坐标为病毒滴度)所示,可以看出,根据IL-17A蛋白孵育剂量的不同,在感染后48和72小时,病毒滴度显著降低,表明,IL-17A蛋白抑制病毒的生长。4、相关基因表达量检测收集上述2培养第三组和第四组8h和12h样品的沉淀,提取RNA作为模板,用下面的引物对进行不同基因的real-timePCR检测。检测real-timePCR的基因和引物如下表2:表2结果显示,与第四组病毒未感染组相比,不同浓度IL17A孵育A549细胞在感染病毒后,IL-13表达量显著下调;当IL-17A浓度从20ng/mL增加至50ng/mL时,IL-15表达增加;而IL-17F表达在用较低IL-17A浓度(20ng/mL)感染后几乎所有时间点都增加。因此,IL17A可提高感染流感病毒的细胞中IL-13、IL-15和IL-17F的表达量。<110>中国科学院微生物研究所南京农业大学<120>白介素17在抵御流感病毒侵染中的应用<160>2<170>PatentInversion3.5<210>1<211>155<212>PRT<213>人工序列<220><223><400>1MetThrProGlyLysThrSerLeuValSerLeuLeuLeuLeuLeuSer151015LeuGluAlaIleValLysAlaGlyIleThrIleProArgAsnProGly202530CysProAsnSerGluAspLysAsnPheProArgThrValMetValAsn354045LeuAsnIleHisAsnArgAsnThrAsnThrAsnProLysArgSerSer505560AspTyrTyrAsnArgSerThrSerProTrpAsnLeuHisArgAsnGlu65707580AspProGluArgTyrProSerValIleTrpGluAlaLysCysArgHis859095LeuGlyCysIleAsnAlaAspGlyAsnValAspTyrHisMetAsnSer100105110ValProIleGlnGlnGluIleLeuValLeuArgArgGluProProHis115120125CysProAsnSerPheArgLeuGluLysIleLeuValSerValGlyCys130135140ThrCysValThrProIleValHisHisValAla145150155<210>2<211>132<212>PRT<213>人工序列<220><223><400>2GlyIleThrIleProArgAsnProGlyCysProAsnSerGluAspLys151015AsnPheProArgThrValMetValAsnLeuAsnIleHisAsnArgAsn202530ThrAsnThrAsnProLysArgSerSerAspTyrTyrAsnArgSerThr354045SerProTrpAsnLeuHisArgAsnGluAspProGluArgTyrProSer505560ValIleTrpGluAlaLysCysArgHisLeuGlyCysIleAsnAlaAsp65707580GlyAsnValAspTyrHisMetAsnSerValProIleGlnGlnGluIle859095LeuValLeuArgArgGluProProHisCysProAsnSerPheArgLeu100105110GluLysIleLeuValSerValGlyCysThrCysValThrProIleVal115120125HisHisValAla130当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 人源抗H7N9禽流感病毒中和性抗体1F7L及其应用的制造方法与工艺
- 吲哚衍生物及其制备方法和其抗流感病毒作用与制造工艺
- 检测H5亚型禽流感病毒与鸡细小病毒的成套试剂与方法与制造工艺
- 检测禽流感病毒与鸡细小病毒的成套试剂与方法与制造工艺
- 一种流感病毒逆转录环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于快速检测流感病毒的狗肾细胞MDCK-NS1的离心小瓶及其应用方法与制造工艺
- 一种保护和稳定病毒RNA的采血管的制造方法与工艺
- H6亚型禽流感病毒荧光定量RT‑PCR检测方法与制造工艺
- 表达H7N9亚型禽流感病毒血凝素蛋白的重组火鸡疱疹病毒株rHOH及构建方法与制造工艺
- 一种提高禽流感疫苗毒株增殖滴度的方法与制造工艺