PHB2基因或蛋白的抑制剂在制备抗猪圆环病毒2型药物中的应用的制作方法
本发明涉及生物技术领域,特别地,涉及一种phb2基因或蛋白的抑制剂在制备抗猪圆环病毒2型药物中的应用。
背景技术:
猪圆环病毒(porcinecircovirus,pcv)属于圆环病毒科圆环病毒属,是无囊膜的环状单链dna病毒(直径17nm)。目前在猪群中已鉴定出pcv1、pcv2和pcv3。其中,pcv2临床或亚临床感染被认为是猪圆环病毒病(porcinecircovirusdiseasesandporcinecircovirus-associateddiseases,pcvd/pcvad)的主要原因,pcvd/pcvad传染性强、流行范围广,不同猪(群或场)的pcvad发病率和严重程度存在差异,该疾病日趋复杂,其代表性特征主要是猪皮炎和肾病综合征(porcinedermatitisandnephropathysyndrome,pdns)、断奶仔猪多系统衰竭综合征(post-weaningmultisystemicwastingsyndrome,pmws)以及猪呼吸系统疾病综合征(porcinerespiratorydiseasecomplex,prdc),还可引起繁殖障碍等,严重危害全球养殖业。pcv2cap蛋白(capsidprotein)是pcv2唯一的核衣壳蛋白,也是主要免疫原性蛋白,基于pcv2cap蛋白组装的病毒样颗粒(virus-likeparticles,vlps)亚单位疫苗可应用于猪场pcv2的预防。
迄今为止,pcvd/pcvad的确切机制还有待阐明,加上临床上pcv2基因组的高突变率和混合感染问题日益严重,使防控pcv2流行面临严峻挑战。shuang等在研究泛素-蛋白酶体系统(ups)与pcv2复制的互作时发现,其蛋白酶体抑制剂(mg132和lactacystin)显著降低pcv2早期复制滴度,ups可能以细胞周期依赖的方式降低病毒蛋白表达和rna转录,表明pcv2复制效率与ups密切相关。liu等利用hsp90抑制剂(17-aag)腹腔注射小鼠后发现,17-aag能够显著降低血液和组织中pcv2病毒载量,可降低pcv2感染小鼠血液和组织中的病毒载量,表明hsp90与pcv2复制密切相关。wang等研究发现波形蛋白(vimentin)可以与pcv2cap蛋白之间的相互作用,并对pcv2在pk-15细胞中的复制有一定的抑制作用。目前pcv2感染与宿主细胞之间的相互作用网络还不是十分清楚,而pcv2与宿主细胞内蛋白分子互作的研究报道相对较少。
抗增殖蛋白(prohibitins,phbs)是一种高度保守和结构非常稳定的蛋白质家族(包括phb1和phb2等),phbs广泛分布于各种生物细胞,呈现不同细胞定位,主要存在于线粒体内膜,也少量分布于细胞质膜和细胞核。phbs是细胞中重要的多功能蛋白,直接参与调控细胞增殖、凋亡和分化等多种细胞生物学进程,与肿瘤、糖尿病和肥胖症等疾病密切相关。而phb2是phbs家族中的重要成员,是线粒体与细胞核间相互交流的重要媒介。
技术实现要素:
本发明提供了一种phb2基因或蛋白的抑制剂在制备抗猪圆环病毒2型药物中的应用,解决如何抑制猪圆环病毒2型的复制的技术问题。
本发明采用的技术方案如下:
一种phb2基因或蛋白的抑制剂在制备抗猪圆环病毒2型药物中的应用。
进一步地,抑制剂选择以能够抑制phb2蛋白表达或基因转录的小干扰rna(sirna)、双链rna(dsrna)、短发夹rna(shrna)或反义寡核苷酸;或能表达或形成sirna、dsrna、shrna或反义寡核苷酸的构建物。
进一步地,sirna包括phb2sirna-1或phb2sirna-2;phb2sirna-1的靶序列如seqidno:1所示,或者,phb2sirna-2的靶序列如seqidno:2所示。
进一步地,shrna的编码序列正义链如seqidno:3所示,反义链如seqidno:4所示。
根据本发明的另一方面,还提供了一种抑制猪圆环病毒2型的sirna的靶序列,sirna包括phb2sirna-1或phb2sirna-2;phb2sirna-1的靶序列如seqidno:1所示,或者,phb2sirna-2的靶序列如seqidno:2所示。
根据本发明的另一方面,还提供了一种抑制猪圆环病毒2型的shrna分子,shrna分子的编码序列正义链如seqidno:3所示,反义链如seqidno:4所示。
根据本发明的另一方面,还提供了一种含有上述抑制猪圆环病毒2型的shrna分子的shrna表达质粒。
根据本发明的另一方面,还提供了一种药物组合物,包括上述sirna的靶序列、shrna分子、shrna表达质粒中的一种,还包含药学可接受的载体和/或赋形剂。
根据本发明的另一方面,还提供了一种用于抑制猪圆环病毒2型复制的试剂盒,包括上述sirna的靶序列、上述shrna分子、上述shrna表达质粒中的一种。
本发明具有以下有益效果:
本发明的phb2基因或蛋白的抑制剂在制备抗猪圆环病毒2型药物中的应用,通过间接免疫荧光试验检测pcv2在pk-15细胞中的增殖变化,检测pcv2感染pk-15细胞后phb2mrna的动态变化,和鉴定在phb2基因或蛋白的抑制剂转染pk-15细胞中pcv2cap蛋白表达。结果表明,phb2在正常及pcv2感染的pk-15细胞中均有效表达。pcv2可显著影响pk-15细胞中phb2转录,而且phb2对pcv2病毒复制具有调节作用,下调phb2的表达,即phb2基因敲除或蛋白表达下调,能明显抑制pcv2的复制,对阐明pcv2致病机理和研究新的抗病毒药物具有重要意义。
除了上面所描述的目的、特征和优点之外,本发明还有其它的目的、特征和优点。下面将参照附图,对本发明作进一步详细的说明。
附图说明
构成本申请的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1是本发明的pcv2在pk-15细胞中的增殖情况示意图;
图2是本发明的gc1qr和phb2荧光定量pcr引物溶解曲线图;
图3是本发明的gc1qr和phb2荧光定量pcr扩增曲线图;
图4是本发明的pcv2感染pk-15细胞后gc1qr基因mrna水平的变化结果示意图;
图5是本发明的pcv2感染pk-15细胞后phb2基因mrna水平的变化结果示意图;
图6是本发明的sirna转染pk-15细胞后phb2基因mrna水平的变化结果示意图;
图7是本发明的sirna转染pk-15细胞后pcv2cap蛋白westernblot鉴定图;
图8是本发明的sirna转染pk-15细胞后pcv2cap蛋白的变化结果示意图;
图9是本发明的sirna转染pk-15细胞后ifa检测结果图;
图10是本发明的shrna设计示意图;
图11是本发明的shrna转染pk-15细胞后phb2基因mrna水平的变化结果示意图;以及
图12是本发明的shrna转染pk-15细胞后pcv2cap蛋白的变化结果示意图。
具体实施方式
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本发明。
本实施例中,一种phb2基因或蛋白的抑制剂在制备抗猪圆环病毒2型药物中的应用。本发明的phb2基因或蛋白的抑制剂在制备抗猪圆环病毒2型药物中的应用,通过间接免疫荧光试验检测pcv2在pk-15细胞中的增殖变化,检测pcv2感染pk-15细胞后phb2mrna的动态变化,和鉴定在phb2基因或蛋白的抑制剂转染pk-15细胞中pcv2cap蛋白表达。结果表明,phb2在正常及pcv2感染的pk-15细胞中均有效表达。pcv2可显著影响pk-15细胞中phb2转录,而且phb2对pcv2病毒复制具有调节作用,下调phb2的表达,即phb2基因敲除或蛋白表达下调,能明显抑制pcv2的复制,对阐明pcv2致病机理和研究新的抗病毒药物具有重要意义。
基于genbank库中猪phb2基因序列(geneid:100627467),设计并合成引物,引物f1(forwardprimer)如seqidno:5所示,具体的:ctgccctccattgtcaacga,引物r1(reverseprimer)如seqidno:6所示,具体的:cagctcccttcggatcaaca;并以tbp作为内参基因,依据tbp基因序列(geneid:110259740),设计并合成引物,引物f2(forwardprimer)如seqidno:7所示,具体的:gatggacgttcggtttagg,引物r2(reverseprimer)如seqidno:8所示,具体的:agcagcacagtacgagcaa;提取具有pcv2感染的pk-15细胞的cdna,以cdna为模板,进行pcr扩增,检测phb2在pcv2感染的pk-15细胞中mrna动态变化。在pcv2感染的作用下,pk-15细胞中phb2mrna转录水平升高,在感染后6h内,phb2mrna转录水平逐渐上升,且呈现时间相关性,在感染后6h时显著升高,是对照组的4.08倍(p<0.01),且达到了最高水平。说明pcv2感染对细胞宿主因子phb2mrna转录的影响。经过前期的试验研究发现将pcv2病毒样颗粒(virus-likeparticles,vlps)侵染猪肺泡巨噬细胞(3d4/2细胞系),利用免疫共沉淀联合质谱方法发现,phb2是pcv2vlps候选细胞互作蛋白之一,提示该蛋白可能参与了pcv2细胞入侵和复制,因此进一步探究phb2在pcv2感染细胞过程中发挥的作用。
本实施例中,抑制剂选择为能够抑制phb2蛋白表达或基因转录的小干扰rna(sirna)、双链rna(dsrna)、短发夹rna(shrna)或反义寡核苷酸;或能表达或形成sirna、dsrna、shrna或反义寡核苷酸的构建物。
本实施例中,sirna包括phb2sirna-1或phb2sirna-2。phb2sirna-1的靶序列如seqidno:1所示,或者,phb2sirna-2的靶序列如seqidno:2所示。将phb2sirna-1、phb2sirna-2的干扰片段转染pk-15细胞,并检测phb2基因变化,phb2sirna-1和phb2sirna-2都可以抑制phb2在pk-15细胞中mrna的转录水平。优选地,sirna选择phb2sirna-2,其敲除效率最高(71%)。将pcv2接种转染phb2sirna-1或phb2sirna-2后的pk-15细胞,并进行培养。检测结果显示,pcv2cap蛋白水平均显著降低。说明phb2基因敲除或蛋白表达下调,能明显抑制pcv2复制,指示phb2sirna-1和phb2sirna-2均能抑制pcv2复制。phb2sirna-1的靶序列具体为5′-ccaucacugagcugagcuu-3′。phb2sirna-2的靶序列具体为5′-ccaguacccuaucaucuau-3′。
本实施例中,shrna的编码序列正义链如seqidno:3所示,反义链如seqidno:4所示。通过已选的靶点序列设计shrna干扰序列,获得上述shrna的编码序列正义链和反义链,并合成双链dnaoligo(简称dsoligo),将dsoligo与线性化载体连接,转化大肠杆菌dh5α中获得菌液,提取质粒获得shrna表达质粒。线性化载体采用pentrtm/u6。shrna的编码序列正义链具体为5'-caccg*ccagtaccctatcatctatcgaaatagatgatagggtactgg-3',shrna的编码序列反义链具体为5'-aaaaccagtaccctatcatctatttcgatagatgatagggtactggc*-3'。
根据本发明的另一方面,还提供了一种抑制猪圆环病毒2型的sirna的靶序列,sirna包括phb2sirna-1或phb2sirna-2;phb2sirna-1的靶序列如seqidno:1所示,或者,phb2sirna-2的靶序列如seqidno:2所示。
根据本发明的另一方面,还提供了一种抑制猪圆环病毒2型的shrna分子,shrna分子的编码序列正义链如seqidno:3所示,反义链如seqidno:4所示。
根据本发明的另一方面,还提供了一种含有上述抑制猪圆环病毒2型的shrna分子的shrna表达质粒。
根据本发明的另一方面,还提供了一种药物组合物,包括上述sirna的靶序列、shrna分子、shrna表达质粒中的一种,还包含药学可接受的载体和/或赋形剂。在制备这些药物组合物时,通常将活性成分与赋形剂混合,或用赋形剂稀释,或包在可以以胶囊或药囊形式存在的载体中。用于预防或治疗由pcv2感染导致的疾病。
根据本发明的另一方面,还提供了一种用于抑制猪圆环病毒2型复制的试剂盒,包括sirna的靶序列、shrna分子、shrna表达质粒中的一种。
实施例
病毒pcv2d毒株,genbank登录号:kj867555,其tcid50为1×105.66/ml,本实验室保存。
猪肾上皮细胞(pk-15),本实验室保存。
兔源性抗pcv2cap多克隆抗体,本实验室保存;异硫氰酸荧光素(fitc)偶联的驴抗兔igg抗体,购自lifetechnologies公司;过氧化物酶(hrp)标记的羊抗兔igg抗体,购自kpl公司。
trizolreagent和lipofectaminetm2000转染试剂,购自invitrogen公司。
m-mlv反转录酶及相关试剂盒,购自promega公司。
easytaqdna聚合酶,购自北京全式金生物公司。
dmem细胞培养基及小牛血清,购自gibco公司。
其他相关试剂均为国产分析纯。
实验数据以平均数±标准差(mean±sd)表示,利用spssstatistics22.0软件中的单因素方差分析(one-wayanova)法,对结果进行分析。0.01<p<0.05为差异显著,用*标示;p<0.01为差异极显著,用**标示。
实施例1
1.1pcv2d感染pk-15细胞
将无pcv1/pcv2污染的pk-15细胞接种于6孔细胞培养板中,用含10%nbcs(新生牛血清)的dmem培养基培养细胞,至细胞融合率为60%。用tcid50=1×105.66/ml的pcv2d感染pk-15细胞后,分别于3、6、12、24和48h收集各孔细胞,作为实验组;不做任何处理的细胞标记为0h,作为对照组,每个时间点设置3个复孔。
1.2间接免疫荧光法检测pcv2在pk-15细胞中的增殖
利用上述方法将pcv2d感染pk-15细胞后,分别于0.5、1、12、24和36h用4%多聚甲醛固定细胞20min,再用含0.1%tritonx-100的pbs透化处理细胞10min,pbs洗3次后在含3%bsa(小牛血清白蛋白)的pbs中封闭1h。以兔源性抗pcv2cap的多克隆抗体作为一抗室温孵育1h,fitc标记的驴抗兔igg的抗体作为二抗室温避光孵育1h,于荧光倒置显微镜下观察,以上每两步骤间用pbs洗3次,每次5min。
1.3细胞rna提取及其反转录
利用细胞rna提取试剂盒(trizol法)对上述收集的细胞进行总rna提取。取2ulrna样品,利用nanodrop分光光度计测定rna浓度及纯度(d260nm/280nm比值)。取1ug细胞总rna,利用m-mlvfirststrandcdnasynthesiskit试剂盒反转录合成cdna。
1.4pcv2感染pk-15细胞中phb2mrna水平的检测
基于genbank库中猪phb2基因序列(geneid:100627467),设计并合成引物,引物f1(forwardprimer)如seqidno:5所示,引物r1(reverseprimer)如seqidno:6所示;并以tbp作为内参基因,依据tbp基因序列(geneid:110259740),设计并合成引物,引物f2(forwardprimer)如seqidno:7所示,引物r2(reverseprimer)如seqidno:8所示;以cdna为模板,利用aceqqpcr
对比例1
对比例1的步骤与实施例1的步骤相同,区别在于:基于genbank库中猪gc1qr基因序列(geneid:110256103),设计并合成引物,引物f3(forwardprimer)如seqidno:9所示,具体的actcccaacttcgtggttgaag,引物r3(reverseprimer)如seqidno:10所示;具体的cctcgtcctcttgtccaatctc。
检测结果如下所示:
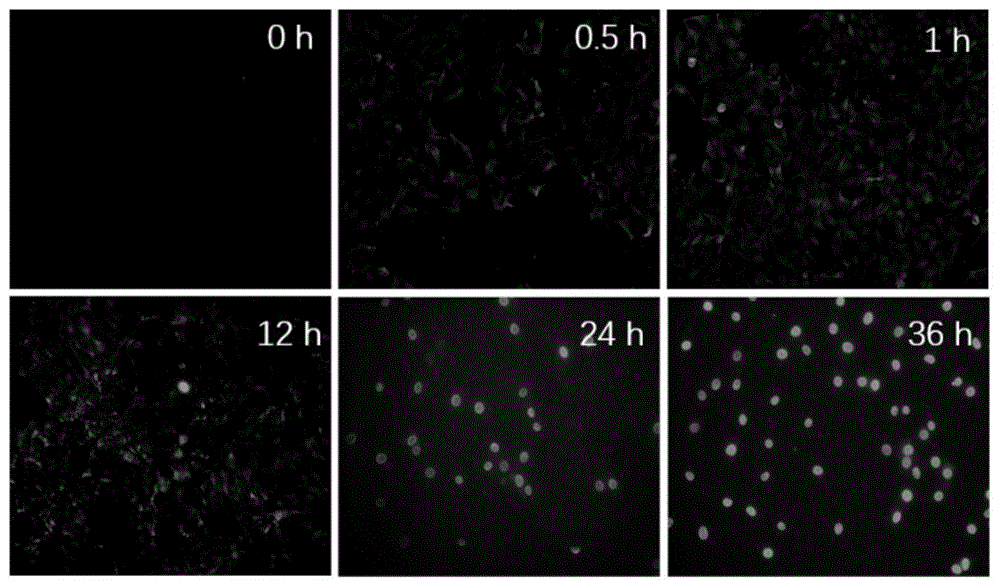
图1是本发明的pcv2在pk-15细胞中的增殖情况示意图。
图2是本发明的gc1qr和phb2荧光定量pcr引物溶解曲线图。
图3是本发明的gc1qr和phb2荧光定量pcr扩增曲线图。
图4是本发明的pcv2感染pk-15细胞后gc1qr基因mrna水平的变化结果示意图。
图5是本发明的pcv2感染pk-15细胞后phb2基因mrna水平的变化结果示意图。
如图1所示,pcv2感染pk-15细胞后,随着时间的推移(0h~36h),pk-15细胞中特异性的荧光信号(pcv2)数量不断增多,荧光强度不断增强,且大部分荧光信号由点状分布于细胞膜周边(0.5h~1h),逐渐聚集在细胞质和细胞核(12h~24h),最后到感染后36h时,pcv2阳性信号均聚集在细胞核。结果表明pcv2在1h内完成入侵,随后在pk-15细胞中不断增殖。
如图2和图3所示,通过荧光定量pcr对不同样品进行分析,gc1qr引物和phb2引物的溶解曲线均峰值集中无杂带,显示出单一峰,同时扩增曲线清晰,平台期稳定,表明检测方法具有较好的准确性和敏感性。
如图4和图5所示,在pcv2感染的作用下,pk-15细胞中phb2mrna转录水平(除了24h外)均升高,在感染后6h内,phb2mrna转录水平逐渐上升,且呈现时间相关性,在感染后6h时显著升高,是对照组的4.08倍(p<0.01),且达到了最高水平。而后随着时间的推移,phb2mrna表达呈下降趋势。而gc1qrmrna转录水平在病毒感染6h时升高,是对照组的1.25倍,而随着时间(12h、24h和48h)转录水平下降,尽管在48h又再次升高,但仍低于对照组。因此,通过实施例1与对比例1的检测可知,并非所有蛋白在pcv2感染的作用下,pk-15细胞中的mrna转录都会提高,本发明则是pcv2特异性的促进phb2在pk-15细胞中phb2mrna转录水平。
实施例2
pk-15细胞长成单层后转染靶向phb2基因的rna干扰片段。干扰片段是phb2sirna-1,phb2sirna-1的靶序列如seqidno:1所示,转染pk-15细胞。qpcr用于检测phb2基因的rna干扰效率。转染24h后弃培养基,pbs洗涤3次后,用pcv2侵染细胞1h后弃培养基,pbs洗涤3次后,换新鲜培养基继续培养48h。裂解细胞计算蛋白浓度后,以β-actin作为内参,分别以抗β-actin(鼠源)和兔源性抗pcv2cap的多克隆抗体作为一抗,以对应的hrp标记的抗鼠和抗兔抗体作为二抗,进行westernblot试验,检测pcv2cap蛋白的变化。
实施例3
pk-15细胞长成单层后转染靶向phb2基因的rna干扰片段。干扰片段是phb2sirna-2,phb2sirna-2的靶序列如seqidno:2所示,转染pk-15细胞。qpcr用于检测phb2基因的rna干扰效率。转染24h后弃培养基,pbs洗涤3次后,用pcv2侵染细胞1h后弃培养基,pbs洗涤3次后,换新鲜培养基继续培养48h。裂解细胞计算蛋白浓度后,以β-actin作为内参,分别以抗β-actin(鼠源)和兔源性抗pcv2cap的多克隆抗体作为一抗,以对应的hrp标记的抗鼠和抗兔抗体作为二抗,进行westernblot试验,检测pcv2cap蛋白的变化。并采用ifa测试方法检测pcv2在pk-15细胞中的增殖,其操作方法与实施例1的1.2步骤相似。
对比例2
无关干扰片段sirna-nc作为对照,sirna-nc的靶序列如seqidno:11所示,具体的:5′-uucuccgaacgugucacgu-3′。其他步骤与实施例2相同。
检测结果如下所示:
图6是本发明的sirna转染pk-15细胞后phb2基因mrna水平的变化结果示意图。
图7是本发明的westernblot鉴定图;泳道1:无关干扰片段sirna-nc;泳道2:干扰片段phb2sirna-1;泳道3:干扰片段phb2sirna-2;cap代表pcv2cap蛋白,β-actin为内参蛋白。
图8是本发明的sirna转染pk-15细胞后pcv2cap蛋白的变化结果示意图。
图9是本发明的sirna转染pk-15细胞后pcv2的ifa检测结果图;1:sirna-nc;2:phb2sirna-2。
如图6所示,为了验证phb2与pcv2复制间的关系,phb2sirna-1、phb2sirna-2及无关干扰片段sirna-nc为对照转染pk-15细胞,qpcr检测phb2基因变化,结果显示phb2sirna-1和phb2sirna-2都可以抑制phb2在pk-15细胞中mrna的转录水平。其中,phb2sirna-2的敲除效率最高(71%),可以明显抑制phb2在pk-15细胞中mrna的转录水平(0.01<p<0.05)。
如图7、图8和图9所示,sirna转染24h后,接种pcv2培养48h,westernbot鉴定结果显示,phb2sirna-2干扰组中pcv2cap蛋白水平显著低于对照组,约低于sirna-nc的25%(0.01<p<0.05)。并且ifa结果表明,与对比例2的sirna-nc相比,phb2sirna-2的使用能导致荧光信号(代表pcv2)减少,说明phb2基因的沉默能抑制pcv2复制。
实施例4
4.1shrna预处理
如图10所示,通过phb2sirna-2靶点序列设计shrna序列,shrna的编码序列正义链(简称topstrandoligo)如seqidno:3所示,反义链(简称bottomstrandoligo)如seqidno:4所示。shrna由公司合成。其中,caccg*与aaaa代表loop序列。
反应体系(20μl)如下:5μltopstrandoligo(200μm),5μlbottomstrandoligo(200μm),2μl10×oligoannealingbuffer(100mmtris-hcl,10mmedta,1mnaclph8.0),8μldnase/rnase-freewater。分别将20μl体系的pcr管于95℃4min,室温10min,获得dsoligo产物,用dnase/rnase-freewater稀释产物(1μl)100倍,再分别取10μl10×oligoannealingbuffer和89μldnase/rnase-freewater与1μl稀释后的产物混匀,获得稀释后的产物浓度(5nm)。
4.2shrna表达质粒的构建
反应体系(20μl):4μl5×ligationbuffer,2μlpentrtm/u6,2μldsoligo(5nm),2μldnase/rnase-freewater,1μlt4dnaligase。反应体系室温放置6min。然后反应产物(2μl)加入大肠杆菌(dh5α)中,经过热激(42℃)1min、冰上放置6min后,加入300μlsoc培养基,然后37℃培养1h。取50μl转化菌液涂布在lb培养板中于37℃培养12h,再将单克隆菌落至lb培养基中培养12h。按质粒提取试剂盒的说明书提取质粒。
4.3shrna表达质粒抑制pcv2
将shrna表达质粒转染pk-15细胞,qpcr用于检测phb2基因的rna干扰效率。转染24h后弃培养基,pbs洗涤3次后,用pcv2侵染细胞1h后弃培养基,pbs洗涤3次后,换新鲜培养基继续培养至48h。westernblot检测pcv2cap蛋白表达量的变化。
检测结果如下所示:
图10是本发明的shrna设计示意图;
图11是本发明的shrna转染pk-15细胞后phb2基因mrna水平的变化结果示意图,shrna-nc代表对照组,即为空载体;
图12是本发明的shrna转染pk-15细胞后pcv2cap蛋白表达量变化的结果示意图,shrna-nc代表对照组,即为空载体。
如图11所示,shrna和空载体转染pk-15细胞,qpcr检测phb2基因变化,结果显示shrna可以明显抑制phb2在pk-15细胞中mrna的转录水平(0.01<p<0.05)。
如图12所示,shrna和空载体转染24h后,接种pcv2培养48h,westernbot鉴定结果显示,shrna干扰组中pcv2cap蛋白水平显著低于对照组(0.01<p<0.05)。与相应的phb2sirna抑制pcv2复制的结果相似(如图9),说明shrna-2同样能抑制pcv2复制。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>湖南农业大学
<120>phb2基因或蛋白的抑制剂在制备抗猪圆环病毒2型药物中的应用
<160>11
<170>siposequencelisting1.0
<210>1
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>1
ccaucacugagcugagcuu19
<210>2
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>2
ccaguacccuaucaucuau19
<210>3
<211>47
<212>dna
<213>人工序列(artificialsequence)
<400>3
caccgccagtaccctatcatctatcgaaatagatgatagggtactgg47
<210>4
<211>47
<212>dna
<213>人工序列(artificialsequence)
<400>4
aaaaccagtaccctatcatctatttcgatagatgatagggtactggc47
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
ctgccctccattgtcaacga20
<210>6
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>6
cagctcccttcggatcaaca20
<210>7
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>7
gatggacgttcggtttagg19
<210>8
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>8
agcagcacagtacgagcaa19
<210>9
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>9
actcccaacttcgtggttgaag22
<210>10
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>10
cctcgtcctcttgtccaatctc22
<210>11
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>11
uucuccgaacgugucacgu19
- 还没有人留言评论。精彩留言会获得点赞!
- 一种快速检测BCR/ABL基因融合的探针组、试剂盒及方法与流程
- 酪氨酸激酶抑制剂的制造方法与工艺
- 芳香族酰胺类衍生物、其制备方法及其在医药上的应用与制造工艺
- 包含5α‑还原酶抑制剂的药物组合物的制造方法与工艺
- 作为脾酪氨酸激酶抑制剂的二氮杂螺烷酮取代的噁唑衍生物的制造方法与工艺
- 包含热弹性感觉剂和TRPA1受体抑制剂的皮肤接合剃刮助剂的制造方法与工艺
- 检测EGFR耐药性突变的方法和组合物与制造工艺
- 5‑溴‑7‑氮杂吲哚啉‑2‑酮类化合物及其制备方法与制造工艺
- 3‑[(3‑{[4‑(4‑吗啉基甲基)‑1H‑吡咯‑2‑基]亚甲基}‑2‑氧代‑2,3‑二氢‑1H‑吲哚‑5‑基)甲基]‑1,3‑噻唑烷‑2,4‑二酮和EGFR TYR激酶抑制剂的组合的制造方法与工艺
- 一种抗癌药物的晶体化合物及其制备方法与制造工艺