长效白细胞介素22的制备方法及其用途与流程
本发明涉及生物制药领域,具体涉及一种长效白细胞介素22融合蛋白,及其制备方法,以及在制备治疗糖尿病肾病药物中的应用。
背景技术:
白细胞介素-22(Interleukin-22,IL-22)是IL-10家族的成员,是由固有淋巴细胞(如自然杀伤细胞)和活化的CD4+辅助型T细胞(如Th17和Th22细胞)产生的细胞因子,它通过白介素-22受体复合物(由IL-22R1和IL-10R2组成)作用于靶细胞,激活JAK/STAT信号通路从而发挥生物学效应(Dumoutier L,Louahed J,Renauld JC.Cloning and characterization of IL-10-related T cell-derived inducible factor(IL-TIF),a novel cytokine structurally related to IL-10and inducible by IL-9.J Immunol.2000;164:1814-9.Wolk K,Sabat R.Interleukin-22:A novel T-and NK-cell derived cytokine that regulates the biology of tissue cells.Cytokine Growth F R.2006;17:367-80.)。由于IL-10R2广泛地表达于不同细胞表面,而特异性部分IL-22R1表达局限于皮肤和肠道的上皮细胞以及胰腺、肾脏和肝脏等参与机体代谢器官的非免疫细胞,白介素-22只作用于特定细胞(Wolk K,Sabat R.Interleukin-22:A novel T-and NK-cell derived cytokine that regulates the biology of tissue cells.Cytokine Growth F R.2006;17:367-80.)。最新研究表明,白介素-22不仅能有效地降低血糖水平、改善胰岛素抵抗、提高胰岛素敏感性以缓解糖毒性,而且能发挥脂类代谢调节作用以缓解代谢紊乱(Wang X,Ota N,Manzanillo P,Kates L,Zavala-Solorio J,Eidenschenk C,et al.Interleukin-22alleviates metabolic disorders and restores mucosal immunity in diabetes.Nature.2014;514:237-41.Hasnain SZ,Borg DJ,Harcourt BE,Tong H,Sheng YHH,Ng CP,et al.Glycemic control in diabetes is restored by therapeutic manipulation of cytokines that regulate beta cell stress.Nat Med.2014;20:1417-26.Dalmas E,Donath MY.A role for interleukin-22in the alleviation of metabolic syndrome.Nat Med.2014;20:1379-81.)。更重要的是,白介素-22能缓解肾脏缺血再灌注损伤、减轻肾脏炎症、缓解肾小管受损并恢复肾脏功能(Xu MJ,Feng DC,Wang H,Guan YF,Yan XQ,Gao B.IL-22 Ameliorates Renal Ischemia-Reperfusion Injury by Targeting Proximal Tubule Epithelium.Journal of the American Society of Nephrology.2014;25:967-77.)。同时,白介素-22能加速肾小管再生和修复从而发挥肾脏保护作用(Kulkarni OP,Hartter I,Mulay SR,Hagemann J,Darisipudi MN,Kumar VRS,et al.Toll-Like Receptor 4-Induced IL-22Accelerates Kidney Regeneration.Journal of the American Society of Nephrology.2014;25:978-89.)。因而白细胞介素22有望成为糖尿病肾病治疗的一线药物。
但是白细胞介素22本身的分子量小,易被肾小球的滤过作用清除,因而在血浆中的终末半衰期相对较短,为了维持体内有效的血药浓度,通常需要多次给药。延长白细胞介素22的血浆半衰期可允许更低频率地给药,减轻注射部位的反应,减轻病人的痛苦,具有广泛的临床益处。因此,提供长效化的白细胞介素22具有重要的社会意义和商业价值。
蛋白质的重组多肽修饰,目前取得了一些研究进展。其中,重组多肽(XTEN)的氨基酸序列由天然存在的亲水性氨基酸组成,因而可生物降解且没有免疫原性,采用分子遗传操作将重组多肽与治疗性目的蛋白进行融合表达,可显著延长治疗性蛋白的半衰期(Schellenberger V,Wang CW,Geething NC,Spink BJ,Campbell A,To W,Scholle MD,Yin Y,Yao Y,Bogin O et al:A recombinant polypeptide extends the in vivo half-life of peptides and proteins in a tunable manner.Nat Biotechnol 2009,27(12):1186-1190)。目前已有研究证实重组多肽与人生长激素形成的融合蛋白、与胰高血糖素形成的蛋白均能有效延长目的蛋白的半衰期;与胰高血糖素样肽2相比,重组多肽与其融合形成的重组蛋白在小鼠、大鼠及猴子体内的半衰期分别为34h、38h和120h(Cleland JL,Geething NC,Moore JA,Rogers BC,Spink BJ,Wang CW,Alters SE,Stemmer WP,Schellenberger V:A novel long-acting human growth hormone fusion protein(VRS-317):enhanced in vivo potency and half-life.J Pharm Sci 2012,101(8):2744-2754;Alters SE,McLaughlin B,Spink B,Lachinyan T,Wang CW,Podust V,Schellenberger V,Stemmer WP:GLP2-2G-XTEN:a pharmaceutical protein with improved serum half-life and efficacy in a rat Crohn's disease model.PLoS One 2012,7(11):e50630)。此外,重组多肽与治疗性蛋白融合基因可通过大肠杆菌工程菌实现原核表达,与人血清白蛋白和人免疫球蛋白IgG Fc片段真核表达相比,更具有产业化优势;由于其生物相容性及生物可降解性优异,重组多肽有望成为延长药物蛋白半衰期最理想的修饰工具(Geething NC,To W,Spink BJ,Scholle MD,Wang CW,Yin Y,Yao Y,Schellenberger V,Cleland JL, Stemmer WP et al:Gcg-XTEN:an improved glucagon capable of preventing hypoglycemia without increasing baseline blood glucose.PLoS One 2010,5(4):e10175)。
技术实现要素:
本发明的目的在于提供一种长效白细胞介素22重组融合蛋白,本发明的另一目的在于提供该长效白细胞介素22重组融合蛋白的制备方法,本发明的第三目的在于提供该长效白细胞介素22重组融合蛋白在制备治疗糖尿病肾病药物中的应用。
本发明所要解决的关键技术问题,如何减少白细胞介素22的免疫原性,如何延长白细胞介素22在体内的半衰期,在延长白细胞介素22的体内半衰期的同时又能保持其生物活性。
本发明的第一方面,提供了一种长效白细胞介素22重组融合蛋白。
本发明所述的一种长效白细胞介素22重组融合蛋白,是由白细胞介素22与亲水性非重复序列多肽融合而成的重组蛋白。
所述的亲水性非重复序列多肽的氨基酸序列如SEQ ID NO:1所示。
GTSTPESGSASPGTSPSGESSTAPGTSPSGESSTAPGSTSSTAESPGPGSTSESPSGTAPGSTSSTAESPGPGTSPSGESSTAPGTSTPESGSASPGSTSSTAESPGPGTSPSGESSTAPGTSPSGESSTAPGTSPSGESSTAP(SEQ ID NO:1)
所述的白细胞介素22的氨基酸序列如SEQ ID NO:2所示。
MAPISSHCRLDKSNFQQPYITNRTFMLAKEASLADNNTDVRLIGEKLFHGVSMSERCYLMKQVLNFTLEEVLFPQSDRFQPYMQEVVPFLARLSNRLSTCHIEGDDLHIQRNVQKLKDTVKKLGESGEIKAIGELDLLFMSLRNACI(SEQ ID NO:2)
本发明提供了一种长效白细胞介素22重组融合蛋白,优选的是N端为白细胞介素22,C端为亲水性非重复序列多肽,其氨基酸序列如SEQ ID NO:3所示。
MAPISSHCRLDKSNFQQPYITNRTFMLAKEASLADNNTDVRLIGEKLFHGVSMSERCYLMKQVLNFTLEEVLFPQSDRFQPYMQEVVPFLARLSNRLSTCHIEGDDLHIQRNVQKLKDTVKKLGESGEIKAIGELDLLFMSLRNACIGTSTPESGSASPGTSPSGESSTAPGTSPSGESSTAPGSTSSTAESPGPGSTSESPSGTAPGSTSSTAESPGPGTSPSGESSTAPGTSTPESGSASPGSTSSTAESPGPGTSPSGESSTAPGTSPSGESSTAPGTSPSGESSTAP(SEQ ID NO:3)
进一步,本发明还提供了上述长效白细胞介素22重组融合蛋白亲水性非重复序列多肽的编码基因,其核苷酸序列如SEQ ID NO:4所示。
GGTACTTCTACTCCGGAAAGCGGTTCCGCATCTCCAGGCACTTCTCCTAGCGGTGAATCTTCTACTGCTCCAGGTACCTCTCCTAGCGGCGAATCTTCTACTGCTCCAGGTTCTACCAGCTCTACCGCTGAATCTCCTGGCCCAGGTTCTACCAGCGAATCCCCGTCTGGCACCGCACCAGGTTCTACTAGCTCTACCGCAGAATCTCCGGGTCCAGGTACTTCCCCTAGCGGTGAATCTTCTACTGCTCCAGGTACCTCTACTCCGGAAAGCGGCTCCGCATCTCCAGGTTCTACCAGCTCTACTGCTGAATCTCCTGGTCCAGGTACCTCCCCTAGCGGCGAATCTTCTACTGCTCCAGGTACCTCTCCTAGCGGCGAATCTTCTACCGCTCCAGGTACCTCCCCTAGCGGTGAATCTTCTACCGCACCA(SEQ ID NO:4)
更进一步的,适用于大肠杆菌原核表达的编码本发明长效白细胞介素22重组融合蛋白的亲水性非重复序列多肽的核苷酸序列如SEQ ID NO:5所示。
GGTACCTCTACGCCGGAATCTGGCAGTGCATCCCCGGGCACCTCACCGAGCGGTGAAAGCAGCACCGCTCCGGGTACGAGCCCGTCTGGTGAATCTAGTACCGCCCCGGGTTCCACCAGCAGCACCGCAGAATCACCGGGTCCGGGTAGTACCAGCGAATCACCGAGCGGTACCGCACCGGGTTCTACCAGCAGCACCGCTGAAAGTCCGGGTCCGGGTACCAGCCCGAGCGGCGAATCTAGCACCGCACCGGGTACCAGCACGCCGGAAAGTGGTAGCGCCTCACCGGGCAGCACCAGCAGCACCGCCGAAAGCCCGGGTCCGGGTACCTCGCCGTCTGGCGAAAGCAGCACCGCACCGGGCACGTCTCCGAGTGGCGAATCGTCCACCGCTCCGGGCACCAGTCCGTCGGGCGAATCCTCCACCGCTCCGTAA(SEQ ID NO:5)
编码本发明长效白细胞介素22重组融合蛋白的核苷酸序列如SEQ ID NO:6所示。
ATGGCGCCCATCAGCTCCCACTGCAGGCTTGACAAGTCCAACTTCCAGCAGCCCTATATCACCAACCGCACCTTCATGCTGGCTAAGGAGGCTAGCTTGGCTGATAACAACACAGACGTTCGTCTCATTGGGGAGAAACTGTTCCACGGAGTCAGTATGAGTGAGCGCTGCTATCTGATGAAGCAGGTGCTGAACTTCACCCTTGAAGAAGTGCTGTTCCCTCAATCTGATAGGTTCCAGCCTTATATGCAGGAGGTGGTGCCCTTCCTGGCCAGGCTCAGCAACAGGCTAAGCACATGTCATATTGAAGGTGATGACCTGCATATCCAGAGGAATGTGCAAAAGCTGAAGGACACAGTGAAAAAGCTTGGAGAGAGTGGAGAG ATCAAAGCAATTGGAGAACTGGATTTGCTGTTTATGTCTCTGAGAAATGCCTGCATTGCGAATTCAGGTACTTCTACTCCGGAAAGCGGTTCCGCATCTCCAGGCACTTCTCCTAGCGGTGAATCTTCTACTGCTCCAGGTACCTCTCCTAGCGGCGAATCTTCTACTGCTCCAGGTTCTACCAGCTCTACCGCTGAATCTCCTGGCCCAGGTTCTACCAGCGAATCCCCGTCTGGCACCGCACCAGGTTCTACTAGCTCTACCGCAGAATCTCCGGGTCCAGGTACTTCCCCTAGCGGTGAATCTTCTACTGCTCCAGGTACCTCTACTCCGGAAAGCGGCTCCGCATCTCCAGGTTCTACCAGCTCTACTGCTGAATCTCCTGGTCCAGGTACCTCCCCTAGCGGCGAATCTTCTACTGCTCCAGGTACCTCTCCTAGCGGCGAATCTTCTACCGCTCCAGGTACCTCCCCTAGCGGTGAATCTTCTACCGCACCATGA(SEQ ID NO:6)
其中,编码白细胞介素22的核苷酸序列如SEQ ID NO:7所示。
ATGGCGCCCATCAGCTCCCACTGCAGGCTTGACAAGTCCAACTTCCAGCAGCCCTATATCACCAACCGCACCTTCATGCTGGCTAAGGAGGCTAGCTTGGCTGATAACAACACAGACGTTCGTCTCATTGGGGAGAAACTGTTCCACGGAGTCAGTATGAGTGAGCGCTGCTATCTGATGAAGCAGGTGCTGAACTTCACCCTTGAAGAAGTGCTGTTCCCTCAATCTGATAGGTTCCAGCCTTATATGCAGGAGGTGGTGCCCTTCCTGGCCAGGCTCAGCAACAGGCTAAGCACATGTCATATTGAAGGTGATGACCTGCATATCCAGAGGAATGTGCAAAAGCTGAAGGACACAGTGAAAAAGCTTGGAGAGAGTGGAGAGATCAAAGCAATTGGAGAACTGGATTTGCTGTTTATGTCTCTGAGAAATGCCTGCATT(SEQ ID NO:7)
本发明所述的亲水性非重复序列多肽以如SEQ ID NO:1所述的氨基酸序列为单位进行重复组合,与白细胞介素22的N-端或C-端进行融合,其组合方式包括但不限于N-端白细胞介素22和C-端亲水性非重复序列多肽的组合。
所述多肽与白细胞介素22之间或多肽本身之间的融合包括但不限于直接融合和间接融合。
本发明还提供了白细胞介素22与亲水性非重复序列多肽之间或亲水性非重复序列多肽之间进行间接融合所需氨基酸序列如SEQ ID NO:8所示。
GSSGSSGSSGSSG(SEQ ID NO:8)
本发明还提供了含有上述长效白细胞介素22重组融合蛋白的编码基因的表达载体、宿主细胞、重组菌。
所述的表达载体,可采用原核表达载体,也可采用真核表达载体构建,较优的为原核表达质粒pET24b、pMD19、pET28a-。
所述的重组菌为大肠杆菌等,较优的为大肠杆菌BL21(DE3)、大肠杆菌Top10。
本发明的第二方面,提供了上述的长效白细胞介素22重组融合蛋白的制备方法。
所述的制备方法包括以下步骤:
A、克隆如SEQ ID NO:6所示的核苷酸序列;
B、构建含有如SEQ ID NO:6所示的核苷酸序列的重组质粒;
C、在大肠杆菌中表达如SEQ ID NO:3所示的重组融合蛋白。
所述的制备方法中,较优的,步骤A中,设计并合成如下引物:
上游引物为:5’-agttCATATggcgcccatcagctcccact-3’(SEQ ID NO:9),
下游引物为:5’-atcgGAATTCgcaatgcaggcatttctcagag-3’(SEQ ID NO:10),
合成白细胞介素22的编码基因;
设计并合成如下引物:
上游引物为:5’-cgatgaattcaggtacttctactccgg-3’(SEQ ID NO:11),
下游引物为:5’-agtctcgagtcatggtgcggtagaagat-3’(SEQ ID NO:12),
合成亲水性非重复序列多肽的编码基因;
所述的制备方法中,较优的,步骤B中,构建所用的质粒为pET24b、pMD19、pET28a-。分别构建pET28a-白细胞介素22和pMD19-亲水性非重复序列多肽编码基因质粒,再pET28a-白细胞介素22-亲水性非重复序列多肽融合蛋白编码基因质粒。
所述的制备方法中,较优的,步骤C中,将pET28a-白细胞介素22-亲水性非重复序列多肽融合蛋白编码基因质粒转化感受态大肠杆菌BL21(DE3)condonplus,涂布于硫酸卡那霉素和氯霉素抗性LB平板,37℃培养过夜;挑取单菌落,扩大培养,收集菌体,振荡、分离、纯化。
本发明的第三目方面,提供了上述融合蛋白、编码基因、表达载体、重组菌在制备治疗糖尿病肾病药物中的应用。
所述的糖尿病肾病(diabetic nephropathy,DN)是糖尿病引起的严重和危害性最大的一种慢性并发症,是糖尿病全身性微血管病变表现之一,临床特征为蛋白尿,渐进性肾功能损害,高血压,水肿,晚期出现严重肾功能衰竭, 是糖尿病患者的主要死亡原因之一。微量白蛋白尿是诊断糖尿病肾病的标志,微量白蛋白尿指UAE持续升高20~200μg/min,或尿白蛋白30~300mg/24h或尿白蛋白:尿肌酐为30~300μg/mg。
本发明的重组融合蛋白可在大肠杆菌中高效表达,且制备工艺简单,可用于大规模的药物级融合蛋白的生产和制备。本发明的长效白细胞介素22融合蛋白相较于白细胞介素22在体内的半衰期延长,同时又保持了其生物活性,减少了白细胞介素22的免疫原性。
附图说明
图1:人白细胞介素22目的基因的克隆;
图2:亲水性非重复序列多肽编码基因的克隆;
图3:编码亲水性非重复序列多肽目的基因回收产物及pET28a-白细胞介素22回收产物;
图4:编码白细胞介素22亲水性非重复序列多肽目的基因的PCR产物;
图5:白细胞介素22亲水性非重复序列多肽的诱导表达;
图6:编码白细胞介素22亲水性非重复序列多肽的大肠杆菌扩大培养诱导表达;
图7:白细胞介素22亲水性非重复序列多肽的纯化;
图8:白细胞介素22亲水性非重复序列多肽体内药代动力学研究;
图9:白细胞介素22亲水性非重复序列多肽治疗糖尿病肾病药效学研究,其中A为肾脏肥大指数,B为肾小球细胞外基质蛋白胶原蛋白Collagen IV水平,C为肾小球细胞外基质蛋白纤维连接蛋白Fibronection水平,D为24h尿蛋白水平。
具体实施方式
现结合实施例和附图,对本发明作详细描述,但本发明的实施不仅限于此。
本发明所用试剂和原料均市售可得或可按文献方法制备。下列实施例中未注明具体条件的实验方法,通常按照常规条件如Sambrook等人《分子克隆:实验室指南》(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照常规条件,或按照制造厂商所建议的条件。除非另外说 明,否则百分比和份数按重量计算。
实施例1、白细胞介素22与亲水性非重复序列多肽重组融合蛋白编码基因的获得。
白细胞介素22编码基因的获得:人外周血单核细胞在含有5μg/ml的脂多糖的RPMI 1640培养基中培养18小时。采用Trizol进行RNA的提取,并采用逆转录试剂盒进行RNA的反转,最终获得cDNA。
以反转录获得的cDNA为模板,采用Primer设计引物,其中上游引物为:5’-agttCATATggcgcccatcagctcccact-3’(SEQ ID NO:9),其中下划线处为NdeI酶切位点;下游引物为:5’-atcgGAATTCgcaatgcaggcatttctcagag-3’(SEQ ID NO:10),其中下划线处为EcoRI酶切位点。引物由上海生工生物工程公司合成。
采用PCR方法克隆含有NdeI和EcoRI酶切位点的白细胞介素22基因,并用1%琼脂糖凝胶电泳检测。
实验结果如图1所示:PCR产物的大小在500bp左右,与白细胞介素22的目的基因大小相符。
人工化学合成亲水性非重复序列多肽编码基因序列,并将其克隆至pUC57质粒载体中。
首先以该质粒中的编码基因序列为模板,采用Primer设计引物,上游引物为:5’-cgatgaattcaggtacttctactccgg-3’(SEQ ID NO:11),其中加下划线处为EcoRI酶切位点;下游引物:5’-agtctcgagtcatggtgcggtagaagat-3’(SEQ ID NO:12),其中加下划线处为XhoI酶切位点。引物由上海生工生物工程公司合成。
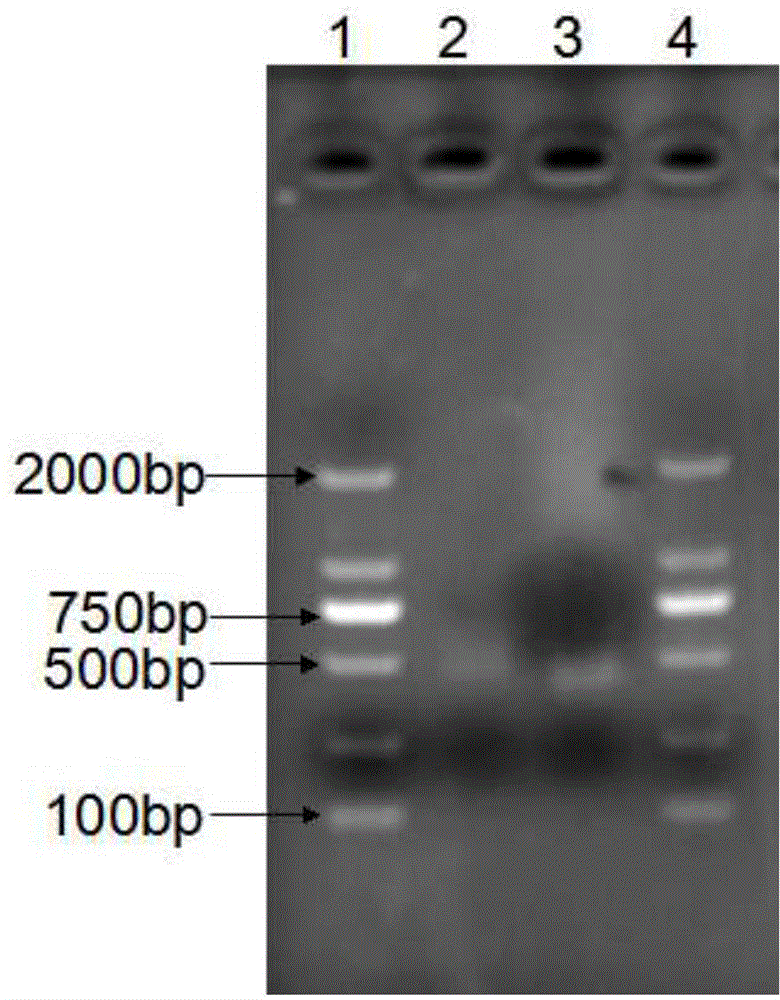
采用PCR方法克隆含有EcoRI和XhoI酶切位点的亲水性非重复序列多肽编码基因,并用1%琼脂糖凝胶电泳检测,实验结果如图2所示;PCR产物在500bp左右,与亲水性非重复序列多肽编码基因的预期大小(435bp)相符。
PCR反应II:在0.2ml的PCR管中加入以下成分并混合均匀:
2X Taq Mix 25μl;上游引物2μl;下游引物2μl;pUC57-融合蛋白编码基因质粒1μl;超纯水20μl。
PCR反应程序为:94℃,5min;94℃,1min;55℃,1min;72℃,1min;72℃,30min。一共进行30个循环反应。
将克隆到的PCR产物连接pMD19-T simple载体,挑取阳性克隆,送至上海英骏贸易有限公司进行测序,经比对与人工化学合成的核苷酸序列一致。
实施例2、白细胞介素22与亲水性非重复序列多肽重组融合蛋白编码基因表达载体的构建。
取pET24b表达载体及pMD19-T-白细胞介素22编码基因质粒,采用NdeI和EcoRI限制性核酸内切酶进行双酶切。双酶切的反应体系为20ul,其中质粒10ul,NdeI1ul,EcoRI1ul,2X buffer Tango 4ul,无菌水4ul。37℃酶切5h。酶切产物采用1%琼脂糖凝胶电泳分离。采用胶回收试剂盒回收目的片段,其中pET24b表达载体回收5000bp左右的片段,pMD19-白细胞介素22回收约500p的片段。
连接反应在T4 DNA连接酶催化下进行,pET24b表达载体酶切片段与白细胞介素22基因目的片段的摩尔数比约为1:3。连接反应体系为25ul,其中T4连接酶1ul,10X T4 DNA连接酶缓冲液2.5ul,16℃连接过夜。
连接产物转化感受态大肠杆菌Top10,涂布于卡那霉素抗性LB平板上,37℃培养过夜,挑取单克隆,扩大培养后抽提质粒。将扩大培养的菌液采用pET载体通用引物测序,测序反应由上海英潍捷基贸易有限公司完成。
取构建成功的pET24b-白细胞介素22和pMD19-亲水性非重复序列多肽编码基因质粒,采用EcoRI和XhoI限制性核酸内切酶进行双酶切。酶切的反应体系为20ul,其中质粒10ul,XhoI1ul,EcoRI1ul,2X buffer Tango 4ul,无菌水4ul。37℃酶切5h。酶切产物采用1%琼脂糖凝胶电泳分离。采用胶回收试剂盒回收目的片段,其中pET24b-白细胞介素22表达载体回收5800bp左右的片段,pMD19-亲水性非重复序列多肽编码基因回收约500p的片段。
连接反应在T4 DNA连接酶催化下进行,pET24b-白细胞介素22基因目的片段与亲水性非重复序列多肽编码基因片段的摩尔数比约为1:3。连接反应体系为25ul,其中T4连接酶1ul,10X T4 DNA连接酶缓冲液2.5ul,16℃连接过夜。
连接产物转化感受态大肠杆菌Top10,涂布于卡那霉素抗性LB平板上,37℃培养过夜,挑取单克隆,扩大培养后抽提质粒。将扩大培养的菌液采用pET载体通用引物测序,测序反应由上海英潍捷基贸易有限公司完成,序列如SEQ ID NO:6所示。
实施例3、含有组氨酸标签的白细胞介素22与亲水性非重复序列多肽重组融合蛋白编码基因表达载体的构建。
取pET28a表达载体及pMD19-T-白细胞介素22编码基因质粒,采用NdeI和EcoRI限制性核酸内切酶进行双酶切。双酶切的反应体系为20ul,其中质粒10ul,NdeI1ul,EcoRI1ul,2X buffer Tango 4ul,无菌水4ul。37℃酶切5h。酶切产物采用1%琼脂糖凝胶电泳分离。采用胶回收试剂盒回收目的片段,其中pET28a表达载体回收5000bp左右的片段,pMD19-白细胞介素22回收约500p的片段。
连接反应在T4 DNA连接酶催化下进行,pET28a表达载体酶切片段与白细胞介素22目的片段的摩尔数比约为1:3。连接反应体系为25ul,其中T4连接酶1ul,10X T4 DNA连接酶缓冲液2.5ul,16℃连接过夜。
连接产物转化感受态大肠杆菌Top10,涂布于卡那霉素抗性LB平板上,37℃培养过夜,挑取单克隆,扩大培养后抽提质粒。将扩大培养的菌液采用pET载体通用引物测序,测序反应由上海英潍捷基贸易有限公司完成。
取构建成功的pET28a-白细胞介素22和pMD19-亲水性非重复序列多肽编码基因质粒,采用EcoRI和XhoI限制性核酸内切酶进行双酶切。酶切的反应体系为20ul,其中质粒10ul,XhoI1ul,EcoRI1ul,2X buffer Tango 4ul,无菌水4ul。37℃酶切5h。酶切产物采用1%琼脂糖凝胶电泳分离,实验结果如图3所示。采用胶回收试剂盒回收目的片段,其中pET28a-白细胞介素22表达载体回收5800bp左右的片段,pMD19-亲水性非重复序列多肽编码基因回收约500p的片段。
连接反应在T4 DNA连接酶催化下进行,pET28a-白细胞介素22基因目的片段与亲水性非重复序列多肽编码基因片段的摩尔数比约为1:3。连接反应体系为25ul,其中T4连接酶1ul,10X T4 DNA连接酶缓冲液2.5ul,16℃连接过夜。
连接产物转化感受态大肠杆菌Top10,涂布于卡那霉素抗性LB平板上,37℃培养过夜,挑取单克隆,扩大培养后抽提质粒。将扩大培养的菌液采用pET载体通用引物测序,测序反应由上海英潍捷基贸易有限公司完成。
采用PCR方法克隆含有NdeI和XhoI酶切位点的白细胞介素22-亲水性非重复序列多肽基因,并用1%琼脂糖凝胶电泳检测。实验结果如图4所示: PCR产物的大小在900bp左右,与编码白细胞介素22-亲水性非重复序列多肽的目的基因大小(897bp)相符,如SEQ ID NO:6所示。
PCR反应II:在0.2ml的PCR管中加入以下成分并混合均匀:
2X Taq Mix 25μl;上游引物2μl;下游引物2μl;cDNA 1μl;超纯水20μl。
PCR反应程序为:94℃,5min;94℃,30s;55℃,30s;72℃,1min。一共进行30个循环反应。最后,72℃,30min。
实施例4、白细胞介素22与亲水性非重复序列多肽重组融合蛋白的表达。
将测序正确的pET28a-白细胞介素22-亲水性非重复序列多肽融合蛋白编码基因质粒转化感受态大肠杆菌BL21(DE3)condonplus,涂布于硫酸卡那霉素和氯霉素抗性LB平板,37℃培养过夜。随机挑取平板上4个单菌落,扩大培养,按1%的比例转接至3ml新鲜LB试管中,37℃震荡培养至OD600≈0.6时,分别取样加入终浓度为1mM的IPTG,继续震荡培养3小时,取1ml菌液离心收集菌体,进行聚丙烯酰胺凝胶电泳检测分析。实验结果如图5所示,与未经IPTG诱导对照组相比,IPTG诱导的实验组在36KDa附近有目的蛋白表达,大小与预期相符。
取编码白细胞介素22-亲水性非重复序列多肽融合蛋白的大肠杆菌表达株进行扩大培养,并诱导表达。实验结果如图6所示,与未经IPTG诱导剂诱导的对照组相比,诱导剂诱导的实验组有大量目的蛋白表达,大小与预期相符。如SEQ ID NO:3所示。
实施例5、白细胞介素22与亲水性非重复序列多肽重组融合蛋白的纯化。
取诱导后的大肠杆菌,8000rpm离心15min收集菌体。将菌体用生理盐水进行洗涤后,按每g菌体加入5ml生理盐水,将菌体重悬,进行超声破碎,其中破碎时间2s,间隔2s,共进行8次循环,每次破碎4min。将破碎的菌液8000rpm离心15min,收集上清和沉淀,进行SDS-PAGE电泳分析。取破碎后的上清上样至生理盐水平衡的镍柱,并采用含不同浓度咪唑的生理盐水进行梯度洗脱,收集洗脱液,进行SDS-PAGE电泳检测。
实验结果如图7所示。将纯化到的目的蛋白溶液置于生理盐水中透析,除去其中的咪唑,获得亲水性非重复序列多肽与白细胞介素-1受体拮抗剂融合蛋白,融合蛋白氨基酸序列如SEQ ID NO:3所示。
实施例6、白细胞介素22与亲水性非重复序列多肽重组融合蛋白的活性测定。
人肝癌细胞HepG2(购自中科院细胞所)采用含10%胎牛血清的DMEM培养液培养至细胞单层贴壁,生长状态良好,采用0.5%的胰酶消化并收集细胞,以1X 105个细胞/mL接种于96孔细胞培养板中,50μl/孔;然后分步在每孔加入50μl不同浓度的倍比稀释白细胞介素22样品,使其终浓度分别为0.1、1、2.5、5、10、50、100、1000、2000、4000、8000ng/mL,同时设置无细胞的空白对照和有细胞但不含白细胞介素22的阴性对照,每个浓度做至少三个复孔;在37℃,5%CO2培养箱中培养72小时后,每孔加入5mg/mL的MTT 10μL;继续孵育3小时后,每孔加入100μl DMSO溶解结晶,测定570nm的吸光值。实验结果表明白细胞介素22与亲水性非重复序列多肽重组融合蛋白的活性与等摩尔量的原型白细胞介素22的活性类似,无显著差异。
实施例7、白细胞介素22与亲水性非重复序列多肽重组融合蛋白的药代动力学研究。
取雄性ICR小鼠5只,按16mg/kg剂量皮下注射给药,眼眶取血采集每个时间点的血样,再将血样离心30min后分离血清,-20℃保存。具体采血时间点为0,5,15,30min,1,2,4,8,12,24h。采用人IL22检测试剂盒检测血样浓度。按照试剂盒要求准备好所有溶液和标准工作液以及条板。
实验结果如图8所示,结果说明与原型的白细胞介素22相比,白细胞介素22与亲水性非重复序列多肽重组融合蛋白可显著延长其在体内的半衰期。
实施例8、白细胞介素22与亲水性非重复序列多肽重组融合蛋白治疗糖尿病肾病的药效学研究。
利用腹腔注射链脲佐菌素(STZ)建立糖尿病肾病模型(3月龄雄性SD大鼠),腹腔注射白介素-22与亲水性非重复序列多肽重组融合蛋白(剂量100ng/g体重;每周2次)对造模成功的糖尿病肾病大鼠进行治疗,持续治疗4周后测定肾脏肥大指数(肾质量/体质量)、肾小球细胞外基质蛋白Collagen IV和Fibronectin水平、尿白蛋白等相关指标。
实验结果如图9所示,与正常大鼠(非模型组)相比,糖尿病肾病模型大鼠的肾脏肥大指数(Kidney Hypertrophy Index,KHI)明显上升,肾小球 细胞外基质蛋白(胶原蛋白Collagen IV和纤维连接蛋白Fibronection)水平显著增加;而本发明的重组白介素-22可显著减弱糖尿病肾病模型组的上述变化。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 作为白细胞介素-1受体相关激酶调节剂的吲唑衍生物的制作方法
- 一种人白细胞介素-17受体样蛋白及其编码基因与应用的制作方法
- 人白细胞介素-17受体样蛋白及其编码基因与应用的制作方法
- 作为白细胞介素-1受体相关激酶抑制剂的吲唑基三唑衍生物的制作方法
- 一种新的多肽——人白细胞介素受体-配体(il-17b和il-17br)32.56和编码这种多肽 ...的制作方法
- 人促甲状腺素受体胞外区氨基端基因表达产物及制备方法和该产物在酶免技术中的应用的制作方法
- 一种中药组合物在制备抑制核转录因子活化药物中的应用的制作方法
- 含有标记有特异标靶白细胞介素-4受体的缩氨酸的脂质体的癌症诊断或治疗用靶向药物 ...的制作方法
- 以白细胞介素6受体抑制剂为有效成分的移植物抗宿主病治疗剂的制作方法
- 白细胞介素-33(il-33)和il-33受体复合物的用途的制作方法