用于推导对PD‑1拮抗剂的反应的基因特征生物标志物的系统和方法与流程
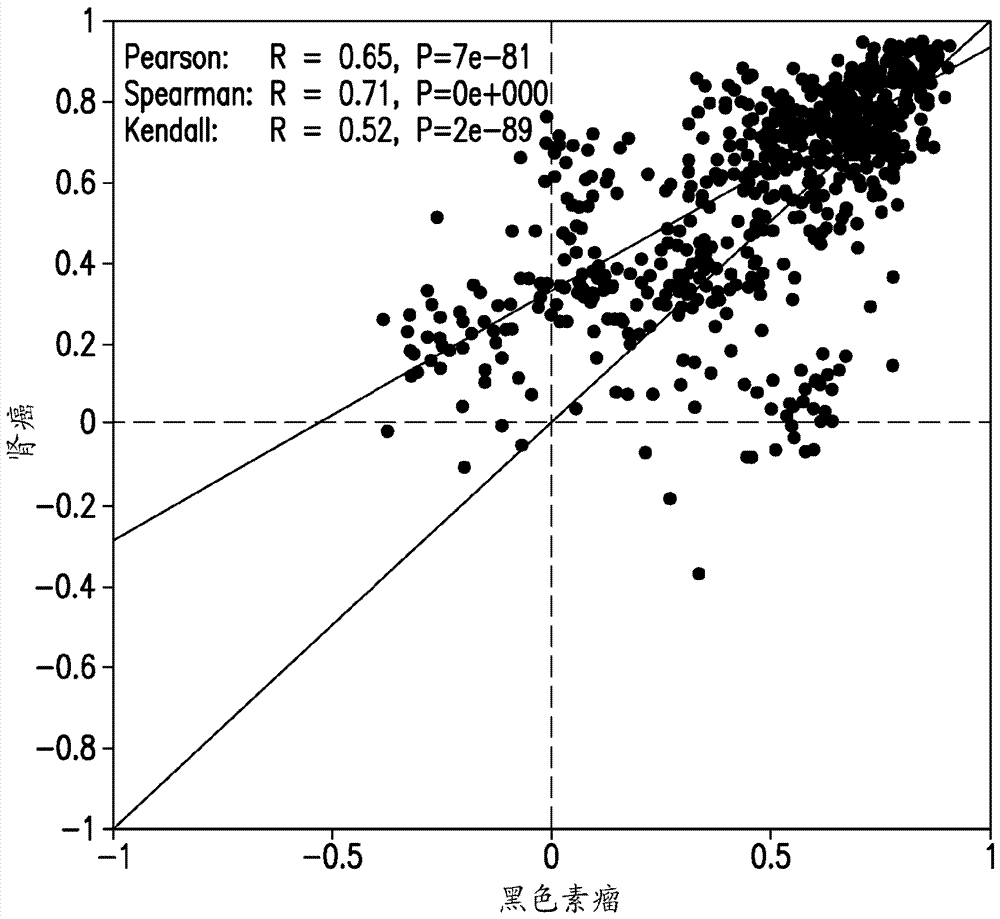
发明领域本发明总体涉及用程序性死亡1(pd-1)的拮抗剂治疗癌症。具体而言,本发明涉及定义预测对pd-1拮抗剂的反应的治疗前基因特征,以及使用此类基因特征作为生物标志物来鉴定最可能对用pd-1拮抗剂的疗法反应的患者。发明背景pd-1被认为是在免疫调节与外周耐受性的维持中的重要分子。pd-1适度表达于幼稚t、b和nkt细胞上并通过在淋巴细胞、单核细胞和骨髓细胞上的t/b细胞受体信号传导上调(1)。两个pd-1的已知的配体是pd-l1(b7-h1)和pd-l2(b7-dc),其在各种组织中产生的人类癌症中表达。在例如卵巢癌、肾癌、结肠直肠癌、胰腺癌、肝癌和黑色素瘤的大样本集中,已表明pd-l1表达与预后不良和总体存活减少有关,而不管后续的治疗(2-13)。类似地,在肿瘤浸润淋巴细胞上的pd-1表达被发现标记在乳腺癌和黑色素瘤中的功能障碍性t细胞(14-15)并与肾癌的预后不良有关(16)。因此,已提出pd-l1表达肿瘤细胞与pd-1表达t细胞相互作用,以减轻t细胞活化并逃避免疫监视,从而造成针对肿瘤的免疫反应受损。通过抑制pd-1及pd-l1和pd-l2的一个或两个之间相互作用而拮抗pd-1活性的几种单克隆抗体(mab)正处于临床开发中用于治疗癌症。这些包括与pd-1结合的纳武单抗(nivolumab)和派姆单抗(pembrolizumab),以及与pd-l1结合的mpdl3280a。尽管用这些mab的临床研究在一些癌症类型中已产生了持久的抗肿瘤反应,但大量的患者未能表现出抗肿瘤反应。因此,需要诊断工具来鉴定哪些癌症患者最可能实现临床受益于用pd-1拮抗剂治疗。癌症研究中的一个活跃领域是鉴定基因集合的肿瘤内表达模式,通常被称为基因特征或分子特征,其为特定类型或亚型的癌症的特征,并且可能与临床结果相关。发明概述本发明的系统和方法基于临床反应基因集合和均一化基因集合的组合,本文被称为“基因表达平台”,其被本发明人设计为用于推导具有多种肿瘤类型的与对pd-1拮抗剂的抗肿瘤反应相关的治疗前肿瘤内rna表达水平(“基因特征”)的不同的基因集合的工具。本发明人还考虑,该基因表达平台将可用于推导一种评分算法,其将特征中的各个基因对相关性的相对贡献加权,以产生基因特征中的所有基因的均一化rna水平的算术复合物,本文被称为“基因特征评分”。通过比较对于具有相同目标肿瘤类型且用pd-1拮抗剂治疗的患者组群获得的基因特征评分和抗肿瘤反应,本发明人考虑可以选择截止评分,其根据具有实现对pd-1拮抗剂的抗肿瘤反应的更高或更低概率来分开患者。特定肿瘤类型的预测性特征评分在本文中被称为基因特征生物标志物。其肿瘤对于根据本发明推导的基因特征生物标志物测试阳性的患者比其肿瘤对于基因特征生物标志物测试阴性的患者更可能受益于用pd-1拮抗剂的疗法。因此,在第一个方面,本发明提供推导对于至少一种目标肿瘤类型预测对pd-1拮抗剂的抗肿瘤反应的基因特征生物标志物的方法。所述方法包括:(a)在诊断具有肿瘤类型的患者组群中从每个患者获得治疗前肿瘤样品;(b)对于组群中的每个患者,获得用pd-1拮抗剂治疗后的抗肿瘤反应值;(c)对于基因表达平台中的每种基因测量每个肿瘤样品中的原始rna水平,其中所述基因表达平台包含临床反应基因的集合和均一化基因的集合;(d)对于每个肿瘤样品,使用测量的均一化基因的rna水平,将临床反应基因的测量的原始rna水平各自均一化;(e)对于每个肿瘤样品和目标基因特征中的每种基因,使用该基因的预定义的乘法系数将均一化的rna表达水平加权;(f)对于每个肿瘤样品,添加加权的rna表达水平以生成基因特征评分;和(g)将所有肿瘤样品的基因特征评分和组群中所有患者的抗肿瘤反应值进行比较,以选择分开患者群组以满足靶标生物标志物临床效用标准的基因特征评分的截止值。在一个实施方案中,所述方法进一步包括将具有等于或大于所选截止值的基因特征评分的肿瘤类型的任何肿瘤样品指定为生物标志物阳性,和将具有低于所选截止值的基因特征评分的肿瘤类型的任何肿瘤样品指定为生物标志物阴性。本发明人考虑使用本发明的上述方法推导的基因特征生物标志物可用于各种临床研究和患者治疗设置,诸如例如,以仅将生物标志物阳性患者选择性登记入pd-1拮抗剂的临床试验,基于生物标志物阳性或阴性状态分层pd-1拮抗剂的临床试验的分析,或确定患者对于用pd-1拮抗剂治疗的合格性。因此,在第二个方面,本发明提供用于针对肿瘤类型对pd-1拮抗剂的抗肿瘤反应的基因特征生物标志物的存在或不存在测试从诊断具有特定肿瘤类型的患者中移取的肿瘤样品的方法。所述方法包括:(a)对于基因表达平台中的每种基因测量肿瘤样品中的原始rna水平,其中所述基因表达平台包含临床反应基因的集合和均一化基因的集合;(b)使用测量的均一化基因的rna水平,将肿瘤类型的预定义的基因特征中的每种临床反应基因的测量的原始rna水平均一化;(c)使用预定义的乘法系数来将每个均一化的rna值加权;(d)添加加权的rna表达水平以生成基因特征评分;(e)将生成的评分与基因特征和肿瘤类型的参考评分进行比较;和(f)将肿瘤样品分类为生物标志物阳性或生物标志物阴性;其中如果生成的评分等于或大于参考评分,则将肿瘤样品分类为生物标志物阳性,且如果生成的评分小于参考评分,则将肿瘤样品分类为生物标志物阴性。在第三个方面,本发明提供用于针对肿瘤类型对pd-1拮抗剂的抗肿瘤反应的基因特征生物标志物的存在或不存在测试从诊断具有特定肿瘤类型的患者中移取的肿瘤样品的系统。所述系统包含(i)用于测量基因表达平台中的每种基因的原始rna表达水平的样品分析仪,其中所述基因表达平台由临床反应基因的集合和均一化基因的集合组成,和(ii)计算机程序,其用于接收和分析测量的rna表达水平,以(a)使用测量的均一化基因的rna水平,将肿瘤类型的预定义的基因特征中的每种临床反应基因的测量的原始rna水平均一化;(b)使用预定义的乘法系数来将每个均一化的rna值加权;(c)添加加权的rna表达水平以生成基因特征评分;(d)将生成的评分与基因特征和肿瘤类型的参考评分进行比较;和(e)将肿瘤样品分类为生物标志物阳性或生物标志物阴性,其中如果生成的评分等于或大于参考评分,则将肿瘤样品分类为生物标志物阳性,且如果生成的评分小于参考评分,则将肿瘤样品分类为生物标志物阴性。在本发明的每个上述方面,基因表达平台中的临床反应基因(a)与多于一种肿瘤类型中的对pd-1拮抗剂的抗肿瘤反应单独相关,和(b)共同生成在每种肿瘤类型中基本相似的协方差模式。临床反应基因集合中的第一基因子集表现出与抗肿瘤反应正相关的肿瘤内rna水平,而临床反应基因集合中的第二基因子集的肿瘤内rna水平与抗肿瘤反应负相关。在一个实施方案中,临床反应基因集合包含约57种基因,第一子集包含约51种基因,且第二子集包含约6种基因。在本发明的任何上述方面的一些实施方案中,所述基因表达平台包含表1a和1b中列出的57种基因。在本发明的任何上述方面的一些实施方案中,所述基因表达平台中的均一化基因的集合包含这样的基因,其在不同肿瘤类型的多个样品中单独表现出低变异性的肿瘤内rna水平,且共同表现出跨越不同肿瘤类型中的临床反应基因的肿瘤内表达水平的范围的范围的肿瘤内rna水平。在一些实施方案中,所述均一化基因集合包含10至12种基因。在本发明的任何上述方面的一个实施方案中,所述基因表达平台包含下表1c中列出的11种均一化基因。本发明人已经鉴定了下表2中所示的特异性基因特征,其代表于临床反应基因中,并且与多种肿瘤类型中对派姆单抗的反应相关。由于存在这些基因特征中的每一个共同的几种基因,本发明人提出可以对于这些特征的每一种以及对于包含表1中的临床反应基因的2至57种的任何组合的其他基因特征推导预测对pd-1拮抗剂的反应的基因特征生物标志物。因此,在一些实施方案中,在本发明的方法或系统中评估的基因特征可以包含表1中的临床反应基因的至少两种的任何组合,并且可以包表1中的临床反应基因的3、4、5、6、7、13或18种,或2至57种之间的任何数字。在一些实施方案中,所述基因特征选自表1a和1b中的57种临床反应基因、表1a中的51种临床反应基因和表2中列出的基因特征。在一些实施方案中,所述基因特征是表2中所示的18基因上-下特征。在本发明的任何上述方面和实施方案中使用的抗肿瘤反应值可用于个体患者中的抗肿瘤反应的任何定量或定性测量,或者可以是已经在患者组群中观察到的抗肿瘤反应率。在用pd-1拮抗剂治疗组群的任何时段期间或之后可以获得抗肿瘤反应值。在另一个实施方案中,所述抗肿瘤反应值是如通过recist1.1或irrc测量的客观值,诸如部分反应、完全反应或最佳总体反应。在一个实施方案中,所述抗肿瘤反应值是抗肿瘤反应的持续时间,例如患者具有无进展存活、无病存活或一些其他正在进行的抗肿瘤反应的天数、月数或年数。在另一个实施方案中,所述抗肿瘤反应值是用pd-1拮抗剂治疗的患者组群的反应率,诸如客观反应率(orr)或中值总存活期。在一些实施方案中,在至少2、3、4、5、6、7、8、9或更多剂量的pd-1拮抗剂之后获得抗肿瘤反应值(个体值或群组反应率)。在其他实施方案中,所述抗肿瘤反应值是针对持续的抗肿瘤反应,其在基于患者间(onapatientbypatientbasis)最后一次剂量的pd-1拮抗剂之后的任何时间进行评估,例如在施用最后一次剂量之后3、6、9、12、15、18、21或24个月进行评估。本发明人考虑上述方法和系统可用于推导各种pd-1拮抗剂和肿瘤类型的基因特征生物标志物。在一些实施方案中,所述pd-1拮抗剂是纳武单抗或派姆单抗。所述患者组群可以用pd-1拮抗剂作为单一疗法或作为包括一种或多种其他癌症治疗的组合疗法的一部分来治疗。在一些实施方案中,所述肿瘤类型是膀胱癌、结肠直肠癌、胃癌、头颈癌、黑色素瘤、非小细胞肺癌、卵巢癌、前列腺癌或肾癌。在一个实施方案中,所述pd-1拮抗剂是派姆单抗,且所述肿瘤类型是肛门癌、胆道癌、膀胱癌、结肠直肠癌、食管癌、胃癌、头颈癌、黑色素瘤或卵巢癌。在本发明的方法和系统的一些实施方案中,每种样品的临床反应基因的均一化rna表达水平通过如下获得:对表1中的每种临床反应基因和表1中的每种均一化基因进行测量的原始rna水平的log(10)转换,计算均一化基因的log10转换的rna水平的算术平均值,和从表1中的每种临床反应基因的log10转换的rna水平减去计算的平均值。在采用表2中的任何特定基因特征的一些实施方案中,测量的rna值通过如下获得:对特征中的每种临床反应基因和均一化基因的集合进行测量的原始rna水平的log(10)转换,计算均一化基因的log10转换的rna水平的算术平均值,和从每种临床反应基因的log10转换的rna水平减去计算的平均值。在一些实施方案中,均一化基因的集合包含表1c中列出的均一化基因。在一个实施方案中,所述基因特征是表2中所述的5-基因ifng诱导的特征或7-基因mipfs特征。在一个实施方案中,所述基因特征是表2中所述的18-基因上-下特征,并且均一化基因的集合由表1c中列出的10种基因组成。在一个实施方案中,假定目标基因特征(即,具体肿瘤类型的预定义的基因特征)中的每种基因对肿瘤反应相关性有同等贡献,因此将每种基因同等加权。因此,该基因特征中的每种基因的预定义的乘法系数为1,并且基因特征中的基因的均一化的rna表达评分可以通过直接加法或通过计算算术平均值来组合。在另一个实施方案中,特定基因特征中不同基因对抗肿瘤反应相关性贡献的程度不同,并且已经通过将多变量统计学模型应用于抗肿瘤反应值和对于患者组群测定的均一化基因表达水平来预先定义将这些贡献差异加权的系数。下表3描述用于计算本发明的几种基因特征的特征评分的加权系数的示例性集合。表3a中鉴定的基因特征由表1中的57种临床反应基因组成,并且表3b中的基因特征是表2中所述的14-基因上-下和18-基因上-下特征。表3a:57-基因上-下特征的示例评分权重集合表3b.源自表1的上-下特征的示例评分权重集合an/a意味着指定基因不被认为是特征的一部分。因此,在一个实施方案中,生成从患者移除的肿瘤样品的特征评分包括(i)将对于基因特征中的每种基因获得的均一化rna值乘以来自评分权重的集合的该基因的系数,以生成特征中每种基因的加权rna值,和(ii)添加加权rna值以产生肿瘤样品的特征评分,其中当基因特征由表3a中的57上-下特征组成时,则评分权重集合选自集合1.1、集合1.2、集合2.1、集合2.2、集合2.3和集合2.4,并且当基因特征由表3b中的14-基因上-下特征组成时,则评分权重集合由表3b的第二列中的权重组成,并且当基因特征由表3b中的18-基因上-下特征组成时,评分权重集合由表3b的第三列中的权重组成。在采用表3a或3b中的评分权重集合之一以生成特征评分的一些实施方案中,均一化的rna值通过如下获得:对特征中的每种临床反应基因和表1c中的每种均一化基因进行测量的原始rna水平的log(10)转换,计算均一化基因的log10转换的rna水平的算术平均值,和从每种临床反应基因的log10转换的rna水平减去计算的平均值。在一个实施方案中,由所选截止评分满足的靶标生物标志物效用标准是组群中的大多数反应者患者具有等于或大于截止值的基因特征评分,而大多数无反应者患者具有低于截止值的基因特征。在另一个实施方案中,靶标生物标志物效用标准是患者组群中的反应者患者的至少20%、40%、60%或80%具有等于或大于所选截止评分的基因特征评分。在另一个实施方案中,选择截止评分以满足组群中的无反应者患者的至少80%、85%、90%或95%或接近100%具有低于截止评分的基因特征评分的靶标生物标志物效用标准。在另一个实施方案中,靶标生物标志物效用标准是当应用于患者组群中的单独患者时至少25%、30%、35%或更高的所选截止值的阳性预测值(ppv)和至少90%、93%、96%或更高的阴性预测值(npv)。在一个实施方案中,所述pd-1拮抗剂是派姆单抗或纳武单抗,所述基因特征由表1中列出的临床反应基因中的至少五种组成。在一些实施方案中,所述基因特征选自表2中列出的基因特征,且所述患者已被诊断具有膀胱癌、胃癌、头颈癌或黑色素瘤。在一些实施方案中,所述pd-1拮抗剂是派姆单抗,所述基因特征是表2中显示的ifng、pd-l1、扩增的免疫或tcr信号传导特征,且所述患者已被诊断具有膀胱癌、胃癌、头颈癌或黑色素瘤。在一些实施方案中,已经确定所述基因特征的参考评分以便将对pd-1拮抗剂的反应者组中的至少大多数与对pd-1拮抗剂的无反应者中的至少大多数分开。因此,其肿瘤样品被分类为生物标志物阳性的患者比其肿瘤样品被分类为生物标志物阴性的患者更可能对pd-1拮抗剂反应或达到更好的反应。在又另一个方面,本发明提供可用于测定肿瘤样品以获得本文所述的任何基因特征的均一化rna表达评分的试剂盒。在一个实施方案中,所述试剂盒包含能够特异性结合由表1中的每种基因表达的转录物的杂交探针的集合和设计以定量与每种杂交探针形成的特异性杂交复合物的数目的试剂的集合。在一个实施方案中,所述集合中的每种杂交探针具有独特的可检测标记物,并被设计为与对于临床反应基因和均一化基因之一独特的靶序列特异性杂交,从而使得能够在单一杂交反应中检测肿瘤样品中的所有表1基因的转录物。在一个实施方案中,本发明的试剂盒还可以包含至少一种对照肿瘤样品,其可以以与测试肿瘤样品相同的方式针对临床反应和均一化基因的表达进行测定。在另一个实施方案中,所述试剂盒包含(1)杂交探针的集合,其能够特异性结合由选自表2中所示的基因特征组的基因特征中的每种基因和由表1中列出的每种均一化基因表达的转录物,和(2)试剂的集合,其被设计用于定量与每种杂交探针形成的特异性杂交复合物的数目。在又另一个方面,本发明提供用于治疗具有肿瘤的患者的方法,其包括确定肿瘤对于基因特征生物标志物是阳性还是阴性,且如果所述肿瘤对于所述生物标志物是阳性的,则向所述受试者施用pd-1拮抗剂,且如果所述肿瘤对于所述生物标志物是阴性的,则向所述受试者施用不包括pd-1拮抗剂的癌症治疗,其中所述基因特征生物标志物用于包含表1中的临床反应基因中的至少两种的基因特征。在一个实施方案中,所述基因特征选自表2中列出的基因特征。在又另一个方面,本发明提供药物组合物,其包含用于受试者中的pd-1拮抗剂,所述受试者具有对于基因特征生物标志物测试阳性的肿瘤,其中所述基因特征生物标志物用于选自表2中列出的基因特征的基因特征。本发明的又另一个方面是包含药物组合物和处方信息的药物产品。所述药物组合物包含pd-1拮抗剂和至少一种药学上可接受的赋形剂。所述处方信息指出,所述药物组合物被指示用于具有对于基因特征生物标志物测试阳性的肿瘤的受试者,其中所述基因特征生物标志物用于选自表2中列出的基因特征的基因特征。附图简述图1显示表2中列出的mipfs基因特征的多个头颈肿瘤样品与表1b中列出的6-基因反相关基因子集的无监督聚类分析的结果。图2a、2b、2c、2d、2e、2f、2g、2h和2i显示多个黑色素瘤肿瘤样品相比于以下肿瘤类型的多个肿瘤样品中表1中的57种临床反应基因中的一些或全部的均一化rna表达水平的成对相关性的分散图:头颈癌(图2a)、膀胱癌(图2b)、胃癌(图2c)、nsclc(图2d)、结肠直肠癌(图2e)、肾癌(图2f)、前列腺癌(图2g)、卵巢癌(图2h)和三阴性乳腺癌(图2i)。图3显示针对治疗前肿瘤样品的荟萃分析中的无进展存活时间和用派姆单抗治疗的三个不同癌症组群中的临床反应数据绘制的表1中的57种临床反应基因的基因特征所确定的模型推导的基因特征评分。图4显示针对表1中列出的57种临床反应基因的治疗前肿瘤样品确定的模型推导的基因特征评分绘制的用派姆单抗治疗的胃癌组群中的反应者和无反应者患者的百分比的柱状图。图5显示图4中所示的基于模型的基因特征评分的roc曲线。图6说明表1中表示的ifng基因特征用于预测头颈组群中的患者中对派姆单抗的bor的潜在用途,其显示增加截止评分对具有高于截止值(上小图)、阳性预测值(ppv,中小图)和阴性预测值(npv,下小图)的基因特征评分的组群中患者的患病率的影响。图7显示表1的57-基因特征的特征评分的预期borppv概况,所述评分在keynote-012和keynote-028的分层贝叶斯荟萃分析下使用集合1.1的权重计算。图8显示表1的57-基因特征的特征评分的预期bornpv概况,所述评分在keynote-012和keynote-028的分层贝叶斯荟萃分析下使用集合1.1的权重计算。图9a和9b是柱状图,其显示在对派姆单抗治疗反应(反应者)或没有反应(无反应者)的食管癌患者中的57基因特征的治疗前特征评分的分布,其中使用示例性评分权重集合1.1(图9a)或集合2.4(图9b)计算特征评分。图10a和10b是柱状图,其显示在对派姆单抗治疗反应(反应者)或没有反应(无反应者)的结肠直肠癌患者中的57基因特征的治疗前特征评分的分布,其中使用示例性评分权重集合1.1(图10a)或集合2.4(图10b)计算特征评分。图11a和11b是柱状图,其显示在对派姆单抗治疗反应(反应者)或没有反应(无反应者)的肛门癌患者中的57基因特征的治疗前特征评分的分布,其中使用集合1.1(图11a)或集合2.4(图11b)中鉴定的评分权重集合计算特征评分。详细描述i.缩写.贯穿本发明的详细描述和实施例,将使用以下缩写:bor 最佳总体反应cdr 互补决定区cho 中国仓鼠卵巢cr 完全反应dfs 无病存活期ffpe 福尔马林-固定、石蜡包埋的fr 框架区ihc 免疫组织化学或免疫组织化学的irrc 免疫相关的反应标准ncbi 国家生物技术信息中心npv 净预测值or 总体反应os 总体存活期pd 进行性疾病pd-1 程序性死亡1pd-l1 程序性细胞死亡1配体1pd-l2 程序性细胞死亡1配体2pfs 无进展存活期(pfs)ppv 阳性预测值pr 部分反应q2w 每两周一个剂量q3w 每3周一个剂量recist 实体瘤的反应评价标准roc 受试者操作特征sd 稳定的疾病vh 免疫球蛋白重链可变区vk 免疫球蛋白κ轻链可变区。ii.定义为了可以更容易地理解本发明,下文具体定义了某些技术和科学术语。除非在本文件中另外特别地定义,在此使用的所有其他的技术和科学术语具有本发明所属领域普通技术人员通常理解的意义。如本文,包括所附权利要求书所用,单词的单数形式例如"一"、"一"和"该"包括它们对应的复数指代,除非文中另外清楚地指明。当用于修饰数字定义的参数(例如,本文讨论的基因特征的基因特征评分,或pd-1拮抗剂的剂量,或pd-1拮抗剂的治疗时间长度)时,“约”是指该参数可以高于或低于该参数的规定数值的差不多10%。例如,由约10种基因组成的基因特征可以具有9至11种基因。类似地,约2.462的参考基因特征评分包括2.2158和2.708的评分和其之间的任何评分。"施用"和"治疗",当它应用于动物、人、实验受试者、细胞、组织、器官或生物液体时,是指使外源性药物、治疗剂、诊断剂或组合物与动物、人、受试者、细胞、组织、器官或生物液体接触。细胞的处理涵盖使试剂与细胞接触,以及使试剂与液体接触,在那里所述液体与细胞接触。"施用"和"治疗"也意指例如通过试剂、诊断剂、结合化合物,或通过另一个细胞的细胞的体外和离体治疗。术语"受试者"包括任何生物,优选动物,更优选哺乳动物(例如,大鼠、小鼠、狗、猫、兔)和最优选人。如本文所用,术语"抗体"是指表现出所需生物学或结合活性的任何形式的抗体。因此,它在广义上使用并特别地覆盖,但不限于,单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如,双特异性抗体)、人源化、完全人抗体、嵌合抗体和骆驼化(camelized)单结构域抗体。"亲本抗体"是在用于预定用途的抗体的修饰,诸如用作人治疗剂的小鼠中生成的亲本抗体的人源化之前,通过使免疫系统暴露于抗原而获得的抗体。一般来说,基本的抗体结构单元包含四聚体。每个四聚体包括两个相同的多肽链对,每对具有一个"轻"(约25kda)和一个"重"链(约50-70kda)。每条链的氨基-末端部分包括主要负责抗原识别的约100-110或更多氨基酸的可变区。重链的羧基-末端部分可限定主要地负责效应子功能的恒定区。典型地,人轻链被分类为κ和λ轻链。此外,人重链典型地被分类为μ、δ、γ、α或ε,且将抗体的同种型分别定义为igm、igd、igg、iga和ige。在轻链和重链内,可变区和恒定区由约12或更多个氨基酸的"j"区连接,其中重链也包括约10个以上的氨基酸的"d"区。一般参见,fundamentalimmunologych.7(paul,w.,编辑,第2版.ravenpress,n.y.(1989)。每个轻/重链对的可变区形成抗体结合位点。因此,一般来说,完整的抗体具有两个结合位点。除了双功能或双特异性抗体中,两个结合位点一般是相同的。典型地,重链和轻链二者的可变结构域均包含3个高变区,也称为互补决定区(cdrs),其位于相对保守的框架区(fr)内。cdrs通常由框架区对齐,使得能够结合特定表位。一般来说,从n-末端至c-末端,轻链和重链可变结构域二者均包含fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。氨基酸分配到每个结构域一般根据以下的定义:sequencesofproteinsofimmunologicalinterest,kabat,等人;nationalinstitutesofhealth,bethesda,md.;第5版;nihpubl.no.91-3242(1991);kabat(1978)adv.prot.chem.32:1-75;kabat,等人,(1977)j.biol.chem.252:6609-6616;chothia,等人,(1987)jmol.biol.196:901-917或chothia,等人,(1989)nature342:878-883。如本文所用,术语"高变区"是指负责抗原-结合的抗体的氨基酸残基。高变区包含来自"互补决定区"或"cdr"的氨基酸残基(即在轻链可变结构域中的cdrl1、cdrl2和cdrl3,以及在重链可变结构域中的cdrh1、cdrh2和cdrh3)。参见,kabat等人(1991)sequencesofproteinsofimmunologicalinterest,第5版.publichealthservice,nationalinstitutesofhealth,bethesda,md.(由序列限定抗体的cdr区);也参见chothia和lesk(1987)j.mol.biol.196:901-917(由结构限定抗体的cdr区)。如本文所用,术语"框架"或"fr"残基是指并非本文定义为cdr残基的高变区残基的那些可变结构域残基。如本文所用,除非另外指明,"抗体片段"或"抗原结合片段"是指抗体的抗原结合片段,即保留特异性地结合至由全长抗体结合的抗原的能力的抗体片段,例如,保留一个或多个cdr区的片段。抗体结合片段的实例包括,但不限于,fab、fab'、f(ab')2和fv片段;双抗体;线性抗体;单链抗体分子,例如sc-fv;从抗体片段形成的纳米抗体和多特异性抗体。"特异性地结合至”特定靶蛋白的抗体是,与其他蛋白相比,显示出优先结合至该靶标的抗体,但这种特异性不需要绝对结合特异性。如果抗体结合确定靶蛋白在样品中的存在,例如,不产生不希望的结果诸如假阳性,则该抗体对其预定的靶标被认为是"特异性的"。可用于本发明的抗体,或其结合片段,将以结合非-靶蛋白的亲和力的至少两倍,优选地至少10倍,更优选至少20-倍,和最优选至少100-倍的亲和力结合至靶蛋白。如本文所用,据说抗体是特异性地结合至包含给定氨基酸序列,例如成熟人pd-1或人pd-l1分子的氨基酸序列的多肽,如果它结合至包含该序列但不结合至缺乏该序列的蛋白的多肽的话。"嵌合抗体"是指其中重链和/或轻链的部分与源自特定物种(例如人)的抗体或属于特定抗体类或亚类中的对应序列相同或同源的抗体,而所述链的其余部分与源自另一个物种(如小鼠)的抗体或属于另一个抗体类或亚类,以及这样抗体的片段中的对应序列相同或同源,只要它们显示出所需生物学活性。“人抗体”是指仅包含人免疫球蛋白蛋白序列的抗体。人抗体可含有鼠碳水化合物链,如果在小鼠,在小鼠细胞,或在源自小鼠细胞的杂交瘤中产生的话。类似地,“小鼠抗体”或“大鼠抗体”是指仅分别包含小鼠或大鼠免疫球蛋白序列的抗体。"人源化抗体"是指含有来自非-人(例如鼠科动物)抗体以及人抗体的序列的抗体形式。这样的抗体含有源自非-人免疫球蛋白的最小序列。一般来说,人源化抗体将基本上都包含至少一个、通常两个可变结构域中的全部,其中所有或几乎所有的高变环对应于非-人免疫球蛋白的那些,并且所有或几乎所有的fr区是人免疫球蛋白序列的那些。人源化抗体任选地还将包含至少一部分免疫球蛋白恒定区(fc),通常为人免疫球蛋白的恒定区。啮齿动物抗体的人源化形式将一般包含亲本啮齿动物抗体的相同的cdr序列,虽然可包括某些氨基酸取代,以增加亲和力,增加人源化抗体的稳定性,或为了其他理由。当是指用治疗剂诸如pd-1拮抗剂治疗的癌症患者时,“抗肿瘤反应”意指至少一种阳性治疗效果,诸如例如癌细胞数目降低,肿瘤大小减小,癌细胞浸润至外周器官的速率降低,肿瘤转移率或肿瘤生长率降低或无进展存活期。可以以多种方式测量癌症中的阳性治疗效果(参见,w.a.weber,j.null.med.50:1s-10s(2009);eisenhauer等人,同上)。在一些实施方案中,使用recist1.1标准、二维irrc或一维irrc评估对pd-1拮抗剂的抗肿瘤反应。在一些实施方案中,抗肿瘤反应是sd、pr、cr、pfs、dfs中的任一种。在一些实施方案中,本发明的基因特征生物标志物预测具有实体瘤的受试者是否可能实现pr或cr。“二维irrc”是指在wolchokjd等人.guidelinesfortheevaluationofimmunetherapyactivityinsolidtumors:immune-relatedresponsecriteria.clincancerres.2009;15(23):7412–7420中描述的一套标准。这些标准利用靶病灶的二维肿瘤测量,其通过使每个病灶的最长直径乘以最长垂直直径(cm2)来获得。“生物治疗剂”意指一种生物分子,诸如抗体或融合蛋白,其阻断任何生物学通路中的配体/受体信号传导,这样的信号传导支持肿瘤维持和/或生长或抑制抗-肿瘤免疫反应。术语“癌症”、“癌性”或“恶性”是指或描述通常特征在于失调的细胞生长的哺乳动物的生理状态。癌症的实例包括但不限于,癌症、淋巴瘤、白血病、胚细胞瘤和肉瘤。此类癌症的更具体的实例包括鳞状细胞癌、骨髓瘤、小细胞肺癌、非-小细胞肺癌、神经胶质瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、急性髓性白血病(aml)、多发性骨髓瘤、胃肠(道)癌、肾癌、卵巢癌、肝癌、淋巴母细胞性白血病、淋巴细胞性白血病、结肠直肠癌、子宫内膜癌、肾癌、前列腺癌、甲状腺癌、黑色素瘤、软骨肉瘤、神经母细胞瘤、胰腺癌、多形性胶质母细胞瘤、宫颈癌、脑癌、胃癌、膀胱癌、肝细胞瘤、乳腺癌、结肠癌和头颈癌。可根据本发明治疗的特别优选的癌症包括特征在于在测试的组织样品中pd-l1和pd-l2的一种或两种的升高的表达的那些癌症。除非另外指示,否则如本文所用“cdr”或“cdrs”意指免疫球蛋白可变区中使用kabat编号系统定义的互补决定区。“化疗剂”是可用于治疗癌症的化学化合物。化学治疗剂的类别包括,但不限于:烷基化剂、抗代谢药、激酶抑制剂、纺锤体毒剂植物生物碱、细胞毒性/抗肿瘤抗生素、拓扑异构酶抑制剂、光敏化剂、抗雌激素和选择性雌激素受体调节剂(serm)、抗孕酮剂、雌激素受体下调剂(erd)、雌激素受体拮抗剂、促黄体激素释放激素激动剂、抗雄激素剂、芳香酶抑制剂、egfr抑制剂、vegf抑制剂、抑制参与异常细胞增殖或肿瘤生长的基因表达的反义寡核苷酸。可用于本发明治疗方法中的化学治疗剂包括细胞生长抑制剂和/或细胞毒性剂。如本文所用,“chothia”意指al-lazikani等人,jmb273:927-948(1997)中所述的抗体编号系统。“包含(comprising)”或变型诸如“包含(comprise)”、“包含(comprises)”或“由...构成”贯穿说明书和权利要求书中以包括性意义使用,即指定所述特征的存在,但不排除可以实质上增强本发明的任何实施方案的操作或效用的进一步特征的存在或添加,除非上下文由于明确的语言或必要的含义而另有要求。如贯穿说明书和权利要求书所用,"基本由...组成"和变型诸如"基本上由...组成"或"基本上由...组成",指包括任何叙述的要素或要素组,和任选包含性质类似或不同于所述要素的其他的要素,所述要素实质上不改变特定剂量方案、方法或组合物的基本或新的特性。作为非限制性实例,如果将基因特征评分定义为由指定的基因列表组成的基因集合的复合rna表达评分,则技术人员将理解,该基因特征评分可以包括对于一种或多种额外基因、优选不超过三种额外基因确定的rna水平,如果此类包含物实质上不影响预测能力。如本文所用的“框架区”或“fr”意指排除cdr区的免疫球蛋白可变区。"同源性"是指两个多肽序列在优化比对时,它们之间的序列相似性。当两个比较的序列二者的位置被同一氨基酸单体亚基所占据,例如如果两个不同的abs的轻链cdr的位置被丙氨酸占据,则两个abs在该位置上是同源的。同源性的百分比是由两个序列共享的同源位置数除以被比较的位置总数×100。例如,当序列被最佳比对时,如果两个序列的10个位置中的8个为匹配或同源的,则两个序列为80%同源的。一般来说,当两个序列经比对以给出最大百分比同源性时,进行比较。例如,可通过blast算法进行比较,其中选择该算法的参数以给出各序列相对于相应的参考序列的整个长度之间的最大匹配。以下参考文献涉及常常用于序列分析的blast算法:blastalgorithms:altschul,s.f.,等人,(1990)j.mol.biol.215:403-410;gish,w.,等人,(1993)naturegenet.3:266-272;madden,t.l.,等人,(1996)meth.enzymol.266:131-141;altschul,s.f.,等人,(1997)nucleicacidsres.25:3389-3402;zhang,j.,等人,(1997)genomeres.7:649-656;wootton,j.c.,等人,(1993)comput.chem.17:149-163;hancock,j.m.等人,(1994)comput.appl.biosci.10:67-70;alignmentscoringsystems:dayhoff,m.o.,等人,"amodelofevolutionarychangeinproteins."于atlasofproteinsequenceandstructure,(1978)vol.5,suppl.3.m.o.dayhoff(ed.),pp.345-352,natl.biomed.res.found.,washington,dc;schwartz,r.m.,等人,"matricesfordetectingdistantrelationships."于atlasofproteinsequenceandstructure,(1978)vol.5,suppl.3."m.o.dayhoff(ed.),pp.353-358,natl.biomed.res.found.,washington,dc;altschul,s.f.,(1991)j.mol.biol.219:555-565;states,d.j.,等人,(1991)methods3:66-70;henikoff,s.,等人,(1992)proc.natl.acad.sci.usa89:10915-10919;altschul,s.f.,等人,(1993)j.mol.evol.36:290-300;alignmentstatistics:karlin,s.,等人,(1990)proc.natl.acad.sci.usa87:2264-2268;karlin,s.,等人,(1993)proc.natl.acad.sci.usa90:5873-5877;dembo,a.,等人,(1994)ann.prob.22:2022-2039;andaltschul,s.f."evaluatingthestatisticalsignificanceofmultipledistinctlocalalignments."于theoreticalandcomputationalmethodsingenomeresearch(s.suhai,ed.),(1997)pp.1-14,plenum,newyork。"分离的抗体"和“分离的抗体片段”是指纯化状态并且在这样的上下文中意指指定的分子基本上不含其他生物学分子诸如核酸、蛋白、脂质、碳水化合物或其他物质诸如细胞碎片和生长培养基。一般来说,术语"分离的"并不意味着指完全不存在这样的物质或不存在水、缓冲剂或盐,除非它们以基本上干扰如本文描述的结合化合物的实验或治疗应用的量存在。如本文所用,“kabat”意指由elvina.kabat首创的免疫球蛋白比对和编号系统((1991)sequencesofproteinsofimmunologicalinterest,第5版.publichealthservice,nationalinstitutesofhealth,bethesda,md.)。如本文所用,"单克隆抗体"或“mab”或“mab”,是指基本上同质的抗体群体,即构成群体的抗体分子在氨基酸序列中是相同的,除了可以少量存在的可能天然存在的突变。相比之下,传统的(多克隆)抗体制备物典型地包括许多不同的抗体,所述抗体在它们的可变结构域,特别是它们的cdrs(其对不同的表位经常是特异性的)中具有不同的氨基酸序列。修饰词"单克隆的"表明如从基本上同质的抗体群体获得的抗体的特征,并且不被解释为需要通过任何具体方法生产抗体。例如,根据本发明要使用的单克隆抗体可通过由kohler等人(1975)nature256:495首次描述的杂交瘤方法制得,或可通过重组dna方法(参见,例如美国专利号4,816,567)制得。"单克隆抗体"也可使用在例如clackson等人(1991)nature352:624-628和marks等人(1991)j.mol.biol.222:581-597中描述的技术,从噬菌体抗体库中分离出来。也参见presta(2005)j.allergyclin.immunol.116:731。当是指对用pd-1拮抗剂治疗的特异性抗肿瘤反应时,“无反应者”意味着患者没有表现出抗肿瘤反应。“寡核苷酸”是指通常长度为5-100个连续碱基,最常见长度为10-50、10-40、10-30、10-25、10-20、15-50、15-40、15-30、15-25、15-20、20-50、20-40、20-30或20-25个连续碱基的核酸。"患者"是指需要治疗或正参与临床试验、流行病学研究或用作对照的任何单个人受试者。"pd-1拮抗剂"意指任何阻断在癌症细胞上表达的pd-l1与在免疫细胞(t细胞、b细胞或nkt细胞)上表达的pd-1的结合并且还优选地阻断在癌症细胞上表达的pd-l2与免疫-细胞表达的pd-1的结合的化学化合物或生物学分子。对pd-1及其配体的替代名称或同义词包括:用于pd-1的pdcd1、pd1、cd279和sleb2;用于pd-l1的pdcd1l1、pdl1、b7h1、b7-4、cd274和b7-h;和用于pd-l2的pdcd1l2、pdl2、b7-dc、btdc和cd273。在其中待治疗人个体的本发明的任何各个方面和实施方案中,pd-1拮抗剂阻断人pd-l1结合至人pd-1,并优选地阻断人pd-l1和pd-l2二者结合至人pd-1。人pd-1氨基酸序列可在ncbi基因座号:np_005009中发现。人pd-l1和pd-l2氨基酸序列可分别在ncbi基因座号:np_054862和np_079515中发现。可用于本发明的任何各个方面和实施方案中的pd-1拮抗剂包括单克隆抗体(mab),或其抗原结合片段,其特异性地结合至pd-1或pd-l1,并优选地特异性地结合至人pd-1或人pd-l1。mab可以是人抗体、人源化抗体或嵌合抗体,并可包括人恒定区。在一些实施方案中,恒定区选自igg1、igg2、igg3和igg4恒定区,和在优选的实施方案,人恒定区是igg1或igg4恒定区。在一些实施方案中,抗原结合片段选自fab、fab'-sh、f(ab')2、scfv和fv片段。结合至人pd-1并可用于本发明的各个方面和实施方案中的mabs的实例,被描述于us7521051、us8008449和us8354509。可用作本发明的各个方面和实施方案的pd-1拮抗剂的特异性抗-人pd-1mabs包括:派姆单抗,一种具有在whodruginformation,vol.27,no.2,第161-162页(2013)中描述的结构的人源化igg4mab,纳武单抗(bms-936558),一种具有在whodruginformation,vol.27,no.1,第68-69页(2013)中描述的结构的人igg4mab;pidilizumab(ct-011,也称为hbat或hbat-1);和wo2008/156712中描述的人源化抗体h409a11、h409a16和h409a17。可用于本发明的各个方面和实施方案中的任一个的其他pd-1拮抗剂包括派姆单抗生物类似物或派姆单抗变体。如本文所用,“派姆单抗生物类似物”是指(a)由除merckandco.,inc.或其子公司以外的实体销售且(b)由任何国家的监管机构批准用于作为派姆单抗生物类似物销售的生物产品。在一个实施方案中,派姆单抗生物类似物包含作为药物物质的派姆单抗变体。在一个实施方案中,派姆单抗生物类似物具有与派姆单抗相同的氨基酸序列。如本文所用,“派姆单抗变体”意指包含重链和轻链序列的单克隆抗体,所述重链和轻链序列与派姆单抗中的那些相同,除了具有在位于轻链cdr之外的位置处的3个、2个或1个保守氨基酸取代和位于重链cdr之外的位置处的6个、5个、4个、3个、2个或1个保守氨基酸取代,例如,变体位置位于fr区或恒定区中。换句话说,派姆单抗和派姆单抗变体包含相同的cdr序列,但是由于分别在其全长轻链和重链序列中的不超过3个或6个其他位置处具有保守氨基酸取代而彼此不同。派姆单抗变体与派姆单抗就以下特性而言基本上相同:与pd-1的结合亲和力和阻断pd-l1和pd-l2中的每一种与pd-1结合的能力。结合至人pd-l1,且可用于本发明的任何各个方面和实施方案中的mabs的实例,被描述于wo2013/019906、w02010/077634a1和us8383796中。可用作在本发明的各个方面和实施方案中的pd-1拮抗剂的特异性抗-人pd-l1mabs包括mpdl3280a(atezolizumab)、bms-936559、medi4736、msb0010718c(avelumab)和分别包含wo2013/019906的seqidno:24和seqidno:21的重链和轻链可变区的抗体。可用于本发明的任何各个方面和实施方案中的其他pd-1拮抗剂包括免疫粘附素(immunoadhesin),其特异性地结合至pd-1或pd-l1,并优选地特异性地结合至人pd-1或人pd-l1,例如含有细胞外或融合于恒定区诸如免疫球蛋白分子的fc区的pd-l1或pd-l2的pd-1结合部分的融合蛋白。特异性地结合至pd-1的免疫粘附素的实例被描述于wo2010/027827和wo2011/066342中。可在本发明的治疗方法、药物和应用中用作pd-1拮抗剂的特异性融合蛋白包括amp-224(也称为b7-dcig),其是pd-l2-fc融合蛋白并结合至人pd-1。如本文所用,“探针”意指这样的寡核苷酸,其能够在严格杂交条件下与由表1中列出的目标基因表达的转录物特异性杂交,并且在一些优选实施方案中,在严格杂交条件下与表1中对于目标基因列出的特定转录物特异性杂交。如本文所用,“recist1.1反应标准”意指在eisenhauer等人,e.a.等人,eur.jcancer45:228-247(2009)中对靶病灶或非靶病灶提出的定义,适当时基于其中反应被测量的上下文而定。如本文所用,“参考ifn-γ基因特征评分”意指ifn-γ基因特征的评分,其已被确定以便将反应者中的至少大多数与具有与测试受试者相同的肿瘤类型且已经用pd-1拮抗剂治疗的受试者参考群体中的无反应者中的至少大多数分开。优选地,参考群体中的反应者中的60%、70%、80%或90%的至少任一者将具有高于所选参考评分的ifn-γ基因特征评分,而对于参考群体中的无反应者中的60%、70%、80%、90%或95%的至少任一者的ifn-γ基因特征评分将低于所选参考评分。在一些实施方案中,参考评分的阴性预测值大于阳性预测值。在一些优选实施方案中,参考群体中的反应者被定义为如通过recist1.1标准所测量实现部分反应(pr)或完全反应(cr)的受试者,且无反应者被定义为未实现任何recist1.1临床反应。在具体优选实施方案中,参考群体中的受试者用与被认为用于测试受试者的疗法实质上相同的抗pd-1疗法治疗,即使用相同或实质上相似的剂量方案施用相同的pd-1拮抗剂。当是指本文所述的肿瘤或任何其他生物材料时,“样品”意指已经从受试者中移取的样品;因此,本文所述的测试方法无一在受试者中或其上进行。当是指对用pd-1拮抗剂治疗的特异性抗肿瘤反应时,“反应者”意味着患者表现出抗肿瘤反应。“持续反应”意指在停止用治疗剂或本文描述的组合疗法治疗后的持续治疗效果。在一些实施方案,持续反应具有与治疗持续时间至少相同的持续时间,或至少为治疗持续时间的1.5、2.0、2.5或3倍。"组织切片"是指组织样品的一部分或一片,例如从正常组织或肿瘤的样品切下的一片薄的组织。如本文所用,"治疗"或"治疗"癌症意指向患有癌症或诊断患有癌症的受试者施用pd-1拮抗剂其他治疗剂,以达到至少一种积极治疗效果,诸如例如,减少癌细胞的数目,减少肿瘤大小或肿瘤负担,减少癌细胞浸润进入外周器官的速率,或减少肿瘤转移或肿瘤生长的速率。癌症的积极治疗效果可以许多方式维持(参见,w.a.weber,j.null.med.50:1s-10s(2009);eisenhauer等人,同上)。在一些优选实施方案中,使用recist1.1标准或irrc评估对pd-1拮抗剂的反应。在一些实施方案中,通过治疗有效量实现的治疗是pr、cr、pfs、dfs、or或os中的任一种。在一些优选实施方案中,本发明的基因特征生物标志物预测具有实体瘤的受试者是否可能实现pr或cr。有效治疗癌症患者的本文所述的疗法的剂量方案可根据因素诸如患者的疾病状态、年龄和体重,和疗法引起受试者的抗-癌反应的能力而变化。虽然本发明的治疗方法、药物和用途的实施方案不能在每一受试者中有效获得积极治疗效果,但在统计学上有意义的数目的受试者中应该达到这样的效果,如通过本领域已知的任何统计学检验诸如student’st-检验、卡方检验(chi2-test),根据mann和whitney的u-检验、kruskal-wallis检验(h-检验)、jonckheere-terpstra-检验和wilcoxon-检验所测定。"肿瘤"当其应用于诊断患有,或怀疑患有癌症的受试者时,是指任何大小的恶性或潜在恶性肿瘤或组织肿块,并包括原发性肿瘤和继发性肿瘤。实体瘤是通常不含有囊肿或液体区的组织的异常生长或肿块。不同类型的实体瘤以形成它们的细胞的类型来命名。实体瘤的实例是肉瘤、癌和淋巴瘤。白血病(血癌)一般不形成实体瘤(国立癌症研究所,癌症术语词典)。"肿瘤负担",也称为"肿瘤负荷",是指分布于整个身体的肿瘤物质的总量。肿瘤负担是指整个身体的癌细胞的总数或肿瘤的总大小,包括淋巴结和骨髓。肿瘤负担可通过本领域已知的各种方法,例如通过在从受试者中取出后,例如使用卡尺测量肿瘤的尺寸,或同时在体内使用成像技术,例如超声波、骨扫描、计算机断层扫描(ct)或磁共振成像(mri)扫描来确定。术语"肿瘤大小"是指可测量为肿瘤的长度和宽度的肿瘤总大小。肿瘤大小可通过本领域已知的各种方法,例如通过在从受试者中取出后,例如使用卡尺测量肿瘤的尺寸,或同时在体内使用成像技术,例如骨扫描、超声波、ct或mri扫描来确定。“一维irrc”是指在nishinom,giobbie-hurdera,garganom,sudam,ramaiyanh,hodifs.developingacommonlanguagefortumorresponsetoimmunotherapy:immune-relatedresponsecriteriausingunidimensionalmeasurements.clincancerres.2013;19(14):3936–3943)中描述的一套标准。这些标准利用每个病灶的最长直径(cm)。如本文所用,“可变区”或“v区”意指在不同的抗体之间的序列中是可变的igg链的片段。它延伸到在轻链中的kabat残基109和在重链中的kabat残基113。iii.基因表达平台的组成本发明人已经构建了上述表1中列出的57种临床反应基因和11种均一化基因的基因表达平台,并已进一步鉴定了上述表2中显示的7种基因特征,其在临床反应基因集合中表示,并与多种肿瘤类型中对派姆单抗的反应相关。由于存在这些基因特征中的每一个共同的几种基因,本发明人提出可以对于这些特征的每一种以及对于包含表1中的临床反应基因的2至57种的任何组合的其他基因特征推导预测对pd-1拮抗剂的反应的基因特征生物标志物。通过测量表1中每种基因的rna水平,然后对于仅每种目标基因特征中的基因从均一化的rna水平计算特征评分,单个基因表达分析系统可用于生成和评估不同基因特征和不同肿瘤类型的基因特征评分,以推导对pd-1拮抗剂的抗肿瘤反应的候选生物标志物。然而,本发明人考虑可以构建包含临床反应基因集合和均一化基因集合的其他基因表达平台,其提供与表1中显示的平台非常相似的功能性,条件是平台中的基因集合满足所有以下标准:(1)临床反应基因集合中的基因(a)与多于一种肿瘤类型中的对pd-1拮抗剂的抗肿瘤反应单独相关,和(b)共同生成在每种肿瘤类型中基本相似的协方差模式;(2)临床反应基因集合由约50至约60种基因组成,且临床反应基因中的约90%表现出与抗肿瘤反应正相关的肿瘤内rna水平,且临床反应基因中的约10%表现出与抗肿瘤反应负相关的肿瘤内rna水平;(3)均一化基因集合中的基因在不同肿瘤类型的多个样品中单独表现出低变异性的肿瘤内rna水平,且共同表现出跨越不同肿瘤类型中的临床反应基因的肿瘤内表达水平的范围的范围的肿瘤内rna水平;且(4)均一化基因集合由约10至约12种管家基因组成。可以遵循下面实施例2中描述的方法构建此类替代基因表达平台。可用于本发明的方法和系统中的替代基因表达平台包含表1中至少40、45、50或55种临床反应基因和不在表1中的一种或多种额外临床反应基因。在一个实施方案中,所述临床反应基因集合包含表1中55至57之间的任何数目的临床反应基因,且所述均一化基因集合包含表1中的至少9种均一化基因和不在表1中的至少一种管家基因。iv.基因特征评分的基于模型的推导可以通过使用整个临床反应基因集合或其任何子集作为输入协变量的集合至多变量统计模型来推导基因特征评分,所述多变量统计模型将使用拟合的模型系数(例如,逻辑或cox回归中的线性预测因子)来确定特征评分。多变量策略的一个具体实例是使用弹性网建模(zou&hastie,2005,j.r.statistsoc.b67(2):301-320;simon等人,2011,j.statisticalsoftware39(5):1-13),其为使用套索和脊回归的罚分之间的杂合体的罚分的回归方法,其具有交叉验证来选择罚分参数。因为预计大多数(如果不是全部)临床反应基因的rna表达水平是预测性的,所以在一个实施方案中,l1罚分参数可以设置得非常低,其有效地运行脊回归。多变量方法可以使用组合跨越癌症适应症的数据的荟萃分析或可以在单一癌症适应症内应用。在任一情况下,分析将使用特征基因的均一化肿瘤内rna表达水平作为输入预测因子,其中抗肿瘤反应作为因变量。此分析的结果算法上定义了来自模型拟合中使用的患者的肿瘤样品以及来自未来患者的肿瘤样品的特征评分,作为预期预测抗肿瘤反应的特征基因的均一化rna表达水平的乘法系数的数值组合。基因特征评分由特征基因的线性组合来确定,如在调整参数的选定值处的弹性网模型系数的最终估计值所规定。具体地,对于给定的肿瘤样品,将每种基因的估计系数乘以肿瘤样品中该基因的均一化rna表达水平,然后将所得产物相加以产生该肿瘤样品的特征评分。除弹性网之外的基于多变量模型的策略也可用于确定基因特征评分。此类基于模型的特征评分的替代方案是使用简单的平均方法,例如,每种肿瘤样品的特征评分将被定义为被认为与抗肿瘤反应正相关的那些特征基因的该样品的均一化rna表达水平的平均值减去被认为与抗肿瘤反应负相关的那些特征基因的该样品的均一化rna表达水平的平均值。v.本发明的基因特征和生物标志物的效用使用本文所述的系统和方法推导的基因特征和基因特征生物标志物可用于鉴定最可能实现临床得益于用pd-1拮抗剂治疗的癌症患者。该效用支持在各种研究和商业应用中使用此类生物标志物,包括但不限于其中基于患者是否对于基因特征生物标志物检测阳性或阴性来选择他们的pd-1拮抗剂的临床试验,用于确定患者的基因特征评分或用于将患者分类为基因特征生物标志物阳性或阴性的诊断方法和产品,涉及基于患者的基因特征评分或生物标志物状态来定制患者的药物疗法的个性化治疗方法,以及用于治疗基因特征生物标志物测试阳性的患者的包含pd-1拮抗剂的药物组合物和药物产品。本文请求保护的任何研究和商业应用的效用不要求基因特征生物标志物测试阳性的100%的患者实现对pd-1拮抗剂的抗肿瘤反应;其也不需要诊断方法或试剂盒在确定每个受试者中的生物标志物的存在或不存在中具有特定程度的特异性或灵敏度,其也不需要本文请求保护的诊断方法在对于每个受试者预测该受试者是否可能对pd-1拮抗剂具有有益反应中具有100%精确度。因此,本发明人在本文意欲术语“测定(determine)”、“测定(determining)”和“预测”不应当被解释为需要确定或特定的结果;相反,这些术语应当被解释为意味着请求保护的方法为至少大多数受试者提供精确的结果,或者任何给定受试者的结果或预测更可能是正确的,而非不正确的。优选地,由本发明的诊断方法提供的结果的准确度是技术人员或管理机构会认为适合于其中使用该方法的特定应用的精确度。类似地,请求保护的药物产品和治疗方法的效用不要求在每个癌症患者中产生请求保护的或期望的效果;所有需要的是,临床医生当应用他或她与所有适用规范一致的专业判断时,决定根据请求保护的方法或用请求保护的组合物或药物产品实现治疗给定患者的请求保护的效果的机会。a.针对基因特征和生物标志物鉴定肿瘤样品在从受试者移取的肿瘤组织的样品中测定基因特征评分。肿瘤可以是原发性的或复发性的,并且可以是任何类型(如上所述),任何分期(例如,分期i、ii、iii或iv或其他分期系统的等效方案)和/或组织学。受试者可以具有任何年龄、性别、治疗史和/或缓解的程度和持续时间。所述肿瘤样品可以通过多种程序获得,包括但不限于手术切除、抽吸或活检。可以将组织样品切片作为新鲜样品测定;或者,组织样品可以被冷冻用于进一步切片。在一些优选实施方案中,通过固定和包埋在石蜡等中来保存组织样品。肿瘤组织样品可以通过常规方法固定,其中固定长度取决于组织样品的大小和使用的固定剂。中性缓冲的福尔马林、戊二醛、布林试剂和多聚甲醛是固定剂的非限制性实例。在优选实施方案中,组织样品用福尔马林固定。在一些实施方案中,将固定的组织样品也包埋在石蜡中以制备ffpe组织样品。通常,将组织样品固定,并通过上升系列的醇脱水,渗透并用石蜡或其他切片介质包埋,使得可以将组织样品进行切片。或者,首先将肿瘤组织样品切片,然后固定各个切片。在一些优选实施方案中,使用约3-4毫米、且优选4微米的ffpe组织切片测定肿瘤的基因特征评分,将所述ffpe组织切片在显微镜载片上封固和干燥。一旦已经获得肿瘤组织的合适样品,就将其分析以针对表1中的每种基因或从其中推导的基因特征定量rna表达水平。如本文所用的短语“测定基因的rna表达水平”是指检测和定量从该基因转录的rna。术语“rna转录物”包括从基因转录的mrna和/或其特异性剪接变体和/或此类mrna和剪接变体的片段。在一些实施方案中,表1基因的rna转录物包含表1中所列的靶区域。本领域技术人员将理解,可以使用多种方法从组织样品中分离rna用于分析。例如,可以通过在异硫氰酸胍中均质化和酸性酚-氯仿萃取而从冷冻组织样品分离rna。商业试剂盒可用于从ffpe样品分离rna。如果肿瘤样品是载玻片上的ffpe组织切片,则可能对全细胞裂解物而不是分离的总rna进行基因表达分析。这些裂解物可以如下面实施例1中所述制备。本领域技术人员还意识到可用于检测和定量分离的rna或全细胞裂解物内rna转录物水平的几种方法。定量检测方法包括但不限于阵列(即微阵列),定量实时pcr(rt-pcr),多重测定,核酸酶保护测定和northern印迹分析。通常,此类方法采用与待检测的每种转录物的一部分互补的标记探针。用于这些方法中的探针可以容易地基于已知的基因序列和由其表达的转录物设计。在一些实施方案中,设计用于检测表1中的基因的转录物的探针以便与表1中鉴定的该基因的靶区域特异性杂交。探针的合适标记物是众所周知的,且包括例如荧光、化学发光和放射性标记物。在一些实施方案中,针对表1中的基因的表达或从其推导的基因特征测定肿瘤样品,采用使用基于核酸序列的扩增(nasba)与分子信标检测分子的组合实时检测和定量rna水平。nasba描述于例如comptonj.,nature350(6313):91-92(1991)。nasba是一种单步等温rna特异性扩增方法。通常,所述方法涉及以下步骤:将rna模板提供给反应混合物,其中第一引物在模板的3'端附接至其互补位点;逆转录酶合成相反的互补dna链;rna酶h破坏rna模板(rna酶h仅破坏rna-dna杂合体中的rna,但不破坏单链rna);第二引物附接至dna链的3'末端,且逆转录酶合成dna的第二链;且t7rna聚合酶结合双链dna并产生可在步骤1中再次使用的互补rna链,使得反应是循环的。在其他实施方案中,测定形式是基于flap内核酸酶的形式,诸如invader™测定法(thirdwavetechnologies)。在使用入侵者方法的情况下,制备含有对靶位点3'的区域特异性的序列的入侵者探针和含有对模板的靶位点5'的区域特异性的序列和不相关的flap序列的主要探针。然后允许切割酶在这些探针、靶分子以及含有与flap序列互补的序列的fret探针和用荧光染料和猝灭剂两者标记的自身互补序列存在的情况下起作用。当主要探针与模板杂交时,入侵者探针的3'末端穿透靶位点,并且该结构被切割酶切割,导致flap的解离。flap结合至fret探针,且荧光染料部分被切割酶切割,导致荧光的发射。在还有其他实施方案中,测定形式采用用支链dna(quantigene™,panomics)或hybridcapture™(digene)的直接mrna捕获。适合于测量本发明的基因表达平台中的基因表达的阵列技术的一个实例是由htgmolecular,tucsonarizona销售且由martel,r.r.,等人,assayanddrugdevelopmenttechnologies1(1):61-71,2002描述的arrayplate™测定技术。简而言之,该技术将核酸酶保护测定与阵列检测相组合。微板孔中的细胞进行核酸酶保护测定。在结合靶向的mrna种类的探针存在的情况下裂解细胞。在添加si核酸酶后,过量的探针和未杂交的mrna被降解,使得仅保留mrna:探针双链体。碱性水解破坏双链体的mrna组分,使探针完整。添加中和溶液后,将处理的细胞培养板的内容物转移至另一个arrayplate™,其被称为程序化的arrayplate™。arrayplates™在每个孔的底部含有16-元件阵列。每个阵列元件含有从一个测定至下一个测定保持相同的位置特异性锚定寡核苷酸。16个锚中的每一个的结合特异性用称为程序性接头寡核苷酸的寡核苷酸修饰,所述程序性接头寡核苷酸在一个末端与锚互补,并且另一个末端与核酸酶保护探针互补。在杂交反应期间,通过固定的程序性接头捕获从培养板转移的探针。捕获的探针通过与检测接头寡核苷酸杂交来标记,所述检测接头寡核苷酸进而用并入过氧化物酶的检测缀合物来标记。所述酶被提供有化学发光底物,并且酶产生的光被捕获在数字图像中。在阵列元件的光强度是原始细胞中存在的相应靶mrna的量的量度。通过进一步实例的方式,dna微阵列可用于测量基因表达。简而言之,dna微阵列,也称为dna芯片,是以定义模式布置在固定支持物上的dna片段(诸如合成寡核苷酸)的微观阵列,其中它们易于通过标准杂交方法进行分析(参见schena,bioessays18:427(1996))。示例性微阵列及其制造和使用的方法记载于t.r.hughes等人,naturebiotechnology9:342-347(2001)。许多不同的微阵列构型及其产生方法是本领域技术人员已知的,且公开于美国专利号:5,242,974;5,384,261;5,405,783;5,412,087;5,424,186;5,429,807;5,436,327;5,445,934;5,556,752;5,405,783;5,412,087;5,424,186;5,429,807;5,436,327;5,472,672;5,527,681;5,529,756;5,545,531;5,554,501;5,561,071;5,571,639;5,593,839;5,624,711;5,700,637;5,744,305;5,770,456;5,770,722;5,837,832;5,856,101;5,874,219;5,885,837;5,919,523;6,022,963;6,077,674;和6,156,501;shena,等人,tibtech6:301-306,1998;duggan,等人,nat.genet.2:10-14,1999;bowtell,等人,nat.genet.21:25-32,1999;lipshutz,等人,nat.genet.21:20-24,1999;blanchard,等人,biosensorsandbioelectronics77:687-90,1996;maskos,等人,nucleicacidsres.2:4663-69,1993;和hughes,等人,nat.biotechnol.79:342-347,2001。描述在各种应用中使用阵列的方法的专利包括:美国专利号5,143,854;5,288,644;5,324,633;5,432,049;5,470,710;5,492,806;5,503,980;5,510,270;5,525,464;5,547,839;5,580,732;5,661,028;5,848,659;和5,874,219;其公开内容通过引用并入本文。在一个实施方案中,可在固相支持物上合成寡核苷酸阵列。示例性的固相支持物包括玻璃、塑料、聚合物、金属、类金属、陶瓷、有机物等。采用芯片掩蔽技术和光防护化学,可产生核酸探针的有序阵列。这些阵列,例如称为“dna芯片”或非常大规模的固化聚合物阵列(“vlsipstm”阵列),在约1平方厘米到几个平方厘米面积的基板上可包含数百万个指定探针区域,从而并入几个到几百万个探针(参见例如,美国专利5,631,734)。为了比较表达水平,在足以使靶核酸与阵列上的探针之间的结合的条件下使标记的核酸与阵列接触。在一个实施方案中,可选择杂交条件以提供所需的杂交特异性水平;也就是说,足以使标记的核酸与微阵列上的探针之间发生杂交的条件。杂交可在允许基本上特异性杂交的条件下进行。核酸的长度和gc含量将决定热熔点,因此获得探针与靶核酸的特异性杂交所必需的杂交条件。这些因素是本领域技术人员熟知的,也可在测定中测试。核酸杂交的通用指导可参见tijssen,等人(laboratorytechniquesinbiochemistryandmolecularbiology,vol.24:hybridizationwithnucleicacidprobes,p.tijssen,编辑;elsevier,n.y.(1993))。上述方法将导致在阵列表面形成标记的靶核酸的杂交模式。所得标记的核酸的杂交模式可显现或者可以多种方法检测,基于靶核酸特定的标记来选择特定的检测方法。代表性的检测方法包括:闪烁计数、放射自显影、荧光测量、比色测定、光发射测量、光散射等。一种此检测方法采用市售的阵列扫描仪(affymetrix,santaclara,calif.),例如,417®阵列仪、418®阵列扫描仪或agilentgenearray®扫描仪。该扫描仪由装有界面及易用软件工具的计算机系统所控制。输出结果可直接输入多种软件应用或直接由其读取。示例性扫描装置描述于例如美国专利号5,143,854和5,424,186。用于测量表1中列出的基因的转录物丰度的优选测定方法利用由nanostring®technologies(seattle,washingtonusa)销售的ncounter®分析系统。由geiss等人,naturebiotechnol.2(3):317-325(2008)描述的该系统利用一对探针,即捕获探针和报告探针,其各自包含与待检测的转录物互补的35至50碱基序列。所述捕获探针额外包括与固定标签(例如,允许复合物被固定用于数据收集的亲和力标签)偶联的短的共同序列。所述报告探针额外包括可检测的信号或标记物,例如,与颜色编码的标签偶联。在杂交后,从样品除去过量的探针,并将杂交的探针/靶复合物比对,并经由药筒中的亲和力或其他标签进行固定。然后分析样品,例如使用数字分析仪或适用于此目的的其他处理器。通常,将每种转录物上的颜色编码的标签进行计数,并对于每种靶转录物制表,以产生样品中每种转录物的表达水平。该系统允许使用由nanostring设计的捕获和报告探针在单次多重测定中测量数百种独特基因转录物的表达。在测量本文所述的表1中的临床反应基因的表达中,将肿瘤样品中每种基因的绝对表达与对照进行比较;例如,所述对照可以分别是受试者合并物中每种基因的平均表达水平。然而,为了增加比较的灵敏度,优选以多种方式转换表达水平值。本文描述的基因表达平台中的临床反应基因的原始表达值可以通过以下任何进行均一化:通过管家基因的集合的平均rna水平,通过依赖于百分位数(例如第75百分位数)的全局均一化来针对共同参考分布百分位数均一化,或本领域技术人员已知的其他生物相关的均一化方法。例如,每种临床反应基因的表达水平可以通过基因表达平台中所有基因的平均rna表达水平或通过均一化基因(例如管家基因)的集合的平均表达水平来均一化。因此,在一个实施方案中,基因表达平台中的基因由探针的集合表示,并且每种基因的rna表达水平通过跨越所有表示的基因(即跨越本文描述的基因表达平台中的所有临床反应和均一化基因)的平均值或中值表达水平来均一化。在一个具体实施方案中,通过除以基因表达平台中的所有基因的rna表达的中值或平均水平来进行均一化。在另一个实施方案中,临床反应基因的rna表达水平通过均一化基因的集合的表达的平均或中值水平进行均一化。在一个具体实施方案中,所述均一化基因包含管家基因。在另一个具体实施方案中,通过将测量的水平除以均一化基因的中值或平均表达水平来实现临床反应基因的测量的rna表达水平的均一化。如果将基因特征中的单个基因的表达水平与肿瘤样品合并物中的相同基因的表达进行比较,则基因特征评分的灵敏度可增加。优选地,与样品合并物中每种特征基因的平均值或中值表达水平进行比较。这具有加重样品中的基因和整个合并物中的基因之间的表达的相对差异的作用,使得比较比单独使用绝对表达水平更灵敏且更可能产生有意义的结果。表达水平数据可以以任何方便的方式进行转换;优选地,所有基因的表达水平数据在取平均值或中值之前进行对数转换。在与合并物进行比较时,可以使用两种方法。首先,可以将样品中的特征基因的表达水平与合并物中的那些基因的表达水平进行比较,其中源自样品的核酸和源自合并物的核酸在单个实验过程期间杂交。此方法要求为每个比较或有限数目的比较生成新的核酸合并物,并且所述新的核酸合并物因此受可用核酸的量的限制。或者,并且优选地,合并物中的表达水平(无论是否是均一化的和/或转换的)存储在计算机上或计算机可读介质上,以用于与来自样品的各个表达水平数据(即,单通道数据)进行比较。当将受试者的肿瘤样品与标准品或对照进行比较时,将样品中的特定基因的表达值与标准品或对照中该基因的表达值进行比较。对于本发明的基因特征中的每种基因,针对单个样品中相对于标准品或对照的表达值生成log(10)比率。通过确定特征中基因的平均log(10)比率来计算基因特征的评分。如果测试样品的基因特征评分等于或大于该基因特征的预定阈值,则该样品被认为对于基因特征生物标志物是阳性的。预定阈值还可以是样品集合或用作标准品或对照的合并样品中的该基因特征的评分的平均值、中值或百分位数。本领域技术人员将认识到,除了log(10)比率之外,其他差异表达值可用于计算特征评分,只要该值表示基因的转录物丰度的客观测量。实例包括但不限于:xdev、误差加权的log(比率)和平均值减去的log(强度)。获得组织样品、从其中制备一个或多个组织切片用于测定基因表达、进行测定和将结果评分的每个步骤可以由分开的个体在不同的位置进行。例如,外科医生可以通过活检来从癌症患者的肿瘤获得组织样品,然后将组织样品送到病理实验室,并且实验室中的技术人员可以固定组织样品,然后制备一个或多个载片用于测定,每个载片具有单个组织切片。载片可以在制备后立即测定,或存储用于将来测定。制备组织切片的实验室可以进行测定或将载片送到不同的实验室以进行测定。针对基因特征将载片评分的技术人员可以对诊断实验室工作,或者可以是独立承揽人。或者,单个诊断实验室从受试者的医师或外科医生获得组织样品,然后进行制备组织切片、测定载片和计算组织切片的基因特征评分中涉及的所有步骤。在一些实施方案中,参与制备组织切片和针对基因特征或基因特征生物标志物测定组织切片的个体不知道正在测试其样品的受试者的身份;即,在送至实验室之前,以某种方式使实验室接受的样品隐名。例如,所述样品可以仅用编号或一些其他代码(“样品id”)来标识,并将测定的结果报告给使用样品id来排序测试的一方。在优选的实施方案中,仅个体或个体的医师知道受试者的身份和受试者的组织样品之间的关联。在一些实施方案中,在已获得测试结果之后,诊断实验室生成测试报告,其可以包含以下结果中的任何一种或两种:组织样品是生物标志物阳性或阴性,肿瘤样品的基因特征评分和该基因特征的参考评分。测试报告还可以包括在测定中分析其表达的基因的列表。在其他实施方案中,所述测试报告还可以包括如何解释结果用于预测受试者是否可能对pd-1拮抗剂反应的指导。例如,在一个实施方案中,如果测试的肿瘤样品来自黑色素瘤且具有等于或高于预定阈值的基因特征评分,则测试报告可以指示受试者具有与对用pd-1拮抗剂治疗的反应或更好反应相关的评分,而如果基因特征评分低于阈值,则测试报告指示该患者具有与对用pd-1拮抗剂治疗无反应或反应不良相关的评分。在一些实施方案中,所述测试报告是由诊断实验室制备的书面文件,并作为硬拷贝或经由电子邮件发送至患者或患者的医师。在其他实施方案中,所述测试报告由计算机程序产生,并显示在医师办公室内的视频监视器上。测试报告也可以包含将测试结果直接地口头传递给患者或患者的医师或医师办公室中的经授权的人员。类似地,测试报告可以包含医师在患者的文件中做出的测试结果的记录。针对本文描述的基因表达平台或基因特征中的基因的表达测定肿瘤样品可以使用为此目的专门设计的试剂盒进行。在一个实施方案中,所述试剂盒包含能够与表1中列出的靶转录物的集合杂交的寡核苷酸探针的集合。在另一个实施方案中,所述试剂盒包含能够与表1c中的18基因上-下特征中的基因和均一化基因的表1中列出的靶转录物的集合杂交的寡核苷酸探针的集合。寡核苷酸探针的集合可以包含在固体表面上的寡核苷酸的有序排列,所述固体表面诸如微芯片、二氧化硅珠(诸如来自illumina,sandiego,ca的beadarray技术)或载玻片(参见例如,wo98/20020和wo98/20019)。在一些实施方案中,所述寡核苷酸探针以液体或干燥形式提供于一种或多种组合物中。本发明试剂盒中的寡核苷酸能够与多核苷酸(诸如例如,rna转录物或由其生成的cdna)的靶区域特异性地杂交。如本文所用,特异性杂交是指,在特定杂交条件下,寡核苷酸与靶区域形成反向平行的双链结构,而在相同杂交条件下,当与所述多核苷酸一起孵育时,不会与非靶区域形成这样的结构。试剂盒中每种寡核苷酸的组成和长度将取决于含有靶区域的转录物的性质以及待用寡核苷酸进行的测定的类型,并且由技术人员容易地确定。在一些实施方案中,试剂盒中的每种寡核苷酸是其靶区域的完美互补序列。如果一个分子的每个核苷酸与另一个分子的对应位置处的核苷酸互补,则称寡核苷酸是另一个核酸分子的“完美”或“完全”互补序列。尽管完美地互补的寡核苷酸对于检测表1基因的转录物而言是优选的,但考虑从完全互补性的偏离,其中这样的偏离不会阻止分子与如上面定义的靶区域特异性地杂交。例如,寡核苷酸探针可以在其5'末端或3'末端处具有一个或多个不互补的核苷酸,且探针的剩余部分与靶区域完全互补。或者,不互补的核苷酸可以散布在探针中,只要所得探针仍然能够与靶区域特异性地杂交。在一些优选的实施方案中,在严谨的杂交条件下,试剂盒中的每种寡核苷酸与其靶区域特异性地杂交。严谨的杂交条件是序列-依赖性的,且根据环境而变化。通常,将严谨的条件选择为,比特定序列在确定的离子强度和ph下的热解链点(tm)低约5℃。tm是50%的与靶序列互补的探针与靶序列平衡地杂交时的温度(在定义的离子强度、ph和核酸浓度下)。由于靶序列通常过量存在,在tm,50%的探针被平衡地占据。通常,严谨的条件包括:对于短寡核苷酸探针(例如,10-50个核苷酸)而言,至少约0.01-1.0m钠离子浓度(或其他盐)的盐浓度,在ph7.0-8.3,且温度是至少约25℃。通过加入去稳定剂诸如甲酰胺,也可以实现严谨的条件。例如,5xsspe(750mmnacl、50mm磷酸钠、5mmedta、ph7.4)和25-30℃温度的条件适合于等位基因-特异性的探针杂交。其他严谨的条件可见于:molecularcloning:alaboratorymanual,sambrook等人,coldspringharborpress,coldspringharbor,ny(1989),第7、9和11章,以及nucleicacidhybridization,apracticalapproach,haymes等人,irlpress,washington,d.c.,1985。严谨的杂交条件的一个非限制性实例包括:在4x氯化钠/柠檬酸钠(ssc)中在约65-70℃杂交(或者可替代地,在4xssc+50%甲酰胺中在约42-50℃杂交),随后在1xssc中在约65-70℃的一次或多次洗涤。高度严谨的杂交条件的一个非限制性实例包括:在1xssc中在约65-70℃杂交(或者可替代地,在1xssc+50%甲酰胺中在约42-50℃杂交),随后在0.3xssc中在约65-70℃的一次或多次洗涤。降低严谨性的杂交条件的一个非限制性实例包括:在4xssc中在约50-60℃杂交(或者可替代地,在6xssc+50%甲酰胺中在约40-45℃杂交),随后在2xssc中在约50-60℃的一次或多次洗涤。本发明也意图涵盖具有在上面列举的值之间的范围(例如,在65-70℃或在42-50℃)的严谨性条件。在杂交和洗涤缓冲液中,可以用sspe(1xsspe是0.15mnac1,10mmnah2po4和1.25mmedta,ph7.4)替换ssc(1xssc是0.15mnacl和15mm柠檬酸钠);在杂交结束后,每次洗涤进行15分钟。预测长度小于50个碱基对的杂合体的杂交温度应当比杂合体的解链温度(tm)低5-10℃,其中tm根据下述方程来确定。对于长度小于18个碱基对的杂合体,tm(℃)=2(a+t碱基的数目)+4(g+c碱基的数目)。对于长度在18至49个碱基对之间的杂合体,tm(℃)=81.5+16.6(log10[na+])+0.41(%g+c)-(600/n),其中n是杂合体中的碱基数目,且[na+]是杂交缓冲液中钠离子的浓度(1xssc的[na+]=0.165m)。本发明试剂盒中的寡核苷酸可以包括核糖核苷酸、脱氧核糖核苷酸和无环的核苷酸衍生物和其他功能上等效的衍生物的任何磷酸化状态。或者,所述寡核苷酸可以具有无磷酸酯的主链,所述主链可以包含连接诸如羧甲基、乙酰胺化物(acetamidate)、氨基甲酸酯、聚酰胺(肽核酸(pna))等(varma,于molecularbiologyandbiotechnology,acomprehensivedeskreference,meyers编,第617-20页,vchpublishers,inc.,1995)。使用本领域已知的任何合适的方法,通过化学合成,可以制备寡核苷酸,或者可以从生物样品衍生寡核苷酸,例如,通过限制性消化。根据本领域已知的任何技术,寡核苷酸可以含有可检测的标记物,包括使用放射性标记物、荧光标记物、酶标记物、蛋白、半抗原、抗体、序列标签等。试剂盒中的寡核苷酸可以作为分析物特异性的试剂(asr)来生产和销售,或可以是批准的诊断装置的构成组分。本发明的试剂盒还可以含有其他试剂,诸如杂交缓冲液和试剂,以检测何时已发生与特异性靶分子的杂交。检测试剂可以包括生物素-或荧光-标记的寡核苷酸和/或酶-标记的抗体以及当受酶作用时产生可检测的信号的一种或多种底物。技术人员将理解,用于执行测定的寡核苷酸和试剂的集合将提供在分开的容器中,所述容器放在试剂盒容器中(如果适当的话),以保持生物或化学活性,并实现在测定中的适当使用。在其他实施方案中,试剂盒中的每种寡核苷酸探针和所有其他试剂已经在设计用于定量ffpe肿瘤切片中的表1中的基因或表2中的基因特征中的基因和表1c中的均一化基因的肿瘤rna表达水平的测定中针对最佳性能进行质量测试。在一些实施方案中,所述试剂盒包括描述如何从定量的rna表达水平计算基因特征评分的指导手册。b.药物组合物、药物产品和治疗方案待通过本文描述的任何方法和产品治疗的个体是被诊断具有肿瘤的人受试者,并且受试者肿瘤的样品是可获得的或可获得用于测试使用本文所述的基因表达平台推导的基因特征生物标志物的存在或不存在。可以在受试者暴露于一种或多种治疗性治疗方案(诸如例如pd-1拮抗剂、化学治疗剂、放射疗法)之前和/或之后从受试者收集肿瘤组织样品。因此,可以在一段时间内从受试者收集肿瘤样品。所述肿瘤样品可以通过多种程序获得,包括但不限于手术切除、抽吸或活检。医师可以使用基因特征评分作为指导,以决定如何治疗已被诊断具有易于用pd-1拮抗剂或其他化学治疗剂治疗的癌症类型的患者。在开始用pd-1拮抗剂或其他化学治疗剂开始治疗之前,医师通常将安排诊断测试以确定从患者移除的肿瘤组织样品对于基因特征生物标志物是阳性还是阴性。然而,设想,医师可以在向个体施用第一剂量的pd-1拮抗剂或其他化学治疗剂之后的任何时间安排第一次或随后的诊断测试。在一些实施方案中,医师可以正在考虑是否用适合用于其肿瘤对基因特征生物标志物测试阳性的患者的药物产品治疗患者。例如,如果报告的评分等于或高于与对用pd-1拮抗剂治疗的反应或更好反应相关的预先指定的阈值评分,则用包括至少pd-1拮抗剂(任选地与一种或多种化学治疗剂组合)的治疗方案治疗患者,并且如果报告的基因特征评分低于与对用pd-1拮抗剂治疗无反应或反应不良相关的预先指定的阈值评分,则用不包括任何pd-1拮抗剂的治疗方案治疗患者。在决定如何使用基因特征测试结果来治疗任何个体患者中,医师还可以考虑其他相关情况,诸如患者的癌症分期、重量、性别和总体状况,包括将这些因素和基因特征生物标志物测试结果的组合输入有助于指导医生选择疗法和/或具有该疗法的治疗方案的模型。医师可以选择用包括pd-1拮抗剂和一种或多种额外治疗剂的组合疗法方案来治疗生物标志物测试阳性的患者。另外的治疗剂可以是,例如化学治疗剂、生物治疗剂(包括但不限于针对vegf、egfr、her2/neu、vegf受体、其他生长因子受体、cd20、cd40、cd-40l、gitr、ctla-4、ox-40、4-1bb和icos的抗体)、免疫原性剂(例如,减弱的癌细胞、肿瘤抗原、抗原递呈细胞诸如用肿瘤衍生的抗原或核酸脉冲的树突状细胞、免疫刺激细胞因子(例如,il-2、ifnα2、gm-csf),和用编码免疫刺激细胞因子(例如但不限于gm-csf)的基因转染的细胞。化疗剂的实例包括烷化剂诸如噻替派和环磷酰胺;烷基磺酸酯诸如白消安、英丙舒凡(improsulfan)和哌泊舒凡;氮杂环丙烷类诸如苯佐替派(benzodopa)、卡波醌、美妥替哌(meturedopa)和乌瑞替派(uredopa);乙撑亚胺类和甲基蜜胺类包括六甲蜜胺(altretamine)、三亚乙基蜜胺(triethlenemelamine)、三亚乙基磷酰胺、三亚乙基硫代磷酰胺和三甲基蜜胺(trimethylolomelamine);多聚乙酰类(acetogenins)(特别是布拉它辛(bullatacin)和布拉它辛酮(bullatacinone));喜树碱(包括合成的类似物托泊替康);苔藓抑素(bryostatin);callystatin;cc-1065(包括其阿多来新(adozelesin)、卡折来新(carzelesin)和比折来新(bizelesin)合成类似物);隐藻素(cryptophycin)(特别是隐藻素1和隐藻素8);多拉司他汀(dolastatin);多卡米星(duocarmycin)(包括合成类似物,kw-2189和cbi-tmi);软珊瑚醇(eleutherobin);水鬼蕉碱(pancratistatin);珊瑚类二萜(sarcodictyin);海绵素(spongistatin);氮芥类诸如苯丁酸氮芥、萘氮芥(chlornaphazine)、胆磷酰胺(cholophosphamide)、雌莫司汀、异环磷酰胺、二氯甲基二乙胺、氧化二氯甲基二乙胺盐酸盐、美法仑、新恩比兴(novembichin)、苯乙酸氮芥胆甾醇酯(phenesterine)、泼尼氮芥、曲磷胺、尿嘧啶氮芥;亚硝基脲类,诸如卡莫司汀、氯脲菌素(chlorozotocin)、福莫司汀、洛莫司汀、尼莫司汀、雷莫司汀(ranimustine);抗生素,诸如烯二炔抗生素类(例如,加利车霉素(calicheamicin),特别是加利车霉素γ1i和加利车霉素phii1,参见例如agnew,chem.intl.ed.engl.,33:183-186(1994);达内霉素(dynemicin),包括达内霉素a;双磷酸盐类,诸如氯膦酸(clodronate);埃斯波霉素(esperamicin);以及新制癌菌素发色团和相关色蛋白烯二炔类抗生素发色团)、阿克莱诺霉素(aclacinomysin)、放线菌素d、奥瑟霉素(authramycin)、偶氮丝氨酸(azaserine)、博莱霉素(bleomycin)、放线菌素c、carabicin、洋红霉素(caminomycin)、嗜癌霉素(carzinophilin)、色霉素(chromomycinis)、更生霉素、道诺霉素、地托比星(detorubicin)、6-二氮杂-5-氧代-l-正亮氨酸、多柔比星(包括吗啉代-多柔比星、氰基吗啉代-多柔比星、2-吡咯啉子基(pyrrolino)-多柔比星和脱氧多柔比星)、表柔比星、依索比星、伊达比星、麻西罗霉素、丝裂霉素类诸如丝裂霉素c、麦考酚酸、诺加霉素、橄榄霉素、培洛霉素(peplomycin)、泊非霉素(potfiromycin)、嘌呤霉素、三铁阿霉素(quelamycin)、罗多比星(rodorubicin)、链霉黑素、链脲菌素、杀结核菌素、乌苯美司(ubenimex)、净司他丁(zinostatin)、佐柔比星(zorubicin);抗代谢药,诸如甲氨蝶呤和5-氟尿嘧啶(5-fu);叶酸类似物,诸如二甲叶酸、甲氨蝶呤、蝶罗呤(pteropterin)、三甲曲沙;嘌呤类似物,诸如氟达拉滨、6-巯基嘌呤、硫咪嘌呤(thiamiprine)、硫鸟嘌呤;嘧啶类似物,诸如安西他滨、阿扎胞苷(6-azacitidine)、6-氮尿苷、卡莫氟、阿糖胞苷、双脱氧尿苷、去氧氟尿苷(doxifluridine)、依诺他滨(enocitabine)、氟尿苷(floxuridine);雄激素类,诸如二甲睾酮、屈他雄酮丙酸盐、环硫雄醇(epitiostanol)、美雄烷(mepitiostane)、睾内酯;抗肾上腺药,诸如氨基格鲁米特、米托坦、曲洛司坦(trilostane);叶酸补充剂,诸如亚叶酸;醋葡醛内酯(aceglatone);醛磷酰胺糖苷;氨基乙酰丙酸;恩尿嘧啶(eniluracil);安吖啶(amsacrine);贝塔布辛(bestrabucil);比生群(bisantrene);伊达曲仙(edatraxate);德弗法明(defofamine);秋水仙胺(demecolcine);地吖醌(diaziquone);伊弗尼辛(elfornithine);依利醋铵;埃博霉素(epothilone);依托格鲁(etoglucid);硝酸镓;羟基脲;香菇多糖;氯尼达明(lonidamine);美登素生物碱类(maytansinoids),诸如美坦辛(maytansine)和安丝菌素(ansamitocins);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫哌达醇(mopidamol);二胺硝吖啶(nitracrine);喷司他丁;蛋氨氮芥(phenamet);吡柔比星;洛索蒽醌(losoxantrone);鬼臼酸(podophyllinicacid);2-乙基酰肼;丙卡巴肼(procarbazine);雷佐生(razoxane);根霉素;西左非兰(sizofuran);锗螺胺(spirogermanium);细交链孢菌酮酸(tenuazonicacid);三亚胺醌(triaziquone);2,2′,2″-三氯代三乙胺;单端孢霉烯类毒素(trichothecenes)(特别是t-2毒素、verracurina,杆孢菌素(roridin)a和蛇形菌素(anguidine));乌拉坦(urethan);长春地辛(vindesine);达卡巴嗪(dacarbazine);甘露醇氮芥(mannomustine);二溴甘露醇(mitobronitol);二溴卫矛醇(mitolactol);哌泊溴烷(pipobroman);gacytosine;阿糖胞苷(“ara-c”);环磷酰胺;噻替派(thiotepa);紫杉烷(taxoid),例如紫杉醇和多西他赛;苯丁酸氮芥;吉西他滨;6-硫鸟嘌呤;巯基嘌呤;甲氨蝶呤;铂类似物,诸如顺铂和卡铂;长春碱;铂;依托泊苷(vp-16);异环磷酰胺;米托蒽醌;长春新碱;长春瑞滨;二盐酸米托蒽醌注射液(novantrone);替尼泊苷;依达曲沙;道诺霉素;氨基蝶呤;卡培他滨(xeloda);伊班膦酸盐(ibandronate);cpt-11;拓扑异构酶抑制剂rfs2000;二氟甲基鸟氨酸(dmfo);维a酸类,诸如维a酸;卡培他滨;以及上述任何药物的药学上可接受的盐、酸和衍生物。也包括用来调节或抑制作用于肿瘤的激素的抗-激素剂,诸如抗-雌激素和选择性雌激素受体调节剂(serms),包括例如他莫昔芬、雷洛昔芬、屈洛昔芬、4-羟基他莫昔芬、曲沃昔芬(trioxifene)、那洛昔芬(keoxifene)、ly117018、奥那司酮(onapristone)和托瑞米芬(toremifene)(fareston);抑制芳香酶的芳香酶抑制剂,其调节肾上腺中雌激素的产生,诸如例如4(5)-咪唑类、氨基格鲁米特、醋酸甲地孕酮、依西美坦(exemestane)、福美坦(formestane)、法倔唑(fadrozole)、伏氯唑(vorozole)、来曲唑和阿那曲唑(anastrozole);和抗-雄激素类,诸如氟他胺(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、亮丙瑞林和戈舍瑞林;以及上述任何药物的药学上可接受的盐、酸或衍生物。用于治疗生物标志物阳性患者的组合疗法中的每种治疗剂可或者单独或者根据标准制药实践以药物(在此也称为药用组合物)施用,所述药物包含治疗剂和一种或多种药学上可接受的载体、赋形剂和稀释剂。用于治疗生物标志物阳性患者的组合疗法中的每种治疗剂可共同(即,在同一药物中)、同时(即,分开的药物以任何次序,在一个紧接着另一个之后施用)或以任何次序依次施用。当在组合疗法中的治疗剂在不同的剂型(一种药剂是片剂或胶凝剂且另一种药剂是无菌液体)中和/或按照不同的给药时间表施用(例如至少每日施用的化学治疗剂和以较低频率施用,诸如每周1次、每两周1次或每三周1次施用的生物治疗剂)时,依次施用是特别是有用的。在一些实施方案中,组合疗法中的至少一种治疗剂使用相同的剂量方案(治疗的剂量、频率和持续时间)施用,该方案通常在所述药剂用作治疗相同的癌症的单一疗法时使用。在其他实施方案中,患者接受组合疗法中的至少一种治疗剂比当该药剂用作单一疗法时的总量更低,如较小的剂量、较低频率的剂量,和/或较短的治疗持续时间。用于治疗生物标志物阳性患者的组合疗法中的每种治疗剂可经口服或胃肠外施用,包括静脉内、肌内、腹膜内、皮下、直肠、局部和透皮施用途径。患者可在手术以除去肿瘤之前或之后施用pd-1拮抗剂,并可在放射疗法之前、期间或之后使用。在一些实施方案中,将pd-1拮抗剂施用于先前未用生物治疗剂或化疗剂治疗,即未接受过治疗(treatment-naïve)的患者。在其他实施方案中,将pd-1拮抗剂施用于在用生物治疗剂或化疗剂的先前治疗后不能获得持续反应,即经历过治疗的患者。包含pd-1拮抗剂的疗法通常被用来治疗大到足以通过触诊或通过本领域熟知的成像技术,诸如mri、超声波或cat扫描发现的肿瘤。在一些优选的实施方案中,疗法被用来治疗具有至少约200mm3、300mm3、400mm3、500mm3、750mm3或至多1000mm3的尺寸的晚期肿瘤。选择包含pd-1拮抗剂的疗法的剂量方案(在此也称为施用方案)取决于几个因素,包括实体的血清或组织转换率、症状的水平、实体的免疫原性和所治疗个体中的靶细胞、组织或器官的可及性。优选地,剂量方案使递送给患者的与可接受水平的副作用一致的pd-1拮抗剂的量最大化。因此,剂量量和给药频率部分取决于特定pd-1拮抗剂,待使用的任何其他治疗剂,和所治疗的癌症的严重性,和患者特征。选择适当剂量的抗体、细胞因子和小分子的指导是可获得的。参见,例如wawrzynczak(1996)antibodytherapy,biosscientificpub.ltd,oxfordshire,uk;kresina(ed.)(1991)monoclonalantibodies,cytokinesandarthritis,marceldekker,newyork,ny;bach(ed.)(1993)monoclonalantibodiesandpeptidetherapyinautoimmunediseases,marceldekker,newyork,ny;baert等人(2003)newengl.j.med.348:601-608;milgrom等人(1999)newengl.j.med.341:1966-1973;slamon等人(2001)newengl.j.med.344:783-792;beniaminovitz等人(2000)newengl.j.med.342:613-619;ghosh等人(2003)newengl.j.med.348:24-32;lipsky等人(2000)newengl.j.med.343:1594-1602;physicians'deskreference2003(physicians'deskreference,第57版);medicaleconomicscompany;isbn:1563634457;第57版(november2002)。适当的剂量方案的确定可通过临床医师,例如使用本领域已知或怀疑影响治疗或预测影响治疗的参数或因素进行,并将取决于例如,患者的临床史(例如先前疗法),待治疗的癌症的类型和分期和对组合疗法中的一种或多种治疗剂的反应的生物标志物。与pd-1拮抗剂组合使用的生物治疗剂可通过连续输注,或通过每隔一段时间的剂量施用,例如每日一次、每隔日一次、每周3次或每周一次、每两周一次、每三周一次、每月一次、每两月一次等。总每周剂量一般为至少0.05μg/kg、0.2μg/kg、0.5μg/kg、1μg/kg、10μg/kg、100μg/kg、0.2mg/kg、1.0mg/kg、2.0mg/kg、10mg/kg、25mg/kg、50mg/kg体重或更多。参见,例如yang等人(2003)newengl.j.med.349:427-434;herold等人(2002)newengl.j.med.346:1692-1698;liu等人(1999)j.neurol.neurosurg.psych.67:451-456;portielji等人(20003)cancerimmunol.immunother.52:133-144。在采用抗-人pd-1mab作为pd-1拮抗剂的一些实施方案中,给药方案将包括在整个疗程中,以约14天(±2天)或约21天(±2天)或约30天(±2天)的时间间隔,以1、2、3、5或10mg/kg的剂量施用抗-人pd-1mab。在采用抗-人pd-1mab作为pd-1拮抗剂的其他实施方案中,给药方案将包括以约0.005mg/kg至约10mg/kg的剂量(随着患者内的剂量递增)施用抗-人pd-1mab。在其他递增剂量实施方案中,剂量之间的时间间隔将进行性缩短,例如在第一个和第二个剂量之间为约30天(±2天),在第二个和第三个剂量之间为约14天(±2天)。在某些实施方案中,对于第二个剂量之后剂量,给药时间间隔将是约14天(±2天)。在某些实施方案中,受试者将静脉内(iv)输注施用包含本文描述的任何pd-1拮抗剂的药物,并且这种施用可以是采用pd-1拮抗剂作为单一疗法方案或作为组合疗法的一部分的治疗方案的一部分。在本发明的一个优选实施方案中,pd-1拮抗剂是纳武单抗,其以选自以下的剂量静脉内施用:1mg/kgq2w、2mg/kgq2w、3mg/kgq2w、5mg/kgq2w、10mgq2w、1mg/kgq3w、2mg/kgq3w、3mg/kgq3w、5mg/kgq3w和10mgq3w。在本发明的另一个优选实施方案中,pd-1拮抗剂是派姆单抗,其以选自以下的剂量在液体药物中施用:200mgq3w、1mg/kgq2w、2mg/kgq2w、3mg/kgq2w、5mg/kgq2w、10mgq2w、1mg/kgq3w、2mg/kgq3w、3mg/kgq3w、5mg/kgq3w和10mgq3w或这些剂量中任一种的等效物(例如,派姆单抗的pk模型估计200mgq3w的固定剂量提供了与用2mg/kgq3w获得的那些一致的暴露)。在一些特别优选的实施方案中,派姆单抗作为液体药物施用,其包含在10mm组氨酸缓冲液(ph5.5)中的25mg/ml派姆单抗、7%(w/v)蔗糖、0.02%(w/v)聚山梨醇酯80,并在30分钟的时间段内通过iv输注施用选择剂量的药物。与任何其他治疗剂组合的派姆单抗的最佳剂量可以通过剂量递增来鉴定。本发明也提供药物,其包含如上所述的pd-1拮抗剂和药学上可接受的赋形剂。当pd-1拮抗剂是生物治疗剂,例如mab时,所述拮抗剂可在cho细胞中使用常规细胞培养和收获/纯化技术来生产。在一些实施方案中,包含作为pd-1拮抗剂的抗-pd-1抗体的药物可作为液体制剂提供或通过在使用之前用注射用无菌水重构冻干粉末而制备。wo2012/135408描述了适合用于本发明的包含派姆单抗的液体和冻干药物的制备。在一些优选实施方案中,包含派姆单抗的药物提供在含有约50mg派姆单抗的玻璃小瓶中。本发明的这些和其他方面,包括下面列出的示例性具体实施方案,将从本文中含有的教导显而易见。vi.本发明的示例性具体实施方案1.推导对于至少一种目标肿瘤类型预测对pd-1拮抗剂的抗肿瘤反应的基因特征生物标志物的方法,其包括:(a)在诊断具有肿瘤类型的患者组群中从每个患者获得治疗前肿瘤样品;(b)对于组群中的每个患者,获得用pd-1拮抗剂治疗后的抗肿瘤反应值;(c)对于基因表达平台中的每种基因,测量每个肿瘤样品中的原始rna水平,其中所述基因表达平台包含约50至约60种基因的临床反应基因集合和约10至约12种管家基因的均一化基因集合,且其中所述临床反应基因中的约90%表现出与抗肿瘤反应正相关的肿瘤内rna水平,且所述临床反应基因中的约10%表现出与抗肿瘤反应负相关的肿瘤内rna水平;(d)对于每个肿瘤样品,使用测量的均一化基因的rna水平,将临床反应基因的测量的原始rna水平各自均一化;(e)对于每个肿瘤样品和目标基因特征中的每种基因,使用该基因的预定义的乘法系数将均一化的rna表达水平加权;(f)对于每个患者,添加加权的rna表达水平以产生所述组群中每个患者的基因特征评分;和(g)将所有肿瘤样品的基因特征评分和组群中所有患者的抗肿瘤反应值进行比较,以选择分开患者群组以满足靶标生物标志物临床效用标准的基因特征评分的截止值。2.实施方案1的方法,其还包括将具有等于或大于所选截止值的基因特征评分的肿瘤类型的任何肿瘤样品指定为生物标志物阳性,和将具有低于所选截止值的基因特征评分的肿瘤类型的任何肿瘤样品指定为生物标志物阴性。3.针对肿瘤类型对pd-1拮抗剂的抗肿瘤反应的基因特征生物标志物的存在或不存在测试从诊断具有特定肿瘤类型的患者中移取的肿瘤样品的方法,其包括:(a)对于基因表达平台中的每种基因,测量肿瘤样品中的原始rna水平,其中所述基因表达平台包含约50至约60种基因的临床反应基因集合和约10至约12种管家基因的均一化基因集合,且其中所述临床反应基因中的约90%表现出与抗肿瘤反应正相关的肿瘤内rna水平,且所述临床反应基因中的约10%表现出与抗肿瘤反应负相关的肿瘤内rna水平;(b)使用测量的均一化基因的rna水平,将肿瘤类型的预定义的基因特征中的每种临床反应基因的测量的原始rna水平均一化,其中所述预定义的基因特征由所述临床反应基因中的至少2种组成;(c)使用预定义的乘法系数来将每个均一化的rna值加权;(d)添加加权的rna表达水平以生成基因特征评分;(e)将生成的评分与基因特征和肿瘤类型的参考评分进行比较;和(f)将肿瘤样品分类为生物标志物阳性或生物标志物阴性;其中如果生成的评分等于或大于参考评分,则将肿瘤样品分类为生物标志物阳性,且如果生成的评分小于参考评分,则将肿瘤样品分类为生物标志物阴性。4.用于针对肿瘤类型对pd-1拮抗剂的抗肿瘤反应的基因特征生物标志物的存在或不存在测试从诊断具有特定肿瘤类型的患者中移取的肿瘤样品的系统,其包括(i)用于测量基因表达平台中的每种基因的原始rna表达水平的样品分析仪,其中所述基因表达平台由临床反应基因的集合和均一化基因的集合组成,和(ii)计算机程序,其用于接收和分析测量的rna表达水平,以(a)使用测量的均一化基因的rna水平,将肿瘤类型的预定义的基因特征中的每种临床反应基因的测量的原始rna水平均一化;(b)使用预定义的乘法系数来将每个均一化的rna值加权;(c)添加加权的rna表达水平以生成基因特征评分;(d)将生成的评分与基因特征和肿瘤类型的参考评分进行比较;和(e)将肿瘤样品分类为生物标志物阳性或生物标志物阴性,其中如果生成的评分等于或大于参考评分,则将肿瘤样品分类为生物标志物阳性,且如果生成的评分小于参考评分,则将肿瘤样品分类为生物标志物阴性。5.上述实施方案中任一项的方法或系统,其中所述基因表达平台包含表1中至少40、45、50或55种临床反应基因和不在表1中的一种或多种额外临床反应基因。6.上述实施方案中任一项的方法或系统,其中所述临床反应基因集合包含表1中55和57之间的任何数目的临床反应基因,且所述均一化基因集合包含表1中的至少9种均一化基因和不在表1中的至少一种管家基因。7.上述实施方案中任一项的方法或系统,其中所述临床反应基因集合由表1a和表1b中的57种临床反应基因组成。8.上述实施方案中任一项的方法或系统,其中所述均一化基因集合由表1c中的基因组成。9.上述实施方案中任一项的方法或系统,其中所述抗肿瘤反应值选自部分反应、完全反应、最佳总体反应、无进展存活的持续时间、无病存活的持续时间、客观反应率和中值总体存活期。10.上述实施方案中任一项的方法或系统,其中所述抗肿瘤反应值是如通过recist1.1或irrc测量的部分反应或完全反应。11.上述实施方案中任一项的方法或系统,在所述患者已经用选自2、3、4、5、6、7、8、9和10的多个剂量的pd-1拮抗剂治疗后获得抗肿瘤反应值。12.上述实施方案中任一项的方法或系统,其中所述pd-1拮抗剂是纳武单抗、派姆单抗、派姆单抗生物类似物或派姆单抗变体。13.上述实施方案中任一项的方法或系统,其中在每q3w施用至少四个200mg剂量的派姆单抗之后获得抗肿瘤反应值。14.上述实施方案中任一项的方法或系统,其中所述目标基因特征或预定义的基因特征选自表2中列出的基因特征。15.上述实施方案中任一项的方法或系统,其中所述肿瘤类型是膀胱癌、乳腺癌、透明细胞肾癌、头/颈鳞状细胞癌、肺鳞状细胞癌、恶性黑色素瘤、非小细胞肺癌(nsclc)、卵巢癌、胰腺癌、前列腺癌、肾细胞癌、小细胞肺癌(sclc)、脂肪肉瘤、三阴性乳腺癌、急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)、慢性淋巴细胞白血病(cll)、慢性骨髓性白血病(cml)、弥漫性大b细胞淋巴瘤(dlbcl)、ebv阳性dlbcl、原发性纵隔大b细胞淋巴瘤、t细胞/组织细胞丰富的大b细胞淋巴瘤、滤泡性淋巴瘤、霍奇金淋巴瘤(hl)、套细胞淋巴瘤(mcl)、多发性骨髓瘤(mm)、骨髓细胞白血病-1蛋白(mcl-1)、骨髓增生异常综合征(mds)、非霍奇金淋巴瘤(nhl)、布基特氏淋巴瘤或小淋巴细胞淋巴瘤(sll)。16.上述实施方案中任一项的方法或系统,其中所述肿瘤类型是膀胱癌、结肠直肠癌、胃癌、头颈癌、黑色素瘤、非小细胞肺癌、卵巢癌、前列腺癌或肾癌。17.上述实施方案中任一项的方法或系统,其中所述肿瘤类型是膀胱癌、胃癌、头颈癌或黑色素瘤。18.上述实施方案中任一项的方法或系统,其中所述临床反应基因集合由表1a和1b中的57种临床反应基因组成,所述均一化基因集合由表1c或表1d中的基因组成,并且每种临床反应基因的预定义的乘法系数是(i)整数1或(ii)表3a中的集合1.1、集合1.2、集合2.2、集合2.3和集合2.4中所示的相应评分权重。19.测试从患者移取的肿瘤样品以生成与对pd-1拮抗剂的抗肿瘤反应相关的基因特征的特征评分的方法,其中所述方法包括:(a)对于基因特征中的每种基因测量肿瘤样品中的原始rna水平,其中所述基因特征选自表3b中所述的14-基因上-下特征和18-基因上-下特征;(b)使用表1c中所述的均一化基因的测量的rna水平将所选特征中的每种基因的测量的原始rna水平进行均一化;(c)将每种均一化rna值乘以表3b中对于所选特征所述的对应的评分权重以生成加权的rna表达值;和(d)添加加权的rna表达值以生成基因特征评分。20.实施方案18或19的方法,其中所述pd-1拮抗剂是纳武单抗、派姆单抗、派姆单抗生物类似物或派姆单抗变体。21.实施方案18至20中任一项的方法,其中所述抗肿瘤反应是无进展存活、部分反应或完全反应。22.实施方案18至21中任一项的方法,其中所述肿瘤样品来自选自肛门癌、胆管癌、膀胱癌、结肠直肠癌、食管癌、胃癌、头颈癌、卵巢癌和三阴性乳腺癌的癌症。23.实施方案22的方法,其中所述癌症在用除了pd-1拮抗剂之外的疗法治疗所述患者之后进展。24.实施方案1至23中任一项的方法或系统,其中所述pd-1拮抗剂是派姆单抗。25.用于定量基因特征中的基因表达的试剂盒,其中所述试剂盒包含能够与选自以下的靶转录物的集合杂交的寡核苷酸探针的集合:(a)表1a、1b和1c中列出的靶转录物(b)下表2.1中列出的靶转录物表2.1实施例实施例1.从ffpe组织分离总rna和随后使用nanostringncounter™系统的基因表达分析。本实施例描述了用于分析下列实施例中讨论的ffpe肿瘤样品中的基因表达的方法。从ffpe组织的载片分离总rna,用于在nanostringncounter™基因表达平台(nanostringtechnologies,seattle,wa)上分析。在rna提取之前,将整个组织切片从载片中大量切除/刮下,并转移至含有200μl100%乙醇的1.5ml标记的eppendorf管中。对于每种样品都使用新鲜的手术刀,以避免交叉污染的可能性。然后将样品脱蜡并使用推荐的方案在ffpe组织的ambion®recoveralltm总核酸分离试剂盒(目录号am1975)中用蛋白酶消化。使用上述ambionrecoveralltm试剂盒(目录号am1975)并遵循制造商推荐的说明书进行总rna提取。将总rna储存在-80℃,直到使用nanostringncounter™系统进行基因表达谱分析。实施例2.本发明的优选的基因表达平台的构建。本文的发明人基于该组基因能够预测不同肿瘤类型对派姆单抗治疗的临床结果的证据累积,为表1中显示的基因表达平台选择了57种临床反应基因。从680种基因(657种候选临床反应基因和23种管家基因)的发现集合鉴定所述基因。候选临床反应基因源自以下来源:1)源自人类肿瘤的大集合的基因表达数据库的来自与pd-l1共表达的免疫特征的基因;2)已知参与t细胞生物学、免疫调节、肿瘤浸润淋巴细胞(tils)和肿瘤相关巨噬细胞(tams)的细胞标志物的基因;和3)具有对用小鼠抗小鼠pd-1mab治疗响应的同基因肿瘤小鼠模型的特征。从nanostring获得用于测定肿瘤样品中该680发现基因集合的基因表达的探针的代码集。黑色素瘤组群的肿瘤样品中680发现集合的治疗前基因表达水平的分析导致生成被称为“pd-l1”、“ifng”和“扩增的免疫”特征的三种基因特征,其显示与对派姆单抗的抗肿瘤反应的统计学显著相关性。在第二个黑色素瘤组群中的证实假设测试表明,这三种特征各自显示与对派姆单抗治疗的抗肿瘤反应的统计学显著相关性。680-基因发现基因集合的进一步分析表明,参与抗原呈递和t细胞受体(tcr)信号传导的基因似乎是黑色素瘤样品中最具预测性特征中的一些,其实现一些临床终点的低错误发现率(fdr)。这些发现用于定义待添加至先前三种特征的额外特征,其用于在来自参与派姆单抗的临床试验的患者组群的治疗前头颈(h&n)肿瘤样品的独立集合中进一步测试。在测试h&n肿瘤样品之前,通过去除一些未发现有助于预测黑色素瘤患者的抗肿瘤反应的能力的个别基因来精炼先前定义的基因特征(“pd-l1”、“ifng”和“扩增的免疫”)。在该精炼之后,这三种特征由上表2的相应列中显示的基因组成。h&n研究的主要目标是进一步检验抗肿瘤反应和精炼的基因特征之间的相关性。在h&n肿瘤的独立集合中的假设检验证实,所有这些特征都是对派姆单抗的抗肿瘤反应的预测因子,如下表4中所示。表4:头颈癌中表2中所列的基因特征中的4种的假设检验结果。这四种预先指定的基因特征以及680基因发现集合中的657种候选临床反应基因的集合中的个体成员基因的分析显示对于头颈癌中的许多基因的一些非常低的估计错误发现率。因此,本文的发明人着手通过使用其他肿瘤类型的治疗前基因表达数据和派姆单抗治疗后的抗肿瘤反应数据来捕获额外的高度相关基因。最初,本发明人使用仅来自黑色素瘤和头颈组群的治疗前基因表达和治疗后反应数据来鉴定用于原型临床反应基因集合的51种基因的集合。以下列方式获得这51种基因。通过采用显示与临床结果的正相关的所有基因的集合来选择基因,所述临床结果或者:1.对于以下临床结果量度中的所有三种,对于h&n的发现基因集合实现估计fdr≤25%:最大%肿瘤收缩、最佳总体反应(bor)和pfs;或者2.对于以下临床结果量度中的所有三种,对于黑色素瘤的发现基因集合实现估计fdr≤33%:bor、pfs和os;或者3.包括在如表2中所示的pd-l1、ifng、扩增的免疫或tcr信号传导特征中。然后将该51种基因的初步集合作为膀胱和胃癌组群中预先指定的临床反应基因集合进行测试,并且发现与发现基因集合中的其余基因相比在相关性的统计学显著性方面显著不同。已经证实已经鉴定临床反应基因的高度预测性基因集合,进行荟萃分析研究,以使用来自用派姆单抗治疗的三种肿瘤类型的治疗前基因表达和临床反应数据来精炼该集合:胃、膀胱和头颈。聚焦于pfs作为抗肿瘤反应的量度,使用头颈、膀胱和胃组群,进行整个680基因发现平台的荟萃分析,其将来自这些组群的数据汇总在一起,以理解最相关的基因。临床反应基因的最终基因集合通过如下获得:1)首先通过p-值排序从荟萃分析中去除10种基因,其为没有出现在前100种最相关的特征中的初步51-基因列表的部分,并且也不是基因b2m或表2中任何特征的成员基因(在胃组群中到测试时已经鉴定的特征)和2)添加在所有三种适应症中通过多变量分析鉴定的16种新的预测基因。因此,鉴定57种基因的最终集合,向其中添加11种管家基因以得到表1中所示的68-基因表达平台。临床反应基因集合中反相关基因子集的存在旨在起到两个作用:作为基因特征的潜在成员和作为对照以检查与对pd-1拮抗剂的抗肿瘤反应相关的关键免疫模式如预期的那样起作用。通过在头颈癌组群中的对表1b中列出的负相关基因子集和表2中列出的mipfs7-基因特征进行基因表达模式的无监督聚类分析来评估该对照功能的效用。结果显示于图1中。通过在69个黑色素瘤肿瘤针对其他癌症类型的多发性肿瘤中分析所有表1临床反应基因或那些基因中的37个子集的均一化rna表达水平的协方差模式来研究该平台推导其他肿瘤类型的基因特征和基因特征生物标志物的潜在效用。分析的患者肿瘤样品和表1临床反应基因的数目显示于下表5中。37基因子集由以下组成:ccl5、ccr5、cd2、cd27、cd274、cd276、cd3e、cd3g、cd4、ctag1b、cxcl10、cxcl9、egfr、grap2、gzmb、gzmk、hla-dra、hla-e、ido1、ifng、ikzf3、il10r、il2rb、il2rg、irf8、lag3、lck、p2ry8、pdcd1lg2、psmb10、slc2a1、stat1、tigit、tnfrsf14、tnfsf13b、tslp和zap70。通过表1中11种均一化基因的平均值将rna表达水平进行均一化。表5:黑色素瘤相比于其他肿瘤类型中的临床反应基因的rna表达水平的协方差的评估。其他肿瘤类型肿瘤样品的数目临床反应基因的数目头颈癌4357膀胱癌2957胃癌3357非小细胞肺癌5837结肠直肠癌5537肾癌6637前列腺癌2857卵巢癌4837三阴性乳腺癌10857如图2a至2i中所表明,对于所检查的表1临床反应基因,协方差模式在很大程度上得到保留。实施例3.使用表1的基因表达平台的基因特征评分的基于模型的推导。对于40个头颈癌患者、29个膀胱癌患者和33个胃癌患者,对表1中的57临床反应基因集合的治疗后pfs时间和均一化的治疗前肿瘤内rna表达水平进行coxpfs弹性网荟萃分析。l1罚分被设置为0.001,以便在模型中包括所有57种临床反应基因(有效地是脊回归),并且使用交叉验证来选择l2罚分的值。除了项目捕获pfs分布中的指标特异性差异和患者表现状态的指标特异性影响,该模型还包括57种基因中的每一种的系数。在拟合该回归之前,管家均一化基因表达水平以其平均值为中心,并通过其标准偏差(在每个癌症指标中)进行标度。在图3的x-轴上绘制的最终特征评分是来自交叉验证拟合的危险函数的“线性预测因子”:有效地管家均一化基因(为中心和标度)的线性组合,其中加权由57种基因的估计模型系数指示(以及在相同图中绘制不同指标所必需的指标特异性模型项)。图3显示对于荟萃分析中使用的患者针对其pfs时间绘制的模型-推导的基因特征评分。还通过组群中的反应者状态比较胃组群的上述推导的基因特征评分,并且结果显示于图4中。图5显示在该胃癌组群中该基于模型的基因特征的潜在截止值的roc曲线。roc曲线下的面积为0.86,并且基于与(曲线上标记的)youden指数相关的统计值的截止值为:57%的ppv,95%的npv,和高于42%的截止值的患病率。然后可以在每种指标中使用由模型拟合指定的57种基因的线性组合,以通过使用抗肿瘤反应量度之一或经由如下文实施例4中所讨论的受试者操作特征(roc)曲线估计临床效用概况来选择适当的截止值。一旦使用这种基于模型的方法估计,基因特征中的每种基因的权重可以被用作系统的一部分,以便在未重新拟合模型的情况下(即权重被认为是固定的)计算未来患者的基因特征评分。实施例4.在推导自本发明的基因表达平台的基因特征评分上的截止值的推导。图6显示当潜在截止值被设置为越来越大的值时使用最佳总体反应(bor)作为抗肿瘤反应值的头颈癌中的ifng特征的基因特征评分的估计的临床诊断效用概况。ifng特征评分的经验分布和描述反应给出的特征评分的概率的逻辑回归模型的组合用于计算ppv(具有≥截止值的特征评分的患者中的反应率)、npv(具有<截止值的特征评分的患者中的无反应率)和特征评分≥截止值的患者的患病率的概况。该概况可用于理解选择给定截止值的含义。所以,例如,ifng基因特征评分的临床效用概况表明,~0.3的截止值将达到~90%npv,~40%ppv,并且导致h/n患者的~25%的生物标志物高亚组患病率。或者,~0.10的截止值将达到~92%npv,~33%ppv,和~40%的生物标志物高亚组患病率。roc曲线分析可以与该临床效用的评估相组合,以帮助选择截止值,并理解选择反应者和排除无反应者用于用pd-1拮抗剂治疗的灵敏度和特异性。本实施例表明如何可以利用表2中列出的基因特征、诸如ifng基因特征来产生评分,并设定区分癌症患者是否更可能受益于用pd-1拮抗剂治疗的截止值。如实施例3中所述的基于模型的基因特征评分也可以是向这种效用分析的输入。实施例5.表1的基因表达平台的示例性评分方法的推导。本实施例描述了表3中列出的特征评分权重的两个集合的推导和效用。每个评分权重集合具有在其各自的荟萃分析中包括的重叠的癌症组织学。对于两个集合,对评分方法的输入是表1中的57种个体临床反应基因的均一化rna表达水平的集合。测量的(例如,原始)rna水平通过如下均一化:对特征中的每种临床反应基因和表1c中的每种均一化基因进行测量的原始rna水平的log(10)转换,计算均一化基因的log10转换的rna水平的算术平均值,和从每种临床反应基因的log10转换的rna水平减去计算的平均值,并且这些均一化值(在指标内没有进一步均一化)是弹性网拟合的输入。此外,在下面所有情况下,使用的弹性网模型包括组织学、基线表现状态以及组织学和基线表现状态之间的相互作用的项(并且在模型估计期间,将弹性网下应用的罚分也应用于这些项)。使用来自mk-3475-012/keynote-012(以下称为keynote-012)的具有头颈(h&n)癌、胃癌和膀胱癌的患者推导评分方法的第一集合。本研究是一项1b期多组群研究,其正在研究派姆单抗(mk-3475)在具有晚期三阴性乳腺癌(tnbc)(组群a)、h&n癌症(组群b和b2)、晚期尿路上皮癌(组群c)或晚期胃癌(组群d)的患者中的安全性、耐受性和抗肿瘤活性。所有用于推导该评分算法的第一集合的患者均用10mg/kg派姆单抗治疗,每2周iv施用一次。使用来自keynote-012的具有h&n癌、胃癌、膀胱和三阴性乳腺癌的患者以及来自mk-3475-028/keynote-028(以下称为keynote-028)的具有肛门癌、胆管癌、结肠直肠癌、食管癌和卵巢癌的患者推导评分方法的第二集合。keynote-028是一项1b期研究,其被设计为评估施用于具有不可治愈的晚期pd-l1阳性实体瘤的参与者的派姆单抗的效力和安全性。keynote-028中的患者用10mg/kg派姆单抗治疗,每2周iv施用一次。评分集合1的描述:集合1.1.在弹性网拟合下推导的线性组合,其在具有交叉验证以确定l2罚分的无进展存活期(pfs)的cox荟萃分析中使用固定低水平的l1罚分。将在l1和l2罚分的选定值处来自最终coxpfs模型拟合的回归系数针对它们相应的基因相乘,然后将所得加权值相加以产生特征评分。回归系数的这些值,即权重,列于表3a中的集合1.1下。集合1.2.在弹性网拟合下推导的线性组合,其在具有交叉验证以确定l2罚分的最佳总体反应(bor)的逻辑回归荟萃分析中使用固定低水平的l1罚分。将在l1和l2罚分的选定值处来自最终逻辑模型拟合的回归系数针对它们相应的基因的均一化rna表达水平相乘,然后将所得加权值相加以产生特征评分。回归系数的这些值,即权重,列于表3a中的集合1.2下。使用来自keynote-012的三个癌症组群(h&n、胃和膀胱)鉴定集合1.1和1.2中的回归系数。为了测试这些评分权重集合可以生成预测对派姆单抗的抗肿瘤反应的特征评分的假设,应用这些评分权重集合来计算来自57基因特征的均一化rna值的特征评分,其已经在派姆单抗治疗之前对于从keynote-028患者取出肿瘤样品进行确定。如表6中所示,使用评分权重集合1.1或1.2获得的特征评分在具有各种癌症的来自keynote-028的独立患者集合中是预测性的。这些结果表明,使用集合1.1或集合1.2中的评分权重计算的特征评分将可用于推导其他癌症类型的基因特征生物标志物。表6:keynote-028患者中的57-基因特征评分的统计学显著性在从keynote-028获得临床反应数据前推导评分集合1。为了探索对这些加权集合的潜在改进,使用来自keynote-012和keynote-028的所有癌症类型和临床反应数据来鉴定和分析额外的评分集合。该分析中使用的来自keynote-012的临床反应数据集合包括在患者已接受更多派姆单抗剂量后获得的数据,而不是用于推导评分集合1的临床反应数据集。下面描述使用该分析推导的评分集合。评分集合2的描述:集合2.1.在弹性网拟合下推导的线性组合,其在cox无进展存活(pfs)荟萃分析中使用固定低水平的l1罚分,且使用交叉验证以确定l2罚分。将在l1和l2罚分的选定值处来自最终coxpfs模型拟合的回归系数针对它们相应的基因的均一化rna表达水平相乘,然后将所得加权值相加以产生特征评分。回归系数的这些值,即权重,列于表3a中的集合2.1下。集合2.2.在弹性网拟合下推导的线性组合,其在最佳总体反应的逻辑回归荟萃分析中使用固定低水平的l1罚分,且使用交叉验证以确定l2罚分。将在l1和l2罚分的选定值处来自最终逻辑模型拟合的回归系数针对它们相应的基因的均一化rna表达水平相乘,然后将所得加权值相加以产生特征评分。回归系数的这些值,即权重,列于表3a中的集合2.2下。在预期大多数基因与多种癌症类型对用派姆单抗治疗的抗肿瘤反应相关的前提下,使用低水平的l1罚分来推导评分集合1.1、1.2、2.1和2.2旨在允许所有57种临床反应基因的表达水平作为特征评分的一部分。用于鉴定反应的稳健的“交叉组织学”预测因子的替代策略是进一步减少来自表1的用于生成特征评分的临床反应基因的集合。将该方法应用于具有来自keynote-012和keynote-028的多种癌症类型的患者的组合临床反应数据,以搜索表1临床反应基因的特定子集,以及其在所有研究的癌症类型中显示稳健的预测值的特征评分。通过如下所述的评分权重集合2.3和2.4的推导来说明该方法。集合2.3.在弹性网拟合下推导的线性组合,其在cox无进展存活(pfs)荟萃分析中使用交叉验证来确定l1和l2罚分。将在l1和l2罚分的选定值处来自最终coxpfs模型拟合的回归系数针对它们相应的基因的均一化rna表达水平相乘,然后将所得加权值相加以产生特征评分。回归系数的这些值,即权重,列于表3a中的集合2.3下和表3b中的第2列中。集合2.4.在弹性网拟合下推导的线性组合,其在逻辑回归荟萃分析中使用交叉验证来确定l1和l2罚分。将在l1和l2罚分的选定值处来自最终逻辑模型拟合的回归系数针对它们相应的基因的均一化rna表达水平相乘,然后将所得加权值相加以产生特征评分。回归系数的这些值,即权重,列于表3a中的集合2.4下和表3b中的第3列中。如从表3b中的基因特征的检查显而易见,主要地,通过pfs和bor回归保留相同的基因,所述pfs和bor回归分别产生集合2.3和2.4的权重,其显示主要使用任一临床终点来选择相同的基因。不应将其他临床反应基因上的零权重解释为意味着这些基因的表达水平不与临床结果单独强烈相关,只是关于当所有基因都同时竞争以显示预测值时改善罚分的pfs回归荟萃分析设置中的预测,它们似乎没有超出用非零系数的那些来添加额外值。实施例6.使用评分权重集合计算的特征评分的临床效用。为了说明使用加权系数生成的特征评分的临床效用,图7和8显示使用集合1.1权重计算的作为特征评分上的推定截止值的函数的预期ppv和npv概况(在指标之间平均化)的估计值。使用组合的keynote-028和keynote-012数据的分层贝叶斯荟萃分析来计算这些预期概况,其中实曲线显示ppv的预期值的估计值(如通过较后中值捕获),且高于和低于曲线的虚线表明预期值上的90%可信区间的上限和下限。图6和7中的ppv和npv概况说明可能如何使用集合1.1权重计算的特征评分的潜在截止值和通过此类截止值暗示的临时效用量度(诸如ppv和npv)之间的预期关系来支持选择最小特征评分作为将患者指定为生物标志物阳性的截止值。这种截止值可以以预先指定的方式应用于癌症适应症,其中没有或几乎没有收集到将基因表达水平与对用pd-1拮抗剂治疗的临床反应相关联的数据。例如,这些预期临床效用概况的荟萃分析估计表明对于多种癌症类型有用的单一截止评分的两种一般可能性:•“低”截止值,其有利于npv,预期ppv接近30%,同时保持预期npv接近90%。•“高”截止值,其有利于ppv,预期ppv接近40%,同时保持预期npv接近85%。表3中列出的每个加权集合可以用于使用由此确定的特征评分来对一种或多种癌症类型进行临床效用概况的类似分析。图9至11显示三种不同癌症(食道、结肠直肠和肛门)的派姆单抗反应状态的特征评分的分布,其中使用集合1.1或集合2.4中的评分权重来计算特征评分。这些数据说明特征评分在对派姆单抗治疗的反应者和无反应者之间如何具有不同的分布。可以通过检查ppv和npv概况以及使用每个候选截止评分选择的患者的隐含患病率来为这些癌症类型中的任何一种或所有选择预测性截止特征评分。参考文献。本文引用的所有参考文献通过引用并入本文,如同各个独立的出版物、数据库条目(如,genbank序列或geneid条目)、专利申请或专利特别地和单独地指明通过引用并入本文的程度一样。申请人这种通过引用并入的陈述,根据37c.f.r.§1.57(b)(1),意欲涉及各个或每一个独立的出版物、数据库条目(例如,genbank序列或geneid条目)、专利申请或专利,其每一篇被清楚地鉴定为符合37c.f.r.§1.57(b)(2),即使这样的引用不是与通过引用并入的专门陈述直接相邻。包括在说明书中的通过引用并入的专门陈述,如果有的话,不以任何方式弱化这种通过引用并入的一般概述。本文参考文献的引用并不视为承认所述参考文献是涉及现有技术的,也不构成对这些出版物或文件的内容或日期的任何承认。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1