一种短链脱氢酶及其基因、重组表达载体、基因工程菌及其在虾青素手性中间体合成中的应用的制作方法
本发明属于生物化工技术领域,具体涉及一种短链脱氢酶及其基因,以及含有该基因的重组表达载体和重组表达转化体,以及该短链脱氢酶或含有该酶的重组细胞在虾青素手性中间体合成中的应用。
(二)
背景技术:
虾青素(Astaxanthin,3,3’-二羟基-4,4’-二酮基-β,β’-胡萝卜素)是自然界广泛存在的一种新型类胡萝卜素。虾青素是世界上最强的天然抗氧化剂之一,其抗氧化能力是其它类胡萝卜素的10倍以上,是维生素E的300~500倍;具有抗肿瘤、抗辐射、抗衰老、提高免疫力、抗光敏作用及机体显色等多种生物学功能,因此,被广泛应用于保健品、药品、化妆品、食品及饲料等的生产中。虾青素主要有三种不同的异构体型态,而抗氧化活性最强的是(3S,3’S)-构型的虾青素。
目前,虾青素主要获取方法包括化学合成、从甲壳纲动物的壳中提取和微生物发酵等。其中,化学合成的虾青素于上世纪80年代被美国FDA批准用于水产饲料添加剂;但是化学合成虾青素多种异构体的同时存在,不利于动物的消化吸收和体内沉积;此外,人们对化学合成虾青素食用安全性的疑虑一直未消除,对它的使用也仅限于饲料添加剂行业。相对于化学合成的虾青素,天然虾青素具有生产过程较为简单、产品中很少有非功能性异构体、功能丰富、容易被吸收和抗氧化活性强等优点,因此,天然虾青素的高效生产成为重要选择。然而,由于甲壳动物的甲壳中含有较高的几丁质和灰分,较低浓度的蛋白质和其他营养成分,限制了甲壳动物虾青素的提取和再利用。另一方面,虽然可通过菌种选育、发酵条件优化等多种途径提高微生物(红法夫酵母和雨生红球藻等)的虾青素的产量,但由于对合成虾青素的次级代谢机制研究不够深入,虾青素的产量一直未得到突破性的提高。
生物催化法由于立体选择性高、反应条件温和、环境友好等优点成为最受瞩目的医药及精细化学品绿色合成技术之一。因此,利用生物催化法高立体选择性的合成(3S,3’S)-虾青素的重要手性中间体,进而获得抗氧化活性最强的手性虾青素单体将具有重要意义。
(三)
技术实现要素:
本发明目的在于提供一种恶臭假单胞菌Pseudomonas putida短链脱氢酶基因及其重组短链脱氢酶,以及含有该基因的重组表达载体,重组表达转化体,该重组酶的制备方法,以及该短链脱氢酶或含有该酶的重组细胞在(3S,3’S)-虾青素手性中间体合成中的应用。
本发明采用的技术方案是:
本发明的第一方面提供一种短链脱氢酶,其氨基酸序列如序列表中SEQ ID NO:2所示。
本发明的短链脱氢酶来源于恶臭假单胞菌ATCC 12633(Pseudomonas putida ATCC 12633)。
任何对SEQ ID NO:2所示氨基酸序列中氨基酸经过缺失、插入或替换一个或几个氨基酸且具有短链脱氢酶活性的,仍属于本发明的保护范围。
本发明的第二方面提供一种短链脱氢酶基因,其(1)核苷酸序列如序列表中SEQ ID NO:1所示;或(2)编码氨基酸序列如序列表SEQ ID NO:2中所示的蛋白质。
该基因是通过PCR技术从恶臭假单胞菌ATCC 12633(Pseudomonas putida ATCC 12633)基因组中克隆获得。具体制备方法为:根据Genbank中收录的短链脱氢酶的基因序列设计合成引物,较佳的,上游引物为:GCTGAGGATCCATGGCTAATGCAAAAACCGC;下游引物为:GCATCCTCGAGTCACCAGACCAAGGGTTCGC;然后以Pseudomonas putida ATCC 12633基因组DNA为模板,利用聚合酶链式反应(PCR)进行基因扩增,获得全长687bp的短链脱氢酶基因序列。该短链脱氢酶基因核苷酸序列如序列表中SEQ ID No:1所示。该序列编码的蛋白质的氨基酸序列如序列表中SEQ ID No:2所示。
如本领域技术人员所知,本发明的短链脱氢酶基因的核苷酸序列也可以是编码序列表中SEQ ID No:2所示的氨基酸序列组成的蛋白质的其它任何核苷酸序列。
任何对SEQ ID NO:1所示核苷酸序列进行一个或多个核苷酸的取代、缺失或插入处理获得的核苷酸序列,只要其与核苷酸具有90%以上的同源性,均属于本发明的保护范围。
本发明的第三方面提供一种包含本发明的短链脱氢酶基因的核苷酸序列的重组表达载体。这些重组载体可通过本领域常规方法将本发明的短链脱氢酶核苷酸序列连接于各种载体上构建而成。所述载体可为本领域常规的各种载体,如各种质粒、噬菌体或病毒载体等,优选pET-30a。较佳地,可通过下述方法获得本发明的重组表达载体:将通过PCR扩增所得的短链脱氢酶基因产物Ppysdr与载体pET-30a连接构建本发明的短链脱氢酶基因重组表达质粒pET30a-Ppysdr。
本发明的第四方面提供一种表达重组短链脱氢酶的基因工程菌,可通过将本发明的重组表达载体转化至宿主微生物中获得。所述的宿主微生物可为本领域常规的各种宿主微生物,只要满足重组表达载体可以稳定自我复制且所携带的本发明的短链脱氢酶基因可以有效表达。本发明优选大肠杆菌,更优选大肠杆菌E.coli BL21(DE3)。将重组质粒pET30a-Ppysdr转化至E.coli BL21(DE3)中,获得工程菌E.coli BL21(DE3)/pET30a-Ppysdr。
本发明的第五方面提供一种重组短链脱氢酶的制备方法,包括如下步骤:培养本发明的重组表达转化体,诱导获得重组短链脱氢酶。其中,所述的培养重组表达转化体所用的培养基可以是本领域可使转化体生长并产生本发明的短链脱氢酶的培养基,优选LB培养基:蛋白胨10g/L,酵母膏5g/L,氯化钠10g/L,pH 7.2。培养方法和培养条件没有特殊限制,只要使转化体能够生长并产生短链脱氢酶即可。优选下述方法:将本发明涉及的重组大肠杆菌E.coli BL21(DE3)/pET30a-Ppysdr接种至含卡那霉素的LB培养基中培养,当培养液的光密度OD600达到0.5~0.7时,在终浓度为0.1~1.0mM异丙基-β-D-硫代吡喃半乳糖苷(IPTG)的诱导下,即可高效表达本发明的重组短链脱氢酶。
本发明的第六方面提供所述短链脱氢酶或其重组细胞在不对称催化潜手性酮(I)制备(3S,3’S)-虾青素手性中间体(II)中的应用。
具体的,所述的应用为:以潜手性酮(I)为底物,以所述短链脱氢酶或其重组细胞为催化剂,以NADH或NADPH为辅酶,20~50℃下,于pH 5.5~10.5的缓冲液构成的转化反应体系a中反应,反应完全后,将反应液分离纯化得到相应产物。
所述的反应条件可按本领域所用的常规条件进行选择。
进一步,所述转化体系a中底物初始浓度为5~1000mmol/L。
进一步,所述转化体系a中重组短链脱氢酶纯酶在反应液中较佳的浓度为0.1~2.0mg/mL。所述转化体系a中菌体的质量用量以菌体湿重计为10~400g/L。
进一步,所述转化体系a还包括有机溶剂,由底物、催化剂、有机溶剂与pH 5.5~10.5的缓冲液构成转化体系b,有机溶剂占转化体系b总体积1~20%,转化体系b中底物初始浓度为5~1000mmol/L,菌体的质量用量以菌体湿重计为10~400g/L。
进一步,所述反应在pH 7.5的缓冲液中进行。
进一步,反应体系还可添加1~15%醇或糖作为辅底物,可以显著提高反应的活力。所述辅底物包括但不限于下列之一:①乙醇、②异丙醇、③葡萄糖、④蔗糖等。
进一步,反应体系中的辅底物为异丙醇。
进一步,反应体系中异丙醇的浓度为10%。
进一步,所述转化反应液分离纯化方法为:反应结束后,将转化反应液离心,取上清液用等体积的乙酸乙酯萃取,有机层即为含相应手性醇的粗品,将粗品提纯即获得相应手性醇。所述粗品提纯的方法为本领域公知技术,通常为有机溶剂萃取、色谱分离和吸附分离等。
本发明所述转化体系a和转化体系b均为转化体系,为便于区分不同步骤转化体系的组成不同而命名,字母本身没有含义。
本发明的有益效果主要体现在:提供了一种来源于Pseudomonas putida ATCC 12633的短链脱氢酶及其基因,以及含有该基因的重组表达载体和重组表达转化体,通过该短链脱氢酶或含有该酶的重组细胞不对称还原可制备高光学纯度的虾青素手性中间体;本发明中所述短链脱氢酶或含有该酶的重组细胞不对称还原制备手性醇具有显著优点,能够合成高光学纯度虾青素手性中间体(ee>99%)。催化剂易于制备、立体选择性高、反应条件温和、环境友好,具有很好的应用开发前景。
(四)附图说明
图1为短链脱氢酶基因PCR扩增产物琼脂糖凝胶电泳图;
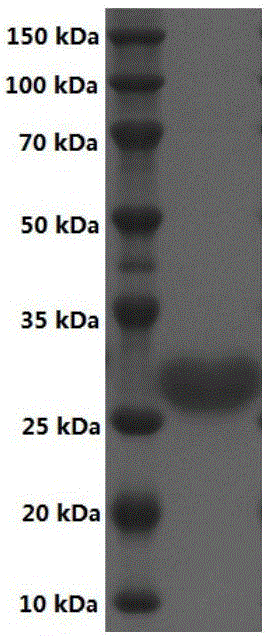
图2为短链脱氢酶分离纯化SDS-PAGE图。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:Pseudomonas putida ATCC 12633短链脱氢酶基因的获得、重组质粒构建及转化大肠杆菌
用DNA提取试剂盒提取Pseudomonas putida ATCC 12633菌体的全基因组DNA,以该DNA为模板,分别以上游引物(GCTGAGGATCCATGGCTAATGCAAAAACCGC)和下游引物(GCATCCTCGAGTCACCAGACCAAGGGTTCGC)为作用引物进行PCR扩增反应。PCR反应体系各组分加入量(总体积50μL):5×PrimeSTARTM HS DNA polymerase Buffer 10μL,10mM dNTP mixture(dATP、dCTP、dGTP和dTTP各2.5mM)4μL,浓度为50μM的上游引物、下游引物各1μL,基因组DNA 1μL,PrimeSTARTM HS DNA polymerase 0.5μL,无核酸水32.5μL。PCR反应条件为:预变性98℃1min,然后进入温度循环98℃10s,56℃15s,72℃1min,共30个循环,最后72℃延伸5min,终止温度为4℃。短链脱氢酶基因PCR扩增产物琼脂糖凝胶电泳结果见附图1。测序分析结果表明,经上述过程扩增得到的核苷酸序列长度为687bp(其核苷酸序列如SEQ ID NO:1所示),该序列编码一个完整的开放阅读框。利用软件对该基因序列进行分析,推知所述短链脱氢酶基因编码SEQ ID NO:2所示的氨基酸序列。
PCR产物由BamHI/XhoI进行双酶切,经琼脂糖凝胶回收试剂盒回收目的片段,然后用T4连接酶将该片段同用相同限制性内切酶处理的商业化载体pET-30a连接,构建重组表达质粒pET30a-Ppysdr。
将上述构建的重组表达载体pET30a-Ppysdr转化至大肠杆菌BL21(DE3)中,得到重组大肠杆菌E.coli BL21(DE3)/pET30a-Ppysdr,涂布于含卡那霉素的平板,37℃下培养过夜,随机挑取克隆进行菌落PCR鉴定,阳性克隆测序验证,结果表明重组表达载体pET30a-Ppysdr成功转化至表达宿主E.coli BL21(DE3)中,且短链脱氢酶基因已成功克隆至pET-30a的BamHI和XhoI位点。
实施例2:重组短链脱氢酶的诱导表达
实施例1构建的工程菌E.coli BL21(DE3)/pET30a-Ppysdr接种至含50μg/mL卡那霉素的LB液体培养基中,37℃培养过夜,再以1%接种量(v/v)接种到含50μg/mL卡那霉素的50mL LB培养基中,37℃,200rpm培养至菌体浓度OD600至0.6左右,加入终浓度为0.1mM的IPTG,26℃诱导培养6h后,4℃、8000rpm离心10min收集菌体,于-80℃贮存备用。
实施例3:重组短链脱氢酶的分离纯化
实施例2收集的菌体细胞悬浮于10mL Na2HPO4-NaH2PO4缓冲液(100mM,pH 8.0)中,振荡摇匀后置超声波下破碎(有效时间8min)。破碎液于12,000rpm离心10min去除细胞碎片,收集上清液(粗酶液)用于酶的后续的分离纯化。纯化柱为Ni-NTA,装柱体积为5mL,先用上样平衡缓冲液(20mM磷酸钠,500mM NaCl和20mM咪唑,pH 7.4)平衡Ni-NTA柱,以5mL/min的速率上样粗酶液,用上样平衡缓冲液洗脱以除去未吸附的蛋白,最后用洗脱缓冲液(20mM T磷酸钠,500mM NaCl和500mM咪唑,pH 7.4)洗脱收集目标蛋白。酶液用HiTrap脱盐柱进行脱盐,脱盐缓冲液为Na2HPO4-NaH2PO4(100mM,pH 7.5)缓冲液,所得纯酶液于4℃贮存备用。纯化后的酶液用SDS-PAGE进行分析,SDS-PAGE电泳见图2,结果表明经Ni-NTA亲和层析,得到电泳纯的重组短链脱氢酶PpYSDR。
实施例4:重组短链脱氢酶不对称还原潜手性酮(I)
取实施例3中所得到的纯酶液1mL,再分别加入10mM潜手性酮(I)和5mM NADH作为底物和辅酶。于30℃恒温摇床振荡(200rpm)反应16h。反应液经等体积的乙酸乙酯萃取,用手性毛细管气相色谱法分析底物和产物的含量及对映体过量值(ee)。产物(3S,3’S)-虾青素手性中间体的光学纯度>99%,转化率65%。
实施例5:重组短链脱氢酶不对称还原潜手性酮(I)
取实施例3中所得到的纯酶液900μL,加入100μL异丙醇,再分别加入10mM潜手性酮(I)和5mM NADH作为底物和辅酶。于30℃恒温摇床振荡(200rpm)反应16h。反应液经等体积的乙酸乙酯萃取,用手性毛细管气相色谱法分析底物和产物的含量及对映体过量值(ee)。产物(3S,3’S)-虾青素手性中间体(II)的光学纯度>99%,转化率96.2%。
实施例8:重组大肠杆菌不对称还原潜手性酮(I)
在900μL、100mM的Na2HPO4-NaH2PO4缓冲液中(pH 7.5),加入100μL异丙醇,加入0.05g实施例2中所得到的湿菌体细胞,再加入10mM潜手性酮(I)作为底物。于30℃恒温摇床振荡(200rpm)反应12h。反应液离心,取上清液,经等体积的乙酸乙酯萃取,用手性毛细管气相色谱法分析底物和产物的含量及对映体过量值(ee)。产物(3S,3’S)-虾青素手性中间体(II)的光学纯度>99%,转化率95.8%。
- 还没有人留言评论。精彩留言会获得点赞!