一种联合苹果愈伤组织细胞培养和遗传转化鉴定苹果抗病基因的方法与流程
本发明涉及生物技术领域,尤其涉及一种联合苹果愈伤组织细胞培养和遗传转化鉴定苹果抗病基因的方法。
背景技术:
苹果是世界四大水果之一,我国是世界上最大的苹果生产和消费国,面积和产量均居世界首位。以苹果轮纹病为代表的真菌病害,是严重制约我国苹果产业优质高效发展的重要病害。以轮纹病为例,该病由致病真菌Botryosphaeria dothidea引起,其危害主要表现两个方面:(一)侵染枝干,导致树体衰弱,造成苹果产量与品质下降;严重时导致树体死亡;(二)在果实成熟期和采后储藏期,侵染果实,导致果实迅速腐烂,失去食用价值。目前,生产上主要采用刮树皮、喷施与涂抹石硫合剂、多菌灵与禁用农药福美胂等来防治枝干轮纹病(国立耘等,2009)。对果实则采用套袋技术。虽然每年为防治轮纹病要耗费大量人力物力,但因轮纹病造成的烂果仍占20%左右,损失巨大(张高雷等,2011)。因此,培育、推广与主栽抗病品种是有效应对轮纹病等真菌病害的当务之急,长远来看,也是实现苹果产业绿色、环保与高效发展的必由之路。
而抗病基因的挖掘和鉴定,是充分挖掘与利用抗病基因潜能,进行抗病品种培育的理论基础。近年来,苹果基因组测序、重测序、深度测序以及相关组学等方面的研究取得了很大进展,为理解苹果基因组的基因构成与表达提供了宏大的信息量,但对于苹果基因功能的研究仍然受制于苹果生长周期长、转化难、童期长等生物学特征。与拟南芥、水稻、烟草等模式植物相比,所鉴定的苹果抗病基因的数量仍然非常少。这已然成为苹果抗病分子机制研究与抗病育种研究的一个巨大障碍和技术瓶颈。在目前的研究中,研究者普遍借用模式植物转化体系,将苹果基因作为外源基因导入烟草、拟南芥等模式植物,这种研究路线在某种程度上可以对苹果基因的功能进行注释和研究,但这种策略抹杀了物种特异性,对问题的揭示具有很大的局限性。目前,国内外的研究科学家已经开始注重创制转基因苹果材料,并取得了一定进展。但仍然不可避免苹果生长周期长、转化难这一异于模式植物的主要制约因素。而且,由于苹果高度杂合,基因功能冗余以及生物学上的自交不亲和,也很难通过突变体筛选来鉴定苹果的抗病基因。因此,寻找一种高效的进行苹果抗病基因鉴定与筛选的方法,对于目前苹果抗病功能基因的研究尤为必要。
技术实现要素:
本发明的一个目的是提供一种鉴定目的基因为苹果抗病相关基因的方法。
本发明提供的方法,为利用苹果愈伤组织作为转化受体,鉴定目的基因是否为苹果抗病相关基因。
上述方法中,
所述方法包括如下步骤:
1)提高或沉默所述苹果愈伤组织中目的基因的表达,得到转目的基因愈伤组织细胞或沉默目的基因愈伤组织细胞;
2)将所述转目的基因愈伤组织细胞或所述沉默目的基因愈伤组织细胞、和所述苹果愈伤组织细胞分别接种引发苹果发病的某种病原菌,得到接种后转目的基因愈伤组织细胞、接种后沉默目的基因愈伤组织细胞和接种后苹果愈伤组织细胞;
观察抗病力,若所述接种后转目的基因愈伤组织细胞或所述接种后沉默目的基因愈伤组织细胞与所述接种后苹果愈伤组织细胞的抗病力有显著差异,则目的基因为或候选为苹果抗该病原菌引发病相关基因;若所述接种后转目的基因愈伤组织细胞或所述接种后沉默目的基因愈伤组织细胞与所述接种后苹果愈伤组织细胞的抗病力无显著差异,则目的基因不为或候选不为苹果抗该病原菌引发病相关基因。
显著差异为如下:
若所述接种后转目的基因愈伤组织细胞的抗病力显著小于所述接种后苹果愈伤组织,则所述目的基因为或候选为苹果抗该病原菌的基因;
若所述接种后沉默目的基因愈伤组织细胞的抗病力显著大于所述接种后苹果愈伤组织,则所述目的基因为或候选为与苹果抗该病原菌相关的基因;
上述方法中,
所述提高苹果愈伤组织中目的基因的表达为将目的基因导入苹果愈伤组织;
或,所述沉默苹果愈伤组织中目的基因的表达为将干扰所述目的基因表达的物质导入苹果愈伤组织;
或,所述苹果愈伤组织为苹果叶片愈伤组织;
或,所述病为苹果轮纹病;
或,所述病原菌为苹果轮纹病病菌。
苹果愈伤组织在鉴定目的基因是否为苹果抗病相关基因中的应用也是本发明保护的范围。
或苹果愈伤组织在培育抗病性苹果愈伤组织或抗病性苹果中的应用也是本发明保护的范围。
上述中,所述目的基因为序列2所示的蛋白的编码基因或序列4所示的蛋白的编码基因或序列6所示的蛋白的编码基因;
所述干扰序列2所示的蛋白的编码基因表达的物质为序列7所示的核苷酸或者表达序列7所示核苷酸的重组载体。
本发明另一个目的是提供一种蛋白。
本发明提供的蛋白,是如下(1)或(2)或(3):
(1)由序列表中序列4或序列6所示的氨基酸序列组成的蛋白质;
(2)由序列表中序列2所示的氨基酸序列组成的蛋白质;
(3)将序列2或序列4或序列6的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加,且与(1)具有相同功能的由(1)或(2)衍生的蛋白质。
编码上述蛋白的DNA分子也是本发明保护的范围。
本发明第三个目的是提供一种DNA分子。
本发明提供的DNA分子,为如下1)-4)中任一的DNA分子:
1)序列表中序列3或序列5所示的DNA分子;
2)序列表中序列1所示的DNA分子;
3)在严格条件下与1)或2)限定的DNA分子杂交且具有相同功能的由1)或2)衍生的蛋白质的DNA分子;
4)与1)或2)限定的DNA序列具有90%以上同一性,且具有相同功能的由序列1或序列3或序列5衍生的DNA分子。
含有上述DNA分子的重组载体、表达盒、转基因细胞系或重组微生物也是本发明保护的范围;
或上述蛋白或上述DNA分子或上述的重组载体、表达盒、转基因细胞系或重组微生物在调控植物抗病性中的应用也是本发明保护的范围;
或上述蛋白或上述DNA分子或权上述的重组载体、表达盒、转基因细胞系或重组微生物在培育抗病性植物愈伤组织或抗病性植物中的应用也是本发明保护的范围。
上述中,
所述植物为单子叶植物或双子叶植物,
或所述双子叶植物为苹果;
或所述病为苹果轮纹病;
或所述病原菌为苹果轮纹病病菌。
本发明的实验证明,本发明利用苹果愈伤组织转化进行苹果抗病基因功能鉴定,克服了苹果植株转化周期长、转化难等在开展苹果抗病基因功能研究中的技术壁垒,大大提高了苹果抗病基因的筛选效率,为筛选与鉴定苹果抗病基因提供了一个高效、简易的方法,使苹果重要抗病基因的发掘成为可能。该方法具有高效、易行、耗时短的特点,它为苹果抗病基因的筛选鉴定与苹果抗病基因作用机制的深入研究奠定了基础和可能。
附图说明
图1为MdSYP121基因的克隆。
图2为MdSYP121基因沉默苹果细胞系及MdSYP121超表达苹果细胞系的分子和蛋白水平鉴定。
图3为MdSYP121基因沉默苹果细胞系及MdSYP121超表达苹果细胞系的抗病力表型鉴定。
图4为MdBAK1基因的克隆。
图5为MdBAK1超表达苹果细胞系及MdBAK1超表达苹果植株的分子和蛋白鉴定。
图6为MdBAK1超表达细胞系抗病力表型鉴定。
图7为MdBAK1超表达苹果植株叶片抗病力表型鉴定。
图8为轮纹病菌菌丝的PDA板等距离的菌饼示意图。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、苹果愈伤组织细胞培养和遗传转化鉴定苹果抗病相关基因MdSYP121
一、待鉴定目的基因MdSYP121的获得
1、应用CTAB法从富士苹果果肉提取总RNA
CTAB提取缓冲液配方:0.1M Tris-Cl(pH 8.0),1.4M NaCl,20mM EDTA,2%CTAB,2%PVP,2%β-巯基乙醇
1)水浴锅调至65℃,离心机4℃预冷。
2)配CTAB提取液,取4mL加入DEPC处理过的10mL离心管,65℃水浴预热。
3)液氮中研磨苹果果肉0.5-1g,研磨至粉状。
4)将研磨好的样品迅速加入预热过的离心管,剧烈震荡、涡旋,65℃水浴5min。
5)在冰架上冷却至室温,加入等体积的氯仿/异戊醇(24:1)并涡旋混合,4℃,10000rpm离心15min。
6)上清液转移至新离心管,重复步骤5)一次。
7)上清液转移至新离心管,加入1/3体积的LiCl(8M,4℃预冷)4℃沉淀过夜(不超过16h)。
8)4℃,10000rpm离心30min,弃上清。
9)用500μL SSTE溶解沉淀,常温转移至1.5mL离心管中,加入等体积的氯仿/异戊醇(24:1),吸打混匀,4℃,10000rpm离心10min(抽提后上层应为澄清状态,若为乳白色应继续离心)。
10)取上清至新的1.5mL离心管(冰浴预冷),加入两倍体积无水乙醇,混匀后于-70℃沉淀30min或-20℃沉淀2h。
11)4℃,12000rpm离心20min,沉淀RNA,弃上清。
12)400μL 70%乙醇洗涤沉淀,重复一次,冰浴晾干,20μL DEPC水溶解RNA。
利用1%浓度的琼脂糖检测RNA的完整性,利用Nanodrop2000测定RNA的浓度和纯度。
取5μL总RNA,按照RevertAidTM First Strand cDNA Synthesis Kit(Fermentas)的说明书进行反转录为cDNA。
2、MdSYP121超表达载体构建
采用如下引物,以上述cDNA为模板,进行PCR扩增,获得MdSYP121CDS序列全长,大小为1000bp。
MdSYP121-BamHI-F:5’-GGATCCATGAACGATTTGTTCTCCGGCTCCT-3’
MdSYP121-StuI-R:5’-AGGCCTCTGCGGTTGCGGYGGCGGT-3’
PCR反应体系:总体积100μL,包括cDNA模板5μL,8μLdNTP,克隆引物各5μL,5×HF Buffer20μL,ddH2O 56μL,Phusion高保真酶1μL。
反应程序为:
①98℃30s
②98℃15s
③58℃15s
④72℃ 1min30s
⑤go to②③④for 35个循环
⑥72℃ 5min
⑦4℃保存
PCR产物纯化回收,片段大小约为1000bp(图1)。
将该PCR产物用2.5倍体积的95%酒精进行PCR扩增产物沉淀;然后,用75%酒精洗沉淀,晾干,用无菌水溶解。
测序该PCR产物,其核苷酸序列为序列表中序列1,编码的蛋白的氨基酸序列为序列表中序列2,将该核苷酸所示的基因命名为MdSYP121,编码的蛋白命名为MdSYP121。
二、超表达MdSYP121的载体和MdSYP121沉默表达载体构建
1、超表达MdSYP121的载体
将序列表中序列1所示的MdSYP121替换pCB302’质粒的BamHI和StuI双酶切位点间的片段得到的载体,命名为pCB302’-35S-MdSYP121-2HA,该载体超表达MdSYP121。
pCB302’质粒为将参考文献:Cui et al.,Plant Physiology,2013,162:1018-1029第1028页Generation of AXR2and AXR2P87S Transgenic Plants中的pCB302质粒中的FLAG标签替换为HA标签。
2、MdSYP121沉默表达载体
以苹果果肉的cDNA为模板,用下面的引物扩增第一片段和第二片段:
第一片段:
F:5’-CGGGATCC GTCAACCTCGACAAGTTCTTC-3’;
R:5’-CCATCGAT CTTGCTCCTGTATTGCCTT-3’。
第二片段:
F:5’-CCGCTCGAG GTCAACCTCGACAAGTTCTTC-3’;
R:5’-GGGGTACC CTTGCTCCTGTATTGCCTT-3’。
得到493bp的第一片段,经过测序,其为具有序列1第121-613位核苷酸;
得到493bp的第二片段,经过测序,其为具有序列1第121-613位核苷酸;与第一片段仅酶切位点不同。
将上述第一片段替换RNAi中间载体pHannibal(参考文献:Varsha Wesley et al.,Plant Journal,2001,27:581-590Figure 5)的BamH I和Cla I酶切位点间的片段,且将第二片段替换RNAi中间载体pHannibal的Xho I和Kpn I酶切位点间的片段,得到中间载体pHannibal-SYP121;
再用BamH I和Stu I双酶切中间载体pHannibal-SYP121,得到2600bp的片段(该片段测序结果见序列7,第317-809位为第一片段,第1671-2163位为第二片段);
将该该2600bp的片段与经过BamH I和Stu I酶切的pCB302’载体骨架连接,得到重组质粒pCB302’-RNAi-MdSYP121。
三、农杆菌介导的苹果愈伤组织的转化得到转基因愈伤组织
1、农杆菌转化及活化
1)所用农杆菌株系为:将100μL农杆菌LBA4404(ThermoFisher SCIENTIFIC,18313-015)感受态细胞于冰上融化,加入2μL质粒DNA(pCB302’-RNAi-MdSYP121或pCB302’-MdSYP121-2HA),混匀,冰浴30min,液氮速冻1min,37℃热激5min,冰浴2-3min。
2)加入1mL YEP培养基,28℃,200rpm,震荡1.5h,离心弃上清,留100μL液体重悬菌体。
3)将重悬好的菌体均匀涂在加有利福平(50mg/L)和卡那霉素(50mg/L)的固体YEP培养基上,28℃倒置培养2d。
4)挑取固体YEP培养基上的单克隆农杆菌于2ml加有利福平(50mg/L)和卡那霉素(50mg/L)的液体YEP培养基中,28℃,200rpm,震荡20h。
5)取50ml加有利福平(50mg/L)和卡那霉素(50mg/L)的液体YEP培养基于150ml锥形瓶,加入2ml已摇好的菌液,28℃,200rpm,震荡6-7h至OD600值为0.4-0.6,得到LBA4404/pCB302’-RNAi-MdSYP121菌液和LBA4404/pCB302’-MdSYP121-2HA菌液。
2、苹果愈伤组织的转化
1)分别将LBA4404/pCB302’-RNAi-MdSYP121菌液和LBA4404/pCB302’-MdSYP121-2HA菌液移至50mL离心管,28℃,5000rpm,离心10min,弃上清。
2)用50mLMS液体培养基重悬,将苹果叶片愈伤组织(品种名称:王林;以下也称为野生型细胞)移入菌液中28℃,200rpm,摇20min。
王林苹果叶片愈伤组织制备:
以春天刚展开的王林苹果幼嫩叶片为外植体,带回实验室用自来水洗净。在超净工作台上用75%的酒精水溶液浸泡10s进行消毒,然后用无菌水冲洗3次,再用浓度为3%的次氯酸钠水溶液(有效Cl浓度)浸泡10min进一步消毒,之后用无菌水冲洗3-6次,放在灭过菌的滤纸上吸干水分,用无菌的剪刀剪几道伤口,放置到诱导培养基上暗培养2周,得到王林苹果叶片愈伤组织
上述诱导培养基为MS(Murashige and Skoog)培养基添加2.5mg/L 2,4-D、0.5mg/L 6-BA和0.1mg/L KT,之后进行每天16h的光培养,光照强度为2000~2500lx。温度均为24±2℃。
3)纱布过滤苹果叶片愈伤组织,用无菌滤纸吸去表面菌液,置于MS培养基上共培养2d。
4)共培养后的愈伤组织转移至加有羧苄青霉素(300mg/L)和除草剂(glufosinate,8mg/L)的MS愈伤组织选择培养基中,23-26℃暗培养。
5)培养约1个月后,取在愈伤组织选择培养基上生长出来的细胞团,进行接种繁殖下一代,总共筛选4代,得到能够在含有除草剂的MS培养基上进行均一稳定生长的细胞系,得到转pCB302’-RNAi-MdSYP121愈伤组织细胞和转pCB302’-MdSYP121-2HA愈伤组织细胞。
3、鉴定
1)、阳性转pCB302’-RNAi-MdSYP121愈伤组织细胞的鉴定
提取转pCB302’-RNAi-MdSYP121愈伤组织细胞的RNA,反转录得到cDNA作为模板,用检测第一片段引物和检测第二片段引物分别PCR扩增;以野生型细胞作为对照(WT)。
检测第一片段引物:
F:5’-CGGGATCC GTCAACCTCGACAAGTTCTTC-3’;
R:5’-GGTAACATGATAGATCATGTC-3’。
检测第二片段引物:
F:5’-CGGGATCC GTCAACCTCGACAAGTTCTTC-3’;
R:5’-CTTCGTCTTACACATCACTTGTC-3’。
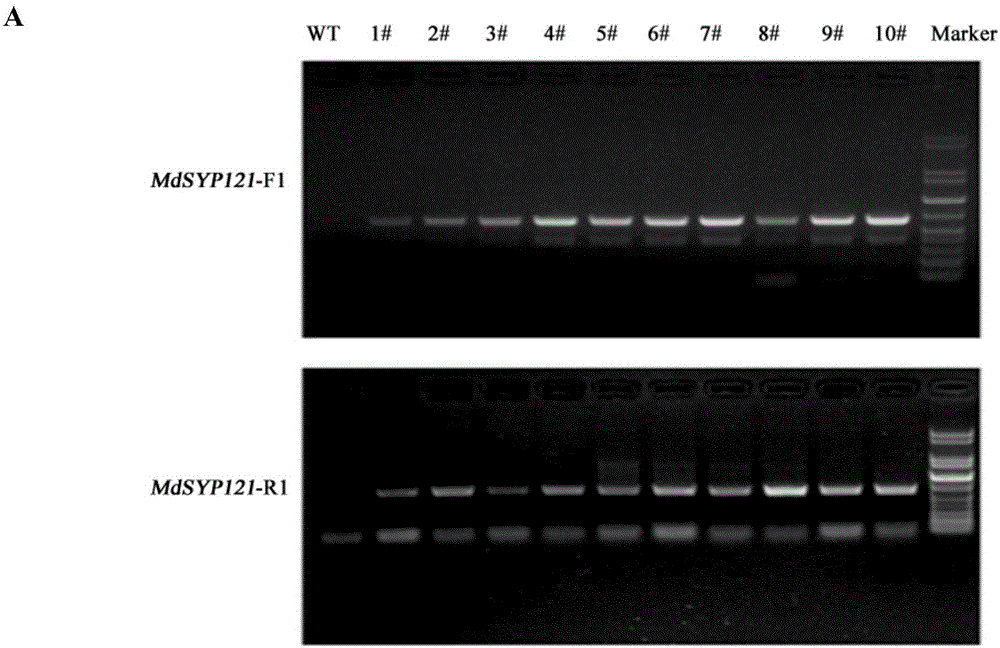
结果如图2A所示(F1和R1分别为沉默载体的第一片段和第二片段),可以看出,除野生型细胞WT无目的条带外,10个转pCB302’-RNAi-MdSYP121愈伤组织细胞都有目的条带(图2A),说明pCB302’-RNAi-MdSYP121转化愈伤组织成功。
为进一步检测MdSYP121是否被沉默,提取10个转pCB302’-RNAi-MdSYP121愈伤组织细胞RNA(#1-#10),反转录为cDNA,经实时定量PCR检测,引物序列为:qRT-RNAi-MLO1-F:5’-TCAAGGTGACCAGTTGGACG-3’;qRT-RNAi-MLO1-R:5’-GAACCTGGCCTTCTGCAACTG-3’;内参基因为MdActin、引物序列为:MdActin-F:5’-TGACCGAATGAGCAAGGAAATTACT-3’;MdActin-R:5’-TACTCAGCTTTGGCAATCCACATC-3’),以野生型细胞作为对照(WT)。
结果如图2B所示,在10个转pCB302’-RNAi-MdSYP121愈伤组织细胞中,该基因的表达均被抑制,且抑制达90%以上,说明MdSYP121在苹果细胞中被有效沉默,10个转pCB302’-RNAi-MdSYP121愈伤组织细胞为阳性转pCB302’-RNAi-MdSYP121愈伤组织细胞。
2)、阳性转pCB302’-MdSYP121-2HA愈伤组织细胞的鉴定
分别提取6个转pCB302’-MdSYP121-2HA愈伤组织细胞和野生型细胞WT的蛋白,用Anti-HA抗体(pCB302’载体上含有HA标签),应用Western Blot技术,检测MdSYP121-2HA融合蛋白在苹果细胞中的表达。
结果如图2C所示,可以看出,在所得到的转基因细胞系中,在分子量43KD处,全部检测到了HA标签信号,与根据MdSYP121氨基酸序列数目判定的分子量大小完全一致,而在野生型细胞中无此信号,也说明该信号特异,所检测细胞为转基因细胞。另,与Anti-HA抗体的检测结果相对照,在野生型细胞和转基因细胞中,均能检测到MdActin的信号。结果表明,MdSYP121转化愈伤组织成功并能稳定遗传,转pCB302’-MdSYP121-2HA愈伤组织细胞为阳性转pCB302’-MdSYP121-2HA愈伤组织细胞。
总之,应用该愈伤组织的转化方法,在以除草剂做选择压的条件下,所随机选取的10个独立的MdSYP121基因沉默转基因细胞团的检测结果表明:MdSYP121的表达均被抑制,转化效率为100%(图2B);在所选取的6个MdSYP121超表达细胞团的检测结果表明,均含有MdSYP121蛋白,转化效率为100%(图2C)。而且,获得稳定生长的转基因细胞所需时间均为2个月;具有转化效率高、试验周期短的特点。
四、转基因愈伤组织的抗轮纹病鉴定
1、待接菌苹果愈伤组织细胞的接种培养与准备
1)准备
培养基配置:使用无菌玻璃培养皿(上海五一),培养皿大小为:直径9cm,深度1.1cm,品牌为,将经121℃高压灭菌20min后的MS培养基,35mL定量倾倒在无菌玻璃培养皿中,备用。
待接菌苹果愈伤组织细胞:选取生长12d野生型苹果愈伤组织(WT)、阳性转pCB302’-MdSYP121-2HA愈伤组织细胞(MdSYP121-OX)和阳性转pCB302’-RNAi-MdSYP121愈伤组织细胞(MdSYP121-RNAi),分别准确称取2g均匀平铺于MS培养基中,培养,得到待接种野生型苹果愈伤组织(WT)、待接种阳性转pCB302’-MdSYP121-2HA愈伤组织细胞(MdSYP121-OX)和待接种阳性转pCB302’-RNAi-MdSYP121愈伤组织细胞(MdSYP121-RNAi)。
野生型苹果细胞在不同时期的生长状态如图3A所示,可以看出,细胞生长12d,此时期苹果愈伤组织生长状态良好均一并且已全部覆盖在培养基表面。
待接种苹果轮纹病病菌:生长于PDA培养基上的苹果轮纹病病菌(Botryosphaeria dothidea(种名:dothidea),参考文献:张高雷等,苹果轮纹病病瘤组织研究,植物病理学报2011,41(1):98-101)菌丝培养3d,得到待接种苹果轮纹病病菌。
2)接种
选取大小一致生长状态良好的待接种苹果轮纹病病菌的菌饼分别置于上述待接种野生型苹果愈伤组织(WT)、待接种阳性转pCB302’-MdSYP121-2HA愈伤组织细胞(MdSYP121-OX)和待接种阳性转pCB302’-RNAi-MdSYP121愈伤组织细胞(MdSYP121-RNAi)的中央(采用直径为6mm的实验室白胶塞打孔器,在生长有轮纹病菌菌丝的PDA板上,以板圆心为核心,等距离打出大小均匀一致的菌饼,各菌饼所含菌丝量一致,如图8所示),24℃,黑暗培养3d,观察不同愈伤组织上苹果轮纹病病菌的扩展情况;阳性转pCB302’-MdSYP121-2HA愈伤组织细胞(MdSYP121-OX)的重复数为6,阳性转pCB302’-RNAi-MdSYP121愈伤组织细胞(MdSYP121-RNAi)的重复数为11。
阳性转pCB302’-MdSYP121-2HA愈伤组织细胞(MdSYP121-OX)结果如图3B左图和图3C所示,与野生型细胞相比,苹果轮纹病病菌在超表达MdSYP121转基因愈伤组织上生长较旺盛,相同时间内病菌扩展面积大,MdSYP121超表达转基因细胞株MdSYP121-OX病斑扩展面积在:50.27-73.79cm2之间,而野生型细胞系病斑扩展面积为:20.41-57.93cm2之间,二者具有显著差异(p<0.05),说明超表达MdSYP121显著降低苹果对轮纹病的抗性,阳性转pCB302’-MdSYP121-2HA愈伤组织细胞(MdSYP121-OX)的抗病力低于野生型细胞。
阳性转pCB302’-RNAi-MdSYP121愈伤组织细胞(MdSYP121-RNAi)的结果如图3B右图和图3C所示,与野生型细胞相比,苹果轮纹病病菌在MdSYP121转基沉默细胞株(MdSYP121-RNAi)中扩展与发病较缓慢,相同时间内病菌扩展面积小;培养3d之后,RNAi沉默细胞株中病斑面积在:9.61-22.04cm2之间,野生型细胞株病斑扩展面积为:24.62-48.98cm2之间,二者区别为极显著(p<0.01),说明沉默MdSYP121后可显著增强苹果对轮纹病的抗性,表明阳性转pCB302’-RNAi-MdSYP121愈伤组织细胞(MdSYP121-RNAi)抗病力高于野生型细胞。
上述实验证明了,MdSYP121基因为苹果轮纹病抗性相关基因,具有调节苹果对轮纹病的抗性,沉默后可以增强苹果对轮纹病的抗性。
实施例2、苹果愈伤组织细胞培养和遗传转化鉴定苹果抗病相关基因MdBAK1
一、待鉴定目的基因MdBAK1的获得
根据GDR公布的苹果基因组数据,利用引物设计软件DNASTAR设计苹果中BAK1同源基因的克隆引物:
MdBAK1-1-NcoI-F:5’-CATGCCATGGACCCAACACTGATGAC-3’,
MdBAK1-1-SmaI-R:5’-TCCCCCGGGTCTGGGACCGGACAACTC-3’;
MdBAK1-2-NcoI-F:5’-CATGCCATGGCGTCCTCCGCCTCTGTT-3’,
MdBAK1-2-SmaI-R:5’-TCCCCCGGGTCTGGGACCGGACAACTC-3’。
提取新疆野苹果红色愈伤的RNA,反转录得到的cDNA为模板,分别用上述2对引物进行PCR扩增,获得了MdBAK1-1CDS序列,片段长度为1851bp(图4A,左)和MdBAK1-2CDS序列,片段长度1833bp(图4A,右)。
MdBAK1-1CDS序列经过测序,其序列3,其编码的蛋白为序列4,蛋白命名为MdBAK1-1;
MdBAK1-2CDS序列经过测序,其序列5,其编码的蛋白为序列6,蛋白命名为MdBAK1-2;
二、超表达MdBAK1的载体构建
超表达MdBAK1-1的载体为将序列表中序列3所示的MdBAK1-1替换pCB302’质粒的BamHI和StuI双酶切位点间的片段得到的载体,命名为pCB302’-35S-MdBAK1-1,该载体超表达MdBAK1-1(电泳图如图4B左)。
超表达MdBAK1-2的载体为将序列表中序列5所示的MdBAK1-2替换pCB302’质粒的BamHI和StuI双酶切位点间的片段得到的载体,命名为pCB302’-35S-MdBAK1-2,该载体超表达MdBAK1-2(电泳图如图4B右)。
三、农杆菌介导的苹果愈伤组织的转化得到转基因愈伤组织
1、农杆菌转化及活化
与实施例1相同;
2、苹果愈伤组织的转化
与实施例1方法相同,分别将pCB302’-35S-MdBAK1-1和pCB302’-35S-MdBAK1-2分别转入苹果叶片愈伤组织(王林)中,得到转pCB302’-35S-MdBAK1-1愈伤组织细胞和转pCB302’-35S-MdBAK1-2愈伤组织细胞(图5A)。
3、鉴定
分别提取转pCB302’-35S-MdBAK1-1愈伤组织细胞、转pCB302’-35S-MdBAK1-2愈伤组织细胞和野生型细胞WT的蛋白,用Anti-HA抗体(pCB302’载体上含有HA标签),应用Western Blot技术,检测MdBAK1-1-HA融合蛋白在苹果细胞中的表达。
转pCB302’-35S-MdBAK1-1愈伤组织细胞、转pCB302’-35S-MdBAK1-2愈伤组织细胞的结果如图5C所示,在鉴定的5个转pCB302’-35S-MdBAK1-1愈伤组织细胞中,均有MdBAK1-1表达(图5C上排,MdBAK1-1OX),2个转pCB302’-35S-MdBAK1-2愈伤组织细胞中,均有MdBAK1-2稳定表达(图5C上排,MdBAK1-2OX);可以看出,得到了MdBAK1超表达的苹果细胞系。
总之,在以除草剂做选择压的条件下,所随机选取的5个独立发生的细胞团,全部含有MdBAK1-1蛋白信号,细胞转化率为100%(图5C上排,MdBAK1-1OX);在MdBAK1-2转基因细胞的检测中,检测了3个独立发生的细胞团,2个含有MdBAK1-2的蛋白信号,细胞转化率为66.7%(图5C上排,MdBAK1-2OX);而且,得到MdBAK1-1及MdBAK1-2稳定表达和生长的细胞团所需时间为2个月,具有转化效率高、试验周期短的特点。
四、转基因愈伤组织的抗轮纹病鉴定
方法同实施例1,选取大小一致生长状态良好的待接种苹果轮纹病病菌的菌饼分别置于上述待接种野生型苹果愈伤组织(WT)、待接种阳性转pCB302’-35S-MdBAK1-1愈伤组织细胞和待接种阳性转pCB302’-35S-MdBAK1-2愈伤组织细胞的中央(采用直径6mm的实验室白胶塞打孔器打出大小均匀一致的菌饼,图8所示),室温黑暗培养6天,重复三次。
结果如图6所示,轮纹病菌在阳性转pCB302’-35S-MdBAK1-1愈伤组织细胞和阳性转pCB302’-35S-MdBAK1-2愈伤组织细胞中的生长与扩展速度显著高于对照野生型苹果愈伤组织;表明,阳性转pCB302’-35S-MdBAK1-1愈伤组织细胞和阳性转pCB302’-35S-MdBAK1-2愈伤组织细胞的抗病力低于野生型苹果愈伤组织。经接种于苹果愈伤组织细胞,24℃度培养发病6天后,在野生型苹果细胞中,病菌侵染与扩展面积为:15.9-19.63cm2之间,在MdBAK1-1超表达细胞中,病菌侵染与扩展面积为:63.2-63.6cm2之间,在MdBAK1-2超表达细胞中,病菌侵染与扩展面积为:62.2-63.6cm2之间。病菌在野生型细胞与MdBAK1-1或MdBAK1-2超表达的细胞中的扩展差异为极显著(p<0.01)(图6B)。
因此,MdBAK1-1或MdBAK1-2的超表达可降低苹果对轮纹病菌的抗性,证明其为轮纹病菌抗病相关基因。
对比例:转化受体为叶片
1、苹果叶片转化
将pCB302’-35S-MdBAK1-1分别转入苹果叶片(以下也称为野生型细胞,品种名:嘎啦,叶片取自嘎啦组培苗上具有1个月叶龄的叶片,嘎啦组培苗制备方法如下)中,得到转pCB302’-35S-MdBAK1-1苹果苗(图5B)。
上述嘎啦苹果组培苗的诱导和再生:
收集嘎啦成熟种子,混在含水量50%左右的湿沙中4℃层积三个月,待种子萌发,挑选下胚轴为红色的种子,去掉种子外壳,用自来水冲洗干净,在超净工作台上用75%的酒精浸泡10s进行消毒,然后用灭菌水冲洗3次,再用浓度3%的次氯酸钠(有效Cl浓度)浸泡10~15min进一步消毒,之后用无菌水冲洗3~6次,放在灭过菌的滤纸上吸干水分,接种到无激素的MS培养基中进行培养,生长成旺盛的小苗时切掉根部,将茎插到诱导培养基上(MS+NAA 0.1mg/L+6-BA 0.5mg/L),经过1个月的培养,得到多丛芽后进行继代培养。得到多丛芽后,取多丛芽的叶片切成正方形小块,放在再生培养基上(MS+0.2mg/L IBA+1.0mg/L TDZ),暗培养2周后进行光培养,4周后再生出不定芽,切下不定芽转到继代培养基进行培养。
2、鉴定
分别提取转pCB302’-35S-MdBAK1-1苹果苗和野生型苹果苗的蛋白,用Anti-HA抗体(pCB302’载体上含有HA标签),应用Western Blot技术,检测MdBAK1-1-HA融合蛋白和MdBAK1-2-HA融合蛋白在苹果植株中的表达。
结果在2#、6#两个系,共5个转pCB302’-35S-MdBAK1-1植株2-1#、2-2#、2-3#、6-1#、6-2#中,均检测到MdBAK1-1的稳定表达(图5C,下排,MdBAK1-1OX),得到了MdBAK1超表达的苹果植株。
在应用苹果叶片进行MdBAK1-1的基因转化中,从600株生长的组培苗植株中,最终筛选得到了2个超表达MdBAK1-1的转基因植株,转化率为0.3%,耗时长达1年,而且,筛选工作量巨大,与愈伤组织细胞的转化相比,转化效率大为降低,而且,对操作者技术水平依赖程度高,得到转基因植株较为困难。
2、转基因植株的抗轮纹病鉴定
苹果植株抗病力鉴定采用离体叶片接种法,具体如下:
在培养皿中加滤纸,倒入无菌水使滤纸保持湿润,将转pCB302’-35S-MdBAK1-1苹果苗叶片分别置于滤纸上,正面朝上。叶片扎孔,在扎孔部位,覆盖于PDA培养基上生长6天的待接种苹果轮纹病病菌菌块,培养3d(24℃,暗培养)。以野生型苹果叶片为对照。
结果如图7所示,轮纹病菌在转pCB302’-35S-MdBAK1-1苹果苗的叶片中的扩展侵染速度显著大于野生型对照,所造成的接种部位叶片腐烂的面积显著大于野生型,证明MdBAK1-1为抗病基因。
因此,表明本发明用叶片愈伤组织转化的鉴定结果与用植株叶片的鉴定结果一致,说明利用苹果愈伤组织转化进行苹果抗病基因功能鉴定为一种简易可靠的方法。
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!