手足口病混合感染中柯萨奇A组10型病毒的检测方法与流程
本发明属于生物技术领域,具体涉及一种手足口病临床样品中柯萨奇a组10型病毒的检测方法。
背景技术:
自2008年以来,在中国,每年手足口病(hand-foot-mouthdisease,hfmd)病例均在百万以上,并有死亡的报道。hfmd已经成为我国和东南亚国家的重大公共卫生问题之一。hfmd是由多种人类肠道病毒引起的常见传染病,引起hfmd的病原体主要为cv-a16、4、5、7、9、10,和b3、5、埃可病毒以及ev-a71,其中柯萨奇a组10型(coxsackievirusa10,cv-a10)已经成为除肠道病毒71型(enterovirus71,ev-a71)、cv-a16和cv-a6以外引起发病的主要病原体之一。
在hfmd爆发期间,存在多种肠道病毒混合感染,混合感染有可能加重疾病和/或延长病程。因此,对混合感染监测有助于hfmd预防和治疗。
在实际检验中,当hfmd已经被确定为某种肠道病毒感染后,想要确定是否还存在cv-a10的感染,通常还需要用cv-a10的特异引物进行rt-pcr,然后巢式pcr,通过琼脂糖电泳鉴定是否有cv-a10感染。这就需要两次rt-pcr,增加了成本,尤其进行大规模分子流行病调查,其花费的成本相当巨大,因此,探索简便快速的cv-a10检测方法非常必要。
技术实现要素:
本发明所要解决的技术问题是,克服以上所述缺陷,提供一种检测速度快、高准确率、费用少的柯萨奇a组10型病毒(cv-a10)的检测方法。
为了解决以上所述技术问题,本发明所述手足口病混合感染中柯萨奇a组10型病毒的检测方法,该包括以下步骤:
(1)提取病毒rna,根据肠道病毒衣壳蛋白基因的特点设计肠道病毒通用引物进行半巢式pcr;首先用引物224(5’gciatgytiggiacicayrt3’)和222(5’cicciggiggiayrwacat3’)进行第一次rt-pcr扩增,然后再用引物an89(5’ccagcactgacagcagyngarayngg3’)和an88(5’actggaccacctggnggnayrwacat3’)根据cv-a10序列设计特异cv-a10上游引物cva10tf(5’tacaagccgcggagacagg3’)和下游引物cva10tr(5’ggtgggacatacatgtactg3’),进行第二次巢式pcr扩增和测序,并将其核苷酸序列进行ncbiblast比对,如果该核苷酸序列与genbank数据库中某种肠道病毒血清型的核苷酸序列同源性大于75%,即认为是相同的血清型,确定该手足口病患者感染了该种肠道病毒,即检测出手足口病患者感染的肠道病毒种类;
(2)经过所述步骤(1)的鉴定,如果用通用引物未检测到柯萨奇a组10型病毒,再用特异cv-a10上游引物cva10tf和下游引物cva10tr,以所述步骤(1)中rt-pcr产物为模版进行巢式pcr扩增,取扩增产物进行1%琼脂糖凝胶电泳,即可确定混合感染中是否存在cv-a10的感染。
本发明的有益效果:相比于现有技术,本发明省略一步rt-pcr法,就可完成该样品的cv-a10鉴定,一个样品可节约成本近25元人民币,时间也从原来4小时缩短到2小时,而且只需一次rt-pcr即可完成,因此该方法能够快速、简便、而且大幅度降低费用,为大规模的肠道病毒混合感染中cv-a10分子流行病学监测提供了保障。
附图说明
图1为所述实施例的肠道病毒1%琼脂糖凝胶电泳图;
图2为所述实施例的cv-a101%琼脂糖凝胶电泳图;
图3为所述实施例所测一个样本的cv-a10序列;
图4为cv-a10部分vp1基因扩增示意图。
具体实施方式
下面结合实施例对本发明作进一步详细说明。
本发明所述手足口病混合感染中柯萨奇a组10型病毒的检测方法,所述方法包括以下步骤:
(1)提取病毒rna,根据肠道病毒衣壳蛋白基因的特点设计肠道病毒通用引物进行半巢式pcr;首先用引物224(5’gciatgytiggiacicayrt3’)和222(5’cicciggiggiayrwacat3’)进行第一次rt-pcr扩增,然后再用引物an89(5’ccagcactgacagcagyngarayngg3’)和an88(5’actggaccacctggnggnayrwacat3’)根据cv-a10序列设计特异cv-a10上游引物cva10tf(5’tacaagccgcggagacagg3’)和下游引物cva10tr(5’ggtgggacatacatgtactg3’),进行第二次巢式pcr扩增或通过测序并将其核苷酸序列进行ncbiblast比对,如果该核苷酸序列与genbank数据库中某种肠道病毒血清型的核苷酸序列同源性大于75%,即认为是相同的血清型,因而确定该手足口病患者感染了这种肠道病毒;
(2)经过所述步骤(1)的鉴定,如果用通用引物未检测出柯萨奇a组10型病毒,也可用特异cv-a10上游引物cva10tf和下游引物cva10tr,以所述步骤(1)中rt-pcr产物为模版进行巢式pcr扩增,取扩增产物进行1%琼脂糖凝胶电泳,即可确定混合感染中是否存在ca10的感染。
本发明所述方法,从临床病人的粪便或脑脊液中提取病毒rna,用肠道病毒通用引物224-222先进行rt-pcr,然后以其产物为模板进行cva10tf和cva10tr巢式pcr,通过测序并在ncbiblast(美国国家生物技术信息中心的一套在dna数据库中进行相似性比较的分析工具,http://blast.ncbi.nlm.nih.gov/blast.cgi)比对,确定为不是cv-a10感染,再用所设计引物做巢式pcr即可。举例如下:
实施例:
1、样品处理
取0.5克粪便标本,加入2.5mlpbs充分振荡混匀,3000r/min离心30min,取上清液,保存于-20℃;
2、病毒rna提取
病毒rna的提取按试剂盒(qiampviralrnaminikit)说明书操作,具体如下:取140μl上清液或脑脊液加入560avl,颠倒混合后室温放置10min;加入560μl无水乙醇,颠倒混合;将上述溶液630μl加入吸附柱中,8000rpm离心1min,加入500μlaw1,8000rpm离心1min,以上均要倒掉收集管中的废液;加入500μlaw2,14000rpm离心3min,倒掉收集管中的废液;将吸附柱放入空收集管中,14000rpm离心1min;吸附柱放入新的离心管中,加洗脱缓冲液,室温放置1min,8000rpm离心1min,-20℃贮存;
3、扩增与测序
rt-pcr根据superonesteprt-pcrkit操作说明,具体如下:2хreactionbuffer25μl,rt-pcrmix1μl,22220pmol,22420pmol,rna10μl加水至50μl,混匀离心后50℃逆转录30min,按94℃2min,94℃30sec,52℃30sec,72℃30sec,30个循环;72℃延伸5min,此为第一步;然后再取rt-pcr产物10μl,用2хtaqpcrmastermix25μl,以an88和an89引物按以上第一步的条件(即94℃2min,94℃30sec,52℃30sec,72℃30sec,30个循环,72℃延伸5min)扩增,取扩增产物2μl1%琼脂糖凝胶电泳(所得电泳图见附图1)。有相应大小的特异片段(约321bp)用abi3730xl高自动化测序仪测序(sanger双脱氧终止法)。
以上测序结果均通过用ncbiblast比对后,确定为何种肠道病毒。
4.非cv-a10的样品再次pcr
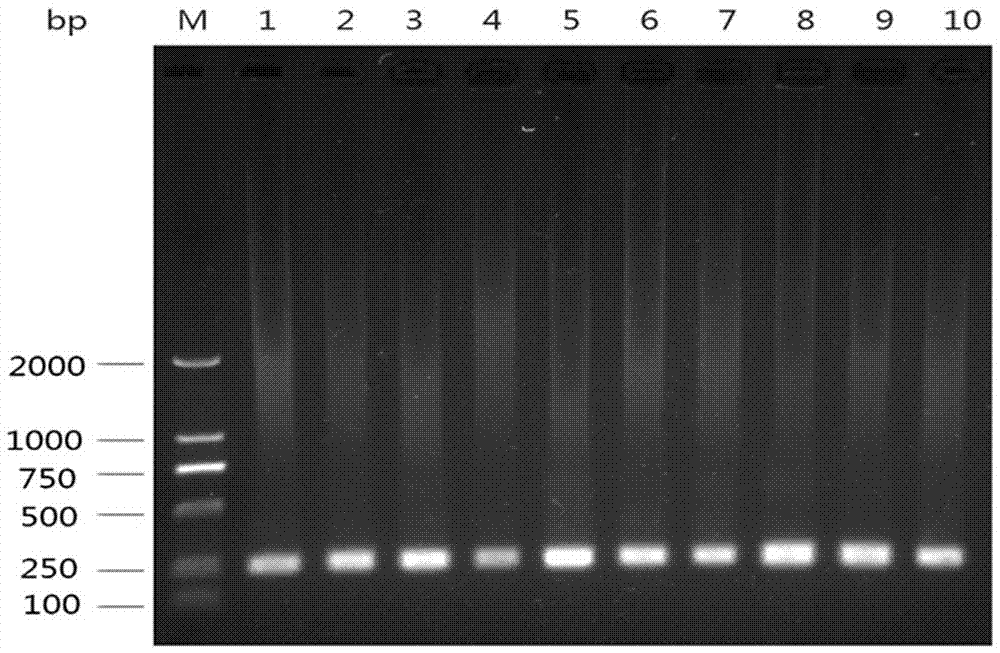
随机抽取10个通过以上步骤未检测出cv-a10感染的样品,用步骤3中第一步得到的rt-pcr产物10μl,用2хtaqpcrmastermix25μl,以cva10tf和cva10tr,按以上步骤3中第一步的条件(即94℃2min,94℃30sec,52℃30sec,2℃30sec,30个循环,72℃延伸5min)扩增;取扩增产物2μl1%琼脂糖凝胶电泳(所得电泳图见附图2)。
从电泳图(附图2)上可看到,凡是感染了cv-a10的样本均有约230bp大小特异片段显示,并将该片段用abi3730xl型自动化测序仪测序(基于sanger双脱氧终止法),其序列通过ncbiblast比对,若阳性样品的序列(见附图3,以一个样品的序列为例)与cv-a10同源大于75%,均为cv-a10感染。这说明通过特异引物扩增阳性样品,其测序结果与电泳图是相吻合的,因此在以后的工作中,只需通过琼脂糖凝胶电泳即可判断为cv-a10感染,这大大简化了工作步骤,简易了程序,缩短时间,节省费用,对大规模流行病的调查意义重大。
- 还没有人留言评论。精彩留言会获得点赞!