肽模拟化合物及其抗体‑药物缀合物的制作方法
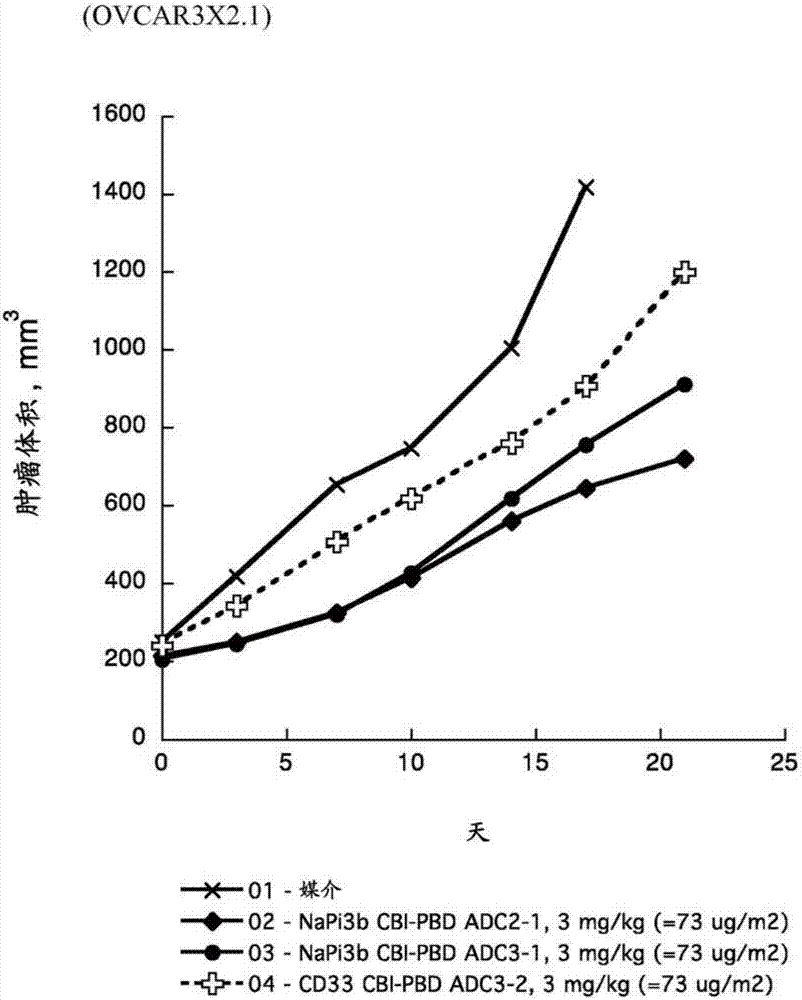
相关申请的交叉引用根据37cfr§1.53(b)提交的本非临时申请根据35usc§119(e)要求于2013年12月16日提交的美国临时申请61/916,661以及于2013年12月16日提交的美国临时申请61/916,691的权益,在此将其全部内容引入本申请,作为参考。序列表本申请包括序列表,其已经以ascii格式电子提交并将其全部内容通过引用的方式并入本申请。与2014年12月12日产生的所述ascii副本命名为p5760pct_sl.txt且其大小为35,047字节。本发明涉及用作抗体-药物缀合物(adc)的接头的新型肽模拟化合物。本发明还涉及包含肽模拟接头的adc。本发明还涉及治疗人类疾病的方法。
背景技术:
:近年来使用单克隆抗体(mabs)将抗癌药物直接递送至肿瘤细胞已吸引了大量关注。fda已批准两种新型抗体-药物缀合物用于治疗癌症。(brentuximabvedotin)是一种适用于治疗复发性或难治性霍奇金淋巴瘤和全身间变性大细胞淋巴瘤(alcl)的针对cd30的抗体-药物缀合物(adc)。(ado-trastuzumabemtansine)是一种批准用于患有her2阳性、晚期(转移性)乳腺癌的患者的新疗法。为了获得adc的治疗性有效抗肿瘤活性和可接受的治疗指数,可优化若干方面的设计。具体地,众所周知接头的化学结构对adc的有效性和安全性均可具有显著影响(ducry&stump,bioconjugatechem,2010,21,5-13)。选择正确的接头会影响药物适当递送至预期的癌细胞的细胞区室。接头通常可分为两类:可断裂的(例如肽、腙或二硫化物)或不可断裂的(例如硫醚)。可被溶酶体酶(例如组织蛋白酶b)水解的肽接头如缬氨酸-瓜氨酸(val-cit)已被用于使药物与抗体连接(us6214345)。部分由于其在系统循环中的相对稳定性以及在肿瘤中有效释放药物的能力,它们一直是特别有用的。包含val-cit接头的adc已在体内显示出相对稳定性(药物释放的t1/2约7天(doronina等(2008),bioconjugatechem.,19,1960-1963)。然而,由天然肽表示的化学间隔是有限的;因此,期望具有如肽一样起作用并可被溶酶体蛋白酶有效水解的各种非肽接头。非肽结构的更大多样性可产生通过肽接头无法获得的新的、有益的特性。本申请所提供的是用于adc的各种类型的非肽接头,其可被溶酶体酶裂解。技术实现要素:本发明涉及由式(i)表示的抗体-药物缀合物:ab—(l—d)p,ab为抗体;l为由下式表示的肽模拟接头:—str—(pm)—sp—其中str为共价连接至ab的延伸单元;sp为键或共价连接至药物部分的间隔单元;pm为选自以下的非肽化学部分:w为–nh-杂环烷基-或杂环烷基;y为杂芳基、芳基、-c(o)c1-c6亚烷基、c1-c6亚烷基-nh2、c1-c6亚烷基-nh-ch3、c1-c6亚烷基-n-(ch3)2、c1-c6烯基或c1-c6亚烷基;每个r1独立为c1-c10烷基、c1-c10烯基、(c1-c10烷基)nhc(nh)nh2或(c1-c10烷基)nhc(o)nh2;r3和r2各自独立为h、c1-c10烷基、c1-c10烯基、芳基烷基或杂芳基烷基,或r3和r2可一起形成c3-c7环烷基;r4和r5各自独立为c1-c10烷基、c1-c10烯基、芳基烷基、杂芳基烷基、(c1-c10烷基)och2-,或r4和r5可形成c3-c7环烷基环;p为1至8的整数;d为药物部分。本发明还涉及式(i)的抗体-药物缀合物的药物组合物。本发明还涉及治疗癌症的方法、式(i)的抗体-药物缀合物在治疗中的用途以及式(i)的抗体-药物缀合物在制备用于治疗癌症的药物中的用途。本发明还涉及制备式(i)的抗体-药物缀合物的方法。附图说明图1显示了cd33adc(cd33cbi-pbdadc3-2和adc2-2)在具有hl-60人急性髓细胞性白血病肿瘤的scid小鼠中的效能比较。图2显示了napi2badcs(napi2bcbi-pbdadc2-1和adc3-1)在具有ovcar3x2.1人卵巢肿瘤的scid-beige小鼠中的效能比较。具体实施方式本申请所提供的是可被溶酶体酶裂解的、用于adc的各种类型的非肽接头。例如,二肽(例如val-cit)中间的酰胺键被酰胺模拟物代替;和/或整个氨基酸(例如,val-cit二肽中的缬氨酸氨基酸)被非氨基酸部分(例如,环烷基二羰基结构(例如,环大小=4或5))代替。本发明涉及式(i)的抗体-药物缀合物。本发明还涉及式(i)的抗体-药物缀合物,其中y为杂芳基;r4和r5一起形成环丁基环。本发明还涉及式(i)的抗体-药物缀合物,其中y为选自以下的部分:本发明还涉及式(i)的抗体-药物缀合物,其中str为由下式表示的化学部分:其中r6选自c1-c10亚烷基、c1-c10烯基、c3-c8环烷基、(c1-c8亚烷基)o-和c1-c10亚烷基-c(o)n(ra)-c2-c6亚烷基,其中每个亚烷基可被选自以下的一至五个取代基取代:卤素、三氟甲基、二氟甲基、氨基、烷基氨基、氰基、磺酰基、磺酰胺基团、亚砜基团、羟基、烷氧基、酯基、羧酸基团、烷基硫基、c3-c8环烷基、c4-c7杂环烷基、芳基、芳基烷基、杂芳基烷基和杂芳基,每个ra独立为h或c1-c6烷基;sp为—ar—rb—,其中ar为芳基或杂芳基,rb为(c1-c10亚烷基)o-。本发明还涉及式(i)的抗体-药物缀合物,其中str具有下式:其中r7选自c1-c10亚烷基、c1-c10烯基、(c1-c10亚烷基)o-、n(rc)-(c2-c6亚烷基)-n(rc)和n(rc)-(c2-c6亚烷基);其中每个rc独立为h或c1-c6烷基;sp为—ar—rb—,其中ar为芳基或杂芳基,rb为(c1-c10亚烷基)o-或sp-c1-c6亚烷基-c(o)nh-。本发明还涉及式(i)的抗体-药物缀合物,其中ab为抗体;l为由下式表示的非肽化学部分r1为c1-c6烷基、c1-c6烯基、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2;r3和r2各自独立为h或c1-c10烷基。本发明还涉及式(i)的抗体-药物缀合物,其中ab为抗体;l为由下式表示的非肽化学部分r1为c1-c6烷基、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2;r4和r5一起形成c3-c7环烷基环。本发明还涉及式(i)的抗体-药物缀合物,其中ab为抗体;l为由下式表示的非肽化学部分r1为c1-c6烷基、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2。本发明还涉及式(i)的抗体-药物缀合物,其由下式表示:其中str为由下式表示的化学部分:其中r6选自c1-c10亚烷基和c1-c10亚烷基-c(o)n(ra)-c2-c6亚烷基,其中每个亚烷基可被选自以下的一至五个取代基取代:卤素、三氟甲基、二氟甲基、氨基、烷基氨基、氰基、磺酰基、磺酰胺基团、亚砜基团、羟基、烷氧基、酯基、羧酸基团、烷基硫基、c3-c8环烷基、c4-c7杂环烷基、芳基、芳基烷基、杂芳基烷基和杂芳基,每个ra独立为h或c1-c6烷基;p为1、2、3或4。本发明还涉及式(i)的抗体-药物缀合物,其由下式表示:其中str为由下式表示的化学部分:其中r6选自c1-c10亚烷基和c1-c10亚烷基-c(o)n(ra)-c2-c6亚烷基,其中每个亚烷基可被选自以下的一至五个取代基取代:卤素、三氟甲基、二氟甲基、氨基、烷基氨基、氰基、磺酰基、磺酰胺基团、亚砜基团、羟基、烷氧基、酯基、羧酸基团、烷基硫基、c3-c8环烷基、c4-c7杂环烷基、芳基、芳基烷基、杂芳基烷基和杂芳基,每个ra独立为h或c1-c6烷基;p为1、2、3或4。本发明还涉及式(i)的抗体-药物缀合物,其由下式表示:其中str为由下式表示的化学部分:其中r6选自c1-c10亚烷基和c1-c10亚烷基-c(o)n(ra)-c2-c6亚烷基,其中每个亚烷基可被选自以下的一至五个取代基取代:卤素、三氟甲基、二氟甲基、氨基、烷基氨基、氰基、磺酰基、磺酰胺基团、亚砜基团、羟基、烷氧基、酯基、羧酸基团、烷基硫基、c3-c8环烷基、c4-c7杂环烷基、芳基、芳基烷基、杂芳基烷基和杂芳基,每个ra独立为h或c1-c6烷基;p为1、2、3或4。本发明还涉及上述抗体-缀合物中的任一者,其中y为杂芳基、芳基或烯基;r6为c1-c10亚烷基。本发明还涉及上述抗体-缀合物(i)和(i)(a1)中的任一者,其中y为本发明还涉及上述抗体-缀合物(i)和(i)(a1)中的任一者,其中y为本发明还涉及上述抗体-缀合物(i)和(i)(a1)中的任一者,其中y为本发明还涉及上述抗体-缀合物(i)(a1)、(i)(b1)和(i)(c1)中的任一者,其中str为由下式表示的化学部分:r6为c1-c6亚烷基,其可取代有1-3个选自芳基和杂芳基的基团;sp为-c1-c6亚烷基-c(o)nh-或—ar—rb—,其中ar为芳基,rb为(c1-c3亚烷基)o-。本发明还涉及上述抗体-缀合物(i)(a1)、(i)(b1)和(i)(c1)中的任一者,其中str为由下式表示的化学部分:r6为c1-c6亚烷基,其可取代有1-3个选自芳基和杂芳基的基团;sp为-c1-c6亚烷基-c(o)nh-。本发明还涉及上述抗体-缀合物(i)和(i)(a1)中的任一者,其由下式表示:其中r1为c1-c6烷基-nh2、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2p为1、2、3或4。本发明还涉及上述抗体-缀合物(i)和(i)(b1)中的任一者,其由下式表示:其中p为1、2、3或4;r1为c1-c6烷基-nh2、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2;r4和r5各自独立为c1-c6烷基,其中所述烷基为未取代的,或r4和r5可形成c3-c7环烷基环。本发明还涉及上述抗体-缀合物(i)和(i)(c1)中的任一者,其由下式表示:其中p为1、2、3或4;r1为c1-c6烷基-nh2、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2。本发明还涉及抗体-缀合物(i),其由下式表示:其中p为1、2、3或4;r1为c1-c6烷基-nh2、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2。本发明还涉及抗体-药物缀合物(i)(b3),其中str为由下式表示的化学部分:r6为c1-c6亚烷基,其可取代有1-3个选自芳基和杂芳基的基团。本发明还涉及抗体-药物缀合物(i)(b3),其中r1为(ch2)3nhc(o)nh2。本发明还涉及抗体-药物缀合物(i)(b3),其中r1为(ch2)4nh2。本发明还涉及抗体-药物缀合物(i)、(i)(b1)、(i)(b2)和(i)(b3),其中r1为(c1-c6烷基)nhc(nh)nh2。本发明还涉及上述抗体-缀合物中的任一者,其中d为具有下式的二聚体药物部分:其中r11选自h、p(o)3h2、c(o)nraarbb或与l的键;r22选自h、p(o)3h2、c(o)nraarbb或与l的键;raa和rbb独立地选自h和任选取代有一个或多个f的c1-c6烷基,或raa和rbb形成五或六元杂环烷基;t为连接基团,选自c3-c12亚烷基、y1、(c1-c6亚烷基)-y1-(c1-c6亚烷基)、(c1-c6亚烷基)-y1-(c1-c6亚烷基)-y1-(c1-c6亚烷基)、(c2-c6亚烯基)-y1-(c2-c6亚烯基)和(c2-c6亚炔基)-y1-(c2-c6亚炔基);其中y1独立选自o、s、nr11、芳基和杂芳基;其中亚烷基、亚烯基、芳基和杂芳基独立且任选取代有f、oh、o(c1-c6烷基)、nh2、nhch3、n(ch3)2、nhc(o)(c1-c6亚烷基)m、op(o)3h2和c1-c6烷基,其中烷基任选取代有一个或多个f,m为0或1;或亚烷基、亚烯基、芳基和杂芳基独立且任选取代有与l的键,其中所述与l的键可经一个任选的取代基连接;d'为选自以下的药物部分:其中波浪线表示与t的连接位点;x1和x2独立选自o和nr33,其中r33选自h、c(o)和任选取代有一个或多个f的c1-c6烷基,或x1和x2各自独立地不存在;r44为h、co2r、c(o)或与l的键,其中r为c1-c6烷基或苄基;且r55为h或c1-c6烷基。本发明还涉及式(i)的抗体-药物缀合物,其由下式表示:其中ab为抗体,其结合选自以下的靶标:her2、cll1、cd33、cd22和napi2b;p为1-4;d为x1不存在或为o;r11为c(o)n-哌嗪(ch3)或p(o)3h2。本发明还涉及式(i)的抗体-药物缀合物,其由下式表示:其中ab为抗体,其结合选自以下的靶标:her2、cll1、cd33、cd22和napi2b;p为1-4;d为x1不存在或为o;r11为c(o)n-哌嗪(ch3)或p(o)3h2。本发明还涉及式(i)的抗体-药物缀合物,其由下式表示:其中ab为抗体,其结合选自以下的靶标:her2、cll1、cd33、cd22和napi2b;p为1-4;且r1为c1-c6烷基-nh2、c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2;r20为h或me。本发明还涉及式(i)(b6)的抗体-药物缀合物,其中r20为h,r1为(ch2)4nh2。本发明还涉及式(i)(b6)的抗体-药物缀合物,其中r20为me,r1为(ch2)4nh2。本发明还涉及式(i)的抗体-药物缀合物,其由下式表示:其中ab为抗体,其结合选自以下的靶标:her2、cll1、cd33、cd22和napi2b;p为1-4;r1为c1-c6烷基-nh2、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2;r20为h或me。本发明还涉及式(i)(b7)的抗体-药物缀合物,其中r20为h,r1为(ch2)4nh2。本发明还涉及式(i)(b7)的抗体-药物缀合物,其中r20为me,r1为(ch2)4nh2。本发明还涉及式(i)的抗体-药物缀合物,其由下式表示:其中ab为抗体,其结合选自以下的靶标:her2、cll1、cd33、cd22和napi2b;p为1-4;且r1为c1-c6烷基-nh2、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2。本发明还涉及式(i)(b8)的抗体-药物缀合物,其中r1为(ch2)4nh2。本发明还涉及式(i)的抗体-药物缀合物,其由下式表示:其中ab为抗体,其结合选自以下的靶标:her2、cll1、cd33、cd22和napi2b;p为1-4;r1为c1-c6烷基-nh2、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2;x1和x2各自独立地不存在或为o;每个r11独立为c(o)n-哌嗪(ch3)或p(o)3h2。本发明还涉及式(i)(b9)的抗体-药物缀合物,其中x1不存在,r11为p(o)3h2,r1为(ch2)4nh2。本发明还涉及上述式(i)(b6)、(i)(b7)、(i)(b8)和(i)(b9)的抗体-药物缀合物中任一者,其中所述ab为结合her2的抗体。本发明还涉及上述式(i)(b6)、(i)(b7)、(i)(b8)和(i)(b9)的抗体-药物缀合物中任一者,其中所述ab为结合cll1的抗体。本发明还涉及上述式(i)(b6)、(i)(b7)、(i)(b8)和(i)(b9)的抗体-药物缀合物中任一者,其中所述ab为结合cd33的抗体。本发明还涉及上述式(i)(b6)、(i)(b7)、(i)(b8)和(i)(b9)的抗体-药物缀合物中任一者,其中所述ab为结合cd22的抗体。本发明还涉及上述式(i)(b6)、(i)(b7)、(i)(b8)和(i)(b9)的抗体-药物缀合物中任一者,其中所述ab为结合napi2b的抗体。本发明还涉及上述抗体-药物缀合物中任一者,其中其中y1为苯基,其任选取代有f、oh、o(c1-c6烷基)、nh2、nhch3、n(ch3)2、nhc(o)(c1-c6亚烷基)m、op(o)3h2和c1-c6烷基,其中烷基任选取代有一个或多个f,m为0或1。本发明还涉及式(i)(b)(ld1)的非肽化合物:其中str为可共价连接至抗体的延伸单元;sp为键或共价连接至药物部分的间隔单元;r1为c1-c10烷基、(c1-c10烷基)nhc(nh)nh2或(c1-c10烷基)nhc(o)nh2;r4和r5各自独立为c1-c10烷基、芳基烷基、杂芳基烷基、(c1-c10烷基)och2-,或r4和r5可形成c3-c7环烷基环;d为药物部分。本发明还涉及由下式表示的非肽化合物:其中r6为c1-c10亚烷基;r4和r5一起形成c3-c7环烷基环。本发明还涉及由下式表示的非肽化合物:本发明还涉及下式的非肽化合物:其中str为可共价连接至抗体的延伸单元;sp为任选的共价连接至药物部分的间隔单元;y为杂芳基、芳基、-c(o)c1-c6亚烷基、c1-c6亚烷基-nh2、c1-c6亚烷基-nh-ch3、c1-c6亚烷基-n-(ch3)2、c1-c6烯基或c1-c6亚烷基;r1为c1-c10烷基、(c1-c10烷基)nhc(nh)nh2或(c1-c10烷基)nhc(o)nh2;r3和r2各自独立为h、c1-c10烷基、芳基烷基或杂芳基烷基,或r3和r2可一起形成c3-c7环烷基;d为药物部分。本发明还涉及由下式表示的非肽化合物:其中r6为c1-c10亚烷基。本发明还涉及由下式表示的非肽化合物:本发明还涉及所述非肽化合物中任一者,其中str具有下式:其中r6选自c1-c10亚烷基、c3-c8环烷基、o-(c1-c8亚烷基)和c1-c10亚烷基-c(o)n(ra)-c2-c6亚烷基,其中每个亚烷基可被选自以下的一至五个取代基取代:卤素、三氟甲基、二氟甲基、氨基、烷基氨基、氰基、磺酰基、磺酰胺基团、亚砜基团、羟基、烷氧基、酯基、羧酸基团、烷基硫基、c3-c8环烷基、c4-c7杂环烷基芳基、芳基烷基、杂芳基烷基和杂芳基;每个ra独立为h或c1-c6烷基;sp为—ar—rb—,其中ar为芳基或杂芳基,rb为(c1-c10亚烷基)o-。本发明还涉及非肽化合物,其中r6为c1-c10亚烷基,sp为—ar—rb—,其中ar为芳基,rb为(c1-c6亚烷基)o-。本发明还涉及非肽化合物,其中r6为–(ch2)q,q为1-10。本发明还涉及非肽化合物,其中str具有下式:其中r7选自c1-c10亚烷基、c1-c10亚烷基-o、n(rc)-(c2-c6亚烷基)-n(rc)和n(rc)-(c2-c6亚烷基);其中每个rc独立为h或c1-c6烷基;sp为—ar—rb—,其中ar为芳基或杂芳基,rb为(c1-c10亚烷基)o-。本发明还涉及非肽化合物,其中r6为c1-c10亚烷基,sp为—ar—rb—,其中ar为芳基,rb为(c1-c6亚烷基)o-。本发明还涉及上述式(iv)、(iv)(a)、(iv)(b)、(v)、(v)(a)和(v)(b)的非肽化合物中任一者,其中d为具有下式的二聚体药物部分:其中r11选自h、p(o)3h2、c(o)nraarbb或与l的键;r22选自h、p(o)3h2、c(o)nraarbb或与l的键;raa和rbb独立地选自h和任选取代有一个或多个f的c1-c6烷基,或raa和rbb形成五或六元杂环烷基;t为连接基团,选自c3-c12亚烷基、y1、(c1-c6亚烷基)-y1-(c1-c6亚烷基)、(c1-c6亚烷基)-y1-(c1-c6亚烷基)-y1-(c1-c6亚烷基)、(c2-c6亚烯基)-y1-(c2-c6亚烯基)和(c2-c6亚炔基)-y1-(c2-c6亚炔基);其中y1独立选自o、s、nr11、芳基和杂芳基;其中亚烷基、亚烯基、芳基和杂芳基独立且任选取代有f、oh、o(c1-c6烷基)、nh2、nhch3、n(ch3)2、nhc(o)(c1-c6亚烷基)m、op(o)3h2和c1-c6烷基,其中烷基任选取代有一个或多个f,m为0或1;或亚烷基、亚烯基、芳基和杂芳基独立且任选取代有与l的键,其中所述与l的键可经一个任选的取代基连接;d'为选自以下的药物部分:其中波浪线表示与t的连接位点;x1和x2独立选自o和nr33,其中r33选自h、c(o)和任选取代有一个或多个f的c1-c6烷基,或x1和x2各自独立地不存在;r44为h、co2r、c(o)或与l的键,其中r为c1-c6烷基或苄基;且r55为h或c1-c6烷基。本发明还涉及任一上述接头药物化合物,其中其中y1为苯基,其任选取代有f、oh、o(c1-c6烷基)、nh2、nhch3、n(ch3)2、nhc(o)(c1-c6亚烷基)m、op(o)3h2和c1-c6烷基,其中烷基任选取代有一个或多个f,m为0或1。本发明还涉及下式的化合物:其中,d为下式的药物部分本发明还涉及下式的化合物:其中,d为下式的药物部分x1不存在或为o;r11为c(o)n-哌嗪(ch3)或p(o)3h2。本发明还涉及下式的化合物:其中,r1为c1-c6烷基-nh2、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2;r20为h或me。本发明还涉及式(i)(b((ld6)的化合物,其中r20为h,r1为(ch2)4nh2。本发明还涉及式(i)(b((ld6)的化合物,其中r20为me,r1为(ch2)4nh2。本发明还涉及下式的化合物:其中,r1为c1-c6烷基-nh2、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2;r20为h或me。本发明还涉及式(i)(b((ld7)的化合物,其中r20为h,r1为(ch2)4nh2。本发明还涉及式(i)(b((ld7)的化合物,其中r20为me,r1为(ch2)4nh2。本发明还涉及下式的化合物:其中,r1为c1-c6烷基-nh2、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2。本发明还涉及式(i)(b)(ld8)的化合物,其中r1为(ch2)4nh2。本发明还涉及下式的化合物:其中,r1为c1-c6烷基-nh2、(c1-c6烷基)nhc(nh)nh2或(c1-c6烷基)nhc(o)nh2;x1和x2各自独立地不存在或为o;每个r11独立为c(o)n-哌嗪(ch3)或p(o)3h2。本发明还涉及任一上述缀合物,其中d为选自以下的抗生素部分:克林霉素、新生霉素、瑞他莫林(retapamulin)、达托霉素、gsk-2140944、cg-400549、西他沙星、替考拉宁、三氯生、萘啶酮、雷得唑来、多柔比星、氨苄西林、万古霉素、亚胺培南、多利培南、吉西他滨、达巴万星和阿奇霉素。上述抗生素的杀菌和抑菌作用的机制包括但不限于:(i)抑制细胞壁、肽聚糖延伸(万古霉素、替考拉宁、达巴万星);(ii)抑制细胞壁、青霉素结合蛋白交联(亚胺培南、多利培南、氨苄西林);(iii)细胞膜去极化(达托霉素);(iv)干扰dna复制(吉西他滨);(v)dna结合(多柔比星);(vi)烯酰acp-还原酶fabi(cg-400549、三氯生、萘啶酮);(vii)抑制核糖体蛋白合成,核糖体30s(克林霉素、瑞他莫林、雷得唑来);和(viii)拓朴异构酶(topoiia)抑制剂(新生霉素、西他沙星、gsk-2140944)。在结构上,大部分抗生素可分为以下组:(i)氨基糖甙类;(ii)β-内酰胺类;(iii)大环内酯类/环状肽;(iv)四环素类;(v)氟喹啉类/氟喹诺酮类;和(vi)噁唑烷酮类。参见shaw,k.andbarbachyn,m.(2011)ann.n.y.acad.sci.1241:48-70;sutcliffe,j.(2011)ann.n.y.acad.sci.1241:122-152。本发明还涉及本申请所述的任一上述抗体-药物缀合物或抗体-抗生素缀合物,其中p为1。本发明还涉及本申请所述的任一上述抗体-药物缀合物或抗体-抗生素缀合物,其中p为2。本发明还涉及本申请所述的任一上述抗体-药物缀合物或抗体-抗生素缀合物,其中p为3。本发明还涉及本申请所述的任一上述抗体-药物缀合物或抗体-抗生素缀合物,其中p为4。本发明提供新的抗菌疗法,其旨在通过靶标逃避常规抗生素疗法的菌群来防止抗生素逃脱。该新的抗菌疗法使用抗体抗生素缀合物(aac)来实现,其中对于存在于金黄色葡萄球菌(s.aureus)(包括mrsa)上的细胞壁组分特异的抗体与有效的抗生素化学连接。该抗生素经一种可蛋白酶断裂的肽接头而连接至抗体,该接头设计为经组织蛋白酶b(一种存在于大部分哺乳动物细胞类型中的溶酶体蛋白酶)断裂(dubowchiketal(2002)bioconj.chem.13:855-869)。aac作为前药起作用,其中抗生素处于失活状态(由于抗体的大尺寸)直到接头断裂。由于天然感染中存在的相当大部分的金黄色葡萄球菌由宿主细胞(主要为嗜中性粒细胞和巨噬细胞)容纳,在宿主中感染的过程中的某一点以及在宿主细胞内度过的时间为细菌提供了逃避抗生素活性的重大机会。本发明的aac被设计为在细菌被宿主细胞容纳后结合金黄色葡萄球菌并在吞噬溶酶体内释放抗生素。通过该机制,aac能够将活性抗生素特定地集中于其中常规抗生素较差治疗金黄色葡萄球菌的位点。尽管本发明不受具体作用机制限制或限定,aac经以下三种潜在机制改善抗生素活性:(1)aac将抗生素递送至容纳细菌的哺乳动物细胞内部,由此增强不良分散于其中隐蔽细菌的吞噬溶酶体内的抗生素的效能。(2)aac调理细菌由此增强游离细菌被吞噬细胞摄取,并且局部释放抗生素以杀死细菌(当它们隐蔽在吞噬溶酶体中时)。(3)aac通过将抗生素与抗体连接而改善抗生素的体内半衰期(改善的药代动力学)。aac的改善的药代动力学能够将充足的抗生素递送至其中金黄色葡萄球菌集中的区域,同时限制需要系统给药的抗生素的总剂量。该性质允许使用aac的长期疗法以靶标持续感染,并且具有最低的抗生素副作用。本发明还涉及抗体-药物缀合物,其为抗体-抗生素缀合物,其中抗体结合细菌且d为抗生素部分。本发明还涉及任一上述抗体-抗生素缀合物,其中d为选自以下的药物:克林霉素、新生霉素、瑞他莫林、达托霉素、gsk-2140944、cg-400549、西他沙星、替考拉宁、三氯生、萘啶酮、雷得唑来、多柔比星、氨苄西林、万古霉素、亚胺培南、多利培南、吉西他滨、达巴万星和阿奇霉素。本发明的另一方面为药物组合物,其包含本发明的抗体-抗生素缀合物化合物。本发明的另一方面为治疗细菌感染的方法,通过对患者给予治疗有效量的本发明的抗体-抗生素缀合物化合物。在一个实施方案中,所述患者为人。在一个实施方案中,细菌感染为金黄色葡萄球菌感染。在一些实施方案中,患者已经诊断有金黄色葡萄球菌感染。在一些实施方案中,治疗细菌感染包括减少细菌载量。在另一个实施方案中,治疗方法还包括给予第二种治疗剂。在另一个实施方案中,第二种治疗剂为抗生素。在一个实施方案中,与本发明的抗体-抗生素缀合物化合物组合给予的第二种抗生素选自以下结构类别:(i)氨基糖甙类;(ii)β-内酰胺类;(iii)大环内酯类/环状肽;(iv)四环素类;(v)氟喹啉类/氟喹诺酮类;和(vi)噁唑烷酮类。在一个实施方案中,与本发明的抗体-抗生素缀合物化合物组合给予的第二种抗生素选自利福霉素、克林霉素、新生霉素、瑞他莫林、达托霉素、gsk-2140944、cg-400549、西他沙星、替考拉宁、三氯生、萘啶酮、雷得唑来、多柔比星、氨苄西林、万古霉素、亚胺培南、多利培南、吉西他滨、达巴万星和阿奇霉素。本发明的另一方面为制备本发明的抗体或抗体-抗生素缀合物化合物的方法。本发明的另一方面为治疗细菌感染的试剂盒,其包含本发明的药物组合物和使用说明。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合选自以下的一种或多种多肽:cll1bmpr1b;e16;steap1;0772p;mpf;napi2b;sema5b;pscahlg;etbr;msg783;steap2;trpm4;cripto;cd21;cd79b;fcrh2;her2;nca;mdp;il20rα;短缩素;ephb2r;aslg659;psca;geda;baff-r;cd22;cd79a;cxcr5;hla-dob;p2x5;cd72;ly64;fcrh1;irta2;tenb2;pmel17;tmeff1;gdnf-ra1;ly6e;tmem46;ly6g6d;lgr5;ret;ly6k;gpr19;gpr54;asphd1;酪氨酸酶;tmem118;gpr172a;muc16;和cd33。本发明还涉及治疗有需要的人的疾病的方法,包括向所述人给予有效量的本发明的抗体-药物缀合物。本发明还涉及药物组合物,其包含本发明的化合物及其药用载体。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合选自以下的一种或多种多肽:cll1;steap1;napi2b;steap2;trpm4;cripto;cd21;cd79b;fcrh2;her2;cd22;cd79a;cd72;ly64;ly6e;muc16;和cd33。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合cd33。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合cd22。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合napi2b。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合cll1。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合her2。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合cd33且抗-cd33抗体包括:包含氨基酸序列seqidno:11的hvr-l1,包含氨基酸序列seqidno:12的hvr-l2,包含氨基酸序列seqidno:13的hvr-l3,包含氨基酸序列seqidno:14的hvr-h1,包含氨基酸序列seqidno:15的hvr-h2,以及包含氨基酸序列seqidno:16的hvr-h3。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合cd33且所述抗cd33抗体包括:包含氨基酸序列seqidno:17的vl域和包含氨基酸序列seqidno:18的vh域。在一些实施方案中,所述抗体-药物缀合物的抗体结合cd33。在一些实施方案中,所述抗体-药物缀合物的抗体包括(a)包含氨基酸序列seqidno:22的hvr-h1;(b)包含氨基酸序列seqidno:23的hvr-h2;(c)包含氨基酸序列seqidno:24的hvr-h3;(d)包含氨基酸序列seqidno:19的hvr-l1;(e)包含氨基酸序列seqidno:20的hvr-l2;以及(f)包含选自seqidno:21的氨基酸序列的hvr-l3。在一些实施方案中,所述抗体包含如以上提供的任意实施方案中的vh域,以及如以上提供的任意实施方案中的vl域。在一个实施方案中,所述抗体分别包含seqidno:25和seqidno:26的vl和vh序列,包括那些序列的翻译后修饰。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合napi2b。本发明还涉及任一上述抗体-药物缀合物,其中所述抗体结合napi2b且所述napi2b抗体包括:包含氨基酸序列seqidno:1的hvr-l1,包含氨基酸序列seqidno:2的hvr-l2,包含氨基酸序列seqidno:3的hvr-l3,包含氨基酸序列seqidno:4的hvr-h1,包含氨基酸序列seqidno:5的hvr-h2,以及包含氨基酸序列seqidno:6的hvr-h3。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合napi2b且所述napi2b抗体包括:包含氨基酸序列seqidno:7的vl域和包含氨基酸序列seqidno:8的vh域。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合napi2b且所述napi2b抗体包含氨基酸序列seqidno:9和氨基酸序列seqidno:10。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合cd22。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合cd22且所述cd22抗体包括:包含氨基酸序列seqidno:41的hvr-l1,包含氨基酸序列seqidno:42的hvr-l2,包含氨基酸序列seqidno:43的hvr-l3,包含氨基酸序列seqidno:44的hvr-h1,包含氨基酸序列seqidno:45的hvr-h2,以及包含氨基酸序列seqidno:46的hvr-h3。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合cd22且所述cd22抗体包括:包含氨基酸序列seqidno:47的vl域和包含氨基酸序列seqidno:48的vh域。本发明还涉及任一上述抗体-药物缀合物,其中抗体结合cd22且所述cd22抗体包含氨基酸序列seqidno:49和氨基酸序列seqidno:50。定义除非另有说明,否则如本申请所使用的下列术语和短语意欲具有如下含义:当本申请中使用商品名时,申请人意欲独立地包括商品名产品制剂、通用药和所述商品名产品的活性药物成分。如本申请所使用的术语“肽模拟”或pm是指非肽化学部分。肽类是通过肽(酰胺)键连接的氨基酸单体的短链,当一个氨基酸的羧基与另一氨基酸的氨基反应时形成所述共价化学键。最短的肽类是二肽,其组成为通过单一肽键连接的2个氨基酸,然后是三肽、四肽等。肽模拟化学部分包含非氨基酸化学部分。肽模拟化学部分还可包含被一个或多个非氨基酸化学单元分隔的一个或多个氨基酸。肽模拟化学部分在其任意化学结构部分中不含有通过肽键连接的两个或多个邻近氨基酸。如本申请所使用的术语“氨基酸”是指甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、甲硫氨酸、赖氨酸、精氨酸、组氨酸、色氨酸、天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺或瓜氨酸。术语“抗生素”(abx或abx)包括特异性抑制微生物诸如细菌的生长或将其杀死的任何分子,但其在所给予的浓度和给药间隔对宿主是非致命性的。在具体方面,抗生素在所给予的浓度和给药间隔对宿主是无毒性的。对细菌有效的抗生素可广泛分类为杀菌的(即直接杀死)或抑菌的(即防止分裂)。抗菌抗生素可进一步细分类为窄谱或广谱。广谱抗生素针对宽范围的细菌有效,包括革兰氏阳性和革兰氏阴性菌,这与窄谱抗生素不同,后者仅针对较小范围细菌或特定细菌家族有效。抗生素的实例包括:(i)氨基糖甙类,例如阿米卡星、庆大霉素、卡那霉素、新霉素、奈替米星、链霉素、妥布霉素、巴龙霉素;(ii)安沙霉素类,例如格尔德霉素、除莠霉素;(iii)碳头孢烯类,例如氯碳头孢;(iv)碳青霉烯类,例如厄他培南、多利培南、亚胺培南/西司他丁、美罗培南;(v)头孢菌素类(第一代),例如头孢羟氨苄、头孢唑林、头孢噻吩、头孢氨苄;(vi)头孢菌素类(第二代),例如头孢克洛、头孢孟多、头孢西丁、头孢丙烯、头孢呋辛、(vi)头孢菌素类(第三代),例如头孢克肟、头孢地尼、头孢托仑、头孢哌酮、头孢噻肟、头孢泊肟、头孢他啶、头孢布烯、头孢唑肟、头孢曲松;(vii)头孢菌素类(第四代),例如头孢吡肟;(viii)头孢菌素类(第五代),例如头孢托罗;(ix)糖肽类,例如替考拉宁、万古霉素;(x)大环内酯类,例如阿奇霉素、克拉霉素、地红霉素、红霉素、罗红霉素、醋竹桃霉素、泰利霉素、大观霉素;(xi)单环β-内酰胺类,例如氨曲南;(xii)青霉素类,例如阿莫西林、氨苄西林、axlocillin、羧苄西林、氯唑西林、双氯西林、氟氯西林、美洛西林、甲氧西林、萘夫西林、苯唑西林、盘尼西林、哌拉西林、替卡西林;(xiii)抗生素多肽类,例如杆菌肽、粘菌素、多粘菌素b;(xiv)喹诺酮类,例如环丙沙星、依诺沙星、加替沙星、左氧氟沙星、洛美沙星、莫西沙星、诺氟沙星、氧氟沙星、曲伐沙星;(xv)磺酰胺类,例如磺胺米隆、偶氮磺胺、磺胺醋酰、磺胺甲二唑、磺胺、柳氮磺吡啶、磺胺异噁唑、甲氧苄啶、甲氧苄啶-磺胺甲噁唑(tmp-smx);(xvi)四环素类,例如地美环素、多西环素、米诺环素、土霉素、四环素;以及(xvii)其他抗生素,诸如胂凡纳明、氯霉素、克林霉素、林可霉素、乙胺丁醇、磷霉素、夫西地酸、呋喃唑酮、异烟肼、利奈唑胺、甲硝唑、莫匹罗星、呋喃妥因、平板霉素、吡嗪酰胺、奎奴普丁/达福普汀、利福平(rifampin/rifampicin)或替硝唑。术语“甲氧西林耐药金黄色葡萄球菌”(mrsa),或者已知为多药耐药金黄色葡萄球菌或苯唑西林耐药金黄色葡萄球菌(orsa),是指对β-内酰胺抗生素抵抗的金黄色葡萄球菌的任何菌株,所述抗生素包括青霉素类(例如甲氧西林、双氯西林、萘夫西林、苯唑西林等)以及头孢菌素类。“甲氧西林敏感金黄色葡萄球菌”(mssa)是指对β-内酰胺抗生素敏感的金黄色葡萄球菌的任何菌株。本申请中的术语“抗体”以其最广泛的含义使用并且具体涵盖单克隆抗体、多克隆抗体、二聚体、多聚体、多特异性抗体(例如双特异性抗体)和抗体片段,只要它们表现出所需的生物活性(milleretal(2003)jour.ofimmunology170:4854-4861)。抗体可以为鼠、人、人源化、嵌合的抗体或来源于其它物种的抗体。抗体为由能够识别和结合特异性抗原的免疫系统产生的蛋白(janeway,c.,travers,p.,walport,m.,shlomchik(2001)immunobiology,5thed.,garlandpublishing,newyork)。靶标抗原一般具有由多种抗体上的cdr识别的大量结合位点,也称作表位。特异性结合不同表位的各抗体具有不同的结构。因此,一种抗原可以具有一种以上相应的抗体。抗体包括全长免疫球蛋白分子或全长免疫球蛋白分子的免疫活性部分,即包含免疫特异性结合所关注靶标的抗原或其部分的抗原结合位点的分子,所述靶标包括但不限于癌细胞或产生与自身免疫疾病相关的自身免疫抗体的细胞。本申请公开的免疫球蛋白可以具有任意类型(例如igg、ige、igm、igd和iga)、类别(例如igg1、igg2、igg3、igg4、iga1和iga2)或亚类的免疫球蛋白分子。免疫球蛋白可来源于任意物种。然而,在一个方面中,免疫球蛋白来源于人、鼠或兔。如本申请所使用的术语"抗体片段"包含全长抗体的一部分,一般为其抗原结合区或可变区。抗体片段的实例包括fab、fab'、f(ab')2和fv片段;双抗体;线性抗体;微抗体(minibody)(olafsenetal(2004)proteineng.design&sel.17(4):315-323);fab表达文库制备的片段;抗-个体基因型(抗-id)抗体;cdr(互补决定区);和以免疫特异性方式结合癌细胞抗原、病毒抗原或微生物抗原的以上任意的表位-结合片段;单-链抗体分子;和由抗体片段形成的多特异性抗体。如本申请所使用的术语“单克隆抗体”指从基本上同质的抗体群中获得的抗体,即除可能少量存在的天然发生的可能突变之外,包含在该群体中的各抗体是相同的。单克隆抗体是高度特异的,靶向单个抗原位点。此外,与包括针对不同决定簇(表位)的不同抗体的多克隆抗体制品不同的是,每种单克隆抗体只针对抗原上的单一决定簇。除其特异性外,单克隆抗体的优点还在于它们可以以不被其它抗体污染的方式合成。修饰语“单克隆”表示获自基本上同质的抗体群的抗体特性,并非解释为需要由任何特定方法产生抗体。例如,可以通过首先由kohler等(1975)nature,256:495描述的杂交瘤方法制备用于本发明的单克隆抗体或可以通过重组dna方法制备(例如参见:us4816567;us5807715)。例如,还可以使用clackson等(1991)nature,352:624-628;marks等(1991)j.mol.biol.,222:581-597中所述的技术从噬菌体抗体文库分离单克隆抗体。本申请的单克隆抗体具体地包括“嵌合”抗体,其中重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类型或亚型的抗体中的相应序列相同或同源,而所述链的剩余部分与来源于另一物种或属于另一抗体类型或亚型的抗体中的相应序列相同或同源,本申请中还包括所述抗体的片段,只要它们显示出期望的生物学活性(us4816567;和morrison等(1984)proc.natl.acad.sci.usa,81:6851-6855)。本申请关注的嵌合抗体包括“灵长化(primatized)”抗体,其包含来源于非人的灵长类(例如旧大陆猴、猿等)的可变区抗原结合序列和人恒定区序列。如本申请所使用的术语“完整抗体”为包含vl和vh结构域以及轻链恒定域(cl)和重链恒定域ch1、ch2和ch3的抗体。恒定域可以为天然序列恒定域(例如人天然序列恒定域)或其氨基酸序列变体。完整抗体可以具有一种或多种“效应子作用”,意指归因于抗体的fc恒定区(天然序列fc区或氨基酸序列变体fc区)的那些生物活性。抗体效应子作用的实例包括c1q结合;补体依赖性细胞毒性;fc受体结合;抗体-依赖性细胞介导的细胞毒作用(adcc);胞吞作用;和细胞表面受体诸如b细胞受体和bcr的下调。如本申请所使用的术语“fc区”是指包含至少一部分恒定区的免疫球蛋白重链的c末端区。所述术语包含天然序列fc区和变体fc区。在一个实施方案中,人igg重链fc区从cys226或从pro230延伸至重链的羧基端。然而,所述fc区的c末端赖氨酸(lys447)可存在或不存在。除非在本申请中另有规定,否则fc区或恒定区中的氨基酸残基编号是根据eu编号系统,也称作eu索引,如在kabatetal.,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md,1991中所述。如本申请所使用的术语“框架”或“fr”是指除高变区(hvr)残基外的可变域残基。可变域的fr通常由四个fr域组成:fr1、fr2、fr3和fr4。因此,hvr和fr序列通常出现在以下vh(或vl)的序列中:fr1-h1(l1)-fr2-h2(l2)-fr3-h3(l3)-fr4。取决于其重链恒定域的氨基酸序列,可以将完整抗体指定为不同“类别”。存在5种主要类别的完整免疫球蛋白抗体:iga、igd、ige、igg和igm,且可以将其中的几种进一步分成“亚类”(亚型),例如igg1、igg2、igg3、igg4、iga1和iga2。对应于不同抗体类别的重链恒定域分别称作α、δ、ε、γ和μ。不同类别免疫球蛋白的亚单位结构和三维构型是众所周知的。ig型包括铰链-修饰型或无铰链型(rouxetal(1998)j.immunol.161:4083-4090;lundetal(2000)eur.j.biochem.267:7246-7256;us2005/0048572;us2004/0229310)。如本申请所使用的术语“人抗体”是指具有以下氨基酸序列的抗体,所述氨基酸序列对应于通过人或人细胞产生的或来源于利用人抗体库或其它人抗体编码序列的非人来源的抗体的氨基酸序列。人抗体的该定义特别排除了包含非人抗原结合残基的人源化抗体。如本申请所使用的术语“人共有框架”是指在选择人免疫球蛋白vl或vh框架序列中代表最常见氨基酸残基的框架。通常,人免疫球蛋白vl或vh序列的选择是来自可变域序列的亚组。通常,所述序列亚组是如kabatetal.,sequencesofproteinsofimmunologicalinterest,fifthedition,nihpublication91-3242,bethesdamd(1991),vols.1-3中的亚组。在一个实施方案中,对于vl,所述亚组是如以上kabat等中的亚组kappai。在一个实施方案中,对于vh,所述亚组是如以上kabat等中的亚组iii。如本申请所述使用的术语“人源化抗体”是指包含来自非人hvr的氨基酸残基以及来自人fr的氨基酸残基的嵌合抗体。在某些实施方案中,人源化抗体将包含实质上所有的至少一种、以及典型两种的可变区,其中所有或实质上所有的hvr(例如,cdr)对应于非人抗体的那些,且所有或实质上所有的fr对应于人抗体的那些。人源化抗体任选可包含至少一部分的来源于人抗体的抗体恒定区。抗体的“人源化形式”,例如非人抗体,是指已进行人源化的抗体。如本申请所使用的术语“高变区”或“hvr”是指序列高度可变和/或形成结构定义环(“高度可变环”)的抗体可变域的各区域。通常,天然四链抗体包含6个hvr;三个在vh(h1、h2、h3),三个在vl(l1、l2、l3)。hvr通常包含来自高度可变环和/或来自“互补决定区”(cdr)的氨基酸残基,后者具有最高序列可变性和/或涉及抗体识别。示例性高度可变环出现在氨基酸残基26-32(l1)、50-52(l2)、91-96(l3)、26-32(h1)、53-55(h2)和96-101(h3)处(chothiaandlesk,j.mol.biol.196:901-917(1987))。示例性cdr(cdr-l1、cdr-l2、cdr-l3、cdr-h1、cdr-h2和cdr-h3)出现在以下氨基酸残基处:l1的24-34、l2的50-56、l3的89-97、h1的31-35b、h2的50-65以及h3的95-102(kabatetal.,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md(1991))。除了vh中的cdr1外,cdr通常包含形成高度可变环的氨基酸残基。cdr还包括“特异性决定残基”或“sdr”,其为接触抗原的残基。sdr包含在cdr称作缩写-cdr或a-cdr的区域内。示例性a-cdr(a-cdr-l1、a-cdr-l2、a-cdr-l3、a-cdr-h1、a-cdr-h2和a-cdr-h3)出现在以下氨基酸残基处:l1的31-34、l2的50-55、l3的89-96、h1的31-35b、h2的50-58以及h3的95-102(参见almagroandfransson,front.biosci.13:1619-1633(2008))。除非另外指明,否则可变域中的hvr残基和其它残基(例如,fr残基)在本申请中的编号是根据以上kabat等。如本申请所使用的术语“可变区”或“可变域”是指涉及将抗体结合至抗原的抗体重链或轻链域。天然抗体的重链和轻链可变域(分别为vh和vl)通常具有相似结构,各域包含四个保守框架区(fr)和三个高变区(hvr)(参见例如kindtetal.kubyimmunology,6thed.,w.h.freemanandco.,page91(2007))。单个vh或vl域可足以赋予抗原结合特异性。此外,可使用来自结合抗原的抗体的vh或vl域来分离结合特定抗原的抗体,从而分别筛选互补vl或vh域的文库。参见例如,portolanoetal.,j.immunol.150:880-887(1993);clarksonetal.,nature352:624-628(1991)。如本申请所使用的术语“载体(vector)”是指能将另一核酸递送至其连接部位的核酸分子。所述术语包括作为自我复制核酸结构的载体以及并入已将其引入的宿主细胞基因组中的载体。某些载体能够指引核酸表达至其有效连接部位。此类载体在本申请中称作“表达载体”。如本申请所使用的术语“游离半胱氨酸”是指已经改造到亲本抗体中、带有巯基官能团(-sh)并且未作为分子内或分子间二硫键配对的半胱氨酸残基。如本申请所使用的术语“接头(linker)”、“接头单元”或“连接”是指包含使药物部分共价连接至抗体的原子链的化学部分。在各个实施方案中,接头为二价基团,指定为l。如本申请所使用的术语“药物部分”是指抑制或阻止细胞功能和/或引起细胞死亡或破坏的物质。细胞毒性试剂包括但不限于放射性同位素(例如at211、i131、i125、y90、re186、re188、sm153、bi212、p32、pb212和lu的放射性);化疗剂或药物(例如,甲氨蝶呤、阿霉素、长春碱类(长春新碱、长春花碱、依托泊苷)、多柔比星、美法仑、丝裂霉素c、苯丁酸氮芥、柔红霉素或其它嵌入剂);生长抑制剂;酶及其片段例如溶核酶;以及以下公开的各种抗肿瘤或抗癌试剂。除非在权利要求中另有定义,否则如本申请所使用的术语“酰基”是指基团-c(o)r’,其中r’是烷基、c3-c6环烷基或杂环基,其各自如本申请所定义。除非在权利要求中另有定义,否则如本申请所使用的术语“烷氧基”是指基团-or’,其中r’是如上定义的c1-c4烷基或c3-c6环烷基。“烷氧基”的实例包括甲氧基、乙氧基、异丙氧基、丙氧基、丁氧基、叔丁氧基、异丁氧基、环丙氧基和环丁氧基,以及其卤代形式,例如氟甲氧基和二氟甲氧基。除非在权利要求中另有定义,否则如本申请所使用的术语“烷基”是指具有1-12个(c1-c12)碳原子的直链或支链、单价或二价烃链基团,其可为未取代的或被多个取代度取代,例如包含在本发明内的一、二、三、四、五或六取代。取代基的实例选自:卤素、三氟甲基、二氟甲基、氨基、烷基氨基、氰基、磺酰基、磺酰胺基团、亚砜基团、羟基、烷氧基、酯基、羧酸和烷基硫基。如本申请所使用的“烷基”的实例包括但不限于甲基(me,-ch3)、乙基(et、-ch2ch3)、1-丙基(n-pr、正丙基、-ch2ch2ch3)、2-丙基(i-pr、异丙基、-ch(ch3)2)、1-丁基(n-bu、正丁基、-ch2ch2ch2ch3)、2-甲基-1-丙基(i-bu、异丁基、-ch2ch(ch3)2)、2-丁基(s-bu、仲丁基、-ch(ch3)ch2ch3)、2-甲基-2-丙基(t-bu、叔丁基、-c(ch3)3)、1-戊基(正戊基、-ch2ch2ch2ch2ch3)、2-戊基(-ch(ch3)ch2ch2ch3)、3-戊基(-ch(ch2ch3)2)、2-甲基-2-丁基(-c(ch3)2ch2ch3)、3-甲基-2-丁基(-ch(ch3)ch(ch3)2)、3-甲基-1-丁基(-ch2ch2ch(ch3)2)、2-甲基-1-丁基(-ch2ch(ch3)ch2ch3)、1-己基(-ch2ch2ch2ch2ch2ch3)、2-己基(-ch(ch3)ch2ch2ch2ch3)、3-己基(-ch(ch2ch3)(ch2ch2ch3))、2-甲基-2-戊基(-c(ch3)2ch2ch2ch3)、3-甲基-2-戊基(-ch(ch3)ch(ch3)ch2ch3)、4-甲基-2-戊基(-ch(ch3)ch2ch(ch3)2)、3-甲基-3-戊基(-c(ch3)(ch2ch3)2)、2-甲基-3-戊基(-ch(ch2ch3)ch(ch3)2)、2,3-二甲基-2-丁基(-c(ch3)2ch(ch3)2)、3,3-二甲基-2-丁基(-ch(ch3)c(ch3)3,以及其二价(“亚烷基”)和取代形式。取代烷基的实例包括但不限于羟基甲基、二氟甲基和三氟甲基。除非在权利要求中另有定义,否则如本申请所使用的术语“烯基”是指2-8个碳原子间任意长度(c2-c10)的具有至少一个不饱和位点(即,碳-碳sp2双键)的直链或支链、单价或二价烃链基团,其中所述烯基可任选地被一个或多个在以上“烷基”定义中所述的取代基所独立取代,并包括具有“顺式”和“反式”定向或替代的“e”和“z”定向的基团。烯基的实例包括但不限于乙烯基(-ch=ch2)、丙-1-烯基(-ch=chch3)、丙-2-烯基(-ch2ch=ch2)、2-甲基丙-1-烯基、丁-1-烯基、丁-2-烯基、丁-3-烯基、丁-1,3-二烯基、2-甲基丁-1,3-二烯、己-1-烯基、己-2-烯基、己-3-烯基、己-4-烯基、己-1,3-二烯基以及其二价(“亚烯基”)和取代形式。除非在权利要求中另有定义,否则如本申请所使用的术语“炔基”是指2-8个碳原子间任意长度(c2-c10)的具有至少一个不饱和位点(即,碳-碳sp三键)的直链或支链、单价或二价烃链基团,其中所述炔基可任选地被一个或多个在以上烷基定义中所述的取代基所独立取代,炔基的实例包括但不限于乙炔基(-c≡ch)、丙-1-炔基(-c≡cch3)、丙-2-炔基(炔丙基,-ch2c≡ch)、丁-1-炔基、丁-2-炔基和丁-3-炔基,以及其二价(“亚炔基”)和取代形式。除非在权利要求中另有定义,否则如本申请所使用的术语“烷基氨基”是指基团-nr’r”,其中r’是h、c1-c6烷基或c3-c6环烷基,且r”是c1-c6烷基或c3-c6环烷基,烷基氨基的实例包括但不限于甲基氨基、二甲基氨基、乙基氨基、二乙基氨基、丙基氨基和环丙基氨基。除非在权利要求中另有定义,否则如本申请所使用的术语“酰胺基团”是指基团-c(o)nr’r”,其中r’和r”各自独立为h、c1-c6烷基或c3-c6环烷基;酰胺的实例包括但不限于-c(o)nh2、-c(o)nhch3和-c(o)n(ch3)2。除非在权利要求中另有定义,否则如本申请所使用的术语“芳基”是指芳族烃环系。所述环系可为单环或稠合多环的(例如,二环、三环等),经取代或未取代的。在各种实施方案中,单环芳基环是c5-c10或c5-c7或c5-c6,其中这些碳数是指形成环系的碳原子数目。c6环系,即苯环,是一种芳基基团。在各种实施方案中,多环环是二环芳基基团,其中二环芳基基团的实例是c8-c12或c9-c10。具有10个碳原子的萘环是一种多环芳基基团。芳基取代基的实例在以下“任选取代的”的定义中描述。除非在权利要求中另有定义,否则如本申请所使用的术语“氰基”是指基团-cn。除非在权利要求中另有定义,否则如本申请所使用的“环烷基”是指非芳族的、经取代或未取代的、饱和或部分饱和的烃环基团。取代基的实例在“任选取代的”的定义中描述。在一个实例中,环烷基基团具有3-12个碳原子(c3-c12)。在其它实例中,环烷基是c3-c8、c3-c10、c5-c10。在其它实例中,作为单环的环烷基是c3-c8、c3-c6或c5-c6。在另一实例中,作为双环的环烷基是c7-c12。在另一实例中,作为螺系的环烷基是c5-c12。单环环烷基的实例包括环丙基、环丁基、环戊基、1-环戊-1-烯基、1-环戊-2-烯基、1-环戊-3-烯基、环己基、全氘环己基、1-环己-1-烯基、1-环己-2-烯基、1-环己-3-烯基、环己二烯基、环庚基、环辛基、环壬基、环癸基、环十一基和环十二基。具有7-12个环原子的二环环烷基的示例性排列包括但不限于[4,4]、[4,5]、[5,5]、[5,6]或[6,6]环系。示例性桥接二环环烷基包括但不限于二环[2.2.1]庚烷、二环[2.2.2]辛烷和二环[3.2.2]壬烷。螺环烷基的实例包括螺[2.2]戊烷、螺[2.3]己烷、螺[2.4]庚烷、螺[2.5]辛烷和螺[4.5]癸烷。除非在权利要求中另有定义,否则如本申请所使用的术语“酯基”是指基团-c(o)or’,其中r’是c1-c6烷基或c3-c6环烷基。除非在权利要求中另有定义,否则如本申请所使用的术语“杂环”、“杂环烷基”或“杂环基”是指包含2-12个环碳原子和1-3个环杂原子的未取代或经取代的单环或多环非芳族环系。多环环系可为稠合二或三环、螺环或桥环。杂原子的实例包括n、o和s,包括n-氧化物、硫氧化物和二氧化物。在一个实施方案中,所述环是3-8元环并且为完全饱和或具有一个或多个不饱和度。多取代度包含在本发明定义内。取代基的实例在下定义。“杂环”基团的实例包括但不限于四氢呋喃基、吡喃基、1,4-二氧杂环己基、1,3-二氧杂环己基、氧杂环戊烷基、氧杂环丁烷基、2-氧杂-6-氮杂螺[3.3]庚-6-基、哌啶基、吡咯烷基、吗啉基、氮杂环丁烷基、哌嗪基、吡咯烷酮基、哌嗪酮基、吡唑烷基、咪唑啉基、咪唑烷基,以及它们的各种互变异构体。除非在权利要求中另有定义,否则如本申请所使用的术语“杂芳基”是指包含1-9个碳和至少一个杂原子的芳香环系。杂原子的实例包括n、o和s。杂芳基可为单环或多环的、经取代或未取代的。单环杂芳基在环中可具有2-6个环碳原子和1-3个环杂原子,而多环杂芳基可包含3-9个环碳原子和1-5个环杂原子。多环杂芳基环可包含稠合环、螺环或桥环连接,例如,二环杂芳基是一种多环杂芳基。二环杂芳基环可包含8-12元原子。单环杂芳基环可包含5-8元原子(碳和杂原子)。示例性杂芳基包括但不限于:苯并呋喃基、苯并噻吩基、呋喃基、咪唑基、吲哚基、氮杂吲哚基、氮杂苯并咪唑基、苯并噁唑基、苯并噻唑基、苯并噻二唑基、苯并三唑基、苯并咪唑基、四嗪基、四唑基、异噻唑基、噁唑基、异噁唑基、吡嗪基、吡唑基、哒嗪基、吡啶基、嘧啶基、吡咯基、喹啉基、喹唑啉基、喹喔啉基、三嗪基、三唑基、噻唑基和噻吩基。杂芳基取代基的实例在以下“任选取代的”的定义中描述。除非在权利要求中另有定义,否则如本申请所使用的术语“杂芳基烷基”是指基团(杂芳基)c1-c3烷基。除非在权利要求中另有定义,否则如本申请所使用的术语“芳基烷基”是指基团(芳基)c1-c3烷基。除非在权利要求中另有定义,否则如本申请所使用的术语“脲”是指基团-nr’c(o)nr”,其中r’和r”各自独立为h、c1-c6烷基或c3-c6环烷基。除非在权利要求中另有定义,否则如本申请所使用的术语“任选地”是指随后描述的一种或多种事件可发生或不发生,且同时包括发生的事件和不发生的事件。除非另有定义,否则如本申请所使用的短语“任选取代的”、“取代的”或其变体表示用一个或多个取代基任选取代,包括多取代度,例如一、二或三取代。所述短语不应被解释重复本申请描述且描绘的取代。示例性的任选的取代基包括酰基、c1-c6烷基、磺酰基、氨基、磺酰胺基团、亚砜基团、烷氧基、氰基、卤素、脲、酯基、羧酸基团、酰胺基团、羟基、氧代和硝基。除非在权利要求中另有定义,否则如本申请所使用的术语“治疗”是指缓解指定病症、消除或减少病症的一种或多种症状、减缓或消除病症的进展。除非在权利要求中另有定义,否则如本申请所使用的术语"有效量"是指被例如研究者或临床医生所寻找的将引起组织、系统、动物或人的生物或医学反应的药物或药剂的量。除非在权利要求中另有定义,否则如本申请所使用的术语“治疗有效量”是指相比于未接受此量的相应受试者,导致疾病、病症或副作用的治疗,或者导致疾病或病症的进展速率减小的任意量。所述术语在其范围内还包括有效增强正常生理功能的量。对于治疗中使用而言,治疗有效量的式i化合物以及其盐可作为化学原料给药。此外,活性成分可呈现为药物组合物。本发明还涉及实验部分中的任一实施例。如本申请所使用的短语“药用盐”是指抗体-药物缀合物(adc)或接头-药物部分的药用有机或无机盐。示例性的盐包括但不限于硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、鞣酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡糖酸盐、葡糖醛酸盐、糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和扑酸盐(即1,1’-亚甲基-二-(2-羟基-3-萘甲酸盐))。药用盐可能牵涉包含另一种分子,诸如乙酸根离子、琥珀酸根离子或其它抗衡离子。抗衡离子可以是稳定母体化合物电荷的任何有机或无机部分。另外,药用盐可以在其结构中具有超过一种荷电原子。在多种荷电原子作为药用盐的组成部分的情况中,可以具有多种抗衡离子。因此,药用盐可具有一种或多种荷电原子和/或一种或多种抗衡离子。非药用的其它盐可用于制备本发明化合物,且应考虑这些构成本发明的另一方面。这些盐诸如草酸盐和三氟乙酸盐,虽然它们自身不是药用的,但可用于制备用作获得本发明化合物及其药用盐的中间体的盐。本发明化合物可以以固体或液体形式存在。在固态中,其可以结晶或非结晶形式或其混合物存在。技术人员将会理解可形成药用溶剂化物以用于结晶或非结晶化合物。在结晶溶剂化物中,溶剂分子在结晶期间掺入晶体晶格。溶剂化物可涉及非水性溶剂,其例如但不限于乙醇、异丙醇、dmso、乙酸、乙醇胺或乙酸乙酯,或者它们可涉及水作为掺入晶体晶格中的溶剂。其中水为掺入晶体晶格中的溶剂的溶剂化物典型称作"水合物"。水合物包括化学计量的水合物以及包含可变量水的组成。本发明包括所有所述溶剂化物。技术人员将会进一步理解,以结晶形式存在的本发明某些化合物,包括其各种溶剂化物,可呈现多晶型现象(即出现不同结晶结构的能力)。这些不同晶形典型称作"多晶型"。本发明包括所有所述多晶型。多晶型具有相同化学组成,但在填装、几何排布和结晶固态的其它描述属性上不同。因此,多晶型可具有不同物理性质,例如形状、密度、硬度、可变形性、稳定性和溶出性能。多晶型典型呈现出不同熔点、ir谱和x射线粉末衍射图,其可用于鉴定。技术人员将会理解不同多晶型的产生可通过例如改变或调整化合物制备中所使用的反应条件或试剂。例如,温度、压力或溶剂的改变可能导致多晶型。此外,一种多晶型在特定条件下可自发转化为另一多晶型。本发明化合物或其盐可以立体异构形式存在(例如,其包含一个或多个不对称碳原子)。单独的立体异构体(对映异构体和非对映异构体)以及这些的混合物包括在本发明的范围内。同样地,应理解式(i)化合物或盐可以以不同于式中所示的互变异构形式存在,且这些也包括在本发明的范围内。应理解本发明包括上文所定义的具体群组的所有组合和子集。本发明的范围包括立体异构体混合物以及纯化对映异构体或者对映异构/非对映异构富集的混合物。应理解本发明包括上文所定义的具体群组的所有组合和子集。本发明主题还包括本发明化合物的同位素标记形式,但存在以下事实:一个或多个原子被具有不同于自然界中通常发现的原子质量或质量数的原子质量或质量数的原子所替代。可掺入本发明化合物及其药用盐中的同位素的实例包括氢、碳、氮、氧、磷、硫、氟、碘和氯的同位素,例如2h、3h、11c、13c、14c、15n、17o、18o、31p、32p、35s、18f、36cl、123i和125i。包含前述同位素和/或其它原子的其它同位素的本发明化合物以及所述化合物的药用盐在本发明的范围内。同位素标记的本发明化合物,例如掺入放射性同位素如3h、14c的那些,用于药物和/或底物组织分布测定中。氘化(即3h)和碳-14(即14c)同位素因其易于制备和可检测性而通常使用。11c和18f同位素用于pet(正电子成像术),且125i同位素用于spect(单光子发射计算机化断层显像),其均用于脑成像。另外,用较重的同位素如氘(即2h)取代,可获得由更高的代谢稳定性引起的某些治疗益处,例如增加的体内半衰期或减少的剂量需求,且因此可在某些情况下优选。本发明式i及跟随的同位素标记化合物通常可以通过进行以下方案和/或实施例中公开的步骤,通过用易于获得的同位素标记试剂替代非同位素标记试剂而制备。adc的药物组合物本发明的治疗性抗体-药物缀合物(adc)通常与药用肠胃外媒介物一起且以单位剂量可注射形式配制成药物制剂以供肠胃外给药,即推注(bolus)、静脉内注射、肿瘤内注射。任选将具有所需纯度的抗体-药物缀合物(adc)与药用稀释剂、载体、赋形剂或稳定剂混合(remington'spharmaceuticalsciences(1980)第16版,osol,a.编),其为冻干制剂或水溶液形式。半胱氨酸改造的抗体本发明化合物包括包含半胱氨酸改造的抗体的抗体-药物缀合物,其中野生型或亲代抗体中的一个或多个氨基酸被半胱氨酸氨基酸替代。由此可以改造任意形式的抗体,即,使其突变。例如,可以将亲代fab抗体片段改造成半胱氨酸改造的fab,在本申请中称作“thiofab”。类似地,可以将亲代单克隆抗体改造成“thiomab”。应注意单一位点突变在thiofab中产生单一改造的半胱氨酸残基,而单一位点突变在thiomab中产生两个改造的半胱氨酸残基,这是由于igg抗体的二聚化特性所致。评价被半胱氨酸(cys)残基替代的(“改造的”)突变体的新引入的改造的半胱氨酸巯基的反应性。巯基反应值为0-1.0范围内的相对数值范围并且可以测定任意半胱氨酸改造的抗体的该值。本发明半胱氨酸改造的抗体的巯基反应值在0.6-1.0;0.7-1.0;或0.8-1.0的范围内。为了通过诱变来制备半胱氨酸改造抗体,可通过本领域中已知的多种方法制备编码起始多肽的氨基酸序列变体的dna。这些方法包括但不限于通过位点-定向(或寡核苷酸介导的)诱变、pcr诱变和对编码所述多肽的较早制备的dna的盒式诱变制备。还可以通过限制片段操作或通过使用合成寡核苷酸的重叠延伸pcr构建重组抗体的变体。诱变引物编码半胱氨酸密码子替代物。标准诱变技术可以用于产生编码所述突变的半胱氨酸改造的抗体的dna。一般指导原则可以在下列文献中找到:sambrooketalmolecularcloning,alaboratorymanual,coldspringharborlaboratorypress,coldspringharbor,n.y.,1989;和ausubeletalcurrentprotocolsinmolecularbiology,greenepublishingandwiley-interscience,newyork,n.y.,1993。半胱氨酸氨基酸可在抗体的反应位点进行改造,且其不形成链内或分子间的二硫键(junutula,etal.,2008bnaturebiotech.,26(8):925-932;dornanetal(2009)blood114(13):2721-2729;us7521541;us7723485;wo2009/052249,shenetal(2012)naturebiotech.,30(2):184-191;junutulaetal(2008)jourofimmun.methods332:41-52)。经改造的半胱氨酸巯基可与具有巯基-反应性亲电子基团如马来酰亚胺或α-卤代酰胺的本发明接头试剂或接头-药物中间体反应以形成具有半胱氨酸改造的抗体(thiomabs)和药物(d)部分的adc。因此药物部分的定位可被设计、控制并知晓。药物载量(drugloading)可被控制,这是由于经改造的半胱氨酸巯基典型地与巯基-反应性接头试剂或接头-药物中间体以高收率反应。通过在重链或轻链的单一位点的取代来改造抗体以引入半胱氨酸氨基酸得到在对称抗体上的两个新的半胱氨酸。可实现接近2的药物载量且结合产物adc的接近同质性也可实现。本发明半胱氨酸改造的抗体优选保持其野生型、亲代抗体对应物的抗原结合能力。因此,半胱氨酸改造的抗体能够结合,优选特异性结合抗原。所述抗原包括:例如肿瘤-相关抗原(taa)、细胞表面受体蛋白和其它细胞表面分子、跨膜蛋白、信号传导蛋白、细胞存活调节因子、细胞增殖调节因子、与组织发育或分化相关(例如,已知或怀疑在功能上相关)的分子、淋巴因子、细胞因子、涉及细胞周期调节的分子、涉及血管生成的分子和与血管生成相关(例如,已知或怀疑在功能上相关)的分子。肿瘤-相关抗原可以为分化簇因子(即cd蛋白)。能够结合半胱氨酸改造的抗体的抗原可以为上述类型之一的亚组中的成员,其中所述类型中另一亚组包含具有不同特性的其它分子/抗原(就所关注的抗原而言)。制备半胱氨酸改造的抗体,其用于通过链内二硫基的还原和再氧化与接头-药物中间体结合。肿瘤相关抗原:抗体,包括但不限于可用于治疗癌症的本发明抗体-药物缀合物中的半胱氨酸改造的抗体,其包括但不限于针对细胞表面受体和肿瘤相关抗原(taa)。某些肿瘤相关抗原是本领域中已知的并可制备它们以用于使用本领域众所周知的方法和信息生产抗体。在发现用于癌症诊断和疗法的有效细胞靶标的尝试中,研究人员寻求鉴定与一种或多种正常非癌细胞相比在一种或多种特定类型的癌细胞表面上特异性表达的跨膜多肽或另外的肿瘤相关多肽。与非癌细胞相比,通常所述肿瘤相关多肽更大量地在癌细胞表面上表达。对所述肿瘤相关细胞表面抗原多肽的鉴定已经使人们能够更特异性地靶向癌细胞,通过基于抗体的疗法对其进行破坏。肿瘤相关抗原taa的实例包括但不限于以下所列的那些。为方便起见,均为本领域已知的有关这些抗原的信息在以下列出,并且按照美国国家生物技术信息中心(ncbi)的核酸和蛋白质序列鉴定规定,包括名称、别名、genbank登记号和主要参考文献。对应于下列taa的核酸和蛋白质序列可以在公共数据库如genbank中获得。由抗体靶向的肿瘤相关抗原包括所有氨基酸序列变体和同工型,它们与引述的参考文献中鉴定的序列相比具有至少约70%、80%、85%、90%或95%序列同一性,和/或表现出基本上与具有引述参考文献中发现的序列的taa相同的生物特性或特征。例如,具有变体序列的taa通常能够采用所列相应序列特异性结合与所述taa特异性结合的抗体。特别将本申请特别引述的参考文献中的序列和公开内容引入作为参考。(1)bmpr1b(骨形成蛋白受体-ib型,genbank登记号nm_001203)tendijke,p.,etalscience264(5155):101-104(1994),oncogene14(11):1377-1382(1997));wo2004063362(权利要求2);wo2003042661(权利要求12);us2003134790-a1(38-39页);wo2002102235(权利要求13;296页);wo2003055443(91-92页);wo200299122(实施例2;528-530页);wo2003029421(权利要求6);wo2003024392(权利要求2;图112);wo200298358(权利要求1;183页);wo200254940(100-101页);wo200259377(349-350页);wo200230268(权利要求27;376页);wo200148204(实施例;图4)np_001194骨形成蛋白受体,ib型/pid=np_001194.1-交叉参考:mim:603248;np_001194.1;ay065994(2)e16(lat1,slc7a5,genbank登记号nm_003486)biochem.biophys.res.commun.255(2),283-288(1999),nature395(6699):288-291(1998),gaugitsch,h.w.,etal(1992)j.biol.chem.267(16):11267-11273);wo2004048938(实施例2);wo2004032842(实施例iv);wo2003042661(权利要求12);wo2003016475(权利要求1);wo200278524(实施例2);wo200299074(权利要求19;127-129页);wo200286443(权利要求27;222、393页);wo2003003906(权利要求10;293页);wo200264798(权利要求33;93-95页);wo200014228(权利要求5;133-136页);us2003224454(图3);wo2003025138(权利要求12;150页);np_003477溶质载体家族7(阳离子氨基酸转运蛋白,y+系统),成员5/pid=np_003477.3-人类交叉参考:mim:600182;np_003477.3;nm_015923;nm_003486_1(3)steap1(前列腺的六跨膜上皮细胞抗原,genbank登记号nm_012449)cancerres.61(15),5857-5860(2001),hubert,r.s.,etal(1999)proc.natl.acad.sci.u.s.a.96(25):14523-14528);wo2004065577(权利要求6);wo2004027049(图1l);ep1394274(实施例11);wo2004016225(权利要求2);wo2003042661(权利要求12);us2003157089(实施例5);us2003185830(实施例5);us2003064397(图2);wo200289747(实施例5;618-619页);wo2003022995(实施例9;图13a,实施例53;173页,实施例2;图2a);np_036581前列腺的六跨膜上皮细胞抗原交叉参考:mim:604415;np_036581.1;nm_012449_1(4)0772p(ca125,muc16,genbank登记号af361486)j.biol.chem.276(29):27371-27375(2001));wo2004045553(权利要求14);wo200292836(权利要求6;图12);wo200283866(权利要求15;116-121页);us2003124140(实施例16);交叉参考:gi:34501467;aak74120.3;af361486_1(5)mpf(mpf,msln,smr,巨核细胞强化因子,间皮素,genbank登记号nm_005823)yamaguchi,n.,etalbiol.chem.269(2),805-808(1994),proc.natl.acad.sci.u.s.a.96(20):11531-11536(1999),proc.natl.acad.sci.u.s.a.93(1):136-140(1996),j.biol.chem.270(37):21984-21990(1995));wo2003101283(权利要求14);(wo2002102235(权利要求13;287-288页);wo2002101075(权利要求4;308-309页);wo200271928(320-321页);wo9410312(52-57页);交叉参考:mim:601051;np_005814.2;nm_005823_1(6)napi3b/napi2b(napi-3b,nptiib,slc34a2,溶质载体家族34(磷酸钠),成员2,ii型钠依赖性磷酸转运蛋白3b,genbank登记号nm_006424)j.biol.chem.277(22):19665-19672(2002),genomics62(2):281-284(1999),feild,j.a.,etal(1999)biochem.biophys.res.commun.258(3):578-582);wo2004022778(权利要求2);ep1394274(实施例11);wo2002102235(权利要求13;326页);ep875569(权利要求1;17-19页);wo200157188(权利要求20;329页);wo2004032842(实施例iv);wo200175177(权利要求24;139-140页);交叉参考:mim:604217;np_006415.1;nm_006424_1(7)sema5b(flj10372,kiaa1445,mm.42015,sema5b,semag,信号素5bhlog,sema结构域,七血小板反应蛋白重复(1型和类1型),跨膜结构域(tm)和短胞浆域,(信号素)5b,genbank登记号ab040878)nagaset.,etal(2000)dnares.7(2):143-150);wo2004000997(权利要求1);wo2003003984(权利要求1);wo200206339(权利要求1;50页);wo200188133(权利要求1;41-43、48-58页);wo2003054152(权利要求20);wo2003101400(权利要求11);登记号:q9p283;embl;ab040878;baa95969.1.genew;hgnc:10737;(8)pscahlg(2700050c12rik,c530008o16rik,rikencdna2700050c12,rikencdna2700050c12基因,genbank登记号ay358628);rossetal(2002)cancerres.62:2546-2553;us2003129192(权利要求2);us2004044180(权利要求12);us2004044179(权利要求11);us2003096961(权利要求11);us2003232056(实施例5);wo2003105758(权利要求12);us2003206918(实施例5);ep1347046(权利要求1);wo2003025148(权利要求20);交叉参考:gi:37182378;aaq88991.1;ay358628_1(9)etbr(内皮素b型受体,genbank登记号ay275463);nakamutam.,etalbiochem.biophys.res.commun.177,34-39,1991;ogaway.,etalbiochem.biophys.res.commun.178,248-255,1991;araih.,etaljpn.circ.j.56,1303-1307,1992;araih.,etalj.biol.chem.268,3463-3470,1993;sakamotoa.,yanagisawam.,etalbiochem.biophys.res.commun.178,656-663,1991;elshourbagyn.a.,etalj.biol.chem.268,3873-3879,1993;haendlerb.,etalj.cardiovasc.pharmacol.20,s1-s4,1992;tsutsumim.,etalgene228,43-49,1999;strausbergr.l.,etalproc.natl.acad.sci.u.s.a.99,16899-16903,2002;bourgeoisc.,etalj.clin.endocrinol.metab.82,3116-3123,1997;okamotoy.,etalbiol.chem.272,21589-21596,1997;verheijj.b.,etalam.j.med.genet.108,223-225,2002;hofstrar.m.w.,etaleur.j.hum.genet.5,180-185,1997;puffenbergere.g.,etalcell79,1257-1266,1994;attiet.,etal,hum.mol.genet.4,2407-2409,1995;auricchioa.,etalhum.mol.genet.5:351-354,1996;amielj.,etalhum.mol.genet.5,355-357,1996;hofstrar.m.w.,etalnat.genet.12,445-447,1996;svenssonp.j.,etalhum.genet.103,145-148,1998;fuchss.,etalmol.med.7,115-124,2001;pingaultv.,etal(2002)hum.genet.111,198-206;wo2004045516(权利要求1);wo2004048938(实施例2);wo2004040000(权利要求151);wo2003087768(权利要求1);wo2003016475(权利要求1);wo2003016475(权利要求1);wo200261087(图1);wo2003016494(图6);wo2003025138(权利要求12;144页);wo200198351(权利要求1;124-125页);ep522868(权利要求8;图2);wo200177172(权利要求1;297-299页);us2003109676;us6518404(图3);us5773223(权利要求1a;31-34栏);wo2004001004;(10)msg783(rnf124,假设蛋白flj20315,genbank登记号nm_017763);wo2003104275(权利要求1);wo2004046342(实施例2);wo2003042661(权利要求12);wo2003083074(权利要求14;图61);wo2003018621(权利要求1);wo2003024392(权利要求2;图93);wo200166689(实施例6);交叉参考:locusid:54894;np_060233.2;nm_017763_1(11)steap2(hgnc_8639,ipca-1,pcanap1,stamp1,steap2,stmp,前列腺癌相关基因1,前列腺癌相关蛋白1,前列腺的六跨膜上皮细胞抗原2,六跨膜前列腺蛋白,genbank登记号af455138)lab.invest.82(11):1573-1582(2002));wo2003087306;us2003064397(权利要求1;图1);wo200272596(权利要求13;54-55页);wo200172962(权利要求1;图4b);wo2003104270(权利要求11);wo2003104270(权利要求16);us2004005598(权利要求22);wo2003042661(权利要求12);us2003060612(权利要求12;图10);wo200226822(权利要求23;图2);wo200216429(权利要求12;图10);交叉参考:gi:22655488;aan04080.1;af455138_1(12)trpm4(br22450,flj20041,trpm4,trpm4b,瞬时型受体电位阳离子通道,m亚族,成员4,genbank登记号nm_017636)xu,x.z.,etalproc.natl.acad.sci.u.s.a.98(19):10692-10697(2001),cell109(3):397-407(2002),j.biol.chem.278(33):30813-30820(2003));us2003143557(权利要求4);wo200040614(权利要求14;100-103页);wo200210382(权利要求1;图9a);wo2003042661(权利要求12);wo200230268(权利要求27;391页);us2003219806(权利要求4);wo200162794(权利要求14;图1a-d);交叉参考:mim:606936;np_060106.2;nm_017636_1(13)cripto(cr,cr1,crgf,cripto,tdgf1,畸胎癌-衍生的生长因子,genbank登记号np_003203或nm_003212)ciccodicola,a.,etalemboj.8(7):1987-1991(1989),am.j.hum.genet.49(3):555-565(1991));us2003224411(权利要求1);wo2003083041(实施例1);wo2003034984(权利要求12);wo200288170(权利要求2;52-53页);wo2003024392(权利要求2;图58);wo200216413(权利要求1;94-95、105页);wo200222808(权利要求2;图1);us5854399(实施例2;17-18栏);us5792616(图2);交叉参考:mim:187395;np_003203.1;nm_003212_1(14)cd21(cr2(补体受体2)或c3dr(c3d/epsteinbarr病毒受体)或hs.73792genbank登记号m26004)fujisakuetal(1989)j.biol.chem.264(4):2118-2125);weisj.j.,etalj.exp.med.167,1047-1066,1988;moorem.,etalproc.natl.acad.sci.u.s.a.84,9194-9198,1987;barelm.,etalmol.immunol.35,1025-1031,1998;weisj.j.,etalproc.natl.acad.sci.u.s.a.83,5639-5643,1986;sinhas.k.,etal(1993)j.immunol.150,5311-5320;wo2004045520(实施例4);us2004005538(实施例1);wo2003062401(权利要求9);wo2004045520(实施例4);wo9102536(图9.1-9.9);wo2004020595(权利要求1);登记号:p20023;q13866;q14212;embl;m26004;aaa35786.1.(15)cd79b(cd79b,cd79β,igb(免疫球蛋白-相关β),b29,genbank登记号nm_000626或11038674)proc.natl.acad.sci.u.s.a.(2003)100(7):4126-4131,blood(2002)100(9):3068-3076,mulleretal(1992)eur.j.immunol.22(6):1621-1625);wo2004016225(权利要求2,图140);wo2003087768,us2004101874(权利要求1,102页);wo2003062401(权利要求9);wo200278524(实施例2);us2002150573(权利要求5,15页);us5644033;wo2003048202(权利要求1,306和309页);wo99/558658,us6534482(权利要求13,图17a/b);wo200055351(权利要求11,1145-1146页);交叉参考:mim:147245;np_000617.1;nm_000626_1(16)fcrh2(ifgp4,irta4,spap1a(含有sh2结构域的磷酸酶锚定蛋白1a),spap1b,spap1c,genbank登记号nm_030764,ay358130)genomeres.13(10):2265-2270(2003),immunogenetics54(2):87-95(2002),blood99(8):2662-2669(2002),proc.natl.acad.sci.u.s.a.98(17):9772-9777(2001),xu,m.j.,etal(2001)biochem.biophys.res.commun.280(3):768-775;wo2004016225(权利要求2);wo2003077836;wo200138490(权利要求5;图18d-1-18d-2);wo2003097803(权利要求12);wo2003089624(权利要求25);交叉参考:mim:606509;np_110391.2;nm_030764_1(17)her2(erbb2,genbank登记号m11730)coussensl.,etalscience(1985)230(4730):1132-1139);yamamotot.,etalnature319,230-234,1986;sembak.,etalproc.natl.acad.sci.u.s.a.82,6497-6501,1985;swierczj.m.,etalj.cellbiol.165,869-880,2004;kuhnsj.j.,etalj.biol.chem.274,36422-36427,1999;choh.-s.,etalnature421,756-760,2003;ehsania.,etal(1993)genomics15,426-429;wo2004048938(实施例2);wo2004027049(图1i);wo2004009622;wo2003081210;wo2003089904(权利要求9);wo2003016475(权利要求1);us2003118592;wo2003008537(权利要求1);wo2003055439(权利要求29;图1a-b);wo2003025228(权利要求37;图5c);wo200222636(实施例13;95-107页);wo200212341(权利要求68;图7);wo200213847(71-74页);wo200214503(114-117页);wo200153463(权利要求2;41-46页);wo200141787(15页);wo200044899(权利要求52;图7);wo200020579(权利要求3;图2);us5869445(权利要求3;31-38栏);wo9630514(权利要求2;56-61页);ep1439393(权利要求7);wo2004043361(权利要求7);wo2004022709;wo200100244(实施例3;图4);登记号:p04626;embl;m11767;aaa35808.1.embl;m11761;aaa35808.1.(18)nca(ceacam6,genbank登记号m18728);barnettt.,etalgenomics3,59-66,1988;tawaragiy.,etalbiochem.biophys.res.commun.150,89-96,1988;strausbergr.l.,etalproc.natl.acad.sci.u.s.a.99:16899-16903,2002;wo2004063709;ep1439393(权利要求7);wo2004044178(实施例4);wo2004031238;wo2003042661(权利要求12);wo200278524(实施例2);wo200286443(权利要求27;427页);wo200260317(权利要求2);登记号:p40199;q14920;embl;m29541;aaa59915.1.embl;m18728;(19)mdp(dpep1,genbank登记号bc017023)proc.natl.acad.sci.u.s.a.99(26):16899-16903(2002));wo2003016475(权利要求1);wo200264798(权利要求33;85-87页);jp05003790(图6-8);wo9946284(图9);交叉参考:mim:179780;aah17023.1;bc017023_1(20)il20rα(il20ra,zcytor7,genbank登记号af184971);clarkh.f.,etalgenomeres.13,2265-2270,2003;mungalla.j.,etalnature425,805-811,2003;blumbergh.,etalcell104,9-19,2001;dumoutierl.,etalj.immunol.167,3545-3549,2001;parrish-novakj.,etalj.biol.chem.277,47517-47523,2002;pletnevs.,etal(2003)biochemistry42:12617-12624;sheikhf.,etal(2004)j.immunol.172,2006-2010;ep1394274(实施例11);us2004005320(实施例5);wo2003029262(74-75页);wo2003002717(权利要求2;63页);wo200222153(45-47页);us2002042366(20-21页);wo200146261(57-59页);wo200146232(63-65页);wo9837193(权利要求1;55-59页);登记号:q9uhf4;q6uwa9;q96sh8;embl;af184971;aaf01320.1.(21)短缩素(bcan,behab,genbank登记号af229053)garys.c.,etalgene256,139-147,2000;clarkh.f.,etalgenomeres.13,2265-2270,2003;strausbergr.l.,etalproc.natl.acad.sci.u.s.a.99,16899-16903,2002;us2003186372(权利要求11);us2003186373(权利要求11);us2003119131(权利要求1;图52);us2003119122(权利要求1;图52);us2003119126(权利要求1);us2003119121(权利要求1;图52);us2003119129(权利要求1);us2003119130(权利要求1);us2003119128(权利要求1;图52);us2003119125(权利要求1);wo2003016475(权利要求1);wo200202634(权利要求1);(22)ephb2r(drt,erk,hek5,epht3,tyro5,genbank登记号nm_004442)chan,j.andwatt,v.m.,oncogene6(6),1057-1061(1991)oncogene10(5):897-905(1995),annu.rev.neurosci.21:309-345(1998),int.rev.cytol.196:177-244(2000));wo2003042661(权利要求12);wo200053216(权利要求1;41页);wo2004065576(权利要求1);wo2004020583(权利要求9);wo2003004529(128-132页);wo200053216(权利要求1;42页);交叉参考:mim:600997;np_004433.2;nm_004442_1(23)aslg659(b7h,genbank登记号ax092328)us20040101899(权利要求2);wo2003104399(权利要求11);wo2004000221(图3);us2003165504(权利要求1);us2003124140(实施例2);us2003065143(图60);wo2002102235(权利要求13;299页);us2003091580(实施例2);wo200210187(权利要求6;图10);wo200194641(权利要求12;图7b);wo200202624(权利要求13;图1a-1b);us2002034749(权利要求54;45-46页);wo200206317(实施例2;320-321页,权利要求34;321-322页);wo200271928(468-469页);wo200202587(实施例1;图1);wo200140269(实施例3;190-192页);wo200036107(实施例2;205-207页);wo2004053079(权利要求12);wo2003004989(权利要求1);wo200271928(233-234,452-453页);wo0116318;(24)psca(前列腺干细胞抗原前体,genbank登记号aj297436)reiterr.e.,etalproc.natl.acad.sci.u.s.a.95,1735-1740,1998;guz.,etaloncogene19,1288-1296,2000;biochem.biophys.res.commun.(2000)275(3):783-788;wo2004022709;ep1394274(实施例11);us2004018553(权利要求17);wo2003008537(权利要求1);wo200281646(权利要求1;164页);wo2003003906(权利要求10;288页);wo200140309(实施例1;图17);us2001055751(实施例1;图1b);wo200032752(权利要求18;图1);wo9851805(权利要求17;97页);wo9851824(权利要求10;94页);wo9840403(权利要求2;图1b);登记号:o43653;embl;af043498;aac39607.1.(25)geda(genbank登记号ay260763);aap14954脂肪瘤hmgic融合-配偶体样蛋白/pid=aap14954.1-人类物种:人类(人)wo2003054152(权利要求20);wo2003000842(权利要求1);wo2003023013(实施例3,权利要求20);us2003194704(权利要求45);交叉参考:gi:30102449;aap14954.1;ay260763_1(26)baff-r(b细胞-活化因子受体,blys受体,blys受体3,br3,genbank登记号af116456);baffreceptor/pid=np_443177.1-homosapiensthompson,j.s.,etalscience293(5537),2108-2111(2001);wo2004058309;wo2004011611;wo2003045422(实施例;32-33页);wo2003014294(权利要求35;图6b);wo2003035846(权利要求70;615-616页);wo200294852(136-137栏);wo200238766(权利要求3;133页);wo200224909(实施例3;图3);交叉参考:mim:606269;np_443177.1;nm_052945_1;af132600(27)cd22(b-细胞受体cd22-b同工型,bl-cam,lyb-8,lyb8,siglec-2,flj22814,genbank登记号ak026467);wilsonetal(1991)j.exp.med.173:137-146;wo2003072036(权利要求1;图1);交叉参考:mim:107266;np_001762.1;nm_001771_1(28)cd79a(cd79a,cd79α,免疫球蛋白-相关α,一种b细胞特异性蛋白,其与igβ(cd79b)共价相互作用并在表面上与igm分子形成复合物,转导涉及b细胞分化的信号),pi:4.84,mw:25028tm:2[p]genechromosome:19q13.2,genbank登记号np_001774.10)wo2003088808,us20030228319;wo2003062401(权利要求9);us2002150573(权利要求4,13-14页);wo9958658(权利要求13,图16);wo9207574(图1);us5644033;ha等(1992)j.immunol.148(5):1526-1531;mueller等(1992)eur.j.biochem.22:1621-1625;hashimoto等(1994)immunogenetics40(4):287-295;preud’hommeetal(1992)clin.exp.immunol.90(1):141-146;yuetal(1992)j.immunol.148(2)633-637;sakaguchietal(1988)emboj.7(11):3457-3464;(29)cxcr5(伯基特淋巴瘤受体1,一种g蛋白偶联受体,由cxcl13趋化因子活化,在淋巴细胞迁移和体液防御中起作用,在hiv-2感染中起作用并可能在aids、淋巴瘤、黑素瘤和白血病发展中起作用);372aa,pi:8.54mw:41959tm:7[p]genechromosome:11q23.3,genbank登记号np_001707.1)wo2004040000;wo2004015426;us2003105292(实施例2);us6555339(实施例2);wo200261087(图1);wo200157188(权利要求20,269页);wo200172830(12-13页);wo200022129(实施例1,152-153页,实施例2,254-256页);wo9928468(权利要求1,38页);us5440021(实施例2,49-52栏);wo9428931(56-58页);wo9217497(权利要求7,图5);dobneretal(1992)eur.j.immunol.22:2795-2799;barellaetal(1995)biochem.j.309:773-779;(30)hla-dob(mhcii类分子的β亚单位(ia抗原),其与肽结合并且将其呈递给cd4+t淋巴细胞);273aa,pi:6.56mw:30820tm:1[p]genechromosome:6p21.3,genbank登记号np_002111.1)tonnelleetal(1985)emboj.4(11):2839-2847;jonssonetal(1989)immunogenetics29(6):411-413;becketal(1992)j.mol.biol.228:433-441;strausbergetal(2002)proc.natl.acad.sciusa99:16899-16903;serveniusetal(1987)j.biol.chem.262:8759-8766;becketal(1996)j.mol.biol.255:1-13;naruseetal(2002)tissueantigens59:512-519;wo9958658(权利要求13,图15);us6153408(35-38栏);us5976551(168-170栏);us6011146(145-146栏);kasaharaetal(1989)immunogenetics30(1):66-68;larhammaretal(1985)j.biol.chem.260(26):14111-14119;(31)p2x5(嘌呤源受体p2x配体门控离子通道5,一种由胞外atp门控的离子通道,可能涉及突触传递和神经发生,其缺陷可以促使特发性逼尿肌不稳定性病理生理学);422aa),pi:7.63,mw:47206tm:1[p]genechromosome:17p13.3,genbank登记号np_002552.2)leetal(1997)febslett.418(1-2):195-199;wo2004047749;wo2003072035(权利要求10);touchman等(2000)genomeres.10:165-173;wo200222660(权利要求20);wo2003093444(权利要求1);wo2003087768(权利要求1);wo2003029277(82页);(32)cd72(b细胞分化抗原cd72,lyb-2)蛋白完整序列maeaity...tafrfpd(1..359;359aa),pi:8.66,mw:40225tm:1[p]genechromosome:9p13.3,genbank登记号np_001773.1)wo2004042346(权利要求65);wo2003026493(51-52、57-58页);wo200075655(105-106页);vonhoegenetal(1990)j.immunol.144(12):4870-4877;strausbergetal(2002)proc.natl.acad.sciusa99:16899-16903;(33)ly64(淋巴细胞抗原64(rp105),即富含亮氨酸重复(lrr)家族的i型膜蛋白,调节b细胞细胞活化和凋亡,其功能缺失与系统性红斑狼疮患者的疾病活动增加有关);661aa,pi:6.20,mw:74147tm:1[p]genechromosome:5q12,genbank登记号np_005573.1)us2002193567;wo9707198(权利要求11,39-42页);miuraetal(1996)genomics38(3):299-304;miuraetal(1998)blood92:2815-2822;wo2003083047;wo9744452(权利要求8,57-61页);wo200012130(24-26页);(34)fcrh1(fc受体样蛋白1,一种含有c2型ig-样和itam结构域的免疫球蛋白fc结构域的推定受体,可能在b淋巴细胞分化中起作用);429aa,pi:5.28,mw:46925tm:1[p]genechromosome:1q21-1q22,genbank登记号np_443170.1)wo2003077836;wo200138490(权利要求6,图18e-1-18-e-2);davisetal(2001)proc.natl.acad.sciusa98(17):9772-9777;wo2003089624(权利要求8);ep1347046(权利要求1);wo2003089624(权利要求7);(35)irta2(免疫球蛋白超家族受体易位相关2,一种在b细胞发育和淋巴瘤生成中具有可能的作用的推定的免疫受体;由于易位所导致的基因失调在某些b细胞恶性肿瘤中发生);977aa,pi:6.88mw:106468tm:1[p]genechromosome:1q21,genbank登记号human:af343662,af343663,af343664,af343665,af369794,af397453,ak090423,ak090475,al834187,ay358085;小鼠:ak089756,ay158090,ay506558;np_112571.1wo2003024392(权利要求2,图97);nakayamaetal(2000)biochem.biophys.res.commun.277(1):124-127;wo2003077836;wo200138490(权利要求3,图18b-1-18b-2);(36)tenb2(tmeff2,tomoregulin,tpef,hpp1,tr,与egf/调蛋白家族生长因子和卵泡抑素相关的推定的跨膜蛋白聚糖);374aa,ncbi登记号:aad55776,aaf91397,aag49451,ncbirefseq:np_057276;ncbigene:23671;omim:605734;swissprotq9uik5;genbank登记号af179274;ay358907,caf85723,cq782436wo2004074320(seqidno810);jp2004113151(seqidnos2,4,8);wo2003042661(seqidno580);wo2003009814(seqidno411);ep1295944(69-70页);wo200230268(329页);wo200190304(seqidno2706);us2004249130;us2004022727;wo2004063355;us2004197325;us2003232350;us2004005563;us2003124579;horieetal(2000)genomics67:146-152;uchidaetal(1999)biochem.biophys.res.commun.266:593-602;liangetal(2000)cancerres.60:4907-12;glynne-jonesetal(2001)intjcancer.oct15;94(2):178-84;(37)pmel17(银同系物;silv;d12s53e;pmel17;(si);(sil);me20;gp100)bc001414;bt007202;m32295;m77348;nm_006928;mcglinchey,r.p.etal(2009)proc.natl.acad.sci.u.s.a.106(33),13731-13736;kummer,m.p.etal(2009)j.biol.chem.284(4),2296-2306;(38)tmeff1(具有egf样和两个卵泡抑素样域1的跨膜蛋白;tomoregulin-1;h7365;c9orf2;c9orf2;u19878;x83961)nm_080655;nm_003692;harms,p.w.(2003)genesdev.17(21),2624-2629;gery,s.etal(2003)oncogene22(18):2723-2727;(39)gdnf-ra1(gdnf家族受体α1;gfra1;gdnfr;gdnfra;retl1;trnr1;ret1l;gdnfr-alpha1;gfr-alpha-1;u95847;bc014962;nm_145793)nm_005264;kim,m.h.etal(2009)mol.cell.biol.29(8),2264-2277;treanor,j.j.etal(1996)nature382(6586):80-83;(40)ly6e(淋巴细胞抗原6复合物,基因座e;ly67,rig-e,sca-2,tsa-1)np_002337.1;nm_002346.2;denooij-vandalen,a.g.etal(2003)int.j.cancer103(6),768-774;zammit,d.j.etal(2002)mol.cell.biol.22(3):946-952;(41)tmem46(shisa同系物2(有爪蟾蜍);shisa2)np_001007539.1;nm_001007538.1;furushima,k.etal(2007)dev.biol.306(2),480-492;clark,h.f.etal(2003)genomeres.13(10):2265-2270;(42)ly6g6d(淋巴细胞抗原6复合物,基因座g6d;ly6-d,megt1)np_067079.2;nm_021246.2;mallya,m.etal(2002)genomics80(1):113-123;ribas,g.etal(1999)j.immunol.163(1):278-287;(43)lgr5(含有亮氨酸富集的重复单元的g蛋白偶联受体5;gpr49,gpr67)np_003658.1;nm_003667.2;salanti,g.etal(2009)am.j.epidemiol.170(5):537-545;yamamoto,y.etal(2003)hepatology37(3):528-533;(44)ret(ret原癌基因;men2a;hscr1;men2b;mtc1;(ptc);cdhf12;hs.168114;ret51;ret-ele1)np_066124.1;nm_020975.4;tsukamoto,h.etal(2009)cancersci.100(10):1895-1901;narita,n.etal(2009)oncogene28(34):3058-3068;(45)ly6k(淋巴细胞抗原6复合物,基因座k;ly6k;hsj001348;flj35226)np_059997.3;nm_017527.3;ishikawa,n.etal(2007)cancerres.67(24):11601-11611;denooij-vandalen,a.g.etal(2003)int.j.cancer103(6):768-774;(46)gpr19(g蛋白偶联受体19;mm.4787)np_006134.1;nm_006143.2;montpetit,a.andsinnett,d.(1999)hum.genet.105(1-2):162-164;o'dowd,b.f.etal(1996)febslett.394(3):325-329;(47)gpr54(kiss1受体;kiss1r;gpr54;hot7t175;axor12)np_115940.2;nm_032551.4;navenot,j.m.etal(2009)mol.pharmacol.75(6):1300-1306;hata,k.etal(2009)anticancerres.29(2):617-623;(48)asphd1(含有天冬氨酸β-羟化酶域的1;loc253982)np_859069.2;nm_181718.3;gerhard,d.s.etal(2004)genomeres.14(10b):2121-2127;(49)酪氨酸酶(tyr;ocaia;oca1a;酪氨酸酶;shep3)np_000363.1;nm_000372.4;bishop,d.t.etal(2009)nat.genet.41(8):920-925;nan,h.etal(2009)int.j.cancer125(4):909-917;(50)tmem118(环指蛋白,跨膜2;rnft2;flj14627)np_001103373.1;nm_001109903.1;clark,h.f.etal(2003)genomeres.13(10):2265-2270;scherer,s.e.etal(2006)nature440(7082):346-351(51)gpr172a(g蛋白偶联受体172a;gpcr41;flj11856;d15ertd747e)np_078807.1;nm_024531.3;ericsson,t.a.etal(2003)proc.natl.acad.sci.u.s.a.100(11):6759-6764;takeda,s.etal(2002)febslett.520(1-3):97-101。在一个实施方案中,所述抗体结合一种或多种以下多肽:bmpr1b;e16;steap1;0772p;mpf;napi2b;sema5b;pscahlg;etbr;msg783;steap2;trpm4;cripto;cd21;cd79b;fcrh2;her2;nca;mdp;il20rα;短缩素;ephb2r;aslg659;psca;geda;baff-r;cd22;cd79a;cxcr5;hla-dob;p2x5;cd72;ly64;fcrh1;irta2;tenb2;pmel17;tmeff1;gdnf-ra1;ly6e;tmem46;ly6g6d;lgr5;ret;ly6k;gpr19;gpr54;asphd1;酪氨酸酶;tmem118;gpr172a;和cd33。在一个实施方案中,所述抗体结合bmpr1b;在一个实施方案中,所述抗体结合e16;在一个实施方案中,所述抗体结合steap1;在一个实施方案中,所述抗体结合0772p;在一个实施方案中,所述抗体结合mpf;在一个实施方案中,所述抗体结合napi2b;在一个实施方案中,所述抗体结合sema5b;在一个实施方案中,所述抗体结合pscahlg;在一个实施方案中,所述抗体结合etbr;在一个实施方案中,所述抗体结合msg783;在一个实施方案中,所述抗体结合steap2;在一个实施方案中,所述抗体结合trpm4;在一个实施方案中,所述抗体结合cripto;在一个实施方案中,所述抗体结合cd21;在一个实施方案中,所述抗体结合cd79b;在一个实施方案中,所述抗体结合fcrh2;在一个实施方案中,所述抗体结合her2;在一个实施方案中,所述抗体结合nca;在一个实施方案中,所述抗体结合mdp;在一个实施方案中,所述抗体结合il20rα;在一个实施方案中,所述抗体结合短缩素;在一个实施方案中,所述抗体结合ephb2r;在一个实施方案中,所述抗体结合aslg659;在一个实施方案中,所述抗体结合psca;在一个实施方案中,所述抗体结合geda;在一个实施方案中,所述抗体结合baff-r;在一个实施方案中,所述抗体结合cd22;在一个实施方案中,所述抗体结合cd79a;在一个实施方案中,所述抗体结合cxcr5;在一个实施方案中,所述抗体结合hla-dob;在一个实施方案中,所述抗体结合p2x5;在一个实施方案中,所述抗体结合cd72;在一个实施方案中,所述抗体结合ly64;在一个实施方案中,所述抗体结合fcrh1;在一个实施方案中,所述抗体结合irta2;在一个实施方案中,所述抗体结合tenb2;在一个实施方案中,所述抗体结合pmel17;在一个实施方案中,所述抗体结合tmeff1;在一个实施方案中,所述抗体结合gdnf-ra1;在一个实施方案中,所述抗体结合ly6e;在一个实施方案中,所述抗体结合tmem46;在一个实施方案中,所述抗体结合ly6g6d;在一个实施方案中,所述抗体结合lgr5;在一个实施方案中,所述抗体结合ret;在一个实施方案中,所述抗体结合ly6k;在一个实施方案中,所述抗体结合gpr19;在一个实施方案中,所述抗体结合gpr54;在一个实施方案中,所述抗体结合asphd1;在一个实施方案中,所述抗体结合酪氨酸酶;在一个实施方案中,所述抗体结合tmem118;在一个实施方案中,所述抗体结合gpr172a;在一个实施方案中,所述抗体结合cd33。亲代抗体还可为包含白蛋白-结合肽(abp)序列的融合蛋白(dennisetal.(2002)“albuminbindingasageneralstrategyforimprovingthepharmacokineticsofproteins”jbiolchem.277:35035-35043;wo01/45746)。本发明的抗体包括具有下列文献中教导的abp序列的融合蛋白:(i)dennis等(2002)jbiolchem.277:35035-35043,表iii和iv,35038页;(ii)us20040001827,[0076]处;和(iii)wo01/45746,12-13页处,并且将所有这些文献引入本申请作为参考。抗体的产生可使用重组方法和组合物,例如如us4816567中所述的以及本领域已知的。在一些实施方案中,在真核宿主细胞(例如,哺乳动物宿主细胞)中产生所述抗体。在一些实施方案中,在原核宿主细胞(例如,大肠杆菌)中产生所述抗体。在某些实施方案中,可将一个或多个氨基酸修饰引入本申请所提供的抗体的fc区,从而产生fc区变体。所述fc区变体可包含在一个或多个氨基酸位置含有氨基酸修饰(例如取代)的人fc区序列(例如,人igg1、igg2、igg3或igg4fc区)。在某些实施方案中,本发明关注具有一些而非全部效应子功能的抗体变体,这使得其为某些应用中的期望侯选,在所述应用中体内抗体半衰期是重要的但某些效应子功能(例如补体和adcc)是不必要或有害的。可进行体外和/或体内细胞毒性测定以证实cdc和/或adcc活性的减少/缺失。例如,可进行fc受体(fcr)结合分析以确保抗体缺乏fcγr结合(因此很可能缺乏adcc活性),但保持fcrn结合能力。adc的药物载量药物载量是每个抗体中药物部分的平均数目。药物载量范围可为每个抗体(ab)1至8个药物(d),即,其中1、2、3、4、5、6、7和8个药物部分共价连接至所述抗体。adc的组成包括与1至8个药物缀合的抗体的集合。来自缀合反应的adc制品中,每个抗体的药物平均数目可以通过常规手段如质谱学、elisa测定、电泳和hplc进行表征。也可测定adc依据p的定量分布。通过elisa可以测定特定adc制品中的p平均值(hamblettetal(2004)clin.cancerres.10:7063-7070;sandersonetal(2005)clin.cancerres.11:843-852)。然而,p(药物)值分布不能通过抗体-抗原结合和elisa的检测限制来辨别。而且,检测抗体-药物缀合物的elisa测定不能确定药物部分于何处连接抗体,如重链或轻链片段或具体氨基酸残基。在一些情况下,可以通过如反相hplc或电泳手段实现同质adc的分离、纯化和表征,其中p为来自adc与其它药物载量的某个值。对于一些抗体-药物缀合物,p可能受限于抗体上的连接位点数目。例如,抗体可能仅有一个或几个半胱氨酸巯基,或可能仅有一个或几个充分反应性的巯基,接头可以通过所述巯基连接。更高的药物载量,例如p>5,可能导致某些抗体-药物缀合物的聚集、不可溶性、毒性或细胞渗透性的丧失。典型地,缀合反应期间,小于理论最大值的药物部分与抗体缀合。抗体可以包含例如许多不与接头-药物中间体(x-l-d)或接头试剂反应的赖氨酸残基。仅反应性最强的赖氨酸基团可与胺反应性接头试剂反应。而且,仅反应性最强的半胱氨酸巯基可与巯基反应性接头试剂或接头-药物中间体反应。通常,即便有,抗体也不会包含许多可连接至药物部分的游离且反应性的半胱氨酸巯基。抗体化合物中的大多数半胱氨酸巯基残基都以二硫键形式存在,且必须用还原剂如二硫苏糖醇(dtt)或tcep在不完全或完全还原条件下还原。adc的负载(药物/抗体比,"dar")可以以几种不同的方式得到控制,包括:(i)限制相对于抗体的接头-药物中间体或接头试剂的摩尔过量,(ii)限制缀合反应时间或温度,和(iii)针对半胱氨酸巯基修饰的部分或限制性还原条件。在抗体超过一个亲核或亲电基团与接头-药物中间体反应或与接头试剂然后是二聚药物部分试剂反应的情况下,则所得产物为抗体-药物缀合物的混合物,其具有连接抗体的药物部分的分布,例如1、2、3等。液相色谱方法如聚合物反相(plrp)和疏水性相互作用(hic)可通过药物载量值分离混合物中的化合物。可以分离具有单一药物载量值(p)的adc制品,然而,这些单一负载值adc可能仍然是非均质混合物,因为药物部分可经由接头连接于抗体上的不同位点。因此,本发明的抗体-药物缀合物组合物包括抗体-药物缀合物化合物的混合物,其中所述抗体具有一个或多个药物部分且其中所述药物部分可在各种氨基酸残基上与抗体连接。示例性药物部分美登素和美登素类化合物在一些实施方案中,免疫缀合物包含与一种或多种美登素类化合物分子缀合的抗体。美登素类化合物为美登素的衍生物,且为有丝分裂抑制剂,其通过抑制微管蛋白聚合而起作用。美登素首先由东非齿叶美登木(shrubmaytenusserrata)分离(美国专利3896111)。随后,发现某些微生物也产生美登素类化合物,诸如美登醇和c-3美登醇酯(美国专利4,151,042)。合成的美登素类化合物公开于例如美国专利4,137,230;4,248,870;4,256,746;4,260,608;4,265,814;4,294,757;4,307,016;4,308,268;4,308,269;4,309,428;4,313,946;4,315,929;4,317,821;4,322,348;4,331,598;4,361,650;4,364,866;4,424,219;4,450,254;4,362,663;和4,371,533。美登素类化合物药物部分为在抗体-药物缀合物中有吸引力的药物部分,这是因为它们(i)可相对容易地通过发酵或化学修饰或发酵产品衍生化来制备,(ii)易于衍生出适于经非二硫化物接头与抗体缀合的官能团,(iii)在血浆中稳定,且(iv)对多种肿瘤细胞系是有效的。适于用作美登素类化合物药物部分的某些美登素类化合物在本领域中已知且可根据已知方法由天然来源分离或使用基因加工技术产生(参见例如yuetal(2002)pnas99:7968-7973)。美登素类化合物也可根据已知方法合成制备。示例性美登素类化合物药物部分包括但不限于具有经修饰的芳族环的那些,例如:c-19-脱氯(美国专利4256746)(例如通过ansamytocinp2的氢化铝锂还原来制备);c-20-羟基(或c-20-脱甲基)+/-c-19-脱氯(美国专利4361650和4307016)(例如通过使用链霉菌属或放线菌属的脱甲基化或使用lah的脱氯作用来制备);和c-20-脱甲氧基、c-20-乙酰氧基(-ocor)、+/-脱氯(美国专利4,294,757)(例如通过使用酰氯的酰化来制备),以及在芳族环的其他位置具有修饰的那些。示例性美登素类化合物药物部分还包括具有修饰的那些,诸如c-9-sh(美国专利4424219)(例如通过使美登醇与h2s或p2s5反应来制备);c-14-烷氧基甲基(脱甲氧基/ch2or)(us4331598);c-14-羟基甲基或乙酰氧基甲基(ch2oh或ch2oac)(美国专利4450254)(例如由nocardia制备);c-15-羟基/乙酰氧基(us4364866)(例如通过链霉菌属转化美登醇来制备);c-15-甲氧基(美国专利4313946和4315929)(例如由trewianudlflora分离);c-18-n-脱甲基(美国专利4362663和4322348)(例如通过链霉菌属使美登醇脱甲基来制备);和4,5-脱氧(us4371533)(例如通过美登醇的三氯化钛/lah还原来制备)。美登素类化合物化合物上的许多位置可用作连接位置。例如,酯连接可通过使用常规偶联技术与羟基反应来形成。在一些实施方案中,反应可发生在具有羟基的c-3位上、修饰有羟基甲基的c-14位上、修饰有羟基的c-15位上以及具有羟基的c-20位上。在一些实施方案中,连接在美登醇或美登醇类似物的c-3位上形成。美登素类化合物药物部分包括具有以下结构的那些:其中波浪线表示美登素类化合物药物部分的硫原子与adc的接头的共价连接。每个r可独立为h或c1-c6烷基。使酰胺基团与硫原子连接的亚烷基链可为甲基、乙基或丙基,即m为1、2或3(us633410;us5208020;charietal(1992)cancerres.52:127-131;liuetal(1996)proc.natl.acad.sciusa93:8618-8623)。针对本发明的adc考虑了美登素类化合物药物部分的所有立体异构体,即手性碳的r和s构型的任何组合(us7276497;us6913748;us6441163;us633410(re39151);us5208020;widdisonetal(2006)j.med.chem.49:4392-4408,将其全部内容通过引用的方式并入本申请)。在一些实施方案中,美登素类化合物药物部分具有以下立体化学:美登素类化合物药物部分的示例性实施方案包括但不限于dm1;dm3;和dm4,其具有以下结构:其中波浪线表示药物的硫原子与抗体-药物缀合物的接头(l)的共价连接。其他示例性美登素类化合物抗体-药物缀合物具有以下结构和缩写(其中ab为抗体且p为1至约20。在一些实施方案中,p为1至10,p为1至7,p为1至5,或p为1至4):其中dm1经bmpeo接头与抗体的巯基连接的示例性抗体-药物缀合物具有以下结构和缩写:其中ab为抗体;n为0、1或2;且p为1至约20。在一些实施方案中,p为1至10,p为1至7,p为1至5,或p为1至4。含有美登素类化合物的免疫缀合物、其制备方法以及其治疗用途披露于例如美国专利5,208,020和5,416,064;us2005/0276812a1;和欧洲专利ep0425235b1,将以上公开通过引用的方式明确地并入本申请。还参见liuetal.proc.natl.acad.sci.usa93:8618-8623(1996);andcharietal.cancerresearch52:127-131(1992)。在一些实施方案中,抗体-美登素类化合物缀合物可通过使抗体与美登素类化合物分子化学连接来制备,而不会显著降低抗体或美登素类化合物分子的生物活性。参见例如美国专利5,208,020(将以上公开通过引用的方式明确地并入本申请)。在一些实施方案中,其中每个抗体分子具有平均3-4个缀合的美登素类化合物分子的adc显示出增强对靶标细胞的细胞毒性而不会不利地影响抗体的功能或溶解度。在一些实例中,甚至一个分子的毒素/抗体预期可优于使用裸露抗体而增强细胞毒性。用于制备抗体-美登素类化合物缀合物的示例性连接基团包括例如披露于本申请的那些以及披露于以下的那些:美国专利5208020;ep专利0425235b1;charietal.cancerresearch52:127-131(1992);us2005/0276812a1;andus2005/016993a1,将以上公开通过引用的方式明确地并入本申请。卡奇霉素(calicheamicin)在一些实施方案中,所述免疫缀合物包含与一个或多个卡奇霉素分子缀合的抗体。抗生素的卡奇霉素家族及其类似物能够以亚皮摩尔浓度产生双链dna断裂(hinmanetal.,(1993)cancerresearch53:3336-3342;lodeetal.,(1998)cancerresearch58:2925-2928)。卡奇霉素具有作用的分子内位点,但在一些情况下,其不能容易地跨越质膜。因此,这些药物经抗体介导的内化的细胞摄取可在一些实施方案中显著增强其细胞毒性作用。用卡奇霉素药物部分制备抗体-药物缀合物的非限制性示例性方法描述于例如us5712374;us5714586;us5739116;和us5767285。cbi二聚体在一些实施方案中,药物部分为具有下式的cbi二聚体:其中r11选自h、p(o)3h2、c(o)nraarbb或与l的键;r22选自h、p(o)3h2、c(o)nraarbb或与l的键;raa和rbb独立地选自h和任选取代有一个或多个f的c1-c6烷基,或raa和rbb形成五或六元杂环烷基;t为连接基团,选自c3-c12亚烷基、y1、(c1-c6亚烷基)-y1-(c1-c6亚烷基)、(c1-c6亚烷基)-y1-(c1-c6亚烷基)-y1-(c1-c6亚烷基)、(c2-c6亚烯基)-y1-(c2-c6亚烯基)和(c2-c6亚炔基)-y1-(c2-c6亚炔基);其中y1独立选自o、s、nr11、芳基和杂芳基;其中亚烷基、亚烯基、芳基和杂芳基独立且任选取代有f、oh、o(c1-c6烷基)、nh2、nhch3、n(ch3)2、op(o)3h2和c1-c6烷基,其中烷基任选取代有一个或多个f;或亚烷基、亚烯基、芳基和杂芳基独立且任选取代有与l的键;d'为药物部分,选自:其中波浪线表示与t的连接位点;x1和x2独立选自o和nr33,其中r33选自h和任选取代有一个或多个f的c1-c6烷基,或x1和x2各自独立地不存在;r44为h、co2r、c(o)或与l的键,其中r为c1-c6烷基或苄基;且r55为h或c1-c6烷基。其他药物部分药物部分还包括格尔德霉素(mandleretal(2000)j.nat.cancerinst.92(19):1573-1581;mandleretal(2000)bioorganic&med.chem.letters10:1025-1028;mandleretal(2002)bioconjugatechem.13:786-791);以及酶促活性毒素及其片段,包括但不限于白喉a链、白喉毒素的未结合活性片段、外毒素a链(来自铜绿假单胞菌)、蓖麻毒蛋白a链、相思豆毒蛋白a链、蒴莲根毒素a链、α-八叠球菌、油桐蛋白、石竹素蛋白、商陆蛋白(papi、papii和pap-s)、苦瓜抑制剂、麻疯树毒蛋白、巴豆毒蛋白、肥阜草抑制剂、白树毒素、mitogellin、局限曲菌素、酚霉素、依诺霉素和单端孢霉烯族毒素。参见例如wo93/21232。药物部分还包括具有溶核活性的化合物(例如核糖核酸酶或dna内切核酸酶)。抗生素可与抗体缀合的抗生素包括克林霉素、新生霉素、瑞他莫林、达托霉素、gsk-2140944、cg-400549、西他沙星、替考拉宁、三氯生、萘啶酮、雷得唑来、多柔比星、氨苄西林、万古霉素、亚胺培南、多利培南、吉西他滨、达巴万星和阿奇霉素。所述抗生素的杀菌和抑菌作用的机制包括但不限于:(i)抑制细胞壁、肽聚糖延伸(万古霉素、替考拉宁、达巴万星);(ii)抑制细胞壁、青霉素结合蛋白交联(亚胺培南、多利培南、氨苄西林);(iii)细胞膜去极化(达托霉素);(iv)干扰dna复制(吉西他滨);(v)dna结合(多柔比星);(vi)烯酰acp-还原酶fabi(cg-400549、三氯生、萘啶酮);(vii)抑制核糖体蛋白合成,核糖体30s(克林霉素、瑞他莫林、雷得唑来);和(viii)拓朴异构酶(topoiia)抑制剂(新生霉素、西他沙星、gsk-2140944)。在结构上,大部分抗生素可分为以下组:(i)氨基糖甙类;(ii)β-内酰胺类;(iii)大环内酯类/环状肽;(iv)四环素类;(v)氟喹啉类/氟喹诺酮类;和(vi)噁唑烷酮类。参见shaw,k.andbarbachyn,m.(2011)ann.n.y.acad.sci.1241:48-70;sutcliffe,j.(2011)ann.n.y.acad.sci.1241:122-152。在某些实施方案中,免疫缀合物可包含高度放射性原子。各种放射性同位素可用于产生放射缀合的抗体。实例包括at211、i131、i125、y90、re186、re188、sm153、bi212、p32、pb212和lu的放射性同位素。在一些实施方案中,当免疫缀合物用于检测时,其可包含用于闪烁法研究的放射性原子,例如tc99或i123,或用于核磁共振(nmr)成像(也已知为磁共振成像,mri)的自旋标记物,诸如锆-89、碘-123、碘-131、铟-111、氟-19、碳13、氮-15、氧-17、钆、锰或铁。锆-89可与各种金属螯合剂络合且与抗体缀合,例如用于pet成像(wo2011/056983)。放射性或其他标记物可以已知方式掺入至免疫缀合物中。例如,可使用适当的氨基酸前体生物合成或化学合成肽,所述前体包含例如一个或多个氟-19原子代替一个或多个氢。在一些实施方案中,标记物诸如tc99、i123、re186、re188和in111可经半胱氨酸残基连接在抗体中。在一些实施方案中,钇-90可经抗体的赖氨酸残基连接。在一些实施方案中,iodogen方法(frakeretal(1978)biochem.biophys.res.commun.80:49-57)可用于掺入碘-123。"monoclonalantibodiesinimmunoscintigraphy"(chatal,crcpress1989)描述了某些其他方法。在某些实施方案中,免疫缀合物可包含缀合至前药活化酶的抗体。在一些所述实施方案中,前药活化酶将前药(例如肽基化疗剂,参见wo81/01145)转变成活性药物,诸如抗癌药。在一些实施方案中,所述免疫缀合物在抗体依赖性酶介导的前药疗法(“adept”)中是有用的。可缀合至抗体的酶包括但不限于对于将含磷酸盐/酯的前药转变为游离药物有用的碱性磷酸酶;对于将含硫酸盐/酯的前药转变为游离药物有用的芳基硫酸酯酶;对于将无毒5-氟胞嘧啶转变为抗癌药物5-氟尿嘧啶有用的胞嘧啶脱氨酶;对于将含肽的前药转变为游离药物有用的蛋白酶,诸如沙雷氏菌蛋白酶、嗜热菌蛋白酶、枯草杆菌蛋白酶、羧肽酶和组织蛋白酶(诸如组织蛋白酶b和l);对于转化含d-氨基酸替代的前药有用的d-丙氨酰羧肽酶;对于将糖基化前药转变为游离药物有用的碳水化合物切割酶,诸如β-半乳糖苷酶和神经氨酸酶;对于将用β-内酰胺衍生的药物转变为游离药物有用的β-内酰胺酶;及对于将在其胺氮处分别用苯氧基乙酰基或苯基乙酰基衍生的药物转变为游离药物有用的青霉素酰胺酶,诸如青霉素v酰胺酶或青霉素g酰胺酶。在一些实施方案中,可通过本领域公知的重组dna技术将酶共价结合至抗体。参见例如neuberger等,nature312:604-608(1984)。适应症和治疗方法预期本发明的抗体-药物缀合物(adc)可用于治疗各种疾病或病症,例如其特征在于肿瘤抗原的过表达的疾病或病症。示例性病症或过度增殖性病症包括良性或恶性实体瘤以及造血系统病症例如白血病和淋巴恶性肿瘤。其它疾病包括神经元、神经胶质、星形胶质细胞、下丘脑、腺体、巨噬细胞、上皮细胞、间质、囊胚腔、炎性、血管发生和免疫性疾病,包括自身免疫性疾病。在某些实施方案中,包含抗napi2b抗体的本发明adc(例如上述那些)用于治疗实体瘤如卵巢癌的方法中。在另一实施方案中,包含抗cd33抗体的本发明adc(例如上述那些)用于治疗血液恶性肿瘤的方法中,所述血液恶性肿瘤例如非霍奇金淋巴瘤(nhl)、弥散性大造血淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤、慢性淋巴细胞白血病、多发性骨髓瘤、急性髓细胞性白血病(aml)和髓细胞白血病(mcl),并包括b细胞相关的癌症和增殖病症。参见:us8226945;li等(2013)mol.cancer.ther.12(7):1255-1265;polson等(2010)leukemia24:1566-1573;polson等(2011)expertopin.investig.drugs20(1):75-85,这些文献的内容通过引用的方式并入本申请。在另一实施方案中,包含抗muc16抗体的本发明adc(例如上述那些)用于治疗卵巢癌、乳腺癌和胰腺癌的方法中。所述癌症可与muc16/ca125/o772p多肽的表达或活性相关。参见:wo2007/001851;us7989595;us8449883;us7723485;chenetal(2007)cancerres.67(10):4924-4932;junutula,etal.,(2008)naturebiotech.,26(8):925-932,这些文献的内容通过引用的方式并入本申请。在某些实施方案中,包含抗her2抗体的本发明adc(例如上述那些)用于治疗癌症的方法中,所述癌症例如乳腺癌或胃癌,更具体的是her2+乳腺癌或胃癌,其中所述方法包括对需要所述治疗的患者给药所述adc。在一个所述实施方案中,所述adc包含抗her2抗体曲妥珠单抗或帕妥珠单抗。一般而言,待治疗的疾病或病症为过度增殖性疾病如癌症。本申请所治疗的癌症的实例包括但不局限于癌、淋巴瘤、母细胞瘤、肉瘤和白血病或淋巴恶性肿瘤。所述癌症的更具体的实例包括:鳞状细胞癌(例如上皮鳞状细胞癌);肺癌,包括小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌;腹膜癌;肝细胞癌;胃癌(gastricorstomachcancer),包括胃肠癌;胰腺癌;成胶质细胞瘤;宫颈癌;卵巢癌;肝癌;膀胱癌;肝细胞癌;乳腺癌;结肠癌;直肠癌;结肠直肠癌;子宫内膜癌或子宫癌;唾液腺癌;肾癌(kidneyorrenalcancer);前列腺癌、外阴癌;甲状腺癌;肝癌;肛门癌;阴茎癌以及头颈部癌。抗体-药物缀合物可用于治疗的自身免疫性疾病包括风湿病(例如类风湿性关节炎;斯耶格仑氏综合征;硬皮病;狼疮,如系统性红斑狼疮(sle)和狼疮性肾炎;多肌炎/皮肌炎;冷球蛋白血症;抗-磷脂抗体综合征;和牛皮癣性关节炎)、骨关节炎、自身免疫性胃肠和肝病(例如炎性肠病(例如溃疡性结肠炎和克罗恩病)、自身免疫性胃炎和恶性贫血、自身免疫性肝炎、原发性胆汁性肝硬变、原发性硬化性胆管炎和乳糜泻)、血管炎(例如anca相关血管炎,包括丘-施血管炎、韦格纳肉芽肿和多动脉炎)、自身免疫性神经疾病(例如多发性硬化、斜视眼肌阵挛综合征、重症肌无力、眼脑脊髓病、帕金森病、阿尔茨海默病和自身免疫性多神经病)、肾脏疾病(例如肾小球肾炎、古德帕斯彻综合征和贝格尔病)、自身免疫性皮肤病(例如银屑病、荨麻疹(urticaria)、荨麻疹(hives)、寻常天疱疮、大疱性类天疱疮和皮肤红斑狼疮)、血液病(例如血小板减少性紫癜、血栓性血小板减少性紫癜、输血后紫癜和自身免疫性溶血性贫血)、动脉粥样硬化、眼色素层炎、自身免疫性听觉疾病(例如内耳疾病和听力丧失)、贝切特病、雷诺综合征、器官移植和自身免疫性内分泌病症(例如糖尿病相关性自身免疫性疾病,诸如胰岛素依赖性糖尿病(iddm)、艾迪生病和自身免疫性甲状腺病(例如格雷夫斯病和甲状腺炎))。更优选的所述疾病包括:例如类风湿性关节炎、溃疡性结肠炎、anca相关血管炎、狼疮、多发性硬化、斯耶格仑综合征、格雷夫斯病、iddm、恶性贫血、甲状腺炎和肾小球肾炎。为预防或治疗疾病,adc的适当剂量将取决于如上定义的待治疗的疾病类型、疾病的严重度和时程、给药所述分子是为了预防还是为了治疗目的、先前的治疗、患者的临床史和对抗体的反应,以及主治医师的判定。将所述分子适当地对所述患者给药一次或在一系列治疗过程中给药。取决于疾病类型和严重度,对患者给药的分子的初始候选剂量约为1μg/kg至15mg/kg(例如0.1-20mg/kg),例如,无论是通过一次或多次分开的给药,还是通过连续输注。典型的每日剂量可在约1μg/kg至100mg/kg或更大的范围内,这取决于上述因素。对患者给药的adc的示例性剂量在约0.1至约10mg/kg患者体重的范围内。实验部分制备肽模拟接头药物部分的方法;将pct/us2014/042560引入本申请,作为参考。实施例1.7-(4-((4-((2r,5s,z)-5-(苄基氧基羰基氨基)-4-氟-6-甲基-2-(3-脲基丙基)庚-3-烯酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.将1-1(10.0g,85.36mmol)、1-2(13.3g,89.79mmol)的混合物在150℃搅拌1h。将混合物冷却至25℃,将固体溶于热水中。将混合物在冰浴中冷却并将析出物经滤过收集并用水洗涤。将滤饼干燥得到1-3,其为白色固体(19.0g,90.0%).1hnmr(400mhz,dmso-d6)δ11.96(br,1h),7.78-7.77(m,4h),3.52(t,j=6.8hz,2h),2.18(t,j=7.2hz,2h),1.59-1.51(m,2h),1.47-1.41(m,2h).步骤2.在室温向1-3(9.0g,36.40mmol)在无水dcm(100ml)中的混合物中逐滴加入(cocl)2(15.0ml,157.76mmol)、dmf(1ml)。在反应混合物在室温搅拌0.5h后,将其减压浓缩。将残留物与无水thf(60ml)共蒸发得到酰氯,其为黄色固体。在-78℃在氮气下向1-4(6.6g,37.25mmol)在无水thf(60ml)中的混合物中逐滴加入n-buli(15.0ml,2.5m,37.5mmol)。在-78℃将酰氯/thf(40ml)缓慢加至混合物中。将反应混合物在-78℃搅拌15min,并用nh4cl水溶液(30ml)淬灭。将混合物在etoac和水之间分配。将合并的有机层经na2so4干燥,滤过,并浓缩。将残留物经硅胶柱色谱纯化(pe/etoac3:1)得到粗化合物1-5,其为白色固体(13.0g,87.9%).1hnmr(400mhz,dmso-d6)δ7.89-7.83(m,4h),7.32-7.28(m,2h),7.25-7.22(m,1h),7.19-7.17(m,2h),4.66-4.60(m,1h),4.30(t,j=8.4hz,1h),4.17(dd,j=9.2,2.8hz,1h),3.61(t,j=6.4hz,2h),3.00–2.78(m,4h),1.70-1.60(m,4h).步骤3.向1-6(3.0g,25.39mmol)在dcm(100ml)中的溶液中加入pcc(10.9g,50.78mmol)。在将混合物在25℃在氮气下搅拌16h后,将其经硅胶填料滤过。将滤液在25℃的浴温减压浓缩得到化合物1-7,其为油状物(1.8g,61.0%).1hnmr(400mhz,cdcl3)δ9.18(d,j=18.4hz,1h),5.79(dd,j=32.8,9.2hz,1h),3.02-2.93(m,1h),1.13(d,j=6.8hz,6h).步骤4.将1-5(6.0g,14.7mmol)在dcm(20ml)中的溶液用冰浴冷却至0℃。逐滴加入bu2botf/dcm(1m,15ml,15mmol),随后以保持内部温度低于3℃的速率加入et3n(3.03g,30mmol)。将冰浴用干冰-丙酮浴替换。当内部温度降低至低于-65℃时,逐滴加入化合物1-7(1.5g,12.9mmol)在dcm(10ml)中的溶液。将溶液在干冰-丙酮浴中搅拌20min,然后在冰浴温度搅拌1h。将反应混合物用磷酸盐缓冲水溶液(ph=7.0,20ml)和meoh(10ml)淬灭。向该浑浊溶液中以保持内部温度低于10℃的速率加入meoh/30%h2o2混合物(2:1,20ml)。在将溶液搅拌另外的1h后,在旋转蒸发器上在25-30℃的浴温除去挥发物。将浆液用etoac(50ml×3)萃取。将合并的有机层用饱和na2so3溶液(15ml)、5%nahco3溶液(30ml)和盐水(25ml)洗涤,经na2so4干燥,滤过并浓缩。将残留物经硅胶柱色谱纯化(pe/etoac3:1)得到粗的1-8,其为油状物(4.0g,59.7%).lcms(esi):m/z505.0[m-17].步骤5.在0℃在氮气下向1-8(4.0g,7.65mmol)和cl3ccn(1.67g,11.48mmol)在dcm(20ml)中的溶液中加入dbu(234mg,1.53mmol)。将混合物在0℃搅拌1h。除去溶剂后,将残留物经硅胶柱色谱纯化(5%-20%石油醚/etoac)得到1-9(3.0g,58.8%).lcms(esi):m/z505.1[m-160].1hnmr(400mhz,cdcl3)δ8.47(s,1h),7.83-7.80(m,2h),7.72-7.69(m,2h),7.36-7.28(m,2h),7.28-7.22(m,3h),5.69-5.63(q,1h),4.89(dd,j=37.6,9.6hz,1h),4.63-4.58(m,2h),4.20-4.11(m,2h),3.74-3.69(m,2h),3.35(dd,j=13.2,3.2hz,1h),2.78-2.69(m,2h),1.99-1.85(m,2h),1.80-1.76(m,2h),0.96-0.92(q,6h).步骤6.将1-9(3.0g,4.50mmol)在二甲苯(5ml)中的溶液在微波中在135℃加热2h。将混合物冷却至25℃并经硅胶柱色谱纯化(5%-10%-50%pe/etoac)得到1-10(1.4g,46.7%).lcms(esi):m/z685.0[m+h2o].1hnmr(400mhz,cdcl3)δ7.83-7.81(m,2h),7.71-7.69(m,2h),7.36-7.32(m,2h),7.29-7.25(m,1h),7.21-7.19(m,2h),6.90(d,j=8.8hz,1h),5.11(dd,j=36.4,9.6hz,1h),4.81-4.76(m,1h),4.68-4.64(m,1h),4.30-4.16(m,3h),3.75-3.68(m,2h),3.27(dd,j=13.2,3.2hz,1h),2.80-2.74(q,1h),2.08-2.05(m,1h),1.93-1.90(m,1h),1.76-1.70(m,2h),1.65-1.62(m,1h),1.00(dd,j=6.8,3.2hz,6h).步骤7.向化合物1-10(1.4g,2.1mmol)在thf/h2o(v/v4:1,10ml)中的溶液中加入h2o2(1.43g,30%在水中,12.6mmol),随后加入lioh.h2o(264.6mg,6.3mmol)。在将溶液在25℃搅拌1.5h后,加入饱和na2so3溶液(8ml)。除去溶剂并将残留物用dcm(20ml×2)萃取。将水溶液用1mhcl酸化至ph=1,用etoac/meoh(10/1,25ml×3)萃取。将合并的有机层经na2so4干燥,滤过,并浓缩得到化合物1-11(1.0g,93.4%).lcms(esi):m/z527.0[m+na+].步骤8.在0℃在氮气下向化合物1-11(1.0g,1.97mmol)和(4-氨基苯基)甲醇(364mg,2.96mmol)在dcm/meoh(v/v2:1,7.5ml)中的溶液中加入eedq(732mg,2.96mmol)。将混合物在25℃搅拌16h。除去溶剂,将残留物经硅胶柱色谱纯化(30%石油醚/etoac)得到粗化合物1-13(1.0g,82.8%).lcms(esi):m/z614.0[m+h+].步骤9.在0℃向化合物1-13(1.0g,1.63mmol)在etoh(15ml)中的溶液中加入nabh4(364.8mg,9.60mmol)。将混合物在25℃搅拌2h并加入水(10ml)以淬灭反应混合物。然后在0℃逐滴加入cbz-cl(410.4mg,2.40mmol)。将混合物在0℃搅拌1h。将混合物用水稀释,并用dcm(25ml×3)萃取。将有机层经na2so4干燥,减压浓缩。将残留物经硅胶柱色谱纯化(dcm/meoh=20:1~5:1)得到粗化合物1-14(300mg,31.2%).lcms(esi):m/z602.0[m+h].步骤10.向化合物1-14(300mg,0.498mmol)在etoh(10ml)中的溶液中逐滴加入nh2nh2.xh2o(48mg,50%,0.748mmol)。将混合物回流加热1h。将反应混合物浓缩,并将残留物(1-15)无需进一步纯化即可直接用于下一反应中。步骤11.向化合物1-15(281.0mg,0.496mmol)在dmf(5ml)中的搅拌溶液中加入tea(100mg,0.992mmol)和cdi(162.7mg,0.992mmol)。在将混合物在29℃搅拌1h后,加入nh3h2o(5ml),并将混合物在29℃搅拌16h。将反应混合物滤过并将滤液经制备性hplc纯化,得到化合物1-16(50mg,19.6%),其为白色固体。lcms(esi):m/z515.1[m+1].1hnmr(400mhz,dmso-d6)δ9.94(s,1h),7.66(d,j=9.2hz,1h),7.53(d,j=8.4hz,2h),7.35-7.29(m,5h),7.22(d,j=8.4hz,2h),5.94(t,j=6.0hz,1h),5.36(s,2h),5.10(t,j=6.0hz,1h),5.05-4.94(m,3h),4.42(d,j=4.2hz,2h),3.92-3.83(m,1h),3.46-3.44(m,1h),3.01-2.90(m,2h),1.92-1.85(m,1h),1.65-1.63(m,1h),1.44-1.28(m,3h),0.88(t,j=6.4hz,6h).步骤12.向化合物1-16(50mg,0.097mmol)在无水dmf(3ml)中的混合物中加入dipea(63mg,0.485mmol)。在25℃加入pnp碳酸盐(87mg,0.291mmol)。将反应混合物在25℃搅拌8h,并加入诺氟沙星(93mg,0.291mmol)。在将混合物在25℃搅拌另外的3h后,将其滤过,并将滤液经制备性hplc纯化,得到实施例1(35mg,42.0%).lcms(esi):rt=0.885min,m/2+h+=430.7.方法=5-95/2min.1hnmr(400mhz,dmso-d6)δ15.32(s,1h),10.04(s,1h),8.95(s,1h),7.94(d,j=12.8hz,1h),7.66(d,j=8.8hz,1h),7.60(d,j=8.8hz,2h),7.34-7.28(m,7h),7.21(d,j=7.2hz,1h),5.94(t,j=5.2hz,1h),5.36(s,2h),5.06-4.94(m,5h),4.59-4.57(q,2h),3.92-3.84(m,1h),3.61(s,4h),3.49-3.43(q,1h),3.33-3.31(m,4h),3.01-2.90(m,2h),1.90-1.83(m,1h),1.68-1.65(m,1h),1.41(d,j=6.8hz,5h),1.33-1.23(m,1h),0.86(t,j=6.8hz,6h).实施例2.7-(4-((4-((2r,5s,z)-5-(苄基氧基羰基氨基)-4-氟-2,6-二甲基庚-3-烯酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0℃向nah(1.82g,45.5mmol)在thf(200ml)中的混合物中逐滴加入2-1(10.0g,41.3mmol)在thf(20ml)中的溶液。将混合物在0℃搅拌1h,然后冷却至-78℃。逐滴加入化合物2-2(2.98g,41.3mmol)在thf(5ml)中的溶液并将混合物缓慢温热至25℃,并在25℃搅拌16h。在0℃缓慢加入饱和nh4cl溶液,随后加入水(50ml)并将混合物用etoac(80ml×2)萃取。将有机层经na2so4干燥,滤过,浓缩并经硅胶柱色谱纯化(pe/etoac=50:1)得到2-3(2.2g,33%).1hnmr(400mhz,cdcl3)δ5.73(dd,j=10.4,22.0hz,1h),4.30(q,j=7.2hz,2h),3.37-3.31(m,1h),1.35(t,j=7.2hz,3h),1.08-1.04(m,6h).步骤2.在0℃向2-3(12.0g,74.91mmol)在thf(80ml)中的溶液中加入lialh4(5.69g,149.82mmol)。在将混合物在0℃搅拌2h后,将其用饱和nh4cl溶液(1ml)淬灭。减压除去有机溶剂并将混合物用水(50ml)稀释并用etoac(100ml×2)萃取。将有机层经na2so4干燥,滤过,浓缩得到粗产物2-4(8.0g).1hnmr(400mhz,cdcl3)δ5.06(dd,j=10.4,21.2hz,1h),4.24(d,j=21.2hz,2h),2.42-2.37(m,1h),1.03-0.99(m,6h).步骤3.在25℃向2-4(8.0g,33.86mmol)在dcm(100ml)中的溶液中加入pcc(29.2g,67.72mmol)。在将混合物在氮气下回流加热3h后,将其冷却至25℃并经硅胶填料滤过。浓缩滤液得到粗的2-5(5.1g).1hnmr(400mhz,cdcl3)δ9.19(d,j=18.0hz,1h),5.79(dd,j=9.6,32.8hz,1h),3.01-2.95(m,1h),1.15-1.13(m,6h).步骤4.将bu2botf/dcm(1m,66ml,66mmol)逐滴加至2-6(15.37g,65.88mmol)在dcm(200ml)中的溶液中,随后以保持内部温度低于3℃的速率加入et3n(8.89g,87.84mmol)。将其冷却至-65℃,并逐滴加入2-5(5.1g,43.92mmol)在dcm(10ml)中的溶液。将溶液在干冰-丙酮浴中搅拌20min,然后在冰浴中搅拌1h。将反应混合物用ph7磷酸盐缓冲水溶液(50ml)和meoh(150ml)淬灭。向该浑浊溶液中以保持内部温度低于10℃的速率加入meoh/30%h2o2混合物(2:1,90ml)。在将溶液搅拌另外的1h后,在旋转蒸发器上在25-30℃的浴温除去挥发物。将所得的浆液用etoac(150ml×3)萃取。将合并的有机层用饱和na2so3溶液(150ml)、5%nahco3溶液(150ml)和盐水(150ml)洗涤,经na2so4干燥,滤过并浓缩。将残留物经硅胶柱色谱纯化(pe/etoac3:1)得到2-7(8.8g,57%).1hnmr(400mhz,cdcl3)δ7.36-7.27(m,3h),7.21-7.19(m,2h),4.85(dd,j=9.2,38.4hz,1h),4.73-4.67(m,1h),4.53-4.50(m,1h),4.27-4.19(m,2h),3.99-3.95(m,1h),3.24(dd,j=3.2,13.6hz,1h),3.17-3.16(m,1h),2.83-2.74(m,2h),1.29(d,j=6.8hz,3h),1.02-0.99(m,6h).步骤5.在0℃在氮气下向2-7(2.0g,5.72mmol)和cl3ccn(1.24g,8.58mmol)在dcm(15ml)中的溶液中加入dbu(174mg,1.14mmol)。在将混合物在0℃搅拌1h后,除去溶剂并将残留物经硅胶柱色谱纯化(5%-20%石油醚/etoac)得到2-8(1.55g,55%).1hnmr(400mhz,cdcl3)δ8.47(s,1h),7.35-7.27(m,3h),7.25-7.19(m,2h),5.81-5.75(m,1h),4.98-4.85(m,1h),4.64-4.59(m,1h),4.40-4.36(m,1h),4.22-4.17(m,2h),3.27-3.24(m,1h),2.83-2.71(m,2h),1.40-1.38(m,3h),0.99-0.95(m,6h).步骤6.将2-8(1.55g,3.14mmol)在二甲苯(10ml)中的溶液在135℃加热30h。将其冷却至室温并减压除去溶剂。将残留物经硅胶柱色谱纯化(5%-10%-50%石油醚/etoac)得到2-9(450mg,29%).1hnmr(400mhz,cdcl3)δ7.35-7.28(m,3h),7.21-7.20(m,2h),6.75(d,j=8.4hz,1h),5.20(dd,j=9.2,37.6hz,1h),4.76-4.65(m,2h),4.28-4.17(m,3h),3.27-3.23(m,1h),2.79(dd,j=9.6,13.2hz,1h),2.07-2.00(m,1h),1.33(d,j=7.2hz,3h),1.00-0.94(m,6h).步骤7.向2-9(950mg,1.92mmol)在thf和h2o(v/v4:1,10ml)中的溶液中加入h2o2(1.38mg,11.52mmol),随后加入lioh.h2o(242mg,5.76mmol)在水(2ml)中的溶液。在将溶液在10℃搅拌1h后,加入饱和na2so3溶液(8ml)。除去溶剂,并将残留物用dcm(20ml×2)洗涤。将水溶液用1mhcl酸化至ph1,并用etoac(25ml×3)萃取。将有机层经na2so4干燥,滤过,浓缩得到2-10(420mg,65%).lcms(esi):m/z334.0[m+h+].步骤8.在0℃在氮气下向2-10(420mg,1.26mmol)和(4-氨基苯基)甲醇(233mg,1.89mmol)在dcm(10ml)中的溶液中加入eedq(623mg,2.52mmol)。在将混合物在10℃搅拌3h后,除去溶剂,并将残留物经硅胶柱色谱纯化(30%石油醚/乙酸乙酯)得到2-11(300mg,54%).lcms(esi):m/z439.0[m+h+].步骤9.在0℃向2-11(300mg,0.682mmol)在etoh(6ml)中的溶液中加入nabh4(300mg,7.94mmol)。将混合物在10℃搅拌3h。加入水(0.5ml),并减压除去etoh。将粗物质溶于thf(4ml)和饱和nahco3溶液(4ml)的混合物,并在10℃加入cbzcl(140mg,8.18mmol)。在将混合物在10℃搅拌2h后,除去溶剂并将残留物用dcm(8ml×2)萃取。将有机层经na2so4干燥,浓缩,并经硅胶柱色谱纯化(pe/etoac=2:1)得到2-12(125mg,43%).1hnmr(400mhz,meod)δ7.53-7.46(m,2h),7.36-7.25(m,7h),5.11-5.00(m,3h),4.56(s,2h),3.94-3.87(m,1h),3.63-3.59(m,1h),1.98-1.92(m,1h),1.27(d,j=6.8hz,3h),0.96-0.93(m,6h).lcms(esi):m/z429.2[m+h+].步骤10.在10℃向2-12(20mg,0.0467mmol)在dcm(2ml)中的溶液中加入pnp碳酸盐(43mg,0.140mmol)和diea(24mg,0.187mmol)。在将混合物回流加热16h后,除去溶剂,并将残留物溶于dmf(2ml)。在10℃向该溶液中加入diea(24mg,0.187mmol)和诺氟沙星(22mg,0.070mmol),并将所得的溶液在10℃搅拌1h。除去溶剂后,将残留物经制备性hplc纯化,得到实施例2(14.1mg,39%).1hnmr(400mhz,dmso-d6)δ15.35(br,1h),10.02(s,1h),8.95(s,1h),7.95-7.91(m,1h),7.69-7.58(m,3h),7.34-7.19(m,8h),5.12-5.00(m,5h),4.59-4.57(m,2h),3.87-3.81(m,1h),3.60-3.51(m,5h),3.30(s,4h),1.89-1.83(m,1h),1.40(t,j=7.2hz,3h),1.20-1.81(m,3h),0.87(m,6h).lcms(esi):m/z774.8[m+h+]实施例3.1-乙基-6-氟-4-氧代-7-(4-((4-((s)-2-(1-((s)-1-(噻吩-3-基)乙基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1,4-二氢喹啉-3-羧酸.步骤1.在20℃向化合物3-1(2g,15.9mmol)在meoh(20ml)中的溶液中加入nh4oac(12.2g,0.159mol)和nabh3cn(3.5g,55.5mmol)。在将混合物在20℃搅拌16h后,将其浓缩。将残留物在etoac(50ml)和naoh溶液(5m,5ml)(调节ph>13)之间分配。将有机层用盐水(20ml×2)洗涤,浓缩并经柱色谱纯化(20%-30%meoh/dcm)得到粗化合物3-2(800mg,40%收率).1hnmr(400mhz,dmso-d6)δ7.63-7.61(d,j=8.0hz,1h),7.58-5.57(m,1h),7.25-7.23(d,j=8.0hz,2h),4.53-4.48(m,1h),1.51-1.49(d,j=8.0hz,3h).步骤2.在20℃向化合物3-3(500mg,1.23mmol)在dmf(3ml)中的溶液中加入化合物3-2(600mg,4.7mmol)、dipea(0.5ml,3mmol)和hatu(740mg,2mmol)。在将混合物在20℃搅拌2h后,将其经制备性hplc纯化,得到3-4(360mg,57%收率)。化合物3-4(300mg)经sfc分离得到2个异构体3-4a和3-4b.1hnmr(400mhz,dmso-d6)δ10.03(s,1h),8.12-8.10(m,1h),7.9-7.75(m,1h),7.55-7.52(m,2h),7.45-7.35(m,2h),7.3-7.2(m,3h),7.04(m,1h),6.0(m,1h),5.5-5.2(m,2h),5.1-5.0(m,1h),4.45-4.35(m,3h),3.1-2.9(m,4h),2.43-2.39(m,4h),1.8-1.7(m,3h),1.7-1.5(m,1h),1.5-1.33(m,5h).步骤3.在20℃向化合物3-4b(110mg,0.21mmol)在无水dmf(3ml)中的溶液中加入pnp(130mg,0.43mmol)和dipea(0.5ml,3mmol)。在将混合物在20℃在氮气下搅拌1.5h后,加入诺氟沙星(100mg,0.31mmol)。将混合物在20℃搅拌另外的1h并经制备性hplc纯化(fa),得到实施例3(102.1mg,57%).1hnmr(400mhz,dmso-d6)δ10.15(s,1h),8.93(s,1h),8.10-8.08(d,1h),8.04(s,1h),7.93-7.90(m,2h),7.60-7.58(d,j=8.0hz,2h),7.41-7.39(d,,2h),7.32-7.30(d,j=8.0hz,2h),7.25(d,1h),7.20(d,1h),7.04-7.02(d,1h),6.0(m,1h),5.40(s,2h),5.1-5.0(m,3h),4.6-4.5(m,2h),4.5-4.35(m,1h),3.59(s,1h),3.2(s,4h),3.1-2.9(m,2h),2.42-2.40(m,4h),1.8-1.7(m,3h),1.7-1.6(m,1h),1.5-1.3(m,8h).实施例4.(s)-1-乙基-7-(4-((4-(2-(1-(乙基氨基甲酰基)环丁烷甲酰氨基)-5-胍基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向化合物4-1(1.3g,2mmol)在dcm/meoh(20ml/20ml)中的溶液中加入4-氨基-苯基)-甲醇(370mg,3mmol)和eedq(989mg,4mmol)。将混合物在室温搅拌16h。将残留物经柱色谱纯化(pe/etoac=1/3)得到4-3(1.94g,收率:90%)在室温经注射器向4-3(1.44g,2mmol)在dcm(50ml)中的溶液中加入4-4(1.2ml,9.56mmol)。将混合物在室温搅拌16h。将残留物浓缩并由甲基叔丁基醚洗涤,然后滤过并合并滤饼得到4-5(700mg,收率:70%).步骤2.向4-5(700mg,1.32mmol)在dme(10ml)中的溶液中加入4-6(424mg,1.58mmol)和nahco3(222mg,2.64mmol)在水(10ml)中的溶液。将混合物在室温搅拌16h。将混合物用etoac洗涤并用10%hcl调节至ph=3。将所得的混悬液用etoac萃取。将合并的有机层浓缩并经柱色谱纯化(pe/etoac=1/3)得到4-7(400mg,收率:37%)步骤3.在0℃向4-7(250mg,0.365mmol)、pnp碳酸盐(223mg,0.731mmol)在dmf(4ml)中的溶液中加入dipea(142mg,1.095mmol)。将混合物在室温搅拌16h。混合物(4-8)无需进一步纯化即可用于下一步。步骤4.在室温向来自最后一步的混合物中加入诺氟沙星(234mg,0.73mmol)。在将混合物在室温搅拌1h后,将其经制备性hplc和sfc纯化,得到4-9(收率:30%).步骤5.在0℃向化合物4-9(100mg,0.1mmol)中加入tfa在dcm(1:5)中的溶液。将混合物在室温搅拌3h。将混合物经nh3.h2o碱化为ph=9。将残留物经制备性hplc、然后sfc纯化,得到实施例4(16.0mg,收率:15%).1hnmr(400mhz,甲醇-d4)δ8.83(s,1h),8.55(s,1h),7.97(d,j=13.2hz,1h),7.62(d,j=7.6hz,2h),7.35(d,j=7.6hz,2h),7.17(s,1h),5.13(s,2h),4.55-4.52(m,3h),3.72(s,4h),3.34(s,4h),3.31–3.24(m,4h),2.58-2.54(m,4h),2.00–1.69(m,6h),1.52(s,3h),1.15–0.11(m,3h).实施例5.1-乙基-6-氟-4-氧代-7-(4-((4-((s)-2-(1-((s)-1-苯基乙基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1,4-二氢喹啉-3-羧酸步骤1.将化合物5-1(50mg,0.1mmol)和5-2(15mg,0.12mmol)在dmf(10ml)中的混合物在室温搅拌3h。将混合物浓缩并经制备性tlc纯化(meoh/dcm=1/10)得到5-3(50mg,99%).步骤2.在0℃向化合物5-3(40mg,0.078mmol)、pnp碳酸盐(48mg,0.157mmol)在dmf(4ml)中的溶液中加入dipea(30mg,0.236mmol)。将混合物在室温搅拌16h。混合物(5-4)无需进一步纯化即可用于下一步。步骤3.在室温向来自最后一步的混合物中加入诺氟沙星(51mg,0.157mmol)并搅拌1h。将残留物经制备性hplc纯化,得到实施例5.(7mg,收率:8%)1hnmr(400mhz,meoh-d4)δ8.86(s,1h),8.46(s,1h),8.00(d,j=12.8hz,1h),7.61(d,j=8hz,2h),7.35–7.33(m,2h),7.30(d,j=7.2hz,2h),7.24(d,j=7.2hz,2h),7.20(d,j=14hz,2h),7.16(s,2h),5.12(s,2h),5.04(d,j=7.2hz,1h),4.50–4.47(m,4h),3.71(s,4h),3.34(s,4h),3.22–3.03(m,2h),2.60–2.51(m,4h),1.94–1.86(m,3h),1.74–1.71(m,1h),1.60–1.45(m,7h).实施例6.1-乙基-6-氟-4-氧代-7-(4-((4-((s)-2-(1-((s)-1-(噻吩-2-基)乙基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1,4-二氢喹啉-3-羧酸实施例6使用如实施例3的操作制备。其与实施例10共用中间体。1hnmr(400mhz,dmso-d6)δ15.3(s,1h),10.13(s,1h),8.93(s,1h),8.25(d,1h),7.94-7.91(d,j=12.0hz,1h),7.8(d,1h),7.60-7.58(d,j=8.0hz,2h),7.33-7.30(d,j=8.0hz,3h),7.20(d,1h),6.92-6.91(m,2h),5.95(m,1h),5.40(s,1h),5.25-5.15(m,1h),5.04(s,2h),4.65-4.4(m,2h),4.5-4.4(m,1h),3.7-3.5(s,4h),3.3(s,4h),3.1-2.85(m,2h),2.44-2.42(m,4h),1.8-1.7(m,3h),1.7-1.55(m,1h),1.46-1.45(d,j=4.0hz,1h),1.45-1.3(m,5h).实施例7.7-(4-((4-((s)-2-(1-((r)-3-(烯丙基氧基)-3-氧代-1-(噻吩-3-基)丙基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向化合物7-1(10.0g,89.17mmol)和ch2(cooh)2(9.3g,89.17mmol)在etoh(100ml)中的溶液中加入nh4oac(13.7g,178.33mmol)。将混合物在80℃搅拌6h。将其冷却至室温,滤过,并用etoh(100ml)洗涤。收集滤饼,并减压浓缩得到化合物7-2(8.0g,52.6%),其为白色固体。1hnmrd2o400mhz,δ7.44(s,2h),7.13(d,j=3.2hz,1h),4.69(t,j=7.2hz,1h),2.84-2.73(m,2h).步骤2.向化合物7-2(6.0g,35.04mmol)和化合物7-3(60.0g)的混合物中逐滴加入tmscl(13.4ml,ρ=0.85,105.13mmol)。将反应混合物在室温在氮气下搅拌过夜。将混合物减压浓缩,并将残留物用h2o(50ml)稀释,经hcl溶液调节至ph1,并用etoac(50ml×3)洗涤。将水相经nh3h2o调节至ph12,并用etoac(50ml×3)萃取。将合并的etoac层经na2so4干燥,滤过,并减压浓缩得到化合物7-4,其为油状物(4.0g,54.1%).1hnmrdmso-d6400mhz,δ7.45-7.43(q,1h),7.31(s,1h),7.15(d,j=4.8hz,1h),5.91-5.85(m,1h),5.27(dd,j=17.2,1.6hz,1h),5.20-5.17(m,1h),4.53(d,j=5.2hz,2h),4.31-4.27(m,1h),2.73-2.61(m,2h).步骤3.向化合物7-5(1.0g,2.46mmol)在dmf(20ml)中的混合物中加入dipea(636mg,4.92mmol),随后加入hatu(1.4g,3.69mmol)。将混合物在室温搅拌15min,并加入化合物7-4(624mg,2.95mmol)。将反应混合物在室温搅拌2h并经制备性hplc纯化,得到化合物7-6,其为白色固体(800mg,54.1%).化合物7-6扩大至1.5g,并经sfc分离得到7-6a(580mg)和7-6b(560mg).7-6alcms:(5-95,ab,1.5min,esi),0.773min,ms=600.1[m+1]1hnmrdmso-d6400mhz,δ10.05(s,1h),8.25(d,j=8.4hz,1h),7.74(d,j=7.9hz,1h),7.56(d,j=8.4hz,2h),7.45-7.43(q,1h),7.31(d,j=2.6hz,1h),7.24(d,j=8.4hz,2h),7.08(d,j=4.0hz,1h),5.97(t,j=5.6hz,1h),5.90-5.80(m,1h),5.43-5.37(m,3h),5.27(dd,j=17.4,1.5hz,1h),5.17(dd,j=10.4hz,1.3hz,1h),5.17(t,j=5.7hz,1h),4.51(d,j=5.3hz,2h),4.44-4.39(m,3h),3.06-2.98(m,1h),2.97-2.88(m,3h),2.48-2.39(m,4h),1.78-1.70(m,3h),1.64-1.55(m,1h),1.42-1.28(m,2h).7-6blcms:(5-95,ab,1.5min,esi),0.762min,ms=600.1[m+1]1hnmrdmso-d6400mhz,δ10.04(s,1h),8.26(d,j=8.4hz,1h),7.79(d,j=7.7hz,1h),7.57(d,j=8.4hz,2h),7.39-7.37(q,1h),7.31(s,1h),7.24(d,j=8.4hz,2h),7.07(d,j=4.9hz,1h),5.97(t,j=5.5hz,1h),5.91-5.81(m,1h),5.43-5.36(m,3h),5.26(dd,j=17.3,1.4hz,1h),5.18(d,j=10.4hz,1h),5.11(t,j=5.7hz,1h),4.53-4.52(m,2h),4.44-4.40(m,3h),3.05-2.98(m,1h),2.97-2.85(m,3h),2.46-2.33(m,4h),1.77-1.72(m,3h),1.64-1.56(m,1h),1.42-1.30(m,2h).步骤4.向7-6a(50mg,0.083mmol)在无水dmf(5ml)中的溶液中加入dipea(107mg,0.83mmol),随后加入pnp碳酸盐(60mg,0.20mmol)。将反应混合物在室温搅拌过夜。然后加入诺氟沙星(64mg,0.20mmol)。将反应混合物在室温搅拌另外的2h。将混合物滤过,并将滤液经制备性hplc纯化,得到实施例7,其为白色固体(41.7g,53.5%).lcms:(5-95,ab,1.5min,esi),0.858min,ms=473.3[1/2m+1]1hnmrdmso-d6400mhz,δ15.32(br,1h),10.15(s,1h),8.95(s,1h),8.23(d,j=8.0hz,1h),7.91(d,j=13.0hz,1h),7.77(d,j=7.5hz,1h),7.62(d,j=8.0hz,2h),7.44-7.42(q,1h),7.35-7.31(m,3h),7.19(br,1h),7.08(d,j=4.5hz,1h),5.98(br,1h),5.89-5.80(m,1h),5.44-5.37(m,3h),5.23(d,j=17.6hz,1h),5.16(d,j=10.5hz,1h),5.07(s,2h),4.57(br,2h),4.51(d,j=5.5hz,2h),4.45-4.40(m,1h),3.61(br,4h),3.31(br,4h),3.06-3.01(m,1h),2.95-2.90(m,3h),2.47-2.40(m,4h),1.76-1.72(m,3h),1.62-1.59(m,1h),1.40-1.35(m,5h).实施例8.1-乙基-6-氟-4-氧代-7-(4-((4-((s)-2-(1-((r)-1-(噻吩-3-基)乙基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1,4-二氢喹啉-3-羧酸实施例8使用如实施例3的操作制备,采用来自合成实施例3的中间体。1hnmr(400mhz,dmso-d6)δ10.14(s,1h),8.92(s,1h),8.05-8.03(d,1h),7.93-7.90(d,j=12.0hz,1h),7.85-7.83(d,1h),7.61-7.59(d,j=8.0hz,1h),7.36-7.35(m,1h),7.33-7.31(d,j=8.0hz,2h),7.24(s,1h),7.20(m,1h),5.5(m,1h),7.04-7.03(m,1h),6.0(m,1h),5.40(s,2h),5.1-5.0(m,3h),4.6-4.5(m,2h),4.5-4.35(m,1h),3.59(s,1h),3.2(s,4h),3.05-2.9(m,2h),2.44-2.41(m,4h),1.8-1.7(m,3h),1.7-1.6(m,1h),1.5-1.35(m,8h).实施例9.1-乙基-6-氟-7-(4-((4-((2s)-2-(1-(4-甲基戊-2-基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-羧酸实施例9使用如实施例5的操作制备。lcms:(5-95ab,1.5min),t=0.858min,m=8.352(m+1);1hnmr(400mhz,dmso-d6)δ10.22(s,1h),8.85(s,1h),7.89-7.71(m,2h),7.65-7.64(d,j=8.8hz,2h),7.53-7.50(m,1h),7.34-7.31(d,j=8.8hz,2h),7.18-7.13(m,1h),6.06(s,1h),5.45(d,j=3.2hz,2h),5.05(s,2h),4.60-4.42(m,2h),3.91-3.88(t,j=6.4hz,1h),3.59(s,4h),3.26(s,4h),3.03-2.99(m,1h),2.97-2.91(m,1h),2.41-2.39(m,5h),1.74-1.71(m,3h),1.7-1.5(m,2h),1.5-1.3(m,6h),1.2-1.1(m,1h),1.03-1.00(m,3h),0.81(m,6h).实施例10.1-乙基-6-氟-4-氧代-7-(4-((4-((s)-2-(1-((r)-1-(噻吩-2-基)乙基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1,4-二氢喹啉-3-羧酸实施例10使用如实施例3的操作制备,其与实施例6共用中间体。1hnmr(400mhz,dmso-d6)δ15.3(s,1h),10.13(s,1h),8.94(s,1h),8.25(d,1h),7.94-7.91(d,j=12.0hz,1h),7.8(d,1h),7.62-7.60(d,j=8.0hz,2h),7.34-7.31(d,j=8.0hz,2h),7.28-7.27(d,j=4.0hz,1h),7.20(d,1h),6.93(s,1h),6.90-6.88(m,1h),5.95(m,1h),5.40(s,1h),5.25-5.15(m,1h),5.05(s,2h),4.65-4.4(m,2h),4.5-4.4(m,1h),3.7-3.5(s,4h),3.3(s,4h),3.1-2.85(m,2h),2.44-2.42(m,4h),1.85-1.7(m,3h),1.7-1.55(m,1h),1.47-1.46(d,j=4.0hz,1h),1.46-1.3(m,5h).实施例11.1-乙基-6-氟-4-氧代-7-(4-((4-((2s)-2-(1-(戊-2-基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1,4-二氢喹啉-3-羧酸实施例11使用如实施例5的操作制备。lcms:(5-95ab,1.5min),t=0.848min,m=821.2(m+1);1hnmr(400mhz,dmso-d6)δ10.15-10.13(m,1h),8.96(s,1h),7.97-7.93(d,j=13.2hz,1h),7.81-7.74(m,1h),7.63(d,j=8.8hz,2h),7.50-7.46(m,1h),7.34(d,j=8.4hz,2h),7.21(d,j=7.2hz,1h),5.98-5.95(t,j=5.6hz,1h),5.42(s,2h),5.06(s,2h),4.60-4.57(q,j=6.8hz,2h),4.44-4.42(m,1h),3.81(m,1h),3.60(s,4h),3.49-3.36(s,4h),3.33-3.29(m,2h),3.1-2.9(m,2h),2.42-2.39(m,4h),1.73(m,4h),1.63-1.58(m,1h),1.41(m,5h),1.35-1.30(m,2h),1.04-1.02(m,3h),0.84-0.78(m,3h).实施例12.(s)-1-乙基-6-氟-7-(4-((4-(2-(1-(异丙基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.将化合物12-1(120mg,0.3mmol)、hatu(171mg,0.45mmol)、dipea(195mg,1.5mmol)在dmf(10ml)中的混合物在室温搅拌30min。然后加入化合物12-2(9mg,0.3mmol)。将反应混合物在室温搅拌3h。将混合物浓缩并经制备性tlc纯化(meoh/dcm=1/10)得到12-3(180mg,136%).步骤2.在0℃向化合物12-3(180mg,0.4mmol)、pnp碳酸盐(245mg,0.81mmol)在dmf(4ml)中的溶液中加入dipea(156mg,1.21mmol)。将混合物在室温搅拌16h。混合物(12-4)无需进一步纯化即可用于下一步。步骤3.在室温向最后一步的混合物中加入诺氟沙星(259mg,0.81mmol)。将混合物在室温搅拌1h。将残留物经制备性hplc纯化,得到实施例12(18.5mg,收率:6%,经历两步).1hnmr(400mhz,meoh-d4)δ8.88(s,1h),8.02-7.99(d,j=13.2hz,1h),7.65-7.62(d,j=8.8hz,3h),7.37-7.35(d,j=8.4hz,2h),7.19(d,j=6.4hz,1h),5.13(s,2h),4.54-4.50(m,4h),4.06-4.01(m,1h),3.73(s,4h),3.35(s,4h),3.26-3.19(m,2h),2.57-2.52(m,4h),1.94-1.90(m,2h),1.81-1.74(m,2h),1.59-1.53(m,3h),1.21-1.13(m,6h).实施例13.(s)-1-乙基-7-(4-((4-(2-(1-(乙基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.将化合物13-1(1g,2.63mmol)和hcl在二噁烷(4m,10ml)中的混合物在室温搅拌2h。将溶液浓缩得到13-2。步骤2.向化合物13-2(651mg,2.326mmol)在dme-h2o(10ml/2ml)中的溶液中加入化合物13-3(623mg,2.326mmol)和饱和nahco3(10ml)的混合物。将混合物在室温搅拌16h。将溶液浓缩并将残留物经制备性hplc纯化,得到13-4.1hnmr(400mhz,甲醇-d4)δ7.62(d,j=8.4hz,2h),7.33(d,j=8.8hz,2h),4.57-4.52(m,3h),3.29-3.10(m,4h),2.60-2.53(m,4h),2.05-1.50(m,6h),1.16(t,j=7.6hz,3h).lcms(esi):m/z434.1[m+h+].步骤3.向13-4(60mg,0.139mmol)在dcm(10ml)中的溶液中加入dipea(90mg,0.695mmol)和pnp碳酸盐(84mg,0.277mmol)。将混合物在25℃搅拌2天。将混合物浓缩并溶于dmf(5ml)中且加入诺氟沙星(88mg,0.278mmol)。将混合物在25℃搅拌1.5h。除去溶剂后,将残留物经制备性hplc纯化,得到实施例13.1hnmr(400mhz,甲醇-d4)δ8.86(s,1h),8.00(d,j=13.2hz,1h),7.63(d,j=8.4hz,2h),7.35(d,j=8.8hz,2h),7.18(d,j=6.8hz,1h),5.11(s,2h),4.57-4.48(m,3h),3.71(s,4h),3.33-3.32(m,4h),3.26-3.08(m,4h),2.60-2.47(m,4h),1.93-1.50(m,10h),1.14(t,j=7.2hz,3h).lcms(esi):m/z779.4.[m+h+].实施例14.1-乙基-6-氟-7-(4-((4-((s)-2-(1-((r)-3-甲基丁-2-基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-羧酸实施例14使用如实施例5的操作制备.1hnmr(400mhz,dmso-d6)δ10.16(s,1h),8.96(s,1h),7.97-7.93(d,j=13.2hz,1h),7.85-7.83(d,j=7.6hz,1h),7.63-7.61(d,j=8.8hz,2h),7.43-7.41(d,j=8.8hz,1h),7.35-7.33(d,j=8.8hz,2h),7.22-7.21(d,j=6.8hz,1h),6.00-5.97(m,1h),5.43(s,2h),5.07(s,2h),4.61-4.56(m,2h),4.46-4.41(m,1h),3.62(m,6h),3.41(s,2h),3.30(s,4h),3.12-2.89(m,2h),2.45-2.39(m,4h),1.76-1.62(m,4h),1.44-1.39(m,3h),1.00(d,j=6.8hz,3h),0.82(d,j=5.6hz,6h).实施例15.7-(4-((4-((s)-2-(3,3-二甲基-1-((r)-1-苯基乙基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0℃向ph3p(91.8g,350mmol)在mecn(250ml)中的搅拌溶液中逐滴加入溴(56g,350mmol)在mecn(40ml)中的溶液。然后将化合物15-1(18.2g,175mmol)加至混合物中。将反应混合物回流加热16h。除去溶剂并将残留物蒸馏得到15-2,其为浅黄色油状物(14g,35%).1hnmrcdcl3400mhz,δ3.40(s,4h),1.17(s,6h).步骤2.在0℃向nah(3.4g,60%,84.9mmol)在dmf(40ml)中的混悬液中逐滴加入化合物15-3(11.14g,69.6mmol)。将混合物在氮气下在70℃加热1h。然后加入化合物15-2(8.0g,34.8mmol)并在氮气下搅拌60h。将混合物倒入nh4cl水溶液(20g,300ml)中并用pe(50mlx5)萃取。将有机相浓缩并经色谱纯化(pe)得到化合物15-4(3.0g,收率:37.9%).1hnmrcdcl3400mhzδ4.21-4.16(m,4h),2.36(s,4h),1.26-1.22(m,6h),1.11(s,6h).步骤3.向化合物15-4(3.0g,13.9mmol)在etoh(10ml)中的搅拌溶液中在室温加入koh水溶液(85%,779mg,13.9mmol)。将反应混合物在76℃搅拌3h。将混合物浓缩并在etoac(75ml)和h2o(125ml)之间分配。将水相用1nhcl酸化直到ph=3并用etoac(75mlx2)萃取。将有机层浓缩得到化合物15-5(1.9g,68.3%),其为油状物。1hnmrcdcl3400mhz,δ11.62(s,1h),4.26-4.21(m,2h),2.42(s,4h),1.29-1.26(m,3h),1.15-1.13(d,j=7.2hz,6h).步骤4.在室温向化合物15-5(500mg,0.5mmol)在dcm(8ml)中的搅拌溶液中加入hatu(285.0mg,0.75mmol)和dipea(193.5mg,1.5mmol)。在将反应混合物在室温搅拌30min后,加入15-6(90.9mg,0.75mmol)并在室温搅拌16h。将混合物浓缩并经色谱纯化(dcm:meoh=90:10)得到化合物15-7,其为白色固体(70mg,46.2%)lcms:(5-95,ab,1.5min,esi),0.807min,ms=303.9[m+1]1hnmrcdcl3400mhz,δ7.34-7.22(m,5h),6.19(d,j=7.2hz,1h),5.14-5.06(m,1h),4.22-4.16(m,2h),2.46-2.31(m,4h),1.46(d,j=6.8hz,3h),1.25-1.21(m,3h),1.09(s,6h).步骤5.在室温向化合物15-7(70mg,0.23mmol)在meoh/thf/h2o(1ml/2ml/2ml)中的搅拌溶液中加入lioh·h2o(19.4mg,0.462mmol)。将反应混合物在室温搅拌1h。除去有机溶剂并在etoac(30ml)和h2o(25ml)之间分配。将水相用1nhcl酸化为ph=3并用etoac(30ml)萃取。将有机相浓缩得到化合物15-8,其为白色固体(50mg,78.7%)。1hnmrcdcl3400mhz,δ7.34-7.23(m,5h),6.30(d,j=7.2hz,1h),5.14-5.07(m,1h),2.50-2.31(m,4h),1.48(d,j=6.8hz,3h),1.11(d,j=16hz,6h).步骤6.在室温向化合物15-8(50mg,0.18mmol)在dcm(10ml)中的搅拌溶液中加入hatu(102.6mg,0.27mmol)和dipea(46.44mg,0.36mmol)并搅拌30min。将化合物15-9(53mg,0.19mmol)加至反应混合物并在室温搅拌16h。将混合物浓缩并经色谱纯化(dcm:meoh=85:15)得到化合物15-10(60mg,61.8%),其为白色固体。lcms:(5-95,ab,1.5min,esi),0.803min,ms=538.2[m+1]1hnmr甲醇-d4400mhz,δ8.19(d,j=8hz,1h),7.58(d,j=8.4hz,2h),7.31-7.17(m,7h),5.07-5.00(m,1h),4.56(s,2h),4.51-4.47(m,1h),3.21-3.17(m,1h),2.45-2.35(m,4h),1.89-1.85(m,1h),1.75-1.72(m,1h),1.55-1.47(m,5h),1.08(d,j=2hz,6h).步骤7.在室温向化合物15-10(60mg,0.11mmol)在无水dmf(3ml)中的搅拌溶液中加入pnp碳酸盐(15-11)(66.9mg,0.22mmol)和dipea(70.9mg,0.55mmol)并在室温搅拌3h。混合物(15-12)无需进一步纯化即可用于下一步。步骤8.在室温向最后一步的反应混合物中加入诺氟沙星(70.2mg,0.22mmol)。将混合物在室温搅拌16h并经制备性hplc纯化,得到实施例15(14.4mg,收率:14.8%).lcms:(5-95,ab,1.5min,esi),0.887min,ms=883.4.4[m+1],442.4[1/2m+1]1hnmrdmso-d6400mhz,δ10.24(s,1h),8.94(s,1h),8.39(s,1h),8.13(d,j=2hz,1h),7.965-7.963(m,2h),7.63(d,j=8.4hz,2h),7.47(d,j=8.8hz,2h),7.30-7.26(m,4h),7.19-7.18(m,2h),6.05(s,1h),5.46(s,2h),5.07(s,2h),4.97-4.91(m,1h),4.57(s,2h),4.45(s,1h),3.62(s,4h),3.35(s,4h),3.05-3.02(m,1h),2.96-2.92(m,1h),2.32-2.26(m,4h),1.73-1.71(m,1h),1.63-1.61(m,1h),1.42-1.37(m,8h),0.99(s,6h).实施例16.(s)-1-乙基-7-(4-((4-(2-(1-(乙基氨基甲酰基)环戊烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在室温向化合物16-1(10g,62.4mmol)在dmf(50ml)中的溶液中加入1,4-二溴丁烷(14.8g,68.6mmol)、k2co3(21.5g,155.8mmol)和化合物16-2(1.4g,6.2mmol)并在室温搅拌16h。减压除去溶剂,并将残留物在etoac(200ml)和h2o(80ml)之间分配,将合并的有机相干燥并浓缩得到化合物16-3,其为油状物(10.0g,收率:75%).1hnmr(400mhz,cdcl3)δ4.15-4.10(m,4h),2.14-2.10(m,4h),1.64-1.61(m,4h),1.20-1.17(m,6h).步骤2.在室温向化合物16-3(6.0g,28.0mmol)在etoh(20ml)中的溶液中加入85%koh水溶液(1.85g,28.0mmol)并在76℃搅拌3h。除去溶剂并将残留物在etoac(20ml)和h2o(30ml)之间分配。将水相用1nhcl酸化为ph=3并用etoac(20ml×2)萃取。将有机层干燥并浓缩得到化合物16-4,其为油状物(2.5g,收率:48.0%).1hnmr(400mhz,cdcl3)δ10.61-10.60(m,1h),4.21-4.15(m,2h),2.21-2.18(m,4h),1.72-1.65(m,4h),1.26-1.22(m,3h).步骤3.在0℃向化合物16-4(2.5g,13.4mmol)和化合物16-5(1.62g,14.1mmol)在无水thf(20ml)中的溶液中加入dcc(3.04g,14.74mmol)。将混合物在氮气下在室温搅拌16h。将混合物滤过并将滤液浓缩得到粗化合物16-6,其无需进一步纯化即可用于下一步。1hnmr(400mhz,meoh-d4)δ4.23-4.18(m,2h),2.79(s,4h),2.36-2.23(m,4h),1.76-1.72(m,4h),1.30-1.28(t,j=7.2hz,3h).步骤4.在室温向化合物16-6(1.0g,3.53mmol)在dmf(15ml)中的溶液中加入化合物16-7(658.7mg,2.35mmol)。将反应混合物在室温搅拌16h。将混合物浓缩并经硅胶柱色谱纯化(dcm:meoh=10:1)得到化合物16-8,其为白色固体(150mg,收率:14.2%).lcms(esi):m/z449.0[m+1].步骤5.在室温向化合物16-8(150mg,0.33mmol)在thf/meoh/h2o(3ml/3ml/1.5ml)中的溶液中加入lioh·h2o(28.14mg,0.67mmol)。将反应混合物在室温搅拌16h。将混合物浓缩并在etoac(15ml)和h2o(20ml)之间分配。将水相用1nhcl酸化为ph=3,用etoac(15ml×3)萃取并浓缩得到粗化合物16-9,其为白色固体,其无需进一步纯化即可用于下一步。lcms(esi):m/z420.9[m+1].步骤6.在室温向化合物16-9(250mg,0.595mmol)在dmf(15ml)中的溶液中加入hatu(339.2mg,0.89mmol)和dipea(268.6mg,2.08mmol)并搅拌30min。将乙胺盐酸盐(96.98mg,1.19mmol)加至反应混合物并在室温搅拌16h。将混合物滤过并经制备性hplc和sfc纯化,得到化合物16-10,其为白色固体(30mg,收率:11.3%).lcms(esi):m/z447.9[m+1].1hnmr(400mhz,dmso-d6)δ9.99(s,1h),7.75-7.73(m,2h),7.57-7.55(m,2h),7.23-7.21(m,2h),5.97-5.94(m,1h),5.39(s,2h),5.11-5.08(m,1h),4.41-4.36(m,2h),4.35-4.32(s,1h),3.13-3.06(m,2h),2.97-2.90(m,2h),2.16-2.14(m,2h),2.11-2.05(m,1h),1.95-1.93(m,1h),1.92-1.91(m,1h),1.51-1.49(m,4h),1.39-1.37(m,1h),1.20-1.19(m,2h),1.02-0.98(t,j=7.2hz,3h).步骤7.在0℃向化合物16-10(30mg,0.067mmol)在无水dmf(3ml)中的溶液中加入化合物16-11(40.7mg,0.134mmol)和dipea(43.22mg,0.335mmol)。在将混合物在室温搅拌5h后,其无需进一步纯化即可直接用于下一步。步骤8.在室温向来自最后一步的混合物中(16-12)加入化合物16-13(42.8mg,0.134mmol)。将混合物在室温搅拌1h,然后经制备性hplc纯化,得到预期产物实施例16.(35.0mg收率:66.0%)1hnmr(400mhz,dmso-d6)δ15.32(s,1h),10.09(s,1h),8.95(s,1h),7.93(d,j=13.2hz,1h),7.80-7.71(m,2h),7.62(d,j=8.4hz,2h),7.32(d,j=8.4hz,2h),7.18(d,j=8.0hz,1h),5.98-5.91(m,1h),5.39(s,2h),5.04(s,2h),4.60-4.52(m,2h),4.38-4.32(m,1h),3.59(s,4h),3.30(s,4h),3.12-3.08(m,2h),2.96-2.85(m,2h),2.14-2.11(m,2h),2.10-2.00(m,1h),1.94-1.89(m,1h),1.63-1.40(m,5h),1.38-1.30(m,5h),1.02-0.98(t,j=7.2hz,3h).实施例17.7-(4-((4-((s)-2-(1-((s)-3-(烯丙基氧基)-3-氧代-1-(噻吩-3-基)丙基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸实施例17使用如实施例7的操作制备,其使用来自合成实施例7的中间体。实施例18.(s)-1-乙基-7-(4-((4-(2-(1-(乙基氨基甲酰基)环己烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.在室温向化合物18-1(4.0g,17.5mmol)在etoh(20ml)中的溶液中加入85%koh水溶液(1.15g,17.5mmol)。在将反应混合物在76℃搅拌3h后,将其浓缩并在etoac(15ml)和h2o(25ml)之间分配。将水相用1nhcl酸化为ph=3并用etoac(15ml×2)萃取。将有机层浓缩得到化合物18-2,其为油状物(2.5g,收率:71.4%).1hnmr(400mhz,cdcl3)δ4.20-4.15(m,2h),2.03-1.90(m,4h),1.56-1.47(m,6h),1.45-1.43(t,4.0hz,3h).步骤2.在0℃向化合物18-2(2.5g,12.5mmol)和18-3(1.51g,13.13mmol)在无水thf(20ml)中的溶液中加入dcc(2.83g,13.35mmol)。将混合物在氮气下在室温搅拌16h。将混合物滤过并将滤液浓缩得到粗化合物18-4,其无需进一步纯化即可用于下一步(2.0g,收率:53.8%).步骤3.在室温向化合物18-4(2.0g,6.7mmol)在dmf(15ml)中的搅拌溶液中加入化合物18-5(1.26g,4.5mmol)。将反应混合物在室温搅拌16h。将混合物浓缩并经柱色谱纯化(dcm:meoh=10:1)得到化合物18-6,其为白色固体(700mg,收率:22.4%).lcms(esi):m/z463.0[m+1].步骤4.在室温向化合物18-6(700mg,1.50mmol)在thf/meoh/h2o(4ml/4ml/2ml)中的溶液中加入lioh·h2o(126.0mg,3.0mmol)。在将反应混合物在室温搅拌16h后,将其浓缩并在etoac(25ml)和h2o(30ml)之间分配,将水相用1nhcl酸化为ph=3,用etoac(25ml×2)萃取并浓缩得到粗化合物18-7,其为白色固体,其无需进一步纯化即可用于下一步。lcms(esi):m/z435.0[m+1].步骤5.在室温向化合物18-7(300mg,0.69mmol)在dmf(15ml)中的溶液中加入hatu(395.2mg,1.04mmol)和dipea(267.03mg,2.07mmol)并在室温搅拌30min。将乙胺(112.47mg,1.38mmol)加至反应混合物并在室温搅拌16h。将混合物滤过并经制备性hplc和sfc纯化,得到化合物18-8(60mg,收率:18.8%),其为白色固体。lcms(esi):m/z462.0[m+1].1hnmr(400mhz,meoh–d4)δ7.62(d,j=8.4hz,2h),7.28(d,j=8.8hz,2h),4.58(s,1h),4.54-4.50(m,3h),3.62-3.57(m,1h),3.26-3.18(s,2h),3.10-3.07(m,2h),2.16-2.02(m,2h),1.85-1.81(m,3h),1.73-1.71(m,1h),1.59-1.50(m,5h),1.18-1.14(m,1h),1.12-1.09(m,3h).步骤6.在0℃向化合物18-8(100mg,0.216mmol)在无水dmf(3ml)中的搅拌溶液中加入化合物18-9(131.3mg,0.432mmol)和dipea(139.3mg,1.08mmol)。将混合物(18-10)在室温搅拌3h并无需进一步纯化即可用于下一步。步骤7.在室温向来自最后一步的混合物(18-10)中加入诺氟沙星(18-11)(137.9mg,0.432mmol)并在室温搅拌1h。将混合物经制备性hplc纯化,得到实施例18(98.0mg收率:56.2%).1hnmr(400mhz,dmso-d6)δ15.30(s,1h),10.09(s,1h),8.93(s,1h),7.92(d,j=13.2hz,1h),7.78-7.72(m,1h),7.67(d,j=7.6hz,1h),7.63(d,j=8.8hz,2h),7.32(d,j=8.8hz,2h),7.18(d,j=8.0hz,1h),5.98-5.92(m,1h),5.38(s,2h),5.04(s,2h),4.57-4.55(m,2h),4.39-4.31(m,1h),3.59(s,4h),3.31(s,4h),3.31-3.08(m,2h),3.00-2.86(m,2h),2.12-2.03(m,1h),2.01-1.91(m,1h),1.90-1.83(m,3h),1.58-1.67(m,1h),1.40-1.25(m,11h),1.01-0.97(t,j=7.2hz,3h).实施例19.7-(4-((4-((s)-2-(2,2-二甲基-3-氧代-3-((r)-1-苯基乙基氨基)丙酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0℃向化合物19-1(5.0g,31.22mmol)在无水thf(70ml)中的溶液中缓慢加入nah(3.75g,93.65mmol,c=60%)。在将混合物在0℃搅拌10m后,在0℃逐滴加入mei(6.15ml,124.88mmol),并将反应混合物在0℃搅拌2h。将混合物用etoac(50ml)稀释,滤过,将滤液减压浓缩。将残留物用etoac(50ml)稀释,滤过,并将滤液浓缩得到化合物19-2(3.5g,59.6%),其为油状物。1hnmr(400mhz,dmso-d6)δ4.13-4.08(q,4h),1.33(s,6h),1.16(t,j=6.8hz,6h).步骤2.向化合物19-2(3.0g,15.94mmol)在etoh(20ml)中的溶液中加入koh水溶液(85%,894mg,15.94mmol)。将反应混合物回流加热1h。在减压除去有机溶剂后,将其用h2o(20ml)稀释,并用pe(10ml×2)洗涤。将水相用浓hcl溶液调节至ph2并用etoac(20ml×3)萃取。将合并的etoac层经na2so4干燥,滤过,并减压浓缩得到化合物19-3(1.5g,58.8%).1hnmr(400mhz,dmso-d6)δ3.98-3.93(q,4h),1.17(s,6h),1.12(t,j=7.2hz,3h).步骤3.向化合物19-3(1.0g,6.24mmol)在无水dcm(20ml)中的混合物中加入dipea(1.61g,12.48mmol),随后加入hatu(2.85g,7.49mmol)。在将混合物在室温搅拌15min后,并加入化合物19-4(908mg,7.49mmol)。将反应混合物在室温搅拌3h,并用柠檬酸溶液(10ml×3)、盐水(10ml×1)洗涤,经na2so4干燥,滤过,并减压浓缩。将残留物经柱色谱纯化(pe/etoac=5:1)得到化合物19-5,其为白色固体(1.30g,79.3%).1hnmr(400mhz,dmso-d6)δ8.00(d,j=8.0hz,1h),7.31-7.28(m,4h),7.22-7.18(m,1h),4.97-4.90(m,1h),4.12-4.01(m,2h),1.36(d,j=6.8hz,3h),1.33(d,j=2.4hz,6h),1.14(d,j=6.8hz,3h).步骤4.向化合物19-5(1.5g,5.70mmol)在meoh/h2o混合物(15ml/5ml)中的溶液中加入lioh·h2o(478mg,11.40mmol)。将反应混合物回流加热2h。减压除去有机溶剂,并将水浆液用dcm(5ml×3)洗涤。将其用浓hcl溶液调节至ph1并用etoac(10ml×3)萃取。将合并的etoac层经na2so4干燥,滤过,并减压浓缩得到化合物19-6,其为白色固体(800mg,59.7%).1hnmr(400mhz,dmso-d6)δ12.45(br,1h),7.95(d,j=8.0hz,1h),7.32-7.27(m,4h),7.23-7.17(m,1h),4.97-4.90(m,1h),1.36(d,j=6.8hz,3h),1.31(d,j=3.6hz,6h).步骤5.向化合物19-6(167mg,0.71mmol)在dmf(5ml)中的溶液中加入dipea(183mg,1.42mmol),随后加入hatu(323mg,0.85mmol)。将混合物在室温搅拌10min,并加入化合物19-7(200mg,0.71mmol)。在将反应混合物在室温搅拌2h后,将其经制备性hplc纯化,得到化合物19-8,其为白色固体(80mg,22.7%).1hnmr(400mhz,dmso-d6)δ10.05(s,1h),8.11(d,j=8.0hz,1h),7.88(d,j=7.6hz,1h),7.57-7.54(m,2h),7.32-7.25(m,4h),7.22-7.15(m,3h),5.95(t,j=5.6hz,1h),5.39(s,2h),5.08(br,1h),4.98-4.94(m,1h),4.41(s,2h),4.36-4.31(m,1h),3.00-2.89(m,2h),1.78-1.75(m,1h),1.63-1.59(m,1h),1.40-1.33(m,8h),1.30(s,3h).步骤6.向化合物19-8(80mg,0.16mmol)在无水dmf(4ml)中的溶液中加入dipea(103mg,0.80mmol),随后加入pnp碳酸盐(97mg,0.32mmol)。在将其在室温在氮气下搅拌2h后,加入诺氟沙星(102mg,0.32mmol)。将混合物在室温搅拌另外的1h,滤过,并将滤液经制备性hplc纯化,得到实施例19,其为白色固体(81mg,60.0%).lcms(esi):rt=0.854min,m/2+h+=422.2.方法=5-95/1.5min.1hnmr(400mhz,dmso-d6)δ15.30(br,1h),10.16(s,1h),8.95(s,1h),8.11(d,j=8.0hz,1h),7.95-7.91(m,2h),7.64(d,j=8.8hz,2h),7.35-7.27(m,6h),7.21-7.17(m,2h),5.97(t,j=5.6hz,1h),5.42(s,2h),5.07(s,2h),5.00-4.97(m,1h),4.58-4.55(m,2h),4.39-4.33(m,1h),3.61(s,4h),3.31(s,4h),3.02-2.92(m,2h),1.80-1.78(m,1h),1.64-1.62(m,1h),1.42-1.33(m,14h).实施例20.(s)-7-(4-((4-(6-氨基-2-(1-(乙基氨基甲酰基)环丁烷甲酰氨基)己酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在室温向化合物20-1(5g,10.7mmol)在dcm中的搅拌溶液中加入化合物20-2(5.5ml,53mmol)。将混合物在室温搅拌16h。将反应混合物用h2o萃取并将合并的水层浓缩得到20-3.(收率:95%)步骤2.向化合物20-4(1.5g,5.6mmol)在dme(50ml)中的溶液中加入化合物20-3(2.75g,11.2mmol)和nahco3(940mg,11.2mmol)在水(50ml)中的溶液。将混合物在室温搅拌16h。将混合物用etoac洗涤并用10%hcl酸化至ph3。将所得的混悬液用etoac萃取。将合并的有机层浓缩得到化合物20-5.(收率:80%)lcms(esi):m/z400.0[m+h+].步骤3.向化合物20-5(1g,2.5mmol)在dcm和meoh混合物(20ml,10ml)中的溶液中加入4-氨基-苯基)甲醇(20-6)(462mg,3.75mmol)和eedq(1.236g,5mmol)。将混合物在室温搅拌16h。将残留物经柱色谱纯化(pe/etoac=1/3)得到20-7(收率:60%).lcms(esi):m/z505.1[m+h+].步骤4.在0℃向化合物20-7(180mg,0.36mmol)在dmf(6ml)中的溶液中加入化合物20-8(219mg,0.72mmol)和dipea(140mg,1.08mmol)。将混合物在室温搅拌16h。混合物(20-9)无需进一步纯化即可用于下一步。(收率:100%)lcms(esi):m/z670.6[m+h+].步骤5.在室温向粗的20-9混合物中加入诺氟沙星(230mg,0.72mmol)并在室温搅拌1h。将残留物经制备性hplc纯化,得到化合物20-11.(收率:60%)lcms(esi):m/z850.5[m+h+].步骤6.在0℃向化合物20-11中加入tfa和dcm溶液(1:1)。将混合物在室温搅拌1h。将混合物用nh3.h2o碱化为ph=9。将残留物经制备性hplc和sfc纯化,得到实施例20(收率:30%).1hnmr(400mhz,dmso-d6)δ10.26(s,1h),9.43(hcooh),8.97(d,j=7.6hz,1h),7.99-7.89(m,6h),7.67-7.65(m,2h),7.39-7.33(m,2h),7.23-7.21(m,1h),5.06(s,2h),4.72-4.60(m,2h),4.40(s,1h),3.80-3.55(m,6h),3.31(s,4h),3.15-3.12(m,2h),2.76-2.73(m,2h),2.48-2.41(m,2h),1.81-1.69(m,4h),1.59-1.55(m,2h),1.43-1.34(m,5h),1.07-0.98(m,3h).实施例21.(s)-7-(4-((4-(5-氨基-2-(1-(乙基氨基甲酰基)环丁烷甲酰氨基)戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向21-1(10.0g,0.06mol)在h2o(300ml)中的溶液中加入cu2(oh)2co3(24.0g,0.12mol)。在将混合物在100℃搅拌1h后,将其快速滤过。将na2co3(20.0g,0.18mol)加至滤液中。在将其在室温搅拌20min后,在室温逐滴加入alloccl(12.0g,0.10mol)并在室温搅拌3h。将混合物滤过并用h2o洗涤,然后加入硫代乙酰胺(7.5g,0.10mol)。在将其在50℃搅拌3h后,加入hcl(aq)调节ph=3-4。将混合物回流加热1h。在将热混合物滤过后,将滤液浓缩直到白色固体沉淀析出。将其冷却至室温并滤过得到21-2,其为白色固体(4.5g,35%)步骤2.向21-2(1.0g,4.6mmol)在thf(30ml)中的溶液中加入dipea(1.9g,15.0mmol)和化合物21-3(1.2g,4.6mmol)。在将其在100℃搅拌4h后,将混合物冷却至室温,加入水(100ml),随后加入hcl(aq)调节ph=2-3。将混合物用etoac(50ml×2)萃取。将有机层用盐水(50ml)洗涤,经na2so4干燥并浓缩得到粗的21-4,其为棕色固体(1.3g,粗的).步骤3.向21-4(1.2g,3.2mmol)在dcm(50ml)中的溶液中加入eedq(1.1g,4.5mmol)和(4-氨基苯基)甲醇(750mg,6.0mmol)。在将混合物在室温搅拌4h后,加入水(50ml)。将混合物用dcm(60ml×2)萃取,经na2so4干燥,浓缩,并经柱色谱纯化(pe:etoac=1:20)得到21-5,其为黄色油状物(500mg,30%).步骤4.向21-5(500mg,1.05mmol)在dcm(30ml)中的溶液中加入dipea(650mg,5.0mmol)和pnp碳酸盐(320mg,1.5mmol)。将混合物回流加热16h。除去溶剂,并将残留物溶于dmf(20ml)。加入dipea(400mg,3.0mol)和诺氟沙星(380mg,1.2mmol)。将混合物在100℃搅拌5h,然后冷却至室温,加入饱和nacl(100ml)并滤过得到粗产物,其为黄色固体(300mg,ms=820.2,m+1).向上述粗产物(300mg)在thf(30ml)中的溶液中加入pd(pph3)4(80mg,0.07mmol)和1,3-二甲基嘧啶-2,4,6(1h,3h,5h)-三酮(1.0g,6.4mmol)。将混合物在50℃在氮气下搅拌16h并冷却至室温将混合物滤过,浓缩并经制备性hplc纯化,得到实施例21(24mg,8%).1hnmr(400mhz,dmso-d6)δ10,37(s,1h),8.94(s,1h),7.94-7.89(m,6h),7.65-7.63(d,j=8.4hz,2h),7.37-7.31(m,2h),7.19(d,j=7.6hz,1h),5.04(s,2h),4.63-4.54(m,2h),4.47-4.41(m,1h),3.68-3.53(m,6h),3.29(s,4h),3.14-3.08(m,2h),2.80-2.77(m,2h),2.48-2.42(m,2h),1.88-1.63(m,6h),1.48(t,j=6.8hz,3h),1.05-0.95(t,j=7.2hz,3h).实施例22.7-(4-((4-(2-(3-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)异噁唑-5-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0℃向化合物22-1(50.0g,0.43mol)和na2co3(90.0g,0.85mol)在thf和h2o(300ml/300ml)中的混悬液中缓慢加入cbzcl(84.0g,0.49mol)。将反应混合物温热至室温并在室温搅拌16h。除去有机溶剂并将水溶液用etoac(200ml)萃取。将水溶液用1mhcl酸化至ph=2,然后用etoac(200ml×2)萃取。将合并的有机层用盐水(150ml)洗涤,经无水na2so4干燥,滤过并浓缩得到粗的22-2,其为白色固体,其无需进一步纯化即可用于下一步。步骤2.向化合物22-2(20g,79.6mmol)在无水dcm(200ml)中的溶液中加入hatu(35g,92.1mmol)和dipea(28g,217mmol)。在将其在室温搅拌15min后,加入n-甲氧基甲胺盐酸盐(11g,112.8mmol)。在将溶液搅拌3h后,将其用1mhcl、饱和nahco3和盐水洗涤。将有机层经na2so4干燥,滤过,浓缩并经硅胶柱色谱纯化,得到化合物22-3(12g,51.2%)。步骤3.在-78℃在氮气下将dibal-h(30ml,1m在甲苯中)逐滴加至化合物22-3(4g,13.6mmol)在无水dcm(150ml)中的溶液中。在将溶液在-78℃搅拌6h后,将其用meoh(100ml)和水(10ml)淬灭。将混悬液滤出并将滤液经na2so4干燥。除去溶剂并将残留物经硅胶柱色谱纯化,得到化合物22-4,其为无色油状物(1.1g,34.4%).1hnmr(400mhz,cdcl3)δ9.65(s,1h),7.37-7.32(m,5h),5.35-5.33(m,1h),5.12(s,2h),4.38-4.32(m,1h),2.36-2.28(m,1h),1.05-1.03(d,j=7.2hz,3h),0.95(d,j=6.8hz,3h).步骤4.向化合物22-4(110mg,0.47mmol)在etoh(10ml)中的溶液中加入乙酸钠(57.5mg,0.7mmol)和羟胺盐酸盐(49mg,0.7mmol)。在将反应混合物在80℃搅拌16h后,除去溶剂并将残留物溶于水并用etoac(30ml×2)萃取。将合并的有机层用盐水(30ml)洗涤,经无水硫酸钠干燥,滤过并浓缩得到化合物22-5,其为白色固体其无需进一步纯化即可用于下一步。1hnmr(400mhz,dmso-d6)δ10.97(s,0.6h),10.73(s,0.3h),7.49-7.45(m,1h),7.39-7.29(m,5h),7.18(d,j=7.2hz,0.3h),6.54(d,j=6.8hz,0.6h),5.02(s,2h),4.63-4.58(m,0.6h),3.88-3.82(m,0.3h),1.89-1.78(m,1h),0.84(q,j=6.8hz,6h).lcms(esi):m/z251.0[m+h+].步骤5.向化合物22-5(800mg,3.2mmol)在dmf(5ml)中的溶液中加入ncs(470mg,3.5mmol)。在将混合物在40℃搅拌1h后,将其用etoac(50ml)和水(20ml)稀释。分离有机层并用盐水(30ml×5)洗涤,经na2so4干燥,滤过并浓缩得到化合物22-6,其直接用于下一步。步骤6.在0℃向化合物22-7(168mg,2.4mmol)在dcm(10ml)中的搅拌溶液中加入tea(240mg,2.4mmol)。在将其搅拌30min后,缓慢加入化合物22-6(1.2mmol)在dcm(10ml)中的溶液。将反应混合物温热至室温并在室温搅拌16h。将水加至反应混合物并分离各层并将水层用dcm(20ml×3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,滤过并浓缩。将残留物经硅胶柱色谱纯化,得到化合物22-8,其为淡黄色固体(150mg,39.3%).1hnmr(400mhz,cdcl3)δ7.34-7.31(m,5h),6.09(s,1h),5.41(d,j=8.0hz,1h),5.14-5.06(m,2h),4.96(d,j=6.4hz,1h),4.78-4.74(q,j=9.2hz,1h),2.17-2.08(m,1h),1.55(d,j=6.8hz,3h),1.03(d,j=6.8hz,3h),0.96-0.91(t,j=9.6hz,6h).步骤7.在0℃向化合物22-8(1g,3.14mmol)在无水dcm(50ml)中的溶液中加入mscl(5g,43.9mmol)。将反应混合物温热至室温并在室温搅拌3h。将水加至反应混合物并分离各层并将水层用dcm(50ml×3)萃取。将合并的有机层用盐水(50ml)洗涤,经无水硫酸钠干燥,滤过并浓缩。将粗产物经硅胶柱色谱纯化,得到化合物22-9,其为无色油状物(1.2g,96.4%).1hnmr(400mhz,cdcl3)δ7.36-7.33(m,5h),6.26(s,1h),5.82-5.77(q,j=13.6hz,1h),5.32-5.31(d,j=8.8hz,1h),5.14-5.08(m,2h),4.80-4.77(m,1h),3.00(s,3h),2.20-2.12(m,1h),1.79-1.77(d,j=6.8hz,3h),0.97-0.93(q,j=10hz,6h).步骤8.将含有csf(690mg,4.54mmol)的烧瓶用氮气净化,加入tmscn(750mg,7.57mmol)和无水dmf(2.5ml)。将混合物在室温搅拌15min且形成淡黄色混悬液。加入化合物22-9(600mg,1.51mmol)在无水dmf(2ml)中的溶液。在将混合物在50℃在氮气下搅拌16h后,加入水(50ml)和etoac(50ml)并分离各层。将水层用etac(50ml×2)萃取。将合并的有机层用nahco3水溶液、盐水洗涤并经na2so4干燥。除去溶剂,并将残留物经制备性hplc纯化,得到化合物22-10(60mg,12.1%)。1hnmr(400mhz,cdcl3)δ7.37-7.33(m,5h),6.22(s,1h),5.28-5.26(m,1h),5.15-5.08(m,2h),4.80-4.76(m,1h),4.12-4.06(m,j=14.8hz,1h),2.19-2.14(m,1h),1.74-1.70(d,j=7.2hz,3h),0.98-0.93(m,6h).lcms(esi):m/z327.9[m+h+].步骤9.向化合物22-10(500mg,1.5mmol)在etoh(10ml)中的搅拌溶液中加入naoh水溶液(4m,5ml)。在将反应混合物在50℃搅拌2h后,除去有机溶剂并将水层用h2o(20ml)和etoac(30ml)稀释。分离各层并将水层用1mhcl酸化至ph=2。将其用etoac(30ml×2)萃取。将合并的有机层用盐水洗涤,干燥并浓缩得到粗化合物22-11其无需进一步纯化即可用于下一步。步骤10.在0℃在氮气下将eedq(300mg,1.22mmol)加至化合物22-11(220mg,0.61mmol)和(4-氨基苯基)甲醇(155mg,1.22mmol)在无水dcm(10ml)中的溶液中。将反应混合物温热至室温并在室温在氮气下搅拌1h。除去溶剂并将残留物经制备性hplc和sfc分离纯化,得到22-12和22-13.1hnmr(400mhz,meod-d4)δ7.49-7.47(d,j=8.4hz,2h),7.27-7.23(m,7h),6.23(s,1h),5.05-4.97(m,2h),4.48(s,3h),4.00-3.94(q,j=14.0hz,1h),2.04-1.95(m,1h),1.521.51(d,j=7.2hz,3h),0.91-0.90(d,j=6.8hz,3h),0.82-0.80(d,j=6.8hz,3h).lcms(esi):m/z473.9[m+na+],497.0[m+2na+].1hnmr(400mhz,meod)δ7.54-7.52(d,j=8.4hz,2h),7.31-7.29(m,7h),6.29(s,1h),5.05(s,2h),4.55(s,3h),4.05-4.00(m,1h),2.10-2.00(m,1h),1.58-1.56(d,j=7.2hz,3h),0.97-0.96(d,j=6.8hz,3h),0.87-0.85(d,j=6.8hz,3h).lcms(esi):m/z473.8[m+na+],496.9[m+2na+].步骤11.向22-12或22-13(30mg,0.066mmol)在无水dcm(5ml)中的溶液中加入pnp碳酸盐(40.4mg,0.13mmol)和dipea(0.5ml)。将混合物回流加热20h。除去溶剂后,将残留物溶于dmf(3ml)。加入dipea(0.5ml)和诺氟沙星(63.5mg,0.2mmol)。在将混合物在室温搅拌2h后,除去溶剂,并将残留物经制备性hplc纯化,得到实施例22.1hnmr(400mhz,dmso-d6)δ15.32(s,1h),10.37(s,1h),8.97(s,1h),7.97-7.94(d,j=13.2hz,1h),7.83-7.81(d,j=10.8hz,1h),7.62-7.60(d,j=8.4hz,2h),7.37-7.21(m,8h),6.34(s,1h),5.07-5.01(m,4h),4.60-4.56(m,2h),4.47-4.43(m,1h),4.08-4.03(m,1h),3.61(s,4h),3.33(s,4h),1.97-1.92(m,1h),1.49-1.47(d,j=7.2hz,3h),1.43-1.39(t,j=7.2hz,3h),0.91-0.90(d,j=4.8hz,3h),0.77-0.76(d,j=6.8hz,3h).lcms(esi):m/z797.0[m+h+].实施例23.7-(4-((4-((s)-2-((r)-3-(苄基氧基羰基氨基)-3-甲基-2-氧代吡咯烷-1-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向l-丙氨酸23-1(18g,0.2mol)在水(100ml)中的溶液中加入碳酸钠(32g,0.30mol)。溶液变为澄清并冷却至0℃。1h内加入cbzcl(40g,235mmol)在thf(200ml)中的溶液,保持温度低于5℃。在将其在室温搅拌另外的3h后,将溶液用etoac洗涤。然后将水溶液酸化并用etoac(300mlx3)萃取。将有机层经na2so4干燥并浓缩得到化合物23-2。步骤2.在0℃将亚硫酰氯(3.27ml,44.8mmol)加至cbz-l-丙氨酸23-2(10.0g,44.8mmol)和苯甲醛二甲基乙缩醛(6.73mml,44.8mmol)在无水thf中的搅拌混合物中。在将其搅拌30min后,加入无水zncl2(6.11g,44.8mmol)。将混合物在0℃搅拌3h,然后加入另外的0.2当量的zncl2/socl2。然后将混合物用水淬灭(低于10℃)并用mtbe(150mlx3)萃取。将有机层经na2so4干燥并经硅胶柱色谱纯化,得到化合物23-4.1hnmr(400mhz,cdcl3)δ7.41-7.39(m,10h),6.65(s,1h),5.18-5.16(m,2h),4.47-4.52(m,1h),1.63-1.57(m,3h).步骤3.在-78℃在1h内向化合物23-4(15.0g,48.2mmol)在无水thf(80ml)中的溶液中逐滴加入lihmds(1m,63ml)并将溶液在-78℃搅拌20min。然后缓慢加入烯丙基碘(6.3ml,68.9mmol)并将反应混合物在-78℃搅拌3h。将混合物温热至室温并搅拌另外的12h。将混合物用乙醚稀释并用aq.nh4cl(100ml)淬灭。将混合物用乙醚(150mlx3)萃取。将有机层经na2so4干燥并经硅胶柱色谱纯化,得到化合物23-5(15g,88%).1hnmr(400mhz,cdcl3)δ7.34-7.14(m,9h),6.82-6.81(m,1h),6.28-6.21(m,2h),5.62-5.56(m,1h),5.23-5.08(m,2h),5.01-4.84(m,2h),3.36-3.19(m,1h),2.50-2.45(m,1h),1.65(s,2h),1.62-1.60(m,1h).步骤4.在-78℃使臭氧鼓泡通过化合物23-5(7.8g,22.2mmol)在dcm中的溶液中,直到溶液变为蓝色。使氮气鼓泡通过溶液直到其变为无色,然后加入me2s(33ml)并在-78℃搅拌1h。在将其温热至室温后,蒸发溶剂得到化合物23-6.1hnmr(400mhz,cdcl3)δ9.66(s,1h),7.42-7.16(m,9h),6.80-6.78(m,2h),6.57(s,1h),4.99-4.96(m,1h),4.86-4.83(m,1h),4.13-4.02(m,1h),3.10-3.05(m,1h),1.76(s,3h).步骤5.向化合物23-6(1.0g,2.83mmol)在meoh(20ml)中的溶液中加入化合物23-7(438mg,4.24mmol)、nacnbh3(263mg,4.24mmol)和naoac(100mg)。加入乙酸以调节ph为6.0。将反应混合物在室温在氮气下搅拌24h。除去溶剂后,将残留物用dcm(50mlx2)萃取,用10%hcl和水(30ml)洗涤。将有机层经na2so4干燥,浓缩并用柱色谱纯化,得到化合物23-8.1hnmr(400mhz,cdcl3)δ7.37-7.29(m,5h),5.35(s,1h),5.11-5.03(m,2h),4.89-4.88(m,1h),3.71(s,3h),3.41-3.35(m,2h),2.45-2.43(m,1h),2.32-2.31(m,1h),1.47-1.39(m,6h).步骤6.向化合物23-8(334mg,1mmol)在thf(1ml)中的溶液中加入aq.lioh(4当量)。将混合物在室温搅拌3h。除去溶剂后,将残留物溶于水中并用aq.hcl酸化至ph3.0。将其用乙醚(20mlx3)萃取。合并有机层,干燥并浓缩得到化合物23-9,其直接用于下一步。步骤7.向化合物23-9(320mg,1.0mmol)在dcm(20ml)中的溶液中加入eedq(247mg,1.0mmol)和化合物23-10(123mg,1.0mmol)。在将反应混合物在室温搅拌1h后,除去溶剂并将残留物用制备性hplc纯化,得到23-11.1hnmr(400mhz,meod)δ7.55-7.52(m,2h),7.34-7.27(m,7h),5.05(s,2h),4.65-4.58(m,1h),4.54(s,2h),3.61-3.59(m,2h),2.60-2.45(m,1h),2.10-2.00(m,1h),1.56-1.54(m,3h),1.33(s,3h).lcms(esi):m/z448.1[m+na+].步骤8.向23-11(42mg,0.1mmol)在dcm(20ml)中的溶液中加入pnp碳酸盐(2当量)和dipea(0.2ml)。将溶液回流加热16h。蒸发溶剂并将残留物溶于无水dmf(5ml)。加入dipea(0.2ml)和诺氟沙星(4当量)。将混合物在室温搅拌30min,除去溶剂后,将残留物用制备性hplc纯化,得到实施例23.1hnmr(400mhz,meod)δ8.77(s,1h),7.91-7.88(m,1h),7.50-7.48(m,2h),7.25-7.23(m,7h),7.10-7.00(m,1h),5.02(s,2h),4.96(s,2h),4.61-4.42(m,6h),4.15-4.08(m,1h),3.62(s,4h),3.52-3.50(m,2h),2.50-2.40(m,1h),2.00-1.92(m,1h),1.47-1.41(m,6h),1.27(s,3h).lcms(esi):m/z771.1[m+h+].实施例24.7-(4-((4-((s)-2-((2s,3s)-3-(苄基氧基羰基氨基)-1,1,1-三氟-4-甲基戊-2-基氨基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0℃向化合物24-1(9.93g,35.28mmol)和2-甲基丙烷-2-亚磺酰胺(4.28g,35.28mmol)在thf(100ml)中的溶液中逐滴加入ti(oet)4(32.19g,141.12mmol)。在将混合物在25℃搅拌16h后,在0℃逐滴加入水(25ml)。将混合物滤过并将滤液用etoac(50ml×3)萃取。除去溶剂得到粗产物24-2(11g,81.1%).lcms(esi):m/z385.3[m+h+].步骤2.在-78℃将tmscf3(3.55g,24.96mmol)逐滴加至24-2(6.4g,16.64mmol)和tmaf(1.86g,19.97mmol)在thf(30ml)中的溶液中。在将溶液在-78℃搅拌2h后,将其用水(2ml)缓慢淬灭,然后用水(50ml)稀释。将混合物用etoac(60ml×2)萃取。将有机层浓缩并将残留物经硅胶柱色谱纯化,得到24-3(3.3g,44%).1hnmr(400mhz,cdcl3)δ7.37-7.20(m,10h),4.21-4.11(m,1h),3.98-3.93(m,3h),3.65-3.61(m,2h),2.88-2.85(m,1h),2.29-2.20(m,1h),1.22(s,9h),1.13-1.11(m,3h),0.95-0.91(m,3h).步骤3.将24-3(3.3g,7.26mmol)和4mhcl/meoh(25ml)的混合物在25℃搅拌6h。除去溶剂得到粗产物24-4(2.8g).lcms(esi):m/z351.2[m+h+].步骤4.在25℃向24-4(900mg,2.57mmol)、2-氧代丙酸(905mg,10.28mmol)和hoac(617mg,10.28mmol)在dce(12ml)中的溶液中加入nabh(aco)3(2.18g,10.28mmol)。在将混合物在25℃搅拌16h后,除去溶剂并将残留物经柱色谱纯化,得到24-5(700mg,64.5%).lcms(esi):m/z423.3[m+h+].步骤5.在0℃向24-5(700mg,1.66mmol)在meoh(5ml)中的溶液中逐滴加入socl2(395mg,3.32mmol)。在将溶液在50℃搅拌16h后,将其冷却至25℃并减压除去溶剂得到粗产物24-6(620mg,粗的).lcms(esi):m/z437.3[m+h+].步骤6.向24-6(520mg,1.19mmol)和boc2o(260mg,1.19mmol)在meoh(8ml)中的溶液中加入pd/c(100mg)。在将混合物在25℃在氢气下搅拌16h后,将其滤过,除去溶剂并将残留物经硅胶柱色谱纯化(pe/etoac5:1)得到24-7(390mg,92%).lcms(esi):m/z357.2[m+h+].步骤7.向24-7(395mg,1.08mmol)在meoh(5ml)中的溶液中加入4mhcl/meoh(5ml,20mmol)。在将溶液在25℃搅拌2h后,除去溶剂并将残留物溶于dcm(8ml)。在0℃加入cbzcl(276mg,1.62mmol)和et3n(219mg,2.16mmol)并将混合物在25℃搅拌6h。除去溶剂并将残留物经制备性tlc纯化,得到化合物8(110mg,26%).lcms(esi):391.1[m+h+].步骤8.在25℃向化合物8(110mg,0.282mmol)在thf/meoh/h2o(0.5ml:0.5ml:0.5ml)中的溶液中加入lioh.h2o(42mg,1mmol)。将溶液在25℃搅拌2h。除去溶剂,并将残留物用水(3ml)吸收。将水溶液用1mhcl酸化至ph2并用etoac(15ml×3)萃取。将有机层经na2so4干燥,滤过,浓缩得到化合物9(100mg,94%).lcms(esi):377.1m/z[m+h+].步骤9.在0℃在氮气下向24-9(120mg,0.319mmol)和(4-氨基苯基)甲醇(79mg,0.638mmol)在dcm(3ml)中的溶液中加入eedq(158mg,0.638mmol)。将混合物在室温搅拌6h。除去溶剂后,将残留物经制备性tlc纯化,然后经sfc分离得到主要异构体(72mg)24-10和次要异构体(26mg)。未确定每个异构体的绝对构型。1hnmr(400mhz,meod)δ7.65-7.63(m,2h),7.37-7.27(m,7h),5.14-5.07(m,2h),4.56(s,2h),3.81-3.79(m,1h),3.59-3.57(m,1h),3.37-3.35(m,1h),2.11-2.10(m,1h),1.33(d,j=6.8hz,3h),0.93(d,j=6.8hz,3h),0.87(d,j=6.4hz,3h).lcms(esi):482.2m/z[m+h+].步骤10.在25℃向24-10(20mg,0.042mmol)在thf(1.5ml)中的溶液中加入pnp碳酸盐(38mg,0.125mmol)和dipea(21mg,0.166mmol)。将混合物在50℃加热18h。除去溶剂,并将残留物溶于dmf(1.5ml)。加入诺氟沙星(20mg,0.062mmol)并将混合物在25℃搅拌2h。将混合物经制备性hplc纯化,得到实施例24(11.2mg,33%).1hnmr(400mhz,meod)δ8.86(s,1h),8.41(s,1h),8.1-7.94(m,1h),7.70-7.68(m,2h),7.37-7.09(m,9h),5.13-5.09(m,4h),4.89-4.86(m,2h),3.80-3.57(m,6h),3.38-3.28(m,3h),2.20-2.07(m,1h),1.52(s,3h),1.33(t,j=6.8hz,3h),0.937(d,j=6.8hz,3h),0.87(d,j=6.8hz,3h).lcms(esi):827.3m/z[m+h+].实施例25:7-(4-((4-((2s,5r)-5-(苄基氧基羰基氨基)-2,6-二甲基-4-氧代庚酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向化合物25-1(2g,17.07mmol)和k2co3(7.066g,51.2mmol)在etoh(50ml)中的溶液中加入苄基溴(8.7g,51.2mmol)。在将混合物回流加热5h后,将固体滤出并将滤液减压浓缩并经快速硅胶色谱纯化(etoac:己烷=1:10)得到25-2(3.52g,58.1%).步骤2.在-78℃历时1h向甲基膦酸二甲酯(6.78g,54.7mmol)在无水thf(60ml)中的溶液中逐滴加入lda(2mol/l,27ml)。在将其在-78℃搅拌1h后,在-78℃逐滴加入25-2(3.52g,9.12mmol)在无水thf(10ml)中的溶液。将混合物搅拌1h并将其用etoac(100ml×3)萃取。将有机层用盐水(60ml)洗涤并浓缩得到粗产物25-3,,其无需进一步纯化即可用于下一步(3.12g,84.9%).lcms(esi):m/z403.9[m+h+],425.9[m+na+]步骤3.在0℃向25-3(3.12g,7.75mmol)在无水thf(60ml)中的溶液中加入氢化钠(372mg,9.3mmol,60%)。在将其在0℃搅拌30min后,逐滴加入2-氧代-丙酸乙酯(1.349g,11.6mmol)在无水thf(5ml)中的溶液。将混合物在室温在氮气下搅拌16h。除去溶剂,将残留物经制备性hplc纯化,得到25-4(2.85g,93.6%).lcms(esi):m/z394.2[m+h+].步骤4.向25-4(2.85g,7.3mmol)和硫酸(750mg,7.3mmol)在etoh(60ml)中的溶液中加入10%钯/活性炭(1g)。在将其在氢气下搅拌6h后,将反应混合物经硅藻土填料滤过并浓缩得到预期产物25-5(3.65g,100%).步骤5.向25-5(3.65g,7.3mmol)和三乙胺(2.21g,21.9mmol)在ch2cl2(150ml)中的溶液中逐滴加入cbzcl(1.36g,8.03mmol)在冰浴中的溶液。在将混合物在室温搅拌2h后,将其用etoac(50ml×3)萃取。将有机层用盐水(50ml)洗涤,经na2so4干燥,真空浓缩得到粗产物25-6.lcms(esi):m/z350.2[m+h+],372.2[m+na+].步骤6.向25-6(1.6g,4.58mmol)在h2o和thf混合物(40ml,1:3)中的溶液中加入氢氧化锂水合物(1.93g,45.8mmol)。在将反应混合物在室温搅拌16h后,将其用etoac(50ml×3)萃取。将有机层用盐水(50ml)洗涤,经na2so4干燥,真空浓缩得到粗产物25-7(1.43g,97.3%).lcms(esi):m/z344.1[m+na+].步骤7.向化合物25-7(1.0g,3.11mmol)在无水dcm(20ml)中的溶液中加入eedq(1.52g,6.22mmol)和25-8(765mg,6.22mmol)。将混合物在0℃在氮气下搅拌16h。除去溶剂后,将残留物经制备性hplc和sfc纯化,得到25-9、25-10、25-11和25-12.1hnmr(400mhz,meod)δ7.49(d,j=8.8hz,2h),7.35-7.25(m,7h),5.06(s,2h),4.53(s,2h),4.12(d,j=5.6hz,1h),3.07-3.92(m,2h),2.62-2.57(m,1h),2.26-2.21(m,1h),1.18(d,j=6.8hz,3h),0.95(d,j=6.8hz,3h),0.81(d,j=6.8hz,3h).lcms(esi):m/z427.2[m+h+],449.1[m+na+],409.2[m-oh].1hnmr(400mhz,meod)δ7.49(d,j=8.8hz,2h),7.33-7.20(m,7h),5.07(s,2h),4.53(s,2h),4.12(d,j=5.6hz,1h),3.28-2.92(m,2h),2.63-2.57(m,1h),2.27-2.19(m,1h),1.18(d,j=6.8hz,3h),0.95(d,j=6.8hz,3h),0.81(d,j=6.8hz,3h).lcms(esi):m/z427.2[m+h+],449.1[m+na+],409.2[m-oh].1hnmr(400mhz,meod)δ7.41(d,j=6.8hz,2h),7.39-7.16(m,7h),5.03-4.96(m,2h),4.47(s,2h),3.89(d,j=6.4hz,1h),2.93-2.82(m,2h),2.49-2.43(m,1h),2.10-2.05(m,1h),1.07(d,j=6.8hz,3h),0.82(d,j=6.8hz,3h),0.77(d,j=6.8hz,3h).lcms(esi):m/z427.2[m+h+],449.1[m+na+],409.2[m-oh].1hnmr(400mhz,meod)δ8.02(d,j=18.8hz,2h),7.79-7.29(m,7h),5.16-5.08(m,2h),4.56(s,2h),4.01(d,j=6.0hz,1h),3.32-2.94(m,2h),2.60-2.55(m,1h),2.24-2.12(m,1h),1.19(d,j=6.8hz,3h),0.95-0.88(m,6h).lcms(esi):m/z409.0[m-oh].步骤8.向25-9(100mg,0.235mmol)在无水dcm(2ml)中的溶液中加入pnp碳酸盐(147mg,0.47mmol)和dipea(61mg)。将混合物回流加热16h。除去溶剂后,将残留物溶于dmf(3ml)。加入dipea(61mg,0.47mmol)和诺氟沙星(150mg,0.47mmol)。将混合物在室温搅拌1h。除去溶剂后,将残留物经制备性hplc纯化,得到实施例25,其为白色固体。1hnmr(400mhz,dmso-d6)δ15.33(s,1h),10.01(s,1h),8.96(s,1h),7.94(d,j=12.8hz,1h),7.72(d,j=8.0hz,1h),7.58(d,j=8.4hz,2h),7.37-7.30(m,7h),7.21(d,j=7.2hz,1h),5.05-5.04(m,4h),4.59-4.58(m,2h),3.84-3.80(m,1h),3.61(s,4h),2.94-2.89(m,2h),2.12-2.05(m,1h),1.42-1.39(m,3h),1.07(d,j=6.0hz,3h),0.82(d,j=6.4hz,6h).lcms(esi):m/z772.6[m+h+],386.7[m/2+h+].实施例26.7-(4-((4-(2-(5-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)-1,3,4-噁二唑-2-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向26-1(10.0g,78.7mmol)在meoh(180ml)和h2o(180ml)中的溶液中加入lioh·h2o(16.9g,393.3mmol)。在将混合物在室温搅拌24h后,将其用浓hcl酸化为ph=6。然后将粗物质用(200ml×3)萃取并浓缩得到26-2.步骤2.向26-2(2g,20.2mmol)和dmap(247mg,2.02mmol)在dcm(400ml)中的搅拌溶液中加入26-3(5.89g,22.2mmol)和edci(4.26g,22.2mmol)。在将溶液在室温搅拌2h后,将其先后用水(200ml×3)、盐水(100ml)洗涤,经na2so4干燥并浓缩得到26-4.步骤3.将26-4(3g,8.7mmol)和burgess试剂(3.1g,13.1mmol)在thf(50ml)中的混合物在室温搅拌24h。除去溶剂后,将残留物用etoac(100ml×3)萃取。将有机层用盐水(100ml)洗涤,浓缩并经硅胶柱色谱纯化(pe:etoac=2:1)得到26-5.步骤4.将26-5(1.67g,5.09mmol)和naoh(66mmol)在etoh(66ml)和h2o(66ml)中的溶液的混合物在80℃加热12h。在将其冷却至室温后,将混合物用etoac(50ml)洗涤并将水层调节至ph5-6,并用etoac(60ml×3)萃取。将合并的有机层经na2so4干燥并浓缩得到26-6.步骤5.将26-6(1.47g,4.23mmol)、26-7(1.56g,12.7mmol)和eedq(3.14g,12.7mmol)在dcm(50ml)中的混合物在室温搅拌2h。除去溶剂,并将残留物经制备性hplc和sfc纯化,得到26-8和26-9.步骤6.将26-8(40mg,0.088mmol)、pnp(57mg,0.18mmol)和dipea(34mg,0.26mmol)在dcm(3ml)中的混合物在50℃搅拌12h。将其浓缩并与诺氟沙星(82mg,0.26mmol)和dipea(34mg,0.26mmol)在dmf(5ml)中混合。在将其在室温搅拌2h后,除去溶剂,并将残留物经制备性hplc纯化,得到实施例26(30.5mg,43.6%).1hnmr(400mhz,dmso-d6)δ15.33(s,1h),10.44(s,1h),8.97(s,1h),8.12-8.08(m,1h),7.95(d,j=13.2hz,1h),7.58(d,j=8.4hz,2h),7.37-7.34(m,7h),7.21(d,j=7.2hz,1h),5.05(d,j=14.8hz,4h),4.59-4.58(m,3h),4.19-4.17(m,1h),3.61(s,4h),3.38(s,4h),2.10-2.07(m,1h),1.58(dd,j=2.0,7.2hz,3h),1.40(t,j=6.8hz,3h),0.93(d,j=6.8hz,3h),0.82(d,j=6.8hz,3h).lcms(esi):m/z798.3[m+h+],820.2[m+na+].实施例27.7-(4-((4-((s)-2-(2-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)噻唑-5-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在-78℃向27-1(8g,31.8mmol)和et3n(6.43g,63.6mmol)在无水thf(100ml)中的溶液中逐滴加入氯甲酸乙酯(3.45g,31.8mmol)在thf(10ml)中的溶液。在将反应混合物在-78℃搅拌1h后,加入nh3.h2o(5ml)。历时2h将反应混合物温热至室温。将白色固体经滤过收集并干燥得到27-2(5.1g,63.8%).步骤2.将27-2(3g,12mmol)和lawesson试剂(9.7g,24mmol)在无水thf(60ml)中的溶液在70℃搅拌16h。除去溶剂并将残留物经柱色谱纯化(etoac:己烷=1:3)得到27-3(2.9g,90.6%).lcms(esi):m/z267.1[m+h+],289.1[m+na+].步骤3.向27-3(3g,11.26mmol)、khco3(3.38g,33.8mmol)在无水dme(40ml)中的溶液中逐滴加入27-3a(11.31g,22.52mmol)在dme(10ml)中的溶液。在将反应混合物在-40℃搅拌16h后,加入水(50ml)和etoac(100ml),并将有机层用盐水洗涤,经na2so4干燥,真空浓缩。在-40℃向粗中间体和2,6-二甲基吡啶(3.3g,30.4mmol)在thf(20ml)中的混合物中缓慢逐滴加入2,2,2-三氟乙酸酐溶液(3.2g,15.2mmol)。在将反应混合物在-10℃搅拌2h后,加入水(100ml)和etoac(100ml)。将有机层用盐水洗涤,经na2so4干燥,真空浓缩。将粗产物经制备性hplc纯化,得到27-4(2g,67.7%).lcms(esi):m/z391.2[m+h+].步骤4.向27-4(2g,5.13mmol)在ch3oh和h2o混合物(60ml/20ml)中的溶液中加入氢氧化锂(2.15g,51.3mmol)。在将混合物在室温搅拌16h后,将ph用稀hcl(5%)调节至5并将混合物用etoac(60ml×2)萃取。将有机层用盐水(60ml)洗涤,经na2so4干燥,真空浓缩得到27-5.lcms(esi):m/z363.2[m+h+].步骤5.在0℃向27-5(1g,2.76mmol)和eedq(750mg,5.52mmol)在ch2cl2(20ml)中的溶液中加入(4-氨基苯基)甲醇(680mg,5.52mmol)。将反应混合物在0℃搅拌2h,然后在室温搅拌16h。将反应混合物用ch2cl2(50ml)稀释并用盐水(50ml)洗涤,经na2so4干燥,滤过,浓缩,经制备性hplc和sfc纯化,得到27-6和27-7(各370mg,28.7%).1hnmr(400mhz,meod)δ7.55(d,j=8.4hz,2h),7.36-7.29(m,8h),5.11(s,2h),4.80(d,j=6.8hz,1h),4.56(s,2h),4.07-4.01(m,1h),2.33-2.25(m,1h),1.60(d,j=6.8hz,3h),0.96-0.91(m,6h).lcms(esi):m/z468.0[m+h+],490.2[m+na+].1hnmr(400mhz,cdcl3)δ8.90(s,1h),7.49-7.23(m,9h),7.05(s,1h),5.48-5.45(m,1h),5.14-5.10(m,2h),5.03-4.99(m,1h),4.61(s,2h),3.94-3.88(m,1h),2.42-2.34(m,1h),1.63(d,j=7.2hz,3h),1.02-1.94(m,6h).lcms(esi):m/z489.9[m+na+].步骤6.向27-6(50mg,0.11mmol)在无水dcm(2ml)中的溶液中加入pnp碳酸盐(67mg,0.22mmol)和dipea(28mg)。将混合物回流加热16h。除去溶剂后,将残留物溶于无水dmf(5ml)。加入dipea(60mg,047mmol)和诺氟沙星(60mg,0.188mmol)。在将混合物在室温搅拌1h后,除去溶剂并将残留物经制备性hplc纯化,得到实施例27.1hnmr(400mhz,dmso-d6)δ15.34(s,1h),10.17(s,1h),8.97(s,1h),8.10(d,j=8.4hz,1h),7.95(d,j=8.4hz,1h),7.60(d,j=8.4hz,2h),7.36-7.31(m,7h),7.21(d,j=7.2hz,1h),5.05(s,4h),4.66-4.56(m,3h),4.03-3.97(m,1h),3.61(s,4h),3.35(s,4h),2.20-2.14(m,1h),1.47-1.39(m,6h),0.87-0.80(m,6h).lcms(esi):m/z813.1,[m+h+],407.1[m/2+h+].实施例28.7-(4-((4-((r)-2-((s)-6-(苄基氧基羰基)-7-异丙基-5-氧代-6,7-二氢-5h-咪唑并[5,1-c][1,2,4]三唑-3-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0℃在10min内向28-1(12g,0.1mol)在meoh(200ml)中的溶液中加入socl2(10ml)。在将混合物在室温搅拌12h后,除去溶剂,得到预期产物28-2.步骤2.向28-2(2.6g,5mmol)在dcm(50ml)中的溶液中加入tea(2ml)并在0℃搅拌直到溶液变为澄清。然后在1h内逐滴加入cbzcl(10.2g,6mmol)并保持温度低于5℃。然后将混合物在室温搅拌另外的10h。将溶液用吸dcm(100ml)收并用aq.hcl、aq.nahco3和水洗涤,将有机层经无水na2so4干燥,然后蒸发溶剂得到28-3.lcms(esi):m/z265.9[m+h+].步骤3.向28-3(2.65g,10mmol)在meoh(25ml)中的溶液中加入nh2nh2.h2o(5ml,80%)。在将混合物在室温搅拌6h后,将固体经滤过收集得到28-4.1hnmr(400mhz,meod)δ7.36-7.30(m,5h),5.07(s,2h),4.59(s,1h),3.84-3.82(m,1h),0.94-0.91(m,6h).步骤4.将化合物28-4(2.65g,10mmol)、28-5(4.2g,20.2mmol)和无水meoh(50ml)在150℃在密封容器中加热24h。除去溶剂得到预期产物28-6.步骤5.向28-6(740mg,2mmol)在etoh(20ml)和水(10ml)中的溶液中加入naoh(400mg,10mmol)。在将混合物在50℃搅拌1h后,除去溶剂,并将残留物经柱色谱纯化,得到28-7.1hnmr(400mhz,meod)δ7.32-7.26(m,5h),5.10-5.05(m,2h),4.61-4.59(m,1h),3.94-3.92(m,1h),2.16-2.14(m,1h),1.55-1.53(m,3h),0.99-0.82(m,6h).步骤6.向28-7(100mg,0.28mmol)在无水dcm(5ml)中的溶液中加入(4-氨基苯基)甲醇(250mg,2mmol)和eedq(247mg,1mmol)。在将混合物在0℃搅拌2h后,除去溶剂,并将残留物经制备性hplc和sfc纯化,得到28-8和28-9.1hnmr(400mhz,meod)δ7.57(d,j=8.4hz,2h),7.35-7.30(m,7h),5.13-5.05(m,2h),4.63(d,j=7.6hz,1h),4.57(s,2h),4.07-4.02(m,1h),2.23-2.17(m,1h),1.66(d,j=7.2hz,3h),0.98(d,j=6.8hz,3h),0.87(d,j=6.8hz,3h).lcms(esi):m/z452.0[m+h+].1hnmr(400mhz,meod)δ7.57(d,j=8.4hz,2h),7.35-7.30(m,7h),5.13-5.05(m,2h),4.63(d,j=7.6hz,1h),4.57(s,2h),4.00-3.99(m,1h),2.19-2.17(m,1h),1.66(s,3h),0.98(d,j=5.6hz,3h),0.87(d,j=6.8hz,3h).lcms(esi):m/z473.9[m+na+].步骤7.向28-8(45mg,0.1mmol)在无水dcm(30ml)中的溶液中加入pnp碳酸盐(62mg,0.2mmol)和dipea(1ml)。在将混合物回流加热16h后,除去溶剂,并将残留物溶于dmf(5ml)。加入dipea(1.0ml)和诺氟沙星(65mg,0.2mmol)。将混合物在室温搅拌1h。除去溶剂后,将残留物经制备性hplc纯化,得到实施例28.1hnmr(400mhz,dmso-d6)δ8.97(s,1h),7.97-7.94(m,2h),7.48-7.23(m,10h),5.17(s,2h),5.04(s,2h),4.61-4.58(m,2h),4.50-4.40(m,1h),3.69-3.63(m,4h),3.40-3.35(m,1h),3.29-3.26(m,4h),2.09-2.08(m,1h),1.91-1.88(m,2h),1.41(t,j=7.2hz,3h),0.96-0.89(m,6h).lcms(esi):823.3m/z[m+h+].实施例29.7-(4-((4-((r)-2-(2-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)噻唑-5-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸实施例29使用如实施例27的操作制备。1hnmr(400mhz,dmso-d6)δ15.33(brs,1h),10.17(s,1h),8.96(s,1h),8.10(d,j=8.4hz,1h),7.95(d,j=8.4hz,1h),7.60(d,j=8.4hz,2h),7.36-7.31(m,7h),7.21(d,j=7.2hz,1h),5.05(s,4h),4.66-4.56(m,3h),4.03-3.97(m,1h),3.61(s,4h),3.35(s,4h),2.20-2.14(m,1h),1.47-1.39(m,6h),0.87-0.80(m,6h).lcms(esi):m/z813.1,[m+h+],407.3[m/2+h+].实施例30.7-(4-((4-((s)-2-((s)-6-(苄基氧基羰基)-7-异丙基-5-氧代-6,7-二氢-5h-咪唑并[5,1-c][1,2,4]三唑-3-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.实施例30使用如实施例28的操作制备.1hnmr(400mhz,dmso-d6)δ8.99(s,1h),8.14-7.93(m,2h),7.57-7.19(m,10h),5.19(s,2h),5.11-5.03(m,2h),4.62-4.56(m,2h),4.51-4.47(m,1h),3.67-3.57(m,4h),3.52-3.50(m,1h),3.40-3.35(m,4h),2.25-2.15(m,1h),1.90(s,2h),1.41(t,j=7.2hz,3h),0.98-0.84(m,6h).实施例31:7-(4-((4-((2s,5s)-5-(苄基氧基羰基氨基)-2,6-二甲基-4-氧代庚酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.实施例31使用如实施例25的操作制备。1hnmr(400mhz,dmso-d6)δ15.29(s,1h),9.98(s,1h),8.92(s,1h),7.90(d,j=13.2hz,1h),7.57-7.54(m,3h),7.32-7.24(m,7h),7.17(d,j=7.6hz,1h),5.05-4.97(m,4h),4.56-4.54(m,2h),3.95-3.92(m,1h),3.58(s,4h),3.26(s,4h),2.93-2.83(m,2h),2.57-2.52(m,1h),2.16-2.08(m,1h),1.45-1.35(m,3h),1.07(d,j=6.4hz,3h),0.85(d,j=8.2hz,3h),0.75(d,j=8.0hz,3h).lcms(esi):m/z772.1[m+h+].实施例32:7-(4-((4-((2r,5r)-5-(苄基氧基羰基氨基)-2,6-二甲基-4-氧代庚酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.实施例32使用如实施例25的操作制备,采用来自合成实施例25的中间体。1hnmr(400mhz,dmso-d6)δ15.30(s,1h),10.03(s,1h),8.97(s,1h),7.95(d,j=12.8hz,1h),7.74(d,j=8.4hz,1h),7.58(d,j=8.4hz,2h)7.37-7.31(m,7h),7.21(d,j=7.2hz,1h)5.09-5.02(m,4h),4.60-4.56(m,2h),3.84-3.80(m,1h),3.61(s,4h),3.34(s,4h),2.92-2.85(m,2h),2.12-2.08(m,1h),2.05(s,1h),1.42-1.39(m,3h),1.07(d,j=6.8hz,3h),0.82(d,j=6.8hz,6h).lcms(esi):m/z772.4[m+h+].实施例33:7-(4-((4-((2r,5s)-5-(苄基氧基羰基氨基)-2,6-二甲基-4-氧代庚酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.实施例33使用如实施例25的操作制备,采用来自合成实施例25的中间体。1hnmr(400mhz,dmso-d6)δ15.34(s,1h),10.02(s,1h),8.97(s,1h),7.95(d,j=12.8hz,1h),7.58(d,j=8.4hz,3h),7.36-7.29(m,7h),7.21(d,j=7.2hz,1h),5.08-5.00(m,4h),4.61-4.56(m,2h),3.99-3.95(m,1h),3.61(s,4h),3.31(s,4h),2.96-2.85(m,2h),2.50-2.47(m,1h),2.19-2.13(m,1h),1.42-1.39(m,3h),1.08(d,j=6.0hz,3h),0.90(d,j=6.0hz,3h),0.82(d,j=6.4hz,3h).lcms(esi):m/z772.0[m+h+].实施例34.7-(4-((4-(2-(5-((r)-1-(苄基氧基羰基氨基)-2-甲基丙基)-1,3,4-噁二唑-2-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.实施例34使用如实施例26的操作制备,采用来自合成实施例26的中间体。1hnmr(400mhz,dmso-d6)δ15.32(s,1h),10.46(s,1h),8.95(s,1h),8.09(s,1h),7.94(d,j=13.2hz,1h),7.58(d,j=8.0hz,2h),7.36-7.33(m,7h),7.20(d,j=6.4hz,1h),5.04(d,j=15.2hz,4h),4.62-4.57(m,3h),4.22-4.21(m,1h),3.61(s,4h),3.35(s,4h),2.13-2.11(m,1h),1.58(d,j=5.6hz,3h),1.40(t,j=6.8hz,3h),0.93(d,j=6.0hz,3h),0.81(d,j=6.4hz,3h).lcms(esi):m/z798.1[m+h+].实施例35:7-(4-((4-((2s,5s)-5-(苄基氧基羰基氨基)-4-羟基-2,6-二甲基庚酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.在冰浴中向实施例25(120mg,0.156mmol)在无水ch3oh(20ml)中的溶液中加入nabh4(6mg,0.158mmol)。在将混合物在室温搅拌2h后,除去溶剂,并将残留物经制备性hplc纯化,得到实施例35,其为固体(40mg).1hnmr(400mhz,dmso-d6)δ15.33(s,1h),9.88(s,1h),8.96(s,1h),7.94(d,j=12.8hz,1h),7.62(d,j=8.4hz,2h),7.37-7.20(m,8h),6.95(d,j=10.0hz,1h),5.05-4.99(m,4h),4.59-4.57(m,3h),3.61(s,4h),3.47-3.42(m,1h),3.30(s,4h),2.72-2.66(m,1h)2.07-2.04(m,1h),1.59-1.51(m,2h),1.45-1.35(m,3h),1.05(d,j=8.0hz,3h),0.85-0.75(m,6h).lcms(esi):m/z387.7[m/2+h+].实施例36.7-(4-((4-(2-(5-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)-4h-1,2,4-三唑-3-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.在15℃向28-8(80mg,0.177mmol)在dcm(3ml)中的溶液中加入boc2o(232mg,1.062mmol)和et3n(107mg,1.062mmol)。在将溶液在15℃搅拌16h后,减压除去dcm并将残留物用石油醚(5ml×3)洗涤。将所得的固体溶于dcm(3ml),并加入pnp碳酸盐(108mg,0.354mmol)dipea(92mg,0.708mmol)。在将溶液在15℃搅拌2h后,减压除去溶剂并加入残留物溶于dmf(3ml)中的溶液和诺氟沙星(170mg,0.531mmol)和dipea(92mg,0.708mmol)。将其在15℃搅拌1h。除去溶剂后,将残留物经制备性hplc纯化,得到实施例36的混合物(37mg,26%).1hnmr(400mhz,dmso-d6)δ8.96(s,1h),7.95(d,j=13.2hz,1h),7.60(d,j=8.4hz,2h),7.34-7.20(m,8h),5.06-5.00(m,4h),4.59-4.41(m,3h),4.08-3.82(m,1h),3.61(s,4h),3.29(s,4h),2.15-2.07(m,1h),1.50-1.49(m,3h),1.40(t,j=7.2hz,3h),0.88-0.87(m,3h),0.75-0.73(m,3h).实施例37.7-(4-((4-(2-(5-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)异噁唑-3-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.将37-1(5g,43.1mmol)和羟胺盐酸盐(3.02g,43.1mmol)在吡啶(50ml)中的混合物在70℃搅拌16h。除去溶剂并将残留物溶于dmf(30ml)并在0℃加入ncs(5.73g,43.1mmol)。将混合物在室温搅拌16h。除去溶剂后,残留物(37-2)无需纯化即可直接用于下一步。步骤2.在0℃向37-2(5g,30.2mmol)、cuso4.5h2o(250mg,1mmol)、抗坏血酸钠(198mg,1mmol)、na2co3(1.1g,10.4mmol)在t-buoh和h2o混合物(20ml/20ml)中的混合物中加入(1-异丙基-丙-2-炔基)-氨基甲酸苄酯(1.2g,5.2mmol)。在将混合物在60℃搅拌16h后,将其用etoac(80ml×3)萃取。将有机层用盐水(60ml)洗涤,经na2so4干燥,真空浓缩并经制备性hplc纯化,得到37-3.lcms(esi):m/z361.1[m+h+]步骤3.向37-3(150mg,0.417mmol)在thf和h2o混合物(8ml/4ml)中的溶液中加入氢氧化锂水合物(145mg,4.17mmol),并将混合物在室温搅拌16h。除去溶剂并将混合物用etoac洗涤。将其酸化后,将其用etoac(30ml×3)萃取。将有机层用盐水(30ml)洗涤,经na2so4干燥,浓缩得到粗产物37-4,其无需进一步纯化即可用于下一步(123mg,84.8%).lcms(esi):m/z347.2[m+h+].步骤4.在0℃向37-4(123mg,0.35mmol)和(4-氨基苯基)甲醇(87mg,0.71mmol)在ch2cl2(5ml)中的混合物中加入eedq(174mg,0.71mmol)。将混合物在室温搅拌16h并用etoac(30ml×3)萃取。将有机层用盐水(30ml)洗涤,经na2so4干燥,浓缩并经制备性hplc纯化,得到37-5(63mg,39.4%).1hnmr(400mhz,meod)δ7.44-7.42(m,2h),7.23-7.19(m,7h),6.23(d,j=2.8hz,1h),4.99-4.98(m,2h),4.58-4.54(m,1h),4.46(s,2h),3.90-3.85(m,1h),2.10-2.01(m,1h),1.45-1.43(m,3h),089-0.79(m,6h).lcms(esi):m/z434.1[m-oh].步骤5.向37-5(40mg,0.089mmol)在无水dcm(2ml)中的溶液中加入pnp碳酸盐(57mg,0.177mmol)和dipea(23mg)。将混合物回流加热16h。除去溶剂后,将残留物溶于dmf(2ml)、dipea(23mg)并加入诺氟沙星(54mg,0.178mmol)。将混合物在室温搅拌1h。除去溶剂后,将残留物经制备性hplc纯化,得到实施例37.1hnmr(400mhz,dmso-d6)δ15.30(s,1h),10.28(s,1h),8.93(s,1h),7.95-7.89(m,2h),7.57(d,j=8.8hz,2h),7.35-7.12(m,8h),6.32(d,j=4.4hz,1h),5.02(d,j=11.6hz,4h),4.56-4.52(m,3h),3.97-3.91(m,1h),3.57(s,4h),3.29(s,4h),2.03-1.96(m,1h),1.41-1.35(m,6h),0.85-0.75(m,6h).lcms(esi):m/z797.3[m+h+],399.3[m/2+h+].实施例38.7-(4-((4-(2-(5-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)噻唑-2-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0℃在氮气下向38-1(40g,0.34mol)在meoh(200ml)中的溶液中加入socl2(28ml,0.38mol)。在将混合物在室温搅拌12后,除去溶剂得到粗产物38-2.步骤2.历时20min将cbzcl(53ml,0.37mol)逐滴加至38-2(57g,0.34mol)和na2co3(72g,0.68mol)在水(300ml)中的混合物中。在将混合物在室温搅拌12h后,将其用etoac(500ml×3)萃取。将合并的有机层经na2so4干燥并浓缩得到粗产物,将其经硅胶柱色谱纯化(pe:etoac=5:1)得到化合物38-3.步骤3.向化合物38-3(10g,37.7mmol)在thf(20ml)中的溶液中加入clch2i(26.6g,151mmol)。在将其冷却至-78℃后,在2h内缓慢加入lda。在将其在-78℃在氮气下搅拌30min后,在-70℃加入hoac(21ml,377mmol)在thf中的溶液。将其温热至室温,并加入etoac(30ml)并将混合物倒入盐水中。将其用etoac(80ml×3)萃取,经na2so4干燥,浓缩,并经硅胶柱色谱纯化(pe:etoac=5:1)得到化合物38-4.步骤4.在将化合物38-4(5g,17.6mmol)和nan3(1.8g,26.4mmol)的混合物在室温搅拌1h后,将其倒入水中并用etoac(150ml×3)萃取。将合并的有机层经na2so4干燥并减压浓缩得到粗产物化合物38-5.步骤5.向化合物38-5(4.84g,16.7mmol)在meoh(50ml)中的溶液中加入sncl·2h2o(7.5g,33.3mmol)并将混合物在室温搅拌2h。除去溶剂后,残留物(38-6)直接用于下一步。步骤6.将化合物38-6(3.75g,14.2mmol)、nahco3(11.93g,142mmol)、boc2o(3.41g,15.6mmol)在h2o(15ml)和二噁烷(15ml)中的混合物在室温搅拌1h。将混合物用etoac(150ml×3)萃取,经na2so4干燥,浓缩并经硅胶柱色谱纯化(pe:etoac=5:1至2:1)得到化合物38-7。在将化合物38-7(1.6g,4.43mmol)和4mhcl/meoh(20ml)的混合物在室温搅拌1h后,将其蒸发得到化合物38-6,其无需进一步纯化即可用于下一步。步骤7.向化合物38-6(1.17g,4.43mmol)和化合物38-8(643mg,4.87mmol)在dcm(20ml)中的溶液中加入eedq(1.31g,5.31mmol)。在将混合物在室温搅拌1h后,除去溶剂,并将残留物经制备性hplc纯化,得到化合物38-9.步骤8.在氮气下向化合物38-9(1g,2.64mmol)在thf(20ml)中的溶液中加入lawesson试剂(1.18g,2.91mmol)。在将混合物在60℃搅拌1h后,除去溶剂,并将残留物经制备性hplc纯化,得到化合物38-10.步骤9.向化合物38-10(630mg,1.67mmol)在meoh(5ml)和h2o(1ml)中的溶液中加入lioh·h2o(105mg,2.51mmol)。在将混悬液在室温搅拌1h后,将其用浓hcl酸化至ph=6。将混合物用萃取(50ml×3)并减压浓缩得到化合物38-11.步骤10.将化合物38-11(438mg,1.21mmol)、化合物38-12(446mg,3.62mmol)、hatu(690mg,1.82mmol)、dipea(468mg,3.62mmol)和eedq(895mg,3.62mmol)在dcm(10ml)中的混合物在室温搅拌2h。除去溶剂后,将其经制备性hplc纯化,得到38-13(200mg,35.4%).1hnmr(400mhz,meod)δ7.54(d,j=8.4hz,3h),7.31-7.25(m,7h),5.06-5.04(m,2h),4.64(d,j=8.0hz,1h),4.55(s,2h),4.21(m,1h),2.14-2.04(m,1h),1.63(d,j=6.8hz,3h),0.99(d,j=6.8hz,3h),0.89-0.86(m,3h).lcms(esi):m/z467.9[m+h+].步骤11.将38-13(50mg,0.107mmol)、pnp(65mg,0.214mmol)和dipea(41mg,0.321mmol)在dcm(5ml)中的混合物在50℃搅拌12h。将其浓缩并加至诺氟沙星(102mg,0.321mmol)和dipea(41mg,0.321mmol)在dmf(5ml)中的混合物中。在将其在室温搅拌2h后,除去溶剂并将残留物经制备性hplc纯化,得到实施例38(24mg,27.6%).1hnmr(400mhz,dmso-d6)δ15.32(s,1h),10.40(s,1h),8.96(s,1h),7.96-7.88(m,2h),7.61(d,j=8.4hz,2h),7.51(s,1h),7.36-7.20(m,8h),5.07(s,2h),5.02-5.00(m,2h),4.59-4.55(m,3h),4.24-4.22(m,1h),3.61(s,4h),3.32(s,4h),1.97-1.92(m,1h),1.52(d,j=6.8hz,3h),1.40(t,j=6.8hz,3h),0.92(d,j=6.0hz,3h),0.79-0.77(m,3h).lcms(esi):m/z813.2[m+h+].实施例39.7-(4-((4-((s)-2-((s)-2-(苄基氧基羰基氨基)-3-甲基丁酰氨基)-5-胍基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0℃向化合物39-1(1g,4mmol)、化合物39-2(459mg,4mmol)在thf(20ml)中的搅拌溶液中加入dcc(908mg,4.4mmol)。将反应混合物在室温搅拌16h。将混合物滤过并将滤液浓缩得到化合物39-3(收率:90%).步骤2.向化合物39-4(2g,3.1mmol)在dcm/meoh(20ml/20ml)中的溶液中加入4-氨基-苯基-甲醇(39-60)(570mg,4.6mmol)和eedq(1.532mg,6.2mmol)。将混合物在室温搅拌16h并经柱色谱纯化(pe/etoac=1/3)得到化合物39-6(2g,收率:86%).步骤3.在室温向化合物39-6(2g,2.65mmol)在dcm(50ml)中的溶液中加入化合物39-7(1.3ml,13.3mmol)。在将混合物在室温搅拌16h后,将其浓缩并用mtbe洗涤,并滤过得到化合物39-8(收率:80%).步骤4.向化合物39-8(640mg,1.2mmol)在dme(10ml)中的溶液中加入化合物39-3(640mg,1.8mmol)和nahco3(304mg,3.6mmol)在水(10ml)中的溶液。在将混合物在室温搅拌16h后,将其用etoac洗涤并用10%hcl酸化至ph3。将所得的混悬液用etoac萃取。将合并的有机层浓缩并经柱色谱纯化(pe/etoac=1/2)得到39-9(510mg,收率:55%).步骤5.在0℃向化合物39-9(200mg,0.26mmol)、pnp碳酸盐(158mg,0.52mmol)在dmf(4ml)中的溶液中加入dipea(101mg,0.78mmol)。将混合物在室温搅拌16h。在室温向混合物中加入诺氟沙星(170mg,0.52mmol)。将混合物在室温搅拌1h并经制备性hplc和sfc纯化,得到化合物39-10(收率:30%,经历两步).步骤6.在0℃向化合物39-10(100mg,0.1mmol)中加入tfa和dcm混合物(tfa/dcm=1/5)。在将混合物在室温搅拌3h后,将其经nh3.h2o碱化为ph=9。将残留物经制备性hplc和sfc纯化,得到实施例39(13.8mg,15%).lcms:(5-95,ab,1.5min,esi),0.826min,ms=858.2[m+1]1hnmr甲醇-d4400mhz,δ8.80(s,1h),8.55(s,1h),7.98(d,j=13.2hz,1h),7.58(s,2h),7.36-7.27(m,9h),7.15(m,1h),5.11(d,j=16.4hz,4h),4.57-4.50(m,4h),3.94(d,j=7.2hz,1h),3.71(m,4h),3.22(s,2h),2.07(d,j=6.8hz,1h),1.95(s,1h),1.83-1.79(m,1h),1.70(d,j=1.6hz,2h),1.51(s,3h),0.97-0.96(m,6h).实施例40.7-(4-((4-((s)-6-氨基-2-((s)-2-(苄基氧基羰基氨基)-3-(噻吩-2-基)丙酰氨基)己酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0℃向化合物40-1(1g,5.85mmol)在h2o(6ml)和二噁烷(9ml)中的混合物中加入k2co3(2.02g,14.63mmol)和cbz-cl(1.2g,7.01mmol)。将反应混合物在室温搅拌2h。将混合物用etoac(20ml)洗涤。将水相用1nhcl酸化为ph=3并用etoac(25mlx2)萃取,将有机层经na2so4干燥,滤过并减压浓缩得到粗化合物40-2,其为油状物(1.5g,收率:84.3%).lcms:(10-80,ab,2min,esi),0.954min,ms=305.8[m+1],327.8[m+na+]1hnmrdmso-d6400mhzδ7.65-7.63(d,j=8.0hz,1h),7.37-7.29(m,6h),6.94-6.90(m,2h),5.01(s,2h),4.2-4.1(m,1h),3.31-3.27(m,1h),3.12-3.06(m,1h).步骤2.在0℃向化合物40-2(2.0g,6.55mmol)、化合物40-3(829.15mg,7.2mmol)在无水thf(25ml)中的溶液中加入dcc(1.49g,7.21mmol)。将混合物在室温在氮气下搅拌16h。将混合物滤过并将滤液浓缩得到粗化合物40-4,其无需进一步纯化即可直接用于下一步(2.2g,收率:84.6%).lcms:(10-80,ab,2min,esi),1.040min,ms=424.8[m+na+]步骤3.在室温向化合物40-5(5g,10.7mmol)在dcm(80ml)中的搅拌溶液中经注射器逐滴加入哌啶(4.5g,52.8mmol)。在将混合物在室温搅拌30min后,将其减压浓缩,并将残留物在etoac(30ml)和h2o(50ml)之间分配。将水相浓缩得到粗化合物40-6(2.0g,76%),其为白色固体,其直接用于下一步。步骤4.向化合物40-4(980mg,2.44mmol)在dme(10ml)中的溶液中加入化合物40-6(500mg,2.03mmol)和nahco3(374mg,4.46mmol)在水(10ml)中的溶液。在将混合物在室温搅拌16h后,将其用etoac(20ml)洗涤并将水相用15%柠檬酸溶液酸化至ph=3。将所得的混悬液用etoac(30mlx2)萃取。将有机层经制备性hplc纯化,得到化合物40-7,其为白色固体(200mg,18.4%).lcms:(10-80,ab,2min,esi),1.123min,ms=434.1[m+1-boc+],556.1[m+na+]步骤5.向化合物40-7(300mg,0.563mmol)在dcm/meoh(20ml/10ml)中的溶液中加入4-氨基-苯基-甲醇(40-8)(103.9mg,0.845mmol)和eedq(208.82mg,0.845mmol)。在将混合物在室温搅拌16h后,将其浓缩。将残留物经柱色谱纯化(pe:etoac=2:3)得到化合物40-9,其为白色固体(260mg,收率:72.3%).lcms:(5-95,ab,1.5min,esi),0.880min,ms=539.0[m+1-boc+],661.0[m+na+]1hnmrcdcl3400mhz,δ8.51(s,1h),7.44(d,j=8hz,2h),7.24-7.19(m,6h),7.05-7.03(m,1h),6.78-6.73(m,3h),5.52(d,j=3.2hz,1h),5.03(s,2h),4.56(s,2h),4.46-4.39(m,2h),3.25(d,j=5.6hz,2h),2.98(s,2h),1.87-1.83(m,1h),1.39(d,j=7.6hz,2h),1.35(s,9h),1.25-1.17(m,2h).步骤6.在0℃向化合物40-9(250mg,0.39mmol)在无水dmf(5ml)中的溶液中加入pnp碳酸盐(237.14mg,0.78mmol)和dipea(251.6mg,1.95mmol)。将混合物在室温搅拌16h。混合物(40-11)无需进一步纯化即可直接用于下一步。步骤7.在室温向40-11的混合物中加入诺氟沙星(249.1mg,0.78mmol)。在将混合物在室温搅拌1h后,将其经制备性hplc纯化,得到粗化合物40-13(220mg收率:57.3%).lcms:(5-95,ab,1.5min,esi),0.964min,ms=442.6[1/2m+1],984.4[m+1]步骤8.在室温向化合物40-13(120mg,0.12mmol)中加入dcm:tfa混合物(5:1,3ml)。在将混合物在室温搅拌1h后,将其用氨水调节至ph=7,然后浓缩,将残留物经制备性hplc纯化,得到实施例40(29mg,收率:16.9%).lcms:(5-95,ab,1.5min,esi),0.826min,ms=884.3[m+1],442.8[1/2m+1]1hnmrdmso-d6400mhz,δ10.23(s,1h),8.93(s,1h),8.44(s,1h),8.42(s,0.5h,hcooh),7.92(d,j=13.2hz,1h),7.93-7.61(m,3h),7.33-7.25(m,8h),7.20-7.16(m,1h),6.88-6.86(m,2h),5.63(s,2h),4.97(s,2h),4.58-4.53(m,2h),4.40-4.31(m,1h),4.30-4.19(m,1h),3.58(s,4h),3.28-3.19(m,4h),3.19-3.03(m,2h),3.04-2.96(m,2h),2.69-2.64(m,2h),1.73-1.67(m,2h),1.57-1.49(m,2h),1.47-1.34(m,3h),1.32-1.28(m,2h).实施例41.7-(4-((4-((s)-2-((s)-2-乙酰氨基-3-甲基丁酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在将化合物41-1(470.6mg,4mmol)在水(10ml)中的溶液超声6min后,历时4min加入ac2o。将混合物浓缩并将残留物溶于meoh,滤过,浓缩得到粗的41-2,其为白色固体(350mg,55%).1hnmrdmso-d6400mhz,δ7.94-7.92(d,j=8.01h),4.10-4.08(m,1h),2.01-1.99(m,1h),1.84(s,1h),0.83-0.80(m,6h)步骤2.在室温向化合物41-2(160mg,1mmol)和ho-su(122mg,1.05mmol)在thf(10ml)中的溶液中加入dcc(218mg,1.05mmol)。将混合物在室温在氮气下搅拌16h。将混合物滤过并将滤液浓缩得到41-3(242mg,收率:95%).步骤3.将化合物41-3(242mg,0.94mmol)、41-4(265mg,0.94mmol)溶于dmf(15ml)。在将反应混合物在室温搅拌3h后,将其滤过并经制备性hplc纯化,得到41-5(70mg,收率:17.7%).步骤4.在室温向化合物41-5(60mg,0.142mmol)在无水dmf(3ml)中的溶液中加入pnp碳酸盐(87mg,0.285mmol)和dipea(56mg,0.427mmol)。将混合物在室温搅拌16h。加入诺氟沙星(91mg,0.285mmol)。将混合物在室温搅拌另外的1h。将混合物浓缩,滤过并经制备性hplc纯化(fa)得到实施例41(40mg,收率:37%).lcms:(5-95,ab,1.5min,esi),0.784min,ms=767.1[m+1]1hnmrdmso-d6400mhz,δ9.96(s,1h),8.93(s,1h),8.10(d,j=7.6hz,1h),7.92(d,j=12.4hz,1h),7.86(d,j=8.8hz,1h),7.58(d,j=8.4hz,2h),7.31(d,j=8.8hz,2h),7.18(d,j=7.2hz,1h),5.96-5.94(m,1h),5.38(s,2h),5.03(s,2h),4.58-4.53(m,2h),4.38-4.32(m,1h),4.17-4.14(m,1h),3.58(s,4h),3.26(s,4h),3.00-2.91(m,2h),1.96-1.92(m,1h),1.86(s,3h),1.68-1.55(m,2h),1.38(m,5h),0.85-0.80(m,6h).实施例42:7-(4-{4-[(s)-6-氨基-2-((s)-2-苄基氧基羰基氨基-3-苯基-丙酰基氨基)-已酰基氨基]-苄基氧基羰基}-哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢-喹啉-3-羧酸步骤1.向5ml42-1(200mg,0.25mmol)的thf溶液中加入diea(0.18ml,0.99mmol),然后加入氯甲酸(4-硝基苯基)酯(150mg,0.75mmol),随后加入吡啶(0.03ml,0.32mmol)。将反应混合物在28℃搅拌过夜。将混合物浓缩至干,溶于etoac,经饱和nh4cl、盐水洗涤。将有机层经mgso4干燥,浓缩。将粗物质用乙醚研磨,滤过得到浅黄色固体42-2(190mg,79%).lcms(esi):m/z970.7[m+h+].步骤2.向1-乙基-6-氟-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-羧酸(59mg,0.18mmol)在2mldmf中的混悬液中加入diea(0.11ml,0.62mmol),然后加入一份42-2(120mg,0.12mmol),缓慢变成黄色溶液直到反应完成。将反应混合物倒入冰水,用dcm萃取。将有机层经饱和nh4cl、盐水洗涤,经mgso4干燥,浓缩得到42-3(140mg,99%).lcms(esi):m/z1150.9[m+h+].步骤3.向10ml42-3(145mg,0.13mmol)的dcm溶液中加入苯甲醚(0.05ml,0.50mmol),冷却至冰浴,然后逐滴加入tfa(0.1ml,1.00mmol)。在10mins后反应完成,移去冰浴。将反应混合物浓缩至干,溶于dcm,经饱和nahco3/水、盐水洗涤。将有机层经mgso4干燥,浓缩。将粗物质用dcm研磨,滤过得到浅黄色固体42(38mg,34%).lcms(esi):m/z878.7[m+h+].1hnmr(400mhz,dmso-d6)δ10.13(s,1h),8.86(s,1h),8.26(s,1h),7.91(d,j=12.7hz,1h),7.62(d,j=8.2hz,2h),7.48(d,j=9.2hz,1h),7.38–7.10(m,13h),5.07(s,2h),4.95(s,2h),4.51(s,2h),4.40(s,1h),4.33(s,1h),3.61(s,4h),3.03(d,j=12.2hz,2h),1.69(d,j=15.5hz,3h),1.39(t,j=6.8hz,8h).实施例43.7-(4-((4-((s)-2-((s)-2-(苄基氧基羰基氨基)-3-(噻吩-2-基)丙酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在10℃向化合物43-1(178mg,0.665mmol)和化合物43-2(79mg,0.688mmol)在thf(3ml)中的溶液中加入dcc(149mg,0.721mmol)在thf(0.5ml)中的溶液。将溶液在10℃搅拌6h。将固体滤过,并除去溶剂。将残留物溶于dcm(5ml)。将混合物静置1h并滤过除去更多的dcu。将滤液蒸发得到粗化合物43-3(245mg).1hnmr(400mhz,cdcl3)δ7.21(d,j=5.2hz,1h),7.02-6.96(m,2h),5.30-4.93(m,1h),3.54-3.40(m,2h),2.82(s,4h),1.44(s,9h).步骤2.向化合物43-3(245mg,0.665mmol)在dme(2ml)中的溶液中加入化合物43-4(175mg,0.998mmol)在水(2ml)中的溶液。将溶液在10℃搅拌16h。加入饱和nahco3溶液(3ml),并将混合物用dcm(15mlx2)洗涤。将水层用1mhcl溶液酸化至ph3,并用etoac(15mlx3)萃取。将有机层经na2so4干燥,滤过,浓缩得到粗产物43-5(270mg).lcms(esi):m/z429.2[m+h+].步骤3.将化合物43-5(270mg,0.63mmol)在hcl/meoh(4m,5ml)中的溶液在10℃搅拌2h。减压除去溶剂并将残留物溶于h2o/thf(v/v1:1,3ml),然后加入na2co3(134mg,1.26mmol)和cbzcl(167mg,0.979mmol)。将混合物在10℃搅拌2h,然后加入lioh.h2o(79mg,1.89mmol)并将所得的溶液在10℃搅拌1h。除去有机溶剂并将水溶液用dcm(15mlx2)洗涤。将水层用1mhcl溶液酸化至ph2并用etoac(15mlx3)萃取。将有机层经na2so4干燥,滤过,浓缩得到粗产物(182mg).lcms(esi):m/z463.2[m+h+].步骤4.在氮气下向化合物43-6(180mg,0.389mmol)和(4-氨基苯基)甲醇(144mg,1.17mmol)在dmf(4ml)中的溶液中加入eedq(289mg,1.17mmol)。将混合物在30℃搅拌16h。将混合物经制备性hplc纯化,得到43-6(80mg,36%).1hnmr(400mhz,meod)δ7.55-7.53(m,2h),7.32-7.27(m,7h),7.17-7.15(m,1h),6.88-6.84(m,2h),5.11-5.03(m,2h),4.55(s,2h),4.50-4.39(m,2h),3.38-3.36(m,1h),3.19-3.05(m,3h),1.89-1.50(m,4h).lcms(esi):m/z568.1[m+h+].步骤5.在10℃向43-7(20mg,0.035mmol)在dmf(2ml)中的溶液中加入pnp碳酸盐(21mg,0.070mmol)和dipea(18mg,0.141mmol)。在将混合物在10℃搅拌24h后,加入诺氟沙星(17mg,0.053mmol)和dipea(9mg,0.0695mmol)。将所得的溶液在10℃搅拌1h并经制备性hplc纯化,得到实施例43(7mg,22%).1hnmr(400mhz,dmso–d6)δ10.16(s,1h),8.95(s,1h),8.33-8.32(m,1h),7.94(d,j=12.0hz,1h),7.63-7.57(m,3h),7.35-7.19(m,10h),6.91-6.90(m,2h),6.04(m,1h),5.44(s,2h),5.06(s,2h),5.00(s,2h),4.59-4.29(m,4h),3.61(s,4h),3.21(s,4h),3.04-2.94(m,4h),1.71-1.61(m,2h),1.45-1.38(m,5h).lcms(esi):m/z913.3[m+h+].实施例44.7-(4-((4-((s)-2-((s)-2-(2-(6-(2,5-二氧代吡咯烷-1-基)己酰氨基)乙酰氨基)-3-甲基丁酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.将化合物44-1(600mg,2.14mmol)和化合物44-2(936mg,2.14mmol)溶于dmf(5ml)并在室温搅拌3h得到44-3,其为混合物。步骤2.向化合物44-3(2.14mmol)在dmf(10ml)中的溶液中加入化合物44-4(0.6ml,4.5mmol)并在室温搅拌1h。将混合物浓缩并用mtbe(30mlx3)洗涤,滤过并将滤液浓缩得到44-5(597mg,收率:70%).步骤3.向化合物44-7(75mg,1mmol)在dme(10ml)中的溶液中加入化合物44-6(340mg,1.1mmol)和nahco3(252mg,3mmol)在水(10ml)中的溶液。将混合物在室温搅拌16h。将混合物用etoac洗涤并用10%hcl酸化至ph=3。将所得的混悬液用etoac萃取。将合并的有机层浓缩得到粗化合物44-8(350mg)步骤4.向44-8(350mg,1.3mmol)和44-9(157mg,1.36mmol)在thf(15ml)中的溶液中加入dcc(281mg,1.36mmol)。在将其在氮气下搅拌16h后,将其浓缩得到44-10(480mg,收率:100%).步骤5.将化合物44-10(404mg,1.1mmol)、化合物44-5(835mg,2.2mmol)溶于dmf(6ml)。在将反应混合物在室温搅拌3h后,将其滤过并经制备性hplc纯化,得到化合物44-11(110mg,收率:16%).步骤6.在室温向化合物44-11(85mg,0.135mmol)在无水dmf(5ml)中的溶液中加入pnp碳酸盐(82mg,0.27mmol)和dipea(52mg,0.40mmol)。将其在室温搅拌16h。加入诺氟沙星(85mg,0.27mmol)并将混合物在室温搅拌另外的1h。将混合物浓缩,滤过并经制备性hplc纯化(fa)得到实施例44(70mg,收率:51%).lcms:(5-95,ab,1.5min,esi),0.794min,ms=977.3[m+1],489.3[1/2m+1]1hnmrdmso-d6400mhz,δ15.32(s,1h),9.90(s,1h),8.96(s,1h),8.17(s,2h),8.11(s,1h),7.95(d,j=13.6hz,1h),7.82(d,j=8.4hz,1h),7.62(d,j=8.8hz,2h),7.33(d,j=8.4hz,2h),7.21(d,j=9.6hz,1h),5.98(s,1h),5.41(s,2h),5.06(s,2h),4.59(d,j=7.2hz,2h),4.35(s,1h),4.22(d,j=14.8hz,1h),3.76-3.73(m,2h),3.61(s,4h),3.28(s,4h),3.12-2.86(m,2h),2.60(s,4h),2.07(d,j=6.8hz,2h),1.98(s,1h),1.80-1.56(m,2h),1.47-1.39(m,9h),1.18(s,2h),0.87-0.82(m,6h).实施例45.7-(4-((4-((s)-2-((s)-2-(苄基氧基羰基氨基)-3-(3-氟苯基)丙酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在10oc向化合物45-1(178mg,0.63mmol)和化合物45-2(76mg,0.662mmol)在thf(3ml)中的溶液中加入dcc(143mg,0.693mmol)在thf(0.5ml)中的溶液。在将溶液在10℃搅拌3h后,将固体滤过,并除去溶剂。将残留物溶于dcm(5ml)。将混合物静置1小时,然后滤过除去更多的dcu。将滤液蒸发得到粗化合物45-3(250mg).1hnmr(400mhz,cdcl3)δ7.69-7.27(m,1h),7.23-6.95(m,3h),4.98-4.85(m,1h),3.33-3.14(m,2h),2.82(s,4h),1.37(s,9h).步骤2.向化合物45-3(250mg,0.63mmol)在dme(2ml)中的溶液中加入化合物45-4(173mg,0.986mmol)在水(2ml)中的溶液。将溶液在10℃搅拌16h。加入饱和nahco3溶液(3ml),并将混合物用dcm(5mlx2)洗涤。将水层用1mhcl溶液酸化至ph3,用etoac(10mlx3)萃取。将有机层经na2so4干燥,滤过,浓缩得到粗产物45-5(280mg).lcms(esi):m/z441.2[m+h+].步骤3.在将化合物45-5(240mg,0.545mmol)在4mhcl/meoh(5ml)中的溶液在10℃搅拌2h后,减压除去溶剂并将残留物溶于h2o/thf(v/v1:1,3ml)。加入na2co3(116mg,1.09mmol)和cbzcl(139mg,0.817mmol)。将混合物在10℃搅拌2h,然后加入lioh.h2o(67mg,1.63mmol)并将所得的溶液在10℃搅拌1h。除去溶剂,并将水溶液用dcm(5mlx2)洗涤并用1mhcl溶液酸化至ph2。将其用etoac(10mlx3)萃取。将合并的有机层经na2so4干燥,滤过,浓缩得到粗产物45-6(198mg).lcms(esi):m/z475.2[m+h+].步骤4.在氮气下向化合物45-6(192mg,0.405mmol)和(4-氨基苯基)甲醇(150mg,1.21mmol)在dmf(4ml)中的溶液中加入eedq(300mg,1.21mmol)。在将混合物在30℃搅拌16h后,将其经制备性hplc纯化,得到45-7(70mg,30%).1hnmr(400mhz,meod)δ7.55-7.53(m,2h),7.31-7.17(m,8h),7.05-7.00(m,2h),6.91-6.86(m,1h),5.07-4.99(m,2h),4.56(s,2h),4.49-4.41(m,2h),3.17-3.06(m,3h),2.91-2.85(m,1h),1.87-1.50(m,4h).lcms(esi):m/z580.2[m+h+].步骤5.在10℃向45-7(20mg,0.0345mmol)在dmf(2ml)中的溶液中加入pnp碳酸盐(21mg,0.069mmol)和dipea(18mg,0.139mmol)。在将混合物在10℃搅拌24h后,加入诺氟沙星(17mg,0.053mmol)和dipea(9mg,0.0695mmol)。将反应混合物在10℃搅拌1h并经制备性hplc纯化,得到实施例45(17mg,53%).1hnmr(400mhz,dmso-d6)δ15.32(br,1h),10.12(s,1h),8.96(s,1h),8.30-8.28(m,1h),7.94(d,j=13.2hz,1h),7.62(d,j=8.4hz,2h),7.52(d,j=8.8hz,1h),7.35-7.13(m,11h),7.04-7.00(m,1h),5.99(m,1h),5.43(s,2h),5.06(s,2h),4.95(s,2h),4.61-4.33(m,4h),3.61(s,4h),3.32(s,4h),3.06-2.66(m,4h),1.75-1.60(m,2h),1.45-1.35(m,5h).lcms(esi):m/z925.5[m+h+].实施例46.7-(4-((4-((s)-2-((r)-2-(苄基氧基羰基氨基)-4,4,4-三氟丁酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-2-羧酸步骤1.在冰浴中向化合物46-1(200mg,1.27mmol)在thf(10ml)中的溶液中加入氯甲酸苄酯(226mg,1.33mmol)。逐滴加入na2co3(270mg,2.54mmol)在水(10ml)中的溶液,同时在7℃或更低温度剧烈搅拌。在将混合物搅拌16h后,分离有机层,用稀hcl(0.1m,60ml)和饱和nahco3溶液(60ml)洗涤,经无水na2so4干燥,浓缩得到化合物46-2,其为白色固体(250mg,67.6%).步骤2.在0℃向化合物46-2(250mg,0.887mmol)、1-羟基吡咯烷-2,5-二酮(102mg,0.887mmol)在无水thf(10ml)中的混合物中加入dcc(183mg,0.887mmol)。将混合物在室温搅拌16h,并滤过。将滤液真空浓缩得到粗产物化合物46-3,其无需进一步纯化即可用于下一步。步骤3.在0℃向化合物46-3(710mg,1.87mmol)在dme和h2o混合物(10ml/10ml)中的溶液中加入化合物46-4(327mg,1.87mmol)和nahco3(236mg,2.8mmol)。在将混合物在室温搅拌16h后,将其用etoac(50mlx3)萃取。将有机层用盐水(50ml)洗涤,经na2so4干燥,并真空浓缩。将粗产物经制备性hplc纯化,得到预期产物化合物46-5,其为白色固体(421mg,50.2%).lcms(esi):m/z449.2[m+h+].步骤4.向化合物46-5(410mg,0.915mmol)在dcm(10ml)中的溶液中加入eedq(448mg,1.83mmol)和4-氨基苯基-甲醇(225g,1.83mmol)。在将混合物在0℃搅拌1h后,除去溶剂并将残留物用制备性hplc和sfc分离纯化,得到46-6a和46-6b.46-6a1hnmr(400mhz,meod-d4)δ7.54(d,j=8.4hz,2h),7.35-7.29(m,7h),5.12(s,2h),4.55-4.49(m,4h),3.30-3.03(m,2h),2.83-2.53(m,2h),1.93-1.75(m,4h).lcms:m/z553.9[m+h+].46-6b1hnmr(400mhz,dmso-d6)δ10.94(s,1h),9.31(d,j=9.2hz,1h),8.53(d,j=9.6hz,1h),8.26(d,j=9.6hz,2h),8.00-7.96(m,5h),7.90(d,j=9.6hz,2h),6.45-6.44(m,1h),5.81(s,1h),5.48-5.36(m,3h),4.77-4.69(m,4h),3.09-2.95(m,2h),2.79-2.64(m,2h),1.64-1.20(m,4h).lcms(esi):m/z553.9[m+h+].步骤5.向46-6a(20mg,0.036mmol)在无水dcm(2ml)中的溶液中加入pnp碳酸盐(22mg,0.072mmol)和dipea(14mg)。将混合物回流加热16h。除去溶剂后,将残留物溶于dmf(5ml)。加入dipea(9mg,0.072mmol)和诺氟沙星(23mg,0.072mmol)。将混合物在室温搅拌1h。除去溶剂并将残留物经制备性hplc纯化,得到实施例46.1hnmr(400mhz,dmso-d6)δ15.33(s,1h),10.11(s,1h),8.97(s,1h),8.34(d,j=7.6hz,1h),7.95(d,j=12.8hz,1h),7.78(d,j=8.4hz,1h),7.60(d,j=8.4hz,2h),7.37-7.21(m,8h),6.00-5.98(m,1h),5.97(s,2h),5.43-5.03(m,4h),4.61-4.37(m,4h),3.61(s,4h),3.31(s,4h),3.04-2.49(m,4h),1.70-1.20(m,7h).lcms(esi):m/z450.3[m/2+h+].实施例47.7-(4-((4-((r)-3-(2-氨基-2-氧代乙基硫基)-2-((s)-2-(苄基氧基羰基氨基)-3-甲基丁酰氨基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.将化合物47-1(120mg,0.411mmol)在4mhcl/1,4-二噁烷(5ml)中的混合物在室温搅拌2h。将混合物浓缩得到47-2.lcms(esi):m/z193.0[m+h+].步骤2.向化合物47-2(1.3g,6.85mmol)在dcm(20ml)中的溶液中加入化合物47-3(2.065g,8.22mmol)、dipea(4.418g,34.25mmol)、hobt(1.018g,7.535mmol)和edci(1.7g,8.905mmol)。将混合物在室温搅拌16h。将溶液滤过并且固体无需进一步纯化即可用于下一步(47-4).lcms(esi):m/z425.9[m+h+].步骤3.向化合物47-4(500mg,1.176mmol)在thf/meoh/h2o(6ml/2ml/2ml)中的溶液中加入lioh(85mg,7.05mmol)。将混合物在室温搅拌1.5h。将混合物浓缩并将残留物经制备性hplc纯化,得到化合物47-5.lcms(esi):m/z412.0[m+h+].步骤4.向化合物47-5(600mg,1.46mmol)在dcm/dmf(10ml/2ml)中的溶液中加入4-氨基-苯基-甲醇(216mg,1.75mmol)和eedq(541mg,2.19mmol)。将混合物在室温搅拌16h。将混合物用h2o淬灭。将残留物经制备性hplc纯化,然后经sfc纯化,得到47-6a和47-6b.47-6a1hnmr(400mhz,meod-d4)δ7.57(d,j=8.4hz,2h),7.35-7.26(m,7h),5.06(s,2h),4.71-4.68(m,1h),4.54(s,2h),3.97(d,j=6.4hz,2h),3.25(m,2h),3.13-3.08(m,1h),3.0-2.93(m,1h),2.13-2.01(m,1h),0.98-0.95(m,6h).lcms(esi):m/z517.2[m+h+].47-6b1hnmr(400mhz,dmso-d6)δ9.93(m,1h),8.597-8.56(m,1h),7.61-7.1(m,11h),5.13-5.00(m,3h),4.63-4.59(m,1h),4.44-4.41(m,2h),3.92-3.90(m,2h),3.17-2.84(m,4h),2.00-1.96(m,1h),0.90-0.89(m,6h).lcms(esi):m/z517.1[m+h+].步骤5.向47-6a(40mg,0.0775mmol)在dcm(3ml)中的溶液中加入碳酸二-(4-硝基-苯基)酯(20mg,0.093mmol)和dipea(15mg,0.116mmol)。将混合物在45℃搅拌16h。将溶液浓缩并溶于dmf(3ml),并加入诺氟沙星(50mg,0.155mmol)。将混合物在室温搅拌1h。除去溶剂后,将残留物经制备性hplc纯化,得到实施例47(5.5mg).1hnmr(400mhz,dmso-d6)δ10.25(s,1h),8.93-8.89(m,1h),8.40-8.34(m,2h),7.63-7.61(m,4h),7.36-7.35(m,8h),7.13(m,2h),5.06-5.03(4h),4.62-4.52(m,3h),3.94-3.91(m,1h),3.36(m,4h),3.19(m,4h),3.00-2.86(m,3h),2.03-1.95(m,1h),1.38(m,3h),0.88-0.83(m,6h).lcms(esi):m/z862.4[m+h+].实施例48.7-(4-((4-((s)-2-((s)-2-(苄基氧基羰基氨基)-3-(呋喃-2-基)丙酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0oc向化合物48-1(1.0g,6.45mmol)在thf和nahco3溶液中的混合物中经注射器加入cbzcl。将反应混合物在室温搅拌2h并经制备性hplc纯化,得到48-2(收率:32%).步骤2.在0℃向化合物48-2(380mg,1.31mmol)、化合物48-3(151mg,1.31mmol)在thf(25ml)中的溶液中加入dcc(271mg,1.31mmol)。将混合物在室温在氮气下搅拌16h。将溶液滤过并将滤液浓缩得到48-4,其无需进一步纯化即可用于下一步(收率:90%).步骤3.向化合物48-4(540mg,1.38mmol)在dme(15ml)中的溶液中加入化合物48-5(364mg,2.07mmol)和nahco3(174mg,2.07mmol)在水(15ml)中的溶液。将混合物在室温搅拌16h。将混合物用etoac洗涤并用10%hcl酸化至ph3.0。将所得的混悬液用etoac萃取。将合并的有机层浓缩得到化合物48-6(收率:90%).lcms:(10-80,ab,2min,esi),0.826min,ms=447.1[m+1]步骤4.向化合物48-6(420mg,0.94mmol)在dcm/meoh(20ml/10ml)中的溶液中加入4-氨基-苯基-甲醇(174mg,1.4mmol)和eedq(495mg,1.88mmol)。将混合物在室温搅拌16h。将混合物用h2o淬灭。将残留物经制备性hplc和sfc纯化,得到48-8(收率:50%).1hnmrdmso-d6400mhz,δ9.98(s,1h),8.20(d,j=8hz,1h),7.56-7.49(m,3h),7.37(s,1h),7.35-7.30(m,5h),7.24(d,j=8.8hz,3h),6.33-6.32(m,1h),6.13(d,j=3.2hz,1h),5.98-5.95(t,j=6.0hz,1h),5.41(s,2h),5.11-5.08(t,j=5.6hz,1h),4.99(d,j=13.2hz,2h),4.44-4.35(m,3h),3.33-2.83(m,4h),1.71-1.58(m,2h),1.44-1.34(m,2h).步骤5.在0℃向化合物48-9(30mg,0.06mmol)在dmf(5ml)中的溶液中加入中的溶液pnp碳酸盐(37mg,0.12mmol)和dipea(24mg,0.18mmol)。将混合物在室温搅拌16h。混合物(48-10)无需进一步纯化即可用于下一步(收率:95%)lcms:(10-80,ab,2min,esi),1.092min,ms=717.1[m+1]步骤6.将来自最后一步的48-10和诺氟沙星的混合物在室温搅拌1h。将残留物经制备性hplc纯化,然后经sfc纯化,得到实施例48.(收率:30%)1hnmrdmso-d6400mhzδ10.08(s,1h),8.96(s,1h),8.22(d,j=7.2hz,1h),7.95(d,j=13.2hz,1h),7.62(s,1h),7.60(s,1h),7.53(d,j=8.4hz,1h),7.50(s,1h),7.36-7.33(m,5h),7.30(d,j=7.6hz,4h),7.21(d,j=7.2hz,1h),6.33-6.32(m,1h),6.13(d,j=2.4hz,1h),5.99-5.96(m,1h),5.42(s,2h),5.07(s,2h),5.01(d,j=1.6hz,2h),4.61-4.56(m,2h),4.45-4.35(m,2h),3.62(d,j=10.4hz,5h),3.06-3.01(m,2h),2.89-2.83(m,2h),2.55-2.45(m,2h),1.71-1.58(m,2h),1.42(s,5h).实施例49.7-(4-((4-((s)-2-((s)-2-(苄基氧基羰基氨基)-3-甲基丁酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在室温将化合物49-1(100mg,0.26mmol)和化合物49-2(138mg,0.38mmol)溶于dmf(5ml)。将反应混合物在室温搅拌3h,滤过并经制备性hplc纯化,得到49-3(100mg,收率:54%).步骤2.在室温向化合物49-3(60mg,0.142mmol)在无水dmf(3ml)中的溶液中加入pnp碳酸盐(87mg,0.285mmol)和dipea(56mg,0.427mmol)。将混合物在室温搅拌16h。加入诺氟沙星(91mg,0.285mmol)。将混合物在室温搅拌另外的1h。将混合物浓缩,滤过并经制备性hplc纯化(fa)得到实施例49(40mg,收率:37%).lcms:(5-95,ab,1.5min,esi),0.866min,ms=859.2[m+1]1hnmrdmso-d6400mhz,δ15.32-15.28(m,1h),10.08(s,1h),8.96(s,1h),8.11(d,j=7.2hz,1h),7.94(d,j=13.2hz,1h),7.61(d,j=8.4hz,2h),7.37-7.30(m,8h),7.21(d,j=7.2hz,1h),5.78(d,j=4.8hz,1h),5.41(s,2h),5.05(d,j=9.6hz,4h),4.58(d,j=7.2hz,2h),4.41(d,j=5.6hz,1h),3.93(s,1h),3.33(s,4h),3.04-2.93(m,2h),2.00-1.95(m,1h),1.68(s,2h),1.60-1.58(m,5h),1.42(d,j=7.2hz,6h).实施例50.7-(4-((4-((s)-2-((s)-2-(苄基氧基羰基氨基)-3-甲基丁酰氨基)-3-(哌啶-4-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.在0℃将dcm/tfa(5:1,v:v)的混合物(1ml)加至实施例56(50mg,52mmol)。将混合物在0℃搅拌1h。lcms显示80%预期产物和20%stm。将混合物经制备性hplc纯化(fa),得到实施例50(31.2mg,70%).lcms:(5-95,ab,1.5min,esi),0.811min,ms=856.2[m+1],428.8[1/2m+1]1hnmr甲醇-d4400mhz,δ8.81(s,1h),8.54(s,1h),7.98-7.95(m,1h),7.59-7.57(m,2h),7.36-7.32(m,7h),7.2-7.1(m,1h),5.12-5.09(m,4h),4.7-4.4(m,3h),3.88-3.86(m,1h),3.70(m,4h),3.3(m,4h),3.0-2.8(m,2h),2.1-1.7(m,6h),1.6-1.3(m,5h),0.98-0.96(m,6h).实施例51:7-(4-{4-[(s)-2-((s)-2-苄基氧基羰基氨基-3-甲基-丁酰基氨基)-丙酰基氨基]-苄基氧基羰基}-哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢-喹啉-3-羧酸实施例51使用如实施例42的操作制备。步骤1.向1-乙基-6-氟-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-羧酸(129mg,0.40mmol)在2mldmf中的混悬液中加入diea(0.30ml,1.69mmol),然后一份加入51-1(120mg,0.34mmol),缓慢变成黄色溶液直到反应完成。将反应混合物倒入冰水,用dcm萃取。将有机层经饱和nh4cl、盐水洗涤,经mgso4干燥,浓缩,经制备性hplc纯化,得到51(125mg,48%).lcms(esi):m/z773.3[m+h+].1hnmr(400mhz,dmso-d6)δ15.29(s,1h),9.98(s,1h),8.95(s,1h),8.14(d,j=6.8hz,1h),7.95(d,j=13.1hz,1h),7.59(d,j=8.3hz,2h),7.47–7.12(m,8h),5.05(d,j=9.9hz,4h),4.70–4.48(m,2h),4.42(t,j=7.0hz,1h),3.91(t,j=7.8hz,1h),3.61(s,4h),1.98(d,j=6.8hz,1h),1.53–1.14(m,6h),0.86(dd,j=17.7,6.7hz,6h).实施例52.7-(4-((4-((s)-2-((r)-2-(苄基氧基羰基氨基)-3-(三甲基甲硅烷基)丙酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在10℃向52-1(3.31g,10.0mmol)在dcm(10ml)中的搅拌溶液中加入dbu(1.67g,11.0mmol)并在室温搅拌1h。在-78℃向(cocl)2(1.83g,14.4mmol)在dcm(30ml)中的搅拌溶液中加入dmso(1.28g,16.32mmol)。在15min后,历时5min加入化合物52-1(1.0g,9.60mmol)和dbu的混合物。在30min后,加入et3n(3.59g,35.52mmol),并在30min后,在-78℃加入叶立德52-2。在将其搅拌30min后,将反应混合物温热至室温并在室温搅拌6h。将混合物用1mhcl溶液淬灭。除去溶剂后,将残留物用etoac(60mlx3)萃取。将有机层用盐水(60ml)洗涤,经na2so4干燥并浓缩。将残留物经制备性hplc纯化,得到化合物52-3(940mg,32%).1hnmr:400mhz,cdcl3,δ7.37-7.30(m,5h),6.58(s,1h),5.15(s,2h),3.76(s,3h),0.16-0.13(s,9h).lcms(esi):m/z308.1[m+h+].步骤2.在室温将wetpd/c(0.1g)加至化合物52-3(0.5g,1.6mmol)在meoh(50ml)中的溶液中。将反应混合物在氢气下(50psi)在室温搅拌4h。将反应混合物滤过并将滤液浓缩得到化合物52-4,其无需进一步纯化即可直接用于下一步。1hnmr:cdcl3,400mhz,δ7.36-7.30(m,5h),5.10(s,2h),4.42-4.36(m,1h),3.72(s,3h),1.17-1.11(dd,j=6.4,14.8hz,1h),0.99-0.93(dd,j=9.2,14.8hz,1h),0.04(s,9h).lcms(esi):m/z310.1[m+h+].步骤3.在0℃向化合物52-4(220mg,0.7mmol)在thf/h2o(5ml/5ml)中的溶液中加入lioh(44mg,1mmol)。将反应混合物温热至室温并搅拌20h。除去溶剂后,将残留物用etoac(20ml)萃取并将水层用1mhcl酸化为ph=2并用etoac(30mlx2)萃取。将有机层用盐水(20mlx2)洗涤,经硫酸钠干燥并浓缩。将残留物经制备性hplc纯化,得到化合物52-5.lcms(esi):m/z280.1[m+h+].步骤4.在0℃向化合物52-5(145mg,0.49mmol)和52-6(57mg,0.495mmol)在无水thf(20ml)中的溶液中逐滴加入dcc(102.3mg,0.495mmol)在无水thf(10ml)中的溶液。将反应混合物在0-5℃搅拌3h。除去溶剂后,将残留物溶于dcm(20ml)。将析出物滤过并将滤液浓缩得到粗产物52-7,其为白色固体,其无需进一步纯化即可用于下一步。步骤5.向化合物52-7(如上获得,0.49mmol)在dme(15ml)和h2o(15ml)中的溶液中加入化合物52-8(129.5mg,0.74mmol)和nahco3(61.8mg,0.74mmol)。将混合物在室温在氮气下搅拌16h。除去溶剂后,残留物(52-9)无需进一步纯化即可用于下一步。1hnmr:dmso-d6,400mhz,δ7.97(dd,j=7.6,29.2hz,1h),7.35-7.29(m,5h),5.93-5.92(m,1h),5.36(s,2h),5.07-4.98(m,2h),4.15-4.07(m,2h),2.95-2.90(m,2h),1.75-1.64(m,1h),1.58-1.49(m,1h),0.98-0.87(m,2h),-0.01(s,9h).步骤6.在0℃在氮气下向中化合物52-9(160mg,0.35mmol)和(4-氨基苯基)甲醇(65.2mg,0.53mmol)在无水dcm(10ml)的溶液中加入eedq(175mg,0.71mmol)。将反应混合物温热至室温并在氮气下搅拌1h。除去溶剂后,将残留物经制备性hplc和sfc纯化,得到52-10and52-11.lcms:(10-80,ab,2min,esi),1.151min,ms=558.1[m+1]1hnmr甲醇-d4,400mhz,δ9.99(s,1h),7.92(d,j=8.0hz,1h),7.55(d,j=8.8hz,1h),7.45-7.24(m,8h),6.01-5.98(m,1h),5.41(s,2h),5.11(t,j=5.2hz,1h),5.05(d,j=4.8hz,2h),4.44(d,j=5.6hz,3h),4.15-4.08(m,1h),3.08-2.87(m,2h),1.72-1.41(m,4h),1.02-0.90(m,2h),0(s,9h).lcms:(10-80,ab,2min,esi),1.130min,ms=558.1[m+1]1hnmr甲醇-d4,400mhz,δ9.89(s,1h),8.16(d,j=8.0hz,1h),7.59-7.57(d,j=8.8hz,2h),7.45-7.24(m,8h),6.01-5.95(m,1h),5.41(s,2h),5.11(t,j=5.6hz,1h),5.03(d,j=11.2hz,2h),4.43(d,j=5.6hz,2h),4.42-4.38(m,1h),4.20-4.12(m,1h),3.05-2.87(m,2h),1.72-1.41(m,4h),0.95(d,j=8.0hz,2h),0(s,9h).步骤7.向52-11(30mg,0.066mmol)在无水dcm(5ml)中的溶液中加入pnp碳酸盐(40.4mg,0.13mmol)和dipea(0.5ml)。将混合物回流加热20h。除去溶剂后,将残留物溶于dmf(3ml)。加入dipea(0.5ml)和诺氟沙星(63.5mg,0.2mmol)。将混合物在室温搅拌2h。将反应混合物经制备性hplc纯化,得到实施例52.lcms:(10-80,ab,2min,esi),1.269min,ms=903.0[m+1]1hnmrdmso-d6,400mhz,δ10.00(s,1h),8.97(s,1h),8.18(d,j=10.4hz,1h),7.94(d,j=13.2hz,1h),7.63(d,j=8.4hz,2h),7.40(d,j=8.4hz,1h),7.35-7.30(m,7h),7.21(d,j=7.6hz,1h),5.96(t,j=6.4hz,1h),5.41(s,2h),5.06(s,2h),5.02(d,j=9.6hz,2h),4.61-4.55(m,2h),4.41-4.36(m,1h),4.21-4.12(m,1h),3.61(s,4h),3.33(s,4h),3.03-2.90(m,2h),1.71-1.68(m,1h),1.58-1.53(m,1h),1.41(t,j=7.2hz,4h),1.42-1.31(m,1h),0.93(d,j=6.8hz,2h),-0.01(s,9h).实施例53.7-(4-((4-((s)-2-((s)-2-(苄基氧基羰基氨基)-4,4,4-三氟丁酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-2-羧酸实施例53使用如实施例46的操作制备,采用来自合成实施例46的中间体。步骤1.向46-6b(23mg,0.041mmol)在无水dcm(2ml)中的溶液中加入pnp碳酸盐(25mg,0.082mmol)和dipea(16mg)。将混合物回流加热16h。除去溶剂后,将残留物溶于dmf(5ml)。加入dipea(16mg,0.123mmol)和诺氟沙星(26mg,0.082mmol),并将混合物在室温搅拌1h。除去溶剂并将残留物经制备性hplc纯化,得到实施例53.1hnmr(400mhz,dmso-d6)δ15.33(s,1h),10.03(s,1h),8.97(s,1h),8.51(d,j=8.0hz,1h),7.45(d,j=13.2hz,1h),7.79(d,j=8.4hz,1h),7.63(d,j=8.4hz,2h),7.36-7.21(m,8h),5.98-5.96(m,1h),5.41(s,2h),5.07-5.01(m,4h),4.59-4.42(m,4h),3.61(s,4h),3.31(s,4h),3.17-2.50(m,4h),1.71-1.60(m,7h).lcms(esi):m/z898.8[m+h+],450.3[m/2+h+].实施例54.7-(4-((4-((s)-2-((s)-2-(苄基氧基羰基氨基)-3-(三甲基甲硅烷基)丙酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸实施例54使用如实施例52的操作制备,采用来自合成实施例52的中间体。lcms:(10-80,ab,2min,esi),1.274min,ms=903.0[m+1]1hnmr(400mhz,dmso-d6)δ10.10(s,1h),8.97(s,1h),7.95(d,j=13.2hz,2h),7.61(d,j=8.4hz,2h),7.40(d,j=8.4hz,1h),7.37-7.29(m,7h),7.21(d,j=10.8hz,1h),5.98(t,j=6.4hz,1h),5.05(d,j=8.8hz,2h),5.01(d,j=13.2hz,2h),4.62-4.56(m,2h),4.43-4.40(m,1h),4.14-4.08(m,1h),3.61(s,4h),3.33(s,4h),3.05-2.91(m,2h),1.76-1.52(m,2h),1.48-1.39(m,5h),1.01-0.89(m,2h),-0.01(s,9h).实施例55.7-(4-((4-((r)-3-(2-氨基乙基硫基)-2-((s)-2-(苄基氧基羰基氨基)-3-甲基丁酰氨基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向化合物555-1(1.55g,10mmol)、55-1a(2.51g,10mmol)和et3n(3.03g,30mmol)在dmf(20ml)中的混合物中加入hatu(3.8g,10mmol)。在将混合物在室温搅拌3h后,将其用etoac(60mlx3)萃取。将有机层用盐水(60mlx3)洗涤,经naso4干燥,真空浓缩并经柱色谱纯化(20%etoac/己烷)得到化合物55-2(3.21g,91.2%).lcms(esi):m/z353.1[m+h+].步骤2.在0℃历时10-15min将三苯基膦(2.87g,10.94mmol)在无水dcm(60ml)中的溶液逐滴加至化合物55-2(3.21g,9.12mmol)和四溴甲烷(4.54g,13.68mmol)在无水dcm中的充分搅拌的溶液。在将混合物在室温搅拌9-10h后,将其用戊烷(200ml)处理并将所得的析出物经滤过除去并用戊烷洗涤若干次。将合并的戊烷溶液用5%nahco3、水、盐水洗涤并经na2so4干燥。蒸发溶剂并将油状物经硅胶柱色谱纯化(己烷:etoac=4:1)得到化合物55-3(3.43g,90.7%).lcms(esi):m/z414.9[m+h+].步骤3.向化合物55-3(3.43g,8.3mmol)在dmf(5ml)中的溶液中加入化合物55-4(1.12g,4.0mmol)和k2co3(1.15g,8.3mmol)。在将混合物在室温搅拌16h后,将其用etoac(100mlx2)萃取。将有机层用盐水(60ml)洗涤,经na2so4干燥,并浓缩得到粗产物化合物55-5(3.67g,86.4%).lcms(esi):m/z412.0[m-boc+h+],534.1[m+na+].步骤4.向化合物55-5(3.67g,6.22mmol)在thf/h2o(30ml/10ml)中的溶液中加入lioh.h2o(2.6g,62.2mmol)。在将混合物在室温搅拌16h后,除去溶剂,并加入水(30ml)。将其用etoac(80mlx3)萃取。将有机层用盐水(60ml)洗涤,经na2so4干燥,真空浓缩得到化合物55-6,,其无需进一步纯化即可用于下一步(3g,96.9%).lcms(esi):m/z398.2[m-boc+h+].步骤5.在0℃向化合物55-6(500mg,1.0mmol)、(4-氨基-苯基)-甲醇(246mg,2mmol)和dipea(258mg,2mmol)在dcm(10ml)中的溶液中加入hatu(380mg,1.0mmol)。在将混合物在0℃搅拌2h后,除去溶剂,并将残留物用制备性hplc和sfc分离纯化,得到55-7a和55-7b.55-7a1hnmr(400mhz,meod)δ7.60(d,j=8.8hz,2h),7.31-7.24(m,7h),5.06(s,2h),4.67-4.64(m,1h),4.53(s,2h),3.88(d,j=7.6hz,1h),3.28-3.11(m,3h),2.89-2.84(m,1h),2.67-2.57(m,2h),2.08-1.99(m,1h),1.41(s,9h),1.01-1.99(m,6h).lcms(esi):m/z503.0[m+h+-boc].55-7b1hnmr(400mhz,meod)δ7.56(d,j=8.8hz,2h),7.34-7.25(m,7h),5.08(s,2h),4.66-4.63(m,1h),4.54(s,2h),3.96(d,j=7.6hz,1h),3.22-3.04(m,3h),2.90-2.80(m,1h),2.69-2.57(m,2h),2.13-2.03(m,1h),1.40(s,9h),0.98-0.94(m,6h).lcms(esi):m/z502.9[m+h+-boc],624.5[m+na+].步骤6.向55-7a(28mg,0.047mmol)在无水dcm(2ml)中的溶液中加入pnp碳酸盐(30mg,0.094mmol)和dipea(0.2ml)。将混合物回流加热16h。除去溶剂后,将残留物溶于dmf(2ml)。加入dipea(0.2ml)和诺氟沙星(29mg,0.094mmol)。将混合物在室温搅拌1h。除去溶剂,并将残留物经制备性hplc纯化,得到化合物55-8(38mg,84.4%).lcms(esi):m/z948.4[m+h+].步骤7.在0℃历时10min向化合物55-8(38mg,0.04mmol)在无水dcm(10ml)中的溶液中加入hcl/ch3oh(4mol/l)。在将混合物在室温搅拌1h后,除去溶剂并将残留物经制备性hplc纯化,得到实施例55,其为白色固体。1hnmr(400mhz,meod)δ8.86(s,1h),7.97(d,j=13.2hz,1h),7.66(d,j=8.4hz,2h),7.34(d,j=8.8hz,2h),7.27-7.22(m,5h),7.14(d,j=7.2hz,1h),5.08(d,j=21.6hz,4h),4.73-4.51(m,1h),4.50-4.48(m,2h),3.81(d,j=8.0hz,1h),3.69(s,4h),3.34(s,4h),3.25-2.91(m,3h),2.90-2.79(m,3h),2.09-2.00(m,1h),1.55-1.45(m,3h),1.09-1.00(m,6h).lcms(esi):m/z848.1[m+h+].实施例56.7-(4-((4-((s)-2-((s)-2-(苄基氧基羰基氨基)-3-甲基丁酰氨基)-3-(1-(叔丁氧基羰基)哌啶-4-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向化合物56-2(150mg,0.551mmol)在thf/h2o(10ml/2ml)中的溶液中加入nahco3(138mg,1.653mmol)和化合物56-1(287mg,0.827mmol)。在将混合物在25℃搅拌过夜后,将其用hcl(1n)酸化至ph=6,用etoac(50mlx3)萃取。将有机层干燥并浓缩得到56-3,将其经硅胶柱色谱纯化(pe/etoac=10/1至1/10).lcms:(0-60,ab,2min,esi),1.309min,ms=406.3[m+1-boc+]步骤2.向化合物56-3(1.2g,2.376mmol)在dcm(20ml)中的溶液中加入化合物56-4(439mg,3.56mmol)和hatu(1.7g,5.064mmol)。将混合物在25℃搅拌过夜。将溶液用h2o淬灭,并用dcm(50mlx3)萃取。将有机层干燥,并浓缩并经硅胶柱色谱纯化(pe/etoac=10/1至1/10)得到56-5.lcms:(0-60,ab,2min,esi),1.413min,ms=511.2[m+1-boc+]步骤3.在0℃在氮气下向化合物56-5(100mg,0.16mmol)在无水dmf(2ml)中的溶液中加入dipea(0.5ml,3mmol)和pnp碳酸盐(200mg,0.66mmol,4.1eq)。将混合物在室温搅拌过夜。向混合物中加入诺氟沙星(102mg,0.32mmol,2eq)并搅拌1h。将混合物经制备性hplc纯化(fa),得到实施例56(60mg,40%).lcms:(5-95,ab,1.5min,esi),1.064min,ms=956.3[m+1]1hnmr:meoh-d4400mhz,δ8.84(s,1h),7.97-7.93(dd,j=16,1h),7.59-7.57(m,2h),7.35-7.27(m,7h),7.20-7.10(m,1h),5.11-5.07(m,4h),4.6-4.5(m,1h),4.55-4.45(m,2h),4.10-3.90(m,3h),3.75-3.65(m,4h),3.3(m,4h),2.80-2.50(m,2h),2.1-2.0(m,1h),1.8-1.6(m,5h),1.6-1.5(m,3h),1.43(s,9h),1.2-1.0(m,2h),0.96-0.94(d,j=6.8hz,6h).步骤1.历时15min在氮气下将化合物57-2(10g,100mmol)在冰醋酸(30ml)中的溶液加至化合物57-1(13.1g,100mmol)在冰醋酸(150ml)中的溶液中。在将其在室温搅拌1h后,将白色不均匀反应混合物回流加热5h。真空除去大部分乙酸。将残留物在水和dcm之间分配。除去dcm并将棕色油状物溶于少量的etoac并倒入pe。将白色析出物经滤过收集得到57-3(12g,收率:56%).1hnmrdmso-d6400mhz,δ11.98(s,1h),3.34-3.31(m,2h),2.61(m,4h),2.19-2.16(m,2h),1.50-1.43(m,4h),1.23(d,j=7.2hz,2h).步骤2.历时15min向化合物57-3(12g,56.3mmol)和过量的三乙胺(25ml,168.9mmol)在dcm(100ml)中的溶液中加入过量的化合物57-4(36g,140.8mmol)。将混合物在室温在氮气下搅拌6h。混合物变为均匀的并在40℃搅拌3h。将其浓缩,用水和盐水洗涤,经无水mgso4干燥。将其浓缩并经柱色谱纯化(etoac),得到57-5(4g,收率:23%).1hnmrmeod-d4400mhz,δ3.54-3.50(m,2h),2.86(d,j=3.2hz,4h),2.71(d,j=2.8hz,4h),2.66-2.63(m,2h),1.79-1.75(m,2h),1.65-1.59(m,2h),1.45-1.41(m,2h).步骤3.向化合物57-6(375mg,2.86mmol)在dme(10ml)中的溶液中加入化合物57-5(800mg,2.6mmol)和nahco3(656mg,7.8mmol)在水(10ml)中的溶液。将混合物在室温搅拌16h。将混合物用etoac洗涤并用10%hcl酸化至ph=3。将所得的混悬液用etoac萃取。将合并的有机层浓缩得到粗化合物57-7(1.2g,含有杂质).步骤4.向化合物57-8(2.0g,4.10mmol)在thf(50ml)中的混合物中加入化合物57-9(3.8g,24.34mol)和pd(pph3)4(946mg,0.82mmol)。将反应混合物在60℃搅拌3h。将混合物冷却至室温并滤过,将滤饼经制备性hplc纯化,得到57-10(1.0g,60.4%).步骤5.将化合物57-7(100mg,0.31mmol)、hatu(175mg,0.46mmol)、dipea(119mg,0.92mmol)溶于dmf(10ml)。将反应混合物在室温搅拌30min。然后加入化合物57-10(124mg,119mmol)。将反应混合物在室温搅拌3h。然后将混合物浓缩并经制备性hplc纯化,得到57-11a和57-11b(30mgeach,5%).步骤6.在0℃向化合物57-11a(30mg,0.042mmol)和pnp碳酸盐(26mg,0.084mmol)在dmf(2ml)中的溶液中加入dipea(17mg,0.127mmol)。将混合物在室温搅拌16h并在室温加入诺氟沙星(27mg,0.084mmol)。将混合物在室温搅拌1h。将残留物经制备性hplc纯化,得到实施例57(14mg,收率:15%).lcms:(5-95,ab,1.5min,esi),0.832min,ms=529.4[1/2m+1]1hnmr甲醇-d4400mhz,δ8.89(s,1h),8.33(d,j=4.6hz,1h),8.06-8.01(m,2h),7.63(d,j=8.4hz,2h),7.50-7.40(m,1h),7.39(d,j=8.4hz,2h),7.21(s,1h),5.55-5.51(m,1h),5.15(s,2h),4.92(s,1h),4.58(s,6h),3.74(s,4h),3.49-3.46(m,2h),3.35-3.33(m,4h),2.69(s,4h),2.26-2.22(m,4h),1.65-1.57(m,9h),1.56-1.29(m,5h),1.01(d,j=6.8hz,3h),0.93(d,j=6.4hz,3h),0.92-0.81(m,6h)实施例58.7-(4-((4-((s)-6-氨基-2-(4-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)己酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.历时20min将cbzcl(26.7ml,0.19mol)逐滴加至58-1(20g,0.17mol)和na2co3(36g,0.34mol)在水(100ml)中的混合物中。在将其在室温搅拌12h后,将其用etoac(200ml×2)洗涤。将水层调节至ph=2并用etoac(200ml×4)萃取。将合并的有机层经na2so4干燥并浓缩得到58-2.步骤2.向58-2(20g,79.3mmol)、n,o-二甲基羟胺(8.4g,87.2mmol)和hatu(45.2g,118.9mmol)在dcm(200ml)中的溶液中加入et3n(45.8ml,317.1mmol)。将混合物在室温搅拌1h。除去溶剂后,将残留物用etoac(200ml×3)萃取。将有机层用浓hcl、nahco3水溶液、饱和nacl洗涤并浓缩。将粗物质经硅胶柱色谱纯化(pe:etoac=2:1)得到58-3.步骤3.将化合物58-3(6.0g,20.4mmol)在dcm(100ml)中的溶液在干冰/丙酮浴中冷却至-78℃。逐滴加入dibal-h(30.6ml,30.6mmol)并将混合物在-78℃搅拌4h。将过量的氢化物用meoh(5ml)淬灭并将溶液温热至室温。除去溶剂后,58-4无需进一步纯化即可用于下一步。步骤4.将58-4(4.80g,20.4mmol)、化合物5(4.70g,24.5mmol)和k2co3(5.64g,40.8mmol)在meoh(60ml)中的混合物在室温搅拌12h。除去溶剂后,将残留物用etoac(100ml×3)萃取。将有机层用盐水(60ml)洗涤并经na2so4干燥。除去溶剂并将粗物质经硅胶柱色谱纯化(pe:etoac=10:1)得到58-6.步骤5.将58-7(10g,68.4mmol)和cu(oh)2co3(15.12g,68.4mmol)在h2o(100ml)中的溶液回流加热30min。将回流过程中形成的固体趁热经滤过除去。将滤液冷却至0℃并通过加入固体na2co3(1.0g)调节至ph9。逐滴加入alloccl(10.8ml,102.6mmol),同时将溶液在0℃搅拌。加入过程中,通过加入固体na2co3(20g)将反应混合物保持在ph9。将反应混合物温热至室温并搅拌12h。将反应过程中形成的蓝色固体产物以定量收率经滤过收集。将如上收集的固体orn(alloc)的铜盐悬浮于h2o(200ml)并加入两当量的硫代乙酰胺(6.511g,86.66mmol)。将碱性混悬液在50℃搅拌3h,在该过程中,固体缓慢溶解。然后将溶液用2mhcl酸化至ph2并进一步煮沸5min。将析出的cus经滤过除去。将滤液真空浓缩为约100ml,此时沉淀出产物orn(alloc)的盐酸盐58-8,其为白色固体,定量收率。步骤6.将nan3(8.5g,129.7mmol)在蒸馏水(45ml)和ch2cl2(75ml)中的溶液在冰浴上冷却。历时5min缓慢加入tf2o(4.4ml,25.94mmol),同时继续搅拌2h。将混合物置于分液漏斗中并移去ch2cl2相。将含水部分用ch2cl2(35ml×2)萃取。收集含有三氟甲磺酰基叠氮化物的有机馏分并用饱和na2co3洗涤一次且无需进一步纯化即可使用。将化合物58-8(2.99g,12.97mmol)与k2co3(2.69g,19.46mmol)和cuso4·5h2o(486mg,1.94mmol)在蒸馏水(90ml)和meoh(180ml)中混合。加入三氟甲磺酰基叠氮化物在ch2cl2(150ml)中的溶液并将混合物在室温搅拌12h。随后,减压除去有机溶剂并将含水浆液用0.2mph6.2磷酸盐缓冲液(100ml)稀释并用etoac(200ml×2)萃取除去磺酰胺副产物。然后将水相用浓hcl酸化至ph2。产物获得自另外一次etoac(400ml×3)萃取。合并etoac萃取物,经na2so4干燥并蒸发得到58-9,其无需进一步纯化即可用于下一步。步骤7.将58-9(3.32g,12.97mmol)、58-6(1.50g,6.48mmol)和cu(ch3cn)4pf6(362mg,0.97mmol)在dmf(10ml)中的混合物在50℃搅拌2h。除去溶剂后,将残留物经制备性hplc纯化,得到58-10(2.3g,36.4%).步骤8.将58-10(2.33g,4.78mmol)、58-11(1.76mg,14.3mmol)和eedq(3.55g,14.3mmol)在dcm(50ml)中的混合物在室温搅拌1h。除去溶剂后,将残留物经制备性hplc和sfc分离纯化,得到58-12(326mg)和58-13(30mg).1hnmr(400mhz,meod)δ8.04(s,1h),7.55-7.53(m,2h),7.33-7.30(m,7h),5.91-5.87(m,1h),5.45-5.41(m,1h),5.27-5.23(m,1h),5.15-5.11(m,1h),5.07(d,j=2.8hz,2h),4.70-4.68(m,1h),4.55(s,2h),4.48-4.46(m,2h),3.34-3.32(m,1h),3.09-3.07(m,2h),2.28-2.22(m,3h),1.54-1.50(m,2h),1.44-1.35(m,2h),0.93(d,j=6.8hz,3h),0.87(d,j=6.8hz,3h).lcms(esi):m/z593.0[m+h+].1hnmr(400mhz,meod)δ8.04(s,1h),7.55-7.52(m,2h),7.32-7.27(m,7h),5.91-5.87(m,1h),5.43-5.42(m,1h),5.27-5.22(m,1h),5.15-5.12(m,1h),5.07(d,j=3.6hz,2h),4.70-4.68(m,1h),4.55(s,2h),4.47(d,j=5.2hz,2h),3.07-3.05(m,2h),2.22-2.14(m,3h),1.54-1.50(m,2h),1.44-1.20(m,2h),0.92(d,j=6.8hz,3h),0.87(d,j=6.8hz,3h).lcms(esi):m/z593.0[m+h+].步骤9.将58-12(100mg,0.169mmol)、pnp(103mg,0.338mmol)和dipea(66mg,0.507mmol)在dcm(5ml)中的混合物在50℃搅拌12h,并除去溶剂。将上述粗产物(128mg,0.169mmol)、诺氟沙星(160mg,0.507mmol)和dipea(66mg,0.507mmol)在dmf(5ml)中的混合物在室温搅拌2h。除去溶剂后,将残留物经制备性hplc纯化,得到100mg中间体。向中间体(50mg,0.053mmol)和1,3-二甲基巴比妥酸(67mg,0.426mmol)在thf(5ml)中的溶液中加入pd(pph3)4(12mg,0.0106mmol)。将混合物在50℃搅拌12h。除去溶剂后,将残留物经制备性hplc纯化,得到实施例58(20.6mg).1hnmr(400mhz,dmso-d6)δ8.96(s,1h),8.47-8.43(m,1h),8.09(s,1h),7.96-7.93(m,1h),7.74-7.72(m,1h),7.62-7.60(m,2h),7.38-7.29(m,7h),7.22-7.20(m,1h),5.52-5.49(m,1h),5.07(s,2h),5.02(d,j=4.8hz,2h),4.62-4.58(m,3h),3.62(s,4h),3.15(s,4h),2,67-2.66(m,2h),2.15-2.09(m,3h),1.54-1.52(m,2h),1.40(t,j=7.2hz,3h),1.23-1.18(m,2h),0.84(d,j=6.4hz,3h),0.78(d,j=6.4hz,3h).lcms(esi):m/z854.1[m+h+].实施例59.7-(4-((4-((s)-2-(4-((s)-1-((r)-2-(6-(2,5-二氧代吡咯烷-1-基)己酰氨基)-3-苯基丙酰氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向化合物59-2(118mg,0.71mmol)在dme(5ml)中的溶液中加入化合物59-1(200mg,0.71mmol)和nahco3(122mg,1.42mmol)在水(5ml)中的溶液。将混合物在室温搅拌16h。将混合物用etoac洗涤并用10%hcl酸化至ph=3。将所得的混悬液用etoac萃取。将合并的有机层浓缩得到粗化合物59-3(240mg).步骤2.将化合物59-3(240mg,0.67mmol)、hatu(506mg,1.34mmol)、dipea(258mg,2.01mmol)溶于dmf(5ml)并在室温搅拌30min。然后加入化合物59-4(269mg,0.67mmol)。将反应混合物在室温搅拌3h。将混合物浓缩并经制备性hplc纯化,得到59-5a和59-5b(40mgeach,8%)步骤3.在室温向化合物59-5a(40mg,0.054mmol)在无水dmf(3ml)中的溶液中加入pnp碳酸盐(34mg,0.11mmol)和dipea(21mg,0.162mmol)并在室温搅拌1.5h。加入诺氟沙星(35mg,0.11mmol)。将混合物在室温搅拌另外的1h并浓缩,滤过并经制备性hplc纯化(fa)(14mg,收率:20%).lcms:(5-95,ab,1.5min,esi),0.838min,ms=546.5[1/2m+1]1hnmrdmso-d6400mhz,δ10.64(s,1h),8.96(s,1h),8.22(d,j=9.2hz,1h),8.04(d,j=8.4hz,1h),8.04-7.92(m,2h),7.61(d,j=8.4hz,2h),7.36(d,j=8.4hz,2h),7.22-7.20(m,5h),7.14(s,1h),6.06(d,j=6hz,1h),5.50-5.47(m,1h),5.44(s,2h),5.07(s,2h),4.90-4.86(m,1h),4.61-4.58(m,3h),3.61(s,4h),3.34-3.25(m,4h),3.04-2.91(m,4h),2.75-2.71(m,2h),2.60(s,4h),2.14-2.11(m,2h),2.09-2.00(m,2h),1.42-1.29(m,10h),1.40(d,j=7.2hz,2h),0.85-0.79(m,6h).实施例60.7-(4-((4-((s)-2-(4-((s)-1-((r)-2-(6-(2,5-二氧代吡咯烷-1-基)己酰氨基)-3-甲基丁酰氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向化合物60-2(83mg,0.71mmol)在dme(5ml)中的溶液中加入化合物60-1(200mg,0.71mmol)和nahco3(122mg,1.42mmol)在水(5ml)中的溶液。在将混合物在室温搅拌16h后,将其用etoac洗涤并用10%hcl酸化至ph3。将所得的混悬液用etoac萃取。将合并的有机层浓缩得到化合物60-3(160mg,具有杂质,收率:80%.步骤2.将化合物60-3(160mg,0.51mmol)、hatu(390mg,1.02mmol)、dipea(200mg,0.68mmol)溶于dmf(5ml)并在室温搅拌30min。然后加入化合物60-4(207mg,0.51mmol)。将反应混合物在室温搅拌3h。然后将混合物浓缩并经制备性hplc纯化,得到60-5a和60-5b(分别为60mg和60mg,8%和8%)步骤3.在室温向化合物60-5a(60mg,0.086mmol)在无水dmf(3ml)中的溶液中加入pnp碳酸盐(60mg,0.2mmol)和dipea(0.5ml,3mmol),并将混合物在室温搅拌1.5h。加入诺氟沙星(60mg,0.19mmol)。将混合物在室温搅拌额外的1h。将混合物浓缩,滤过并经制备性hplc纯化(fa)得到实施例60(47.9mg,收率:54%).lcms:(5-95,ab,1.5min,esi),0.824min,ms=522.4[1/2m+1]1hnmrdmso-d6400mhz,δ10.1(s,1h),8.93(s,1h),8.15-8.13(d,1h),7.99(s,1h),7.93-7.90(d,1h),7.81-7.79(d,1h),7.57-7.55(d,j=8.0hz,2h),7.35-7.33(d,j=8.0hz,2h),7.20-7.18(m,1h),6.0(m,1h),5.5(m,1h),5.40(s,2h),5.04(s,2h),4.8(m,1h),4.6-4.5(m,2h),4.2-4.1(m,1h),3.6(s,4h),3.2(m,6h),3.05-2.9(m,2h),2.57(s,4h),2.15-2.0(m,5h),1.9-1.8(m,1h),1.5-1.35(m,7h),1.3-1.1(m,4h),0.82-0.80(m,j=8.0hz,3h),0.76-0.70(m,9h).实施例61.7-(4-((4-((s)-2-(4-((s)-1-((r)-2-(6-(2,5-二氧代吡咯烷-1-基)己酰氨基)丙酰氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向化合物61-2(64mg,0.71mmol)在dme(5ml)中的溶液中加入化合物61-1(200mg,0.71mmol)和nahco3(122mg,1.42mmol)在水(5ml)中的溶液。在将混合物在室温搅拌16h后,将其用etoac洗涤并用10%hcl酸化至ph=3。将所得的混悬液用ea萃取。将合并的有机层浓缩得到化合物61-3.(100mg,含有杂质,收率:60%)步骤2.将化合物61-3(100mg,0.35mmol)、hatu(267mg,0.7mmol)、dipea(136mg,1.05mmol)溶于dmf(5ml)并在室温搅拌30min。加入化合物61-4(142mg,0.35mmol)并将反应混合物在室温搅拌3h。将混合物浓缩并经制备性hplc纯化,得到61-5aand61-5b(分别为43mg、22mg,6%、3%)。步骤3.在室温向化合物61-5b(22mg,0.033mmol)在无水dmf(2ml)中的溶液中加入pnp碳酸盐(20mg,0.066mmol)和dipea(0.2ml,1.2mmol)并将混合物在室温搅拌1.5h。加入诺氟沙星(20mg,0.066mmol)。将混合物在室温搅拌另外的1h。将混合物浓缩,滤过并经制备性hplc纯化(fa),得到实施例61(14.6mg收率:43%).lcms:(5-95,ab,1.5min,esi),0.805min,ms=508.3[1/2m+1]1hnmr甲醇-d4+cdcl3400mhz,δ8.83(s,1h),8.02-7.99(m,2h),7.77(solvent:cdcl3),7.59-7.57(d,j=8.0hz,2h),7.36-7.34(d,j=8.0hz,2h),7.15-7.13(m,1h),5.5(m,1h),5.11(s,2h),4.95-4.9(m,1h),4.55-4.45(m,2h),4.4-4.35(m,1h),3.7(s,4h),3.45(m,2h),3.4(s,4h),3.25-3.05(m,2h),2.66(s,4h),2.3-2.1(m,5h),1.6-1.5(m,7h),1.5-1.3(m,2h),1.3-1.2(m,5h),0.96-0.94(d,j=8.0hz,3h),0.87-0.85(d,j=8.0hz,3h).实施例62.7-(4-((4-((s)-2-(4-((s)-1-(苄基氧基羰基氨基)-2,2-二甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.历时20min将cbzcl(24ml,0.17mol)逐滴加至62-1(20g,0.15mol)和na2co3(32g,0.30mol)在水(100ml)中的混合物中。在将反应混合物搅拌12h后,将其用etoac(200ml×2)洗涤。将水层调节至ph=2并用etoac(200ml×4)萃取。将合并的有机层经na2so4干燥并减压浓缩得到62-2,其无需进一步纯化即可用于下一步。步骤2.向62-2(10g,37.7mmol)、n,o-二甲基羟胺(4.0g,41.5mmol)和hatu(21.3g,56.0mmol)在dcm(100ml)中的混合物中加入et3n(21.8ml,150.8mmol)。在将混合物在室温搅拌1h后,除去溶剂并将粗物质用水(200ml)吸收。将水层用etoac(200ml×3)萃取。将萃取物用浓hcl、nahco3水溶液、饱和nacl洗涤。将其浓缩并经硅胶柱色谱纯化(pe:etoac=2:1)得到62-3.步骤3.在-78℃将dibal-h(19.5ml,19.46mmol)逐滴加至化合物3(4g,12.97mmol)在dcm(60ml)中的溶液中。在将混合物在-78℃搅拌4h后,将过量的氢化物用meoh(5ml)淬灭并将所得的溶液温热至室温。将溶液浓缩得到化合物4,其无需进一步纯化即可用于下一步。步骤4.在将62-4(3.23g,12.97mmol),62-5(2.99g,15.56mmol)和k2co3(3.58g,25.94mmol)在meoh(40ml)中的混合物在室温搅拌12h后,除去溶剂,并将残留物用etoac(60ml×3)萃取。将有机层用盐水洗涤,经na2so4干燥,浓缩并经柱色谱纯化(pe:etoac=10:1)得到62-6.步骤5.在0℃历时5min将tf2o(4.4ml,25.94mmol)缓慢加至nan3(8.3g,129.7mmol)在h2o(45ml)和dcm(75ml)混合物中的溶液中。在将其搅拌2h后,分离dcm层并将含水部分用dcm(35ml×2)萃取。收集含有三氟甲磺酰基叠氮化物的有机馏分并用饱和na2co3洗涤一次并加至62-7(2.27g,12.97mmol)、k2co3(2.69g,19.46mmol)和cuso4·5h2o(323mg,1.30mmol)在h2o(90ml)和meoh(180ml)中的混合物中。在将混合物搅拌12h后,减压除去有机溶剂并将含水浆液用磷酸盐缓冲液(0.2m,ph6.2,100ml)稀释,并用etoac(200ml×2)萃取。然后将水相用浓hcl酸化至ph=2,并用萃取(400ml×3)。合并有机层,经na2so4干燥并浓缩得到62-8,其无需进一步纯化即可用于下一步。步骤6.在将62-8(2.61g,12.97mmol)、62-6(1.59g,6.48mmol)和cu(ch3cn)4pf6(362mg,0.97mmol)在dmf(5ml)中的混合物在50℃搅拌2h后,除去溶剂,并将残留物经制备性hplc纯化,得到62-9.步骤7.在将62-9(968mg,2.17mmol)、62-10(801mg,6.50mmol)和eedq(1.61g,6.50mmol)在dcm(50ml)中的混合物在室温搅拌2h后,除去溶剂,并将残留物经制备性hplc纯化,得到62-11(395.9mg,33.1%).1hnmr(400mhz,meod)δ8.11(s,1h),7.59-7.56(m,2h),7.37-7.27(m,7h),5.55-5.51(m,1h),5.13-5.05(m,2h),4.79(s,1h),4.58(s,2h),3.34-3.32(m,1h),3.25-3.11(m,1h),2.28-2.22(m,2h),1.48-1.41(m,2h),0.96(s,9h).lcms(esi):m/z551.9[m+h+].步骤8.在将62-11(190mg,0.34mmol)、pnp碳酸盐(126mg,0.41mmol)和dipea(132mg,1.02mmol)在dcm(5ml)中的混合物在50℃搅拌12h后,除去溶剂并加至诺氟沙星(323mg,1.02mmol)和dipea(132mg,1.02mmol)在dmf(5ml)中的混合物中。在将其在室温搅拌2h后,除去溶剂,并将残留物经制备性hplc纯化,得到实施例62(6.2mg).1hnmr(400mhz,dmso-d6)δ15.31(s,1h),10.66(s,1h),8.96(s,1h),8.15(s,1h),7.94(d,j=13.2hz,1h),7.72-7.70(m,1h),7.60(d,j=8.0hz,2h),7.38-7.28(m,8h),6.04-6.03(m,1h),5.52-5.51(m,1h),5.42(s,2h),5.07(s,2h),5.03-5.01(m,2h),4.66(d,j=9.6hz,1h),4.58-4.56(m,2h),3.61(s,4h),3.41(s,4h),3.02-2.98(m,2h),2.12-2.02(m,2h),1.42-1.39(m,3h),1.26-1.23(m,2h),0.84(s,9h).lcms(esi):m/z897.1[m+h+].实施例63.7-(4-((4-((s)-2-(4-((s)-1-((s)-2-(6-(2,5-二氧代吡咯烷-1-基)己酰氨基)丙酰氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸实施例63使用如实施例61的操作制备,其采用来自合成实施例61的中间体。步骤1.在室温向化合物61-5a(43mg,0.064mmol)在无水dmf(3ml)中的溶液中加入pnp碳酸盐(40mg,0.128mmol)和dipea(0.4ml,2.4mmol)并将混合物在室温搅拌1.5h。加入诺氟沙星(40mg,0.128mmol)。将混合物在室温搅拌另外的1h。将混合物浓缩,滤过并经制备性hplc纯化(fa),得到实施例63(33.8mg,收率:52%).lcms:(5-95,ab,1.5min,esi),0.803min,ms=508.4[1/2m+1]1hnmr甲醇-d4400mhz,δ8.86(s,1h),8.15-8.12(d,1h),8.10-8.05(m,1h),8.05-7.98(d,1h),7.62-7.60(d,j=8.0hz,2h),7.37-7.35(d,j=8.0hz,2h),7.20-7.18(m,1h),5.5(m,1h),5.12(s,2h),4.95-4.9(m,1h),4.6-4.5(m,2h),4.42-4.38(m,1h),3.7(s,4h),3.41(m,2h),3.3(s,4h),3.25-3.1(m,2h),2.63(s,4h),2.35-2.2(m,5h),1.6-1.5(m,7h),1.5-1.3(m,2h),1.35-1.33(d,j=8.0hz,3h),1.3-1.2(m,2h),0.95-0.93(d,j=8.0hz,3h),0.91-0.88(d,j=8.0hz,3h).实施例64.7-(4-((4-((s)-2-(4-((s)-1-乙酰氨基-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0℃向64-1(1.1g,11.4mmol)在thf中的搅拌溶液中加入64-2(4.5ml,57mmol)、tea(9ml,62.7mmol)。将混合物在室温在氮气下搅拌3h。将反应混合物倒入水(30ml)中并用萃取dcm,将合并的有机层用nacl水溶液洗涤并浓缩得到64-3(收率:95%).步骤2.在室温将化合物64-3(139mg,1mmol)、64-4(302mg,1.5mmol)、cu(ch3cn)4pf6(75mg,0.2mmol)溶于dmf(8ml)。将混合物在60℃搅拌2h。混合物64-5无需进一步纯化即可用于下一步。步骤3.在室温向64-5的粗混合物中加入64-6(1.123g,9.12mmol)和eedq(3g,12.2mmol)。将混合物在室温在氮气气氛下搅拌16h。将残留物经制备性hplc纯化,然后经sfc纯化,得到64-7.(收率:80%)lcms(esi):m/z446.0[m+h+].步骤4.在0℃向64-7(30mg,0.068mmol)在dmf(2ml)中的溶液中加入pnp碳酸盐(42mg,0.136mmol)和dipea(27mg,0.21mmol)。将混合物在室温搅拌16h。混合物64-8无需进一步纯化即可用于下一步。(收率:95%)lcms(esi):m/z611.2[m+h+].步骤5.在室温向64-8的混合物中加入诺氟沙星(44mg,0.136mmol)。将混合物在室温搅拌1h。将残留物经制备性hplc纯化,然后经sfc纯化,得到实施例64(收率:30%).1hnmr(400mhz,dmso-d6)δ10.62(s,1h),8.96(s,1h),8.17(d,j=9.2hz,1h),8.06(d,j=6.8hz,1h),7.94(d,j=13.2hz,1h),7.60(d,j=8.4hz,2h),7.36(d,j=8.0hz,2h),7.21(d,j=6.0hz,1h),6.02(d,j=4.4hz,1h),5.51-5.42(m,3h),5.07(s,2h),4.90-4.86(m,1h),4.59-4.57(m,2h),3.65-3.61(m,4h),3.06-2.96(m,2h),2.12-1.87(m,3h),1.86(s,3h),1.48-1.35(m,3h),1.28(s,2h),0.89-0.72(m,6h).实施例65:7-(4-((4-((s)-2-(4-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.在0℃历时5min将tf2o(8.8ml,51.9mmol)缓慢加至nan3(16.9g,259.4mmol)在蒸馏水(30ml)和ch2cl2(45ml)的混合物中的溶液中。在将其搅拌2h后,将有机相分离并将含水部分用ch2cl2(40ml×2)萃取。收集含有三氟甲磺酰基叠氮化物的有机馏分并用饱和na2co3洗涤一次并加至65-1(2.3g,12.97mmol)、k2co3(2.69g,19.46mmol)和cuso4.5h2o(65mg,0.26mmol)在h2o(90ml)和meoh(180ml)中的混合物中。在将混合物在26℃搅拌12h后,减压除去有机溶剂并将含水浆液用h2o(50ml)稀释。将混合物用浓hcl酸化至ph=6,然后用磷酸盐缓冲液(0.2m,ph6.2,50ml)稀释。将混合物用etoac(100ml×2)洗涤,然后将水相用浓hcl酸化至ph=2。将混合物用etoac(200ml×3)萃取。将有机层经na2so4干燥并浓缩得到65-2,其无需进一步纯化即可用于下一步。步骤2.在将65-2(2.6g,12.97mmol)、65-3(1.5g,6.48mmol)和cu(mecn)4pf6(304mg,0.97mmol)在dmf(10ml)中的混合物在50℃搅拌2h后,除去溶剂,并将残留物经制备性hplc纯化,得到65-4(516mg,18%).步骤3.在将65-4(285mg,0.66mmol)、65-5(244mg,1.98mmol)和eedq(490mg,1.98mmol)在dcm(30ml)中的混合物在24℃搅拌2h后,除去溶剂,并将残留物经制备性hplc纯化,得到65-6(250mg,70.4%).1hnmr(400mhz,meod)δ8.10(s,1h),7.58(s,2h),7.45-7.20(m,7h),5.55-5.52(m,1h),5.10-5.05(m,2h),4.77-4.58(m,3h),3.22-3.21(m,2h),2.33-2.15(m,3h),1.49-1.47(m,2h),0.97(s,3h),0.90(s,3h).lcms(esi):m/z538.3[m+h+].步骤4.在将65-6(127mg,0.24mmol)、pnp(143mg,0.47mmol)和dipea(92mg,0.71mmol)在dcm(10ml)中的混合物在50℃搅拌12h后,除去溶剂并将残留物与dipea(93mg,0.72mmol)和诺氟沙星(230mg,0.72mmol)在dmf(10ml)中混合。在将其在24℃搅拌4h后,除去溶剂,并将残留物经制备性hplc纯化,得到实施例65(30mg,14.1%).1hnmr(400mhz,dmso-d6)δ15.32(s,1h),10.63(s,1h),8.96(s,1h),8.08(s,1h),7.94(d,j=13.2hz,1h),7.71(d,j=9.2hz,1h),7.60(d,j=8.4hz,2h),7.38-7.29(m,8h),7.21(d,j=7.6hz,1h),6.02(s,1h),5.48-5.47(m,1h),5.42(s,2h),5.06(s,2h),5.02(s,2h),4.62-4.60(m,3h),3.61(s,4h),3.44(s,4h),3.02-2.99(m,2h),2.12-2.02(m,3h),1.40(t,j=6.8hz,3h),1.27-1.24(m,2h),0.84(d,j=6.8hz,3h),0.78(d,j=6.8hz,3h).lcms(esi):m/z883.7[m+h+].实施例66.7-(4-((4-((s)-2-(4-((s)-(苄基氧基羰基氨基)(环丙基)甲基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.在0℃向66-1(5.0g,43.43mmol)和na2co3(6.9g,65.15mmol)在h2o(50ml)中的混合物中逐滴加入cbzcl(8.89g,52.12mmol)。在将反应混合物在25℃搅拌16h后,将其用etoac(30ml×2)洗涤。将水相用浓hcl酸化至ph2,并用etoac(50ml×2)萃取。将合并的有机层经na2so4干燥并减压浓缩得到66-2(11g,粗的).1hnmr(400mhz,cdcl3)δ7.38-7.29(m,5h),5.13-5.08(m,2h),4.72-4.68(m,1h),1.12-1.09(m,1h),0.61-0.43(m,4h).步骤2.在25℃向66-2(500mg,2.006mmol)、n,o-二甲基羟胺盐酸盐(235mg,2.407mmol)和et3n(609mg,6.018mmol)在dcm(10ml)中的混合物中加入hatu(1.14g,3.009mmol)。在将其在25℃搅拌2h后,除去溶剂并将残留物用水(10ml)吸收。将水层用etoac(8ml×2)萃取。将有机层用饱和na2co3溶液(10ml)、1nhcl溶液(10ml)、然后水(10ml)洗涤。将有机层经na2so4干燥,滤过并浓缩。将粗物质经硅胶柱色谱纯化(pe/etoac=2:1)得到66-3(400mg,68%).lcms(esi):m/z293.1[m+h+].步骤3.在-78℃将dibal-h在甲苯中的溶液(1m,18ml,18mmol)加至66-3(3.5g,11.97mmol)在dcm(30ml)中的混合物中。在将混合物在-78℃搅拌3h后,逐滴加入meoh(5ml)。将混合物温热至25℃。除去溶剂并将其溶于meoh(25ml)和k2co3(3.31g,23.94mmol),并在0℃加入66-4(2.76g,14.36mmol)。将混合物在25℃搅拌16h。除去溶剂后,将粗物质用1nhcl溶液(30ml)吸收,用etoac(20ml×3)萃取。将有机层经na2so4干燥,浓缩并经硅胶柱色谱纯化(pe/etoac=5:1-2:1)得到66-5(1.5g,55%).1hnmr(400mhz,cdcl3)δ7.41-7.30(m,5h),5.12-5.05(m,3h),4.47(m,1h),2.24(s,1h),1.18-1.11(m,1h),0.56-0.47(m,4h).步骤4.在25℃将cu(ch3cn)4pf6(366mg,0.981mmol)加至66-6(2.63g,13.08mmol)和66-5(1.5g,6.54mmol)在dmf(10ml)中的溶液中。将反应混合物在50℃在氮气下搅拌2h。除去溶剂并将残留物经制备性hplc纯化,得到66-7(3.0g,53%).1hnmr(400mhz,dmso-d6)δ8.01(s,1h),7.83-7.81(m,1h),7.37-7.14(m,5h),5.97(br,1h),5.40-5.38(m,1h),5.03-4.99(m,2h),4.32-4.28(m,1h),2.94(s,2h),2.17-2.07(m,2h),1.30-1.10(m,3h),0.50-0.26(m,4h).步骤5.将66-7(1.0g,2.32mmol)、66-8(571mg,4.64mmol)和eedq(1.15g,4.64mmol)在dcm(15ml)中的溶液在25℃搅拌2h。除去溶剂后,将残留物经制备性hplc和sfc纯化,得到66-9(500mg)和66-10(112mg)。1hnmr(400mhz,dmso–d6)δ10.60(s,1h),8.10(s,1h),7.82(d,j=9.2hz,1h),7.56-7.54(m,2h),7.36-7.25(m,7h),6.08-6.05(m,1h),5.51-5.43(m,3h),5.14(t,j=5.6hz,1h),5.03(s,2h),4.44(d,j=5.6hz,2h),4.31(t,j=8.4hz,1h),3.04-2.97(m,2h),2.15-2.08(m,2h),1.30-1.23(m,3h),0.49-0.30(m,4h).lcms(esi):m/z536.3[m+h+].1hnmr(400mhz,dmso–d6)δ10.54(s,1h),8.09(s,1h),7.82-7.80(m,1h),7.56-7.54(m,2h),7.36-7.26(m,7h),6.03-6.01(m,1h),5.49-5.42(m,3h),5.13(t,j=5.6hz,1h),5.03(s,2h),4.44(d,j=5.6hz,2h),4.29(t,j=8.4hz,1h),3.04-2.97(m,2h),2.14-2.05(m,2h),1.30-1.25(m,3h),0.49-0.30(m,4h).lcms(esi):m/z536.4[m+h+].步骤6.在25℃向66-9(80mg,0.149mmol)在dcm(2ml)中的溶液中加入pnp碳酸盐(136mg,0.447mmol)和dipea(77mg,0.596mmol)。将混合物回流加热20h。除去溶剂并将残留物溶于dmf(2ml)和诺氟沙星(72mg,0.224mmol),并在25℃加入diea(96mg,0.745mmol),并将混合物在25℃搅拌2h。除去溶剂后,将残留物经制备性tlc纯化(dcm/meoh=10:1)得到实施例66(23mg,18%).1hnmr(400mhz,mdso-d6)δ15.33(s,1h),10.65(s,1h),8.96(s,1h),8.14(s,1h),8.09(s,1h),7.96-7.81(m,2h),7.62-7.60(m,2h),7.38-7.20(m,8h),6.04-6.00(m,1h),5.48-5.43(m,1h),5.07(s,2h),5.02(s,2h),4.59-4.57(m,2h),4.40-4.31(m,1h),3.61(s,4h),3.32(s,4h),3.03-2.99(m,2h),2.20-2.11(m,2h),1.40(t,j=7.2hz,3h),1.30-1.23(m,3h),0.48-0.23(m,4h).lcms(esi):m/z881.4[m+h+].实施例67.7-(4-((4-((s)-2-(4-((s)-1-(2-(6-(2,5-二氧代吡咯烷-1-基)己酰氨基)乙酰氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向化合物67-2(75mg,1mmol)在dme(10ml)中的溶液中加入化合物67-1(310mg,1mmol)和nahco3(252mg,3mmol)在水(10ml)中的溶液。将混合物在室温搅拌16h。将混合物用etoac洗涤并用10%hcl酸化至ph=3。将所得的混悬液用etoac萃取。将合并的有机层浓缩得到化合物67-3(270mg,含有杂质).步骤2.在室温向化合物67-3(200mg,0.74mmol)和化合物67-4(90mg,0.777mmol)在thf(10ml)中的溶液中加入dcc(161mg,0.777mmol)。将混合物在室温在氮气下搅拌16h。将其浓缩并将滤液浓缩得到67-5(200mg,收率:74%).步骤3.将化合物67-5(200mg,0.53mmol)、化合物67-6(107mg,0.265mmol)溶于dmf(6ml)并将反应混合物在室温搅拌3h。将混合物滤过并经制备性hplc纯化,得到67-7(25mg,收率:6.3%)步骤4.在室温向化合物67-7(25mg,0.038mmol)在无水dmf(3ml)中的溶液中加入pnp碳酸盐(25mg,0.076mmol)和dipea(15mg,0.114mmol)。将混合物在室温搅拌1.5h。加入诺氟沙星(30mg,0.076mmol)。将混合物在室温搅拌另外的1h。将混合物浓缩,滤过并经制备性hplc纯化(fa),得到实施例67(20mg,收率:48%).lcms:(5-95,ab,1.5min,esi),0.802min,ms=501.3[1/2m+1]1hnmr甲醇-d4+cdcl3400mhz,δ8.83(s,1h),7.99(d,j=13.2hz,2h),7.59(d,j=6.8hz,2h),7.35(d,j=8.0hz,2h),7.11(s,1h),5.51(s,1h),5.12(s,2h),4.95(s,1h),4.47(s,2h),3.86(s,2h),3.71(s,4h),3.48-3.44(m,2h),3.31(s,4h),3.25(s,1h),3.15(s,1h),2.67(s,4h),2.26-2.20(m,5h),1.65-1.61(m,6h),1.58-1.52(m,1h),1.33-1.29(m,4h),0.95(d,j=6.8hz,3h),0.88(d,j=6.4hz,3h).实施例68.7-(4-((4-((s)-2-(4-((s)-1-(6-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)己酰氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向粗化合物68-1(500mg,1.24mmol)在1,4-二噁烷/h2o(10ml/5ml)中的溶液中逐滴加入k2co3(428mg,3mmol)和fmoc-cl(416mg,1.6mmol)在二噁烷(10ml)中的溶液。在将混合物在室温搅拌16h后,将其浓缩并经柱色谱纯化(15%-20%meoh/dcm)得到化合物68-2(286mg,37%).lcms:(5-95,ab,1.5min,esi),0.709min,ms=626.1[m+1]1hnmr甲醇-d4400mhz,δ8.06(s,1h),7.80-7.78(d,j=7.2hz,2h),7.67-7.63(t,j=6.8hz,2h),7.58-7.56(d,j=8.4hz,2h),7.39-7.27(m,6h),5.6-5.5(m,1h),4.69-4.67(d,j=7.2hz,1h),4.57(s,2h),4.40-4.36(m,2h),4.25-4.15(m,1h),3.3-3.2(m,1h),3.2-3.1(m,1h),2.35-2.15(m,3h),1.55-1.35(m,2h),0.98-0.97(d,j=6.8hz,3h),0.90-0.88(d,j=6.8hz,3h).步骤2.在室温向化合物68-2(200mg,0.31mmol)在无水dmf(5ml)中的溶液中加入pnp碳酸盐(185mg,0.62mmol)和dipea(0.5ml,3.0mmol)并将混合物在室温在氮气下搅拌1.5h。加入诺氟沙星(197mg,0.62mmol)。将混合物在室温搅拌另外的1h。然后加入哌啶(0.1ml,1mmol)。在30min后,将混合物经制备性hplc纯化,得到化合物68-4(250mg,含有4-硝基苯酚)。其无需进一步纯化即可用于下一步。步骤3.向化合物68-4(100mg,0.134mmol)在无水dmf(2ml)中的溶液中加入化合物5(50mg,0.162mmol)。将混合物在23℃搅拌2h。将混合物经制备性hplc纯化,得到实施例68(20mg,yield16%).lcms:(5-95,ab,1.5min,esi),0.803min,ms=942.4[m+1],471.8[1/2m+1]1hnmrdmso-d6400mhz,δ15.3(s,1h),10.60(s,1h),8.94(s,1h),8.1(d,1h)8.01(s,1h),7.94-7.90(dd,j=12.8hz,1h),7.58-7.56(d,j=8.8hz,2h),7.34-7.32(d,j=8.8hz,2h),7.2(d,1h),6.97(s,2h),6.0(m,1h),5.5-5.4(m,1h),5.40(s,2h),5.04(s,2h),4.9-4.85(m,1h),4.6-4.5(m,2h),3.58(s,4h),3.4-3.3(m,6h),3.1-2.9(m,2h),2.2-2.0(m,5h),1.6-1.4(m,7h),1.3-1.2(m,4h),0.80-0.78(d,j=6.8hz,3h),0.76-0.74(d,j=6.8hz,3h).实施例69.7-(4-((4-((s)-2-(4-((s)-1-(苄基氧基羰基氨基)戊基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向aqna2co3(16g,152.5mmol)和69-1(5g,38.1mmol)的混合物中加入cbz-osu(11.4g,45.7mmol)在thf(40ml)中的溶液。在将混合物在室温搅拌16h后,将其调节至ph>10并用etoac(100ml×2)洗涤。将水层用浓hcl酸化至ph<1。将溶液用etoac(200ml×3)萃取。将有机层经na2so4干燥并浓缩得到69-2(9.7g,95.9%),其无需进一步纯化即可用于下一步。步骤2.向69-2(9.7g,36.6mmol)、n,o-二甲基羟胺盐酸盐(3.9g,40.2mmol)和hatu(20.8g,54.8mmol)在dcm(100ml)中的混合物中加入et3n(21ml,146.2mmol)。在将混合物在室温搅拌2h后,除去溶剂,并将粗物质用水(150ml)吸收并用etoac(150ml×3)萃取。将有机层用饱和nahco3、浓hcl、饱和nacl洗涤并浓缩。将残留物经硅胶柱色谱纯化(pe:etoac=2:1)得到69-3(10.1g,89.6%).步骤3.在-78℃将dibal-h(19.5ml,1m在tol中)逐滴加至69-3(4.0g,13.0mmol)在无水ch2cl2(50ml)中的溶液中。在将反应混合物在-78℃搅拌2h后,将过量的dibal经无水meoh(15ml)淬灭并将混合物温热至室温。将其浓缩得到69-4(3.2g,粗的),其无需进一步纯化即可用于下一步。步骤4.在将69-4(3.2g,13.0mmol)、69-5(3.0g,15.6mmol)和k2co3(3.6g,26.0mmol)在meoh(60ml)中的混合物在室温搅拌16h后,除去溶剂,并将残留物用etoac(80ml×3)萃取。将有机层用盐水(60ml)洗涤并经无水na2so4干燥,浓缩,并经硅胶柱色谱纯化(pe:etoac=10:1)得到69-6(1.9g,60.3%).步骤5.在0℃将tf2o(3.3ml,19.6mmol)缓慢加至nan3(6.3g,97.8mmol)在h2o(30ml)和ch2cl2(48ml)中的溶液中。在将其搅拌2h后,分离有机相并将水相用ch2cl2(24ml×2)萃取。收集含有三氟甲磺酰基叠氮化物的有机馏分,并用饱和na2co3洗涤一次且无需进一步纯化即可使用。将三氟甲磺酰基叠氮化物在ch2cl2中的溶液加至69-7(1.71g,13.9mmol)、k2co3(2.03g,14.67mmol)和cuso4.5h2o(245mg,0.98mmol)在h2o(54ml)和meoh(108ml)中的混合物中。在将混合物在26℃搅拌12h后,减压除去有机溶剂并将含水浆液用h2o(200ml)稀释。将混合物用浓hcl酸化至ph6并用磷酸盐缓冲液(0.2m,ph6.2,200ml)稀释,并用etoac(300ml×2)洗涤。然后将水相用浓hcl酸化至ph=2。将其用萃取(300ml×3),并将萃取物经na2so4干燥并浓缩得到69-8,其无需进一步纯化即可用于下一步。步骤6.在将69-8(2.0g,9.78mmol)、69-6(1.2g,4.89mmol)和cu(ch3cn)4pf6(273mg,0.73mmol)在dmf(5ml)中的混合物在50℃搅拌2h后,除去溶剂,并将残留物经制备性hplc纯化,得到69-9(600mg,27.5%).步骤7.在将69-9(600mg,1.34mmol)、69-10(496mg,4.03mmol)和eedq(996mg,4.03mmol)在dcm(15ml)中的混合物在23℃搅拌4h后,除去溶剂,并将残留物经制备性hplc和sfc纯化,得到69-11(350mg,47.4%)和69-12(23.1mg).1hnmr(400mhz,meod)δ8.02(s,1h),7.54(d,j=6.8hz,2h),7.34-7.25(m,7h),5.49-5.46(m,1h),5.08(s,2h),4.55(s,2h),3.37-3.33(m,1h),3.24-3.16(m,1h),2.24-1.80(m,3h),1.45-1.43(m,7h),1.41(s,3h).lcms(esi):m/z552.1[m+h+].1hnmr(400mhz,meod)δ10.53(s,1h),8.03(s,1h),7.55(d,j=9.2hz,1h),7.35(d,j=4.0hz,2h),7.31-7.26(m,7h),6.04(s,1h),5.50-5.43(m,3h),5.12-5.03(m,3h),4.77-4.73(m,1h),4.44(d,j=3.2hz,2h),3.08-2.91(m,2h),2.24-2.16(m,2h),1.90-1.71(m,2h),1.35-1.20(m,6h),0.86-0.83(m,3h).lcms(esi):m/z552.2[m+h+].步骤8.将69-11(100mg,0.18mmol)、pnp碳酸盐(109mg,0.36mmol)和dipea(70mg,0.54mmol)在dcm(5ml)中的混合物在50℃搅拌12h。将其浓缩并加至dipea(70mg,0.54mmol)和诺氟沙星(172mg,0.54mmol)在dmf(5ml)中的混合物中。在将其在23℃搅拌4h后,除去溶剂,并将残留物经制备性hplc纯化,得到实施例69(69.3mg,43%).1hnmr(400mhz,dmso-d6)δ15.32(s,1h),10.63(s,1h),8.96(s,1h),8.02(s,1h),7.94(d,j=12.8hz,1h),7.70(d,j=8.0hz,1h),7.60(d,j=8.8hz,2h),7.38-7.20(m,8h),6.03(s,1h),5.49-5.42(m,3h),5.07(s,2h),5.04(d,j=4.0hz,2h),4.72-4.71(m,1h),4.58-4.57(m,2h),3.67(s,4h),3.61(s,4h),3.06-3.01(m,2h),2.12-2.07(m,2h),1.80-1.68(m,2h),1.42-1.38(m,3h),1.34(s,6h),0.84(s,3h).lcms(esi):m/z897.4[m+h+].实施例70:7-(4-((4-((s)-2-(4-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4,4a,8a-四氢喹啉-3-羧酸步骤1.向化合物70-1(3.0g,25.61mmol)在水(20ml)中的混合物中加入na2co3(2.71g,25.61mmol)。加入cbzcl(4.81g,28.17mmol)并将反应混合物在28℃搅拌16h。将混合物滤过并用etoac(15ml×2)萃取。将合并的有机层经na2so4干燥并减压浓缩得到化合物70-2(5.9g,92%).1hnmr(400mhz,cdcl3)δ8.21-7.30(m,5h),5.86(br,1h),5.15(s,2h),4.37-4.34(m,1h),2.28-2.21(m,1h),1.01-0.84(m,6h).步骤2.在28℃向化合物70-2(5.9g,23.48mmol)、n-甲氧基甲胺盐酸盐(2.52g,25.83mmol)和et3n(7.13g,70.44mmol)在dcm(60ml)中的溶液中加入hatu(13.4g,35.22mmol)。在将混合物在28℃搅拌3h后,除去溶剂并将残留物溶于水(30ml)。将水层用etoac(80ml×3)萃取。合并有机层,经na2so4干燥并浓缩。将粗物质经硅胶柱色谱纯化(pe/etoac=2:1)得到化合物70-3(4.5g,65%).lcms(esi):m/z295.1[m+h+].步骤3.在-78℃向化合物70-3(588mg,2.0mmol)在dcm(8ml)中的混合物中逐滴加入dibal-h在甲苯中的溶液(1m,2.4ml,2.4mmol)。在将混合物在-78℃搅拌2h后,逐滴加入meoh(1ml)。将混合物温热至室温。除去溶剂并将粗物质直接用于下一步。向上述粗物质在meoh(5ml)中的溶液中加入k2co3(553mg,4.0mmol)和化合物70-4(461mg,2.4mmol)。将反应混合物在26℃搅拌8h。除去溶剂并将残留物经硅胶柱色谱纯化(pe/etoac=20:1)得到化合物70-5(300mg,65.2%).lcms(esi):m/z232.1[m+h+].步骤4.在0℃向nan3(2.0g,30.76mmol)在蒸馏水(4.5ml)和dcm(7.5ml)中的混合物中逐滴加入tf2o(1.57g,5.55mmol)。将混合物在0℃搅拌3h。将水层用dcm(4ml×2)萃取,并用饱和na2co3溶液(8ml)洗涤。向化合物70-6(249mg,2.79mmol)、k2co3(578mg,4.19mmol)和cuso45h2o(7mg,27.9umol)在h2o(9ml)和meoh(18ml)中的混合物中逐滴加入三氟甲磺酰基叠氮化物在dcm(15.5ml)中的溶液。在将混合物在26℃搅拌过夜后,减压除去有机溶剂并将含水浆液用h2o(50ml)稀释。将其用浓hcl酸化至ph6,用磷酸盐缓冲液(0.2m,ph6.2,50ml)稀释,并用etoac(50ml×2)萃取。然后将水相用浓hcl酸化至ph2并用etoac(80ml×3)萃取。将有机层经na2so4干燥并蒸发得到70-7,其无需进一步纯化即可用于下一步。步骤5.向化合物70-7(321mg,2.79mmol)和化合物70-5(278mg,1.2mmol)在dmf(3ml)中的溶液中加入cu(ch3cn)4pf6(67mg,0.18mmol)。将反应混合物在50℃在氮气下加热2h。除去溶剂后,将残留物经硅胶柱色谱纯化(2.5-5%meoh/dcm)得到化合物70-8(90mg,22%).1hnmr(400mhz,dmso-d6)δ7.65(s,1h),7.37-7.32(m,5h),5.05(s,2h),4.64(s,1h),3.35(s,4h),2.02(s,1h),0.85-0.67(m,6h).步骤6.在25℃向化合物70-8(1.4g,4.04mmol)和化合物70-9(1.49g,12.12mmol)在dcm(15ml)中的溶液中加入eedq(3.0g,12.12mmol)。在将反应混合物在25℃搅拌2h后,除去溶剂,将残留物经制备性hplc纯化,得到混合物(1.1g)。两个异构体经sfc分离纯化,得到70-10a(250mg)和其他对映异构体70-10b(116mg).1hnmr(400mhz,meod)δ8.03(s,1h),7.57-7.54(m,2h),7.35-7.28(m,7h),5.57(q,j=7.2hz,1h),5.13-5.06(m,2h),4.72-4.65(m,1h),4.58(s,2h),2.21-2.17(m,1h),1.87(d,j=7.2hz,3h),0.97(d,j=6.8hz,3h),0.90(d,j=6.8hz,3h).lcms(esi):m/z452.2[m+h+].步骤7.在25℃向70-10a(100mg,0.221mmol)在thf(3ml)中的溶液中加入pnp碳酸盐(202mg,0.663mmol)和dipea(114mg,0.884mmol)。在将混合物回流加热24h后,除去溶剂,并将残留物经硅胶柱色谱纯化(dcm/meoh=20:1)得到中间体(90mg)。向诺氟沙星(70mg,0.219mmol)在dmf(2ml)中的溶液中加入dipea(94mg,0.73mmol)。在将溶液在25℃搅拌15min后,加入上述中间体(90mg,0.219mmol)。将混合物在25℃搅拌2h。除去溶剂并将残留物经制备性tlc纯化(dcm/meoh=10:1)得到实施例70(26.5mg,23%).1hnmr(400mhz,dmso-d6)δ15.32(s,1h),10.61(s,1h),8.98(s,1h),8.07(s,1h),7.95-7.92(m,1h),7.71-7.58(m,3h),7.38-7.16(m,8h),5.52(m,1h),5.10-5.00(m,4h),4.63-4.52(m,3h),3.60(s,4h),3.30(s,4h),2.10-2.00(m,1h),1.75(d,j=7.6hz,3h),1.42(t,j=7.6hz,3h),0.88-0.75(m,6h).lcms(esi):m/z797.6[m+h+].实施例71.7-(4-((4-((2s)-6-氨基-2-(4-(1-(苄基氧基羰基氨基)-2-(噻吩-2-基)乙基)-1h-1,2,3-三唑-1-基)己酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向化合物71-1(500mg,1.84mmol)在无水dcm(20ml)中的混合物中加入et3n(559mg,5.52mmol)和hatu(1.049g,2.76mmol)。将混合物在室温搅拌15min,然后加入nhme(ome)hcl(269mg,2.76mmol)。将反应混合物在室温搅拌过夜。将混合物用etoac(30ml×3)和水(30ml)萃取,将合并的有机层干燥,浓缩,并经硅胶柱色谱纯化(pe:etoac=2:1)得到71-2(500mg,86.4%).1hnmr(400mhz,dmso-d6)δ7.34(d,j=4.8hz,1h),7.22(d,j=9.2hz,1h),6.94-6.89(m,2h),4.56(s,1h),3.70(s,3h),3.11(s,3h),3.09-2.95(m,2h),1.35(s,9h).步骤2.将化合物71-2(500mg,1.59mmol)溶于无水ch2cl2(5ml)并在干冰/丙酮浴中冷却至-78℃。逐滴加入dibal-h(4.8ml,4.77mmol,1.0m在甲苯中)并将所得的溶液在-78℃搅拌3h。将过量的氢化物用meoh(5ml)淬灭并将所得的溶液温热至室温。将溶液蒸发得到化合物71-3,其无需进一步纯化。步骤3.向粗化合物71-3(406mg,1.59mmol)、化合物71-4(611mg,3.18mmol)在meoh(20ml)中的溶液中加入k2co3(659mg,4.77mmol)。将反应混合物在室温搅拌过夜。将混合物真空浓缩,并经硅胶柱色谱纯化(pe:etoac=5:1)得到71-5(250mg,62.3%).1hnmr(400mhz,dmso-d6)δ7.45(d,j=8.4hz,1h),7.35(dd,j=4.8,1.2hz,1h),6.96-6.92(m,2h),4.35-4.31(m,1h),3.19(d,j=1.2hz,1h),3.10-3.08(m,2h),1.36(s,9h).步骤4.在0℃向化合物71-5(250mg,0.99mmol)在dcm(5ml)中的溶液中逐滴加入hcl-etoac(5ml,4.0m,20.00mmol)。将反应混合物在0℃搅拌1h。将混合物在25℃真空浓缩得到71-6,其为盐酸盐(180mg,96.9%).步骤5.将cbz-cl(287mg,1.68mmol)在thf(2ml)中的溶液逐滴加至化合物71-6(170mg,0.91mmol)在饱和nahco3水溶液(2ml)中的溶液中。将反应混合物在0℃搅拌1h。将混合物用etoac(10ml×3)和h2o(10ml)萃取。将合并的有机层经na2so4干燥,滤过并浓缩。将残留物经硅胶柱色谱纯化(pe:etoac=5:1)得到化合物71-7(250mg,96.3%).1hnmr(400mhz,dmso-d6)δ7.93(d,j=8.4hz,1h),7.38-7.31(m,6h),6.96-6.93(m,2h),5.02(s,2h),4.45-4.39(m,1h),3.26(d,j=2.0hz,1h),3.13(dd,j=6.8,2.0hz,2h).步骤6.向化合物71-7(280mg,0.98mmol)和化合物71-8(400mg,1.47mmol)在dmf(5ml)中的溶液中加入cu(ch3cn)4pf6(37mg,0.1mmol)。将反应混合物在50℃搅拌2h,得到71-9,其直接用于下一步。步骤7.向粗化合物71-9(547mg,0.98mmol)在dmf(5ml)中的混合物中加入eedq(484mg,1.96mmol)和化合物71-10(181mg,1.47mmol)。将反应混合物在室温在氮气下搅拌过夜。将混合物经制备性hplc纯化,得到71-11(100mg,15.4%).1hnmr(400mhz,dmso-d6)δ10.54(s,1h),8.11–8.06(m,1h),7.90(t,j=8.4hz,1h),7.53(d,j=8.8hz,2h),7.36-7.26(m,8h),6.92-6.89(m,1h),6.85(d,j=3.2hz,1h),6.79(t,j=4.8hz,1h),5.44-5.40(m,1h),5.14(t,j=6.0hz,1h),5.06-4.93(m,3h),4.44(d,j=5.6hz,2h),3.43-3.38(m,1h),3.01-3.24(m,1h),2.90-2.85(m,2h),2.12-2.07(m,2h),1.43-1.39(m,2h),1.37(s,9h),1.18-1.10(m,2h).步骤8.在0℃向化合物71-11(100mg,0.15mmol)在无水dmf(2ml)中的溶液中加入dipea(116mg,0.90mmol)、pnp碳酸盐(91mg,0.30mmol)。在将反应混合物在0℃搅拌2h后,加入诺氟沙星。将混合物在0℃搅拌另外的1h,并将其经制备性hplc纯化,得到化合物71-12(120mg,79.4%).步骤9.向化合物71-12(100mg,0.10mmol)在无水dcm(2.5ml)中的混合物中加入tfa(0.5ml)。将反应混合物在0℃搅拌1h。然后将混合物用dmf稀释,并用nh3h2o逐滴调节至ph8。将所得的混合物经制备性hplc纯化,得到实施例71(63mg,69.4%)。lcms(esi):rt=0.830min,m/2+h+=454.8.方法=5-95/2min.1hnmr(400mhz,dmso-d6)δ10.84(bs,1h),8.96(s,1h),8.46(s,1h),8.13-8.09(m,1h),7.96-7.89(m,2h),7.61(d,j=8.8hz,2h),7.38-7.30(m,8h),7.21(d,j=7.2hz,1h),6.92-6.90(m,1h),6.86(d,j=2.0hz,1h),5.49-5.45(m,1h),5.08-4.92(m,5h),4.60-4.55(m,2h),3.61(s,4h),3.34-3.26(m,6h),2.70-2.66(m,2h),2.19-2.08(m,2h),1.57-1.49(m,2h),1.42-1.37(m,3h),1.23-1.16(m,2h).实施例72.7-(4-((4-((s)-6-氨基-2-(4-((s)-1-(苄基氧基羰基氨基)-2-苯基乙基)-1h-1,2,3-三唑-1-基)己酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.向化合物72-1(14.7g,0.1mol)在水(300ml)中的溶液中加入cu2(oh)2co3(38g,0.1mol)。将其回流加热1h。将固体滤出,并通过加入na2co3将滤液的ph调节至9.0。在0℃逐滴加入alloc-cl(14.4g,0.12mmol),同时通过加入na2co3将ph保持在9.0。将混合物在室温搅拌12h。将蓝色固体经滤过收集并重新溶于水(300ml)。加入硫代乙酰胺(20mmol)并将溶液在50℃搅拌3h。将溶液用hcl酸化为ph2.0并煮沸10min。将cus滤出,并将溶液浓缩为100ml,并将72-2经滤过收集。1hnmr(400mhz,meod)δ5.94-5.88(m,1h),5.30-5.26(m,1h),5.18-5.15(m,1h),4.55-4.93(m,1h),3.50(brs,1h),3.13-3.09(m,2h),2.00-1.70(m,2h),1.54-1.41(m,4h).步骤2.向nan3(1.78g,27.45mmol)在h2o(5ml)和dcm混合物(7.5ml)中的溶液中加入tf2o(0.93ml,5.55mmol)。在将混合物在室温搅拌2h后,将其用dcm(50ml×3)萃取。将有机层用aq.na2co3洗涤并浓缩为10ml。加入化合物72-2(640mg,2.8mmol),随后加入k2co3(577mg,4.19mmol)、cuso4(7mg,0.028mmol)、h2o(9ml)和meoh(18ml)。将混合物在室温搅拌12h。蒸发有机溶剂,将溶液用水稀释,并将ph用hcl调节为6.0并用磷酸盐缓冲液(0.25m,ph6.2,50ml)稀释。将混合物用etoac(50ml×3)萃取。将有机层干燥得到化合物72-3,其无需进一步纯化即可用于下一步。步骤3.向72-3(560mg,2mmol)在dmf(5ml)中的溶液中加入72-4(1.12g,4.0mmol)和cat.cu(ch3cn)4pf6。将混合物在50℃在氮气下搅拌3h。除去溶剂后,将残留物经制备性hplc纯化,得到72-5.lcms(esi):m/z536.2[m+h+]步骤4.向72-5(480mg,1.0mmol)在dcm(10ml)中的溶液中加入eedq(247mg,1.0mmol)和72-6(123g,1.0mmol),并将混合物在0℃在氮气下搅拌1h。除去溶剂后,将残留物用制备性hplc和sfc分离纯化,得到72-7and72-8.1hnmr(400mhz,cdcl3)δ7.91(s,1h),7.55-7.52(m,2h),7.33-7.15(m,12h),5.89-5.87(m,1h),5.42-5.38(m,1h),5.28-5.23(m,1h),5.15-5.02(m,3h),4.58(s,2h),4.51-4.47(m,2h),3.31-3.05(m,4h),2.20-2.15(m,2h),1.53-1.50(m,2h),1.31-1.21(m,2h).lcms(esi):m/z641.1[m+h+].1hnmr(400mhz,cdcl3)δ7.95(s,1h),7.56(d,j=8.4hz,2h),7.35-7.17(m,12h),5.95-5.88(m,1h),5.45-5.41(m,1h),5.30-5.26(m,1h),5.18-5.03(m,3h),4.58(s,2h),4.51-4.50(m,2h),3.31-3.23(m,1h),3.15-3.01(m,3h),2.23-2.15(m,2h),1.56-1.53(m,2h),1.32-1.22(m,2h).lcms:m/z641.1[m+h+].步骤5.向72-7(59mg,0.1mmol)在无水dcm(30ml)中的溶液中加入pnp碳酸盐(62mg,0.2mmol)和dipea(1ml)。将混合物回流加热16h。除去溶剂后,将残留物溶于dmf(5ml)。加入dipea(0.2ml)和诺氟沙星(65mg,0.2mmol)。将混合物在室温搅拌1h。除去溶剂后,将残留物经柱色谱纯化。向中间体在无水thf(10ml)中的溶液中加入pd(pph3)4(116mg,0.1mmol)。将混合物在室温在氮气下搅拌12h。除去溶剂后,将残留物经硅胶柱色谱纯化,得到实施例72.1hnmr(400mhz,cdcl3)δ8.86(s,1h),8.47(s,1h),8.01-7.93(m,2h),7.59-7.57(m,2h),7.39-7.37(m,2h),7.27-7.14(m,11h),5.41(s,1h),5.14(s,2h),5.09-4.92(m,3h),4.59-4.50(m,2h),3.72-3.71(m,4h),3.30(s,4h),3.21-3.19(m,2h),2.89-2.85(m,2h),2.25-2.23(m,2h),1.69-1.67(m,2h),1.52-1.49(m,3h),1.40-1.20(m,2h).lcms(esi):m/z902.5[m+h+].实施例73:7-(4-((4-((s)-2-(4-((s)-2-(苄基氧基羰基氨基)-3-甲基丁-2-基)-1h-1,2,3-三唑-1-基)丙酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4,4a,8a-四氢喹啉-3-羧酸步骤1.向aqna2co3(82g,0.78mol)和化合物73-1(20g,0.19mol)的混合物中加入cbz-osu(57g,0.23mol)在thf(150ml)中的溶液。在将混合物在室温搅拌16h后,将其调节至ph>10并将溶液用etoac(400ml×2)萃取。将水层用浓hcl酸化至ph<1并将溶液用etoac(500ml×2)萃取。将有机层经na2so4干燥并浓缩得到化合物73-2(45g,0.19mol),其无需进一步纯化即可用于下一步。步骤2.向化合物73-2(20g,84.3mmol)、n,o-二甲基羟胺盐酸盐(8.9g,92.7mmol)和hatu(48.1g,126.4mmol)在dcm(200ml)中的混合物中加入et3n(48.7ml,337.2mmol)。在将混合物在室温搅拌2h后,除去溶剂并将残留物用水(300ml)吸收。将水层用etoac(300ml×3)萃取。将有机层用饱和nahco3(100ml)、浓hcl(100ml),饱和nacl(100ml)洗涤。除去溶剂并将残留物经硅胶柱色谱纯化(pe:etoac=2:1)得到化合物73-4(12.9g,46.0mmol).步骤3.在-78℃将dibal(17.8ml,1m在tol中)逐滴加至化合物73-4(4.15g,14.8mmol)在无水ch2cl2(100ml)中的溶液中。将所得的溶液在-78℃搅拌2h并将过量的dibal用无水meoh(5ml)淬灭,并将所得的溶液温热至室温。将溶液浓缩得到化合物73-5(3.27g,14.8mmol),其无需进一步纯化即可用于下一步。步骤4.在将化合物75-5(3.27g,14.8mmol)、73-6(2.96g,17.8mmol)和k2co3(4.1g,29.7mmol)在meoh(60ml)中的混合物在室温搅拌16h后,减压除去溶剂并将粗残留物在etoac(200ml)和水(100ml)之间分配。将有机层用盐水洗涤并经无水na2so4干燥。除去溶剂后,将残留物经硅胶柱色谱纯化(pe:etoac=10:1)得到化合物73-7(606mg,2.79mmol).步骤5.历时5min在0℃向nan3(3.2g,49.3mmol)在蒸馏水(10ml)和ch2cl2(16ml)中的混合物中缓慢加入tf2o(1.7ml,9.9mmol)。在将其搅拌2h后,分离有机相并将水相用ch2cl2(8ml×2)萃取。将含有三氟甲磺酰基叠氮化物的有机馏分用饱和na2co3洗涤一次并加至化合物73-8(0.86g,4.93mmol)、k2co3(1.02g,7.40mmol)和cuso4.5h2o(25mg,0.099mmol)在蒸馏水(18ml)和meoh(36ml)中的混合物中。在将混合物在26℃搅拌12h后,减压除去有机溶剂并将含水浆液用h2o(50ml)稀释并用浓hcl酸化至ph6,并用0.2mph6.2磷酸盐缓冲液(50ml)稀释。将其用etoac(100ml×2)洗涤,然后将水相用浓hcl酸化至ph2。将其用etoac(200ml×3)萃取并将合并的层经na2so4干燥浓缩并无需进一步纯化即可用于下一步。步骤6.将化合物73-9(0.99g,4.93mmol)、化合物73-7(0.54g,2.46mmol)和cu(ch3cn)2pf6(115mg,0.37mmol)在dmf(5ml)中的混合物在50℃搅拌2h。除去溶剂并将残留物经制备性hplc纯化,得到化合物73-10(250mg,23%).步骤7.将化合物73-10(199mg,0.55mmol)、化合物73-11(176mg,1.43mmol)和eedq(353mg,1.43mmol)在dcm(10ml)中的混合物在24℃搅拌2h。除去溶剂并将残留物经制备性hplc纯化,得到73-12(100mg,39.1%).1hnmr(400mhz,meod)δ7.98(s,1h),7.54(d,j=8.4hz,2h),7.33-7.31(m,6h),7.10(s,1h),5.55-5.49(m,1h),4.98(s,2h),4.55(s,3h),2.35(s,1h),1.84(d,j=6.4hz,3h),1.69(s,3h),0.94(d,j=6.8hz,3h),0.79(d,j=6.8hz,3h).lcms(esi):m/z465.9[m+h+].步骤8.将73-12(150mg,0.29mmol)、pnp(173mg,0.57mmol)和dipea(111mg,0.86mmol)在dcm(5ml)中的混合物在50℃搅拌12h。除去溶剂并且残留物无需进一步纯化即可用于下一步。将混合物(200mg,0.29mmol)、dipea(112mg,0.87mmol)和诺氟沙星(316mg,0.87mmol)在dmf(5ml)中的溶液在25℃搅拌4h。除去溶剂并将残留物经制备性hplc纯化,得到实施例73(38.9mg,14.8%).1hnmr(400mhz,cdcl3)δ8.69(s,1h),8.11(d,j=12.8hz,1h),7.94(s,1h),7.59(s,1h),7.50(d,j=8.0hz,2h),7.32-7.27(m,6h),6.82(d,j=6.4hz,1h),5.45(s,1h),5.38-5.37(m,1h).5.10(s,2h),4.97(s,2h),4.34-4.29(m,2h),3.71(d,j=2.4hz,4h),3.25(s,4h),2.52-2.46(m,1h),1.94-1.91(m,3h),1.74(s,3h),1.58-1.56(m,3h),0.93(d,j=7.2hz,3h),0.82(d,j=6.8hz,3h).lcms(esi):m/z811.2[m+h+].实施例74.7-(4-((4-((s)-2-(4-((s)-1-(苄基氧基羰基氨基)-2-(4-氟苯基)乙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4,4a,8a-四氢喹啉-3-羧酸.步骤1.历时5min在搅拌的同时将tf2o(3.15ml,18.4mmol)缓慢加至冰浴中的nan3(5.93g,91.3mmol)在h2o(18ml)和dcm(30ml)中的溶液中。在将其在0℃搅拌2h后,分离有机相。将含水部分用dcm(30ml×2)萃取。收集含有三氟甲磺酰基叠氮化物的有机馏分并用饱和na2co3洗涤一次且无需进一步纯化即可使用。使化合物74-1(1.6g,9.14mmol)、k2co3(1.90g,13.7mmol)和cuso4.5h2o(46mg,0.183mmol)在h2o(33ml)和meoh(66ml)中混合。加入三氟甲磺酰基叠氮化物在dcm中的溶液并将混合物在20℃搅拌12h。减压除去有机溶剂并将含水浆液用h2o(60ml)稀释,用浓hcl酸化至ph6并用0.2mph6.2磷酸盐缓冲液(60ml)稀释。将其用etoac(150ml×2)萃取除去磺酰胺副产物。然后将水相用浓hcl酸化至ph2。将其用etoac(200ml×3)萃取并合并有机层,经na2so4干燥并蒸发得到74-2,其无需进一步纯化即可用于下一步。步骤2.将74-2(1.84g,9.14mmol)、74-3(1.36g,4.57mmol)和cu(cn)4pf6(213mg,0.687mmol)在dmf(10ml)中的混合物在50℃搅拌2h。除去溶剂后,将残留物经制备性hplc纯化,得到74-4(470mg,20.6%).lcms(esi):m/z499.2[m+h+].步骤3.将74-4(300mg,0.602mmol)、74-5(148mg,1.20mmol)和eedq(294mg,1.20mmol)在dcm(10ml)中的混合物在20℃搅拌10h。除去溶剂后,将残留物经制备性hplc和sfc纯化,得到74-6(160mg,44.1%)和74-7(95mg,26.2%).1hnmr(400mhz,dmso-d6)δ10.5(s,1h),8.07(s,1h),7.80(d,j=9.2hz,1h),7.53(d,j=6.8hz,2h),7.51-7.18(m,8h),7.05-7.00(m,2h),6.03-6.00(m,1h),5.47-5.41(m,3h),5.12-5.09(m,1h),4.99-4.88(m,3h)4.42(d,j=5.6hz,2h),3.17-2.92(m,4h),2.14-2.05(m,2h),1.28-1.22(m,2h).lcms(esi):m/z604.1[m+h+].1hnmr(400mhz,dmso-d6)δ10.56(s,1h),8.03(s,1h),7.81(d,j=9.2hz,1h),7.51(d,j=6.8hz,2h),7.28-7.18(m,8h),7.04-7.00(m,2h),6.06-6.03(m,1h),5.49-5.41(m,3h),5.13-5.10(m,1h),4.99-4.87(m,3h)4.42(d,j=5.6hz,2h),3.18-2.92(m,4h),2.13-2.02(m,2h),1.24-1.23(m,2h).lcms(esi):m/z604.1[m+h+].步骤4.将74-6(50mg,0.082mmol)、pnp(53mg,0.166mmol)和dipea(32mg,0.246mmol)在dcm(5ml)中的混合物在50℃搅拌12h。除去溶剂后,残留物无需进一步纯化即可使用。将上述粗产物(110mg,粗的,0.082mmol)、dipea(32mg,0.246mmol)和诺氟沙星(51mg,0.166mmol)在dmf(5ml)中的混合物在20℃搅拌2h。除去溶剂后,将残留物经制备性hplc纯化,得到实施例74(25mg,32.1%).1hnmr(400mhz,dmso-d6)δ15.64-15.33(m,1h),10.67(s,1h),8.96(s,1h),8.21-7.03(m,17h),6.08(s,1h),5.47(s,3h),5.08(s,2h),5.01-4.91(m,3h),4.58(s,2h).3.61(s,4h),3.31(s,4h),3.20-2.96(m,4h),2.12(s,2h),1.41-1.24(m,5h).lcms(esi):m/z949.1[m+h+],475.3[m/2+h+].实施例75.7-(4-((4-((s)-2-(4-((s)-1-氨基-3-甲基丁基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.历时15min将cbz-hosu(22.8g,91.4mmol)在thf(60ml)中的溶液逐滴加至75-1(10.0g,76.2mmol)在水(60ml)和thf(30ml)的混合物中的混合物中。将混合物用na2co3(24.2g,228.6mmol)处理。在将反应混合物在25℃搅拌16h后,除去溶剂并将残留物用etoac(150ml×3)萃取。将水相用浓hcl酸化至ph=2,并用etoac(60ml×3)萃取。将合并的有机层经na2so4干燥并减压浓缩得到75-2(21.0g粗的)。lcms(esi):m/z288.1[m+na+].步骤2.在25℃向75-2(5.0g,18.85mmol)、n,o-二甲基羟胺盐酸盐(2.2g,22.62mmol)和et3n(5.7g,56.55mmol)在dcm(150ml)中的溶液中加入hatu(10.8g,28.28mmol)。在将混合物在25℃搅拌2h后,除去溶剂并将残留物用水(80ml)吸收。将水层用etoac(80ml×2)萃取。将有机层用2nhcl溶液(80ml)洗涤并经na2so4干燥,滤过并浓缩。将粗物质经硅胶柱色谱纯化(pe/etoac=2:1)得到75-3(4.1g,71%).lcms(esi):m/z309.2[m+h+].步骤3.在-78℃将dibal-h在甲苯中的溶液(1m,16ml,16mmol)逐滴加至75-3(4.1g,13.3mmol)在dcm(25ml)中的混合物中。在将混合物在-78℃搅拌2h后,逐滴加入meoh(1ml)。将混合物温热至25℃,除去溶剂,并溶于meoh(40ml)。在0℃向该溶液中加入k2co3(3.68g,26.6mmol)和75-4(3.07g,16.0mmol)。在将溶液在25℃搅拌16h后,除去溶剂,并将粗物质用1nhcl溶液(30ml)吸收并用etoac(360ml×3)萃取。将有机层经na2so4干燥,滤过并真空浓缩。将粗物质经硅胶柱色谱纯化(pe/etoac=20:1)得到75-5(1.9g,58%).lcms(esi):m/z246.1[m+h+].步骤4.在25℃将cu(ch3cn)4pf6(432mg,1.16mmol)加至75-6(3.11g,15.48mmol)和化合物5(1.9g,7.74mmol)在dmf(15ml)中的溶液中。在后将反应混合物在50℃在氮气下加热2h,除去溶剂并将残留物经制备性hplc纯化,得到75-7(2.1g,61%).1hnmr(400mhz,dmso–d6)δ7.95(s,1h),7.69(d,j=8.8hz,1h),7.36-7.29(m,5h),5.96(br,1h),5.38-5.35(m,1h),5.07-4.99(m,2h),4.82-4.77(m,1h),2.94(s,2h),2.16-2.06(m,2h),1.68-1.56(m,3h),1.28-1.05(m,2h),0.92-0.80(m,6h).步骤5.将75-7(500mg,1.12mmol)、75-8(414mg,3.36mmol)和eedq(831mg,3.36mmol)在dcm(10ml)中的混合物在25℃搅拌2h。除去溶剂并将残留物经硅胶柱色谱纯化(dcm/meoh=5:1)得到75-9(350mg,57%).1hnmr(400mhz,meod)δ8.02(s,1h),7.56-7.54(m,2h),7.33-7.27(m,7h),5.50-5.46(m,1h),5.07(s,2h),4.95-4.91(m,1h),4.55(s,2h),3.25-3.07(m,2h),2.25-2.21(m,2h),1.77-1.64(m,3h),1.44-1.40(m,2h),0.96-0.95(m,6h).lcms(esi):m/z552.2[m+h+].步骤6.在25℃向75-9(120mg,0.218mmol)在thf(3ml)中的溶液中加入pnp碳酸盐(199mg,0.654mmol)和dipea(113mg,0.872mmol)。在将混合物在50℃加热18h后,除去溶剂,并将残留物溶于dmf(3ml)。加入诺氟沙星(104mg,0.327mmol)和dipea(141mg,1.09mmol)并将混合物在25℃搅拌6h。除去溶剂,并将残留物经制备性hplc纯化,得到实施例75(90mg,46%).1hnmr(400mhz,dmso-d6)δ15.34(s,1h),10.64(s,1h),8.97(s,1h),8.13(s,1h),8.04(s,1h),7.97-7.93(m,1h),7.73-7.70(m,1h),7.61-7.59(m,2h),7.38-7.20(m,8h),6.03(m,1h),5.47-5.43(m,1h),5.07-5.03(m,4h),4.82-4.74(m,1h),4.59-4.57(m,2h),3.61(s,4h),3.34(s,4h),2.90-3.01(m,2h),2.10-2.07(m,2h),1.62-1.56(m,3h),1.42-1.38(m,3h),1.27(m,2h),0.90-0.89(m,6h).lcms(esi):m/z897.4[m+h+].实施例76.7-(4-((4-((s)-2-(4-((s)-1-((s)-2-(6-(2,5-二氧代吡咯烷-1-基)己酰氨基)-4-甲基戊酰氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.实施例76使用如实施例57的操作制备,采用来自合成实施例57的中间体。lcms:(5-95,ab,1.5min,esi),0.828min,ms=529.4[1/2m+1]1hnmr甲醇-d4400mhz,δ8.89(s,1h),8.09(s,1h),8.00(d,j=13.2hz,1h),7.62(d,j=8hz,2h),7.38(d,j=8hz,2h),7.20(s,1h),5.51(d,j=5.2hz,1h),5.15(s,2h),4.96(d,j=6.8hz,1h),4.88(s,2h),4.60(s,4h),3.73(s,4h),3.46-3.42(m,2h),3.35(s,4h),2.65(s,4h),2.30-2.22(m,4h),1.65-1.56(m,9h),1.54-1.28(m,5h),1.00-0.97(m,12h).实施例77.7-(4-((4-((s)-2-(4-((s)-1-((s)-2-(6-(2,5-二氧代吡咯烷-1-基)己酰氨基)-3-苯基丙酰氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.实施例77使用如实施例59的操作制备,采用来自合成实施例59的中间体。lcms:(5-95,ab,1.5min,esi),0.841min,ms=546.5[1/2m+1]1hnmrdmso-d6400mhz,δ10.66(s,1h),8.96(s,1h),8.34(d,j=9.2hz,1h),8.09(s,1h),8.04(d,j=8.8hz,1h),7.95(d,j=12.8hz,1h),7.61(d,j=8.4hz,2h),7.36(d,j=8.8hz,2h),7.28-7.17(m,6h),6.05(s,1h),5.55-5.48(m,1h),5.43(s,2h),5.07(s,2h),4.90-4.86(m,1h),4.59-4.58(m,3h),3.61(s,4h),3.34-3.23(m,4h),3.04-2.95(m,4h),2.78(s,1h),2.59(s,4h),2.05-1.98(m,4h),1.43-1.22(m,10h),1.04(d,j=7.2hz,2h),0.77(d,j=6.8hz,3h),1.42(d,j=6.8hz,3h),.实施例78.7-(4-((4-((s)-2-(4-((s)-1-((s)-2-(6-(2,5-二氧代吡咯烷-1-基)己酰氨基)-3-甲基丁酰氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸实施例78使用如实施例60的操作制备,采用来自合成实施例60的中间体。步骤1.在室温向化合物60-5b(50mg,0.072mmol)在无水dmf(3ml)中的溶液中加入pnp碳酸盐(50mg,0.16mmol)和dipea(0.5ml,3mmol),并将混合物在室温搅拌1.5h。加入诺氟沙星(50mg,0.16mmol)。将混合物在室温搅拌额外的1h。将混合物浓缩,滤过并经制备性hplc纯化(fa),得到实施例78(38.8mg,收率:52%).lcms:(5-95,ab,1.5min,esi),0.833min,ms=522.4[1/2m+1]1hnmrdmso-d6400mhz,δ10.1(s,1h),8.93(s,1h),8.25-8.22(d,1h),8.04(s,1h),7.93-7.90(d,1h),7.81-7.79(d,1h),7.58-7.56(d,j=8.0hz,2h),7.35-7.33(d,j=8.0hz,2h),7.20-7.18(m,1h),6.0(m,1h),5.5(m,1h),5.40(s,2h),5.04(s,2h),4.9-4.87(m,1h),4.6-4.5(m,2h),4.2-4.1(m,1h),3.6(s,4h),3.2(m,6h),3.05-2.9(m,2h),2.55(s,4h),2.18-2.0(m,5h),1.9-1.8(m,1h),1.5-1.35(m,7h),1.3-1.05(m,4h),0.84-0.77(m,12h).实施例79.7-(4-((4-((s)-2-(4-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)-5-胍基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向化合物79-1(2g,19.4mmol)在thf(4ml)中的溶液中加入饱和aq.k2co3(30ml),随后在0℃加入cbz-cl(3.958g,23.2mmol)。在将反应混合物在28℃搅拌1h后,将其用etoac(20ml×3)和h2o(20ml)萃取。将合并的有机层经na2so4干燥,滤过并浓缩得到化合物79-2(5g,100%),其无需进一步纯化即可用于下一步。1hnmr(400mhz,dmso-d6)δ7.36-7.31(m,5h),6.92(d,j=8.8hz,1h),5.01(s,2h),3.39-3.32(m,3h),1.80-1.76(m,1h),0.85-0.80(m,6h).步骤2.在0℃在氮气下向化合物79-2(6.8g,28.7mmol)在dcm(100ml)中的溶液中加入dmp(14.59mg,343.4mmol)。在5min后,将反应混合物温热至室温并在室温搅拌1h。将反应混合物冷却至0℃并用饱和nahco3/na2so3溶液(1:1)洗涤。在分离后,将有机层再洗涤一次。将合并的水层用dcm(30ml×2)萃取。将其经na2so4干燥,滤过并浓缩得到化合物79-3(5.3g,79%),其无需进一步纯化即可用于下一步。1hnmr(400mhz,dmso-d6)δ9.51(d,j=0.8hz,1h),7.72-7.61(m,1h),7.43-7.30(m,5h),5.04(s,2h),3.91-3.88(m,1h),2.18-2.13(m,6h),0.94-0.82(m,6h).步骤3.向化合物79-3(粗的,4.9g,12.76mmol)、化合物79-4(4.9g,25.5mmol)在meoh(50ml)中的溶液中加入k2co3(5.28g,38.28mmol)。将反应混合物在室温搅拌过夜。将混合物浓缩并经硅胶柱色谱纯化(pe:etoac=10:1)得到预期产物79-5(1.30g,44%).1hnmr(400mhz,dmso-d6)δ7.74(d,j=8.8hz,1h),7.37-7.29(m,5h),5.01(s,2h),4.09-4.05(m,1h),3.16(d,j=2.4hz,1h),1.76(d,j=6.8hz,1h),0.91(d,j=6.8hz,3h),0.87(d,j=6.8hz,3h).步骤4.向化合物79-6(2g,3.09mmol)在dcm(30ml)中的溶液中加入化合物79-7(1.6ml,15.4mmol)。在将反应混合物在室温搅拌16h后,将其真空浓缩,并用mtbe洗涤,滤过得到预期产物79-8(1.315g,100%).步骤5.将nan3(1.6g,15.45mmol)在蒸馏水(5ml)和ch2cl2(10ml)中的混合物在冰浴上冷却。历时5min缓慢加入tf2o(1.1ml,6.18mmol)并搅拌2h。除去ch2cl2相并将水相用ch2cl2(5ml×2)萃取。收集含有三氟甲磺酰基叠氮化物的有机馏分并用饱和na2co3(40ml)洗涤一次且无需进一步纯化即可使用。将化合物79-8(1.315g,3.09mmol)、k2co3(641mg,4.635mmol)和cuso4·5h2o(155mg,0.618mmol)加至蒸馏水(10ml)和meoh(20ml)。加入三氟甲磺酰基叠氮化物在ch2cl2中的溶液(50ml)并将混合物在室温搅拌过夜。减压除去有机溶剂并将含水浆液用h2o(50ml)稀释并用浓hcl酸化至ph6,然后用0.2mph6.2磷酸盐缓冲液(50ml)稀释并用etoac(3×100ml)萃取除去磺酰胺副产物。然后将水相用浓hcl酸化至ph2。产物获得自另外一次etoac/meoh(20:1)萃取(4×100ml)。合并这些etoac/meoh萃取液,经na2so4干燥并蒸发得到化合物79-9,其无需进一步纯化(600mg,43%).步骤6.向化合物79-9(500mg,1.1mmol)和79-5(307g,1.33mmol)在dmf(5ml)中的溶液中加入cu(ch3cn)4pf6(165mg,0.44mmol)。将反应混合物在50℃搅拌2h,混合物(79-10)直接用于下一步。步骤7.向化合物79-10(粗的,752mg,1.1mmol)在dmf(5ml)中的混合物中加入eedq(544mg,2.2mmol)和化合物79-11(203g,1.65mmol)。将反应混合物在0℃搅拌并在氮气下温热至室温过夜。将混合物经制备性hplc和sfc分离纯化,得到化合物79-12(250mg,30%).步骤8.向化合物79-12(90mg,0.114mmol)和pnp碳酸盐(69mg,0.228mmol)在dmf(3ml)中的溶液中加入dipea(45mg,0.342mmol)。将反应混合物在21℃在氮气下搅拌3h。混合物(79-13)无需进一步纯化即可直接用于下一步。步骤9.向来自前面步骤的溶液中加入诺氟沙星(75mg,0.228mmol)。将反应混合物在21℃搅拌1h。将混合物经制备性hplc纯化,得到化合物79-14(80mg,62%).步骤10.在0℃向化合物79-14(60mg,0.053mmol)在dcm(5ml)中的溶液中加入tfa(1ml)。将反应混合物在16℃搅拌5h。将混合物经制备性hplc和sfc纯化,得到实施例79(30mg,64%).lcms(esi):rt=0.837min,m+h+=882.2.方法=5-95/1.5min.1hnmr(400mhz,dmso-d6)δ8.94(s,1h),8.48(s,1h),8.12(s,1h),7.92(d,j=12.4hz,1h),7.76(d,j=8.8hz,1h),7.61(s,1h),7.34(m,10h),5.07-4.99(m,5h),4.59(d,j=7.2hz,1h),3.61(s,4h),3.17(m,6h),3.12(s,2h),2.18-2.03(m,4h),1.39(s,5h),0.84(d,j=6.4hz,3h),0.78(d,j=6.0hz,3h).实施例80.(s)-7-(4-((4-(2-(4-(2-(苄基氧基羰基氨基)丙-2-基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.步骤1.向cbz-osu(57g,0.23mol)在thf(150ml)中的溶液中加入aqna2co3(82g,0.78mol)和80-1(20g,0.19mol)的混合物。在将其在室温搅拌16h后,将其调节至ph>10并用etoac(400ml×2)洗涤。收集水层并用浓hcl酸化至ph<1。将其用etoac(500ml×2)萃取。将有机层经na2so4干燥并蒸发得到80-2(45g,97.8%).步骤2.向80-2(20g,84.3mmol)、n,o-二甲基羟胺盐酸盐(8.9g,92.7mmol)和hatu(48.1g,126.4mmol)在dcm(200ml)中的混合物中加入et3n(48.7ml,337.2mmol)。将混合物在室温搅拌2h。除去溶剂后,将残留物用水(300ml)吸收。将水层用etoac(300ml×3)萃取并将有机层用饱和nahco3(150ml)、浓hcl(100ml)和饱和nacl(100ml)洗涤。将有机层经na2so4干燥,浓缩并经硅胶柱色谱纯化(pe:etoac=2:1)得到80-3(12.9g,54.6%).步骤3.在-78℃将dibal-h(17.8ml,1m在甲苯中)逐滴加至80-3(4.15g,14.8mmol)在无水ch2cl2(100ml)中的溶液中并将所得的溶液在-78℃搅拌2h。将过量的dibal经无水meoh(5ml)淬灭并将溶液温热至室温。将溶液浓缩得到80-4(3.27g),其无需进一步纯化即可用于下一步。步骤4.将80-4(3.27g,14.8mmol)、80-5(2.96g,17.8mmol)和k2co3(4.1g,29.7mmol)在meoh(60ml)中的混合物在室温搅拌16h。减压除去溶剂并将粗残留物在etoac(200ml)和水(100ml)之间分配。将有机层用盐水(50ml)洗涤并经无水na2so4干燥。减压除去溶剂并经硅胶柱色谱纯化(pe:etoac=10:1)得到80-6(606mg,18.9%).步骤5.历时5min在0℃将tf2o(1.7ml,9.9mmol)缓慢加至nan3(3.2g,49.3mmol)在蒸馏水(10ml)和ch2cl2(16ml)中的溶液中。在将其搅拌2h后,分离有机相,并将水相用ch2cl2(20ml×2)萃取。收集含有三氟甲磺酰基叠氮化物的合并的有机馏分并用饱和na2co3洗涤一次,且无需进一步纯化即可使用。向80-7(0.86g,4.93mmol)和k2co3(1.02g,7.40mmol)、cuso4.5h2o(25mg,0.099mmol)在h2o(18ml)和meoh(36ml)中的混合物中加入三氟甲磺酰基叠氮化物在ch2cl2中的溶液(32ml),并将混合物在26℃搅拌12h。减压除去有机溶剂并将含水浆液用h2o(50ml)稀释。将其用浓hcl酸化至ph6并用磷酸盐缓冲液(0.2m,ph6.2,50ml)稀释并用etoac(100ml×2)洗涤。然后将水相用浓hcl酸化至ph2并用etoac(100ml×2)萃取,经na2so4干燥并浓缩得到80-8,其无需进一步纯化即可用于下一步。步骤6.将80-8(0.99g,4.93mmol)、80-6(0.54g,2.46mmol)和cu(ch3cn)4pf6(115mg,0.37mmol)在dmf(5ml)中的混合物在50℃搅拌2h。除去溶剂后,将残留物经制备性hplc纯化,得到80-9(250mg,23%).步骤7.将80-9(199mg,0.48mmol)、80-10(176mg,1.43mmol)和eedq(353mg,1.43mmol)在dcm(10ml)中的混合物在24℃搅拌2h。除去溶剂后,将残留物经制备性hplc纯化,得到80-11(211mg,84%).1hnmr(400mhz,meod)δ8.00(s,1h),7.56(dd,j=1.6,8.4hz,2h),7.33-7.31(m,7h),5.48-5.44(m,2h),4.99(s,2h),4.56(s,2h),3.23-3.16(m,1h),3.09-3.03(m,1h),2.26-2.20(m,2h),1.68(s,6h),1.51-1.45(m,1h),1.39-1.29(m,1h).lcms(esi):m/z524.3[m+h+].步骤8.在将80-11(150mg,0.29mmol)、pnp碳酸盐(173mg,0.57mmol)和dipea(111mg,0.86mmol)在dcm(5ml)中的混合物在50℃搅拌12h后,除去溶剂并加至dipea(112mg,0.87mmol)和诺氟沙星(316mg,0.87mmol)在dmf(5ml)中的溶液中,并在25℃搅拌4h。除去溶剂并将残留物经制备性hplc纯化,得到实施例80(113mg,45%).1hnmr(400mhz,dmso-d6)δ10.65(s,1h),8.96(s,1h),7.98-7.93(m,2h),7.63-7.60(m,3h),7.38-7.20(m,9h),6.05(s,1h),5.44(s,3h),5.07(s,2h),4.93(s,2h),4.59-4.57(m,2h),3.61(s,4h),3.02-2.98(m,2h),2.12-2.02(m,2h),1.57(d,j=4.0hz,6h),1.42-1.38(m,3h),1.28-1.23(m,2h).lcms(esi):m/z869.3[m+h+].实施例81.7-(4-((4-((s)-2-(4-((s)-1-(苄基氧基羰基氨基)-2-苯基乙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4,4a,8a-四氢喹啉-3-羧酸.步骤1.向cbz-l-苯基丙氨酸(3.0g,10mmol)在dcm(100ml)中的溶液中加入hatu(4.57g,12.0mmol)和dipea(3.87g,30.0mmol)。在将其在室温搅拌15min后,加入n-甲氧基甲胺盐酸盐(1.2g,12mmol)。在将溶液搅拌另外的1h后,将其用dcm(60ml×3)萃取,用10%aq.hcl(60ml)和水(60ml)洗涤。将有机层经na2so4干燥,浓缩并经硅胶柱色谱纯化,得到81-2(3.2g,94%).1hnmr(400mhz,cdcl3)δ7.36-7.14(m,10h),5.42-5.40(m,1h),5.13-5.02(m,3h),3.69(s,3h),3.18(s,3h),3.11-3.06(m,1h),2.94-2.89(m,1h).步骤2.在-78℃在氮气下将dibal-h(20ml,1m在甲苯中)加至81-2(3.4g,10mmol)在无水dcm(150ml)中的溶液中。在将溶液在-78℃搅拌6h后,将混合物用meoh(50ml)和水(50ml)淬灭。将其滤过并将滤液经na2so4干燥,浓缩并且81-3无需进一步纯化即可直接用于下一步。lcms(esi):m/z284.1[m+h+].步骤3.在0℃向81-3(10mmol)在meoh(100ml)中的溶液中加入k2co3(2.76g,20mmol)和81-4(2.31g,12mmol)。在将反应混合物在0℃搅拌12h后,除去溶剂并将残留物经硅胶柱色谱纯化,得到81-5.lcms(esi):m/z280.1[m+h+].步骤4.向nan3(1.78g,27.45mmol)在h2o(5ml)和dcm混合物(7.5ml)中的溶液中加入tf2o(0.93ml,5.55mmol)。在将混合物在室温搅拌2h后,将其用dcm(60ml×3)萃取。将有机层用aq.na2co3洗涤并浓缩为10ml。然后加入81-6(500mg,2.8mmol),随后加入k2co3(577mg,4.19mmol)、cuso4(7mg,0.028mmol)、h2o(9ml)和meoh(18ml)。将混合物在室温搅拌12h。在蒸发有机溶剂后,将其用水(20ml)稀释并将ph用hcl调节至6.0,然后用磷酸盐缓冲液(0.25m,ph6.2,50ml)稀释。将混合物用etoac(50ml×3)萃取。将有机层经na2so4干燥得到81-7,其直接用于下一步。步骤5.向81-5(560mg,2mmol)在dmf(5ml)中的溶液中加入81-7(804mg,4.0mmol)和cat.cu(ch3cn)4pf6。将混合物在50℃在氮气下搅拌3h。除去溶剂后,将残留物经制备性hplc纯化,得到81-8.1hnmr(400mhz,meod)δ8.00(s,1h),7.57(d,j=8.4hz,2h),7.35-7.18(m,12h),5.50-5.45(m,1h),5.14-5.11(m,1h),5.05-5.03(m,2h),4.58(s,2h),3.26-3.24(m,2h),3.13-3.12(m,2h),2.35-2.15(m,2h),1.55-1.35(m,2h).步骤6.在氮气下向81-8(480mg,1.0mmol)在dcm(10ml)中的溶液中加入eedq(247mg,1.0mmol)和81-9(123g,1.0mmol)并将混合物在0℃搅拌1h。除去溶剂后,将残留物经制备性hplc和sfc分离纯化,得到81-10and81-11.1hnmr(400mhz,meod)δ8.00-7.95(m,1h),7.58-7.56(m,2h),7.35-7.18(m,12h),5.51-5.47(m,1h),5.15-5.09(m,1h),5.55-5.00(m,2h),4.58(s,2h),3.33-3.20(m,2h),3.16-3.09(m,2h),2.25-2.18(m,2h),1.43-1.38(m,2h).lcms(esi):m/z586.0[m+h+].1hnmr(400mhz,meod)δ7.96(s,1h),7.57(d,j=8.8hz,2h),7.35-7.18(m,12h),5.52-5.48(m,1h),5.13-4.87(m,3h),4.58(s,2h),3.33-3.15(m,2h),3.14-3.07(m,2h),2.27-2.14(m,2h),1.46-1.31(m,2h).lcms(esi):m/z586.1[m+h+].步骤7.向81-10(59mg,0.1mmol)在无水dcm(30ml)中的溶液中加入pnp碳酸盐(62mg,0.2mmol)和dipea(1ml)。将混合物回流加热16h。除去溶剂后,将残留物溶于dmf(5ml)和dipea(0.3ml)并加入诺氟沙星(65mg,0.2mmol)。将混合物在室温搅拌1h。除去溶剂后,将残留物经制备性hplc纯化,得到实施例81.1hnmr(400mhz,dmso-d6)δ15.35(brs,1h),10.66(s,1h),8.97(s,1h),8.10(s,1h),7.95(d,j=12.8hz,1h),7.85-7.83(m,1h),7.62(d,j=8.4hz,2h),7.39-7.19(m,13h),6.07-6.02(m,1h),5.51-5.45(m,3h),5.07(s,2h),5.01-4.92(m,3h),4.59(d,j=7.6hz,2h),3.61(s,4h),3.44-3.38(m,4h),3.21-3.16(m,1h),3.06-2.98(m,3h),2.12-2.00(m,2h),1.45-1.15(m,5h).lcms(esi):m/z931.2[m+h+].实施例82.(s)-7-(4-((4-(2-(4-(1-(苄基氧基羰基氨基)环丙基)-1h-1,2,3-三唑-1-基)-5-脲基戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸步骤1.向82-1(10g,98.9mmol)在na2co3水溶液(41.9g,395.6mmol)中的混合物中加入cbz-osu(29.6g,118.7mmol)在thf(150ml)中的溶液。在将混合物在室温搅拌16h后,将其调节至ph>10并将溶液用etoac(200ml×2)洗涤。将水层用浓hcl酸化至ph<1并将溶液用etoac(250ml×2)萃取。将有机层经na2so4干燥并浓缩得到82-2(23g,粗的),其无需进一步纯化即可用于下一步。步骤2.向82-2(10g,42.5mmol)、n,o-二甲基羟胺盐酸盐(4.5g,46.8mmol)和hatu(24.2g,63.8mmol)在dcm(100ml)中的溶液中加入et3n(24.6ml,170.0mmol)。在将混合物在室温搅拌2h后,除去溶剂,并将粗物质用水(300ml)吸收。将水层用etoac(300ml×3)萃取。将有机层用饱和nahco3、稀hcl、饱和nacl洗涤,浓缩并经硅胶柱色谱纯化(pe:etoac=2:1)得到82-3(10.8g,91.3%).步骤3.在-78℃将dibal-h(22.5ml,1m在甲苯中)逐滴加至82-3(4.2g,15.0mmol)在无水ch2cl2(50ml)中的溶液中。在将混合物在-78℃搅拌2h后,将过量的dibal经无水meoh(15ml)淬灭并将所得的溶液温热至室温。将溶液浓缩得到82-4(3.3g,粗的),其无需进一步纯化即可用于下一步。步骤4.在将82-4(3.3g,15.0mmol)、82-5(3.0g,18.1mmol)和k2co3(4.1g,30mmol)在meoh(60ml)中的混合物在室温搅拌16h后,减压除去溶剂并将粗残留物在etoac(200ml)和水(100ml)之间分配。将有机层用盐水洗涤并经无水na2so4干燥。除去溶剂后,将残留物经硅胶柱色谱纯化(pe:etoac=10:1)得到82-6(1.8g,55.6%).步骤5.在0℃将tf2o(4.7ml,27.9mmol)缓慢加至nan3(9.2g,139.3mmol)在蒸馏水(30ml)和dcm(48ml)中的混合物中。在将其搅拌2h后,分离dcm层并将含水部分用ch2cl2(24ml×2)萃取。收集含有三氟甲磺酰基叠氮化物的有机馏分并用饱和na2co3洗涤一次,且无需进一步纯化即可使用。将三氟甲磺酰基叠氮化物在ch2cl2中的溶液(96ml)加至82-7(2.44g,13.9mmol)、k2co3(2.89g,20.9mmol)和cuso4.5h2o(347mg,1.39mmol)在h2o(54ml)和meoh(108ml)中的混合物中。在将混合物在26℃搅拌12h后,减压除去有机溶剂并将含水浆液用h2o(200ml)稀释。将混合物用浓hcl酸化至ph=6并用磷酸盐缓冲液(0.2m,ph6.2,200ml)稀释并用etoac(300ml×2)洗涤。然后将水相用浓hcl酸化至ph=2。将其用etoac(300ml×3)萃取。将有机层经na2so4干燥并浓缩得到82-8,其无需进一步纯化即可用于下一步。步骤6.在将82-8(2.8g,14.0mmol)、82-6(1.5g,7.0mmol)和cu(cn)4pf6(779mg,2.1mmol)在dmf(20ml)中的混合物在50℃搅拌2h后,除去溶剂并将残留物经制备性hplc纯化,得到82-9(200mg,6.9%).步骤7.在将82-9(410mg,0.98mmol)、82-10(364mg,2.95mmol)和eedq(730mg,2.95mmol)在dcm(10ml)中的混合物在24℃搅拌2h后,除去溶剂,并将残留物经制备性hplc纯化,得到82-11(350mg,68%).1hnmr(400mhz,meod)δ7.96(s,1h),7.60(d,j=8.4hz,2h),7.42-7.35(m,7h),5.50-5.46(m,1h),5.14(s,2h),4.61(s,2h),3.24-3.22(m,1h),3.15-3.13(m,1h),2.30-2.15(m,2h),1.46-1.40(m,4h),1.29(s,2h).lcms(esi):m/z522.0[m+h+].步骤8.在将82-11(200mg,0.38mmol)、pnp(234mg,0.77mmol)和dipea(149mg,1.15mmol)在dcm(10ml)中的混合物在50℃搅拌12h后,将其浓缩并加至dipea(149mg,1.15mmol)和诺氟沙星(367mg,1.15mmol)在dmf(8ml)中的溶液中。在将其在23℃搅拌4h后,除去溶剂,并将残留物经制备性hplc纯化,得到实施例82(50mg,15.2%).1hnmr(400mhz,dmso-d6)δ10.62(s,1h),8.96(s,1h),8.18(s,1h),7.96-7.89(m,2h),7.62-7.60(m,2h),7.38-7.36(m,7h),7.22-7.20(m,1h),6.04(s,1h),5.43(s,3h),5.07(s,2h),5.03(s,2h),4.59-4.57(m,2h),3.67(s,6h),3.30--2.98(m,4h),2.20-2.09(m,2h),1.42-1.38(m,3h),1.25-1.22(s,4h),1.13(s,2h).ms(esi):m/z867.05[m+h+],889.16[m+na+].实施例83.7-(4-((4-((s)-5-氨基-2-(4-((s)-1-(苄基氧基羰基氨基)-2-甲基丙基)-1h-1,2,3-三唑-1-基)戊酰氨基)苄基氧基)羰基)哌嗪-1-基)-1-乙基-6-氟-4-氧代-1,4-二氢喹啉-3-羧酸.实施例83使用如实施例58的操作制备。1hnmr(400mhz,dmso-d6)δ8.96(s,1h),8.47-8.39(m,1h),8.08(s,1h),7.94(d,j=13.2hz,1h),7.74(d,j=9.2hz,1h),7.61(d,j=8.4hz,2h),7.38-7.29(m,8h),7.22-7.20(m,1h),5.49-5.47(m,1h),5.07(s,2h),5.02(d,j=6.0hz,2h),4.62-4.55(m,3h),3.60(s,4h),3.16(s,4h),2.77-2.70(m,2h),2.20-2.15(m,2h),2.09-2.00(m,1h),1.40(t,j=6.8hz,5h),1.23(s,1h),0.85(d,j=6.8hz,3h),0.78(d,j=6.8hz,3h).lcms(esi):m/z840.2[m+h+].制备接头-药物化合物的方法制备cbi-pbdld1(11as)-8-(6-((s)-1-(氯甲基)-5-(膦酰氧基)-1h-苯并[e]吲哚-3(2h)-基)-6-氧代己基氧基)-11-羟基-7-甲氧基-5-氧代-2,3,11,11a-四氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-10(5h)-羧酸4-((s)-6-氨基-2-(1-(5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基氨基甲酰基)环丁烷甲酰氨基)己酰氨基)苄基酯合成方案实施例1.2,2,2-三氟乙酸化合物与(11as)-8-((6-((s)-1-(氯甲基)-5-(膦酰氧基)-1h-苯并[e]吲哚-3(2h)-基)-6-氧代己基)氧基)-11-羟基-7-甲氧基-5-氧代-2,3,11,11a-四氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-10(5h)-羧酸4-((s)-6-氨基-2-(1-((5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基)氨基甲酰基)环丁烷甲酰氨基)己酰氨基)苄基酯(1:1)(cbi-pbdld1).在20℃在氮气气氛下向苯酚1(3.34g,10.0mmol)在无水dcm(25ml)中的搅拌的均匀溶液中加入4mhcl在二噁烷中的溶液(12.5ml,50.0mmol)。在加入后,将反应混合物在20℃在氮气下搅拌另外的20h。将混合物用石油醚(250ml)稀释并在20℃在氮气下搅拌20min。弃去溶剂并使用石油醚(250ml)重复该操作一次。将所得的固体在25℃真空干燥1h得到化合物2(2.7g,100%);1hnmr[(cd3)2so]δ10.80(s,1h),8.15(d,j=8.3hz,1h),7.87(d,j=8.2hz,1h),7.58(brt,j=7.5hz,1h),7.43(brt,j=7.4hz,1h),6.81(s,1h),4.27-4.17(m,1h),4.01(dd,j=11.0,3.2hz,1h),3.93-3.74(m,3h),未观察到2个质子。粗产物无需进一步纯化即可用于下一步。在0℃在氮气气氛下向胺2(2.7g,10.0mmol)在无水dcm(10ml)和二噁烷(30ml)中的搅拌的均匀混合物中加入三氟乙酸酐(tfaa)(3.4ml,24.0mmol),随后加热二异丙基乙胺(dipea)(8.71ml,50.0mmol)。加入后,将反应混合物在0℃在氮气下搅拌另外的50min。加入乙酸乙酯(400ml)并在0℃加入1nhcl(200ml)并将混合物在氮气下搅拌20min。分离乙酸乙酯层,先后用1nhcl(200ml)和水(2x200ml)洗涤,然后干燥(mgso4)并在25℃的浴温减压蒸发得到3(3.3g,100%),其为绿灰色固体。该物质无需进一步纯化即可用于下一步。在20℃在氮气气氛下向苯酚3(3.3g,10.0mmol)在无水thf(40ml)中的搅拌的均匀溶液中加入二叔丁基-n,n-二异丙基亚磷酰胺(4.31ml,13.0mmol)。加入后,将反应混合物在20℃在氮气下搅拌5-10min,然后历时17min逐滴加入四唑(3%在ch3cn中的溶液,38.0ml,13.0mmol)。将最终反应混合物在20℃在氮气下搅拌另外的19h。将混合物在冰浴中冷却并加入30%h2o2(11.3ml,100.0mmol)。加入后,将反应混合物在20℃搅拌另外的1h30min。将混合物用乙酸乙酯(300ml)和10%na2s2o3水溶液(500ml)稀释并在0℃搅拌20min。分离乙酸乙酯层并先后用水(200ml)、饱和nahco3(200ml)和水(200ml)洗涤,然后干燥(mgso4)并在25℃的浴温减压蒸发得到琥珀色油状物。经硅胶色谱纯化(用乙酸乙酯:石油醚1:3洗脱)得到化合物4(4.7g,90%),其为无色泡沫状固体,mp39-42℃;[α]d-61.8°(c1.02,chcl3).分析(c23h28clf3no5p)计算:c,52.93;h,5.41;n,2.68.实测值:c,53.05;h,5.43;n,2.80.向醇5(4.14g,6.95mmol)(j.med.chem.2003,46,2132-2151)在无水dcm(25ml)中的搅拌溶液中加入乙酸酐(3.30ml,34.8mmol)和三乙胺(5.81ml,41.7mmol)。将混合物在20℃搅拌3h30min。加入无水meoh(4.0ml)并将混合物搅拌30min。将混合物在etoac(400ml)和水(400ml)之间分配。分离etoac层,用水(2x200ml)洗涤,然后干燥(mgso4)并蒸发得到乙酸酯6(4.28g,96%),其为油状物;[α]d-57.4°(c0.21,chcl3);1hnmr[(cd3)2so]δ7.17(s,1h),6.87(s,1h),6.01-5.87(m,1h),5.32(dd,j=17.2,1.5hz,1h),5.21(dd,j=10.4,1.4hz,1h),4.89(s,2h),4.54(d,j=5.4hz,2h),4.39-4.20(m,3h),3.93(t,j=6.4hz,2h),3.75(s,3h),3.46-3.27(m,2h),2.13-1.90(m,4h),1.89-1.60(m,7h),1.54-1.40(m,2h),2个质子由dmso峰掩蔽。hrms(esi)m/zc27h36cl3n2o9计算值:637.1481,实测值:637.1475[mh+];c27h35cl3n2nao9计算值:659.1300,实测值:659.1303[mna+];c27h35cl3kn2o9计算值:675.1040,实测值:675.1035[mk+].向乙酸酯6(4.27g,6.69mmol)在丙酮(75ml)、水(50ml)和thf(30ml)中的搅拌溶液中加入锌粉(17.5g,268mmol)和nh4cl(28.6g,535mmol)。将混合物在20℃在氮气气氛下搅拌42h。加入丙酮(100ml),将混合物搅拌10min,并弃去上清液。重复两次该操作并将合并的上清液减压蒸发除去丙酮和thf。将残留物用水(50ml)稀释并用1nhcl水溶液酸化为ph约为1。将酸性混合物用石油醚(2x200ml)洗涤并用etoac(400ml)萃取。将etoac萃取液用水(200ml)洗涤并干燥(mgso4)且蒸发溶剂得到酸7(2.72g,80%),其为油状物;[α]d-73.5°(c1.12,chcl3);1hnmr[(cd3)2so]δ11.99(s,可与d2o交换,1h),9.10(s,可与d2o交换,1h),7.17(s,1h),6.87(s,1h),6.00-5.86(m,1h),5.32(dd,j=17.2,1.5hz,1h),5.20(dd,j=10.4,1.5hz,1h),4.57-4.52(m,2h),4.37-4.03(m,3h),3.93(t,j=6.5hz,2h),3.75(s,3h),3.40-3.10(m,2h),2.23(t,j=7.3hz,2h),2.07-1.93(m,4h),1.89-1.66(m,5h),1.62-1.49(m,2h),1.47-1.34(m,2h)。hrms(esi)m/zc25h35n2o9计算值:507.2337,实测值:507.2340[mh+];c25h34kn2o9计算值:545.1896,实测值:545.1906[mk+];c25h34n2nao9计算值:529.2157,实测值:529.2169[mna+].在0℃在氮气气氛下向三氟乙酰胺4(1.38g,2.64mmol)在meoh(10ml)中的搅拌溶液中加入cs2co3(1.03g,3.17mmol)。将混合物在0℃搅拌2h30min,然后在etoac(200ml)和水(150ml)之间分配。分离etoac层并再次用水(100ml)洗涤,然后干燥(mgso4)并在25℃的浴温减压蒸发得到不稳定的胺8(1.17g),其为淡黄色泡沫状固体。将该粗物质用酸7(1.24g,2.45mmol)、edci.hcl(1.41g,7.35mmol)和对甲苯磺酸(84mg,0.49mmol)在无水dma(14ml)中的溶液在0-20℃处理22h。将混合物在etoac(400ml)和水(300ml)之间分配。分离etoac层并再次用水(100ml)洗涤,然后干燥(mgso4)并蒸发。经硅胶色谱纯化(用etoac:石油醚2:1洗脱)得到酰胺9(1.49g,66%),其为淡黄色泡沫状固体,mp55-59℃;[α]d-68.0°(c1.00,chcl3);1hnmr[(cd3)2so]δ9.10(s,可与d2o交换,1h),8.56(s,1h),8.03(d,j=8.1hz,1h),7.92(d,j=8.4hz,1h),7.57(t,j=8.1hz,1h),7.47(t,j=7.6hz,1h),7.19(s,1h),6.86(s,1h),5.99-5.86(m,1h),5.32(dd,j=17.2,1.6hz,1h),5.20(dd,j=10.4,1.5hz,1h),4.53(d,j=5.4hz,2h),4.45-3.84(m,10h),3.74(s,3h),3.44-3.26(m,2h),2.68-2.47(m,2h),2.02(brs,3h),1.93-1.43(m,10h),1.474和1.469(2s,18h)。hrms(esi)m/zc46h62cln3o12p计算值:914.3754,实测值:914.3749[mh+];c46h61clkn3o12p计算值:952.3313,实测值:952.3381[mk+];c46h61cln3nao12p计算值:936.3574,实测值:936.3589[mna+].在20℃在氮气气氛下向氨基甲酸酯9(548mg,0.60mmol)在dcm(8ml)中的搅拌溶液中加入pd(ph3p)4(17.1mg;9.8%pd)和吡咯烷(0.49ml,6.00mmol)。将混合物在20℃搅拌30min,然后在etoac(200ml)和水(150ml)之间分配。分离etoac层并再次用水(50ml)洗涤,然后干燥(mgso4)并在25℃的浴温减压蒸发。将粗产物经硅胶色谱纯化(用etoac:meoh50:1洗脱)得到苯胺10(323mg,65%),其为淡黄色泡沫状固体,mp46-49℃;[α]d-85.2°(c0.36,chcl3);1hnmr[(cd3)2so]δ8.56(s,1h),8.04(d,j=8.3hz,1h),7.93(d,j=8.4hz,1h),7.58(t,j=8.2hz,1h),7.47(t,j=8.1hz,1h),6.67(s,1h),6.37(s,1h),5.09(s,可与d2o交换,2h),4.46-3.85(m,10h),3.63(s,3h),3.52-3.34(m,2h),2.69-2.50(m,2h),2.08-1.94(m,1h),2.01(s,3h),1.91-1.61(m,7h),1.58-1.44(m,2h),1.476和1.470(2s,18h)。hrms(esi)m/zc42h58cln3o10p计算值:830.3522,实测值:830.3543[mh+].在20℃在氮气气氛下向苯胺10(293mg,0.35mmol)和dmap(202mg,1.65mmol)在无水dcm(7ml)中的搅拌溶液中加入双光气在无水dcm中的溶液(0.05m,6.7ml,0.33mmol)。将混合物搅拌25min,然后加入醇11(1.54g,3.54mmol)在无水dcm(20ml)中的溶液。将混合物在20℃在氮气气氛下搅拌68h,然后在etoac(300ml)和水(200ml)之间分配。分离etoac层,再次用水(100ml)洗涤,然后干燥(mgso4)并在30℃的浴温蒸发。将所得的橙色油状物经硅胶色谱纯化(用etoac:meoh:石油醚30:0.5:10洗脱)得到氨基甲酸酯12(385mg,84%),其为泡沫状固体,mp72-75℃;[α]d-55.2°(c0.53,chcl3);1hnmr[(cd3)2so]δ10.04(s,可与d2o交换,1h),9.12(brs,可与d2o交换,1h),8.56(s,1h),8.03(d,j=8.3hz,1h),7.92(d,j=8.4hz,1h),7.65-7.52(m,3h,在d2o后减少为2h),7.46(t,j=7.8hz,2h),7.31(d,j=8.5hz,2h),7.20(brs,1h),6.86(s,1h),6.75(不良拆分的t,可与d2o交换,1h),5.97-5.83(m,1h),5.30(brd,j=17.3hz,1h),5.17(brd,j=10.6hz,1h),5.18-4.97(m,2h),4.51-3.85(m,13h),3.74(s,3h),3.43-3.23(m,2h,由水峰部分掩蔽),2.94-2.83(m,2h),2.65-2.50(m,2h,由dmso峰部分掩蔽),2.07-1.91(m,1h),2.01(brs,3h),1.88-1.43(m,11h),1.473-1.468(2s,18h),1.43-1.20(m,4h),1.35(s,9h)。hrms(esi)m/zc65h89cln6o17p计算值:1291.5665,实测值:1291.5705[mh+];c65h88clkn6o17p计算值:1329.5262,实测值:1329.5264[mk+];c65h88cln6nao17p计算值:1313.5554,实测值:1313.5524[mna+].将乙酸酯12(366mg,0.28mmol)和k2co3(1.14g,8.24mmol)在dcm(9ml)和meoh(9ml)中的混合物在0℃搅拌3h30min。将混合物与冷的etoac(200ml)和冰水(150ml)搅拌10min。分离etoac层,再次用水(100ml)洗涤,然后干燥(mgso4)并在25℃的浴温蒸发得到醇13(343mg,97%),其为无色泡沫状固体,mp71-75℃;[α]d-58.2°(c0.57,chcl3);1hnmr[(cd3)2so]δ10.04(s,可与d2o交换,1h),9.11(brs,可与d2o交换,1h),8.56(s,1h),8.03(d,j=8.3hz,1h),7.92(d,j=8.4hz,1h),7.65-7.53(m,3h,在d2o后减少为2h),7.46(t,j=7.6hz,2h),7.32(d,j=8.6hz,2h),7.27(brs,1h),6.93(s,1h),6.75(不良拆分的t,可与d2o交换,1h),5.97-5.82(m,1h),5.29(brd,j=17.2hz,1h),5.17(brd,j=10.5hz,1h),5.03(brs,2h),4.73(t,j=5.8hz,可与d2o交换,1h),4.50-3.82(m,11h),3.74(s,3h),3.62-3.44(m,2h),3.40-3.21(m,2h,由水峰部分掩蔽),2.95-2.80(m,2h),2.65-2.50(m,2h,由dmso峰部分掩蔽),1.93-1.21(m,16h),1.473-1.468(2s,18h),1.35(s,9h)。hrms(esi)m/zc63h86clkn6o16p计算值:1287.5158,实测值:1287.5113[mk+];c63h86cln6nao16p计算值:1271.5419,实测值:1271.5381[mna+].在0℃历时3min向醇13(322mg,0.26mmol)在无水dcm(14ml)中的搅拌溶液中分批加入dess-martin高碘烷(dmp)(131mg,0.31mmol)。将反应混合物在0℃搅拌另外的2h,然后在20℃搅拌50h。将混合物用dcm(40ml)和10%na2s2o3(40ml)稀释,在20℃搅拌10min,然后在dcm(200ml)和饱和nahco3溶液(150ml)之间分配。分离dcm层并将水层进一步用dcm(2x50ml)萃取。将合并的dcm萃取液用饱和nahco3溶液(2x100ml)和水(2x100ml)洗涤,然后干燥(mgso4)并在25℃的浴温蒸发。将所得的橙色油状物经硅胶色谱纯化(用chcl3:meoh40:1洗脱)得到14(228mg,71%),其为淡棕色泡沫状固体,mp98℃(分解);[α]d+74.5°(c0.26,chcl3);1hnmr[(cd3)2so]δ10.02(s,可与d2o交换,1h),8.56(s,1h),8.04(d,j=8.3hz,1h),7.92(d,j=8.4hz,1h),7.65-7.47(m,5h,在d2o后减少为4h),7.25-7.12(m,2h,brs和1h,在d2o交换时),7.03(s,1h),6.83-6.64(m,2h),6.48(brs,可与d2o交换,1h),5.96-5.80(m,1h),5.52-5.39(m,d在d2o交换时,j=9.6hz,1h),5.27(brd,j=16.8hz,1h),5.21-5.10(m,2h),4.81(brd,j=12.3hz,1h),4.54-3.85(m,8h),3.83-3.70(m,5h),3.53-3.21(m,3h,由水峰部分掩蔽),2.93-2.82(m,2h),2.64-2.47(m,2h,由dmso峰部分掩蔽),2.10-1.20(m,16h),1.470and1.464(2s,18h),1.34(s,9h)。hrms(esi)m/zc63h84clkn6o16p计算值:1285.5002,实测值:1285.4938[mk+];c63h84cln6nao16p计算值:1269.5262,实测值:1269.5220[mna+].在20℃在氮气气氛下向14(125mg,0.10mmol)在dcm(2ml)中的搅拌溶液中加入pd(ph3p)4(2.9mg;9.8%pd)和吡咯烷(0.08ml,1.00mmol)。将混合物在20℃搅拌并经tlc监测(etoac:meoh20:1)。在40min后,加入更多的pd(ph3p)4(5.8mg;9.8%pd)和吡咯烷(0.16ml,2.00mmol)并将混合物搅拌另外的3h。将混合物在etoac(100ml)和水(100ml)之间分配。分离etoac层并再次用水(50ml)洗涤,然后干燥(mgso4)并在25℃的浴温蒸发。粗产物15(94mg,81%)无需进一步纯化即可用于下一步。hrms(esi)m/zc59h81cln6o14p计算值:1163.5231,实测值:1163.5188[mh+].在氮气气氛下将15(91mg,0.078mmol)在无水dma(1.0ml)中的溶液用预先形成的(在20℃,10min)酸16(36mg,0.12mmol)、edci.hcl(34mg,0.18mmol)和tsoh(4.0mg,0.023mmol)在无水dma(0.5ml)中的混合物处理20℃。在10min后,加入dipea(0.016ml,0.078mmol)并将反应混合物搅拌23h。将混合物在etoac(100ml)和水(100ml)之间分配。分离etoac层并进一步用饱和nahco3(50ml)、水(50ml)洗涤,然后干燥(mgso4)。在25℃的浴温蒸发溶剂得到粗产物,将其经硅胶色谱纯化(用chcl3:etoac:meoh30:10:2洗脱)得到17(63mg,56%),其为淡棕色泡沫状固体;mp67-70℃;[α]d+23.9°(c2.09,chcl3);1hnmr[(cd3)2so]δ10.05(s,可与d2o交换,1h),8.56(s,1h),8.03(d,j=8.3hz,1h),7.92(d,j=8.4hz,1h),7.84-7.71(m,2h,可与d2o交换),7.62-7.52(m,3h),7.46(t,j=7.7hz,1h),7.22-7.13(m,2h),7.03(brs,1h),6.96(s,2h),6.71(brs,2h,在d2o后减少为1h),6.49(brs,可与d2o交换,1h),5.51-5.41(m,butd在d2o交换时,j=9.5hz,1h),5.15(d,j=12.2hz,1h),4.82(brd,j=12.4hz,1h),4.47-3.85(m,8h),3.77(brs,3h),3.52-3.20(m,3h,由水峰部分掩蔽),3.12-3.20(m,butt在d2o交换时,j=6.7hz,2h),2.92-2.80(m,2h),2.65-2.50(m,2h,由dmso峰部分掩蔽),2.39(t,j=7.9hz,2h),2.07-1.24(m,28h),1.469和1.463(2s,18h),1.33(s,9h)。hrms(esi)m/zc74h98cln8nao18p计算值:1475.6317,实测值:1475.6267[mna+].在20℃在氮气下向17(45mg,0.031mmol)在dcm(1.0ml)中的搅拌溶液中加入tfa(1.0ml)并将混合物搅拌15min。加入石油醚(20ml)并将混合物搅拌30min。弃去上清液并使用etoac:石油醚(1:5)(2×20ml)重复该操作。将所得的固体收集并经制备性hplc纯化[synergipolarrp柱;含水tfa(ph=2.56;90%至2%)/10%水/ch3cn(10%至98%);梯度洗脱,历时23min,流速为12ml/min]得到纯的cbi-pbdld1(17.5mg,38%),其为米色固体,纯度(hplc):99.1%;[α]d+54.9°(c0.18,meoh);1hnmr[(cd3)2so]δ10.20(s,可与d2o交换,1h),8.50(s,1h),8.20-7.78(m,7h,在d2o后减少为1h),8.12(d,j=9.1hz,1h),7.72-7.47(m,4h,在d2o后减少为3h),7.40(t,j=7.5hz,1h),7.17(brd,j=7.3hz,2h),7.03(brs,1h),6.97(s,2h),6.66(brs,可与d2o交换,1h),5.51(brs,1h),5.48(brd,j=9.7hz,1h),5.32-5.18(m,butd在d2o后,j=12.6hz,1h),4.75(brd,j=12.4hz,1h),4.44-3.81(m,8h),3.77(s,3h),3.52-3.21(m,5h,由水峰部分掩蔽),3.04(q,butt在d2o后,j=6.8hz,2h),2.80-2.68(m,2h),2.39(t,j=7.7hz,2h),2.12-1.08(m,28h)。hrms(esi)m/zc61h75cln8o16p计算值:1241.4722,实测值:1241.4700[mh+];c61h74cln8nao16p计算值:1263.4541,实测值:1263.4531[mna+].合成cbi-cbild4(s)-1-(氯甲基)-3-(5-((s)-1-(氯甲基)-5-(膦酰氧基)-1h-苯并[e]吲哚-3(2h)-基)-5-氧代戊酰基)-2,3-二氢-1h-苯并[e]吲哚-5-基氨基甲酸4-((s)-2-(1-(5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基酯合成方案实施例2.((s)-1-(氯甲基)-3-(5-((s)-1-(氯甲基)-5-(膦酰氧基)-1h-苯并[e]吲哚-3(2h)-基)-5-氧代戊酰基)-2,3-二氢-1h-苯并[e]吲哚-5-基)氨基甲酸4-((s)-2-(1-((5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基)氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基酯(cbi-cbild4).在20℃在氮气下向亚胺18(497mg,1.00mmol)在无水dcm(10ml)和meoh(10ml)中的搅拌溶液中加入4mhcl/二噁烷(0.63ml,2.5mmol)。加入后,将反应混合物在20℃搅拌1h。将挥发物在20℃减压蒸发得到黄色固体,将其与etoac和石油醚的混合物(1:10)(200ml)在20℃搅拌30min。弃去上清液并重复该操作。将所得的固体与na2co3水溶液(2n,200ml)和dcm(200ml)的混合物在0℃搅拌15min。分离dcm层,用水(100ml)洗涤,然后干燥(mgso4)并在25℃蒸发得到苯胺19(322mg,97%),其为不稳定的固体;1hnmr[(cd3)2so]δ8.01(d,j=8.4hz,1h),7.94-7.78(m,2h),7.52(t,j=7.3hz,1h),7.39(t,j=7.5hz,1h),4.20-3.72(m,5h),1.54(s,9h),未观察到2个质子。hrms(esi)m/zc18h22cln2o2计算值:333.1364,实测值:333.1355[mh+];c18h21clkn2o2计算值:371.0923,实测值:371.0920[mk+];c18h21cln2nao2计算值:355.1184,实测值:355.1179[mna+]。该物质无需进一步纯化即可用于下一步。在20℃在氮气下向苯胺19(322mg,0.97mmol)和dmap(730mg,6.00mmol)在无水dcm(30ml)中的搅拌的均匀混合物中加入双光气在无水dcm(0.10m,11ml,1.10mmol)中的溶液。将混合物搅拌20min,然后加入固体对硝基苯甲醇(1.53g,10.0mmol)。将最终反应混合物在20℃在氮气下搅拌18h,然后在etoac(300ml)和水(300ml)之间分配。分离etoac层,用盐水(200ml)洗涤并干燥(mgso4)。在30℃蒸发溶剂得到软的黄色固体,将其经硅胶色谱纯化(用dcm:etoac:石油醚20:1:10洗脱)得到氨基甲酸酯20(411mg,83%),其为淡黄色固体,mp141-142℃;[α]d-15.0°(c0.20,chcl3);1hnmr[(cd3)2so]δ9.85(s,1h),8.36-8.15(m,3h),8.05(d,j=8.4hz,1h),7.88(d,j=8.3hz,1h),7.72(d,j=8.6hz,2h),7.57-7.49(m,1h),7.45-7.36(m,1h),5.35(s,2h),4.27-4.12(m,2h),4.10-3.96(m,2h),3.94-3.81(m,1h),1.52(s,9h)。分析(c26h26cln3o6)计算:c,61.00;h,5.12;n,8.21.实测值:c,61.27;h,5.05;n,8.25.在0℃在氮气下向20(282mg,0.55mmol)在dcm(6ml)中的搅拌溶液中加入三氟乙酸(tfa)(3ml)。加入后,将反应混合物在0℃搅拌1h15min,然后在dcm(300ml)和冷的na2co3水溶液(2n,300ml)之间分配。分离dcm层,用冷的na2co3水溶液(2n,100ml)和水(100ml)洗涤,然后干燥(mgso4)并在25℃蒸发得到橙色固体。将该固体溶于无水dma(4ml)并用酸21(297mg,0.55mmol)、edci.hcl(317mg,1.65mmol)和tsoh(19mg,0.11mmol)处理。将混合物在20℃在氮气下搅拌22h,然后在etoac(300ml)和水(300ml)之间分配。分离etoac层,用水(200ml)洗涤,并干燥(mgso4)。在25℃蒸发溶剂得到油状物,将其经硅胶色谱纯化(用dcm:etoac2:1洗脱)得到酰胺22(181mg,35%),其为粘稠固体,[α]d-26.8°(c0.37,chcl3);1hnmr[(cd3)2so]δ9.84(s,1h),8.62(s,1h),8.59(s,1h),8.28(d,j=8.5hz,2h),8.04(d,j=8.5hz,2h),7.92(d,j=8.2hz,2h),7.72(d,j=8.3hz,2h),7.63-7.57(m,2h),7.51-7.39(m,2h),5.34(s,2h),4.48-4.17(m,6h),4.10-3.97(m,2h),3.97-3.84(m,2h),2.82-2.54(m,4h),2.04-1.91(m,2h),1.49(s,18h)。hrms(esi)m/zc47h51cl2kn4o10p计算值:971.2351,实测值:971.2344[mk+];c47h51cl2n4nao10p计算值:955.2612,实测值:955.2621[mna+].在0℃在氮气下向硝基化合物22(47mg,0.05mmol)在丙酮:水:thf(10:5:1)(6ml)中的搅拌溶液中加入锌粉(65.4mg,1.00mmol)和nh4cl(107mg,2.00mmol)。加入后,将反应混合物在0℃搅拌40min。将反应混合物经硅藻土滤过,用冷的dcm洗涤若干次。将合并的滤液用冷水(50ml)洗涤,然后干燥(mgso4)并在25℃蒸发得到黄色泡沫状固体。将该固体溶于无水dma(1ml)并加至预先形成的(10min,在20℃)fmoc-l-瓜氨酸(29.8mg,0.075mmol)和eedq(18.5mg,0.075mmol)在dma(0.3ml)中的混合物。将反应混合物在20℃在氮气下搅拌48h,然后在etoac(100ml)和水(100ml)之间分配。分离etoac层,用水(50ml)洗涤,并干燥(mgso4)。在25℃蒸发溶剂得到油状物,将其经硅胶色谱纯化(etoac:meoh10:1)得到23(24mg,38%),其为粘稠固体,[α]d-31.9°(c0.28,chcl3);1hnmr[(cd3)2so]δ10.09(s,1h),9.66(s,1h),8.62(s,1h),8.59(s,1h),8.10-7.25(m,21h),6.04-5.94(m,1h),5.53-5.29(m,2h),5.13(s,2h),4.51-4.08(m,10h),4.08-3.82(m,4h),3.11-2.90(m,2h),2.80-2.54(m,4h),2.04-1.92(m,2h),1.80-1.30(m,4h),1.49(s,18h)。hrms(esi)m/zc68h75cl2n7o12p计算值:1282.4583,实测值:1282.4536[mh+];c68h74cl2kn7o12p计算值:1320.4142,实测值:1320.4119[mk+];c68h74cl2n7nao12p计算值:1304.4402,实测值:1304.4388[mna+].在0℃在氮气下向23(86mg,0.067mmol)在无水dma(3ml)中的搅拌溶液中加入哌啶在dma中的溶液(1.00m,0.58ml,0.58mmol)并将混合物在0℃搅拌1h30min。加入etoac和石油醚的混合物(1:10,60ml)并将混合物在0℃搅拌40min。弃去上清液并使用更多的etoac-石油醚(1:3,50ml,然后30ml)重复该操作。将残留的油状物在20℃真空干燥1h得到中间体胺24(67mg,94%),其为粘稠固体。该固体无需进一步纯化即可用于下一步。将酸8(30.4mg,0.098mmol)、edci.hcl(25.3mg,0.13mmol)和tsoh(2.2mg,0.013mmol)在无水dma(0.7ml)中的混合物在20℃在氮气下搅拌10min。向该混合物中加入上述胺24的溶液(67mg,0.060mmol),随后加入dipea(0.011ml,0.065mmol)。将反应混合物在20℃在氮气下搅拌20h。加入冰水(30ml)并将混合物在0℃搅拌30min。将分离的固体滤出,干燥,并经硅胶色谱纯化(用dcm:etoac;meoh10:10:1洗脱)得到25(44mg,54%),其为粘稠固体,[α]d-51.6°(c0.16,chcl3);1hnmr[(cd3)2so]δ10.15(s,可与d2o交换,1h),9.66(s,可与d2o交换,1h),8.62(s,1h),8.59(s,1h),8.08-7.76(m,6h,在d2o交换后减少为4h),7.69-7.34(m,8h),6.97(s,2h),5.96(t,j=5.7hz,可与d2o交换,1h),5.40(s,可与d2o交换,2h),5.11(s,2h),4.50-4.15(m,7h),4.02-3.82(m,4h),3.25(t,由水峰部分掩蔽,j=6.8hz,2h),3.13-2.86(m,4h),2.81-2.56(m,4h),2.45-2.33(m,4h),2.05-1.91(m,2h),1.83-1.09(m,12h),1.49(s,18h)。hrms(esi)m/zc68h83cl2n9o14p计算值:1350.5169,实测值:1350.5170[mh+];c68h82cl2kn9o14p计算值:1388.4727,实测值:1388.4771[mk+];c68h82cl2n9nao14p计算值:1372.4988,实测值:1372.4992[mna+].在20℃在氮气下向25(30.3mg,0.022mmol)在dcm(1.0ml)中的搅拌溶液中加入tfa(1.0ml)。加入后,将混合物在该温度搅拌1min。加入冷的石油醚(20ml)并将混合物在0℃搅拌15min。弃去上清液并使用etoac-石油醚(1:3,2×20ml)重复该操作。将所得的固体收集并在20℃真空干燥得到cbi-cbild4(25.3mg,93%),其为米色固体,[α]d-186°(c0.059,meoh);1hnmr[(cd3)2so]δ10.13(s,可与d2o交换,1h),9.66(s,可与d2o交换,1h),8.62(s,1h),8.51(s,1h),8.10(d,j=8.4hz,1h),8.00(d,j=8.5hz,1h),7.94-7.73(m,4h,在d2o交换后减少为2h),7.65(d,j=8.4hz,2h),7.60-7.32(m,6h),6.97(s,2h),6.00(t,j=5.5hz,可与d2o交换,1h),5.45(brs,可与d2o交换,2h),5.13(s,2h),4.52-4.15(m,7h),4.10-3.82(m,4h),3.28(t,由水峰部分掩蔽,j=6.9hz,2h),3.13-2.84(m,4h),2.81-2.56(m,4h),2.47-2.34(m,4h),2.08-1.89(m,2h),1.84-1.53(m,4h),1.53-1.09(m,8h),未观察到2h。hrms(esi)m/zc60h65cl2n9o14p计算值:1236.3771,实测值:1236.3772[m-h]-.制备(11as)-8-((6-((s)-1-(氯甲基)-5-((4-甲基哌嗪-1-羰基)氧基)-1h-苯并[e]吲哚-3(2h)-基)-6-氧代己基)氧基)-11-羟基-7-甲氧基-5-氧代-2,3,11,11a-四氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-10(5h)-羧酸4-((s)-6-氨基-2-(1-((5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基)氨基甲酰基)环丁烷甲酰氨基)己酰氨基)苄基酯二(2,2,2-三氟乙酸盐)(cbi-pbdld2)和(11as)-8-((6-((s)-1-(氯甲基)-5-((4-甲基哌嗪-1-羰基)氧基)-1h-苯并[e]吲哚-3(2h)-基)-6-氧代己基)氧基)-7,11-二甲氧基-5-氧代-2,3,11,11a-四氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-10(5h)-羧酸4-((s)-6-氨基-2-(1-((5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基)氨基甲酰基)环丁烷甲酰氨基)己酰氨基)苄基酯二(2,2,2-三氟乙酸盐)(cbi-pbdld3)步骤a:合成化合物15(pct/us2014/042560中的65j):(s)-8-(6-((s)-1-(氯甲基)-5-(4-甲基哌嗪-1-羰基氧基)-1h-苯并[e]吲哚-3(2h)-基)-6-氧代己基氧基)-11-羟基-7-甲氧基-5-氧代-2,3,11,11a-四氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-10(5h)-羧酸4-((s)-2-(烯丙基氧基羰基氨基)-6-(叔丁氧基羰基氨基)己酰氨基)苄基酯方案步骤1.(s)-6-(5-(叔丁氧基羰基氨基)-4-(2-(羟基甲基)吡咯烷-1-羰基)-2-甲氧基苯氧基)己酸2,2,2-三氯乙酯54c将由terceletal(2003)j.med.chem46:2132-2151的操作制备的(s)-(2-氨基-4-羟基-5-甲氧基苯基)(2-(羟基甲基)吡咯烷-1-基)甲酮54a(7.6g,28.6mmol)和一缩二碳酸二叔丁酯(12.48g,57.2mmol)在无水thf(140ml)中的混合物在氮气气氛下回流搅拌18h。将反应混合物冷却至室温并加入2nnaoh(57.2ml,114mmol)和meoh(70ml)。将混合物在室温搅拌6h。将挥发物在35-40℃(浴温)减压蒸发。加入冰水(250ml)并在0℃将ph调节至8-9。将混合物与石油醚-乙酸乙酯(20:1)(2x400ml)在室温搅拌15min。将有机层分离并弃去。将水层用dcm(4x300ml)萃取并将合并的萃取液干燥(mgso4)并减压蒸发得到(s)-5-羟基-2-(2-(羟基甲基)吡咯烷-1-羰基)-4-甲氧基苯基氨基甲酸叔丁酯54b,其为粉白色固体(9.36g,89%);mp154-156℃;1hnmr[(cd3)2so]δ9.51(s,1h),8.90(s,1h),7.27(s,1h),6.91(s,1h),4.73(t,j=5.8hz,1h),4.16-4.02(m,1h),3.73(s,3h),3.64-3.34(m,4h),1.99-1.60(m,4h),1.43(s,9h)。分析(c18h26n2o6)计算:c,59.00;h,7.15;n,7.65.实测值:c,58.94;h,7.31;n,7.39.向54b(2.88g,7.87mmol)和由terceletal(2003)j.med.chem46:2132-2151中的操作制备的6-溴己酸2,2,2-三氯乙酯(3.86g,11.8mmol)在无水dma(7ml)中的溶液中加入无水k2co3(2.61g,18.9mmol)。将所得的混合物在室温搅拌68h。将其倒入冰水(600ml)并将产物在乙酸乙酯(600ml)中萃取。将萃取物先后用冷的(0℃)2nna2co3水溶液(2x400ml)和水(400ml)洗涤,然后干燥(mgso4)。蒸发溶剂得到棕色油状物,将其经硅胶柱色谱纯化(dcm-乙酸乙酯=2:1)得到纯的(s)-6-(5-(叔丁氧基羰基氨基)-4-(2-(羟基甲基)吡咯烷-1-羰基)-2-甲氧基苯氧基)己酸2,2,2-三氯乙酯54c(3.62g,76%),其为淡黄色泡沫状物;mp36-39℃;1hnmr[(cd3)2so]δ9.90(s,1h),7.33(s,1h),6.93(s,1h),4.89(s,2h),4.74(t,j=5.8hz,1h),4.17-4.02(m,1h),3.94(t,j=6.4hz,2h),3.73(s,3h),3.63-3.26(m,4h),2.55-2.46(m,2h,由dmso峰部分掩蔽),2.00-1.55(m,8h),1.53-1.36(m,11h)。分析(c26h37n2o8)计算:c,51.03;h,6.09;n,4.58.实测值:c,51.33;h,6.21;n,4.35.步骤2:(s)-4-甲基哌嗪-1-羧酸1-(氯甲基)-2,3-二氢-1h-苯并[e]吲哚-5-酯58b将(s)-1-(氯甲基)-5-羟基-1h-苯并[e]吲哚-3(2h)-羧酸叔丁酯51a(3.338g,10mmol)、4-甲基哌嗪-1-碳酰氯盐酸盐(5.98g,30mmol)、et3n(3.5g,35mmol)和dmap(1.34g,11mmol)在ch2cl2(80ml)中的混合物在室温搅拌2天。参见图12。将混合物用水洗涤并将溶剂干燥并真空除去,得到定量收率的(s)-1-(氯甲基)-5-(4-甲基哌嗪-1-羰基氧基)-1h-苯并[e]吲哚-3(2h)-羧酸叔丁酯58a(bogerd.l.etal,synthesis,(1999),1505-1509):mp98℃;1hnmr(cdcl3)δ8.11(br,1h),7.84(d,j=8.4hz,1h),7.70(d,j=8.4hz,1h),7.50(ddd,j=8.2,6.9,1.1hz,1h),7.37(ddd,j=8.1,6.9,1.0hz,1h),4.34-4.20(m,1h),4.17-4.10(m,1h),4.01-3.98(m,1h),3.94(dd,j=9.6,2.4hz,1h),3.87-3.80(br,2h),3.68-3.60(br,2h),3.47(t,j=10.8hz,1h),2.57-2.48(m,4h),2.83(s,3h),1.58(s,9h);ms(apci+)m/z461.2mh+.c24h30cln3o4分析计算值:c,62.7;h,6.6;n,9.1.实测值:c,62.5;h,6.8;n,9.2%.将58a(2.30g,5mmol)在ch2cl2(50ml)中的溶液用过量的三氟乙酸(tfa)在0℃处理4h,并将混合物用冷的nh3水溶液中和。用己烷稀释导致固体沉淀,将其经滤过收集,用水和己烷洗涤,并干燥得到(s)-4-甲基哌嗪-1-羧酸1-(氯甲基)-2,3-二氢-1h-苯并[e]吲哚-5-酯58b(1.60g,89%):mp144-147℃;1hnmr(cdcl3)δ7.69(d,j=8.4hz,1h),7.63(d,j=8.4hz,1h),7.45(ddd,j=8.3,6.9,1.2hz,1h),7.25(ddd,j=8.4,6.8,1.2hz,1h),6.82(s,1h),5.30(s,1h),4.17-4.05(m,2h),4.03-3.96(m,2h),3.89-3.77(m,4h),3.54(t,j=10.9hz,1h),3.20-2.90(m,4h),2.76(s,3h)。c19h22cln3o2分析计算值:c,63.4;h,6.2;n,11.7.实测值:c,63.2;h,6.2;n,11.5%.步骤3:(s)-4-甲基哌嗪-1-羧酸3-(6-(4-((s)-2-(乙酰氧基甲基)吡咯烷-1-羰基)-5-氨基-2-甲氧基苯氧基)已酰基)-1-(氯甲基)-2,3-二氢-1h-苯并[e]吲哚-5-酯65d在室温向(s)-6-(5-(叔丁氧基羰基氨基)-4-(2-(羟基甲基)吡咯烷-1-羰基)-2-甲氧基苯氧基)己酸2,2,2-三氯乙酯54c(1.66g,2.71mmol)在无水dcm(10ml)中的搅拌溶液中加入乙酸酐(1.29ml,13.6mmol)和三乙胺(2.27ml,16.3mmol)。参见图17。将反应混合物搅拌另外的4h。加入无水meoh(1.5ml)并将混合物搅拌30min。加入乙酸乙酯(200ml)并分离乙酸乙酯层,然后用水洗涤若干次。将乙酸乙酯溶液干燥(mgso4)并蒸发得到(s)-6-(4-(2-(乙酰氧基甲基)吡咯烷-1-羰基)-5-(叔丁氧基羰基氨基)-2-甲氧基苯氧基)己酸2,2,2-三氯乙酯65a(1.8g,100%),其为淡黄色胶状物;1hnmr[(cd3)2so]δ8.82(brs,1h),7.27(s,1h),6.86(s,1h),4.89(s,2h),4.39-4.20(m,3h),3.93(t,j=6.4hz,2h),3.74(s,3h),3.50-3.33(m,2h),2.10-1.94(m,4h),1.92-1.61(m,7h),1.53-1.42(m,2h),1.43(s,9h),2hobscuredbydmsopeak.hrms(esi)m/zc28h39cl3n2nao9计算值:675.1613,实测值:675.1603[mna+].c28h40cl3n2o9计算值:653.1794,实测值:653.1778[mh+].在氮气下向65a(1.76g,2.69mmol)在丙酮(30ml)、水(20ml)和thf(12ml)的混合物中的搅拌溶液中加入zn(7.06g,108mmol)和nh4cl(11.6g,216mmol)。将混合物在室温搅拌23h。加入乙酸乙酯(100ml)并将混合物搅拌15min。将有机层弃去。使用更多的乙酸乙酯(2x100ml)重复该萃取。将合并的有机溶液用水(2x100ml)洗涤,干燥(mgso4),经硅藻土滤过并蒸发得到(s)-6-(4-(2-(乙酰氧基甲基)吡咯烷-1-羰基)-5-(叔丁氧基羰基氨基)-2-甲氧基苯氧基)己酸65b(1.36g,96%),其为粘稠的无色泡沫状物;1hnmr[(cd3)2so]δ11.49(非常宽的s,1h),8.83(s,1h),7.27(s,1h),6.86(brs,1h),4.39-4.02(m,3h),3.93(t,j=6.4hz,2h),3.74(s,3h),3.51-3.33(m,2h,由水峰部分掩蔽),2.21(t,j=7.1hz,2h),2.11-1.93(m,4h),1.90-1.66(m,5h),1.62-1.50(m,2h),1.50-1.35(m,2h),1.43(s,9h)。分析(c26h38n2o9.)计算:c,59.76;h,7.33;n,5.36.实测值:c,59.66;h,7.49;n,5.29.在0℃在氮气气氛下向65b(0.87g,2.41mmol)和(s)-4-甲基哌嗪-1-羧酸1-(氯甲基)-2,3-二氢-1h-苯并[e]吲哚-5-酯58b(1.26g,2.41mmol)在无水dma(5ml)中的搅拌溶液中加入4mhcl/对二噁烷(1.21ml,4.82mmol),随后加入edci.hcl(1.39g,7.23mmol)和无水tsoh(83mg,0.48mmol)。将反应混合物在0℃在氮气下搅拌21小时,然后在乙酸乙酯(500ml)和水(500ml)之间分配。分离乙酸乙酯层并将水层进一步用更多的乙酸乙酯(200ml)萃取。将合并的乙酸乙酯萃取液先后用水(200ml)、饱和nahco3溶液(2x200ml)和水(200ml)洗涤。将乙酸乙酯层干燥并蒸发得到(s)-4-甲基哌嗪-1-羧酸3-(6-(4-((s)-2-(乙酰氧基甲基)吡咯烷-1-羰基)-5-(叔丁氧基羰基氨基)-2-甲氧基苯氧基)已酰基)-1-(氯甲基)-2,3-二氢-1h-苯并[e]吲哚-5-酯65c(1.66g,80%),其为米色固体-泡沫状物;mp84-87℃;1hnmr[(cd3)2so]δ8.84(brs,1h),8.21(s,1h),7.95(d,j=8.3hz,1h),7.81(d,j=8.3hz,1h),7.58(brt,j=7.7,1h),7.46(brt,j=8.1hz,1h),7.29(s,1h),6.86(s,1h),4.40(t,j=10.0hz,1h),4.36-3.86(m,10h),3.83-3.74(m,1h),3.73(s,3h),3.54-3.36(m,4h),2.67-2.34(m,6h,由dmso峰部分掩蔽),2.26(s,3h),2.02(brs,3h),1.93-1.62(m,8h),1.60-1.47(m,2h),1.42(s,9h)。分析(c45h58cln5o10·11/2h2o)计算:c,60.63;h,6.90;n,7.86.实测值:c,60.39;h,6.66;n,8.08.在0℃在氮气气氛下向65c(2.17g,2.51mmol)在dcm(20ml)中的搅拌溶液中加入tfa(20ml)。加入后,将混合物进一步在该温度搅拌2.5h。将混合物倒入冷的(0℃)nahco3(50g)、水(700ml)和dcm(500ml)的混合物中并搅拌15min。(ph约为8)。分离dcm层并用更多的nahco3水溶液(200ml)和水(200ml)洗涤,然后干燥(mgso4)。蒸发溶剂得到(s)-4-甲基哌嗪-1-羧酸3-(6-(4-((s)-2-(乙酰氧基甲基)吡咯烷-1-羰基)-5-氨基-2-甲氧基苯氧基)已酰基)-1-(氯甲基)-2,3-二氢-1h-苯并[e]吲哚-5-酯65d,其为淡棕色固体-泡沫状物(1.76g,92%);mp62℃;1hnmr[(cd3)2so]δ8.21(s,1h),7.95(d,j=8.3hz,1h),7.81(d,j=8.3hz,1h),7.57(brt,j=7.6hz,1h),7.46(brt,j=7.2hz,1h),6.67(s,1h),6.37(s,1h),5.09(s,2h),4.41(t,j=9.7hz,1h),4.36-4.20(m,3h),4.17-4.00(m,3h),3.97-3.86(m,3h),3.81-3.70(m,2h),3.63(s,3h),3.54-3.32(m,5h),2.66-2.34(m,6h,由dmso峰部分掩蔽),2.26(s,3h),2.08-1.96(m,1h),2.10(s,3h),1.93-1.63(m,7h),1.57-1.45(m,2h)。分析(c40h50cln5o8·1/2h2o)计算:c,62.13;h,6.65;n,9.06.实测值:c,62.12;h,6.76;n,8.77.步骤4:65g将(s)-2-(烯丙基氧基羰基氨基)-6-(叔丁氧基羰基氨基)己酸65e(3.30g,10.0mmol)和eedq(3.71g,15.0mmol)在无水dma(10ml)中的混合物在室温在氮气下搅拌15min。参见图18。向该预先形成的混合物中加入4-((叔丁基二甲基甲硅烷基氧基)甲基)苯胺(由相应的对硝基苯甲醇和tbdmscl在dmf中制备,随后使用zn/nh4cl还原)(2.37g,10.0mmol)在无水dma(3ml)中的溶液。将最终反应混合物进一步在室温在氮气气氛下搅拌23h。将混合物在乙酸乙酯(500ml)和水(500ml)之间分配。分离乙酸乙酯层并先后用饱和nahco3(2x300ml)和水(300ml)洗涤,然后干燥(mgso4)。蒸发溶剂得到橙色油状物,将其经硅胶柱色谱纯化(10-35%的石油醚-乙酸乙酯梯度)得到tbdms-保护的赖氨酸65f(4.87g,89%),其为粘稠的米色固体-泡沫状物;1hnmr[(cd3)2so]δ9.97(s,1h),7.55(d,j=8.50hz,2h),7.44(d,j=7.8hz,1h),7.21(d,j=8.5hz,2h),6.75(t,j=5.3hz,1h),5.99-5.82(m,1h),5.28(brd,j=17.2hz,1h),5.17(brd,j=10.5hz,1h),4.64(s,2h),4.46(d,j=5.2hz,2h),4.12-4.02(m,1h),2.93-2.83(m,2h),1.70-1.52(m,2h),1.46-1.20(m,4h),1.35(s,9h),0.89(s,9h),0.06(s,6h)。hrms(esi)m/zc28h47n3nao6si计算值:572.3126,实测值:572.3136[mna+].在室温向65f(4.81g,8.75mmol)在thf(30ml)中的搅拌溶液中加入1m四丁基氟化铵在thf中的溶液(17.5ml,17.5mmol)。加入后,将混合物在该温度搅拌另外的2.5h。加入nh4cl水溶液(300ml)并将产物在乙酸乙酯(500ml)中萃取。将乙酸乙酯用水(2x100ml)洗涤并干燥(mgso4)。蒸发溶剂得到苯甲醇赖氨酸65g(3.81g,100%),其为米色固体;mp101-103℃;1hnmr[(cd3)2so]δ9.94(s,1h),7.52(d,j=8.4hz,2h),7.44(d,j=7.8hz,1h),7.23(d,j=8.4hz,2h),6.76(t,j=5.4hz,1h),5.97-5.84(m,1h),5.29(brd,j=17.2hz,1h),5.17(brd,j=10.4hz,1h),5.08(t,j=5.7hz,1h),4.47(d,j=5.3hz,2h),4.43(d,j=5.7hz,2h),4.13-4.03(m,1h),2.96-2.82(m,2h),1.72-1.52(m,2h),1.46-1.20(m,4h),1.36(s,9h)。hrms(esi)m/zc22h33n3nao6计算值:458.2262,实测值:458.2272[mna+];c22h33n3ko6计算值:474.2001,实测值:474.1998[mk+].步骤5:(s)-4-甲基哌嗪-1-羧酸3-(6-(4-((s)-2-(乙酰氧基甲基)吡咯烷-1-羰基)-5-((4-((s)-2-(烯丙基氧基羰基氨基)-6-(叔丁氧基羰基氨基)己酰氨基)苄基氧基)羰基氨基)-2-甲氧基苯氧基)已酰基)-1-(氯甲基)-2,3-二氢-1h-苯并[e]吲哚-5-基酯65h在室温在氮气下向65d(764mg,1.00mmol)和dmap(367mg,3.00mmol)在无水dcm(15ml)中的搅拌溶液中加入双光气在无水dcm中的溶液(0.05mmol/ml,12ml,0.60mmol),并将混合物搅拌另外的20min。参见图19。向该混合物中加入65g(3.97g,9.13mmol)在无水dcm(80ml)中的溶液。将最终反应混合物进一步在室温在氮气气氛下搅拌48h。将混合物在乙酸乙酯(500ml)和水(300ml)之间分配。分离乙酸乙酯层并将水层进一步用乙酸乙酯(2x200ml)萃取。将合并的乙酸乙酯溶液用更多的水(2x200ml)洗涤并干燥(mgso4)。在30℃(浴温)蒸发溶剂得到橙色油状物,将其经硅胶柱色谱纯化(乙酸乙酯-meoh=10:1)得到(s)-4-甲基哌嗪-1-羧酸3-(6-(4-((s)-2-(乙酰氧基甲基)吡咯烷-1-羰基)-5-((4-((s)-2-(烯丙基氧基羰基氨基)-6-(叔丁氧基羰基氨基)己酰氨基)苄基氧基)羰基氨基)-2-甲氧基苯氧基)已酰基)-1-(氯甲基)-2,3-二氢-1h-苯并[e]吲哚-5-基酯65h(1.04g,85%),其为淡橙色固体;mp90-93℃;1hnmr[(cd3)2so]δ10.04(s,1h),9.10(brs,1h),8.21(s,1h),7.95(d,j=8.3hz,1h),7.81(d,j=8.3hz,1h),7.63-7.53(m,3h),7.51-7.42(m,2h),7.32(d,j=8.5hz,2h),7.21(brs,1h),6.85(brs,1h),6.79-6.72(m,1h),5.97-5.83(m,1h),5.29(brd,j=17.2hz,1h),5.17(brd,j=10.4hz,1h),5.08-4.96(m,2h),4.52-4.37(m,3h),4.37-3.85(m,10h),3.83-3.66(m,2h),3.74(s,3h),3.54-3.41(m,2h),3.41-3.23(m,2h,由水峰部分掩蔽),2.95-2.83(m,2h),2.66-2.34(m,6h,由dmso峰部分掩蔽),2.25(s,3h),2.07-1.92(m,4h),1.87-1.45(m,11h),1.45-1.20(m,4h),1.35(s,9h)。hrms(esi)m/zc63h82cln8o15计算值:1225.5583,实测值:1225.5557[mh+];c63h81cln8nao15计算值:1247.5402,实测值:1247.5401[mna+];c63h81clkn8o15计算值:1263.5142,实测值:1263.5141[mk+].将65h(1.01g,0.824mmol)和k2co3(1.14g,8.24mmol)在dcm(20ml)和meoh(10ml)中的混合物在室温搅拌1小时40min。将混合物用dcm(200ml)稀释并与冰水(200ml)搅拌10min。分离dcm层并将水层进一步用dcm(2x100ml)萃取。将合并的dcm溶液用更多的水(200ml)洗涤并干燥(mgso4)。在25℃(浴温)蒸发溶剂得到(s)-4-甲基哌嗪-1-羧酸3-(6-(5-((4-((s)-2-(烯丙基氧基羰基氨基)-6-(叔丁氧基羰基氨基)己酰氨基)苄基氧基)羰基氨基)-4-((s)-2-(羟基甲基)吡咯烷-1-羰基)-2-甲氧基苯氧基)已酰基)-1-(氯甲基)-2,3-二氢-1h-苯并[e]吲哚-5-基酯65i(0.94g,96%),其为米色固体;mp104-107℃;1hnmr[(cd3)2so]δ10.04(s,1h),9.17(brs,1h),8.21(s,1h),7.95(d,j=8.4hz,1h),7.80(d,j=8.3hz,1h),7.63-7.53(m,3h),7.51-7.42(m,2h),7.38-7.21(m,3h),6.93(s,1h),5.32(t,j=5.4hz,1h),5.98-5.83(m,1h),5.30(brd,j=17.2hz,1h),5.17(brd,j=11.7hz,1h),5.03(s,2h),4.73(t,j=5.7hz,1h),4.52-4.36(m,3h),4.36-4.17(m,2h),4.17-3.85(m,6h),3.83-3.66(m,2h),3.73(s,3h),3.61-3.40(m,4h),3.40-3.20(m,2h,由水峰部分掩蔽),2.94-2.83(m,2h),2.67-2.34(m,6h,由dmso峰部分掩蔽),2.25(s,3h),1.96-1.45(m,12h),1.45-1.20(m,4h),1.35(s,9h)。hrms(esi)m/zc61h80cln8o14计算值:1183.5477,实测值:1183.5445[mh+];c61h79cln8nao14计算值:1205.5296,实测值:1205.5256[mna+];c61h79clkn8o14计算值:1221.5036,实测值:1221.5026[mk+].在0℃向65i(0.92g,0.78mmol)在无水dcm(20ml)中的搅拌溶液中分批加入(历时8min)dess-martin高碘烷(dmp,1,1,1-三乙酰氧基-1,1-二氢-1,2-苯并碘氧杂环戊烯-3(1h)-酮,cas登记号.87413-09-0,492mg,1.16mmol)。加入完成后,将反应混合物进一步在0℃搅拌2h,然后在室温搅拌45h。将混合物用dcm(100ml)稀释并与10%na2s2o3(100ml)在室温搅拌10min。将所得的混合物在dcm(400ml)和饱和nahco3溶液(400ml)之间分配。分离dcm层并将水层进一步用dcm(2x100ml)萃取。将合并的dcm溶液进一步用饱和nahco3溶液(200ml)和水(200ml)洗涤,然后干燥(mgso4)。在25℃(浴温)蒸发溶剂得到淡棕色固体,将其经硅胶柱色谱纯化(梯度dcm-乙酸乙酯-meoh=15:15:1至15:15:3)得到(s)-8-(6-((s)-1-(氯甲基)-5-(4-甲基哌嗪-1-羰基氧基)-1h-苯并[e]吲哚-3(2h)-基)-6-氧代己基氧基)-11-羟基-7-甲氧基-5-氧代-2,3,11,11a-四氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-10(5h)-羧酸4-((s)-2-(烯丙基氧基羰基氨基)-6-(叔丁氧基羰基氨基)己酰氨基)苄基酯65j(0.64g,70%),其为淡黄色固体;mp137℃(dec.);1hnmr[(cd3)2so]δ10.02(s,1h),8.21(s,1h),7.95(d,j=8.4hz,1h),7.80(d,j=8.3hz,1h),7.65-7.38(m,5h),7.18(d,j=7.0hz,2h),7.03(s,1h),6.82-6.63(m,2h),6.49(不良拆分的d,j=4.7hz,可与d2o交换,1h),5.96-5.82(m,1h),5.46(不良拆分的dd,j=9.8,4.7hz,在d2o后变为d,j=10.1hz,1h),5.27(brd,j=17.1hz,1h),5.21-5.10(m,2h),4.81(brd,j=12.3hz,1h),4.51-4.17(m,5h),4.13-3.84(m,4h),3.84-3.67(m,2h),3.77(s,3h),3.55-3.20(m,6h,由水峰部分掩蔽),2.66-2.30(m,6h,由dmso峰部分掩蔽),2.26(s,3h),2.10-1.20(m,16h),1.35(s,9h)。hrms(esi)m/zc61h78cln8o14计算值:1181.5321,实测值:1181.5286[mh+];c61h77cln8nao14计算值:1203.5140,实测值:1203.5130[mna+];c61h77clkn8o14计算值:1219.4879,实测值:1219.4861[mk+].步骤b:(11as)-8-((6-((s)-1-(氯甲基)-5-((4-甲基哌嗪-1-羰基)氧基)-1h-苯并[e]吲哚-3(2h)-基)-6-氧代己基)氧基)-11-羟基-7-甲氧基-5-氧代-2,3,11,11a-四氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-10(5h)-羧酸4-((s)-6-氨基-2-(1-((5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基)氨基甲酰基)环丁烷甲酰氨基)己酰氨基)苄基酯二(2,2,2-三氟乙酸盐)(cbi-pbdld2)和(11as)-8-((6-((s)-1-(氯甲基)-5-((4-甲基哌嗪-1-羰基)氧基)-1h-苯并[e]吲哚-3(2h)-基)-6-氧代己基)氧基)-7,11-二甲氧基-5-氧代-2,3,11,11a-四氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-10(5h)-羧酸4-((s)-6-氨基-2-(1-((5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基)氨基甲酰基)环丁烷甲酰氨基)己酰氨基)苄基酯二(2,2,2-三氟乙酸盐)(cbi-pbdld3)合成cbi-pbdld2和cbi‐pbdpd3合成方案合成cbi‐pbdld2和cbi‐pbdld3合成方案(续)向1-(叔丁氧基羰基)环丁烷羧酸(16)(200mg,1.00mmol)(pctint.appl.2002,wo2002076968a1)、1-(5-氨基戊基)-1h-吡咯-2,5-二酮盐酸盐(17)(218mg,1.00mmol)(j.med.chem.2013,56,7890-7901)、edci.hcl(576mg,3.00mmol)和tsoh(35mg,0.20mmol)的混合物中加入dma(2ml)。将混合物在20℃搅拌15min并加入dipea(0.17ml,1.00mmol)。将反应混合物进一步搅拌20h并在etoac(200ml)和水(100ml)之间分配。分离etoac层并先后用冷的1nhcl(100ml)、饱和nahco3(100ml)和水(100ml)洗涤,然后干燥(mgso4)。蒸发溶剂得到1-((5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基)氨基甲酰基)环丁烷羧酸叔丁酯(18)(290mg,80%),其为淡黄色固体,mp63-65℃;1hnmr[(cd3)2so]δ7.58(t,j=5.6hz,1h),7.00(s,2h),3.37(t,j=7.0hz,2h),3.03(q,j=6.0hz,2h),2.40-2.23(m,4h),1.85-1.64(m,2h),1.55-1.32(m,4h),1.38(s,9h),1.26-1.01(m,2h)。hrms(esi)m/zc19h29n2o5计算值:365.2071,实测值:365.2071[mh+];c19h28n2nao5计算值:387.1890,实测值:387.1898[mna+];c19h28kn2o5计算值:403.1630,实测值:403.1629[mk+].向18(794mg,2.18mmol)在dcm(50ml)中的搅拌溶液中加入甲磺酸(2.83ml,43.6mmol)。将浑浊的混合物在20℃搅拌2h30min。将混合物用dcm(200ml)稀释并用水(2×50ml)洗涤。将dcm溶液干燥(mgso4)并在25℃(浴温)蒸发得到1-((5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基)氨基甲酰基)环丁烷羧酸(19)(636mg,95%),其为淡黄色固体,mp100-102℃;1hnmr[(cd3)2so]δ12.46(brs,1h),7.63(t,j=5.4hz,1h),7.00(s,2h),3.37(t,j=7.0hz,2h),3.02(q,j=5.9hz,2h),2.42-2.28(m,4h),1.89-1.63(m,2h),1.55-1.32(m,4h),1.29-1.11(m,2h)。分析(c15h20n2o5)计算:c,58.43;h,6.54;n,9.09.实测值:c,58.54;h,6.39;8.84.在20℃在氮气气氛下向(11as)-8-((6-((s)-1-(氯甲基)-5-((4-甲基哌嗪-1-羰基)氧基)-1h-苯并[e]吲哚-3(2h)-基)-6-氧代己基)氧基)-11-羟基-7-甲氧基-5-氧代-2,3,11,11a-四氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-10(5h)-羧酸4-((s)-2-(((烯丙基氧基)羰基)氨基)-6-((叔丁氧基羰基)氨基)己酰氨基)苄基酯(15)(177mg,0.15mmol)(参照提交的专利:genenlaw-#446508)在无水dcm(2ml)中的搅拌的均匀溶液中加入吡咯烷(0.122ml,1.50mmol),随后加入pd(ph3p)4(4.28mg,9.8%pd)。加入后,将反应混合物进一步在20℃(n2)搅拌25min。将混合物用石油醚(50ml)稀释并在20℃(n2)搅拌10min。弃去溶剂并使用dcm-石油醚(1:10)(2×30ml)重复该操作。将留置的固体溶于dcm(100ml)并用水(50ml)、盐水(50ml)洗涤,然后干燥(mgso4)。在25℃(浴温)蒸发溶剂得到游离胺,其为米色固体(140mg,85%)。将一些该物质(110mg,0.10mmol)用预先形成的(在20℃,10min)19(34mg,0.11mmol)、edci.hcl(58mg,0.30mmol)和tsoh(3.4mg,0.02mmol)在无水dma(1ml)中的混合物在20℃(在氮气气氛下)处理。在10min后,加入dipea(0.02ml,0.10mmol)并将反应混合物进一步搅拌22h。将混合物在etoac(200ml)和水(100ml)之间分配。分离etoac层并进一步用饱和nahco3(100ml)、水(100ml)洗涤,然后干燥(mgso4)。在25℃(浴温)蒸发溶剂得到粗产物,将其经硅胶柱色谱纯化(dcm-etoac-meoh=20:10:3)得到20(92mg,66%),其为淡黄色固体;mp106-109℃;[α]d+43.1°(c0.418,chcl3);1hnmr[(cd3)2so]δ10.06(s,可与d2o交换,1h),8.21(s,1h),7.95(d,j=8.4hz,1h),7.85-7.77(m,2h,在d2o后减少为1h),7.75(d,j=8.0hz,可与d2o交换,1h),7.65-7.51(m,3h),7.46(t,j=7.6hz,1h),7.24-7.11(m,2h),7.03(s,1h),6.96(s,2h),6.79-6.66(m,2h,减少为1h在d2o后),6.54-6.43(m,可与d2o交换,1h),5.52-5.41(m,在d2o后butd,j=9.5hz,1h),5.15(d,j=12.0hz,1h),4.81(d,j=12.0hz,1h),4.47-4.18(m,5h),4.08-3.98(m,1h),3.97-3.86(m,2h),3.84-3.67(m,5h),3.56-3.21(m,8h,由水峰部分掩蔽),3.12-3.02(m,在d2o后butt,j=6.2hz,2h),2.92-2.80(m,2h),2.65-2.33(m,10h,由dmso峰部分掩蔽),2.25(s,3h),2.15-1.12(m,23h),1.33(s,9h)。hrms(esi)m/zc72h92cln10o16计算值:1387.6376,实测值:1387.6319[mh+];c72h91cln10nao16计算值:1409.6195,实测值:1409.6146[mna+];c72h91clkn10o16计算值:1425.5935,实测值:1425.5875[mk+].在20℃在氮气下向20(79mg,0.057mmol)在dcm(5ml)中的搅拌溶液中加入tfa(5ml)。加入后,将混合物进一步在该温度搅拌20min。加入石油醚(100ml)并将混合物在20℃搅拌30min。除去溶剂并将留置的油状物与更多的etoac-石油醚(1:10)(3×50ml)搅拌。将残留的油状物溶于meoh并将溶液蒸发得到玻璃状固体(76mg),将其经制备性hplc纯化[synergimaxrp柱,4μ,21×250mm;水-tfa(ph=2.56;95%至55%)/10%h2o/ch3cn(5%至45%);梯度时间30min;流速:12ml/min]得到(i)cbi-pbdld2(26.2mg,30%),其为淡琥珀色固体;hplc纯度:98.5%;[α]d+30.0°(c0.233,meoh);1hnmr[(cd3)2so]δ10.08(s,可与d2o交换,1h),9.82(brs,可与d2o交换,1h),8.27(s,1h),7.97(d,j=8.4hz,1h),7.92-7.79(m,3h,在d2o后减少为1h),7.67-7.52(m,5h,在d2o后减少为3h),7.46(t,j=8.0hz,1h),7.21-7.11(m,2h),7.04(s,1h),6.97(s,2h),6.75(s,1h),6.50(brs,1h,可与d2o交换),5.45(brd,在d2o后butd,j=9.0hz,1h),5.10(brd,j=13hz,1h),4.87(brd,j=12hz,1h),4.55-4.10(m,5h),4.50(dd,j=11.4,3.4hz,1h),4.01-3.88(m,2h),3.76(s,3h),3.39-3.22(m,4h),3.14-3.03(m,2h),2.89(s,3h),2.81-2.69(m,2h),2.65-2.55(m,1h),2.47-2.34(m,4h),2.07-1.13(m,23h),剩余的12h由水和dmso峰掩蔽。hrms(esi)m/zc67h84cln10o14计算值:1287.5852,实测值:1287.5845[mh+];c67h83cln10nao14计算值:1309.5671,实测值:1309.5654[mna+].还纯化得到(ii)cbi-pbdld3(11.2mg,15%),其为米色固体;hplc纯度:92.6%;1hnmr[(cd3)2so]δ10.07(s,可与d2o交换,1h),9.90(brs,可与d2o交换,1h),8.27(s,1h),7.96(d,j=8.5hz,1h),7.93-7.76(m,3h,在d2o后减少为1h),7.73-7.51(m,5h,在d2o后减少为3h),7.46(t,j=8.2hz,1h),7.16-7.08(m,2h),7.04(s,1h),6.97(s,2h),6.85(s,1h),5.33(brd,j=7.8hz,1h),5.07(brd,j=12hz,1h),4.93(brd,j=13hz,1h),4.56-4.10(m,5h),3.77(s,3h),3.62-3.23(m,6h),3.44(s,3h),3.15-3.01(m,2h),2.89(s,3h),2.82-2.69(m,2h),2.66-2.55(m,1h),2.46-2.34(m,4h),2.11-1.12(m,23h),剩余13h由水和dmso峰掩蔽。hrms(esi)m/zc68h86cln10o14计算值:1301.6008,实测值:1301.5952[mh+];c68h85cln10nao14计算值:1323.5827,实测值:1323.5778[mna+].制备(2e,2'e)-3,3'-(2-(3-((s)-2-(1-(5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)丙酰氨基)-1,4-亚苯基)二丙烯酸方案向2(1.35g,4.34mmol)在无水dmf(20ml)中的搅拌溶液中加入hatu(2.20g,5.79mmol)、diea(1.12g,8.68mmol)。在将混合物在25℃搅拌10min后,加入化合物1(1.0g,2.89mmol)。将反应混合物在25℃在氮气下搅拌15h。加入水(20ml)并将其用etoac(30ml×3)萃取。将合并的有机相用盐水洗涤,经na2so4干燥,并浓缩。将其经快速柱纯化(pe:etoac=1:1)得到粗产物3(2.25g),其为黄色固体。lcms:(5-95ab,1.5min),1.075min,[m-114]+=527.0.向化合物3(1.95g,3.05mmol)在无水dcm(30ml)中的搅拌溶液中加入哌啶(2.60g,30.5mmol)。将混合物在25℃在氮气下搅拌2.5h。将其用h2o(20ml×3)、盐水(15ml)洗涤,并经na2so4干燥。将其浓缩,用pe(20ml×3)洗涤,并干燥得到粗产物4(2.4g),其为黄色固体。向化合物9(3.0g,17.1mmol)在dme/h2o(40ml/20ml)中的溶液中加入nahco3(2.88g,34.3mmol)。在将混合物在25℃搅拌15min后,加入化合物10(5.54g,20.6mmol)。将混合物在25℃在氮气下搅拌16h。除去溶剂并加入h2o(5ml)。将其用etoac(30ml×3)萃取。将水相的ph用hcl溶液调节至3,并将其用etoac(120ml×3)萃取。将合并的有机相经na2so4干燥,并浓缩得到粗产物11,其为无色油状物。向化合物11(5.64g,17.1mmol)在无水thf(120ml)中的溶液中加入hosu(2.07g,17.98mmol)和dcc(3.70g,17.98mmol)。将混合物在25℃在氮气下搅拌15h。将其滤过并浓缩。将残留物用pe(30ml×3)洗涤,干燥并浓缩得到粗产物12(8.30g),其为白色固体。向化合物4(1.65g,3.96mmol)在无水dmf(20ml)中的溶液中加入化合物12(2.03g,4.75mmol)。将混合物在25℃在氮气下搅拌15h。加入水(30ml)并将其用etoac(30ml×3)萃取。将合并的有机相用盐水(30ml)洗涤,并经na2so4干燥。将其浓缩得到粗产物,将其用pe(30ml×4)和mtbe/pe(15ml/45ml×2)洗涤,并干燥得到产物5(0.96g,收率:33%),其为浅黄色固体。向化合物5(0.96g,1.32mmol)在meoh(4ml)、thf(8ml)和h2o(8ml)中的溶液中加入lioh-h2o(111mg,2.64mmol)。将混合物在25℃在氮气下搅拌30min。减压除去有机溶剂并加入h2o(10ml)。加入hcl溶液以调节ph为3-4。将其用etoac(50ml×4)萃取,经na2so4干燥,并浓缩得到粗产物。将粗产物用pe(30ml)和mtbe(10ml×3)洗涤,并干燥得到产物6(620mg,收率:67%),其为白色固体。在0℃向化合物6(620mg,0.89mmol)在无水dmf(10ml)中的溶液中加入diea(573mg,4.43mmol)和bop-cl(248mg,0.97mmol)。加入化合物7(177.59mg,0.97mmol)。在将混合物在0℃在氮气下搅拌30min后,加入h2o(20ml)并将其用etoac(30ml×3)萃取。将合并的有机相用盐水(30ml)洗涤,经na2so4干燥,并浓缩得到粗产物.将其用mtbe(10ml×2)和pe(50ml×3)洗涤,并干燥得到产物8(690mg,收率:90%),其为白色固体。lcms:(5-95ab,1.5min),0.875min,ms=864.2[m+1];向化合物8(300mg,0.347mmol)在无水dcm(4.0ml)中的搅拌溶液中逐滴加入tfa(2.0ml)。在将混合物在25℃在氮气下搅拌30min后,除去溶剂。将残留物溶于dmf并经制备性hplc纯化(hcooh)得到产物(2e,2'e)-3,3'-(2-(3-((s)-2-(1-(5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)丙酰氨基)-1,4-亚苯基)二丙烯酸(81.4mg,收率:31%),其为浅黄色粉末。1hnmr(400mhz,dmso-d6)δ9.93(s,2h),6.13(s,1h),7.82–7.46(m,8h),6.98(s,2h),6.55–6.51(d,j=16.0hz,2h),5.98(s,1h),5.41(s,2h),4.22(s,1h),3.03–2.90(m,6h),2.67–2.50(m,4h),2.36(s,4h),1.69(s,3h),1.46–1.33(m,7h),1.23–1.16(d,j=28hz,2h).制备cbi-cbild52,5-二((e)-3-((s)-1-(氯甲基)-5-(膦酰氧基)-1h-苯并[e]吲哚-3(2h)-基)-3-氧代丙-1-烯基)苯基氨基甲酸4-((s)-2-(1-(5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基酯2向在冰浴中冷却的1(230mg,0.44mmol)在meoh(2ml)中的溶液中加入cs2co3(287mg,0.88mmol)和几滴水。将混合物在冰浴中搅拌1h,然后重新分散于乙酸乙酯和水之间。将水相用乙酸乙酯萃取三次。将合并的有机萃取液用水和盐水洗涤,经无水na2so4干燥,经硅藻土滤过,并除去溶剂。将所得的残留物溶于乙酸乙酯并经florisil填料滤过得到粗的2,其为灰白色胶状物(188mg,100%),其无需进一步纯化即可直接使用。4向180mg(0.42mmol)2(由如上提及的操作新鲜制备)中加入(2e,2'e)-3,3'-(2-(3-((s)-2-(1-(5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)丙酰氨基)-1,4-亚苯基)二丙烯酸3(100mg,0.12mmol)、edci.hcl(185mg,0.96mmol)、甲苯磺酸(2.1mg,0.012mmol)和dma(0.5ml)。在将混合物搅拌过夜后,真空除去大部分dma并将残留物重新分散于乙酸乙酯和nahco3水溶液之间。将水相用乙酸乙酯萃取三次。将合并的有机萃取液用水、随后盐水洗涤,经无水na2so4干燥,并经硅藻土填料滤过。除去溶剂并将所得的残留物溶于最少的dcm中并通过加入庚烷沉淀得到粗产物(207mg),将其进一步经制备性hplc纯化[柱:synergi-maxrp4μ,250×21.20mm;流动相:a/b=20%至1%(a:甲酸铵ph3.45,b:90%乙腈/水);流速12ml/min]得到4(65mg,33%),其为黄色固体。1hnmr(cdcl3)δ9.67(brs,1h),8.67(brs,2h),8.18-7.98(m,4h),7.90-7.72(m,3h),7.66-7.58(m,6h),7.50-7.28(m,8h),6.84-6.62(m,4h),6.66(s,2h,马来酰亚胺),6.00(brs,1h),5.23-5.13(m,2h),4.80-4.70(m,1h),4.40-3.85(m,6h),3.50-3.40(m,6h),3.20-3.14(m,2h),2.90-2.75(m,2h),2.60-2.45(m,4h),1.92-1.80(m,2h),1.62,1.60,1.57,1.56(4s,36h),1.55-1.40(m,6h),1.30-1.20(m,3h)。31pnmr(cdcl3)δ-15.44(s),15.82(s)。hrms(esi)实测m/z1666.6051(m+na)。c83h101cl2n9nao18p2需要1666.6009.5向在冰浴中冷却的4(25mg,0.015mmol)在dcm(0.6ml)中的溶液中加入tfa(0.2ml,2.61mmol)。将混合物在冰浴中搅拌0.5h。将所有挥发组分在0℃泵出并将所得的残留物用乙酸乙酯研磨,然后用thf和石油醚洗涤得到5(cbi-cbild5),其为黄色固体(19mg,88%)。1hnmr(dmso)δ10.33(brs,1h),9.63(s,1h),8.70(s,1h),8.95(s,1h),8.14-8.11(m,4h),7.96-7.90(m,4h),7.81-7.69(m,6h),7.64-7.54(m,2h),7.50-7.39(m,4h),7.33-7.26(m,2h),6.97(s,2h,马来酰亚胺),6.13(brs,2h),5.14(s,2h),4.58(s,4h),4.40-4.30(m,4h),4.08-3.95(m,4h),3.29(t,j=6.9hz,2h),2.99-2.94(m,4h),2.39-2.33(m,2h),1.71-1.67(m,4h),1.40-1.35(m,6h),1.12-1.10(m,3h)。31pnmr(dmso)δ-5.91(s)。hrms(esi)实测m/z1442.3438(m+na)。c67h69cl2n9nao18p2需要1442.3505.cbi-cbild62,5-二((e)-3-((s)-1-(氯甲基)-5-(膦酰氧基)-1h-苯并[e]吲哚-3(2h)-基)-3-氧代丙-1-烯基)苯基氨基甲酸4-((s)-2-(1-(5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基酯步骤a:(s)-n-(5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基)-n-(1-(4-(羟基甲基)苯基氨基)-1-氧代-5-脲基戊-2-基)环丁烷-1,1-二甲酰胺方案操作将化合物1(150g,1.53mol)加至化合物2(201g,1.53mol)在hoac(1000ml)中的搅拌溶液中。在将混合物在室温搅拌2h后,将其回流加热8h。减压除去有机溶剂并将残留物用etoac(500ml×3)萃取,用h2o洗涤。将合并的有机层经na2so4干燥并浓缩得到粗产物。将其用石油醚洗涤得到化合物3,其为白色固体(250g,77.4%).将dppa(130g,473mmol)和tea(47.9g,473mmol)加至化合物3(100g,473mmol)在t-buoh(200ml)中的溶液中。将混合物在氮气下回流加热8h。将混合物浓缩,并将残留物经硅胶柱色谱纯化(pe:etoac=3:1)得到化合物4(13g,10%).向化合物4(28g,992mmol)在无水etoac(30ml)中的溶液中逐滴加入hcl/etoac(50ml)。在将混合物在室温搅拌5h后,将其滤过并将固体干燥得到化合物5(16g,73.7%).1hnmr(400mhz,dmso-d6):δ8.02(s,2h),6.99(s,2h),3.37-3.34(m,2h),2.71-2.64(m,2h),1.56-1.43(m,4h),1.23-1.20(m,2h).向化合物6(17.50g,0.10mol)在二噁烷和h2o的混合物(50ml/75ml)中的混合物中加入k2co3(34.55g,0.25mol)。在0℃缓慢加入fmoc-cl(30.96g,0.12mol)。历时2h将反应混合物温热至室温。减压除去有机溶剂,并将水浆液用6mhcl溶液调节至ph=3,并用etoac(100ml×3)萃取。将有机层经na2so4干燥,滤过,并减压浓缩得到预期产物7(38.0g,95.6%)。(化合物7之后变为可商购得到的)向化合物7(4g,10mmol)在dcm和meoh的混合物(100ml/50ml)中的溶液中加入4-氨基-苯基-甲醇(8)(1.6g,13mmol,1.3eq)和eedq(3.2g,13mmol,1.3eq)。在将混合物在室温在氮气下搅拌16h后,将其浓缩得到棕色固体。加入mtbe(200ml)并将其在15℃搅拌2h。将固体经滤过收集,用mtbe(50ml×2)洗涤得到粗产物9,其为橙色固体(4.2g,84%).lcms(esi):m/z503.0[m+1].在室温向化合物9(4.2g,8.3mmol)在无水dmf(20ml)中的搅拌溶液中逐滴加入哌啶(1.65ml,17mmol,2eq)。将混合物在室温搅拌30min,并形成固体析出物。加入无水dcm(50ml),并且混合物立即变为透明的。将混合物在室温搅拌另外的30min,且lcms显示消耗化合物9。将其减压浓缩干燥(确保无哌啶残留),并将残留物在etoac和h2o(50ml/20ml)之间分配。将水相用etoac(50ml×2)洗涤并浓缩得到10,其为油状残留物(2.2g,94%)(含有少量的dmf).向化合物11(8g,29.7mmol)在dme(50ml)中的溶液中加入化合物10(6.0g,21.4mmol)和nahco3(7.48g,89.0mmol)在水(30ml)中的溶液。在将混合物在室温搅拌16h后,将其减压浓缩干燥并将残留物经柱色谱纯化(dcm:meoh=10:1)得到粗化合物12,其为白色固体(6.4g,68.7%).lcms(esi):m/z435.0[m+1].在室温向化合物12(6.4g,14.7mmol)在thf和meoh的混合物(20ml/10ml)中的搅拌溶液中加入lioh·h2o(1.2g,28.6mmol)在h2o(20ml)中的溶液。在将反应混合物在室温搅拌16h后,减压除去溶剂,将得到的残留物经制备性hplc纯化,得到化合物13(3.5g,收率:58.5%).lcms(esi):m/z406.9[m+1].1hnmr(400mhz,甲醇-d4)δ8.86(d,j=8.4hz,2h),8.51(d,j=8.4hz,2h),5.88-5.85(m,1h),5.78(s,2h),4.54-4.49(m,3h),4.38-4.32(m,1h),3.86-3.75(m,1h),3.84-3.80(m,2h),3.28-3.21(m,1h),3.30-3.24(m,1h),3.00-2.80(m,1h),2.37-2.28(m,2h).在0℃将dipea(1.59g,12.3mmol)和bop-cl(692mg,2.71mmol)加至化合物13(1.0g,2.46mmol)在dmf(10ml)中的溶液中,随后加入化合物5(592mg,2.71mmol)。将混合物在0℃搅拌0.5h。将反应混合物用柠檬酸溶液(10ml)淬灭,用dcm/meoh(10:1)萃取。将有机层干燥并浓缩,并将残留物经硅胶柱色谱纯化(dcm:meoh=10:1)得到化合物14(1.0g,71%)。1hnmr(400mhz,dmso-d6):δ10.00(s,1h),7.82-7.77(m,2h),7.53(d,j=8.4hz,2h),7.19(d,j=8.4hz,2h),6.96(s,2h),5.95(t,j=6.4hz,1h),5.39(s,2h),5.08(t,j=5.6hz,1h),4.40-4.35(m,3h),4.09(d,j=4.8hz,1h),3.01(d,j=3.2hz,2h),3.05-2.72(m,4h),2.68-2.58(m,3h),2.40-2.36(m,4h),1.72-1.70(m,3h),1.44-1.42(m,1h),1.40-1.23(m,6h),1.21-1.16(m,4h).步骤b:合成(2e,2'e)-3,3'-(2-((4-((s)-2-(1-(5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基氨基)-1,4-亚苯基)二丙烯酸方案操作向化合物1(1.5g,21.4mmol)在二噁烷(4.0ml)中的溶液中加入化合物2(2.74g,85.6mmol)、dipea(3.45g,107mmol)和pd(t-bu3p)2(0.55g,4.30mmol)。将反应混合物在120℃在微波辐射下搅拌2.0h。将反应重复4次(总计使用6.0g1)。将合并的反应混合物浓缩,用水(20ml)稀释并用etoac(100.0mlx3)萃取。合并有机层,经na2so4干燥。将其浓缩并经柱色谱纯化(pe:etoac=10:1)得到预期产物(3.8g,47%).向化合物3(3.88g,10.1mmol)在etoh/h2o(120.0ml)中的溶液中加入fe(2.83g,50.7mmol)和nh4cl(5.4g,101mmol),并将反应混合物在100℃搅拌2.0h。将反应混合物滤过并将滤液浓缩并用etoac(60.0mlx3)萃取。合并有机层,经na2so4干燥并浓缩得到产物(2.5g,72%).向三光气溶液(224mg,0.76mmol)中逐滴加入冰浴中的化合物4(725mg,2.1mmol)和et3n(530.3mg,5.25mmol)在dcm(5.0ml)中的溶液。将反应混合物在21℃搅拌1.0h直到无起始物质剩余。将反应混合物用水(5.0mlx2)洗涤,并经na2so4干燥。将其浓缩并溶于dcm(5.0ml)。加入化合物5的溶液(1.0g,1.75mmol)并将反应混合物在21℃搅拌3.0h。将反应混合物用meoh(2.0ml)淬灭,并经柱色谱纯化(dcm:meoh=10:1)得到预期产物(380mg,23%)。向化合物6(300.0mg,0.32mmol)在dcm(10.0ml)中的溶液中加入tfa(2.0ml),并将混合物在21℃搅拌30.0min。将混合物用nh3·h2o调节至ph6。将析出物经滤过收集得到产物(2e,2'e)-3,3'-(2-((4-((s)-2-(1-(5-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)戊基氨基甲酰基)环丁烷甲酰氨基)-5-脲基戊酰氨基)苄基氧基)羰基氨基)-1,4-亚苯基)二丙烯酸(112.0mg,收率42%).lcms(10-80,ab,2.0min)rt=0.962min,[m+1]+=830.0;1hnmr(400mhz,dmso-d6)δ12.45(br,2h),10.10(s,1h),9.55(s,1h),7.50-7.81(m,8h),7.34(m,2h),6.95(s,2h),6.47-6.57(m,2h),5.96(s,1h),5.40(s,2h),5.05(s,2h),4.36-4.39(m,1h),2.98-3.06(m,6h),2.35-2.39(m,4h),1.15-1.73(m,13h).步骤c:8向184mg(0.43mmol)2(由如上提及的操作新鲜制备)中加入3(80mg,0.11mmol)、edci.hcl(165mg,0.86mmol)、甲苯磺酸(2.0mg,0.011mmol)和dma(0.5ml)。在将混合物搅拌过夜后,真空除去大部分dma并将残留物重新分散于乙酸乙酯和nahco3水溶液之间。将水相用乙酸乙酯萃取三次。将合并的有机萃取液用水、随后盐水洗涤,经无水na2so4干燥,并经硅藻土填料滤过。除去溶剂并将所得的残留物溶于最少的dcm中并通过加入庚烷沉淀得到粗产物(195mg),将其进一步经制备性hplc纯化[柱:synergi-maxrp4μ,250×21.20mm;流动相:a/b=90%至2%(a:甲酸铵ph3.45,b:90%乙腈/水);流速12ml/min]得到4(56mg,34%),其为黄色固体。1hnmr(dmso)δ10.02(s,1h),8.67(s,2h),8.14-8.06(m,4h),7.97(d,j=8.4hz,2h),7.86-7.76(m,4h),7.70(d,j=15.2hz,1h),7.63-7.59(m,2h),7.53-7.49(m,2h),7.29-7.23(m,2h),6.96(s,2h,马来酰亚胺),5.91(brs,1h),5.36(brs,2h),4.65-4.50(m,4h),4.44-4.37(m,2h),4.28-4.22(m,2h),4.05-3.95(m,4h),3.60(t,j=6.6hz,1h),3.07-3.00(m,2h),2.95-2.88(m,2h),2.68-2.58(m,2h),2.42-2.32(m,3h),1.78-1.62(m,4h),1.51,1.50,1.49,1.48(4s,36h),1.49-1.28(m,11h)。31pnmr(cdcl3)δ-15.44(s),15.46(s)。hrms(esi)实测m/z1588.5827(m+na)。c78h99cl2n9nao17p2需要1588.5903.5向在冰浴中冷却的4(25mg,0.015mmol)在dcm(0.6ml)中的溶液中加入tfa(0.2ml,2.61mmol)。将混合物在冰浴中搅拌0.5h。加入乙醚并将所得的析出物经滤过收集并用乙酸乙酯、thf和石油醚洗涤得到5(cbi-cbild6),其为棕色固体(18mg,86%)。1hnmr(dmso)δ10.01(brs,1h),8.60(brs,2h),8.16-8.09(m,4h),7.96-7.93(m,2h),7.88-7.58(m,8h),7.46(t,j=7.7hz,2h),7.30-7.25(m,2h),6.97(s,2h,马来酰亚胺),6.10(brs,1h),5.35(brs,2h),4.60-4.18(m,6h),4.05-3.95(m,4h),3.45-3.29(m,5h),3.04-2.87(m,4h),2.68-2.60(m,2h),2.40-2.30(m,4h),1.72-1.57(m,4h),1.43-1.28(m,5h),1.20-1.07(m,3h)。31pnmr(dmso)δ-5.82(s)。hrms(esi)实测m/z1342.3562(m+h)。c62h68cl2n9o17p2需要1342.3580.制备adc的方法通过还原和再氧化制备用于缀合的半胱氨酸改造的抗体在某些条件下,可通过用还原剂如dtt(cleland试剂,二硫苏糖醇)或tcep(三(2-羧基乙基)膦盐酸盐;getz等(1999)anal.biochem.vol273:73-80;soltecventures,beverly,ma)处理,使半胱氨酸改造的抗体具有反应性以便与本发明的接头-药物中间体缀合。在cho细胞中表达的全长半胱氨酸改造的单克隆抗体(thiomab)(gomez等(2010)biotechnologyandbioeng.105(4):748-760;gomez等(2010)biotechnol.prog.26:1438-1445)在室温例如用约50倍过量的dtt还原过夜,以便还原可在新引入的半胱氨酸残基与存在于培养基中的半胱氨酸之间形成的二硫键。轻链氨基酸根据kabat(kabat等,sequencesofproteinsofimmunologicalinterest,(1991)第5版,usdeptofhealthandhumanservice,nationalinstitutesofhealth,bethesda,md)编号。除了指定为kabat系统的情形外,重链氨基酸根据eu编号系统(edelman等(1969)proc.natl.acad.ofsci.63(1):78-85)编号。使用单字母氨基酸缩写。由于细胞培养条件,在cho细胞中表达的全长、半胱氨酸改造的单克隆抗体(thiomab)携带半胱氨酸加合物(胱氨酸)或在改造的半胱氨酸上进行谷胱甘肽化。为释放改造的半胱氨酸的反应性巯基,将thiomab在约ph8.0的500mm硼酸钠和500mm氯化钠中溶解并用约50-100倍过量的1mmtcep(三(2-羧基乙基)膦盐酸盐;getz等(1999)anal.biochem.vol273:73-80;soltecventures,beverly,ma)在37℃还原约1-2小时。或者,可使用dtt作为还原剂。通过非还原性sds-page或通过变性反相hplcplrp柱色谱监测链间二硫键的形成。将还原的thiomab在ph5的10mm乙酸钠中稀释并加载到hitrapspff柱上,并用含有0.3m氯化钠的pbs或者含有150mm氯化钠的ph7.5的50mmtris-cl洗脱。通过进行再氧化重新产生存在于亲代mab中的半胱氨酸残基间的二硫键。对于洗脱的经还原thiomab,在ph7用15x或2mm脱氢抗坏血酸(dhaa)处理3小时,或在50mmtris-cl,ph7.5处理3小时,或用2mm硫酸铜水溶液(cuso4)在室温处理过夜。可使用本领域已知的其它氧化剂,即氧化试剂和氧化条件。环境空气氧化也可为有效的。这种适度的部分再氧化步骤有效地形成具有高保真度的链内二硫键。通过在sephadexg25树脂上洗脱来更换缓冲液并用含1mmdtpa的pbs洗脱。由溶液在280nm处的吸光度确定还原抗体浓度以及通过与dtnb(aldrich,milwaukee,wi)反应并测定在412nm处的吸光度而确定巯基浓度,由此检测巯基/ab值。在质量范围扩大的tsqquantumtriplequadrupoletm质谱仪(thermoelectron,sanjosecalifornia)上进行液相色谱/质谱分析。在加热至75℃的1000a,微内径柱(50mmx2.1mm,polymerlaboratories,shropshire,uk)上对样品进行色谱分析。使用30-40%b的线性梯度(溶剂a:0.05%tfa/水,溶剂b:0.04%tfa/乙腈)并使用电喷射源将洗脱液直接电离。通过数据系统收集数据并使用(novatia,llc,newjersey)进行解卷积。在lc/ms分析之前,将抗体或药物缀合物(50微克)用pngasef(2单位/ml;prozyme,sanleandro,ca)于37℃处理2小时以除去n连接的碳水化合物。将疏水作用色谱(hic)样品注入butylhicnpr柱(2.5微米粒度,4.6mm×3.5cm)(tosohbioscience)并以0.8ml/min用0至70%b的线性梯度洗脱(a:1.5m硫酸铵/50mm磷酸钾,ph7;b:50mm磷酸钾,ph7,20%异丙醇)。使用配备有多波长检测仪和chemstation软件的agilent1100系列hplc系统来解析和定量具有不同药物/抗体比的抗体种类。本发明的半胱氨酸改造的抗体可根据上述一般方法制备。接头-药物中间体与抗体的缀合(步骤1)改造的抗体半胱氨酸以与如在cho细胞中表达的谷胱甘肽和/或半胱氨酸的混合二硫化物的形式被阻断。这些半胱氨酸在缀合前必须被"解阻断(deblocked)"。将20mm琥珀酸盐、150mmnacl、2mmedta中的解阻断抗体(5-12mg/ml)加至75-100mmtris,ph7.5-8(使用1mtris)。将共溶剂(dmso、dmf或dma)加至所述抗体溶液,然后加入接头-药物(在dmso或dmf中),得到10-13%的最终%-有机溶剂以及相对于抗体浓度2.5-10x的接头-药物最终浓度。在室温进行反应1-12小时(直至实现最大缀合)。通过使用一次性柱的阳离子交换色谱和/或凝胶过滤(分别为smaxi或zeba)纯化缀合反应混合物。若根据分析性sec发现粗缀合物显著聚集(例如,>10%),则通过制备性凝胶过滤(s200柱)进行额外的纯化。随后使用凝胶过滤或透析将缀合物交换于制剂缓冲液(20mmhis-乙酸盐,ph5.5,240mm蔗糖)。随后将tween-20加至经纯化缀合物以实现0.02%的最终浓度。最终缀合物浓度范围为2.4至7.5mg/ml(%收率:34-81%,来自解阻断抗体)。通过lcms分析缀合物以获得药物-抗体比(dar)的测量,其范围为1.3至2.1(平均:1.8)。还使用分析性sec(zenix或shodex柱)分析缀合物的高分子量聚集物的存在;最终,经纯化缀合物显示出0-10%的聚集。还对缀合物的内毒素污染进行评估,其在所有情况下均不超过1.3eu/mg。游离的未缀合药物不超过最终缀合物的1%。接头-药物中间体与抗体的缀合(步骤2,替代操作)在以上实施例的还原和再氧化操作后,将抗体溶于pbs(磷酸盐缓冲盐水)缓冲液中并在冰上冷却。将过量的约1.5摩尔浓度至20当量的接头-药物中间体与巯基反应性官能团如马来酰亚胺基团或溴-乙酰胺基团溶于dmso中,在乙腈和水中稀释,并加至pbs中的冷却的经还原、再氧化的抗体。约1小时后,添加过量马来酰亚胺以淬灭反应混合物并对任何未反应的抗体巯基封端(cap)。可将缀合混合物装载并洗脱通过hitrapspff柱以除去过量的药物-接头中间体和其它杂质。通过离心超滤浓缩反应混合物并将半胱氨酸改造的抗体药物缀合物在pbs中洗脱通过g25树脂来纯化和脱盐,在无菌条件下滤过通过0.2μm滤器,并冷冻供贮存。本发明的adc可根据以上部分中描述的操作制备。测定然后测试所选接头并发现其在体外和体内测定中具有活性。裂解数据在下表中示出。组织蛋白酶b裂解测定如同肽接头,预期用于adc的非肽接头在溶酶体中可裂解以用于适当药物释放。作为细胞的一种消化性细胞器,溶酶体富含一些在酸性ph显示出最佳水解活性的蛋白酶。组织蛋白酶b是一种代表性的溶酶体蛋白酶并已显示出有助于adc肽接头(参照)的活化。作为初始筛选,开发使用经纯化组织蛋白酶b的测定以鉴定适用于与抗体缀合的可裂解接头-药物结构。使用诺氟沙星表示接头-药物的药物成分。在给定时间点以及裂解反应的动力学参数(km和vmax)测量相对于对照肽(例如val-cit)的裂解百分数。以下显示了所述测定的详细描述。从该测定鉴定了各种具有蛋白水解活性且结构多样性的接头并在之后将其用于制备adc。使用实验性接头-药物作为底物,通过使用lc/ms监测诺氟沙星的释放,测量组织蛋白酶b裂解活性。在包含20nm组织蛋白酶b(emdmillipore批号#219364,人肝)、10mmmesph6.0、1mmdtt、0.03%chaps和25nm诺氟沙星-d5内标(santacruzbiotechnology,批号#sc-301482)的20ul反应液中培养不同浓度的接头-药物(3倍连续稀释)。在37℃培养反应混合物1小时,然后加入60ul2%甲酸以淬灭反应混合物。通过在watersacquityuplcbehphenyl柱(2.1mmx50mm,waters批号#186002884)上注射2ul终止的反应混合物对样品进行分析。在wateracquityuplc上使用乙腈、0.1%甲酸的线性2分钟梯度(0%至80%)纯化样品。使用以阳性mrm模式运行的absciexqtrap5500三重四级杆质谱仪检测诺氟沙星和诺氟沙星-d5内标(诺氟沙星320→233m/z,诺氟沙星-d5325→233m/z)。将量化的诺氟沙星(用内标标准化)针对接头-药物浓度进行作图,且所得曲线是使用graphpadprism软件针对动力学常数km和vmax进行米-曼二氏拟合的拟合曲线。体外细胞增殖测定通过使用以下方案的细胞增殖测定来测量adc的效能(celltiterglotm发光细胞存活测定,promegacorp.technicalbulletintb288;mendoza等(2002)cancerres.62:5485-5488):1.将100μl小份的在培养基中含有104个细胞(skbr-3,bt474,mcf7或mda-mb-468)的细胞培养物置于96孔不透明壁板的各孔中。2.准备包含培养基且无细胞的对照孔。3.将adc加至实验孔并培养3-5天。4.将板平衡至室温约30分钟。5.加入等同于各孔中存在的细胞培养基体积的一定体积的celltiterglotm试剂。6.在定轨振荡器上混合内容物2分钟以诱导细胞裂解。7.在室温培养所述板10分钟以稳定化发光信号。8.记录发光并将其在图中报告为rlu=相对发光单位。数据绘制为具有标准偏差误差棒的各组重复测量的发光均值。所述方案是对celltiterglotm发光细胞的修改。培养基:sk-br-3生长在50/50/10%fbs/谷氨酰胺/250μg/mlg-418,ovcar-3生长在rpmi/20%fbs/谷氨酰胺。体内测定1.在hl-60或eol-1(人急性髓细胞性白血病)的小鼠异种移植模型中研究抗cd33抗体-药物缀合物(adc)的效能。所述hl-60细胞系获自atcc(americantypeculturecollection;manassas,va)且eol-1细胞系来源于dsmz(germancollectionofmicroorganismsandcellcultures;braunschweig,germany)。雌性c.b-17scid小鼠(charlesriver实验室;hollister,ca)在侧面区域各自皮下接种五百万个hl-60或eol-1细胞。当异种移植瘤达到100-300mm3的平均肿瘤体积时(称作第0日),将动物随机分入各自含7-10只小鼠的组中并接受adc的单次静脉内注射。在给药adc前约4小时,腹膜内给药动物过量(30mg/kg)的抗-gd对照抗体以阻断肿瘤细胞上可能的非特异性抗体结合位点。在整个研究过程中每周测量小鼠肿瘤和体重1-2次。当体重减轻>20%其初始体重时,对小鼠立即进行安乐死。在肿瘤达到3000mm3或显示出即发溃疡迹象前对所有动物进行安乐死。2.在ovcar3-x2.1(人卵巢癌)的小鼠异种移植模型中研究抗napi2b抗体-药物缀合物(adc)的效能。所述ovcar3细胞系获自atcc(americantypeculturecollection;manassas,va)且亚系ovcar3-x2.1在小鼠中最佳生长的genentech产生。雌性c.b-17scid-米色小鼠(charlesriver实验室;sandiego,ca)在胸部乳腺脂肪垫区域各自接种一千万个ovcar3-x2.1细胞。当异种移植瘤达到100-300mm3的平均肿瘤体积时(称作第0日),将动物随机分入各自含7-10只小鼠的各组中并接受adc的单次静脉内注射。在整个研究过程中每周测量小鼠肿瘤和体重1-2次。当体重减轻>20%其初始体重时,对小鼠立即进行安乐死。在肿瘤达到3000mm3或显示出即发溃疡迹象前对所有动物进行安乐死。3.在bjab-luc(人伯基特淋巴瘤)或wsu-dlcl2(人弥散性大b细胞淋巴瘤)的小鼠异种移植模型中研究抗cd22抗体-药物缀合物(adc)的效能。所述bjab细胞系获自dsmz(germancollectionofmicroorganismsandcellcultures;braunschweig,germany),且亚系bjab-luc在genentech产生以稳定表达荧光素酶基因。所述wsu-dlcl2细胞系也是来源于dsmz。雌性c.b-17scid小鼠(charlesriver实验室;hollister,ca)在侧面区域各自皮下接种2千万个bjab-luc或wsu-dlcl2细胞。当移植瘤达到100-300mm3的平均肿瘤体积时(称作第0日),将动物随机分入各自含7-10只小鼠的各组中并接受adc的单次静脉内注射。在整个研究过程中每周测量小鼠肿瘤和体重1-2次。当体重减轻>20%其初始体重时,对小鼠立即进行安乐死。在肿瘤达到3000mm3或显示出即发溃疡迹象前对所有动物进行安乐死。4.在mmtv-her2founder#5(小鼠乳腺肿瘤)的小鼠同种异体移植模型中研究抗her2抗体-药物缀合物(adc)的效能。所述mmtv-her2founder#5(fo5)模型(在genentech开发)是一种转基因小鼠模型,其中人her2基因在小鼠乳腺肿瘤病毒启动子(mmtv-her2)的转录调节下,在乳腺上皮细胞中过表达。所述过表达导致过表达人her2受体的乳腺肿瘤的自发发展。来自于一只founder动物(founder#5,fo5)的乳腺肿瘤已通过连续移植肿瘤碎片而在fvb小鼠(charlesriver实验室)中传播。对于效能研究,将所述fo5转基因乳腺肿瘤以约2mmx2mm大小的肿瘤碎片形式手术移植入雌性nu/nu小鼠(charlesriver实验室;hollister,ca)的胸部乳腺脂肪垫。当同种异体移植瘤达到100-300mm3的平均肿瘤体积时(称作第0日),将动物随机分入各自含7-10只小鼠的各组中并接受adc的单次静脉内注射。在整个研究过程中每周测量小鼠肿瘤和体重1-2次。当体重减轻>20%其初始体重时,对小鼠立即进行安乐死。在肿瘤达到3000mm3或显示出即发溃疡迹象前对所有动物进行安乐死。生物学数据接头-药物化合物结构和组织蛋白酶b裂解数据以下接头-药物化合物可如下式概述:cap—pm—sp—t其中cap为封端基团,其在组织蛋白酶b测定中保护氨基(例如cbz和乙基);pm为肽模拟部分;sp为间隔基团,t为药物部分的取代基。下表中的catb裂解数据显示了本发明的非肽接头的裂解速率与肽接头是相当的(40-56)。肽接头已经广泛用于抗体药物缀合物以释放活性药物部分;因此,预期包含本发明非肽接头的缀合物可实现相似的体外和体内结果。adc接头-药物结构序列napi2b人源化抗体:在一个实施方案中,本发明adc的napi2b抗体包含三个轻链高变区和三个重链高变区(seqidno:1-6),其序列在以下示出。在一个实施方案中,本发明adc的napi2b抗体包含seqidno:7的可变轻链序列和seqidno:8的可变重链序列。在一个实施方案中,本发明adc的napi2b抗体包含seqidno:9的轻链序列和seqidno:10的重链序列。抗cd33人源化抗体:在一个实施方案中,本发明adc的抗cd33抗体包含三个轻链高变区和三个重链高变区,其序列(seqidno:11-16)在以下示出。在一个实施方案中,本发明adc的抗cd33抗体包含seqidno:17的可变轻链序列和seqidno:18的可变重链序列。在一个实施方案中,本发明adc的抗cd33抗体包含seqidno:19的轻链序列和seqidno:20的重链序列。在一个实施方案中,本发明adc的抗cd33抗体包含三个轻链高变区和三个重链高变区,其序列(seqidno:19-24)在以下示出。在一个实施方案中,本发明adc的抗cd33抗体包含seqidno:25的可变轻链序列和seqidno:26的可变重链序列。在一个实施方案中,本发明adc的抗cd33抗体包含seqidno:27的可变轻链序列和seqidno:28的可变重链序列。在一个实施方案中,本发明adc的抗cd33抗体包含seqidno:29的可变轻链序列和seqidno:30的可变重链序列。在一个实施方案中,本发明adc的抗cd33抗体包含seqidno:31的可变轻链序列和seqidno:32的可变重链序列。抗cd22人源化抗体:在一个实施方案中,本发明adc的抗cd22抗体包含三个轻链高变区和三个重链高变区(seqidno:41-46),其序列在以下示出。在一个实施方案中,本发明adc的抗cd22抗体包含seqidno:47的可变轻链序列和seqidno:48的可变重链序列。在一个实施方案中,本发明adc的抗cd22抗体包含seqidno:49的轻链序列和seqidno:50的重链序列。adc体外数据在如上所述的体外测定中测试以下adc并发现其具有活性。所述adc的活性在下表中阐明。napi2badcs用作非靶标对照。编码抗体ideol-1ic50(ng/ml)napi2bcbi-pbdadc2-110h1.11.4b2187cd33cbi-pbdadc2-215g15.33370napi2bcbi-pbdadc3-110h1.11.4b590cd33cbi-pbdadc3-215g15.3318.1adc体内数据图1显示了cd33adc在具有hl-60人急性髓细胞性白血病肿瘤的scid小鼠中的效能比较。cd33cbi-pbdadc3-2相比于媒介物组显示出肿瘤生长的剂量依赖性抑制。非靶标对照napi2bcbi-pbdadc3-1对于肿瘤生长具有最小作用。图2显示了napi2badcs在具有ovcar3x2.1人卵巢肿瘤的scid-beige小鼠中的效能比较。napi2bcbi-pbdadc2-1和adc3-1相比于媒介物组证实了对肿瘤生长的适度抑制。napi2bcbi-pbdadc2-1和adc3-1的抗肿瘤活性是相当的,在3mg/kg抗体剂量(=73ug/m2的药物剂量)导致肿瘤生长延迟。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1