miRNA302‑367簇的微小RNA在靶向抑制血管新生和肿瘤生长的应用的制作方法
本发明属于实体肿瘤疾病治疗领域。具体地,涉及mirna302-367簇的微小rna在靶向抑制血管新生和肿瘤生长的应用。
背景技术:
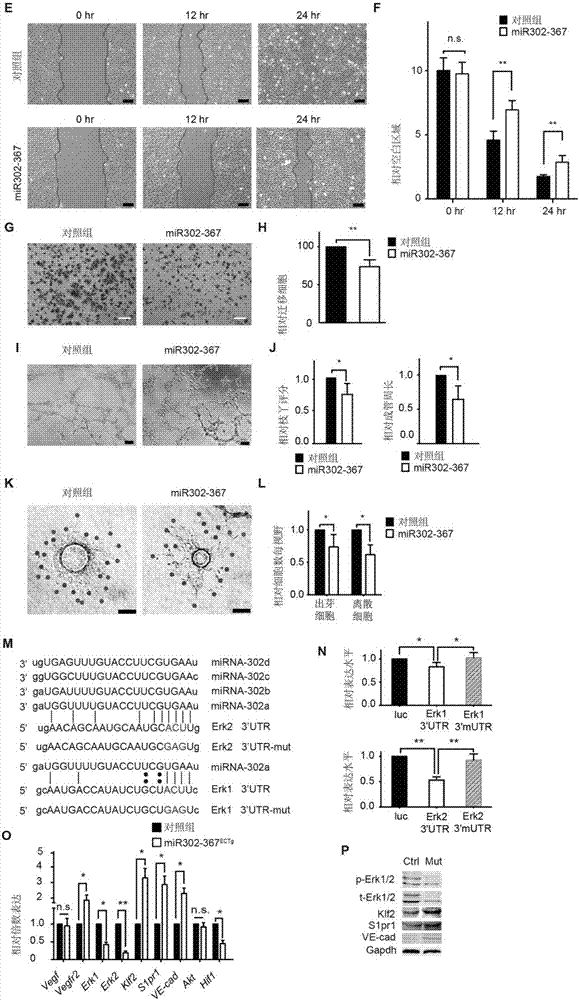
:恶性肿瘤是目前全世界人口的主要死亡原因之一,已经成为严重危害人类生命健康、制约社会经济发展的一大类疾病。并且随着社会经济发展,环境因素改变等,我国的肿瘤发病率更成逐年上升趋势。近年来随着高血压,高血糖患者的不断增加,视网膜小血管变性,增殖,新生血管形成最终导致患者视力受损甚至失明也日益成为严峻的临床问题。血管新生是由血管内皮细胞激活、增殖、迁移,并从已有的毛细血管发展而形成新的血管和血管网,涉及多种细胞分子机制的复杂过程。血管新生在肿瘤的生长、转移中起着决定性作用,对肿瘤的预后具有及其重要的意义,而如何特异且有效的抑制肿瘤中的血管新生已成为肿瘤领域的热点与重点之一,也是一项难点。以血管新生为靶点的相关研究内容屡见报道,但以通过蛋白抗体针对与血管新生过程中关键靶点的抗体特异性治疗方法往往由于存在耐药性,免疫原性等诸多问题而难以在临床实践中获得很好应用。例如,针对内皮血管新生过程关键蛋白靶点的抗血管内皮生长因子(vegf)抗体已被美国fda批准用于治疗转移性肿瘤,但其引起它血管生长因子代偿性增加以及抗体耐药性等缺陷导致该方法虽短期内有一定作用但长期疗效有限。因此,研发一种能够特异、多靶点的针对肿瘤血管新生并且安全、有效的新方法将对肿瘤治疗领域起革命性的推动作用。mirna是一类非编码小rna,其通过在转录后调控mrna的翻译过程及稳定性从而参与多种细胞进程的调控。如,细胞发育、稳态、增殖分化、代谢和凋亡等。研究显示,将dicer(mirna生物合成中所必须的一种酶)在内皮细胞中敲除后,导致血管生成障碍及内皮功能异常,而对特定mirna在血管新生中的功能研究,将对肿瘤等病理性血管新生相关疾病的治疗提供新的途径。mirna302-367簇位于larp7基因8号内含子中,在胚胎干细胞中具有高表达,并在胚胎干细胞的自我更新及体细胞重编程中起关键作用,但其在血管新生中的作用以及血管新生靶向的抗肿瘤治疗中的作用尚未见报道。因此,本领域迫切需要开发一种能够抑制肿瘤细胞血管新生,并抑制肿瘤生长,从而治疗肿瘤的方法。技术实现要素:本发明提供了一种能够抑制视网膜血管新生和肿瘤细胞血管新生,并抑制肿瘤生长,从而治疗肿瘤及视网膜血管新生相关疾病的方法。本发明第一方面提供了一种活性成分的用途,所述的活性成分选自下组:(a)mirna302-367簇的微小rna,其中,所述mirna302-367簇的微小rna选自下组:(a1)mirna302类微小rna,所述的mirna302类微小rna选自下组g1:mirna302a、mirna302a*、mirna302b、mirna302b*、mirna302c、mirna302c*、mirna302d、或其组合;(a2)mirna367类微小rna,所述的mirna367类微小rna选自下组g2:mirna367、mirna367*、或其组合;(a3)经修饰的mirna302类微小rna衍生物;或核心序列1为5’aagugcu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaagugcuuccauguuuu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;(a4)经修饰的mirna367类微小rna;或核心序列1为5’aauugca3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaauugcacuuuagcaa3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;(b)前体mirna,所述的前体mirna能在宿主内加工成(a)中所述的mirna302-367簇的微小rna;(c)多核苷酸,所述的多核苷酸能被宿主转录形成(b)中所述的前体mirna,并加工形成(a)中所述的微小rna;(d)表达载体,所述表达载体含有(a)中所述的mirna302-367簇的微小rna、或(b)中所述的前体mirna、或(c)中所述的多核苷酸;(e)(a)中所述的微小rna的激动剂;其中,所述的活性成分用于:(i)制备抑制血管新生的药物组合物;(ii)制备治疗肿瘤的药物组合物;和/或(iii)制备治疗视网膜血管增生和通透性增高相关疾病的药物组合物。在另一优选例中,(a3)中所述的核心序列指mirna302类微小rna的第2-8位或第1-17位的核苷酸序列;和/或所述的“功能与mirna302类微小rna相同或基本相同”是指保留了mirna302类微小rna的≥40%,且≤500%的抑制血管新生的功能。在另一优选例中,(a4)中所述的核心序列指mirna367类微小rna的第2-8位或第1-17位的核苷酸序列;和/或所述的“功能与mirna367类微小rna相同或基本相同”是指保留了mirna367类微小rna的≥40%,且≤500%的抑制血管新生的功能。在另一优选例中,所述的mirna302-367簇的微小rna的序列为选自seqidno.:1-5中任一所示的序列。在另一优选例中,所述视网膜血管增生和通透性增高相关疾病选自下组:糖尿病眼病、或其组合。在另一优选例中,所述的药物组合物包括所述的活性成分和药学上可接受的载体。在另一优选例中,所述的血管新生包括肿瘤血管新生。在另一优选例中,所述血管新生还包括视网膜血管新生。在另一优选例中,所述药物组合物还用于稳定血管通透性。在另一优选例中,所述药物组合物还包括其他的抑制血管新生(如肿瘤血管新生)的药物和/或肿瘤治疗剂(如化疗药、靶向药物、抗体药物等)。在另一优选例中,所述其他的抑制血管新生的药物选自下组:血管内皮生长因子单克隆抗体。在另一优选例中,所述其他的抑制血管新生(如肿瘤血管新生)的药物选自下组:内皮抑素。在另一优选例中,在所述药物组合物中,所述的mirna302-367簇的微小rna为纳米药物颗粒。在另一优选例中,所述的纳米药物颗粒为实心的或空心的。在另一优选例中,所述的纳米药物颗粒具有位于外部的包裹层,以及被所述包裹层包裹的、位于内部的所述mirna302-367簇的微小rna。在另一优选例中,所述药物组合物包括具体成分为rgd-肽(rgd-peptide)的fe3o4磁性纳米颗粒、以及包裹在纳米材料内部的mirna302-367簇的微小rna。在另一优选例中,所述的fe3o4磁性纳米颗粒具有位于外部连接或吸附靶向分子-rgdpeptide和cy5.5的包裹层,以及包裹层包裹的位于内部的mirna302-367簇的微小rna。在另一优选例中,所述纳米药物颗粒包括纳米mirna颗粒。在另一优选例中,所述的包裹层连接有或吸附有靶向分子。在另一优选例中,所述的包裹层还连接有或吸附有荧光检测分子。在另一优选例中,所述的靶向分子针对肿瘤细胞特异性的细胞表面受体或标志物(如整合素、her2、egfr)。在另一优选例中,所述的靶向分子针对肿瘤血管内皮细胞特异性的细胞表面受体或标志物(如rgd-peptide、整合素、egfr)。在另一优选例中,所述的靶向分子选自下组:rgd。在另一优选例中,所述的纳米药物颗粒为靶向型纳米药物颗粒。在另一优选例中,所述的纳米药物颗粒为特异性靶向于肿瘤细胞的纳米药物颗粒。在另一优选例中,所述的纳米药物颗粒为特异性靶向于血管内皮细胞的纳米药物颗粒。在另一优选例中,所述的纳米的尺寸为0.1-999nm,较佳地,0.1-100nm(如直径)。在另一优选例中,所述的mirna302-367簇的微小rna还用于抑制肿瘤生长。在另一优选例中,所述的mirna302-367簇的微小rna包括分离的或人工合成的。在另一优选例中,所述的经修饰的mirna衍生物,其修饰选自下组的一种或多种修饰形式:核苷酸的糖基修饰、核苷酸之间连接方式的修饰、胆固醇修饰、锁核苷酸修饰、肽段修饰、脂类修饰、卤素修饰、烃基修饰、和核酸修饰。在另一优选例中,所述的核苷酸的糖基修饰包括2-o-甲基的糖基修饰、2-o-甲氧乙酯的糖基修饰、2-o-烷基的糖基修饰、2-氟代的糖基修饰、糖环修饰、锁核苷酸修饰;和/或所述的核苷酸之间连接方式的修饰包括硫代磷酸修饰、磷酸烷基化修饰;和/或所述的核酸修饰包括“tt”修饰。在另一优选例中,(a)中所述经修饰的mirna衍生物是具有式i所示结构的化合物单体或其多聚体:(x)n-(y)m式i,在式i中,各x为(a)中所述的微小rna;各y独立地为促进微小rna施药稳定性的修饰物;y连接于x的左侧、右侧或中间;n为1-100的(较佳地1-20)正整数(较佳地n为1、2、3、4或5);m为1-1000的(较佳地1-200)正整数;各“-”表示接头、化学键、或共价键。在另一优选例中,所述的接头是长度为1-10个碱基的核酸序列。在另一优选例中,所述的y包括(但不限于)胆固醇、类固醇、甾醇、醇、有机酸、脂肪酸、酯、单糖、多糖、氨基酸、多肽、单核苷酸、多核苷酸。在另一优选例中,(c)中所述的多核苷酸具有式ii所示的结构:seq正向-x-seq反向式ii,式ii中,seq正向为能在宿主中被加工成所述的微小rna核苷酸序列;seq反向为与seq正向基本上互补或完全互补的核苷酸序列;x为位于seq正向和seq反向之间的间隔序列,并且所述间隔序列与seq正向和seq反向不互补;并且式ii所示的结构在转入宿主细胞后,形成式iii所示的二级结构:式iii中,seq正向、seq反向和x的定义如上述,||表示在seq正向和seq反向之间形成的碱基互补配对关系。在另一优选例中,(d)中所述的表达载体包括:病毒载体和非病毒载体。在另一优选例中,(e)中所述irna302-367簇的微小rna的激动剂选自下组:促进mirna302-367簇的微小rna表达的物质、提高mirna302-367簇的微小rna活性的物质、或其组合。在另一优选例中,所述的药学上可接受的载体选自下组:水、盐水、脂质体、脂质、蛋白、蛋白-抗体缀合物、肽类物质、纤维素、纳米凝胶、或其组合。本发明第二方面提供了一种药物组合物,所述的药物组合物包括:(i)第一活性成分,所述的活性成分选自下组:(a)mirna302-367簇的微小rna,其中,所述mirna302-367簇的微小rna选自下组:(a1)mirna302类微小rna,所述的mirna302类微小rna选自下组g1:mirna302a、mirna302a*、mirna302b、mirna302b*、mirna302c、mirna302c*、mirna302d、或其组合;(a2)mirna367类微小rna,所述的mirna367类微小rna选自下组g2:mirna367、mirna367*、或其组合;(a3)经修饰的mirna302类微小rna衍生物;或核心序列1为5’aagugcu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaagugcuuccauguuuu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;(a4)经修饰的mirna367类微小rna;或核心序列1为5’aauugca3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaauugcacuuuagcaa3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;(b)前体mirna,所述的前体mirna能在宿主内加工成(a)中所述的mirna302-367簇的微小rna;(c)多核苷酸,所述的多核苷酸能被宿主转录形成(b)中所述的前体mirna,并加工形成(a)中所述的微小rna;(d)表达载体,所述表达载体含有(a)中所述的mirna302-367簇的微小rna、或(b)中所述的前体mirna、或(c)中所述的多核苷酸;(e)(a)中所述的微小rna的激动剂;(ii)第二活性成分,所述第二活性成分为其他的抑制血管新生的药物;和(iii)药学上可接受的载体。本发明第三方面提供了一种筛选治疗肿瘤的候选化合物的方法,包括步骤:(a)将加入候选化合物的细胞培养体系作为实验组;将不加入候选化合物的细胞培养体系作为对照组,其中,所述的细胞为肿瘤细胞;和(b)测试实验组和对照组中肿瘤细胞内mirna302-367簇的表达活性;其中,当实验组中肿瘤细胞内mirna302-367簇的表达活性e1显著高于对照组e2,则表明该候选化合物为治疗肿瘤的物质。在另一优选例中,所述肿瘤细胞包括肿瘤血管内皮细胞。在另一优选例中,所述肿瘤细胞选自下组:小鼠lewis肺肿瘤细胞、bl6黑色素瘤细胞、或其组合。在另一优选例中,步骤(b)中还包括:进一步测试所获得化合物对实验组或对照组中肿瘤细胞生长的抑制作用。在另一优选例中,所述“显著高于”指e1/e2≥2,较佳地,≥3,更佳地,≥4。本发明第四方面提供了一种体外非治疗性的抑制血管新生和/或抑制肿瘤细胞生长的方法,包括步骤:向细胞培养体系中加入mirna302-367簇的微小rna,从而抑制血管新生;和/或抑制肿瘤细胞的生长。本发明第五方面提供了一种抑制血管新生、和/或抑制肿瘤细胞生长的方法,包括步骤:向需要的对象施用本发明第二方面所述的药物组合物,从而抑制血管新生、和/或抑制肿瘤细胞生长。在另一优选例中,所述对象为哺乳动物,较佳地,为人、小鼠、或大鼠。本发明第六方面提供了一种纳米药物颗粒,所述的纳米药物颗粒包括位于外部的包裹层,以及被所述包裹层包裹的、位于内部的第一活性成分;并且,所述的包裹层连接有或吸附有靶向分子,其中,所述的第一活性成分选自下组:(a)mirna302-367簇的微小rna,其中,所述mirna302-367簇的微小rna选自下组:(a1)mirna302类微小rna,所述的mirna302类微小rna选自下组g1:mirna302a、mirna302a*、mirna302b、mirna302b*、mirna302c、mirna302c*、mirna302d、或其组合;(a2)mirna367类微小rna,所述的mirna367类微小rna选自下组g2:mirna367、mirna367*、或其组合;(a3)经修饰的mirna302类微小rna衍生物;或核心序列1为5’aagugcu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaagugcuuccauguuuu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;(a4)经修饰的mirna367类微小rna;或核心序列1为5’aauugca3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaauugcacuuuagcaa3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;(b)前体mirna,所述的前体mirna能在宿主内加工成(a)中所述的mirna302-367簇的微小rna;(c)多核苷酸,所述的多核苷酸能被宿主转录形成(b)中所述的前体mirna,并加工形成(a)中所述的微小rna;(d)表达载体,所述表达载体含有(a)中所述的mirna302-367簇的微小rna、或(b)中所述的前体mirna、或(c)中所述的多核苷酸;和/或(e)(a)中所述的微小rna的激动剂。在另一优选例中,所述的靶向分子针对肿瘤细胞特异性的细胞表面受体或标志物(如整合素、her2、egfr)。在另一优选例中,所述的包裹层还连接有或吸附有荧光检测分子。在另一优选例中,所述荧光检测分子包括cy5.5。在另一优选例中,所述的靶向分子选自下组:rgd。在另一优选例中,所述的纳米药物颗粒为靶向型纳米药物颗粒。在另一优选例中,所述的纳米药物颗粒为特异性靶向于肿瘤细胞的纳米药物颗粒。在另一优选例中,所述的纳米药物颗粒为特异性靶向于血管内皮细胞的纳米药物颗粒。在另一优选例中,所述的纳米药物颗粒是分离的或纯化的。本发明第七方面提供了一种药物组合物,所述的药物组合物包括:药学上可接受的载体以及本发明第六方面所述的纳米药物颗粒。本发明第八方面提供了一种本发明第六方面所述的纳米药物颗粒的用途,用于制备(i)抑制血管新生的药物组合物;(ii)治疗肿瘤的药物组合物;(iii)抑制肿瘤生长的药物组合物;和/或(iv)治疗视网膜血管增生和通透性增高相关疾病的药物组合物。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1,(a)显示了mirna302-367簇在肿瘤组织中表达明显低于正常组织;(b)显示了在将huvecs与llcs共培养之后,mirna302-367簇明显表达下降;(c-d)显示了病毒转染效率表明mirna302-367簇确实在内皮细胞过表达成功;(e-i)显示了在mirna302-367簇过表达组,内皮细胞迁移能力明显受到抑制;(m-p)显示了mirna302-367簇能直接作用于erk1/2,并调控其下游靶分子。图2,(a-b)显示了实验小鼠构建模式图及qpcr结果验证了动物模型构建成功;(c-f)显示了mir302-367内皮特异过表达新生小鼠视网膜的血管长度、分支和出芽较正常对照明显减少,血管新生能力明显下降;(g-h)显示了mir302-367簇内皮特异过表达的小鼠主动脉环内皮出芽明显减少;(i-j)显示了mir302-367簇内皮特异过表达的小鼠肺中渗出伊文思蓝(evansblue)较对照组明显减少,表明内皮mir302-367簇能够降低血管通透性,增强血管稳态。图3,(a-i)显示了mirna302-367簇肿瘤血管内皮细胞高表达组能显著减少肿瘤血管新生,肿瘤明显减小,通透性明显增加。图4,(a-b)显示了通过免疫荧光及qpcr方法,rgd介导的mirna302-367簇能特异性进入肿瘤血管内皮细胞,并实现高表达mirna302-367簇;(c-g)显示了通过rgd介导进入肿瘤血管内皮之后,mirna302-367簇模拟物能通过抑制血管新生从而实现抑制肿瘤生长。具体实施方式本发明人经过广泛而深入的研究,首次意外地发现,mirna302-367簇的微小rna能够抑制肿瘤和视网膜血管新生,并可抑制肿瘤细胞的生长,从而达到拮抗肿瘤生长和治疗视网膜血管增生疾病(如糖尿病眼病)的效果,此外,本发明的实验还证明,mirna302-367簇的微小rna还可形成一种纳米药物颗粒,所述的纳米药物颗粒包括位于外部的包裹层,以及被所述包裹层包裹的、位于内部的第一活性成分;并且,所述的包裹层连接有或吸附有靶向分子,本发明的纳米药物颗粒可有效的抑制肿瘤细胞的血管新生,抑制肿瘤细胞的增殖,拮抗肿瘤生长;本发明的纳米药物颗粒还可抑制视网膜血管新生,可用于治疗视网膜血管增生疾病。在此基础上,完成了本发明。血管新生相关疾病含有本发明的活性成分的药物组合物,对血管新生有显著的抑制活性。血管新生为一极其复杂的过程,其包括了现存血管的扩张、血管通透性的增加、血管周围基质的降解、内皮细胞的激活增殖、迁移以及新的毛细血管样管腔的形成。血管新生在创伤愈合以及多种疾病的发生中均起到关键作用。在本发明中,所述血管新生相关疾病没有特别限制,包括本领域中已知的各种与血管新生相关的疾病。代表性的、与血管新生相关的疾病例子包括(但并不限于):新生血管性眼病、肿瘤、缺血性心脏病、非炎症性心肌病、冠状动脉硬化、闭塞性动脉硬化、动脉栓塞、动脉血栓、berger’s病、慢性炎症、炎症性肠病、溃疡、风湿性关节炎、硬皮症、银屑病、不育症或肉瘤状病等。经动物试验证实,本发明的活性成分不仅可以抑制肿瘤的血管新生,还可抑制肿瘤的生长,有优异的抗肿瘤特性。此外,在肿瘤和自身免疫疾病治疗方面,越来越多的研究表明,血管新生在肿瘤和自身免疫疾病如银屑病、风湿性关节炎的发生和预后中起到主导作用,也有很多研究证实,抑制血管新生是一种行之有效的对抗肿瘤或改善自身免疫疾病症状的方法。血管内皮生长因子与血管新生血管内皮生长因子(vascularendothelialgrowthfactor,vegf)是新生血管形成过程中的一个主要介导因子,vegf基因经过转录水平的剪切至少可产生7种vegf变异体,其中vegf165(vegf-a,即原型vegf)是最常见、最主要的一种。其主要的生物学功能为:选择性增强血管内皮细胞有丝分裂,刺激血管内皮细胞增殖并促进血管形成;增强血管尤其是小血管的渗透性,使血浆蛋白等大分子(主要是纤维蛋白原)外渗沉积在血管外的基质中,为新生毛细血管网的建立提供营养。因此,科研人员针对vegf的抑制进行了很多研究。贝伐单抗(bevacizumab,即avastin)是一种重组抗人vegf单抗,它是第一个美国fda批准能运用于治疗转移性结肠癌患者的抗新生血管药物。玻璃体注射bevacizumab亦能有效抑制视网膜及脉络膜新生血管。另一种vegf抑制剂ranibizumab,是一种重组抗人vegf单抗片段。它是第一个被美国fda批准用于治疗眼部新生血管性黄斑变性的抗新生血管类药物。目前,人们仍在不断寻找新的更加安全有效的治疗眼部新生血管的药物。mirna302-367簇mirna302簇是细胞内源性的一种非编码rna,suh等在2004年发现mirna302簇坐落于7号染色体八号内含子上,可以同时编码9种mirnas(可从公共数据库中获得相关信息),包括mirna302a、mirna302a*、mirna302b、mirna302b*、mirna302c、mirna302c*、mirna302d、mirna367和mirna367*,一般认为mirna302簇包括4种成熟的mirna302a/b/c/d和mirna367,共5种mirnas。mirna302簇主要表达在人胚胎干细胞(embryonicstemcell,esc)和鼠胚胎外胚层干细胞(embryonicepiblaststemcell,episc),由rna聚合酶ⅱ先转录成长1kb的初级mirna(pri-mirna),然后在核内被drosharna内切酶剪切成约60~80nt具有发卡结构的前体mirna(pre-mirna),被运输到核外,由dicer切去茎环,被加工为成熟双链mirna,rna介导的沉默复合物(rnainducedsilencingcomplex,risc)负责将配对mirna分开,利用这个单链mirna分子区识别、寻找特异的mrna进行抑制,调控mrna的表达。mirna-302a、b、c、d等mirna302簇和mirna367等,这些mirna含有6~8核苷酸组成的5’端高度保守的种子序列(见图1),具有相同或相似种子序列的mirna具有相同或相似的目标靶基因。代表性的mirna302-367簇(mirna302簇和mirna367)的具体序列如下:mirna302auaagugcuuccauguuuuggugaseqidno.:1mirna302buaagugcuuccauguuuuaguagseqidno.:2mirna302-367簇mirna302cuaagugcuuccauguuucaguggseqidno.:3mirna302duaagugcuuccauguuugaguguseqidno.:4mirna367uaauugcacuuuagcaauggugaseqidno.:5mirna及其前体微小rna(microrna,简称mirna)是近年来在线虫,果蝇和植物,哺乳动物等真核生物中发现的一种内源性的长度为22个核苷酸左右的非编码单链小rna。它在表达上具有组织和时间的特异性,通过与靶mrna的碱基互补配对而在转录后水平上对基因的表达进行负调控,导致mrna的降解或翻译抑制,是调节其他功能基因表达的重要调控分子。越来越多的证据表明mirna虽然微小,但它通过与靶mrna形成完全或者不完全互不配对从而对生物体的各种生命过程有着至关重要的作用。本发明提供了一类涉及通过抑制p110α蛋白从而治疗脂肪肝的mirna。如本文所用,所述的“mirna”是指一类rna分子,从可形成mirna前体的转录物加工而来。成熟的mirna通常具有18-26个核苷酸(nt)(更特别的约19-22nt),也不排除具有其它数目核苷酸的mirna分子。mirna通常可被northern印迹检测到。人来源的mirna可被从人细胞中分离。如本文所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多聚核苷酸和多肽是没有分离纯化的,但同样的多聚核苷酸或多肽如从天然状态中同存在的其他物质中分开,则为分离纯化的。mirna可从前体mirna(precursormirna,pre-mirna)加工而来,所述的前体mirna可折叠成一种稳定的茎环(发夹)结构,所述的茎环结构长度一般在50-100bp之间。所述的前体mirna可折叠成稳定的茎环结构,茎环结构的茎部两侧包含基本上互补的两条序列。所述的前体mirna可以是天然的或是人工合成的。前体mirna可被剪切生成mirna,所述的mirna可与编码基因的mrna的至少一部分序列基本上互补。如本文所用,“基本上互补”是指核苷酸的序列是足够互补的,可以以一种可预见的方式发生相互作用,如形成二级结构(如茎环结构)。通常,两条“基本上互补”的核苷酸序列互相之间至少有70%的核苷酸是互补的;优选的,至少有80%的核苷酸是互补的;更优选的,至少有90%的核苷酸是互补的;进一步优选的,至少有95%的核苷酸是互补的;如98%、99%或100%。一般地,两条足够互补的分子之间可以具有最多40个不匹配的核苷酸;优选的,具有最多30个不匹配的核苷酸;更优选的,具有最多20个不匹配的核苷酸;进一步优选的,具有最多10个不匹配的核苷酸,如具有1、2、3、4、5、8、11个不匹配的核苷酸。如本申请所用,“茎环”结构也被称作“发夹”结构,是指一种核苷酸分子,其可形成一种包括双链区域(茎部)的二级结构,所述的双链区域由该核苷酸分子的两个区域(位于同一分子上)形成,两个区域分列双链部分的两侧;其还包括至少一个“环”结构,包括非互补的核苷酸分子,即单链区域。即使该核苷酸分子的两个区域不是完全互补的,核苷酸的双链部分也可保持双链状态。例如,插入、缺失、取代等可导致一个小区域的不互补或该小区域自身形成茎环结构或其它形式的二级结构,然而,该两个区域仍可基本上互补,并在可预见的方式中发生相互作用,形成茎环结构的双链区域。茎环结构是本领域技术人员所熟知的,通常在获得了一条具有一级结构的核苷酸序列的核酸后,本领域技术人员能够确定该核酸是否能形成茎环结构。本发明所述的mirna是指:(a1)mirna302类微小rna,所述的mirna302类微小rna选自下组g1:mirna302a、mirna302a*、mirna302b、mirna302b*、mirna302c、mirna302c*、mirna302d、或其组合;(a2)mirna367类微小rna,所述的mirna367类微小rna选自下组g2:mirna367、mirna367*、或其组合;(a3)经修饰的mirna302类微小rna衍生物;或核心序列1为5’aagugcu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaagugcuuccauguuuu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;(a4)经修饰的mirna367类微小rna;或核心序列1为5’aauugca3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaauugcacuuuagcaa3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物。在另一优选例中,所述的微小rna来源于人或非人哺乳动物;较佳地所述的非人哺乳动物为大鼠、小鼠,鼠和人的mirna302-367簇的序列完全一致。所述的“功能与mirna302-367簇相同或基本相同”是指保留了mirna302-367簇的≥40%、≥50%、≥60%、≥70%、≥80%、≥90%的(a)抑制血管新生;(b)抑制肿瘤细胞生长;(c)治疗肿瘤的功能;和/或(d)治疗视网膜血管增生和通透性增高相关疾病。本发明还包括mirna变体和衍生物。此外,广义上的mirna衍生物也可包括mirna变体。本领域的普通技术人员可以使用通用的方法对mirna302-367簇进行修饰,修饰方式包括(但不限于):甲基化修饰、烃基修饰、糖基化修饰(如2-甲氧基-糖基修饰、烃基-糖基修饰、糖环修饰等)、核酸化修饰、肽段修饰、脂类修饰、卤素修饰、核酸修饰(如“tt”修饰)等。多核苷酸构建物根据本发明所提供的mirna序列,可设计出在被导入后可被加工成可影响相应的mrna表达的mirna的多核苷酸构建物,也即所述多核苷酸构建物能够在体内上调相应的mirna的量。因此,本发明提供了一种分离的多核苷酸(构建物),所述的多核苷酸(构建物)可被人细胞转录成前体mirna,所述的前体mirna可被人细胞剪切且表达成所述的mirna。作为本发明的一种优选方式,所述的多核苷酸构建物含有式ii所示的结构:seq正向-x-seq反向式ii式ii中,seq正向为可在细胞中表达成所述的mirna-27b的核苷酸序列,seq反向为与seq正向基本上互补的核苷酸序列;或者,seq反向为可在细胞中表达成所述的mirna的核苷酸序列,seq正向为与seq正向基本上互补的核苷酸序列;x为位于seq正向和seq反向之间的间隔序列,并且所述间隔序列与seq正向和seq反向不互补;式i所示的结构在转入细胞后,形成式iii所示的二级结构:式iii中,seq正向、seq反向和x的定义如上述;||表示在seq正向和seq反向之间形成的碱基互补配对关系。通常,所述的多核苷酸构建物位于表达载体上。因此,本发明还包括一种载体,它含有所述的mirna,或所述的多核苷酸构建物。所述的表达载体通常还含有启动子、复制起点和/或标记基因等。本领域的技术人员熟知的方法能用于构建本发明所需的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如卡拉霉素、庆大霉素、潮霉素、氨苄青霉素抗性。药物组合物及施用方法如本文所用,术语“活性成分”指的是可用于本发明的mirna302-367簇、mirna302-367簇衍生物或其前体序列、或含有其的表达载体。优选地,所述的活性成分选自下组:(a)mirna302-367簇的微小rna,其中,所述mirna302-367簇的微小rna选自下组:(a1)mirna302类微小rna,所述的mirna302类微小rna选自下组g1:mirna302a、mirna302a*、mirna302b、mirna302b*、mirna302c、mirna302c*、mirna302d、或其组合;(a2)mirna367类微小rna,所述的mirna367类微小rna选自下组g2:mirna367、mirna367*、或其组合;(a3)经修饰的mirna302类微小rna衍生物;或核心序列1为5’aagugcu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaagugcuuccauguuuu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;(a4)经修饰的mirna367类微小rna;或核心序列1为5’aauugca3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaauugcacuuuagcaa3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;(b)前体mirna,所述的前体mirna能在宿主内加工成(a)中所述的mirna302-367簇的微小rna;(c)多核苷酸,所述的多核苷酸能被宿主转录形成(b)中所述的前体mirna,并加工形成(a)中所述的微小rna;(d)表达载体,所述表达载体含有(a)中所述的mirna302-367簇的微小rna、或(b)中所述的前体mirna、或(c)中所述的多核苷酸;和/或(e)(a)中所述的微小rna的激动剂。如本文所用,术语“有效量”或“有效剂量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。如本文所用,术语“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。本发明的药物组合物含有安全有效量的本发明的活性成分以及药学上可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物的剂型为注射剂、口服制剂(片剂、胶囊、口服液)、透皮剂、缓释剂。例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。本发明所述的活性成分的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的活性成分的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。通常,当本发明的活性成分每天以约1-50μg/g动物体重(较佳的5-10μg/g动物体重)的剂量给予,能得到令人满意的效果。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。本发明所述的药学上可接受的载体包括(但不限于):水、盐水、脂质体、脂质、蛋白、蛋白-抗体缀合物、肽类物质、纤维素、纳米凝胶、或其组合。载体的选择应与给药方式相匹配,这些都是本领域的普通技术人员所熟知的。在本发明中mirna302-367簇可被用于制备抑制血管新生的药物组合物。例如,mirna302-367簇的衍生物或其激动剂可被用于制备一种药物组合物,所述组合物用于(a)抑制血管新生;(b)抑制肿瘤细胞生长;(c)治疗视网膜血管增生和通透性增高相关疾病;和/或(c)治疗肿瘤。此外,本发明药物组合物中还可以含有其他抑制血管新生(如肿瘤血管新生)的药物。例如,优选的其他抑制血管新生(如肿瘤血管新生)的药物包括内皮抑素等。纳米药物颗粒本发明还提供了一种纳米药物颗粒,包括:所述的纳米药物颗粒包括位于外部的包裹层,以及被所述包裹层包裹的、位于内部的第一活性成分;并且,所述的包裹层连接有或吸附有靶向分子,其中,所述的第一活性成分选自下组:(a)mirna302-367簇的微小rna,其中,所述mirna302-367簇的微小rna选自下组:(a1)mirna302类微小rna,所述的mirna302类微小rna选自下组g1:mirna302a、mirna302a*、mirna302b、mirna302b*、mirna302c、mirna302c*、mirna302d、或其组合;(a2)mirna367类微小rna,所述的mirna367类微小rna选自下组g2:mirna367、mirna367*、或其组合;(a3)经修饰的mirna302类微小rna衍生物;或核心序列1为5’aagugcu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaagugcuuccauguuuu3’、长度为18-26nt、功能与mirna302类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;(a4)经修饰的mirna367类微小rna;或核心序列1为5’aauugca3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;或核心序列2为5’uaauugcacuuuagcaa3’、长度为18-26nt、功能与mirna367类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;(b)前体mirna,所述的前体mirna能在宿主内加工成(a)中所述的mirna302-367簇的微小rna;(c)多核苷酸,所述的多核苷酸能被宿主转录形成(b)中所述的前体mirna,并加工形成(a)中所述的微小rna;(d)表达载体,所述表达载体含有(a)中所述的mirna302-367簇的微小rna、或(b)中所述的前体mirna、或(c)中所述的多核苷酸;和/或(e)(a)中所述的微小rna的激动剂。本发明的纳米药物颗粒用于制备(i)抑制血管新生的药物组合物;(ii)治疗肿瘤的药物组合物;(iii)抑制肿瘤生长的组合物;和/或(iv)治疗视网膜血管增生和通透性增高相关疾病的药物组合物。本发明的优点主要包括:(1)本发明首次提出,微小核糖核酸302-367簇(mirna302-367簇)可有效抑制肿瘤组织的血管新生,抑制肿瘤的生长,从而达到抗肿瘤的作用。(2)本发明首次提供一种纳米药物颗粒,通过rgd偶联纳米材料靶向新生血管内皮细胞能够将微小核糖核酸302-367簇特异募集到肿瘤内新生内皮细胞中,特异性抑制肿瘤内血管新生,抑制肿瘤生长。(3)本发明的微小核糖核酸302-367簇(mirna302-367簇)rgd偶联纳米材料具有分子量小,无免疫原性,制备简单,性质稳定,特异性高并针对血管内皮新生中多靶点产生作用,不易产生耐药性等诸多优势,具有十分可观的临床应用前景。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。在本发明中,如果没有特殊说明,实施例中所用的材料均为市售产品。实施例1构建mir302-367簇过表达的人脐静脉内皮细胞(huvecs)稳转株,体外检测其对内皮细胞血管新生的作用1.1人脐静脉内皮细胞(huvecs)(购自美国promocell生物公司)与鼠源性肺腺癌细胞(llc1)(购自美国atcc公司)共培养实验:将huvecs与lcc1以1:5的比例分别铺于transwell小室与下层6孔板中,共培养24小时后抽提细胞rna,qpcr检测mir302-367簇的表达情况。结果显示,huvecs中mir302-367表达较未与lcc1共培养组明显下降(图1a);1.2小鼠皮下荷瘤实验:将鼠源性肺腺癌细胞(llc1)以0.5×106个左右注入小鼠右侧腹部皮下组织,14天后取肿瘤并以正常小鼠肺组织作为对照,抽提rna后,qpcr检测mir302-367簇的表达情况(图1b)。结果显示,肿瘤组织中mir302-367的表达是下降的;1.3通过过表达mir302-367簇和对照慢病毒载体感染huvecs,构建稳定转染细胞株:将mirna302-367簇慢病毒质粒及对照慢病毒质粒,以及包装质粒pcmv.dr8,pmd2.g(addgene)通过x-tremegene9(roche)转染人胚肾(hek)293t细胞(购自美国atcc公司)。48小时后收集病毒上清,超离心浓缩后感染huvecs细胞。质粒带有绿色荧光蛋白,细胞成功感染后在荧光显微镜下可见绿色荧光(图1c),如图所示,细胞感染率超过90%。抽提细胞rna,qpcr检测显示,mir302-367过表达稳转株mir302-367簇表达量较正常细胞上升30-40倍以上(图1d);1.4内皮细胞血管新生作用研究:(i)“划痕”实验检测细胞迁移功能:将等量上述huvecs细胞铺于12孔版中,贴壁增殖至90%汇合度,细胞使用低血清的dmem培养以减少增殖,用200μl枪头进行“划痕”。并于0,12,24小时时间点进行拍照、测量“划痕”面积情况(图1,e,f)。如图所示,mir302-367簇过表达huvecs“划痕”面积较正常对照明显更大,细胞迁移能力较对照明显减弱;(ii)“transwell”小室实验检测细胞趋化能力:将上述huvecs铺于含有egm2的上层小室中,而在下层培养孔中加入含有vegf(1ng/μl)的egm2。培养4小时候,通过结晶紫染色并计数小室外层中穿过的huvecs细胞数量(图1g,h)。如图所示,mir302-367簇过表达huvecs细胞小室穿过数量较对照明显减少,趋化迁移能力减弱;(iii)小管形成实验:将上述的等量huvecs铺于预先包被有matrigel的96孔板中,于培养箱中孵育4小时后。倒置显微镜成像拍照,统计小管形成的分叉数量及小管总长度(图1i,j)。结果显示,mir302-367簇过表达huvecs细胞形成小管交叉点数量及总管长度较对照明显减少;(iv)fibringelbeads实验检测细胞出芽式血管新生能力:将上述的huvecs与cytodex3微粒(amershampharmaciabiotech)相互混合,孵育过夜后用纤维蛋白原重悬,加入抑酶肽和凝血酶铺于24孔版中以凝结。上层铺成纤维细胞作为滋养层,并隔天换培养液。7天后拍照观察并定量微粒表面血管内皮细胞出芽、迁移细胞数量(图1,k,l)。结果显示,过表达mir302-367能够使huvecs出芽及迁移明显减少。1.5mir302对内皮细胞血管新生作用的机制及下游信号通路研究:(i)荧光素酶报告基因检测:通过序列比对发现mir302-367与erk1/2的mrna3’-utr区序列相匹配,将包含有mir302-367结合位点的erk1/2的3’-utr区片段插入pmir-report载体质粒。通过pcr点突变技术对erk1/2mir302-307结合位点进行点突变,并通过dna测序验证。将质粒转染后48小时进行荧光素酶报告基因检测(图1m,n),结果显示,mir302-367能够抑制erk1/2荧光素酶报告基因表达,而对结合位点突变的erk1/2没有影响,证实erk1/2是mirna302-367的直接下游靶基因;(ii)通过对上述实施例1.3所述细胞进行qpcr及westernblot检测发现,mir302-367过表达细胞中p-erk1/2,t-erk1/2表达下降,而与内皮细胞出芽增殖和内皮细胞稳态密切相关的klf2,s1pr1,ve-cadherin表达上升(图1,o,p)。实施例2构建血管内皮细胞mir302-367簇特异性过表达的转基因小鼠,体内检测其对视网膜血管内皮细胞血管新生及血管稳态的作用2.1构建血管内皮细胞mir302-367簇特异性高表达的转基因小鼠:将r26r-mir302-367tg/+品系敲入小鼠(获自edwardmorrisey实验室1)与内皮特异性(ve-cadherin(cdh5))他莫昔芬诱导性cre重组酶表达小鼠cdh5(pac)-creert2(获自ralfadams实验室2)进行杂交,得到他莫昔芬诱导性mir302-367内皮特异性转基因小鼠r26r-mir302-367tg/+;cdh5(pac)-creert2小鼠(图2a);通过qpcr证实该小鼠肺、肺内皮细胞mir302-367表达明显增加(图2b);2.2新生小鼠视网膜血管网染色检测小鼠血管新生:通过ib4血管染色观察出生后6天上述实例2.1中的tamoxifen诱导后mir302-367簇内皮特异过表达小鼠视网膜血管新生情况,计数血管网长度、分支以及出芽数量,在体定量检测血管新生情况(图2,c-f)。结果显示,mir302-367簇内皮特异过表达新生小鼠视网膜血管长度、分支和出芽较正常对照明显减少,血管新生能力明显下降。2.3小鼠主动脉环离体培养实验:无菌分离上述实例2.1中的小鼠主动脉,横向剪成0.5mm左右主动脉环,接种于i型胶原中,并使用含有胎牛血清及vegf(30ng/ml)的opti-mem(gibco)进行培养。各组拍照并选取3个内皮出芽前端位置进行统计(图2,g,h)。结果显示,结果显示mir302-367簇内皮特异过表达小鼠主动脉环内皮出芽明显减少;2.4miles实验检测肺血管通透性改变:将上述实例2.1中的小鼠,伊文思蓝(evansblue)(10mg/ml)通过尾静脉注射30分钟后,处死通过心脏灌流柠檬酸缓冲液(ph4)以清除血管中的evansblue。取肺组织,称重、拍照,并用甲酰胺洗提出组织中渗出的evansblue,通过分光光度记检测吸光度(图2i,j)。结果显示,mir302-367簇内皮特异过表达小鼠肺中渗出evansblue较对照组明显减少,表明内皮mir302-367簇能够降低血管通透性,增强血管稳态。结果表明,mir302-367簇通过erk1/2-klf2-s1pr1-vecadherin通路抑制离体内皮细胞(invitro),半整体主动脉环(exvivo)和整体(invivo)视网膜血管出芽新生,稳定血管通透性,可进一步用于治疗病理性血管新生疾病(如糖尿病视网膜血管增生性眼病等相关疾病)。实施例3mir302-367簇抑制肿瘤内血管新生作用以及抑制肿瘤生长作用3.1小鼠皮下荷瘤实验:将鼠源性肺腺癌细胞(llc1)以0.5×106个左右注入上述实例2.1所述小鼠及对照小鼠右侧腹部皮下组织,14天后取肿瘤进行拍照、测量、称重(图3a,b),结果显示,mir302-367簇内皮特异过表达小鼠肿瘤体积及重量较对照组明显减少;qpcr结果证实,mir302-367簇内皮特异过表达小鼠移植肿瘤内mir302-367簇较对照组明显升高(图3c);表明内皮细胞特异性过表达mir302-367簇对肿瘤生长具明显抑制作用;3.2肿瘤血管成像及染色:通过ib4血管染色检测上述3.1中小鼠肿瘤组织中血管密度(图3d,e)并计数定量;通过双光子活体成像技术活体肿瘤内血管成像并计数血管分支数量(图3f,g)。结果显示,mir302-367簇内皮特异过表达小鼠移植肿瘤内血管密度及分支密度较正常对照明显减少1.,表明mir302-367簇具有抑制肿瘤血管新生作用;3.3检测血管通透性miles实验检测肿瘤血管通透性改变:将上述实例3.1中的小鼠,evansblue(10mg/ml)通过尾静脉注射30分钟后,处死通过心脏灌流柠檬酸缓冲液(ph4)以清除血管中的evansblue。取肿瘤组织,称重、拍照,并用甲酰胺洗提出组织中渗出的evansblue,通过分光光度记检测吸光度(图3h,i)。结果显示,mir302-367簇内皮特异过表达小鼠肿瘤中渗出evansblue较对照组明显减少,表明内皮mir302-367簇能够降低血管通透性,增强血管稳态。实施例4利用带有rgd-肽(rgd-peptide)的磁性纳米材料包被的微小核糖核酸302-367簇将微小核糖核酸302-367簇靶向导入肿瘤内增殖期血管内皮细胞抑制肿瘤内血管新生及肿瘤生长4.1构建带有rgd-peptide和cy5.5荧光标记的特异靶向内皮细胞的纳米颗粒,该rgd-纳米颗粒以fe3o4为核心,之后将cy5.5(一种红色荧光标记物)通过化学连接方法接在在fe3o4之上,再在此基础上将rgd(一种氨基酸三肽合成物)链接在cy5.5之上,该纳米颗粒能够通过精氨酸-谷氨酸-天冬氨酸(rgd)特异靶向肿瘤内高表达α(v)β(3)整合素的增殖期内皮细胞。将rgd-nanoparticle分别包被于各mir302-367簇的人工合成类似物(mimics)。同上述3.1所述方法对c57bl/6品系小鼠(购自上海南方模式动物公司)构建皮下合瘤模型,将包被有rgd-纳米颗粒(rgd-nanoparticle)的mir302-367类似物(mimics)在埋瘤后6,8,10天通过尾静脉注射给药,14天后进行取样4.2免疫荧光染色验证rgd-nanoparticle特异靶向肿瘤组织中内皮细胞:通过对上述实例4.1中取得的肿瘤组织免疫荧光染色标记内皮细胞特异标记ve-cadherin(绿色)以及cy5.5(红色)纳米颗粒荧光信号,结果显示,带有rgd的nanoparticle能够与ve-cadherin共标,证实rgd-nanoparticle能够特异靶向增殖的血管内皮细胞(图4a);4.3通过磁珠分选获取上述4.1中肿瘤组织的血管内皮细胞,抽屉rna,qpcr检测mir302-367簇表达量(图4b),结果显示,给予rgd-nanoparticle包被的mir302-367簇模拟物组肿瘤内皮细胞中mir302-367簇表达明显升高,说明rgd-n纳米颗粒能够将mir302-367模拟物靶向导入肿瘤内皮细胞中。4.4肿瘤血管染色:通过ib4血管染色检测上述4.1中小鼠肿瘤组织中血管密度并计数定量(图4e,g);结果显示,给予rgd纳米颗粒包被的mir302-367mimics组小鼠移植肿瘤内血管密度及分支密度较对照明显减少,表明该制剂具有抑制肿瘤血管新生作用;4.5对上述实例4.1肿瘤组织取样、拍照、测量、称重(图4c,d,f),结果显示,给予rgd纳米颗粒包被的mir302-367mimics肿瘤生长明显减缓,说明该制剂具有有效的抗肿瘤作用。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。参考文献1.tiany,liuy,wangt,zhoun,kongj,chenl,snitowm,morleym,lid,petrenkon,zhous,lum,gaoe,kochwj,stewartkm,morriseyee.amicrorna-hippopathwaythatpromotescardiomyocyteproliferationandcardiacregenerationinmice.scitranslmed.2015;7:279ra238.2.pitulescume,schmidti,beneditor,adamsrh.induciblegenetargetingintheneonatalvasculatureandanalysisofretinalangiogenesisinmice.natureprotocols.2010;5:1518-1534.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法