一种酚苷类化合物在抗肿瘤药物中的应用的制作方法
本发明属于生物医药领域,具体涉及一种酚苷类化合物在抗肿瘤药物中的应用。
背景技术:
肿瘤是严重威胁人类健康乃至生命的疾病之一,肿瘤死亡率高举全世界第一或第二位,极大威胁着人类的生存与健康。肿瘤治疗一直是医学界面临的难题,手术、化学疗法和放射性疗法是通常的治疗方法。而大多数现有的治疗方法会有很严重的副作用,如出血,认知障碍,多发等,这主要是和非选择性的细胞毒性有关。科学家们一直致力于寻找新型、高效、低毒的抗肿瘤药物,寻找毒副作用小、具有选择杀伤性的新型抗癌药物一直是全世界科学工作者主要研究目标之一。天然产品,包括植物、海洋生物和微生物等一直吸引了许多科学家的关注。目前,由于肿瘤多重耐药性日益严重,从天然资源中筛选和开发新型抗肿瘤药物的意义显得尤为突出。
3,4-二羟苯基-o-β-d-吡喃葡萄糖苷是从绞股蓝(gynostemmapentaphyliummakino)中首次分离得到的一种酚苷类化合物(分子式为c12h16o8,分子量为288.26)。1999年,l.verotta等人首次从南非地区木本植物山龙眼属的10个品种的叶子中分离得到3,4-二羟苯基-o-β-d-吡喃葡萄糖苷(verottal.,orsinif.,pelizzonif.,etal.polyphenolicglycosidesfromafricanproteaceae[j].journalofnaturalproducts,1999,62(11):1526-1531)。查阅国内外文献得知,3,4-二羟苯基-o-β-d-吡喃葡萄糖苷在抗癌方面还未有过报道。
技术实现要素:
本发明的目的在于克服现有技术中临床上抗肿瘤药物的用药剂量高、药效不理想、缺乏选择性、产生耐药性以及抑制造血系统、消化系统、免疫系统、神经和内分泌系统的毒副作用等缺点和不足,提供一种酚苷类化合物在制备抗肿瘤药物中的应用。
本发明的目的通过下述方案实现:
一种酚苷类化合物在制备抗肿瘤药物中的应用,所述的酚苷类化合物为3,4-二羟苯基-o-β-d-吡喃葡萄糖苷,其结构式如式ⅰ:
所述抗肿瘤药物优选为抗乳腺癌药物和/或抗肺癌药物;
所述抗乳腺癌药物优选为抗人乳腺癌细胞mcf-7的药物;所述抗肺癌药物优选为为抗人肺癌细胞a549的药物。
所述酚苷类化合物3,4-二羟苯基-o-β-d-吡喃葡萄糖苷可作为新型的抗肿瘤药物。
一种抗肿瘤药物,含有上述酚苷类化合物。
本发明的原理:肿瘤细胞的本质特性是恶性增值,抑制肿瘤细胞增值、阻滞细胞周期和诱导细胞凋亡是遏制肿瘤生长的关键环节,本发明的酚苷类化合物能够较好的显著抑制癌肿瘤细胞的增殖且该酚苷类化合物的使用剂量低(25-800μg/ml),最大使用剂量为800μg/ml,在同样剂量下的毒副作用也较低,具有细胞选择性。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明发现酚苷类化合物3,4-二羟苯基-o-β-d-吡喃葡萄糖苷在体外能显著抑制癌肿瘤细胞的增殖;
(2)3,4-二羟苯基-o-β-d-吡喃葡萄糖苷的用药剂量低,而且在有效用药剂量范围内毒性较低。
附图说明
图1是实施例1制备的3,4-二羟苯基-o-β-d-吡喃葡萄糖苷对人正常肝细胞l-o2的毒性作用图;
图2是实施例1制备的3,4-二羟苯基-o-β-d-吡喃葡萄糖苷对人肺癌细胞a549的增殖抑制作用图;
图3是实施例1制备的3,4-二羟苯基-o-β-d-吡喃葡萄糖苷对人乳腺癌细胞mcf-7的增殖抑制作用图。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。实施例中,人正常肝细胞l-o2、人乳腺癌细胞mcf-7、人肺癌细胞a549购自中科院上海生命科学研究院细胞资源中心;dmem培养基购自于广州茂云生物科技有限公司;绞股蓝购于广州清平药材市场,产地为陕西。
化合物3,4-二羟苯基-o-β-d-吡喃葡萄糖苷从绞股蓝中制备得到。
实施例1从绞股蓝中制备3,4-二羟苯基-o-β-d-吡喃葡萄糖苷
(1)称取干燥的绞股蓝原料5kg,经粉碎过筛后按料液比1:15(g/ml),用体积分数为75%的乙醇加热回流提取3次,每次2h,真空抽滤,弃去残渣,合并浸提液,用旋转蒸发仪在温度45℃、真空度0.095mpa的条件下减压浓缩提取液至棕黑色膏状,得到绞股蓝乙醇粗提物浸膏;
(2)将步骤(1)的绞股蓝乙醇粗提物浸膏用蒸馏水充分溶解,转移至分液漏斗中,加入等体积的石油醚溶剂,充分震动混匀,静置1h,待两相溶剂完全分层后,取出上层的石油醚相;重复萃取三次,合并石油醚萃取液(石油醚相),用旋转蒸发仪在温度45℃、真空度0.075mpa的条件下减压浓缩蒸干,回收石油醚,浓缩后得到的黑色油状物即为石油醚相萃取物;将石油醚萃取后的下层水相溶液进行下一步操作;
(3)向步骤(2)中石油醚萃取后的下层水相溶液中加入等体积的乙酸乙酯溶剂,充分震动混匀,静置1h,待两相溶剂完全分层后,取出上层的乙酸乙酯相(即乙酸乙酯萃取液);重复萃取三次,合并乙酸乙酯萃取液,用旋转蒸发仪在温度45℃、真空度0.075mpa的条件下减压浓缩蒸干,回收乙酸乙酯,浓缩蒸干后得到的黑紫色浸膏即为乙酸乙酯相萃取物;
(4)将乙酸乙酯相萃取物经硅胶柱层析(100-200目硅胶,柱体积4升),用氯仿-甲醇系统洗脱,根据tlc摸索的分离条件设置8个梯度即8个不同体积比的氯仿与甲醇洗脱比例(氯仿:甲醇体积比:100:16、90:20、80:20、3:1、10:4、10:5、50:50和0:100);每个梯度洗脱5个柱体积,每1l收集一次;收集的馏分经减压浓缩之后用少量的甲醇溶解,转移到试管中,做好标记;用tlc对收集的馏分进行检测,合并相同的馏分,共得到8个组分,各组分依次标记为氯仿:甲醇100:16(组分1)、90:20(组分2)、80:20(组分3)、3:1(组分4)、10:4(组分5)、10:5(组分6)、50:50(组分7)和0:100(组分8)。其中组分2(氯仿甲醇比例为90:20)经过葡聚糖凝胶柱层析,用甲醇-水(体积比70:30)洗脱,然后用聚酰胺柱分离,甲醇-水(体积比40:60)洗脱,得到黄色粉末化合物1(20mg)。
实施例2确定化合物1的结构
称取20mg实施例1制备的化合物1,用0.5ml氘代dmso溶解后转移至核磁管中,以四甲基硅烷作为内标物,用brukerdrx-400核磁共振仪测定化合物1的氢谱(1h-nmr)和全区偶碳谱(13c-nmr)。
实施例1制备的化合物1为黄色粉末,以聚酰胺薄层层析(甲醇:水1:1)展开,呈现单一斑点,在254nm紫外光下有黄色荧光。esi-msm/z:311[m+na]+,289[m+h]+(推断出分子式为c12h16o8)。
1h-nmr(400mhz,dmso-d6):δh8.91(1h,s,oh),8.49(1h,s,oh),6.59(1h,d,j=8.5hz,h-5),6.47(1h,d,j=2.7hz,h-2),6.32(1h,dd,j=8.5,2.7hz,h-6),5.23(1h,d,j=4.4hz,oh),5.02(1h,d,j=5.1hz,oh),4.59(1h,d,j=7.5hz,h-1'),4.54(1h,s,oh),3.65(1h,dd,j=11.0,1.5hz,h-6'),3.45(1h,m,h-6'),3.17(4h,m,h-2',-3',-4',-5')。
13c-nmr(dmso-d6)δc150.8(d),145.6(s),140.3(s),115.5(d),106.8(d),105.4(d),101.8(d),76.9(d),76.7(d),73.4(d),69.8(d),60.8(t)。
化合物1的1h-nmr、13c-nmr数据与文献(polyphenolicglycosidesfromafricanproteaceae)报道的数据一致,因此鉴定化合物1为3,4-二羟苯基-o-β-d-吡喃葡萄糖苷。
实施例3mtt法检测3,4-二羟苯基-o-β-d-吡喃葡萄糖苷对l-o2细胞毒性的影响
用胰酶消化处于对数生长期的l-o2细胞,用含质量分数为10%胎牛血清的dmem培养基调整细胞数为3×104个/ml,每孔100μl接种于96孔细胞培养板中,置于5%co2培养箱中,37℃培养24h。待细胞完全贴壁之后,弃去上清液,各组分别加入含有3,4-二羟苯基-o-β-d-吡喃葡萄糖苷的dmem培养基(3,4-二羟苯基-o-β-d-吡喃葡萄糖苷终浓度分别为25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml和800μg/ml)。在37℃、5%co2培养箱中培养24h,倒置显微镜观察细胞形态的变化,然后弃去上清液,pbs清洗两次,每孔加入200μl不含血清的dmem培养基和20μl噻唑蓝(mtt),放入培养箱中孵育4h,弃去上清液,每孔加入150μl二甲基亚砜(dmso),避光放置于微量振荡器均匀震荡10min,用多功能酶联免疫检测仪测量在490nm波长下的od值,计算细胞生长活力。
mtt比色法测定3,4-二羟苯基-o-β-d-吡喃葡萄糖苷对l-o2正常细胞代谢活力的影响,测试结果如图1所示。图1是实施例1制备的3,4-二羟苯基-o-β-d-吡喃葡萄糖苷对人正常肝细胞l-o2的毒性作用图。(即3,4-二羟苯基-o-β-d-吡喃葡萄糖苷的浓度对正常肝细胞存活率的影响)。
从图中可知,在加药浓度为400μg/ml和800μg/ml时,3,4-二羟苯基-o-β-d-吡喃葡萄糖苷干预培养下的细胞存活率分别为89.99%和89.33%,可视为对l02细胞正常生长没有明显的毒副作用。因此,后续的实验设定各单体化合物的浓度为800、400、200、100、50、25μg/ml。
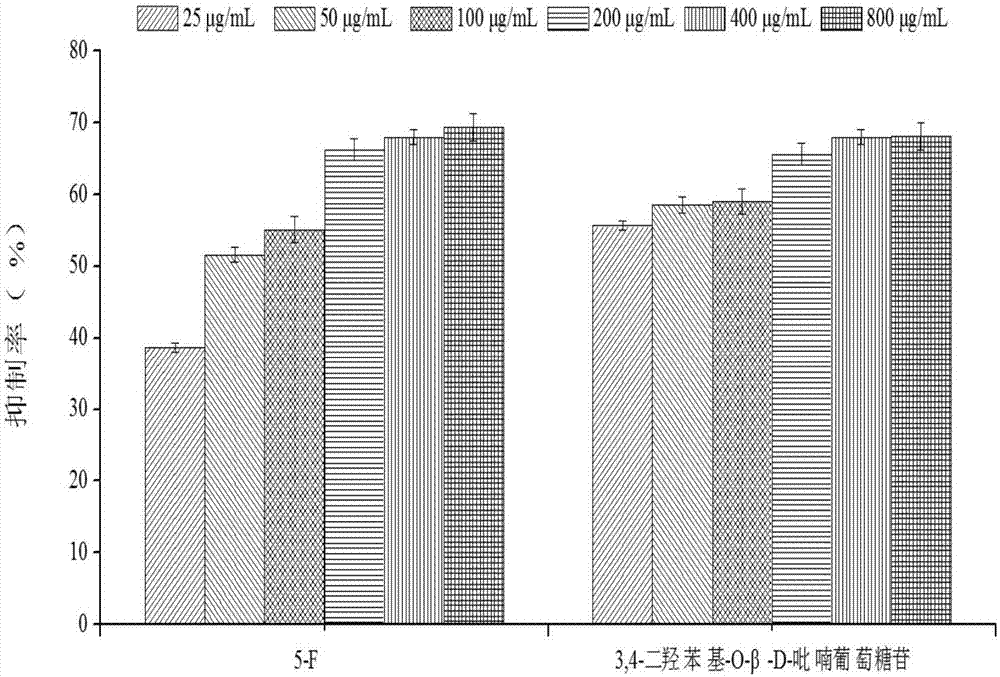
实施例43,4-二羟苯基-o-β-d-吡喃葡萄糖苷抑制人肺癌细胞a549增殖
用胰酶消化处于对数生长期的a549细胞,用含质量分数为10%胎牛血清的dmem培养基调整细胞数为3×104个/ml,每孔100μl接种于96孔细胞培养板中,置于5%co2培养箱中,37℃培养24h。待细胞完全贴壁之后,弃去上清液,分别加入100μl含有3,4-二羟苯基-o-β-d-吡喃葡萄糖苷的dmem培养基(3,4-二羟苯基-o-β-d-吡喃葡萄糖苷终浓度分别为25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml和800μg/ml),每组设置3个复孔,用完全培养基、5-氟尿嘧啶(5-f)代替样品溶液分别作为空白对照组和阳性对照组。在37℃、5%co2培养箱中培养24h,倒置显微镜观察细胞形态的变化,然后弃去上清液,pbs清洗两次,每孔加入200μl不含血清的dmem培养基和20μl噻唑蓝(mtt),放入培养箱中孵育4h,弃去上清液,每孔加入150μl二甲基亚砜(dmso),避光放置于微量振荡器均匀震荡10min,用多功能酶联免疫检测仪测量在490nm波长下的od值,计算细胞增殖抑制率。测试结果如图2所示。图2是实施例1制备的3,4-二羟苯基-o-β-d-吡喃葡萄糖苷对人肺癌细胞a549的增殖抑制作用图。
当浓度达到800μg/ml时,a549细胞增殖抑制率达到68.17%(ic506.99μg/ml)。3,4-二羟苯基-o-β-d-吡喃葡萄糖苷的抑制作用比较平稳,整体上效果和阳性对照相当(图2)。
实施例53,4-二羟苯基-o-β-d-吡喃葡萄糖苷抑制人乳腺癌细胞mcf-7增殖
用胰酶消化处于对数生长期的mcf-7细胞,用含质量分数为10%胎牛血清的dmem培养基调整细胞数为3×104个/ml,每孔100μl接种于96孔细胞培养板中,置于5%co2培养箱中,37℃培养24h。待细胞完全贴壁之后,弃去上清液,分别加入100μl含有3,4-二羟苯基-o-β-d-吡喃葡萄糖苷的dmem培养基(3,4-二羟苯基-o-β-d-吡喃葡萄糖苷终浓度分别为25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml和800μg/ml),每组设置3个复孔,用完全培养基、5-氟尿嘧啶(5-f)代替样品溶液分别作为空白对照组和阳性对照组。在37℃、5%co2培养箱中培养24h,倒置显微镜观察细胞形态的变化,然后弃去上清液,pbs清洗两次,每孔加入200μl不含血清的dmem培养基和20μl噻唑蓝(mtt),放入培养箱中孵育4h,弃去上清液,每孔加入150μl二甲基亚砜(dmso),避光放置于微量振荡器均匀震荡10min,用多功能酶联免疫检测仪测量在490nm波长下的od值,计算细胞增殖抑制率。测试结果如图3所示。图3是实施例1制备的3,4-二羟苯基-o-β-d-吡喃葡萄糖苷对人乳腺癌细胞mcf-7的增殖抑制作用图。
从图中可以看出,随着浓度的升高,3,4-二羟苯基-o-β-d-吡喃葡萄糖苷的抑制效果与阳性对照相当。当浓度达到800μg/ml时,mcf-7细胞增殖抑制率达到54.69%(ic50929.141μg/ml)(图3)。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!