一种PM2.5致肺损伤拮抗剂及其制备方法与流程
本发明涉及一种pm2.5致肺损伤拮抗剂及其制备方法,属于生物技术领域。
背景技术
近几年,随着我国经济的迅猛发展以及化石燃料的大面积使用,我们正在面临并遭受着严峻的考验—大气污染。其中包含pm2.5。pm2.5,又称细颗粒物,它是指一种直径小于或等于2.5μm的颗粒物。我国现在的pm2.5水平要比世界卫生组织推荐的正常值高出八倍,被认为是世界上pm2.5水平最高的国家之一。尤其是华北平原,频繁的雾霾天气给人民的生活和出行带来了深重的灾难。由于pm2.5粒子的尺寸,它可以进入到人类的肺部和血液中,给生物系统带来引起严重的影响,甚至会摧毁人类的健康。根据一些风险疾病的评估,雾霾已经成为东亚地区第四大高危风险,且已经导致了中国120万人死亡。流行性病学研究进一步指出长期暴露于室外的雾霾中尤其是pm2.5中还会增加罹患呼吸系统和心血管系统疾病的风险。因此寻找pm2.5拮抗剂具有重要的科学意义和应用价值。
长期以来,食用菌多糖因其独特的免疫调节作用而受到广泛关注。羊肚菌作为一种味道鲜美、营养丰富的珍稀食用菌,其醇提物和粗多糖具有抗肿瘤、护肝、抗氧化等活性。实验室前期从羊肚菌子实体中提取的多糖均一组分fmp-1具有很好的抗氧化活性,而对于拮抗pm2.5致肺损伤的活性还未见报道。此外,研究表明多糖的化学修饰可以通过引入新的化学基团提高自身的生物活性以及产生新的活性,常见的多糖化学修饰方法有多糖的硫酸化、羧甲基化、乙酰化、磷酸化以及烷基化等,通过适当的分子修饰获得高效的多糖基pm2.5拮抗剂也未见报道。
技术实现要素:
本发明的目的在于提供一种pm2.5致肺损伤拮抗剂及其制备方法,无任何毒副作用,且具有良好的抵抗pm2.5致肺泡巨噬细胞损伤作用,在医药及保健品等领域具有巨大的应用前景。
本发明pm2.5致肺损伤拮抗剂,为羊肚菌硫酸化多糖sfmp-1,分子量为9.0kda,硫酸根取代度为1.36,其单糖组成主要有甘露糖、葡萄糖和半乳糖,摩尔比为1:7.84:1.24。
本发明pm2.5致肺损伤拮抗剂的制备方法,包括如下步骤:
步骤1:取100mg干燥的羊肚菌多糖fmp-1置于洁净干燥的三颈烧瓶,加入甲酰胺5ml,25℃下水浴30min,随后加入200mgso3-py,70℃下油浴搅拌反应3h;
步骤2:用naoh溶液(4mol/l)调步骤1获得的反应液的ph值至中性,透析,所得透析液浓缩,加入四倍体积的95vt%乙醇,4℃下静置12h,离心,收集沉淀,所得沉淀经冷冻干燥得到羊肚菌硫酸化多糖sfmp-1。
步骤2中,所述透析是采用3500da透析袋,流水透析48h。
步骤2中,所述冷冻干燥的参数为:温度-50℃,气压0.1mbar,时间72h。
本发明pm2.5致肺损伤拮抗剂的表征,包括如下内容:
1、采用硫酸钡比浊法测定硫酸基团含量。配制1mol/l的hcl溶液200ml,称干燥至恒重的硫酸钾108.75mg,用配好的盐酸溶液定容至100ml,配制3%的三氯乙酸溶液250ml,配制bacl-明胶(1%:0.5%)溶液100ml及0.5%的明胶溶液100ml。按照表4-3的顺序加入各试剂,25℃下静置15min后360nm处测定吸光值ai。再以0.5%的明胶溶液代替bacl-明胶(1%:0.5%)溶液重复上述实验,在360nm处测定吸光值aj。以(ai-aj)对硫酸基团含量作标准曲线。配制1mg/ml的样品盐酸溶液,100℃水浴3h,按上述方法测360nm处的吸光值测得ai样品和aj样品,测定硫酸化多糖硫酸根含量,按照标准曲线和公式计算出硫酸根取代度。
2、准确配制2mg/ml标准葡聚糖t3,t7,t10,t50,t100,t-500,t-1000标准溶液,按以上条件进行实验。以保留时间t为横坐标,标准葡聚糖分子量的自然对数为纵坐标,绘制相对分子质量标准曲线。将所述的pm2.5致肺损伤拮抗剂的保留时间代入标准曲线方程,求出样品的平均分子量。
3、采用溴化钾压片法对羊肚菌子实体多糖fmp-1的红外光谱结构进行分析。称取适量预先干燥好的光谱纯溴化钾与少量多糖样品混合研磨,压制成薄片,在400~4000cm-1的频率范围内进行红外测定。
本发明pm2.5致肺损伤拮抗剂的活性检测,包括如下内容:
1、利用200μg/ml的pm2.5处理nr8383细胞4h建立起pm2.5损伤细胞模型,通过fmp-1、sfmp-1、cfmp-1和afmp-1的干预处理,比较相同浓度下(50,100和200μg/ml)不同多糖处理组的细胞存活率、细胞凋亡率发现这四种多糖均可以保护细胞拮抗pm2.5的损伤,其中sfmp-1的效果更加明显,在200μg/ml的浓度下可以将细胞存活率提高至82%;通过流式细胞仪结果的分析得出,经过四种多糖处理的细胞的凋亡率显著下降,且呈现浓度依赖性,尤其是200μg/ml的sfmp-1的凋亡率降低为8.06%,与空白对照组(6.74%)相差不大;
2、通过对细胞炎症因子tnf-α和il-1β释放量的检测发现,与其他三组多糖比较,sfmp-1降低pm2.5诱导的tnf-α和il-1β释放效果更加显著,并且呈现明显地浓度依赖性;
3、dcfh-da染色、流式细胞仪检测的结果显示了伴随着sfmp-1浓度的增加,pm2.5引起的细胞内ros的产生量也随之降低,在浓度达到200μg/ml时,ros产生量与空白对照相当。
与现有技术相比,本发明的有益效果体现在:
1、本发明成功得到硫酸化修饰的羊肚菌子实体多糖sfmp-1,步骤简单,效率高。
2、通过对pm2.5损伤的细胞模型的干预发现,sfmp-1可以有效提高损伤细胞模型的生存率;通过细胞凋亡和elisa实验发现,sfmp-1可以减少pm2.5造成的细胞凋亡,降低pm2.5诱导产生的细胞炎症因子tnf-α和il-1β水平,并且呈现浓度依赖性,帮助细胞提高抵抗pm2.5损伤能力;此外,细胞在sfmp-1的干预下,pm2.5引起的ros释放量明显降低,说明sfmp-1可以减弱pm2.5引起的氧化损伤。目前的文献查阅尚未发现天然多糖及其衍生物的相关活性报道,其在拮抗pm2.5致肺损伤方面具有广阔的应用前景。
附图说明
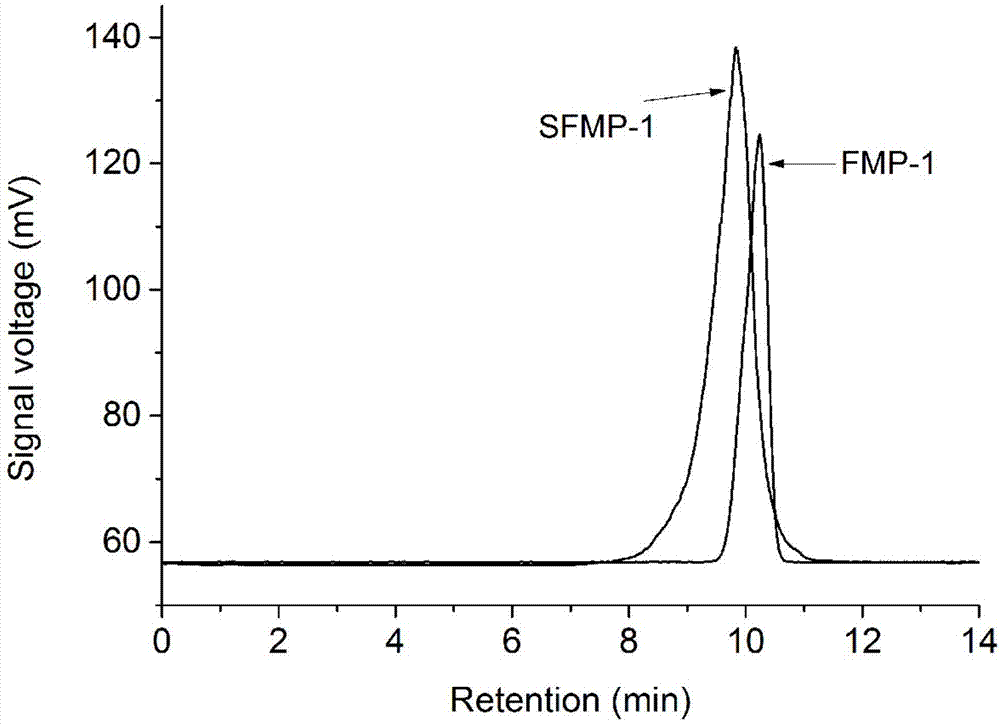
图1是羊肚菌多糖fmp-1和硫酸化修饰的羊肚菌多糖sfmp-1高效液相色谱(hplc)检测图。从图1中可以看出sfmp为纯品,保留时间为9.78min,根据多糖分子量标准曲线可以算出fmp的分子量为9.0×103da。
图2是fmp-1和硫酸化多糖sfmp-1红外光谱(ft-ir)检测图。从图2中可以看出红线代表的sfmp-1在1238cm-1和820cm-1处出现了两个新的硫酸根特征吸收峰,说明硫酸化修饰成功。
图3是不同多糖对pm2.5刺激的nr8383细胞保护作用。从图3中可以看出pm2.5处理的细胞的存活率明显降低,然而经过fmp-1、sfmp-1、cfmp-1和afmp-1干预的细胞的存活率升高,其中sfmp-1的效果优于其它三种多糖。
图4是不同多糖对pm2.5刺激的nr8383细胞凋亡的影响。从图4中可以看出,随着浓度的增加,四种多糖均表现出浓度依赖性地降低pm2.5引起的细胞凋亡,且sfmp-1的效果更加出色。
图5是不同多糖对pm2.5诱导的nr8383细胞内炎症因子tnf-α和il-1β释放的影响。图5显示了pm2.5可以促进tnf-α和il-1β的大量释放从而损伤细胞,由于多糖的干预,tnf-α和il-1β的释放量都降低了,且呈递减趋势。相比较fmp-1、cfmp-1和amfmp-1来说,sfmp-1可以更好地减少由于pm2.5造成的细胞因子tnf-α和il-1β的释放,进而达到更好的保护pm2.5造成的细胞损伤。
图6是sfmp-1对pm2.5诱导的细胞凋亡的影响。pm2.5促进了细胞的凋亡,当pm2.5浓度达到200μg/ml时细胞的凋亡率为22.65%,经过sfmp-1的处理可以极大地降低pm2.5造成的凋亡,同时这种作用呈现浓度依赖性降低。当sfmp-1的浓度为200μg/ml时细胞凋亡率降到最低,为8.06%。
图7是sfmp-1对pm2.5诱导的ros的产生量的影响。pm2.5诱导产生的ros的量(83.1%)远远高于空白组细胞,约是空白组ros产生量(18%)的5倍多。而经过sfmp-1的干预后,ros的产生量明显地减少了。当sfmp-1浓度达到200μg/ml,其ros产生量则降低为22.4%,几乎与空白组一致。
具体实施方式
下面通过具体的实施例对本发明进行详细说明,应当理解的是,这些具体实施方式仅用来帮助理解本发明,并非对本发明的实际保护范围构成任何形式的任何限定。
实施例1:
本实施例中pm2.5致肺损伤拮抗剂的制备方法如下:
1、取100mg干燥的羊肚菌多糖fmp-1置于洁净干燥的三颈烧瓶,加入甲酰胺5ml,25℃下水浴30min,随后加入200mgso3-py,70℃下油浴搅拌反应3h;
2、用4mol/l的naoh溶液调步骤1获得的反应液的ph值至中性,置于3500da透析袋中,流水透析48h,所得透析液浓缩,加入四倍体积的95vt%乙醇,4℃下静置12h,离心,收集沉淀,所得沉淀经冷冻干燥(温度-50℃,气压0.1mbar,时间72h)得到羊肚菌硫酸化多糖sfmp-1。sfmp-1的结果表征见图1(hplc检测图)和图2(红外光谱图)。
实施例2:拮抗pm2.5损伤、保护肺泡细胞巨噬细胞实验测试
1、nr8383细胞损伤模型的建立
等到细胞长到60~80%,将细胞悬液调整以1×105cells/孔的密度种至96孔板中,每孔加入50μl的培养基,培养24h;称取15mg的pm2.5样品,悬浮于3ml的pbs中,制成5mg/ml的pm2.5悬浮液,超声使其均匀分散,用灭菌锅进行120℃,1h灭菌处理,每次使用pm2.5样品之前超声分散10min;分别将pm2.5母液稀释成50,100,200,400,600,800μg/ml的浓度加入96孔板中培养4个小时;4个小时之后每孔再加入10μl浓度为5mg/ml的mtt溶液继续培养4h;4个小时之后每孔加入100μl的酸化异丙醇(sds、异丙醇、10mm盐酸)溶解mtt的产物,570nm波长下测量并记录其吸光值。选择细胞存活率达到50%时的pm2.5浓度建立pm2.5诱导的nr8383细胞损伤模型。
2、sfmp-1对pm2.5诱导的nr8383细胞损伤的保护作用的比较
将细胞密度调整至1×105cells/孔种入96孔板中,每孔加入50μl的细胞悬液;24个小时之后,将pm2.5母液5mg/ml稀释成200μg/ml加入到每孔中在细胞培养箱中培养4个小时;4个小时之后,sfmp-1的浓度50,100,200,400,600,800μg/ml,分别加入到每个孔中,每孔加50μl的多糖稀释液,继续相同条件培养24个小时;培养结束后,向每个孔中加入100μl的酸化异丙醇溶解甲瓒,避光震荡10min,以保证充分溶解。然后进行酶标仪570nm波长的检测。结果如图3。
3、sfmp-1对pm2.5引起的nr8383细胞的tnf-α、il-1β生物学活性的检测
将生长状况良好,存活率>95%的l929细胞用pbs洗涤两遍,加入胰酶37℃消化细胞2分钟;加入适量含有血清的培养基中止胰酶消化,1000rpm,5min离心收集细胞,倒掉上清除去胰酶;将一定密度细胞悬液加至96孔细胞培养板中;加入不同比例的il-1β和tnf-α标准品的稀释液,tnf-α的释液中加入1μg/ml的放线菌素d,同时收集上述步骤pm2.5和sfmp-1处理好的nr8383细胞的上清液,加入96孔板中,每孔100μl;5%co2、37℃培养箱继续培养4h;向96孔板中加入酸化异丙醇,室温震荡10min,酶标仪570nm波长检测吸光值。结果如图4和图5。
4、sfmp-1对pm2.5诱导的nr8383细胞凋亡的保护作用
同上述步骤分别用pm2.5和sfmp-1处理细胞后,收集并洗涤细胞,按照操作步骤,进行流式细胞仪检测。结果如图6。
5、sfmp-1对pm2.5损伤的nr8383细胞ros产生量的作用
待细胞长到一定密度收集细胞按照1×105个/孔种至六孔板中,37℃,5%co2的环境中培养24个小时。加入浓度为200μg/ml的pm2.5培养4个小时后再加入200μ/ml的sfmp-1培养24个小时。24个小时之后,用事先预冷好的pbs洗三遍,加入10μm的dcfh-da避光反应30min,上流式细胞仪波长488nm进行检测。结果如图7。
比较例1:
取干燥后的羊肚菌子实体,经热水浸提,醇沉除蛋白,透析(mw=3.5kda),冷冻干燥,得羊肚菌粗多糖。取纯度为90%以上的粗多糖,通过超滤膜(mw=5kda)超滤,superdex-75分子筛柱层析,经冷冻干燥得羊肚菌多糖均一组分fmp-1。其活性检测步骤同实施例2,结果见图3-5。
比较例2:
取100mg羊肚菌多糖fmp-1,加入10ml异丙醇,室温下磁力搅拌器搅拌30min,加入2ml2%naoh溶液,剧烈搅拌1h,随后加入30mg氯乙酸,60℃反应3h。冷却至室温,用冰乙酸将ph调至中性,去离子水透析三天,然后浓缩、冷冻干燥,得羧甲基化羊肚菌多糖cmfmp-1。其活性检测步骤同实施例2,结果见图3-5。
比较例3:
取100mg羊肚菌多糖fmp-1,加入10ml去离子水,室温下磁力搅拌器搅拌30min,加入2ml2%naoh溶液,剧烈搅拌1h,随后逐滴加入2ml乙酸酐,室温反应1h。调ph值至中性,去离子水透析三天,然后浓缩、冷冻干燥,得乙酰化羊肚菌多糖afmp-1。其活性检测步骤同实施例2,结果见图3-5。
- 还没有人留言评论。精彩留言会获得点赞!