用于检测靶微生物的制品和方法与流程
用于检测靶微生物的制品和方法相关申请的交叉引用本专利申请要求提交于2010年12月30日的美国临时专利申请No.61/428,722的权益,该专利申请以引用的方式完整并入本文。
背景技术:
测试全部食品、饮料和水的样品的病原微生物可能是不切实际的,原因在于花费高昂并且因为病原微生物极少存在于(例如)恰当加工的食品中。因此,针对指示微生物存在的测试例行用来测试食品和水,以确定遭人类病原体污染的可能性。一种或多种指示微生物的存在可能指示(例如)粪便污染,并且可以指示可能存在病原微生物。大肠杆菌(大肠菌)代表指示微生物的一个例子。大肠菌群包括多个属(如,柠檬酸杆菌属(Citrobacter)、肠杆菌属(Enterobacter)、埃希杆菌属(Escherichia)、哈夫尼菌属(Hafnia)、克雷白氏杆菌属(Klebsiella)和沙雷氏菌属(Serratia))的杆状革兰氏阴性菌,它们大量存在于温血动物的粪便中,并且通过它们将乳糖发酵为酸和气体副产物的能力来表征。虽然大多数大肠菌仅与人类中的机会性感染相关,但是一些大肠菌(如,大肠杆菌O157:H7或其他产生志贺毒素的大肠杆菌(STEC))与较高的发病率和死亡率相关。肠杆菌科(Enterobacteriaceae)的微生物成员代表指示微生物的另一个例子。除大肠杆菌外,该科还包括大量其他的杆状革兰氏阴性菌。类似于大肠杆菌,在食品或水的样品中存在肠杆菌科微生物可能表明存在粪便污染,并因此表明可能存在人类病原体(如,肠炎肠道沙门氏菌(Salmonellaenterica)、鼠伤寒肠道沙门氏菌、志贺氏杆菌(Shigella)属以及阪崎肠杆菌(Cronobacter)属)。需要用来测试病原微生物在样品中存在的高效方法。
技术实现要素:
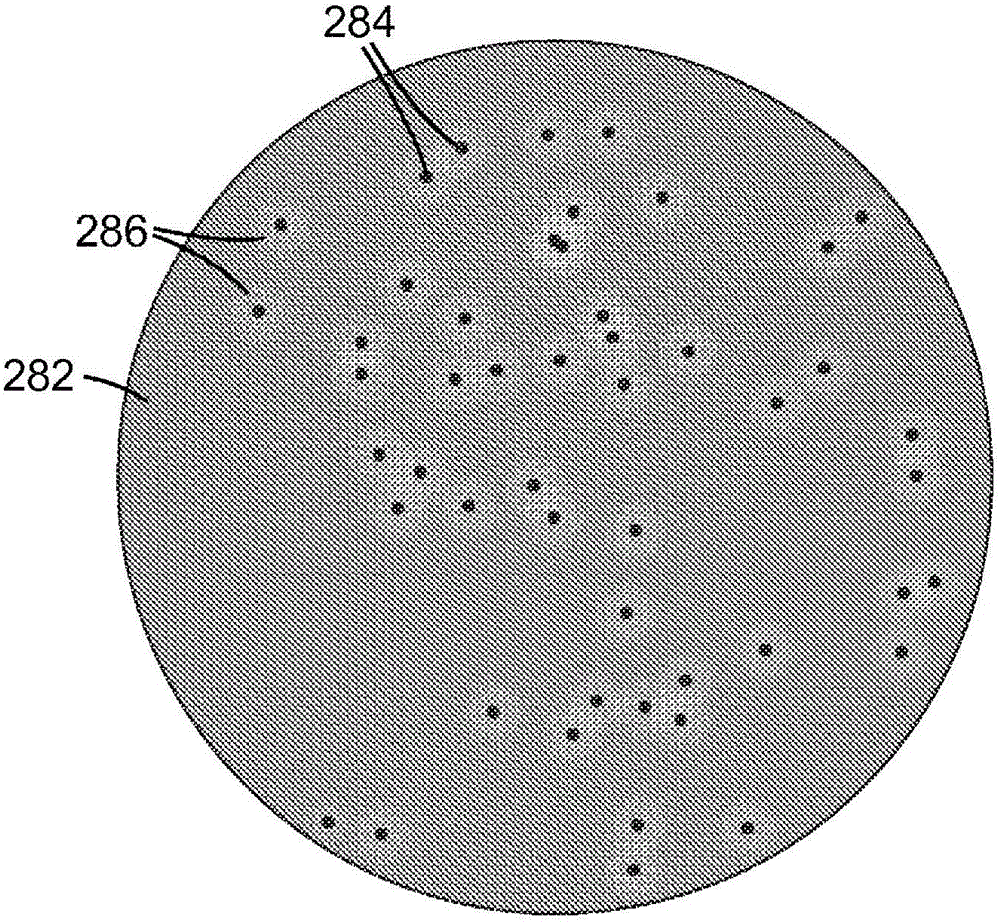
通常,本发明涉及用于评估样品(如,食物或水的样品、环境样品)的微生物含量的方法。具体地讲,本发明的方法可以检测靶微生物在样品中的存在或不存在,其中已发现该样品包含可以表明靶微生物存在的指示生物体。本发明的方法包括在具有第一指示系统的培养装置中培养样品,以确定指示微生物的存在,并且如果检测到指示微生物,则将培养装置与包含第二指示系统的检测制品接触,以确定靶微生物的存在或不存在。在一个方面,本发明提供了检测靶微生物的存在或不存在的方法。该方法可以包括提供包含培养基、含有第一指示系统的检测制品和样品的培养装置,其中所述培养基包含经选择以促进预定指示微生物生长的成分。可以选择第一指示系统以检测靶微生物。该方法还可以包括:用样品接种该培养装置,将接种的培养装置孵育一段足够允许指示微生物生长的时间,观察培养装置至少一种指示微生物存在的指示,使孵育的培养装置的培养基与检测制品接触,然后观察接触过制品的培养装置,以检测第一指示系统从第一状态到第二状态的转变。在一些实施例中,如果存在第一指示系统从第一状态到第二状态的转变,则其可能指示存在至少一种靶微生物。在一些实施例中,如果不存在第一指示系统从第一状态到第二状态的转变,则表明存在至少一种靶微生物。在一些实施例中,该方法还可以包括提供第二指示系统并将该第二指示系统放置为与培养基流体连通,其中观察培养装置至少一种指示微生物的存在包括检测存在或不存在第二指示系统从第一状态到第二状态的转变。在上述实施例的任何一个中,提供培养装置还可以包括提供包含第二指示系统的培养装置。在该方法的上述实施例的任何一个中,提供培养装置还可以包括提供包含水凝胶或干燥的冷水可溶胶凝剂的培养装置。在该方法的上述实施例的任何一个中,只有当观察到至少一种指示微生物存在的指示时,才将培养基与检测制品接触。在上述实施例的任何一个中,提供培养基可以包括提供经选择以促进肠杆菌科微生物生长的培养基,其中提供检测制品可以包括提供检测沙门氏菌(Salmonella)属微生物的检测制品。在一些实施例中,第一指示系统可以包含检测α-半乳醣苷酶或辛酸酯酶的酶活性的试剂。在上述实施例的任何一个中,提供培养基可以包括提供经选择以促进肠杆菌科微生物生长的培养基,其中提供检测制品可以包括提供检测志贺氏杆菌属微生物的检测制品。在一些实施例中,第一指示系统可以包含检测β-葡萄糖苷酶、β-岩藻糖苷酶、N-乙酰基-β-半乳糖胺酶或前述任意两种或更多种酶活性的组合的试剂。在上述实施例的任何一个中,提供培养基可以包括提供经选择以促进肠杆菌科微生物生长的培养基,其中提供检测制品可以包括提供检测阪崎肠杆菌属微生物的检测制品。在一些实施例中,第一指示系统可以包含检测α-葡萄糖苷酶和/或β-纤维二糖糖苷酶的酶活性的试剂。在上述实施例的任何一个中,提供培养基可以包括提供经选择以促进肠杆菌科微生物生长的培养基,其中提供检测制品可以包括提供检测大肠杆菌(Escherichiacoli)的检测制品。在上述实施例的任何一个中,提供培养基包括提供经选择以促进大肠菌微生物生长的培养基,其中提供检测制品包括提供检测大肠杆菌的检测制品。在一些实施例中,第一指示系统可以包含检测β-葡糖苷酸酶的酶活性的试剂。在一些实施例中,提供培养基可以包括提供经选择以促进李斯特氏菌属(Listeria)微生物生长的培养基,其中提供检测制品可以包括提供检测单核细胞增多性李斯特菌(Listeriamonocytogenes)的检测制品。在一些实施例中,第一指示系统可以包含检测α-吡喃甘露糖苷酶或磷脂酰肌醇特异性磷脂酶C的酶活性的试剂。在上述实施例的任何一个中,观察培养装置或接触过制品的培养装置可以包括目视观察所述培养装置。在上述实施例的任何一个中,观察培养装置或接触过制品的培养装置可以包括使用自动读数器观察所述培养装置。在上述实施例的任何一个中,该方法还可以包括对指示微生物菌落形成单元的一部分计数。在上述实施例的任何一个中,该方法还可以包括对靶微生物菌落形成单元的一部分计数。在上述实施例的任何一个中,使培养基与检测制品接触还可以包括在预定温度下接触培养基。在另一方面,本发明提供一种制品。该制品可以包括具有上主表面和下主表面的基底,以及设置在所述主表面的至少一个上的涂层。该涂层可以包含第一指示系统。该指示系统可以由α-吡喃半乳糖苷或辛酸酯酶的酶活性从第一状态转变到第二状态。在该制品的一些实施例中,第一指示系统可以选自5-溴-4-氯-3-吲哚基-α-D-吡喃半乳糖苷、5-溴-6-氯-3-吲哚基-辛酸和5-溴-4-氯-3-吲哚基-辛酸。在又一个方面,本发明提供一种制品。该制品可以包括具有上主表面和下主表面的基底,以及设置在所述主表面的至少一个上的涂层。该涂层可以包含第一指示系统。第一指示系统可以由β-葡糖苷酸酶的酶活性从第一状态转变到第二状态。在一些实施例中,第一指示系统可以选自5-溴-4-氯-3-吲哚基-β-D-葡糖醛酸、对硝基苯基-β-葡糖苷酸、对硝基苯基-2,3,4-三氧-乙酰基-β-葡糖醛酸甲酯、酚酞葡糖醛酸、酚酞单-P-葡糖醛酸、萘基-AS-BI-β-D-葡糖苷酸,以及4-甲基伞形酮基β-D-葡糖苷酸、8-羟基喹啉-β-D-葡糖醛酸、8-羟基喹啉-β-D-葡糖醛酸的钠盐、2-萘基-β-D-葡糖醛酸、2-萘基-β-D-葡糖醛酸的钠盐、4-硝基苯基-β-D-葡糖醛酸、4-硝基苯基-β-D-葡糖醛酸的钠盐、酚酞-β-D-葡糖醛酸、酚酞-β-D-葡糖醛酸的钠盐一水合物、5-溴-4-氯-3-吲哚氧基-β-D-葡糖醛酸、5-溴-4-氯-3-吲哚氧基-β-D-葡糖醛酸的环己基铵盐、3-吲哚氧基-β-D-葡糖醛酸、3-吲哚氧基-β-D-葡糖醛酸环己基铵盐、3-吲哚氧基-β-D-葡糖醛酸、3-吲哚氧基-β-D-葡糖醛酸钠盐、5-溴-6-氯-3-吲哚氧基-β-D-葡糖醛酸、5-溴-6-氯-3-吲哚氧基-β-D-葡糖醛酸的环己基铵盐、5-溴-4-氯-3-吲哚氧基-β-D-葡糖醛酸、5-溴-4-氯-3-吲哚氧基-β-D-葡糖醛酸的无水钠盐、5-溴-4-氯-3-吲哚氧基-β-D-葡糖醛酸、5-溴-4-氯-3-吲哚氧基-β-D-葡糖醛酸的钠盐三水合物。在又一个方面,本发明提供一种制品。该制品可以包括具有上主表面和下主表面的基底,以及设置在所述主表面的至少一个上的涂层。该涂层可以包含第一指示系统。第一指示系统可以由α-吡喃甘露糖苷酶或磷脂酰肌醇特异性磷脂酶C的酶活性从第一状态转变到第二状态。在一些实施例中,第一指示系统可以选自5-溴-4-氯-3-吲哚氧基-肌醇-1-磷酸酯、5-溴-6-氯-3-吲哚氧基-肌醇-1-磷酸酯的铵盐、4-甲基伞形酮基肌醇-1-磷酸酯、N-甲基-吗啉盐、3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-3-吲哚氧基-α-D-吡喃甘露糖苷、4-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、5-碘-3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-4-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、氯-3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-6-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、6-溴-3-吲哚氧基-α-D-吡喃甘露糖苷、6-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、6-氟-3-吲哚氧基-α-D-吡喃甘露糖苷、4,6-二氯-3-吲哚氧基-α-D-吡喃甘露糖苷、6,7-二氯-3-吲哚氧基-α-D-吡喃甘露糖苷、4,6,7-三氯-3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-4-氯-N-甲基-α-D-吡喃甘露糖苷、3-吲哚氧基-α-D-吡喃甘露糖苷,以及N-甲基-3-吲哚氧基-α-D-吡喃甘露糖苷、6-溴-2-萘基-α-D-吡喃甘露糖苷、4-甲基伞形酮基-α-D-吡喃甘露糖苷以及4-硝基苯基-α-D-吡喃甘露糖苷。在上述实施例的任何一个中,所述涂层可以设置在上主表面和下主表面上。在上述实施例的任何一个中,所述制品还可以包括粘合剂层。在一些实施例中,第一指示系统的至少一部分可以设置在粘合剂层之上或之中。在上述实施例的任何一个中,第一指示系统可以设置在两个主表面上。在上述实施例的任何一个中,基底可以选自聚合物膜、纸张、无纺布、膜滤器以及前述物质中任一种的衍生物。在上述实施例的任何一个中,所述涂层还可以包含粘结剂。词语“优选的”和“优选地”指在某些情况下可以提供某些有益效果的本发明实施例。然而,在相同的情况或其他情况下,其他实施例也可以是优选的。此外,对一个或多个优选实施例的表述并不暗示其他实施例不是可用的,并且不意在将其他实施例从本发明的范围排除。当术语“包括”和其变型在说明书和权利要求书中出现时,这些术语的确不具有限制性含义。本文所用的“一种(个)”、“所述(该)”、“至少一种(个)”以及“一种或多种(一个或多个)”可互换使用。因此,例如,微生物可以解释为意指“一种或多种”微生物。术语“和/或”意指所列要素的一个或全部,或所列要素的任何两个或两个以上的组合。如本文所用,“培养装置”指能够容纳有利于微生物生长的营养培养基的制品。任选地,培养装置可以包括封盖或顶盖,以便使营养培养基对外部污染的暴露最小化和/或以便减少水分在孵育和/或存储期间从培养基中的损失。培养装置的非限制性例子包括烧瓶、烧杯、管、培养皿、多孔板、PETRIFILM板、COMPACTDRY培养基片、SANITA-KUN测试片等。如本文所用,“指示系统”指以下一种或多种物质中的任一种和以下一种或多种物质的任意组合,所述物质包括:显色酶底物、荧光酶底物、氧化还原指示剂(如,氯化三苯基四唑、亚甲蓝)、可代谢的营养物质、pH指示剂。“可代谢的营养物质”指能够被预定的指示生物体和/或预定的靶微生物用来生成生物质和/或能量的任何分子。微生物直接或间接地使用可代谢的营养物质在与微生物流体接触的水性介质中产生pH或其他可检测的离子变化。“区分性”指示系统是能够用于根据两种不同微生物各自与一种或多种指示系统的一种或多种组分的反应度而区分它们的指示系统。如本文所用,“指示微生物”指属于已知存在于也存在靶微生物的环境(如,液体或固体基质)中的一种微生物群的微生物。根据本发明,指示微生物和它们相应的靶微生物能够在同样的培养基中进行培养。另外,靶微生物可以与检测相应指示微生物的同一指示系统反应。指示微生物可以包括相对庞大且多样化的微生物群(如,有氧细菌、酵母、丝状真菌)、相对庞大且较少多样化的微生物群(如,系统发育相关的微生物群,诸如肠杆菌科,或生理上相关的微生物群,诸如大肠杆菌),以及甚至更小的微生物群和/或更不多样化的微生物群(如,一个属,如李斯特氏菌属,一个物种,如大肠杆菌)。如本文所用,“靶微生物”指可以在一种或多种其中存在指示微生物的相同环境中存在的预定微生物。基于靶微生物与区分性指示系统的反应度或其缺少反应度,靶微生物可以与一种指示微生物群中的一种或多种区分。在一些实施例中,靶微生物可以属于指示微生物群(如,示例性靶微生物大肠杆菌是肠杆菌科的成员,所述肠杆菌科是本领域已知的一种指示微生物群)。在某些实施例中,“靶微生物”可以指特定物种的一个或多个菌株、特定属的一个或多个物种,或者来自两个或更多个属中的每一个的不止一个物种,或未分类的(如,生理上相关的)群的一个或多个菌株或物种。另外,本文通过端点表述的数值范围包括所述范围内包含的所有数值(例如,1到5包括1、1.5、2、2.75、3、3.80、4、5等)。本发明的上述发明内容并不意在描述本发明的每个公开的实施例或每种实施方式。以下描述更具体地例示了示例性实施例。在整个申请的若干地方,通过实例清单提供了指导,所述实例可以按多种组合方式来使用。在各种情形下,所列举的清单仅仅作为代表性群组,而不应被理解为排他性清单。下面将结合附图和描述介绍上述及其他实施例的更多细节。通过描述、附图和权利要求书,可以充分理解其他特征、目标和优点。附图说明图1为根据本发明检测靶微生物的方法的一个实施例的框图。图2为在其中设置有指示微生物的菌落的培养装置的一个实施例的俯视图。图3为根据本发明的检测制品的一个实施例的透视图。图4为在图3的培养装置中放置检测制品后该培养装置的俯视图。具体实施方式本发明涉及一种用于评估样品的微生物含量的方法。具体地讲,该方法包括有利地在单个培养装置中进行的连续检测方法。这些检测方法是有区别的,但就第一检测方法鉴定指示微生物群且第二检测方法识别出该群内部靶微生物的意义而言,它们是相关的。有利的是,第一识别方法的结果可以用来决定是否指示使用第二检测方法。因此,在一些实施例中,当通过第一鉴定方法未检测到指示微生物时,操作员可以省去第二鉴定方法的时间、材料、人工和花费。图1为显示根据本发明检测靶微生物的方法的一个实施例的框图。本发明的方法涉及对样品测试靶微生物的存在或不存在。该方法包括步骤152:提供待测试的样品、检测制品以及包含培养基的培养装置。任选地,可以提供第二指示系统。该方法还包括步骤154:将第二指示系统(如果存在)放置为与培养基流体连通。该方法还包括用样品接种培养装置的步骤156,行孵育接种的培养装置的步骤158,以及观察培养装置指示微生物的指示的步骤160。如果在步骤160中观察到指示微生物,则该方法还包括将培养基与检测制品接触的可选步骤162,以及观察第一指示系统的步骤164。下文更详细描述该方法中所述步骤的每一个。该方法的优点是如果检测到指示微生物的指示,则可能仅需要将检测制品施加至培养基。因此,在没有检测到指示微生物的指示的样品中,可以推断靶微生物并不存在,并且不必使用检测制品。提供待测试的样品可以包括提供疑似含有靶微生物的样品。这种样品可以是可能包含如本文所定义的靶微生物的任何样品。合适样品的非限制性例子包括环境样品(如,表面拭子/海绵、污垢、沉淀物、传染体)、食品(如,原料、生产过程中的样品和制成品样品)、饮料、临床/兽医样品(如,血液、血清、血浆、尿液、痰液、组织、黏液、粪便、伤口渗出物、脓、脑脊液)以及水(如,地表水、饮用水、工业用水)。在一些实施例中,可以在源自多种食品、饮料、或加工食品或饮料的环境来源的测试样品中分析靶微生物的存在或不存在。食品来源的非限制性例子包括生肉或加工肉、生鲜或加工水果或蔬菜、非流体的乳制品(如,奶酪、黄油和冰淇淋)、坚果、香料、作料和糖浆。饮料来源的非限制性例子包括饮用水、果汁或蔬菜汁、乳和发酵饮料。巴氏消毒的食品或饮料也可以是合适的来源。加工食品或饮料的环境样品的非限制性例子包括食品操作表面的样品(如,传送带、刀片、切削表面、混合设备表面、滤器、存储容器)、房间样品(如,墙壁、地板、排水沟、通风设备),以及清洗设备(如,软管、清洁工具)。在一些实施例中,可以在源自多种人类或动物来源的样品(诸如生理流体,如血液、唾液、人工晶状体流体、滑液、脑脊髓液、脓、汗液、渗出物、尿液、黏液、乳汁等)中分析靶微生物的存在或不存在。此外,测试样品可源自身体部位,如伤口、皮肤、鼻孔、头皮、指/趾甲等。特别值得关注的来自人或动物来源的样品包括含黏液的样品,诸如鼻样品(来自如前鼻孔、鼻咽腔、鼻腔、鼻前庭等)以及来自外耳、中耳、口、直肠、阴道或其他类似组织的样品。具体的粘膜组织的例子包括口腔、齿龈、鼻、眼、气管、支气管、胃肠、直肠、尿道、输尿管、阴道、子宫颈和子宫的粘膜。除了生理流体外,其他测试样品可以包括其他液体以及溶于液体介质的一种或多种固体。所关注的样品可以包括工艺流、水、土壤、植物或其他植被、空气、表面(例如污染的表面)等。样品还可以包括培养的细胞。样品还可以包括在装置(如,生物指示剂装置)之上或之中的样品,包括细胞、孢子或酶。适用于本发明方法的样品可以包括某些固体样品。固体样品可以(如,通过混合、超声波降解、均化)碎裂,并且可以悬浮在液体(如,水、缓冲液、肉汤)中。在一些实施例中,可以在该方法中使用含有样品材料的样品采集装置(如,拭子、海绵)。或者,可以从样品采集装置洗提(如,冲洗出、刮出、挤压出)样品材料,然后在所述方法中使用样品材料。在一些实施例中,液体或固体样品可以在液体(如,水、缓冲液、肉汤)中稀释。样品可以包含如本文所述的指示微生物。所述指示微生物能够表明存在污染(如,粪便污染)、感染(如,遭病原微生物感染),或可以是一般环境卫生的指示(如,任何有氧微生物)。指示微生物还可以是靶微生物。特别值得关注的,即可以是作为指示生物体或靶微生物而受到关注的,的微生物包括原核和真核生物,尤其革兰氏阳性细菌、革兰氏阴性细菌、真菌、支原体和酵母。特别相关的生物包括肠杆菌科或微球菌(Micrococcaceae)科或葡萄球菌(Staphylococcus)属、链球菌(Streptococcus)属、假单胞菌(Pseudomonas)属、肠球菌(Enterococcus)属、沙门氏菌属、军团杆菌(Legionella)属、志贺氏杆菌属、耶尔森氏菌(Yersinia)属、肠杆菌属、埃希杆菌属、芽孢杆菌(Bacillus)属、李斯特氏菌属、弧菌(Vibrio)属、棒杆菌(Corynebacteria)属以及疱疹病毒、曲霉菌(Aspergillus)属、镰刀菌(Fusarium)属以及假丝酵母(Candida)属的成员。毒力特别强的生物体包括:金黄色葡萄球菌(Staphylococcusaureus)(包括耐药菌株,如,耐甲氧西林金黄色葡萄球菌(MRSA))、表皮葡萄球菌(S.epidermidis)、肺炎链球菌(Streptococcuspneumoniae)、无乳链球菌(S.agalactiae)、酿脓链球菌(S.pyogenes)、粪肠球菌(Enterococcusfaecalis)、耐万古霉素肠球菌(VRE)、耐万古霉素金黄色葡萄球菌(VRSA)、对万古霉素半成品耐药的金黄色葡萄球菌(VISA)、炭疽芽孢杆菌(Bacillusanthracis)、铜绿假单胞菌(Pseudomonasaeruginosa)、大肠杆菌、黑曲霉(Aspergillusniger)、烟曲霉(A.fumigatus)、棒曲霉(A.clavatus)、茄病镰刀菌(Fusariumsolani)、尖孢镰刀菌(F.oxysporum)、厚孢镰刀菌(F.chlamydosporum)、单核细胞增多性李斯特菌、依氏李斯特菌(Listeriaivanovii)霍乱弧菌(Vibriocholera)、副溶血性弧菌(V.parahemolyticus)、猪霍乱沙门氏菌(Salmonellacholerasuis)、伤寒沙门菌(S.typhi)、鼠伤寒沙门氏菌(S.typhimurium)、白色假丝酵母(Candidaalbicans)、光滑假丝酵母(C.glabrata)、克鲁斯假丝酵母(C.krusei)、阪崎肠杆菌(Cronobactersakazakii)、大肠杆菌(E.coli)O157以及多重耐药性革兰氏阴性杆菌(MDR)。革兰氏阳性细菌和革兰氏阴性细菌是特别值得关注的。特别要关注的是革兰氏阳性细菌,例如,单核细胞增多性李斯特菌。另外,特别要关注的是抗生素耐药性微生物,包括MRSA、VRSA、VISA、VRE和MDR微生物。重新参见图1的步骤152,除了提供待测试的样品外,该方法还包括提供培养装置、第一指示系统以及其上涂覆第二指示系统的制品。培养装置在广义上使用,并且包括适于容纳促进微生物生长的营养培养基的多种制品。根据所述方法选择特定营养培养基以促进任何特定指示微生物的生长处于本领域一般技术人员的能力范围内。在一些实施例中,营养培养基可以包含一种或多种选择性抑制剂。如本文所用,“选择性抑制剂”指化学化合物,其中将所述化学化合物添加至营养培养基以便部分或完全抑制某些易感微生物或微生物群的生长,从而选择性地促进其他微生物或微生物群的生长。选择性抑制剂为本领域已知,并且包括例如,胆汁盐、无机盐(如,NaCl、LiCl、MgCl2)以及抗生素(氟喹诺酮类、β-内酰胺抗生素、氨基糖苷类)。在本发明的某些优选实施例中,营养培养基可以按选择性最小的浓度(即,比选择性生长培养基中所用的习惯浓度低的浓度)包含选择性抑制剂。有利的是,通过使用本发明的方法,最小选择性营养培养基的使用可以允许恢复并检测更多的靶微生物。不受理论的约束,这可能是可行的,因为更低浓度的选择性抑制剂允许受损、应激和/或相对易感的靶微生物在选择性培养基中生长,从而使得用第二指示系统检测它们成为可能。第一指示系统用来表明靶微生物的存在或不存在。可选的第二指示系统用来表明指示微生物的存在或不存在。第一和/或第二指示系统可以包括显色酶底物、荧光酶底物、氧化还原指示剂、可代谢的营养物质、pH指示剂或前述任意两种或更多种的组合。在一些实施例中,可以通过在培养装置的培养基中提供组分之一以及在检测制品中提供其他组分,为该方法提供pH指示剂和某些可代谢的营养物质的组合。如本领域一般技术人员将认识到,第一指示系统的选择可以取决于靶微生物和/或培养装置中所用的培养基,并且此类选择以本发明为指导。在该方法的一些实施例中,高度区分性的第一指示系统(即,与包括靶微生物的相对较少的微生物反应的指示系统)可以与最小选择性的培养基结合使用。在这些实施例中,最小选择性培养基可以允许受损和/或应激的靶微生物恢复并生长,从而使这些可能被相对高选择性的培养基抑制的靶微生物能够检出。在所述方法的一些实施例中,相对较低区分性的第一指示系统(即,与相对众多的微生物(包括靶微生物)反应的指示系统)可以与选择性相对高的培养基结合使用。该方法可以随高度复杂的样品(如,要求强选择性条件的样品(如,来自往往含有大量高度多样化微生物内容物的地漏的样品)或来自相对无选择性的预富集肉汤培养物的样品)。该方法的一个例子是,Demi-Fraser/UVM、Fraser肉汤富集系统与检测李斯特氏菌属微生物的改良牛津琼脂一起使用。在任何一个所述实施例中,第一或第二指示系统可以包括适用于生物氧化还原反应的氧化还原指示剂。氧化-还原指示染料可以是pH依赖的或pH不依赖的。氧化-还原指示染料的非限制性例子包括:2,2'-联吡啶(钌络合物)、硝基邻二氮杂菲(铁络合物)、N-苯基邻氨基苯甲酸、1,10-邻二氮杂菲(铁络合物)、N-乙氧基菊橙、2,2`-联吡啶(铁络合物)、5,6-二甲基邻二氮杂菲(铁络合物)、邻联茴香胺、二苯胺磺酸钠、二苯基联苯胺、二苯胺、紫罗碱、2,6-二溴苯酚靛酚钠、2,6-二氯苯酚靛酚钠、邻甲酚靛酚钠、硫堇(同义:、劳氏紫)、亚甲蓝、靛蓝四磺酸、靛蓝三磺酸、靛蓝二磺酸、靛蓝一磺酸、酚藏花红、番红花红T,以及中性红。在任何一个所述实施例中,第一和/或第二指示系统可以包括显色酶底物。合适的显色酶底物包括(例如)溴-氯-吲哚衍生物、硝基苯衍生物,以及酚酞衍生物。可用的5-溴-4-氯-3-吲哚衍生物包括:5-溴-6-氯-3-吲哚醋酸酯、5-溴-4-氯-3-吲哚基醋酸酯、5-溴-4-氯-3-吲哚氧基-β-D-吡喃半乳糖苷、5-溴-4-氯-3-吲哚基-1,3二乙酸酯、5-溴-4-氯-3-吲哚基-β-D-岩藻吡喃糖苷、5-溴-4-氯-3-吲哚基-β-D-吡喃葡萄糖苷、5-溴-4-氯-3-吲哚基-β-D-葡糖醛酸、5-溴-4-氯-3-吲哚基磷酸酯以及5-溴-4-氯-3-吲哚基硫酸酯。可用的硝基苯衍生物包括:对硝基苯酚衍生物和邻硝基苯酚衍生物。特别可用的对硝基苯酚类化合物包括:二乙基对硝基苯磷酸酯;二对硝基苯磷酸酯;对硝基苯基-2-乙酰胺基-2-脱氧-3-O-β-吡喃半乳糖基-β-吡喃葡萄糖苷;对硝基苯基-2-乙酰胺基-2-脱氧-β-吡喃葡萄糖苷;对硝基苯乙酸酯、对硝基苯基-N-乙酰基-β-D-氨基葡糖苷、对硝基苯基-β-D-N,N’-二乙酰基壳二糖糖苷;对硝基苯基-α-吡喃葡萄糖苷;对硝基苯基-α-麦芽糖苷;对硝基苯基-β-麦芽糖苷;对硝基苯基-α-吡喃甘露糖苷;对硝基苯基-β-吡喃甘露糖苷;对硝基苯基肉豆蔻酸酯;对硝基苯基棕榈酸酯;对硝基苯基磷酸酯;二(对硝基苯基)磷酸酯;三(对硝基苯基)磷酸酯;对硝基苯基-β-吡喃葡萄糖苷;对硝基苯基-β-葡糖苷酸;α-对硝基苯基甘油;对硝基苯基-α-吡喃鼠李糖苷;对硝基苯基硬脂酸酯;对硝基苯基硫酸酯;对硝基苯基-2,3,4-三氧-乙酰基-β-葡糖醛酸甲酯;以及对硝基苯基戊酸酯。特别可用的邻硝基苯酚类化合物包括:邻硝基苯乙酸酯、邻硝基苯基-β-葡糖苷以及邻硝基苯基-β-D-吡喃葡萄糖苷。其他特别可用的硝基苯基衍生物包括:硝基苯基-β-岩藻吡喃糖苷、硝基苯基-α-吡喃半乳糖苷、硝基苯基丁酸酯、硝基苯基癸酸酯、硝基苯基己酸酯、硝基苯基辛酸酯、硝基苯基月桂酸酯以及硝基苯基丙酸酯。可用的吲哚氧基衍生物包括:吲哚乙酸酯;吲哚氧基-β-D-葡糖苷;3-吲哚硫酸酯;3-吲哚酰磷酸酯。可用的酚酞衍生物包括:酚酞二丁酸酯;酚酞二磷酸酯;酚酞二硫酸酯;酚酞葡糖醛酸;酚酞单-P-葡糖苷酸;酚酞单-P-葡糖醛酸;以及酚酞单磷酸酯。所有上述的显色底物将与合适的酶直接反应以生成发色团。如果所述衍生性酶修饰产物进一步与显色试剂(如重氮化染料,如1-重氮-4-苯甲酰胺基-2,5-二乙氧基苯(以“固蓝BB盐”商购自西格玛化学公司(SigmaChemical))、1-重氮-4-苯甲酰胺基-2,5-二乙氧基苯、对重氮-2,5-二乙氧基-N-苯甲酰丙氨酸、氯-2-甲基苯重氮氯化盐以及邻氨基偶氮甲苯重氮盐)反应生成发色团,则含有1-萘基、2-萘基和萘基-AS-BI衍生物的其他酶底物可有效使用。特别可用的1-萘基衍生物包括:1-萘基-N-乙酰基-β-D-氨基葡糖苷。特别可用的2-萘基衍生物包括:2-萘基-磷酸酯;2-萘基丁酸酯;2-萘基辛酸酯;2-萘基肉豆蔻酸酯;L-亮氨酰-2-萘基胺;L-缬氨酰-2-萘基胺;L-胱氨酰-2-萘基胺;N-苯甲酰-DL-精氨酸-2-萘基胺;N-戊二酰-苯基丙氨酸-2-萘基胺;2-萘基磷酸盐;6-溴-2-萘基-α-D-吡喃半乳糖苷;2-萘基-β-D-吡喃半乳糖苷;2-萘基-2-D-吡喃葡萄糖苷;6-溴-2-萘酚-β-D-吡喃葡萄糖苷;6-溴-2-萘基-2-D-吡喃甘露糖苷;以及2-萘基-α-L-岩藻吡喃糖苷。特别可用的萘基-AS-BI衍生物包括萘基-AS-BI-磷酸酯以及萘基-AS-BI-β-D-葡糖苷酸。在待检测其活性的酶是α-D-葡萄糖苷酶的情况下,合适的显色酶底物为,例如,对硝基苯基-α-吡喃葡萄糖苷。在待检测其活性的酶是α-L-阿拉伯呋喃糖酶的情况下,合适的显色酶底物为,例如,对硝基苯基-α-L-阿拉伯呋喃糖苷。在待检测其活性的酶是β-D-葡萄糖苷酶的情况下,合适的显色酶底物为,例如,对硝基苯基-β-D-吡喃葡萄糖苷。在任一所述实施例中,第一和/或第二指示系统可以包括荧光酶底物。合适的荧光酶底物包括例如,4-甲基伞形酮-7-酰氨基-4-甲基香豆素的衍生物、荧光素的衍生物、若丹明的衍生物以及荧光胺的衍生物。合适的4-甲基伞形酮基衍生物包括,例如:4-甲基伞形酮基-2-乙酰氨基-4,6-O-亚苄基-2-脱氧-β-D-吡喃葡萄糖苷;4-甲基伞形酮基乙酸盐;4-甲基伞形酮基-N-乙酰基-β-D-氨基半乳糖苷;4-甲基伞形酮基-N-乙酰基-α-D-氨基葡糖苷;4-甲基伞形酮基-N-乙酰基-β-D-氨基葡糖苷;2'-(4-甲基伞形酮基)-α-D-N-乙酰基神经氨酸;4-甲基伞形酮基α-L-阿拉伯呋喃糖苷;4-甲基伞形酮基α-L-阿拉伯糖苷;4-甲基伞形酮基丁酸盐;4-甲基伞形酮基β-D-纤维二糖糖苷;甲基伞形酮基β-D-N,N'二乙酰基壳二糖糖苷;4-甲基伞形酮基反油酸盐;4-甲基伞形酮基β-D-岩藻糖苷;4-甲基伞形酮基α-L-岩藻糖苷;4-甲基伞形酮基β-L-岩藻糖苷;4-甲基伞形酮基α-D-半乳糖苷;4-甲基伞形酮基β-D-半乳糖苷;4-甲基伞形酮基α-D-葡糖苷;4-甲基伞形酮基β-D-葡糖苷;4-甲基伞形酮基β-D-葡糖苷酸;4-甲基伞形酮基对胍基苯甲酸盐;4-甲基伞形酮基庚酸盐;4-甲基伞形酮基α-D-吡喃甘露糖苷;4-甲基伞形酮基β-D-吡喃甘露糖苷;4-甲基伞形酮基油酸盐;4-甲基伞形酮基棕榈酸盐;4-甲基伞形酮基磷酸盐;4-甲基伞形酮基丙酸盐;4-甲基伞形酮基硬脂酸盐;4-甲基伞形酮基硫酸盐;4-甲基伞形酮基β-D-N,N',N"-三乙酰壳三糖糖苷;4-甲基伞形酮基2,3,5-三-o-苯甲酰-α-L-阿拉伯呋喃糖苷;4-甲基伞形酮基-对三甲基肉桂酸氯化铵;以及4-甲基伞形酮基β-D-木糖苷。合适的7-酰氨基-4-甲基香豆素衍生物包括,例如:L-丙氨酸-7-酰氨基-4-甲基香豆素;L-脯氨酸7-酰氨基-4-甲基香豆素;L-酪氨酸-7-酰氨基-4-甲基香豆素;L-亮氨酸-7-酰氨基-4-甲基香豆素;L-苯基丙氨酸-7-酰氨基-4-甲基香豆素;以及7-戊二酰苯基丙氨酸-7-酰氨基-4-甲基香豆素。合适的7-酰氨基-4-甲基香豆素的肽衍生物包括,例如:N-t-BOC-异亮氨酸-谷氨酸-甘氨酸-精氨酸7-酰氨基-4-甲基香豆素;N-t-BOC-亮氨酸-丝氨酸-苏氨酸-精氨酸7-酰氨基-4-甲基香豆素;N-CBZ-苯丙氨酸-精氨酸7-酰氨基-4-甲基-香豆素;脯氨酸-苯丙氨酸-精氨酸7-酰氨基-4-甲基香豆素;N-t-BOC-缬氨酸-脯氨酸-精氨酸7-酰氨基-4-甲基香豆素;以及N-戊二酰-甘氨酸-精氨酸7-酰氨基-4-甲基香豆素。合适的二乙酰基荧光素衍生物包括,例如,荧光素二乙酸盐、荧光素二-(β-D-吡喃半乳糖苷)和荧光素二月桂酸盐。在待检测的生物活性是α-D-葡萄糖苷酶、胰凝乳蛋白酶的情况下,合适的荧光酶底物分别为4-甲基伞形酮基-α-D-葡糖苷、7-戊二酰苯基丙氨酸-7-酰氨基-4-甲基香豆素或4-甲基伞形酮基庚酸酯。在待检测的生物活性是α-L-阿拉伯呋喃糖酶的情况下,合适的荧光酶底物为4-甲基伞形酮基-α-L-阿拉伯呋喃糖苷。在待检测的生物活性是β-D-葡萄糖苷酶的情况下,合适的荧光酶底物是4-甲基伞形酮基-β-D-葡糖苷。在本方法的任一所述实施例中,第一和/或第二指示系统可以包括与可代谢的营养物质结合使用的pH指示染料。pH指示染料可以根据本领域已知的条件进行选择,所述条件例如,pH范围、与指示剂和/或靶微生物的相容性以及溶解度。在一些实施例中,可以使用pH指示剂的盐形式,例如,以增大pH指示剂在水性混合物中的溶解度。合适的pH指示染料的非限制性例子包括,例如,百里酚蓝、金莲橙OO、甲基黄、甲基橙、溴酚蓝、溴甲酚绿、甲基红、溴百里酚蓝、酚红、中性红、酚酞、百里酚酞、茜素黄、金莲橙O、硝胺、三硝基苯甲酸、百里酚蓝、溴酚蓝、四溴酚蓝、溴甲酚绿、溴甲酚紫、甲基红、溴百里酚蓝、酚红、刚果红和甲酚红。可代谢的营养物质可以是本领域已知的任何一种可代谢的营养物质,其与至少一种微生物(或者一种指示微生物和/或靶微生物)反应并导致与所述微生物流体接触的水性介质中的pH变化(如,局部的pH变化)。营养物质可以选自本领域已知的多种营养物质类型。营养物质类型的非限制性例子包括:碳水化合物(如,糖类、多糖类及其衍生物)、脂肪类(如,脂肪酸、脂肪酸酯及其衍生物)、胺类(如,氨基酸、多肽、寡肽、蛋白质、多胺及其衍生物)、多磷酸盐、嘌呤、嘧啶、核苷以及核苷酸。在一些实施例中,可以在培养装置(如,在培养皿的琼脂培养基上例如,在如Petrifilm培养装置的装置中的脱水培养基上)中提供可选的第二指示系统;当作为水凝胶的组分(例如,琼脂培养基的组分)提供时,使可选的第二指示系统与培养基处于流体连通。如图1的步骤154所示,当作为可复水培养装置(例如,Petrifilm板)一部分的脱水组分提供时,使可选的第二指示系统与培养基处于流体连通。例如,可以通过用液体(如,水、缓冲液、稀释液)将装置中的脱水培养基复水,完成这一步骤。在一些实施例中,可复水的培养基包括,例如,可溶于冷水的胶凝剂(如琼脂、琼脂糖、瓜耳胶、黄原胶、刺槐豆胶、聚乙烯醇和/或聚乙烯吡咯烷酮)。可选地,所述液体可以包含样品材料,从而允许操作者同时进行步骤154和接种步骤156。接种培养装置可以通过本领域已知的多种方法完成。合适的接种方法的非限制性例子包括倾注平板技术、表面接种技术、划线铺板技术、拭子铺板技术以及表面接触铺板技术(如,Rodac铺板法)。可以在本发明方法中使用滤膜铺板技术,前提是膜滤器基本上不干扰微生物和指示系统间的反应,或基本上不干扰对指示系统的观察。本发明的方法包括对已接种的培养装置孵育一段时间。相关领域的普通技术人员将认识到,可以根据要检测的微生物来选择孵育温度。例如,如果酵母或霉菌待检测,则第一孵育温度通常可以是从约室温(大约23℃)至约32℃。例如,如果细菌待检测,则第一孵育温度通常可以是约室温至约45℃。根据本发明,孵育时间段可以短至约一小时。在一些实施例中,第一孵育少于约4小时(例如,少于约2小时、少于约3小时或少于约4小时)。在一些实施例中,孵育时间段少于约8小时(例如,少于约5小时、少于约6小时、少于约7小时或少于约8小时)。在一些实施例中,孵育少于约12小时(例如,约9小时、约10小时、约11小时或约12小时)。在一些实施例中,孵育时间段少于或等于约15小时(例如,少于约13小时、少于约14小时或少于约15小时)。在一些实施例中,孵育时间段最长到48小时(例如,少于约24小时、少于约36小时或少于约48小时)。在这个个孵育时间段后,观察培养装置指示微生物存在的指示。在一些实施例中,用肉眼观察培养装置。在一些实施例中,观察培养装置可以包括使用成像装置观察培养装置。用于扫描和可任选地分析培养装置的成像装置是本领域已知的,并且包括,例如,得自明尼苏达州圣保罗的3M公司(3MCompany(St.Paul,MN))的PETRIFILM读板机(PPR)、得自马萨诸塞州诺伍德的(Norwood,MA)的SpiralBiotech公司的PETRISCAN菌落计数器以及得自英国剑桥(Cambridge,U.K.)的Synbiosis公司的PROTOCOL和ACOLYTE平板扫描仪。在使用可选第二指示系统的实施例中,可以通过检测第二指示系统从第一状态到第二状态的转变,观察指示微生物存在的指示。例如,在一些实施例中,第二指示系统可以包括显色试剂(如,氯化三苯基四唑或5-溴-4-氯-3-吲哚基-β-D-吡喃葡萄糖苷),其在转变(如,通过指示微生物)成有色第二状态之前以无色第一状态存在。在其他实施例中,第二指示系统可以包括荧光试剂(如,4-甲基伞形酮基β-D-半乳糖苷或荧光素二乙酸盐),其在转变(如,通过指示微生物)成荧光性第二状态之前以无色第一状态存在。在其他实施例中,第二指示系统可以包括可以由微生物活性的产物(如,将碳水化合物发酵为酸性终产物)从有色或荧光性第一状态转变为有色或荧光性第二状态的试剂(如,pH指示剂)。在一些实施例中,检测第二指示系统从第一状态到第二状态的转变可以包括观察微生物菌落以检测该转变。在一些实施例中,检测第二指示系统从第一状态到第二状态的转变可以包括观察培养基以检测该转变。图2示出了根据本发明检测指示微生物的几个方面。图2示出了已接种培养装置的一个实施例的俯视图,该培养装置包括与第二指示系统反应的指示微生物。该培养装置具有包括第二指示系统的培养基282,所述第二指示系统包括可发酵糖(如,葡萄糖)以及处于第一状态的试剂(如,氯酚红)(第一状态在图2中示出为深灰色;氯酚红以紫色的第一状态存在于pH为约6.8或更高的培养基中)。图2中还示出了指示微生物菌落284,所述菌落已经将葡萄糖发酵为可扩散的酸性终产物,所述终产物与试剂反应以便将它转变为第二状态(第二状态在图2中显示为围绕菌落284的浅灰色晕圈286;氯酚红在pH小于约5.2的培养基中转变为黄色的第二状态)。在一些实施例中,菌落可能由试剂染色,并且可能呈现与紧紧围绕菌落的培养基相同(或相似)的颜色。在其他实施例中(未示出),第二指示系统可能仅包括从第一状态变为第二状态的酶底物或氧化还原试剂,并从而直接改变菌落本身而非菌落周围培养基的颜色或荧光属性。在不使用可选的第二指示系统(如,包含选择性琼脂培养基的培养装置,未示出)的实施例中,可以通过观察在培养基上或培养基中的细菌菌落(如本领域已知,通过其典型大小、形状、颜色和/或形态)的存在来检测指示微生物存在的指示。表1显示可以用来支持肠杆菌科微生物生长的选择性培养基的几个非限制性例子,所述肠杆菌科微生物是表明沙门氏菌靶微生物存在的示例性指示微生物群。表1中还显示可以用来检测所述肠杆菌科微生物的示例性指示系统(即,根据本发明的第二指示系统)。可以用来表明沙门氏菌靶微生物存在的示例性第一指示系统包括:辛酸酯酶底物(公开于PCT专利申请No.WO2007023185,其通过引用方式完整并入本文);2-脱氧-D-核糖与中性红(公开于美国专利No.7,150,977,其通过引用方式完整并入本文);5-溴-4-氯-3-吲哚基-α-D-吡喃半乳糖苷(公开于美国专利No.6,368,817,其通过引用方式完整并入本文);丙二醇与中性红(公开于美国专利No.5,194,374,其通过引用方式完整并入本文);以及蜜二糖、甘露糖醇、山梨醇和中性红的组合(公开于美国专利No.5,786,167,其通过引用方式完整并入本文)。表1培养基指示系统结晶紫中性红胆盐琼脂葡萄糖+中性红PETRIFILM肠杆菌计数平板葡萄糖+氯酚红根据本发明的检测沙门氏菌靶微生物的方法的示例性实施例包括使用具有培养基的培养装置(如,琼脂培养皿或PETRIFILM培养装置),所述培养基包含表2中所列的组分。在准备琼脂培养基时,将除新生霉素钠和头孢磺啶外的所有组分以任意顺序混合在一起,并且然后煮沸并冷却以形成基础培养基。在正好快要完成平板培养基之前,将新生霉素钠和头孢磺啶加入煮沸冷却之后的基础培养基。如示例1所述,除培养基外,用包含5-溴-4-氯-3-吲哚基-α-D-吡喃半乳糖苷的第一指示系统制备检测制品。将培养基用样品接种并孵育一段时间(如,约18-48小时)。孵育后,观察培养装置至少一种指示微生物存在的指示(如,表明2-脱氧-D-核糖发酵成酸性终产物的总体上圆形的红色菌落和/或区域,其中所述酸性终产物使中性红pH指示剂从无色变为红色)。所述区域在其中心或中心附近可能具有可见的菌落。如果检测到指示微生物,则使检测制品与培养基接触,并且可将接触过制品的培养基孵育一段时间(如,约1-5小时)并对其观察靶微生物存在的指示(即,总体上在因微生物与第一指示系统反应所形成的红色区域中心的蓝色菌落)。可任选地,可以将额外的第二指示系统添加至培养基或检测制品,所述第二指示系统包括产生与5-溴-4-氯-3-吲哚基-α-D-吡喃半乳糖苷不同颜色的显色性β-吡喃半乳糖苷底物。额外的第二指示系统可以用来进一步鉴定非靶指示微生物,如,某些大肠杆菌和弗氏柠檬酸杆菌(Citrobacterfreundii)的菌株。作为中性红的替代,本领域已知的其他pH指示剂可以在第二指示系统中用来检测来自2-脱氧-D-核糖发酵的酸性终产物。本文中公开了其他合适的pH指示剂的例子。在一些实施例中,可以使用其他第二指示系统(如,氯化三苯基四唑)替代2-脱氧-D-核糖/中性红指示系统或作为其补充,以表明指示微生物的存在。在一些实施例中,可以将其他第二指示剂掺入检测制品而非培养基中。可以在检测制品中包括的替代性第一指示系统可以包括用于α-半乳醣苷酶的其他显色或荧光酶底物、用于辛酸酯酶的显色或荧光酶底物,或检测苯基丙氨酸脱氨基酶或丙二醇发酵的指示系统。表2.组分克/升酵母提取物3.00□蛋白胨10.00LabLemco粉1.00氯化钠5.00L-苯基丙氨酸3.50柠檬酸铁铵0.50胆汁盐3号0.40胆汁盐0.202-脱氧-D-核糖12.0中性红0.03琼脂*15.97去离子水*950mL/升新生霉素钠0.02头孢磺啶0.006可以用来支持肠杆菌科和/或大肠菌微生物(表明大肠杆菌O157:H7靶微生物存在的示例性指示微生物群)生长的选择性培养基的非限制性例子包括:结晶紫中性红胆盐-葡萄糖培养基、结晶紫中性红胆盐-乳糖培养基、PETRIFILM大肠杆菌计数平板、PETRIFILM大肠菌计数平板、PETRIFILM肠杆菌计数平板和PETRIFILM快速大肠菌计数平板。可以用来表明存在大肠杆菌O157:H7靶微生物的示例性第一指示系统包括水杨苷、核糖醇、肌醇、山梨醇与酚红的组合(公开于美国专利No.6,617,149,其通过引用方式完整并入本文)。可以用来支持李斯特氏菌属微生物(表明单核细胞增多性李斯特菌靶微生物存在的示例性指示微生物群)生长的选择性培养基的非限制性例子包括改良牛津培养基和R&F培养基。可以用来表明单核细胞增多性李斯特菌靶微生物的存在的示例性第一指示系统包括磷脂酰肌醇磷脂酶C酶底物(公开于美国专利No.20070259393,其通过引用方式完整并入本文)和α-甘露糖苷酶的酶底物(公开于美国专利No.7,351,548,其通过引用方式完整并入本文)。可以用来检测单核细胞增多性李斯特菌靶微生物的第一指示系统的非限制性例子包括5-溴-4-氯-3-吲哚氧基-肌醇-1-磷酸酯、5-溴-6-氯-3-吲哚氧基-肌醇-1-磷酸酯的铵盐、4-甲基伞形酮基肌醇-1-磷酸酯、N-甲基-吗啉盐、3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-3-吲哚氧基-α-D-吡喃甘露糖苷、4-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、5-碘-3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-4-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、氯-3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-6-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、6-溴-3-吲哚氧基-α-D-吡喃甘露糖苷、6-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、6-氟-3-吲哚氧基-α-D-吡喃甘露糖苷、4,6-二氯-3-吲哚氧基-α-D-吡喃甘露糖苷、6,7-二氯-3-吲哚氧基-α-D-吡喃甘露糖苷、4,6,7-三氯-3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-4-氯-N-甲基--α-D-吡喃甘露糖苷、3-吲哚氧基-α-D-吡喃甘露糖苷和N-甲基-3-吲哚氧基-α-D-吡喃甘露糖苷、6-溴-2-萘基-α-D-吡喃甘露糖苷、4-甲基伞形酮基-α-D-吡喃甘露糖苷以及4-硝基苯基-α-D-吡喃甘露糖苷。在优选实施例中,检测李斯特氏菌属微生物存在的薄膜培养装置可以包含脱水肉汤培养基,所述脱水肉汤培养基包括□蛋白胨、胰蛋白胨、酪蛋白氨基酸、LabLemco粉/牛肉膏、葡萄糖、酵母提取物、磷酸氢二钾、氯化锂、牛血清白蛋白、瓜耳胶、萘啶酸(钠盐)、检测β-葡萄糖苷酶酶活性(如,Salmon-β-D-葡糖苷和/或品红-β-D葡糖苷)和头孢他啶五水化物的显色酶底物。使用液体样品来接种培养基,并且如果存在,李斯特氏菌属微生物生长并且形成因β-葡萄糖苷酶显色酶底物水解而形成的红色菌落。如果在培养装置中检测到李斯特氏菌属微生物,则培养装置中已接种的培养基可以任选地与包含脱水涂层的检测制品接触,其中所述脱水涂层包含检测磷脂酰肌醇磷脂酶C酶活性(如,5-溴-4-氯-3-吲哚氧基-肌醇-1-磷酸酯)的显色指示剂、瓜耳胶和磷酸盐缓冲液。如果一个或多个菌落包含有单核细胞增多性李斯特菌微生物,它将水解磷脂酰肌醇磷脂酶C酶底物,造成菌落变成蓝色。有利的是,如果首先通过观察与菌落相关的β-葡萄糖苷酶活性的迹象而检测李斯特氏菌属微生物,则只需使用检测制品。可以用来支持肠杆菌科微生物(表明阪崎肠杆菌(Cronobactersakazaki)靶微生物存在的示例性指示微生物)生长的选择性培养基的非限制性例子包括结晶紫中性红胆盐-葡萄糖培养基和PETRIFILM肠杆菌计数平板。可以用来表明阪崎肠杆菌靶微生物存在的示例性第一指示系统包括显色的α葡萄糖苷酶和β纤维二糖糖苷酶的酶底物(公开于美国专利申请No.2006/0257967,其通过引用方式完整并入本文)。在一些实施例中,一种已知存在于相似环境(如,粪便)中作为靶微生物的指示微生物群实际上可能并不包含所述靶微生物。这种情况的一个例子由大肠菌指示微生物和沙门氏菌靶微生物的关系展示。大肠杆菌存在于粪便中并且以具有将乳酸发酵为酸性终产物的能力为特征。某些沙门氏菌靶微生物(如,鼠伤寒沙门氏菌)存在于粪便中,但不将乳酸发酵为酸性终产物。因此,本发明的方法可以包括:提供检测沙门氏菌靶微生物的第一指示系统(如,5-溴-4-氯-3-吲哚基-α-D-吡喃半乳糖苷)和检测大肠菌指示微生物的第二指示系统(如,乳糖和中性红)。在这个实施例中,与第一指示系统反应的菌落将不与第二指示系统反应。观察到指示生物体存在的指示意味着样品中可能存在靶微生物(如,潜在的病原体)。因此,所述方法的一个特征是,当观察到指示微生物存在的指示时,可以使用检测制品来确认样品中靶微生物的存在或不存在。反之,在一些实施例中,在没有观察到培养装置中指示微生物存在的指示的情况下,不必在该方法中使用检测制品,因为指示微生物在样品中的不存在意味着样品中不存在靶微生物。本发明的方法包括提供包含第一指示系统的检测制品。图3为根据本发明的检测制品300的一个实施例的透视图。检测制品300包括具有上主表面和下主表面的固体载体310以及设置在其上的涂层320。如本文所述,涂层320包含第一指示系统。可以选择第一指示系统以检测特定靶微生物。可任选地,粘合剂层(未示出)可以设置在固体载体310和涂层320之间的固体载体310上。可选的粘合剂层应当包括基本上不干扰第一指示系统与靶微生物之间的反应和/或基本上不干扰对第二指示系统的观察的粘合剂。合适的粘合剂的非限制性例子包括通过引用方式完整并入本文的美国专利No.4,565,783中描述的丙烯酸异辛酯/丙烯酰胺(94:6)压敏粘合剂。在一些实施例中,涂层320基本上是无水的(即该涂层具有这样的水含量,它不高于脱水涂层在经允许与周围环境平衡后的大致水含量)。在一些实施例中,可以将涂层320作为干涂层(如,粉末)的形式施用到基底310或可选的粘合剂层(未示出)上,或者,可以将该涂层作为液体形式施用到基底上,所述液体随后在基底上干燥,这两种工艺均在(例如)美国专利No.4,565,783中描述。在一些实施例中,可以将制品300进行构造、涂覆和干燥,如在美国专利No.6,022,682中针对复合材料的制造所述那样,所述专利通过引用方式完整并入本文。在一些实施例中,涂层320包括粘结剂。存在很多适用于检测制品300中的粘结剂。合适的粘结剂的非限制性例子包括琼脂糖、瓜耳胶、黄原胶、刺槐豆胶和其他天然树胶。一种优选的粘结剂是瓜耳胶。涂层320可能还优选地包括其他成分,如,将pH控制在某一个有利于第一指示系统与靶微生物反应的值的合适的缓冲剂。如本领域一般技术人员将认识到,对特定缓冲剂(如,磷酸盐缓冲剂)和pH(如,7.2)的选择取决于第一指示系统和/或靶微生物。固体载体310应当选自这样的材料,所述材料可以涂覆并且基本上不会模糊对第一指示系统,以及任选地第二指示系统的反应物和产物的观察。固体载体310可以为聚合物膜,如聚酯膜。固体载体310可以衍生自片状材料(如,聚合物膜、纸张、无纺布),在涂覆和干燥之后,允许对切割出或冲切出具有所需尺寸和形状的检测制品300。在一些实施例中,固体载体310可以是透明或半透明的,或者在放置为与水凝胶接触时可以变得透明或半透明。可以选择用于固体载体310的材料以赋予检测制品300任意刚度和柔度。另外,可以根据想要的具体应用,将检测制品300以任意形状(如,圆形、卵形、正方形、矩形等)或任意厚度制备。固体310优选地是透明的或至少是半透明的,以便允许在所述制品放置为与培养装置流体接触时观察形成的颜色变化。固体载体310还为所述制品提供稳定性并保护其免受损坏。可以如此选择固体载体310,从而它从涂层320上可剥离,剩下涂层在没有固体载体310时能自由地用于测试(如,与培养基处于流体接触)。例如,在其中聚酯膜用作固体载体的情况下,当涂层320与培养装置接触后变得水合时,固体载体310可以从涂层320上剥离下来。使用时,使检测制品与培养装置的培养基处于流体接触。优选地,将使检测制品和培养基在培养装置中接触(如,通过将检测制品放置为与培养装置中的培养基接触)。在某些优选的实施例中,切割检测制品以使其具有基本上相同的形状和表面积,从而使制品接触培养装置中培养基的整个表面。在一些实施例中,所述检测制品可以预水合(例如,用无菌水或缓冲液),不过构思培养基中的水分足以水合所述检测制品,从而使第一指示系统与培养装置中存在的微生物处于流体接触。不受理论的约束,据信培养基和检测制品之间的流体接触允许第一指示系统、微生物产生的代谢物和/或微生物(或其组分,如,酶)的扩散,从而第一指示系统的组分可以与代谢物、靶微生物或靶微生物的组分反应并从第一状态转变为第二状态。因此在一些实施例中,如果存在第一指示系统从第一状态到第二状态的转变,则表明存在至少一种靶微生物。在一些实施例中,如果不存在第一指示系统从第一状态到第二状态的转变,则表明存在至少一种靶微生物。在该方法的这些实施例中,当指示微生物使第一指示系统从第一状态变为第二状态(如,紧紧围绕该菌落的菌落和/或培养基变得有色或发荧光)时,则该指示微生物不是靶微生物。反之,在这些实施例中,如果指示微生物未使第一指示系统从第一状态变为第二状态,则表明指示微生物是靶微生物。一个具体的非限制性例子可以说明这一点。志贺氏杆菌属的某些微生物对人类致病,因此,志贺氏杆菌是靶微生物的一个例子。志贺氏杆菌是肠杆菌科的一个属。由于肠杆菌科微生物(包括志贺氏杆菌属)可以存在于粪便中,因此,肠杆菌科微生物是志贺氏杆菌的指示微生物的一个例子。在本发明方法的一个实施例中,可以将材料的样品接种到肠杆菌科的选择性培养基上(如,结晶紫中性红胆盐琼脂或PETRIFILM肠杆菌计数平板)。如果在培养基上检测到指示微生物,则可以使包含(例如)检测β-葡萄糖苷酶、β-岩藻糖苷酶和/或N-乙酰基-β-半乳糖胺酶的显色酶底物的检测制品与培养基接触。这些酶底物中的任何一种从无色状态转变为有色状态表明该菌落不是靶微生物,因为志贺氏杆菌靶微生物不具有针对这些酶底物的任一种酶活性。使检测制品与培养基流体接触之后,观察接触过该制品的培养基,以检测第一指示系统从第一状态到第二状态的转变(如,从无色状态变为有色状态、从无荧光状态变为发荧光状态、从第一颜色变成第二颜色)。可以检测到这种转变,例如,通过本文所讨论的检测第二指示系统从第一状态转变为第二状态的任何一种检测手段。任选地,在一些实施例中,可将接触过制品的培养基在预定温度下孵育一段时间,以促进第一指示系统从第一状态转变为第二状态。孵育温度可以是,例如,环境温度(约23℃)、最高达约28℃、最高达约30℃、最高达约35℃、最高达约37℃、最高达约42℃或最高达约45℃。在一些实施例中,可以将接触过制品的培养基在与用来培养和检测指示微生物的孵育温度相同的温度孵育。在一些实施例中,可以将接触过制品的培养基在用来培养和检测指示微生物的温度不同的温度(更高或更低)孵育。在一些实施例中,可以将接触过制品的培养基孵育至少约15分钟。在一些实施例中,可以将接触过制品的培养基孵育至少约30分钟。在一些实施例中,可以将接触过制品的培养基孵育至少约60分钟。在一些实施例中,可以将接触过制品的培养基孵育至少约90分钟。在一些实施例中,可以将接触过制品的培养基孵育至少约2小时。在一些实施例中,可以将接触过制品的培养基孵育至少约4小时。在一些实施例中,可以将接触过制品的培养基孵育最长达约60分钟。在一些实施例中,可以将接触过制品的培养基孵育最长达约90分钟。在一些实施例中,可以将接触过制品的培养基孵育最长达约2小时。在一些实施例中,可以将接触过制品的培养基孵育最长达约3小时。在一些实施例中,可以将接触过制品的培养基孵育最长达约4小时。在一些实施例中,可以将接触过制品的培养基孵育最长达5小时。在一些实施例中,可以将接触过制品的培养基孵育最长达8小时。在一些实施例中,可以将接触过制品的培养基孵育最长达12小时。在一些实施例中,可以将接触过制品的培养基孵育最长达24小时。在一些实施例中,可以将接触过制品的培养基在约15分钟和约8小时之间(包括约15分钟和约8小时)孵育。在一些实施例中,可以将接触过制品的培养基在约30分钟和约8小时之间(包括约30分钟和约8小时)孵育。在一些实施例中,可以将接触过制品的培养基在约30分钟和约5小时之间(包括约30分钟和约5小时)孵育。在一些实施例中,可以将接触过制品的培养基在约1小时和约5小时之间(包括约1小时和约5小时)孵育。在一些实施例中,可以将接触过制品的培养基在约2小时和约5小时之间(包括约2小时和约5小时)孵育。在一些实施例中,可以将接触过制品的培养基在约2小时和约4小时之间(包括约2小时和约4小时)孵育。图4示出了将检测制品放置为与图3的培养装置中的培养(生长)基接触后该培养装置的俯视图。该培养装置具有菌落在其上和/或其中生长的培养基482。如图2中所示,指示微生物菌落484存在,并将第一指示系统从第一状态(深灰色)变为第二状态(浅灰色),从而在指示微生物菌落484周围形成一个明显晕圈486。图4中还示出了靶微生物菌落485,其看起来比指示微生物菌落484更大。这可能例如归因于第二指示系统从第一状态向第二状态的转变。在一些实施例中,第二指示系统可以是可沉淀的显色酶底物(如,5-溴-4-氯-3-吲哚基-β-D-葡糖苷酸),其中与靶微生物反应时,所述可沉淀的显色酶底物可以使菌落变成蓝色并使菌落显得略微较大。靶微生物菌落485也已与第一指示系统反应,并具有围绕自身的晕圈486。本发明的方法还可以任选地包括对某类型微生物计数的步骤。对某类型微生物计数包括计数特定类型的微生物的多个菌落(或菌落形成单位)。对菌落形成单位的计数值可以用来估算每克(或每毫升)原始样品中微生物的数目。可以将对菌落形成单位的计数值与规范比较,以便例如确定原始样品是否符合质量标准。在一些实施例中,可以对某一特定类型的微生物(如,指示微生物、靶微生物)的全部计数。在一些实施例中,可以对某一特定类型微生物的部分(如,最多至预定的阈值)计数。在一些实施例中,对某一类型的微生物计数包括对指示微生物的数目计数。在一些实施例中,对某一类型的微生物计数包括对靶微生物的数目计数。在一些实施例中,对某一类型的微生物计数包括对指示微生物的数目计数和对靶微生物的数目计数。在一些实施例中,对某一类型的微生物计数可以包括使用成像设备对该微生物计数。实施例实施例1是检测靶微生物存在或不存在的方法,其包括:提供:培养装置,其包括含有经选择以促进预定指示微生物生长的成分的培养基;检测制品,其包含第一指示系统,所述第一指示系统经选择以检测靶微生物;和样品;用所述样品接种所述培养装置;对所述已接种的培养装置孵育一段足够允许所述指示微生物生长的时间;观察所述培养装置至少一种指示微生物存在的指示;使所述孵育的培养装置的所述培养基与所述检测制品接触;和观察接触过所述制品的培养装置,以检测所述第一指示系统从第一状态到第二状态的转变。实施例2是实施例1的方法,其中如果存在第一指示系统从第一状态到第二状态的转变,则表明至少一种靶微生物的存在。实施例3是实施例1的方法,其中如果不存在第一指示系统从第一状态到第二状态的转变,则表明至少一种靶微生物的存在。实施例4是前述实施例中任一个的方法,该方法还包括提供第二指示系统并将第二指示系统放置为与培养基液体连通,其中观察培养装置至少一种指示微生物存在的指示包括检测第二指示系统从第一状态到第二状态的转变。实施例5是前述实施例中任一个的方法,其中提供培养装置还包括提供包含水凝胶或一种干燥、可溶于冷水的胶凝剂的培养装置。实施例6是前述实施例中任一个的方法,其中只有当观察到至少一种指示微生物存在的指示时,才将培养基与检测制品接触。实施例7是前述实施例中任一个的方法,其中提供培养装置还包括提供包含第二指示系统的培养装置。实施例8是实施例1至7中任一个的方法,其中提供培养基包括提供经选择以促进肠杆菌科微生物生长的培养基,其中提供检测制品包括提供检测沙门氏菌属微生物的检测制品。实施例9是实施例8的方法,其中第一指示系统包括检测α-半乳醣苷酶或辛酸酯酶的酶活性的试剂。实施例10是实施例1至7中任一个的方法,其中提供培养基包括提供经选择以促进肠杆菌科微生物生长的培养基,其中提供检测制品包括提供检测志贺氏杆菌属微生物的检测制品。实施例11是实施例10的方法,其中第一指示系统包括检测β-葡萄糖苷酶、β-岩藻糖苷酶、N-乙酰基-β-半乳糖胺酶或前述任意两种或更多种酶活性的组合的试剂。实施例12是实施例1至7中任一个的方法,其中提供培养基包括提供经选择以促进肠杆菌科微生物生长的培养基,其中提供检测制品包括提供检测阪崎肠杆菌属微生物的检测制品。实施例13是实施例12的方法,其中第一指示系统包括检测α-葡萄糖苷酶和/或β-纤维二糖糖苷酶的酶活性的试剂。实施例14是实施例1至7中任一个的方法,其中提供培养基包括提供经选择以促进肠杆菌科微生物生长的培养基,其中提供检测制品包括提供检测大肠杆菌的检测制品。实施例15是实施例14的方法,其中第一指示系统包括检测β-葡糖苷酸酶的酶活性的试剂。实施例16是实施例1至7中任一个的方法,其中提供培养基包括提供经选择以促进大肠菌微生物生长的培养基,其中提供检测制品包括提供检测大肠杆菌的检测制品。实施例17是实施例16的方法,其中第一指示系统包括检测β-葡糖苷酸酶的酶活性的试剂。实施例18是实施例1至7中任一个的方法,其中提供培养基包括提供经选择以促进李斯特氏菌属微生物生长的培养基,其中提供检测制品包括提供检测单核细胞增多性李斯特菌的检测制品。实施例19是实施例18的方法,其中第一指示系统包括检测α-吡喃甘露糖苷酶和/或磷脂酰肌醇特异性磷脂酶C的酶活性的试剂。实施例20是实施例1至19中任一个的方法,其中观察培养装置或接触过制品的培养装置包括用肉眼观察培养装置。实施例21是实施例1至19中任一个的方法,其中观察培养装置或接触过所述制品的培养装置包括用成像装置观察培养装置。实施例22是前述实施例中任一个的方法,还包括对培养装置中的指示微生物菌落形成单位计数。实施例23是前述实施例中任一个的方法,还包括对培养装置中的靶微生物菌落形成单位计数。实施例24是前述实施例中任一个的方法,其中将培养基与检测制品接触还包括在预定温度下将培养基与检测制品接触。实施例25是一种检测制品,其包括具有上主表面和下主表面的基底,以及包括置于所述主表面的至少一个上的第一指示系统的涂层,其中第一指示系统由α-吡喃半乳糖苷或辛酸酯酶的酶活性从第一状态转变为第二状态。实施例26是实施例25的制品,其中第一指示系统包含指示剂,所述指示剂选自5-溴-4-氯-3-吲哚基-α-D-吡喃半乳糖苷、5-溴-6-氯-3-吲哚基-辛酸、5-溴-4-氯-3-吲哚基-辛酸以及前述指示剂的任意两种或更多种的组合。实施例27是一种检测制品,其包括具有上主表面和下主表面的基底,以及涂覆于所述主表面的至少一个上的第一指示系统,其中第一指示系统由β-葡糖苷酸酶的酶活性从第一状态转变为第二状态。实施例28是实施例27的制品,其中第一指示系统包含指示剂,所述指示剂选自5-溴-4-氯-3-吲哚基-β-D-葡糖醛酸、对硝基苯基-β-葡糖苷酸、对硝基苯基-2,3,4-三氧-乙酰基-β-葡糖醛酸甲酯、酚酞葡糖醛酸、酚酞单-P-葡糖醛酸、萘基-AS-BI-β-D-葡糖苷酸、4-甲基伞形酮基β-D-葡糖苷酸、8-羟基喹啉-β-D-葡糖醛酸的钠盐、2-萘基-β-D-葡糖醛酸的钠盐、4-硝基苯基-β-D-葡糖醛酸的钠盐、酚酞-β-D-葡糖醛酸的钠盐一水合物、5-溴-4-氯-3-吲哚氧基-β-D-葡糖醛酸的环己基铵盐、3-吲哚氧基-β-D-葡糖醛酸的环己基铵盐、3-吲哚氧基-β-D-葡糖醛酸的钠盐、5-溴-6-氯-3-吲哚氧基-β-D-葡糖醛酸的环己基铵盐、5-溴-4-氯-3-吲哚氧基-β-D-葡糖醛酸的无水钠盐、5-溴-4-氯-3-吲哚氧基-β-D-葡糖醛酸的钠盐三水合物,以及前述指示剂的任意两种或更多种的组合。实施例29是一种检测制品,其包括:具有上主表面和下主表面的基底,以及涂覆于所述主表面的至少一个上的第一指示系统,其中第一指示系统由α-吡喃甘露糖苷酶或磷脂酰肌醇特异性磷脂酶C的酶活性从第一状态转变为第二状态。实施例30是实施例29的制品,其中第一指示系统包含指示剂,所述指示剂选自5-溴-4-氯-3-吲哚氧基-肌醇-1-磷酸酯、5-溴-6-氯-3-吲哚氧基-肌醇-1-磷酸酯、5-溴-6-氯-3-吲哚氧基-肌醇-1-磷酸酯的铵盐、4-甲基伞形酮基肌醇-1-磷酸酯、N-甲基-吗啉盐、3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-3-吲哚氧基-α-D-吡喃甘露糖苷、4-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、5-碘-3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-4-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、氯-3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-6-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、6-溴-3-吲哚氧基-α-D-吡喃甘露糖苷、6-氯-3-吲哚氧基-α-D-吡喃甘露糖苷、6-氟-3-吲哚氧基-α-D-吡喃甘露糖苷、4,6-二氯-3-吲哚氧基-α-D-吡喃甘露糖苷、6,7-二氯-3-吲哚氧基-α-D-吡喃甘露糖苷、4,6,7-三氯-3-吲哚氧基-α-D-吡喃甘露糖苷、5-溴-4-氯-N-甲基--α-D-吡喃甘露糖苷、3-吲哚氧基-α-D-吡喃甘露糖苷、N-甲基-3-吲哚氧基-α-D-吡喃甘露糖苷、6-溴-2-萘基-α-D-吡喃甘露糖苷、4-甲基伞形酮基-α-D-吡喃甘露糖苷、4-硝基苯基-α-D-吡喃甘露糖苷以及前述指示剂的任意两种或更多种的组合。实施例31是实施例25至30中任一个的制品,其还包括粘合剂层,其中第一指示系统的至少一部分设置在粘合剂层之上或之中。实施例32是实施例25至31中任一个的制品,其中第一指示系统被涂覆在两个主表面上。实施例33是实施例25至32中任一个的制品,其中基底选自聚合物膜、纸张、无纺布、膜滤器和前述物质中任一种的衍生物。实施例34是实施例25至33中任一个的制品,其中涂层包含粘结剂。实例材料磷酸二氢钾(KH2PO4)–新泽西州菲利普斯堡的MallinkrodtBaker公司(MallinkrodtBaker,Inc.;Phillipsburg,NJ)磷酸氢二钾(K2HPO4)–俄亥俄州索伦的AMRESCO公司(AMRESCO;Solon,OH)瓜耳胶–M150guarMEYPROGATgum,MeyhallChemicalAG5-溴-4-氯-3-吲哚基-α-D-吡喃半乳糖苷–BIOSYNTHAG,Rietlistr,Switzerland聚酯膜–2.91密耳(0.074mm)透明聚酯膜BCIG–5-溴-4-氯-3-吲哚基-β-D-葡糖苷酸环己基铵盐–BIOSYNTHAG甲基葡糖苷酸–1-O-甲基-β-D-葡糖醛酸钠盐–BIOSYNTHAG实例1:检测沙门氏菌靶微生物的检测制品的制备。通过以下方式制备涂层组合物:在4L容器中,向1000mL经反渗透处理的水中加入13.6g磷酸二氢钾,使用气动搅拌机搅拌约1.5分钟,然后加入3.4g的磷酸氢二钾,并搅拌约2分钟。然后慢慢加入11g的瓜耳胶并搅拌约5分钟。将容器盖住并在电炉上加热,同时搅拌,直至混合物达到80℃。将容器从电炉上取下,并且在室温搅拌约15分钟,然后冷藏直至混合物是约40℃。通过以下方式制备指示剂悬浮液:将5-溴-4-氯-3-吲哚基-α-D-吡喃半乳糖苷加入10mL经反渗透处理的水中,然后将混合物涡旋以形成均匀的悬浮液。在冷却涂层组合物至约40℃之后,将指示剂悬浮液混入涂层组合物中。然后将混合物从冰箱中取出并允许其达到接近室温。将混合物在10英寸(25.4cm)×54英寸(137.2cm)的聚酯膜薄片上手工刮涂成宽约8英寸(20.32cm)以获得一个重量约0.150克每24平方英寸(9.69g/m2,“盘1A”)的干燥涂层。重复该涂覆工序,以提供具有0.185g/24平方英寸(11.95g/m2,“盘1B”)、0.240g/24平方英寸(15.5g/m2,“盘1C”)以及0.30g/24平方英寸(19.38g/m2,“盘1D”)的干燥涂层重量的涂覆膜。将涂覆的薄片在设置为230℉(110℃)的烘箱中干燥5至15分钟直至干燥。将涂覆的薄片保存在塑料袋中。将薄片各自切成4英寸(10.2cm)的方块,并且这些方块在测试前一直保存在塑料袋中。实例2:用检测制品检测沙门氏菌靶微生物。将从琼脂划线培养皿分离的肠沙门氏菌(Salmonellaenterica)Agona((FSD#140)菌落接种至5mL胰酶大豆肉汤,并在35℃过夜孵育。将过夜的培养物用Butterfield磷酸盐稀释液稀释以获得具有约每毫升100个菌落形成单位(CFU)的悬液。按照生产商的说明,将四个细菌培养装置(3MTMPetrifilmTM肠杆菌计数平板;明尼苏达州圣保罗的3M公司(3MCompany;St.PaulMN))各自用1mL细菌悬液进行接种,并在35℃孵育22–24小时。检查所述装置并且红色菌落(直径约1mm)由黄色酸性区域(直径约24mm)环绕。将培养平板的顶部膜小心地提走离开底部膜以便暴露培养皿中的培养基。将两个方形的盘(盘1A)插入培养皿中。将第一个盘在其涂覆表面抵住与底部膜粘附的培养基的情况下放置(即,面朝下)。第二个盘放在第一个盘上面,同时第二个盘的涂覆侧面背离底部膜(即,面朝上)。将顶部膜小心地放下(采用“旋转”移动方式),以便使与顶部膜粘附的培养基与第二个盘的涂覆侧面接触。施加轻微指压至封闭平板的顶部膜的外表面,以确保培养装置的表面和所述盘的涂覆表面之间接触。使用盘1B、1C和1D重复该工序。将带有这些盘的装置在35℃孵育,并且每小时检测一次,持续5小时。在每次检查期间,拍摄数字图像。这些图像显示,在约3小时内,每个培养皿上的所有菌落都从蓝色变为蓝绿色,原因在于5-溴-4-氯-3-吲哚基-α-D-吡喃半乳糖苷由菌落中的微生物水解。实例3:检测大肠杆菌靶微生物的检测制品的制备。根据实例1的过程制备涂层组合物。通过以下方式制备悬浮液:在室温将0.4克1-O-甲基-β-D-葡糖醛酸(钠盐)和2.0克5-溴-4-氯-3-吲哚氧基-β-D-葡糖醛酸在使用磁力搅拌棒匀速搅拌的情况下加入烧杯中的50mL经反渗透处理的水中。将包含指示剂悬浮液的烧杯放入冰箱中。当所述涂层组合物冷却到约40℃时,将其从冰箱中取出,并随后用气动搅拌机搅拌,直至涡旋形成。将所述指示剂悬浮液加入所述涂层组合物并搅拌约20分钟。然后将所得的检测培养基盖住并冷藏直至待用。按照实例1所述的工序制备和保存盘2A、2B、2C和2D,它们具有以下干涂层重量:0.150克每24平方英寸(9.69g/m2,“盘2A”)、0.185g/24平方英寸(11.95g/m2,“盘2B”)、0.240g/24平方英寸(15.5g/m2,“盘2C”)以及0.30g/24平方英寸(19.38g/m2,“盘2D”)。实例4:使用检测制品检测大肠杆菌靶微生物。将分离的大肠杆菌菌株(ATCC#51813)的菌落接种至5mL胰酶大豆肉汤中并在35℃孵育20小时以提供具有细菌浓度约2×109cfu/mL的过夜培养物。将所述培养物涡旋并将10微升所述培养物加入99mL的Butterfields磷酸盐缓冲液(稀释液1)中。将该悬浮液剧烈震荡约20秒,并将5微升稀释液加入另外的99mL的Butterfields磷酸盐缓冲液中(稀释液2)。将这种悬浮液剧烈震荡约20秒。按照生产商的说明,将16个细菌培养装置(3MTMPetrifilmTM高灵敏度大肠菌计数平板;明尼苏达州圣保罗的3M公司(3MCompany;St.PaulMN)各自接种5mL稀释液2。将四个培养装置在4个不同的温度(分别为32℃、35℃、37℃和44.5℃)孵育22-24小时。将培养装置从细菌培养器中取出,用数码相机记录每个计数平板的数字图像。每个菌落在高灵敏度大肠菌计数平板上具有大肠菌菌落的特征外观(即,红色菌落以约1mm直径为中心,周围环绕一个直径约2-3mm的红色区域)。将每个类型的盘(即,盘2A,、盘2B、盘2C和盘2D)按实例2所述分别放入已经在各自温度孵育的分立培养装置中。随后将带所述盘的培养装置在其相应的孵育温度孵育5小时。在5小时孵育时间的每一小时后,记录每个培养装置的数字图像录。在孵育包含盘的培养装置后,观察它们。在培养装置与盘接触并孵育5小时之后,所有平板上的每个红色菌落均变成蓝色。观察到在较高温度与盘孵育的平板比在较低温度孵育的平板在更早时间具有蓝色菌落。还观察到接受涂层重量更大的检测制品的平板比接受涂层重量更小的检测制品的平板在更早时间具有蓝色菌落。实例5:制备用于培养李斯特氏菌属指示微生物的培养装置的预测性实例。用表3中的材料制备培养基组合物。□蛋白胨、胰蛋白胨、酪蛋白氨基酸和酵母提取物可以例如购自马里兰州斯帕克斯的BD公司(BectonDickinson(Sparks,MD))。LabLemco粉/牛肉膏可以例如购自英国汉普郡(Hampshire,UK)的Oxoid。牛血清白蛋白可以例如购自佐治亚州诺克罗斯(Norcross,GA)的Serologicals公司。β-D-葡糖苷指示剂可以例如购自BioSynthAG。头孢他啶可以例如购自葛兰素威康公司(GlaxoWellcome)。表3.组分材料克1□蛋白胨6.02胰蛋白胨19.23酪蛋白氨基酸12.04LabLemco粉/牛肉膏10.05葡萄糖5.06酵母提取物14.07磷酸氢二钾9.08氯化锂15.09牛血清白蛋白6.010瓜耳胶1011萘啶酸的钠盐0.0212橙红-β-D-葡糖苷0.0613品红-β-D-葡糖苷0.06614五水合头孢他啶0.027通过以下方式制备第一混合物:将(表3中所示的)组分1-10添加至1000mL经反渗透处理的水,混合以获得均匀的悬浮液,加热混合物直至它达到80℃,并且随后冷却至室温。在第一混合物冷却的同时,通过在10毫升经反渗透处理的水中混合(表1中所示的)组分11-14制备第二混合物。将第二混合物涡旋以提供均匀的混合物,其中将所述混合物添加至第一混合物,并且随后进一步混合以提供均匀的培养基。然后将培养基冷藏18-24h(2-8℃)。允许冷藏后的培养基加温至室温,并且随后刮涂到一片2.6密耳(0.074mm)厚的透明聚酯薄膜上并在约200℉干燥5至10分钟。调整刮刀间隙以提供约515-540mg/24平方英寸(33.27-34.88g/m2)的干涂层重量。将18密耳(0.46mm)厚的闭孔聚苯乙烯泡沫板层合到压敏粘合剂转移带。从泡沫板冲切出直径2英寸的圆形开孔,并且然后将泡沫板层合到聚酯膜的涂覆培养基的侧面,以便形成与美国专利No.4,565,783的图1中所示的培养装置底部相似的结构。通过以下方式完成培养装置的制备:从3MTMPetrifilmTM金黄色葡萄球菌快速检验计数平板移走顶部膜,并将其附连至具有双面涂覆的粘合带的泡沫聚苯乙烯板上,从而制备与美国专利No.4,565,783的图1中所示的完整培养装置类似的装置。实例6:制备检测单核细胞增多性李斯特菌靶微生物的检测制品的预测性实例。通过以下方式产生涂层组合物:在1000mL经反渗透处理的水中混合瓜耳胶、磷酸二钠和磷酸氢钾(表4中所示),以便形成如实例1中所述的均匀悬浮液。表4材料克5-溴-4-氯-3-吲哚氧基-肌醇-1-磷酸酯0.60瓜耳胶10磷酸氢二钠8.0磷酸二氢钾4.0将盛有涂层组合物的容器盖住,并且将分散体持续混合,同时将其加热至80℃。然后,停止对其加热并且在室温持续地混合。通过以下方式制备指示剂悬浮液:将5-溴-4-氯-3-吲哚氧基-肌醇-1-磷酸酯(可以例如购自BiosynthAG)添加至10mL经反渗透处理的水并涡旋混合以形成均匀的悬浮液。在涂层组合物冷却至室温后,将所述指示剂悬浮液混入涂层组合物中。将混合物盖住并冷藏18–22小时。将涂层混合物从冰箱取出并允许其加温至约室温。按照实例1所述的工序,用所述混合物刮涂2.9密耳(0.074mm)的聚酯薄膜以获具有约80-95mg/24平方英寸(5.17-6.14g/m2)干涂层重量的薄膜。将所述聚酯膜翻面并以相同方式在另一侧面上刮涂。随后将两面上均涂覆的薄膜冲切成具有约2英寸直径的圆盘。实例7:检测单核细胞增多性李斯特菌靶微生物的预测性实例采用标准的样品采集和富集肉汤工序(如,如美国农业部、食品安全检查局或细菌性分析手册所规定)从食物样品或环境样品中制备富集培养物。在Butterfield稀释液中制备培养物的八份10倍连续稀释物。将1毫升每种稀释液接种至如实例5所述的各个培养装置中。然后将所述装置在35-37℃孵育18-30小时。对所述装置检查指示李斯特氏菌属(指示单核细胞增多性李斯特菌存在的指示微生物群)的典型菌落形态(如,直径约0.5至1.5mm的红色菌落)。如果孵育后的培养装置中观察到典型着色的菌落,则使用者还可可以插入检测制品以检测区分这些菌落。将所述培养装置的顶部膜轻柔回拉,并且将实例6中所述的2英寸检测制品放入与培养基接触。将顶部膜重新盖上,让其与检测制品接触。可以用轻指压力压迫顶部膜,以使所述装置的菌落生长区域与检测制品接触。在35-37℃孵育所述装置最长至5小时,并对定期(如每小时一次)查看菌落中蓝色至蓝绿色的存在。蓝色至蓝绿色的菌落表明存在单核细胞增多性李斯特菌。实例8:检测单核细胞增多性李斯特菌靶微生物的方法制备薄膜培养装置-肉汤涂覆的基底:在不锈钢的烧杯中将除瓜耳胶至外的表5中所示的所有组分与970毫升去离子水混合。在混合的同时,添加瓜耳胶并且将全部混合物加热至80℃。将加热的全部混合物搅拌约15分钟,盖起来,并在冰箱中冷却过夜。在涂覆之前,将20毫升补充物A(牛血清白蛋白,3.2g/20mL)和10毫升补充物B(五水合头孢他啶,40mg/10mL)与涂层混合物混合。采用15密耳(0.38mm)间隙,将含有补充物的涂层混合物刮涂到透明聚酯薄膜(2.91密耳(0.07mm)厚)上。将涂覆的聚酯薄膜放入设定在210℃的烘箱中干燥约8分钟。干燥的涂覆的混合物的最终涂层重量为0.308g/24平方英寸(0.308g/154.8cm2)。将带有直径2英寸(5.08cm)的开口的泡沫聚乙烯垫片(20密耳(0.51mm)厚)粘附至涂覆的干燥膜上,如通过引用方式完整并入本文的美国专利No.5,601,998的实例1中所述。将基底切成约4英寸(10.2cm)×4英寸(10.2cm)的片,每片具有一个带5cm开口的垫片,所述开口框住干燥、涂覆有肉汤的组合物的圆形区域。表5:涂层混合物的组成组分材料克1□蛋白胨No.33.1272III型酪蛋白胨9.63酪蛋白氨基酸6.04肉胨(猪肉)5.05葡萄糖2.56酵母提取物7.07磷酸氢二钾4.58氯化锂9.010瓜耳胶1211萘啶酸的钠盐0.01制备薄膜培养装置–粉末涂覆的基底:聚乙烯涂层纸(0.13mm厚)购自纽约州珀拉斯凯(Pulaski,NY)的SchoellerPaper。6-氯-3-吲哚氧基-β-D-吡喃葡萄糖苷(X-gluc,部件编号B5020)购自BiosynthAG(Staad,Switzerland)。将139.1mg的X-gluc与200克粘合剂(丙烯酸异辛酯和丙烯酰胺以96:4的重量比形成的共聚物)充分混合。然后将所述粘合剂混合物刮涂至聚乙烯涂层纸上并且在烘箱中在210℃加热,以得到重量0.237g/24平方英寸(0.237g/154.8cm2)的干涂层。将粘合剂涂覆的膜用事先使用环氧乙烷消毒的一层瓜耳胶涂覆。将多余的瓜耳胶抖落并且将粉末涂覆的基底切割成约4英寸(10.2cm)×4英寸(10.2cm)的片。薄膜培养装置的组装:沿着每个涂有肉汤的基底上的泡沫聚乙烯垫片的一边粘上双面胶(明尼苏达州圣保罗的3M公司(3MCompany,St.Paul,MN))。将粉末涂覆的基底(与朝向垫片的粉末涂覆侧面)对齐以便叠加涂覆肉汤的基底,并且将粉末涂覆的侧面与双面胶粘附以便形成组装的培养装置。检测制品的制备:通过以下方式制备涂层混合物:将下列组分掺入1000毫升去离子水:13.0克瓜耳胶和溶解于2.0mL二甲基亚砜(DMSO)中的141.3毫克5-溴-4-氯-3-吲哚氧基-β-肌醇-1-磷酸酯溶液(X-IP,部件号B7404-P00,购自BiosynthAG)。将混合物在加盖的烧杯中加热至80℃,同时混合,在这个温度搅拌额外15分钟,并且然后在冰箱中冷却。涂覆前,将混合物加温至室温。将该混合物刮涂到(25密耳(0.64mm)间隙)上述的透明聚酯膜上。将涂覆的膜在烘箱中于210℃干燥以得到0.092g/24平方英寸(0.092g/154.8cm2)的干涂层重量。将涂覆的基底切割成约4英寸(10.2cm)×4英寸(10.2cm)的片。检测方法。将表6中示出的每种细菌的纯菌落接种至含有酵母提取物的单独胰酶大豆肉汤(TSBYE)管中。将所述管在35℃孵育18-24小时。将(如本实例中所述那样制备的)各个培养装置打开,并且通过移取1.5mL的Butterfield缓冲液至泡沫聚乙烯垫片限定的脱水肉汤的圆形区域内,使培养装置水合。将培养装置封闭,使粉末涂层纸与缓冲液接触并使缓冲液在垫片限定的整个圆形生长区域范围内扩散。允许水合板在室温静置1小时。通过平板划线技术,将10微升每个过夜的李斯特氏菌属培养物分别接种至已水合的各个培养装置中,并将接种的培养装置在35℃在拉锁密封型塑料袋中孵育24小时。孵育后,观察菌落,并且在表6中描述菌落的外观。将孵育的培养平板打开,使含有细菌菌落的水合凝胶保持与聚丙烯涂层的纸基底附接。将(本实例中所述的)检测制品置于所述培养装置中,从而检测制品的涂覆侧面朝向含有菌落的水合凝胶。然后,将所述培养装置封闭,使检测制品的涂覆侧面与含有细菌菌落的水合凝胶接触。然后,在35℃孵育所述培养装置并观察。表6中报告观察结果。结果表明,仅单核细胞增多性李斯特菌微生物与来自所述检测制品的酶底物指示剂(5-溴-4-氯-3-吲哚氧基-β-肌醇-1-磷酸酯)反应(即,水解)。表6:包含李斯特氏菌属微生物的培养装置的观察结果。1–孵育24小时后的菌落外观2–在检测制品与培养装置生长区域接触后15-60分钟内的菌落外观。在不脱离本发明的精神和范围的前提下,可进行各种修改。这些和其他实施例均在所附权利要求书的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1