成刚菌属嗜甲基短杆菌及其在降解磺酰脲除草剂的应用的制作方法
本发明涉及微生物领域,具体涉及一种成刚菌属嗜甲基短杆菌及其在降解磺酰脲除草剂中的应用。
背景技术:
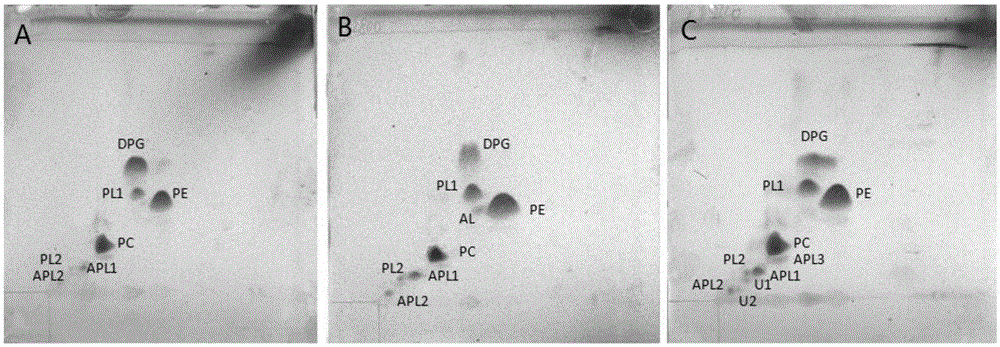
:磺酰脲除草剂最早是由美国杜邦公司于20世纪70年代末研制开发出来的,由于除草谱广、高效(2-75g/公顷)、对哺乳动物低毒等优点,该类除草剂一经使用即获得了广泛的关注。迄今为止,美国、日本、瑞士、韩国等开发并商品化的磺酰脲除草剂已有近40余种,是目前世界上最大的一类除草剂,被广泛用于小麦、水稻、玉米、大豆等作物的一年生或多年生阔叶杂草的防治。磺酰脲除草剂的分子结构由芳环、脲桥和杂环三部分组成,其化学结构式如式1所示。其中,X为N或CH;Y为脂肪酸、芳香族或杂环;R为H或烷基;R1为CH3、OCH2CH3、OCH2、CF3、NHCH3、Cl、NCH3或CH3;和,R2为CH3、OCH3、OCH2CH3、OCH2CF3、NHCH3、Cl或NCH3。氯嘧磺隆(Chlorimuron-ethyl)是由美国杜邦公司于20世纪80年代研制的一种磺酰脲除草剂,其化学结构式如式2所示,化学名称为2[[[[4-氯-6-甲氧基嘧啶-2]氨基甲酰基]氨基]磺酰基]苯甲酸乙酯。氯嘧磺隆的纯品为白色固体粉末,熔点181℃,密度1.51g/cm3(25℃),蒸汽压0.49nPa,在水中的 半衰期为17-25天,在25℃水中溶解度11mg/L(pH5);1.2g/L(pH7)。此外,氯嘧磺隆还可溶于二甲基甲酰胺、二氧六环,微溶于丙酮、乙醇,难溶于苯等非极性溶剂。化学名称:2-[(4-甲氧基-6-甲基-1,3,5-三嗪基-2-基)脲基磺酰基]苯甲酸甲酯。其理化性质为无色晶体(原药灰白色固体,略带酯味),熔点158℃,密度1.47g/cm3。25℃时在水中的溶解度:pH5时为0.55g/L,pH7时为2.79g/L,pH9时为213g/L。20℃时在有机溶剂中的溶解度为:二甲苯0.58glL,己烷0.79g/L,乙醇2.3g/L,甲醇7.3g/L,丙酮36g/L,二氯甲烷121g/L。140℃以下在空气中稳定,25℃时在中性和碱性介质中稳定。其化学结构式如式3所示:化学名,2-[N-(4-甲氧基-6-甲基-1,3,5-三嗪-2-基)-N-甲基氨基甲酰胺基磺酰基]苯甲酸甲酯,本品为白色固体,m.p.141℃,蒸气压0.036×10-3Pa(25℃)。在pH值4、pH值5、pH值6时,在水中的溶解度分别为28mg/L、50mg/L、280mg/L;在有机溶剂中溶解度为:丙酮43.8mg/L、乙腈54.2mg/L、四氯化碳3.12mg/L、乙酸乙酯17.5mg/L、己烷0.028mg/L。分配系数(正辛醇/水)0.36(pH=7)。常温贮存稳定,对光稳定,在45℃时水解,pH值8~10稳定, 但在pH<7或>12时迅速水解。土壤中半衰期1~7d。其化学结构式如式4所示:磺酰脲除草剂的广泛应用不仅为粮食的增产增收提供了重要保障,还大大降低了人工除草的强度及成本。然而,长期过度使用该类除草剂造成的环境安全问题也日益受到人们的关注。特别是对后茬敏感作物的药害问题,不仅限制了此类除草剂的应用,同时也给农业生产带来巨大损失,并且造成土壤和水体的污染。90年代以来,部分地区大面积使用氯嘧磺隆、甲磺隆、绿磺隆、胺苯磺隆、普施特等长残效除草剂,其在土壤中持续积累,在轮作农田中对后茬敏感作物造成严重药害,导致作物减产甚至绝产。此外,由于磺酰脲除草剂作用的靶标是乙酰乳酸合成酶,这种酶除了在植物体内含有外同样存在于微生物体内。因此,该类除草剂同样会对土壤和水体中的微生物造成药害,而微生物往往在土壤的物质和能量循环中发挥着重要作用,是评价土壤质量的重要指标。从现有文献报道来看,磺酰脲除草剂对土壤微生物的影响作用随除草剂种类、施加量的不同存在较大差异。但总体而言,该类除草剂对土壤微生物的数量,结构和功能都存在潜在的影响,特别是对氮循环相关的微生物的影响更为显著。长期过度施用磺酰脲除草剂不仅对后茬敏感作物及土壤微生物产生药害、使杂草产生抗性,残留的农药还会随雨水进入地下,污染地下水源,直接对人类的生存环境和身体健康构成威胁。目前,除了禁止部分长残留磺酰脲除草剂的生产使用外,还没有有效方法用于修复磺酰脲除草剂污染土壤。已有的研究表明微生物在土壤中氯嘧磺 隆的分解过程中扮演着重要角色。然而,目前的研究多集中于对修复剂株的筛选,所得到的降解数据也是基于实验室纯培养条件下,鲜有将微生物用于土壤修复实验的报道。技术实现要素:本发明所要解决的技术问题是,针对目前缺乏用于土壤修复或降解磺酰脲除草剂的微生物的不足,提供一种成刚菌属嗜甲基短杆菌(Chenggangellamethylivorans)及其在降解磺酰脲除草剂或修复磺酰脲除草剂污染的土壤中的应用。还提供一种包括所述的成刚菌属嗜甲基短杆菌的磺酰脲除草剂污染的土壤的修复剂。本发明的技术方案之一是:一种成刚菌属嗜甲基短杆菌(Chenggangellamethylivorans),其保藏在中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏号为:CGMCCNo.11649。从南京农药厂污水处理池中的污泥中分离获得所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649。所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649在含甲醇的无机盐培养基中生长良好,可用于降解磺酰脲除草剂或修复磺酰脲除草剂污染的土壤。对该菌株进行鉴定,结果为Chenggangellamethylivorans,命名为IAE-B-2015。该菌株已于2015年11月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心,并收到保藏中心登记入册编号CGMCCNo.11649。本发明的技术方案之二是,一种制备所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649的方法,其包括以下的步骤:在培养基中培养所述的嗜甲基短杆菌CGMCCNo.11649即可。其中,所述的培养基为本领域常规的培养基,能够生长所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649即可,较佳地为PBMM或TY培养基,更佳地为PBMM培养基。所述培养的温度为本领域常规的温度,能够生长所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649即可,较佳地为28~32℃,更 佳地为30℃。所述培养的时间为本领域常规的时间,较佳地为48~72小时,更佳地为60小时。所述培养的pH为本领域常规的pH,能够生长所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649即可,较佳地为6.8~7.5,更佳地为7.0。较佳地,所述的培养前还包括使用种子培养基进行种子培养的步骤。所述的种子培养为本领域常规的种子培养。所述的种子培养基为本领域常规的种子培养基,较佳地为PBMM或TY培养基,更佳地为PBMM培养基。所述种子培养的时间为本领域常规的时间,较佳地为48~72小时,更佳地为60小时。所述种子培养的温度为本领域常规的温度,较佳地为28~32℃。所述种子培养的接种量为本领域常规的接种量,较佳地为1%,所述百分比为体积百分比。本发明提供的技术方案之三是:一种所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649在降解磺酰脲除草剂中的应用。较佳地,所述的磺酰脲除草剂的化学结构式如式1所示,其中X为N或CH;Y为脂肪酸、芳香族或杂环;R为H或烷基;R1为CH3、OCH2CH3、OCH2、CF3、NHCH3、Cl、NCH3或CH3;和,R2为CH3、OCH3、OCH2CH3、OCH2CF3、NHCH3、Cl或NCH3,本发明所述的磺酰脲除草剂更佳地为氯嘧磺隆、甲磺隆、苯磺隆、氯磺隆或醚磺隆,最佳地为氯嘧磺隆。本发明提供的技术方案之四是:所述的成刚菌属嗜甲基短杆菌CGMCC No.11649在修复磺酰脲除草剂污染的土壤中的应用。较佳地,所述的磺酰脲除草剂的化学结构式如式1所示,其中X为N或CH;Y为脂肪酸、芳香族或杂环;R为H或烷基;R1为CH3、OCH2CH3、OCH2、CF3、NHCH3、Cl、NCH3或CH3;和,R2为CH3、OCH3、OCH2CH3、OCH2CF3、NHCH3、Cl或NCH3,所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649可将所述的磺酰脲除草剂降解为芳基磺酰胺、氨基杂环及其前体酸,降解产物对后茬作物及土壤微生物无明显毒性,达到修复磺酰脲除草剂污染的土壤的效果。本发明提供的技术方案之五是:一种磺酰脲除草剂污染的土壤的修复剂,其包括所述的嗜甲基短杆菌CGMCCNo.11649。较佳地,所述的磺酰脲除草剂的化学结构式如式1所示,其中X为N或CH;Y为脂肪酸、芳香族或杂环;R为H或烷基;R1为CH3、OCH2CH3、OCH2、CF3、NHCH3、Cl、NCH3或CH3;和,R2为CH3、OCH3、OCH2CH3、OCH2CF3、NHCH3、Cl或NCH3所述的修复剂的活性物质为所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649。较佳地,所述的修复剂还包括载体。所述的载体为本领域常见的载体,能够负载所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649,并且使所述的修复剂发挥修复磺酰脲除草剂污染的土壤即可。较佳地,所述的修复剂为液体修复剂,所述的载体为PBS缓冲液。较佳地,所述液体修复剂的制备方法是,将所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649在PBMM培养基中培养后,用PBS缓冲液重悬菌体,得浓缩液体菌剂;将所述浓缩液体菌剂加入PBMM培养基即可。更佳地,所述液体修复剂中所述的成刚菌属嗜甲基短杆菌CGMCCNo.11649的含量为2~6×109个/mL。更佳地,所述液体菌剂按5~10%(v/v)加入PBMM培养基。较佳地,所述的修复剂为所述浓缩液体菌剂。较佳地,所述的修复剂为固体修复剂,所述的载体为肥料基质。较佳地,所述固体修复剂的制备方法是,将上述的液体修复剂与肥料基质混合,造粒、干燥、过筛即可。其中,所述肥料基质为本领域常规的肥料基质,较佳地为将鸡粪和草炭土分别烘干、粉碎、过筛,然后混合得到。更佳地,所述造粒的造粒时间为3~10分钟,所述造粒的转速为30-50转/分钟,所述干燥的时间为1~2小时,所述过筛的直径为2.5~4.5mm。在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。本发明的积极进步效果在于:本发明提供一种成刚菌属嗜甲基短杆菌CGMCCNo.11649,其属于嗜甲基短杆菌科(Methylocystaceae),是成刚菌属嗜甲基短杆菌(Chenggangellamethylivorans),其中成刚菌属(Chenggangella)是一个新属。同时CGMCCNo.11649能安全、高效、快速的降解水体、土壤等介质中的磺酰脲除草剂残留,从而降低该类除草剂对环境造成的危害,起到修复污染土壤,保护生态环境的作用。并且,本发明提供一种含有所述成刚菌属嗜甲基短杆菌CGMCCNo.11649的磺酰脲除草 剂污染的土壤的修复剂,该修复剂使用简便、效果良好,能够降解90%以上的土壤中磺酰脲除草剂。生物材料保藏信息本发明的成刚菌属嗜甲基短杆菌(Chenggangellamethylivorans),已于2015年11月12日保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏地址:北京市朝阳区北辰西路1号院3号,邮编:100101,保藏编号为CGMCCNo.11649,培养物名称为IAE-B-2015,分类命名为Chenggangellamethylivorans。附图说明图1为成刚菌属嗜甲基短杆菌CGMCCNo.11649的扫描电镜图片。图2为成刚菌属嗜甲基短杆菌CGMCCNo.11649(图2A)和甲基孢囊菌科的模式菌株AlbibactermethylovoransDSM22840T(图2B)、MethylopilahelveticaDM9T(图2C)的磷脂组成。其中,DPG:心磷脂;PE:磷脂酰乙醇胺;PC:卵磷脂;PL:未知磷脂;APL:未知抗磷脂;AL:未知氨基脂;UL:未知极性酯。图3为成刚菌属嗜甲基短杆菌CGMCCNo.11649的NJ系统发育树。图4为成刚菌属嗜甲基短杆菌CGMCCNo.11649的ML系统发育树。图5为成刚菌属嗜甲基短杆菌CGMCCNo.11649的MP系统发育树。图6为成刚菌属嗜甲基短杆菌CGMCCNo.11649对不同磺酰脲除草剂的降解。具体实施方式下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。实施例中所述室温是本领域常规的室温,较佳地为15~30℃。实施例中所用的培养基包括:无机盐培养基:向水中添加NaNO3、(NH4)2SO4、Na2HPO4和KH2PO4,使其浓度分别为0.5g/L、1.0g/L、2.5g/L和1.0g/L,再添加1mL微量元素储存液,调节pH至7.0,121℃灭菌20min。冷却至室温后加入1mL维生素溶液和1mL钙镁溶液,即可。其中,微量元素储存液:向水中添加108mgAl2(SO4)3·18H2O、56mgCoSO4·7H2O、56mgCuSO4·5H2O、3.0gFeSO4·7H2O、611mgH3BO3、28mgKBr、56mgKI、28mgLiCl、389mgMnCl2·4H2O,、28mgNa2MoO4·2H2O、28mgNa2WO4·2H2O、58mgNiCl2·6H2O、28mgSnCl2·2H2O和34mgZnSO4·H2O,补足水至1L。维生素溶液:向水中添加200mg对氨基苯甲酸、200mg生物素、200mg叶酸、200mg烟酸、100mg泛酸钙、100mg盐酸吡哆醇、100mg核黄素、100mg硫胺素和1mg维生素B12,补足水至1L。然后用0.2μm滤膜过滤,室温储存。钙镁溶液:向水中添加30gCaCl2和20gMgCl2,补足水至1L。然后121℃灭菌20分钟,室温储存。固体无机盐培养基:与上述无机盐培养基的配制方法完全相同,除了灭菌前还加入琼脂粉,使琼脂粉的浓度为15g/L。LB培养基(1L):添加蛋白胨10g、酵母膏5g、氯化钠10g和琼脂15g,余量为水,调节pH至7.0-7.2,121℃高温灭菌30分钟。PBMM培养基:向水中添加NaNO3、(NH4)2SO4、Na2HPO4和KH2PO4,使其浓度分别为0.5g/L、1.0g/L、2.5g/L和1.0g/L,再添加1mL无机盐母液,121℃灭菌20min。待温度降至60℃时加入1mL维生素母液(0.22μm滤膜除菌)、1mL钙镁溶液(0.22μm滤膜除菌)和10mL甲醇。其中,上述微量元素储存液、维生素溶液和钙镁溶液与配制无机盐培养基所用的完全相同。实施例所用的氯嘧磺隆等磺酰脲除草剂购自SIGMA(中国,上海)。实施例1本发明新微生物的获得1)菌株富集分离:取10g污染土(该污染土取自南京农药厂污水处理池中的污泥)加入盛有100mL含2000mg/L氯嘧磺隆的无机盐培养基的250mL三角摇瓶中,30℃,180r·min-1摇床培养两周后得悬浊液。然后取10mL悬浊液接入100mL新鲜的含2000mg/L氯嘧磺隆的无机盐培养基中继续培养,连续转接4次后,取1mL菌液梯度稀释后,分别涂于含2000mg/L氯嘧磺隆的固体无机盐培养基,将长出的菌落划线分离获得单菌落,斜面保存。分别将获得的单菌落预培养,即在50mg/L氯嘧磺隆的无机盐液体培养基上30℃、180r·min-1摇床培养,离心获得菌体后使用无机盐培养基重悬,调节OD600值至2.0,然后按1/100(v/v)的接种量加入含50mg/L氯嘧磺隆的无机盐培养基,空白对照为不加单菌落的含50mg/L氯嘧磺隆的无机盐培养基,每个处理设置3个重复,30℃、180r·min-1摇床培养,每隔2天,取培养液(即培养获得的发酵液)作为待检样本,HPLC法测氯嘧磺隆等磺酰脲除草剂的残留量。2)HPLC法测氯嘧磺隆等磺酰脲除草剂的残留量a、除草剂母标准溶液的配制准确称取0.001g除草剂标准品溶于10mL甲醇,充分混匀,配置成100mg/L除草剂母液。分别取该除草剂母液100μL、200μL、300μL、400μL或500μL,用甲醇稀释至1mL,配置成10mg/L、20mg/L、30mg/L、40mg/L和50mg/L的除草剂母标准溶液,均经0.2μm有机滤膜过滤,供液相色谱测定。b、待检菌株处理将10mL培养液置于150mL分液漏斗中,分别用10mL二氯甲烷萃取3次,合并有机相,过无水硫酸钠柱除去水分,40℃旋转蒸发近干(使用EYELARotaryEvaporatorN-1000,Japan),甲醇定容至10mL,经0.2μm有机滤膜过 滤,用于高效液相色谱测定。c、高效液相色谱测定使用高效液相色谱仪(Agilent1100,USA)、C18反相柱(4.6μm×250μm)和DAD检测器,检测波长为254nm,进样量为5μL,流速为1mL/min,柱温为室温,流动相为甲醇:水:乙酸=70:30:0.15。经检测,获得降解氯嘧磺隆活性较高的菌株,命名为IAE-B-2015。实施例2菌株IAE-B-2015的形态学和培养学特征形态学特征:无色、革兰氏阴性不动短杆菌(长约1.4μm,宽约0.6μm);无鞭毛、内孢子、菌柄等结构(参见图1);细胞增殖方式为均等二分裂,细胞呈分散排布。培养特征:采用含有10g/L甲醇的固体无机盐培养基30℃培养菌株IAE-B-20157天后,观察培养特征。表1菌株IAE-B-2015在培养基上的培养特征培养基菌落质地菌落颜色菌落形状含有10g/L甲醇的固体无机盐培养基表面微凸起,湿润光滑无色直径2mm,圆形表1的结果说明,菌株IAE-B-2015在含有10g/L甲醇的固体无机盐培养基上生长良好。培养7天后可形成直径约2mm、无色、圆形、表面微凸、湿润光滑的菌落。实施例3菌株IAE-B-2015的16SrDNA序列分析16SrDNA序列分析:采用FastDNASPINKitforSoil试剂盒提取菌体总DNA,使用细菌16SrDNA通用引物(8F和1492R)扩增16SrDNA序列。采用50μL反应体系,扩增程序如下:96℃预变性10min,95℃变性1min,55℃退火1min,72℃延伸2min,35个循环,最后72℃延伸10min,得到约为1.4kb的扩增产物,即扩增的16SrDNA片段。扩增的16SrDNA片段经切胶纯化后酶连到pMD19-T载体上,转化入DH5α感受态细胞中。经蓝白斑筛选,挑取阳性克隆送至华大基因(北京)测序。其中,如上所述的引物对序列为:8F:AGAGTTTGATCCTGGCTCAG;1492R:TACCTTGTTACGACTT-3(其核苷酸序列分别如序列表SEQIDNo.2和SEQIDNo.3所示)。菌株IAE-B-2015的16SrRNA基因测序的结果如SEQIDNo.1所示。将菌株IAE-B-2015的16SrDNA片段在Genbank上进行比对,结果发现与α-变形菌纲、根瘤菌目、甲基胞囊菌科的16SrDNA序列的同源性最高,达到了97%,然而一般而言同一种菌的菌株之间16SrDNA序列的差异不超过3%,这就说明,菌株IAE-B-2015有可能是甲基孢囊菌科的一个新种甚至新属。为了将菌株IAE-B-2015进行准确的生物学分类,进行了下述的试验:实施例4菌株IAE-B-2015的Biolog全自动微生物鉴定系统分析1.将菌株IAE-B-2015(简称目标菌株,同以下实施例5~11)和甲基孢囊菌科的模式菌株AlbibactermethylovoransDSM22840T(简称DSM22840T,同以下实施例5~11,购自DSMZ)、MethylopilahelveticaDM9T(简称DM9T,同以下实施例5~11,购自DSMZ)分别接种至Biolog推荐的BUG+B培养基上,33℃培养。2.使用Inoculatorz棉签从琼脂平板中有细胞生长的地方沾取直径3mm的菌落,抓住棉签的末端,使棉签顶端垂直的与菌落接触。将棉签的末端伸入装有接种液的接种管的底段,并来回上下晃动,以便将菌体释放到接种液中,搅拌均匀后用浊度仪检测,分别调整目标菌株、DSM22840T和DM9T的细胞浓度至90-98%T,得调整好浊度的菌悬液。3.将调整好浊度的菌悬液倒入V型加样水槽中,使用8道移液器将菌悬液按照每孔100μL的量依次加入微孔板的所有孔中,盖好微孔板的盖子。4.将微孔板直接放入OmniLog的孵育、读数仪中,33℃培养数小时。5.使用BIOLOG鉴定系统读取微孔板各孔颜色信息。结果如表2所示,表2的结果说明,目标菌株与DSM22840T和DM9T在底物利用上存在显著差异。这表明,目标菌株体内的物质/能量代谢通路与 DSM22840T和DM9T有许多不同,这是由于目标菌株与DSM22840T和DM9T在基因和表达上的差异造成的,也说明目标菌株与DSM22840T和DM9T很可能属于不同的种甚至是属于不同的属。表2Biolog表型测试阳性结果实施例5菌株IAE-B-2015的DNA-DNA同源性分析DNA-DNA杂交率实验参照《常见细菌系统鉴定手册》所述方法进行。目标菌株、DSM22840T和DM9T的DNA-DNA同源性分析结果如表3所示。其中,A表示目标菌株、B表示DSM22840T和C表示DM9T。表3目标菌株、DSM22840T和DM9T的DNA-DNA同源性分析结果说明,目标菌株、DSM22840T和DM9T的DNA-DNA的杂交率分别为25.14±4.31%和22.41±1.98%,远低于新种鉴定的经验值70%。由于在新种鉴定中,DNA-DNA杂交率是一个重要指标,同一种菌株的DNA-DNA杂交率不得低于70%,而DNA-DNA杂交率低于30%则可初步认为是不同属),由此说明目标菌株属于一个新属。实施例6菌株IAE-B-2015的脂肪酸成分的检测1.采用四区划线法,分别将目标菌株、DSM22840T和DM9T划线接种在PBMM培养基上,30℃培养。2.收集第三区的菌体40mg,转入干净、干燥的13mm×100mm具螺旋盖的培养试管,样品应抹拭在试管的底部。3.向每个样品管中加入1.0±0.1mL的试剂1(45g氢氧化钠溶于150mL甲醇及150mL蒸馏水),用干净Telfon-lined螺旋盖子旋紧每个试管,剧烈震荡10s后置于95℃水浴中5分钟。4.从水浴中取出试管并稍微冷却,震荡试管5-10s后放回水浴中,确认试管不漏气后,继续水浴25分钟,取出试管,打开水龙头,用水冲洗试管外壁使其冷却。5.待试管冷却后,旋开盖子加入2.0±0.1mL试剂2(97.5mL浓盐酸、137.5mL甲醇溶于65mL蒸馏水),拧紧盖子震荡10s,迅速进入下一步。6.80℃水浴加热试管10min,取出试管,参照步骤4快速冷却至室温。7.每个试管中加入1.25±0.1mL的试剂3(200mL正己烷与200mL甲基叔丁基醚混合均匀),盖紧盖子,将试管置于旋转器上温和旋转10min,充分萃取。8.打开管盖,用干净的巴斯德吸管移除试管中的下层水相。9.加入3.0±0.21mL试剂4(10.8g氢氧化钠溶于900mL蒸馏水),拧紧盖子后再于旋转器上温和混匀5min。10.利用洁净的巴斯德吸管移出上层有机相体积的2/3,置于干净的GC样品小瓶,盖严盖子。11.气相色谱检测分析,具体操作步骤参见MIDI;Sherlockversion6.1。结果如表4所示,表4说明,目标菌株的主要脂肪酸成分为18:1w7c/18:1w6c(75.78%),16:0(15.75%),18:1w7c11-methyl(2.39%)和20:1w7c(2.10%)。模式菌株DSM22840T和DM9T的主要脂肪酸成分与目标菌株相近,但在比例上有一定差别。此外,目标菌株的脂肪酸种类要显著多于两种模式菌株,如脂肪酸14:0、15:0反式、16:1w5c、17:0反式、17:0和18:1w9c均为目标菌株IAE-B-2015所特有;而模式菌株DSM22840T则比目标菌株多了15:0iso和16:0iso两种脂肪酸。表4目标菌株、DSM22840T和DM9T的脂肪酸成分注:复合特征峰3包括16:1w7c和/或16:1w6c;复合特征峰8包括18:1w7c和/或18:1w6c。实施例7菌株IAE-B-2015的呼吸醌类型参照Minnikin等人的方法(Minnikin,Collins&Goodfellow,1979;Collins,Pirouz,Goodfellowetal.,1977),使用HPLC法对目标菌株、DSM22840T和DM9T的呼吸醌进行分析,方法简述如下:1.将菌株目标菌株、DSM22840T和DM9T在PBMM液体培养基中培养至指数期后期,离心收集菌体,用灭菌去离子水洗涤两次,冷冻干燥,得冻 干菌体。2.取50mg冻干菌体,加入40mL萃取液(氯仿:甲醇=2:1,v/v),密封于黑暗处磁力搅拌过夜。3.黑暗处用滤纸过滤收集滤液,40℃减压蒸馏干燥,用1mL萃取液溶解干燥物,得溶解液。4.将溶解液点样到GF254硅胶板上,展开剂为正己烷:乙醚=34:6(v/v),展层20min,取出风干。5.在254nm紫外灯下,将Rf=0.8处的暗褐色条带刮下来,溶于1mL氯仿中,无菌滤膜过滤,除去硅胶。6.滤液保存在4℃冰箱中用于HPLC分析。HPLC分析条件:C18反相柱;柱温40℃;流动相:异丙醇;检测波长:270nm;流速:1.0mL/min;上样量:20μL。结果表明目标菌株、DSM22840T和DM9T的呼吸醌类型均为Q10。实施例8菌株IAE-B-2015的磷脂组分检测参照Minnikin等人的方法(Minnikin,Collins&Goodfellow,1979;Collins,Pirouz,Goodfellowetal.,1977),进行极性脂的提取和组分分析。1.取2mL脂肪酸样品点在10cm×10cm的硅胶板中,每个样品做3个重复。待样品风干后在层析缸中做单向展开,展开剂为氯仿:甲醇:乙酸:水=85:22.5:10:4(v/v/v/v)。2.取2μL脂肪酸样品点在10cm×10cm的硅胶板中,每个样品做3个重复。待样品风干后在层析缸中做双向展开,第一向展开剂为氯仿:乙酸:水=65:25:4(v/v/v);第二向展开剂为氯仿:甲醇:乙酸:水=80:12:15:4(v/v/v/v)。3.用磷钼酸盐试剂均匀喷雾板面至板子颜色变黄,150℃加热约10min显色,显示出所有磷脂。4.均匀喷雾茚三酮试剂(0.4g茚三酮溶于100mL水饱和正丁醇中)(100℃加热6-10min)显色。圈起显色的点,再用钼蓝试剂(取10g磷钼酸盐溶于100mL95%的乙醇溶液,搅拌过夜)显色,PE与PME在茚三酮试剂下显红 色,后经钼蓝试剂喷雾后显蓝色。5.先用D试剂(D试剂由A液和B液按1:1的体积比例混合。其中A液:1.7g次硝酸铋溶于100mL20%(v/v)的冰醋酸中;B液:40g碘化钾溶于100mL蒸馏水中)显色。再用钼蓝试剂显色,先变微红后变蓝的点即为PC、PE、PME。目标菌株、DSM22840T和DM9T的磷脂组成如图2所示。目标菌株的主要磷脂类型为心磷脂、磷脂酰乙醇胺和卵磷脂。虽然DSM22840T和DM9T也均含有以上三类磷脂,除此之外,还有一些特有的磷脂种类。相较于目标菌株,DSM22840T多出一种未知氨基脂,DM9T则多出一种抗磷脂及另外两种未知磷脂。实施例9菌株IAE-B-2015的基因组DNAG+Cmol%含量分析1.参照细菌基因组快速提取试剂盒MK047-3(购自BioDev,Beijing)所提供步骤提取目标菌株、DSM22840T和DM9T的基因组DNA,得DNA溶液。2.NanoDrop2000超微量分光光度计检测DNA的浓度及A260/A280、A260/A230值。3.取10μL上述DNA溶液用PCR仪于99℃加热10min,迅速取出于冰上静置5min。加入10μL63U/mL的核酸酶P1,50℃放置60min。加入10μL70U/mL的碱性磷酸酶,37℃放置60min,取出于4℃保存用于HPLC检测。4.将四种脱氧核糖核苷酸标准品以每种0.1mg/mL的量配成混合液,采用HPLC法检测,分别得到峰面积与四种脱氧核糖核苷酸浓度的换算关系。5.HPLC法测定各样品中四种脱氧核糖核苷酸的峰面积,得出浓度值。HPLC条件:AgilentHPLC1100;色谱柱:ZORBAXEclipseXDB-C18;流动相:0.05mol/L磷酸二氢铵:乙腈=97.5:2.5;检测波长:270nm;流速:1mL/min;进样量:10μL。目标菌株基因组DNA中A、G、C、T四种碱基所对应脱氧核糖核苷酸的保留时间及其比例如表5所示。结果发现,目标菌株、DSM22840T和DM9T 的基因组DNAG+Cmol%含量分别为69.4%,66.7%和67.1%,存在着一定的差异。表5目标菌株基因组DNA中四种脱氧核糖核苷酸的比例实施例10菌株IAE-B-2015的生理生化特征分析参照《常见细菌系统鉴定手册》(东秀珠,2001)及Cowan和Lanyi所描述的方法(Cowan,K.J,ManualfortheIdentificationofMedicalBacteria,London:CambridgeUniversityPress,1965),对目标菌株、DSM22840T和DM9T进行生理生化特征分析。10A)、酶学实验结果如表6所示,表6说明目标菌株与DSM22840T和DM9T在酶学活性上存在显著差异。这表明目标菌株体内相关的功能基因及功能酶,在基因和翻译表达水平上与DSM22840T和DM9T存在显著差异。表6目标菌株、DSM22840T和DM9T的酶学实验10B)、抗生素敏感性实验结果如表7所示,表7说明,目标菌株与DSM22840T和DM9T在抗生素敏感性上存在显著差异。这表明目标菌株体内存在与DSM22840T和DM9T不同的抗性基因,或者对抗生素的耐受性存在差异。表7目标菌株、DSM22840T和DM9T的抗生素敏感性实验10C)、非肠道革兰氏阴性杆菌鉴定系统(API-20NE)实验利用API50CHB鉴定系统(生产厂商:bioMe′rieux)测定菌株发酵碳水化合物的产酸情况。API50CHB的试剂条中,不同的序列号对应不同的碳源,同时,其中含有指示剂,这样,如果其对应的碳源被利用,则培养液pH下降,指示剂便会改变颜色,利于观察记录。(1)API50CHB基础培养基成分:胰蛋白胨1g,酵母膏0.5g,硫酸铵2g,酚红0.18g,无机盐基础(Cohen-Bazire)10ml,磷酸盐缓冲液(pH7.8)1000ml。(2)在平板上培养菌株,挑取有多个大小相近,单菌落分离的平板。挑取大小相近的单菌落若干个,加入步骤(1)中的培养基中,制成OD600=0.5的菌悬液。(3)将接种过的API50CHB培养基加入到含有实验条的小管中,上面覆盖一层已灭菌的石蜡油。(4)在30℃的恒温培养箱中培养,分别在24小时和48小时记录实验现象。结果如表8所示,表8说明,目标菌株与DSM22840T和DM9T在碳源利用上存在显著差异。这表明,目标菌株体内的物质/能量代谢通路与DSM22840T和DM9T有许多不同,这是由于目标菌株与DSM22840T和DM9T在基因和翻译的表达量上的差异造成的。表8目标菌株、DSM22840T和DM9T的API-20NE实验10D)、API-ZYM实验利用API-ZYM酶学测定系统(生产厂商:bioMe′rieux)测定菌株发酵碳水化合物的产酸情况。API-ZYM试剂条是由20个小管所组成,它的底部是一个专门设计含有酶底物和缓冲液的支持物。这个支持物可以接触被测的酶和不溶的底物。不同的序列号对应不同的酶底物。(1)接种目标菌株IAE-B-2015至PBMM培养基中,30℃,180r·min-1摇床培养,每隔2小时检测菌液的浊度OD600。待培养至指数期后期时10000×g离心10min收集菌体,4℃保存,用PBS缓冲液(0.2mol/L,pH7.8)重悬菌体两次后调整菌液浓度至OD600为3.0。(2)在每个API-ZYM酶学测试板边缘标记菌株,每孔加入相应菌株的菌悬液65μL,放入湿盒中37℃培养4h。(3)培养4h后,每孔分别加一滴ZYM-A试剂(Tris缓冲液)和ZYM-B试剂(坚牢蓝B),然后暴露在强光下5min。试验条第一个孔为底物空白,结果示无色或浅黄色作为阴性结果。其他各孔根据显色判读结果,紫色、蓝色、棕色和橙色分别代表阳性结果,半定量结果通过与标准半定量色板比较读出:(-)为阴性,(+)为阳性。结果如表9所示,表9说明,目标菌株与DSM22840T和DM9T在酶学活性上存在显著差异。这表明,目标菌株体内相关的功能基因及功能酶在基因和表达水平上与DSM22840T和DM9T存在显著差异。表9目标菌株、DSM22840T和DM9T的API-ZYM实验上述的数据说明,菌株IAE-B-2015具有以下的微生物学特性:1、形态学的特性菌株IAE-B-2015为无色的革兰氏阴性不动短杆菌(长约1.4μm,宽约0.6μm);无鞭毛、内孢子、菌柄等结构;细胞增殖方式为均等二分裂,细胞呈分散排布。2、培养学的特性菌株IAE-B-2015在含有10g/L甲醇的固体无机盐培养基上生长良好。 培养7天后可形成直径约2mm、无色、圆形、表面微凸、湿润光滑的菌落。3、生理特性菌株IAE-B-2015的主要脂肪酸成分为18:1w7c/18:1w6c(75.78%),16:0(15.75%),甲基化18:1w7c1(2.39%)和20:1w7c(2.10%);呼吸醌类型为Q10;主要磷脂类型为心磷脂、磷脂酰乙醇胺和卵磷脂;基因组DNAG+Cmol%含量为69.4%。实施例11菌株IAE-B-2015的系统发育树NJ系统发育树的绘制过程是:将实施例2得到的菌株IAE-B-2015的16SrDNA的测序结果用Blast软件与Genbank数据库中的16SrDNA序列进行同源性比对,调取相似性较高的菌株16SrDNA序列,经ClastaX软件包比对后导入MEGA(version5.1)软件中,分别采用邻接法(NJ,NeighborJoining)、最大似然法(ML,MaximumLikelihood)、和最大简约法(MP,MaximumParsimony)三种方法构建系统发育树。菌株IAE-B-2015在NJ系统发育树中的地位如图3所示,图3说明,整个系统发育树的自展值均高于50,说明系统发育树的可信度较高;菌株IAE-B-2015的16SrDNA序列并未与其他标准菌株的16SrDNA序列聚在一起,而是独自形成一个进化枝,这说明,菌株IAE-B-2015属于甲基孢囊菌科的一个新属。此外,将菌株IAE-B-2015的16SrRNA序列与GenBank上的其他序列进行同源比对,发现菌株IAE-B-2015与菌株AlbibactermethylovoransDM10、HansschlegeliazhihuaiaeS113的相似性最高,均为98%。然而,在构建NJ系统发育树时,菌株IAE-B-2015并未与甲基孢囊菌科的模式菌株HansschlegeliazhihuaiaeS113T/DQ916067或AlbibactermethylovoransDSM22840T/FR733694聚在一起,而是单独归为一类,因此菌株IAE-B-2015属于潜在新属。菌株IAE-B-2015在ML和MP的系统发育树中的地位如图4和图5所示,图4~5也说明,菌株IAE-B-2015属于甲基孢囊菌科的一个新属。作为单细胞生物,细菌具有很高的多样性,种内或种间均存在不同程度 的差异。单一地依赖某个或某几个指标很难准确的确定菌株的分类地位。多相分类鉴定这一概念最初是1970年由Colwell提出,是将生物的各种信息,包括表型的、基因的和系统发育各方面的数据综合起来,用于种水平及其它分类单元的描述以及检验各个分类单元的一致性。多相分类鉴定法克服了以往依赖单一分类方法进行分类的不足,被誉为现代细菌分类学的一个重要里程碑。综合分析实施例2~11的所有结果,菌株IAE-B-2015和Albibacter属的DSM22840T以及Methylopila属的DM9T在形态、生理生化特征等指标中均有重大差异,尽管三者在基因组DNAG+Cmol%和呼吸醌类型上与两种模式菌株有相似性,但是,在基因组DNA-DNA同源性、脂肪酸成分分析、磷脂成分分析、系统发育树等方面均存在显著差异。参照已有的新属鉴定文章(DongL,MingH,LiuL,etal.Zhizhongheellacaldifontisgen.nov.,sp.nov.,anovelmemberofthefamilyComamonadaceae[J].AntonievanLeeuwenhoek,2014,105(4):755-761.;1.TanWB,JiangZ,ChenC,etal.Thiopseudomonasdenitrificansgen.nov.,sp.nov.,isolatedfromanaerobicactivatedsludge[J].Internationaljournalofsystematicandevolutionarymicrobiology,2015,65(Pt1):225-229.)中的各项指标分析后,确认菌株IAE-B-2015属于一个新属,将该新属命名为成刚菌属(Chenggangella)。将IAE-B-2015于2015年11月12日在中国微生物菌种保藏管理委员会普通微生物中心(CGMCC)保藏,获得保藏编号为:CGMCCNo.11649,培养物名称是IAE-B-2015,分类命名是Chenggangellamethylivorans。实施例12成刚菌属嗜甲基短杆菌CGMCCNo.11649的培养成刚菌属嗜甲基短杆菌CGMCCNo.11649至PBMM培养基中,28℃,180r·min-1摇床培养72小时,得种子液;接种1%(v/v)种子液于至PBMM培养基(pH6.8)中,28℃,180r·min-1摇床培养72小时。实施例13成刚菌属嗜甲基短杆菌CGMCCNo.11649的培养成刚菌属嗜甲基短杆菌CGMCCNo.11649至PBMM培养基中,30℃,180r·min-1摇床培养60小时,得种子液;接种1%(v/v)种子液于至PBMM培养基(pH7.0)中,30℃,180r·min-1摇床培养60小时。实施例14成刚菌属嗜甲基短杆菌CGMCCNo.11649的培养成刚菌属嗜甲基短杆菌CGMCCNo.11649至TY培养基(购自SigmaChemicalCo.上海,中国)中,32℃,180r·min-1摇床培养48小时,得种子液;接种1%(v/v)种子液于至TY培养基(pH7.5)中,32℃,180r·min-1摇床培养48小时。实施例15成刚菌属嗜甲基短杆菌CGMCCNo.11649降解氯嘧磺隆等磺酰脲除草剂将成刚菌属嗜甲基短杆菌CGMCCNo.11649在含有10g/L甲醇的无机盐培养基中,30℃、180r·min-1条件下预培养5天,8000r·min-1离心10min,除去上清液,用无菌PBS缓冲液(pH7.2)重悬菌体,重复上述步骤两次,然后将菌体浓度调节至OD600为1.0,此时活菌数目约为3.2×109个/mL。以1/10(v/v)的接种量将上述菌体分别接种于以50mg/L氯嘧磺隆、50mg/L甲磺隆、50mg/L苯磺隆、50mg/L醚磺隆和50mg/L氯磺隆为唯一碳源的无机盐培养基中,每个处理设3个重复。以等量的灭菌PBS缓冲液代替菌液加入上述培养基中作为空白对照。30℃、180r·min-1条件下培养,每12小时取样一次,按照实施例1步骤2)所述的方法检测氯嘧磺隆等磺酰脲除草剂的残留量。结果如图6和表10所示。表10中的数字为培养时间所对应的磺酰脲除草剂的残留量(mg/L),以接种时为起始培养时间开始计时。表10对不同磺酰脲除草剂的降解表10的结果说明,经过最初20小时左右的适应期,成刚菌属嗜甲基短杆菌CGMCCNo.11649迅速对氯嘧磺隆、甲磺隆和苯磺隆表现出高效的降解活性。在60小时处,3种除草剂的降解率均已达到了90%,其中,降解率=残留量/50mg/L╳100%。实施例16成刚菌属嗜甲基短杆菌CGMCCNo.11649对氯嘧磺隆等除草剂污染土壤的生物修复1)成刚菌属嗜甲基短杆菌CGMCCNo.11649的预培养接种成刚菌属嗜甲基短杆菌CGMCCNo.11649至PBMM培养基中,30℃,180r·min-1摇床培养,每隔2小时检测菌液的浊度OD600。待培养至指数期后期时10000×g离心10min收集菌体,4℃保存,用PBS缓冲液(0.2mol/L,pH7.8)重悬菌体两次后调整菌液浓度至OD600为1.0,即称为修复剂,用于后续试验。此时修复剂中活菌数目约为3.2×109个/mL2)实验处理试验所用土壤采自中国科学院沈阳应用生态研究所沈阳农田生态系统国家野外研究站内16年未施加任何除草剂和肥料的撂荒地(41°47′N,123°23′E)。将采集到的土壤充分混匀,过2mm筛。其中一部分土壤自然风干后,研磨过筛用于土壤基本性质的测定;另一部分新鲜土壤直接用于实验室培养。用于盆栽实验的土壤播种玉米前分别进行以下处理:自然土不做处理(CK);10μg/kg氯嘧磺隆(T1);10μg/kg氯嘧磺隆+修复剂(T2);30μg/kg氯嘧磺隆(T3);30μg/kg氯嘧磺隆+修复剂(T4);50μg/kg氯嘧磺隆(T5);50μg/kg氯嘧磺隆+修复剂(T6)。每个处理三个重复,用灭菌去离子水调节土壤的湿度至25%左右,按每盆1kg土的量分装于花盆中,室温培养7天,每隔两天调节土壤含水量一次,使其保持恒定。7天后,挑选籽粒饱满,形 状规则的玉米种子,播种于各处理土壤中,每盆播种15粒。于室温下培养,观察并记录不同处理土壤玉米种子的出芽时间、出芽率、株高、根长、鲜重等数据。从添加氯嘧磺隆当天开始计时,分别于第0、7、14、21天取土,每次取100g作为土样,用于后续检测。其中,表11的出芽时间指从播种当天开始计时的天数,株高、主根长、鲜重和出芽率为第21天的结果。表11的结果说明,相较于CK对照组,氯嘧磺隆不加修复剂处理组玉米的出芽时间出现了不同程度的延迟,出芽率、株高、主根长、鲜重出现了不同程度的减少和下降,这说明氯嘧磺隆抑制了玉米的生长,且这种抑制作用呈氯嘧磺隆剂量依赖型。而在有修复剂添加的处理组,氯嘧磺隆对玉米的这种抑制作用得到了显著的缓解。表11不同处理土壤栽培玉米的情况3)HPLC法测土壤中氯嘧磺隆的残留量3.1提取分别称取10g步骤2)所述的土样(精确至0.01g)于50mL聚苯乙烯的离心管中,加入10.0mL提取液(200mL乙腈用磷酸缓冲液定容至1L,其中磷酸缓冲液:向水中加入KH2PO4和K2HPO4·3H2O,使其浓度分别为0.038mol/L和0.16mol/L,然后调整pH至7.8),在漩涡混合器中剧烈涡旋1min,然后在超声波仪中超声提取5min,4000rpm/min离心5min,移出上清。重 复提取步骤3次,每次均加入提取液10mL。将3次上清液合并在一起,混合均匀,用磷酸溶液调节pH至2.5±0.1,得调好pH值的提取液,用于净化。3.2净化依次使用5mL乙腈和5mL磷酸缓冲液(用磷酸调节pH至2.5±0.1)淋洗活化C18-SPE小柱。将步骤3.1所得的调好pH值的提取液过柱,保证在整个过程中小柱上液面不能干。全部过完后,抽真空10min,加入3mL洗脱液(900mL乙腈用磷酸缓冲液定容至1L,其中磷酸缓冲液:向水中加入KH2PO4和K2HPO4·3H2O,使其浓度分别为0.038mol/L和0.16mol/L,然后调整pH至7.8)洗脱,收集到试管中,氮气吹干,用1mL乙腈定容。3.3测定色谱条件:Agilent1100,ZorbaxC-18反相柱(4.6×250mm,5μm,AgilentTechnologies,PaloAlto,CA,USA),柱温箱温度:30℃,进样量:10μL,检测波长:254nm。流动相组成见表12,测定的结果如表13所示。其中,以未添加嗜甲基短杆菌CGMCCNo.11649的(CK)土壤中氯嘧磺隆残留量为对照,表5中的数字为培养时间所对应的氯嘧磺隆的残留量(mg/L),从添加氯嘧磺隆当天开始计时。结果如表13所示,表13说明,当有成刚菌属嗜甲基短杆菌CGMCCNo.11649添加时,初始浓度为10μg/kg,30μg/kg和50μg/kg的氯嘧磺隆分别经过15、30和45天已经降解至检测限,即1.2μg/kg以下。表12流动相组成表13成刚菌属嗜甲基短杆菌CGMCCNo.11649对氯嘧磺隆的降解此外,液相质谱检测证明,磺酰脲除草剂氯嘧磺隆在成刚菌属嗜甲基短杆菌CGMCCNo.11649的作用下降解为芳基磺酰胺、氨基杂环及其前体酸,这些残留物对后茬作物及土壤微生物无明显毒性。实施例17成刚菌属嗜甲基短杆菌CGMCCNo.11649对氯嘧磺隆/甲磺隆/苯磺隆等除草剂污染土壤的生物修复1)成刚菌属嗜甲基短杆菌CGMCCNo.11649的预培养与实施例16步骤1)相同。2)实验处理试验所用土壤采自中国科学院沈阳应用生态研究所沈阳农田生态系统国家野外研究站内16年未施加任何除草剂和肥料的撂荒地(41°47′N,123°23′E)。将采集到的土壤充分混匀,过2mm筛。用于实验分别进行以下处理:自然土不做处理(CK);10μg/kg氯嘧磺隆/甲磺隆/苯磺隆(T1);10μg/kg氯嘧磺隆/甲磺隆/苯磺隆+修复剂(T2);100μg/kg氯嘧磺隆/甲磺隆/苯磺隆(T3);100μg/kg氯嘧磺隆/甲磺隆/苯磺隆+修复剂(T4);1000μg/kg氯嘧磺隆/甲磺隆/苯磺隆(T5);1000μg/kg氯嘧磺隆/甲磺隆/苯磺隆+修复剂(T6)。每个处理三个重复,用灭菌去离子水调节土壤的湿度至25%左右,按每盆1kg土的量分装于花盆中,室温培养7天,每隔两天调节土壤含水量一次,使其保持恒定。3)HPLC法测土壤中氯嘧磺隆的残留量与实施例16步骤3)相同。结果如表14~16所示,表14~16说明,成刚菌属嗜甲基短杆菌CGMCCNo.11649在高、中、低(10-1000μg/kg)各种浓度的氯嘧磺隆/甲磺隆/苯磺隆污染土壤中均表现出高效降解活性。即使在高剂量(100-1000μg/kg)氯嘧磺隆处理组,接种用菌株IAE-B-2015的处理组土壤中的氯嘧磺隆残留也要远低于同剂量不接种土壤。表14成刚菌属嗜甲基短杆菌CGMCCNo.11649对氯嘧磺隆的降解表15成刚菌属嗜甲基短杆菌CGMCCNo.11649对甲磺隆的降解表16成刚菌属嗜甲基短杆菌CGMCCNo.11649对苯磺隆的降解实施例18成刚菌属嗜甲基短杆菌CGMCCNo.11649固体修复剂对氯嘧磺隆等除草剂污染土壤的生物修复1)成刚菌属嗜甲基短杆菌CGMCCNo.11649的预培养接种成刚菌属嗜甲基短杆菌CGMCCNo.11649至PBMM培养基中,30℃,180r·min-1摇床培养,每隔2小时检测菌液的浊度OD600。待培养至指数期后期时10000×g离心10min收集菌体,4℃保存,用PBS缓冲液(0.2mol/L,pH7.8)重悬菌体两次后调整菌液浓度至OD600为1.0,此时菌液中活菌数目约为3.2×109个/mL。2)固体修复剂的制备取5000克发酵后的鸡粪,放入干燥机内进行干燥,进口温度600℃,出口温度100℃。干燥时间15-20分钟,干燥后水分12%(w/w),干燥机内的高温同时灭菌,得干燥并灭菌后的鸡粪。另取5000克草炭土,放入干燥机内干燥,进口温度600℃,出口温度100℃。干燥时间15-20分钟,干燥后水分12%(w/w),干燥机内的高温同时达到灭菌,得干燥并灭菌后的草炭土。将干燥并灭菌后的鸡粪及草炭土粉碎,过80目筛,得粉碎后的鸡粪及 草炭土。取粉碎后的鸡粪1200克、草炭土800克,混合均匀得到肥料基质。按每100g的上述肥料基质中加入5ml步骤1)所得的菌液,混合均匀即得固体修复剂。将所得的固体修复剂造粒。具体步骤为将圆盘造粒机转速调为36转/分钟,转盘倾角为45°,将所得的固体修复剂放置在圆盘造粒机的转盘中,开动造粒机,造粒时间为10分钟。然后50℃干燥2小时,再过4.5mm筛子,得到1100克颗粒状微生物有机复合肥料。得到微生物有机复合肥料含水量8%(w/w),细菌总数1.6×108个/克。3)实验处理除了下面的分组,其余步骤和操作同实施例16步骤2)实验处理。自然土不做处理(CK);10μg/kg氯嘧磺隆(T1);10μg/kg氯嘧磺隆+微生物有机复合肥料(T2);30μg/kg氯嘧磺隆(T3);30μg/kg氯嘧磺隆+微生物有机复合肥料(T4);50μg/kg氯嘧磺隆(T5);50μg/kg氯嘧磺隆+微生物有机复合肥料(T6)。其中,表17的出芽时间指从播种当天开始计时的天数,株高、主根长、鲜重和出芽率为第21天的结果。从表17中可以看出:相较于CK对照组,氯嘧磺隆不加修复剂处理组玉米的出芽时间出现了不同程度的延迟,出芽率、株高、主根长、鲜重出现了不同程度的减少和下降,这说明氯嘧磺隆抑制了玉米的生长,且这种抑制作用呈氯嘧磺隆剂量依赖型。而在有修复剂添加的处理组,氯嘧磺隆对玉米的这种抑制作用得到了显著的缓解。表17不同处理土壤栽培玉米的情况4)HPLC法测土壤中氯嘧磺隆的残留量与实施例16步骤3)相同。其中色谱的流动相组成见表18,测定的结果如表19所示。其中,以未添加嗜甲基短杆菌CGMCCNo.11649的(CK)土壤中氯嘧磺隆残留量为对照,表19中的数字为培养时间所对应的氯嘧磺隆的残留量(mg/L),从添加氯嘧磺隆当天开始计时。表19说明,当有成刚菌属嗜甲基短杆菌CGMCCNo.11649添加时,初始浓度为10μg/kg、30μg/kg和50μg/kg的氯嘧磺隆分别经过15、30和45天已经降解至检测限,即1.2μg/kg以下。表18流动相组成表19固体修复剂对氯嘧磺隆的降解实施例19成刚菌属嗜甲基短杆菌CGMCCNo.11649固体修复剂对氯嘧磺隆等除草剂污染土壤的生物修复1)成刚菌属嗜甲基短杆菌CGMCCNo.11649的预培养与实施例18步骤1)相同。2)固体修复剂的制备除了以下的步骤,与实施例18步骤2)相同。将所得的固体修复剂造粒。具体步骤为将圆盘造粒机转速调为50转/分钟,转盘倾角为45°,将所得的固体修复剂放置在圆盘造粒机的转盘中,开动造粒机,造粒时间为3分钟。然后50℃干燥1小时,再过2.5mm筛子,得到1100克颗粒状微生物有机复合肥料。得到微生物有机复合肥料含水量8%(w/w),细菌总数1.6×108个/克。3)实验处理与实施例18步骤3)相同。4)HPLC法测土壤中氯嘧磺隆的残留量与实施例18步骤4)相同。试验说明所制得的固体修复剂能够对氯嘧磺隆等除草剂污染土壤的生物修复。以上所述仅为本发明的较佳实施例而已,并不构成对权利要求范围的限制,本领域技术人员可以想到的其他实质上等同的替代,均在本发明保护范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1