纤维素酶及其编码基因、重组载体和应用的制作方法
本发明属于生物工程领域,涉及一种新的纤维素酶,及其制备方法和应用。本发明还涉及所述纤维素酶的编码基因、重组载体以及其重组基因工程菌株。
背景技术:
纤维素是植物细胞壁的主要结构组分,也是自然界中含量最丰富的有机聚合物,纤维素为生产生物燃料产品提供了巨大的应用潜力。纤维素酶是能够降解纤维素,将纤维素水解并转化为葡萄糖的一类酶系的总称。最早的纤维素酶是1906年seilliere从蜗牛消化液中发现的,随后又从其它动物、植物以及微生物体内发现。80年代以来,由于分子生物学的发展及生物工程技术的兴起,纤维素酶的研究得以快速发展。
许多微生物可以分泌纤维素酶,它们能够在独立的酶或多蛋白复合物中被激活。但是由于培养技术的限制,自然界中大部分微生物未能获得纯培养,当前科学家在实验室条件下能够培育的微生物,少于在自然界中可观察到的所有微生物的1%,因此可以从培养微生物中筛选出的纤维素酶种类单一、重复率高,在一定程度上阻碍了人们对纤维素酶的认识和应用。
虽然纤维素酶被广泛研究,并且已经从不同的宿主中鉴别出多于一千种纤维素酶。但是当前对具有可以用于工业应用的不同性质的新纤维素酶仍然存在需求,例如对不溶的纤维素底物具有更高的催化效率的纤维素酶,在升高的温度和特异性ph值下稳定性增加的纤维素酶,或者对盐或有机溶剂具有更高的耐受性的纤维素酶等。同时,当使用纤维素酶将预处理的含纤维素的材料水解为糖,使其可以大规模发酵以生产商品例如乙醇或其它生物制品时,可以预期的是纤维素酶市场将急剧扩张。但是,许多纤维素酶将纤维素水解为葡萄糖的效率低,使得从木质纤维素生物质生产燃料乙醇的花费较高。
宏基因组方法涉及从环境样品中直接提取dna,并且进一步使用两 种主要的方法分析。首先,在合适的克隆载体和宿主中,使用dna构建宏基因组文库,通过基于功能或基于序列的方法分离新的生物催化剂。其次,使用新近的测序技术,例如illumina,宏基因组测序成为发现新的生物催化剂的最有利的工具。
宏基因组方法可以用于从各种环境样品中分离纤维素酶,例如植物材料、土壤、高等白蚁的后肠内容物、堆肥、兔盲肠的内容物、沼气反应池中的淤泥,和富集培养物等。来自特定环境的纤维素酶基因显示了某些特性。因此,可以从未培养的微生物中鉴别新的纤维素酶,并获得纤维素酶基因。例如从土壤样品中得到的耐盐纤维素酶cel5a,或从水牛瘤胃中得到的内切葡聚糖酶c67-1等。
耐盐纤维素cel5a是第一个被详细描述的源于宏基因组的纤维素酶,它是从土壤样品中分离的(vogetetal.2006)。该纤维素酶在广泛的ph范围(ph5.5-9)显示了高水平的稳定性,稳定在40"c直至11h,同时还显示出高耐盐性,在3mnac1中具有活性并稳定。从水牛瘤胃中分离的内切葡聚糖酶c67-1是酸性酶,但是在酸性(ph≥3.5)和碱性(ph达到10.5)条件下都非常稳定(duanetal.2009)。pottkamper等人(2009)鉴别出了三种新的源于宏基因组的纤维素酶,其适合存在于高浓度的不同离子溶液的纤维素降解。
但是,现有技术中并没有报道在酸性条件下以及高热环境中保持稳定的纤维素酶,而对于恶劣的工业催化条件,例如在生物燃料生产、废水处理、纺织和制浆等领域中,对这样的酶存在需求。
技术实现要素:
因此,本发明的目的是提供一种新的纤维素酶、其编码基因、重组载体,以及遗传工程化的宿主细胞。本发明提供的纤维素酶是通过宏基因组技术,从啤酒糟宏基因组中得到的,该酶的酶活力在酸性条件下是稳定的,并且具有更强的耐热性,因此可以用于恶劣的工业催化条件,例如生物燃料生产、废水处理、纺织和制浆等领域。
一方面,本发明提供了一种具有纤维素酶生物学功能或活性的肽或蛋白,所述肽或蛋白的氨基酸序列与seqidno:1-3中任一项所示的氨基酸序列的同源性为95%以上。
由于氨基酸序列的特殊性,任何含有seqidno:1-3中任一项所示 的氨基酸序列的肽或蛋白的片段或其变体,如其保守性变体、生物活性片段或衍生物,只要该肽或蛋白的片段、或肽或蛋白的变体与前述氨基酸序列同源性在95%以上,均属于本发明的保护范围之列。具体的变体可包括氨基酸序列中氨基酸的缺失、插入或替换;其中,对于变体的保守性改变,所替换的氨基酸具有与原氨基酸相似的结构或化学性质,如用亮氨酸替换异亮氨酸,变体也可具有非保守性改变,如用色氨酸替换甘氨酸。
本发明所述的肽或蛋白的片段、衍生物或类似物是指基本上保持与本发明所述的纤维素酶相同的生物学功能或活性的肽或蛋白,可以是下列情形:(i)一个或多个氨基酸残基被保守或非保守氨基酸残基(优选的是保守氨基酸残基)取代,并且取代的氨基酸可以是也可以不是由遗传密码子编码的;(ii)一个或多个氨基酸残基上的某个基团被其它基团取代;(iii)成熟肽或蛋白与另一种化合物(比如延长肽或蛋白半衰期的化合物,例如聚乙二醇)融合;(iv)附加的氨基酸序列融合到成熟的肽或蛋白而形成的肽或蛋白序列(如用来纯化此肽蛋白的序列或蛋白原序列)。
所述蛋白可以是重组蛋白、天然蛋白或合成蛋白,可以是纯天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如:细菌、酵母、高等植物、昆虫和哺乳动物细胞)中产生。根据重组生产方法所用的宿主,本发明的肽或蛋白可以是糖基化的。本发明的肽或蛋白还可以包括或不包括起始的甲硫氨酸残基。
优选的,所述肽或蛋白的氨基酸序列选自seqidno:1-3所示的氨基酸序列中的一项。
本发明还涉及编码所述肽或蛋白的核苷酸序列。
所述核苷酸序列与seqidno:4-6中任一项所示的核苷酸序列的同源性为70%以上。由于核苷酸序列的特殊性,任何seqidno:4-6中任一项所示的核苷酸序列的变体,只要其与该核苷酸序列具有70%以上同源性,均属于本发明保护范围之列。所述核苷酸序列的变体是指一种具有一个或多个核苷酸改变的核苷酸序列。此核苷酸序列的变体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是核苷酸序列的替换形式,它可能是核苷酸序列的取代、缺失或插入,但不会从实质上改变其编码的肽或蛋白的功能。
另外,可与seqidno:4-6中任一项所示的核苷酸序列杂交的多核苷酸(至少具有50%同源性,优选具有70%同源性),也在本发明保护范 围之列,特别是在严格条件下可与本发明所述核苷酸序列杂交的多核苷酸。所述“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2ssc,0.1%sds,60℃;或(2)杂交时加变性剂,如50%(v/v)甲酰胺,0.1%小牛血清,0.1%ficoll,42℃;或(3)仅在两条序列之间的同源性至少在95%以上,更好是97%以上时才发生杂交。并且,可杂交的多核苷酸编码的肽或蛋白与seqidno:1-3中任一项所示的肽或蛋白有相同的生物学功能和活性。
优选地,所述核苷酸序列选自seqidno:4-6所示的核苷酸序列中任一种。
本发明的发明人将具有纤维素酶活性或功能的肽或蛋白的氨基酸序列和核苷酸序列经蛋白质数据库和核苷酸数据库分别进行搜寻比较,未发现有任何相同氨基酸序列和核苷酸序列,因此其为新型纤维素酶,属于糖苷水解酶家族5,分别命名为cel7482、cel3623和cel36。在氨基酸水平上,三种纤维素酶与已知的纤维素酶具有约50%的序列相似性。三种纤维素酶的序列是新的,并且该酶在低ph和高温下具有高活性。
具体地,纤维素酶cel7482的基因7482的蛋白质编码区(cds)编码341个氨基酸,其理论分子量为41kd。使用ncbi的conserveddomainsearch(http://www.ncbi.nlm.nih.gov/structure/cdd/wrpsb.cgi)分析结构域,显示其具有糖基水解酶家族5的保守结构域。通过ncbi的blastp分析,纤维素酶基因7482与genbankaccessionno.aev59734的未培养细菌的纤维素酶同源性最高,氨基酸序列的identity为54%。
纤维素酶cel3623的基因3623cds编码354个氨基酸,其理论分子量为41kd。使用ncbi的conserveddomainsearch分析结构域,显示其具有糖基水解酶家族5的保守结构域。通过ncbi的blastp分析,纤维素酶基因3623与genbankaccessionno.gap08306的anaerolineathermolimosa的内切葡聚糖酶的同源性最高,氨基酸序列的identity为51%。
纤维素酶cel36的基因36cds编码515个氨基酸,其理论分子量为58kd。使用ncbi的conserveddomainsearch分析结构域,显示其具有糖基水解酶家族5的保守结构域。通过ncbi的blastp分析,纤维素酶基因36与genbankaccessionno.wp_010249757的acetivibriocellulolyticus的纤维素酶的同源性最高,氨基酸序列的identity为48%。
本发明还涉及一种含有所述核苷酸序列的重组载体,以及利用所述重组载体转化、转导或转染得到的遗传工程化宿主细胞。
本发明中,编码所述肽或蛋白的核苷酸序列可插入到载体中,以构成 含有本发明所述核苷酸序列的重组载体。“载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒或其它载体。在本发明中适用的载体还包括但不限于:在细菌中表达的基于t7启动子的表达载体;在哺乳动物细胞中表达的pcdna3.1载体和在昆虫细胞中表达的来源于杆状病毒的载体。总之,只要能在宿主体内稳定复制,任何质粒和载体都可以用于构建重组表达载体,优选pet载体系列以及其它原核表达载体系列。表达载体一个重要特征是通常含有复制起始点、启动子、标记基因和翻译调控元件。
本领域的技术人员熟知的方法可用于构建含编码具有纤维素酶活性或功能的肽或蛋白的dna序列和合适的转录/翻译调控元件的表达载体。这些方法包括体外重组dna序列、dna合成技术、体内重组技术等。所述的dna序列可有效连接到表达载体中的适当启动子上,以指导mrna的合成。这些启动子的代表性例子有:大肠杆菌的lac或trp启动子;噬菌体的pl启动子;真核启动子包括cmv早期启动子、hsv胸苷激酶启动子、早期和晚期sv40启动子、反转录病毒的ltrs和其它一些已知的可控制基因在原核细胞或真核细胞或其病毒中表达的启动子。表达载体还包括翻译起始用的核糖体结合位点和转录终止子等。在载体中插入增强子序列将会使其在高等真核细胞中的转录得到增强。增强子是dna表达顺式作用因子,通常大约有10到300个碱基对,作用于启动子以增强基因的转录。可举的例子包括在复制起始点晚期一侧的100到270个碱基对的sv40增强子、在复制起始点晚期一侧的多瘤增强子以及腺病毒增强子等。
此外,表达载体优选包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白,或用于大肠杆菌的卡那霉素或氨苄青霉素等。
本发明中,编码所述肽或蛋白的核苷酸序列或含有该核苷酸序列的重组载体可转化或转导入宿主细胞,以构成含有该核苷酸序列或重组载体的基因工程化宿主细胞。“宿主细胞”指原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表例子有:大肠杆菌,链霉菌属;细菌细胞如鼠伤寒沙门氏菌;真菌细胞如酵母;植物细胞;昆虫细胞如果蝇s2或sf9;动物细胞如cho、cos或bowes黑素瘤细胞等。
用本发明所述的dna序列或含有所述dna序列的重组载体转化宿主细胞可用本领域熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,或者常规机械方法如显微注射、电穿孔、脂质体包装等。
本发明还涉及所述核苷酸序列在制备重组纤维素酶中的应用。
通过常规的重组dna技术,利用本发明的核苷酸序列可用来表达或生产重组的纤维素酶。一般来说有以下步骤:
(1)用本发明的编码具有纤维素酶活性或功能的核苷酸序列(或变异体),或用含有该核苷酸序列的重组表达载体转化或转染合适的宿主细胞;
(2)在合适的培养基中培养宿主细胞;
(3)从培养基或细胞中分离、纯化蛋白质。
在步骤(2)中,根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞的条件下进行培养。当宿主细胞生长至适当的细胞密度后,用合适的方法诱导选择的启动子,将细胞再培养一段时间。
在步骤(3)中,重组肽蛋白可包被于细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法包括但不限于:常规的复性处理、蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超声波处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的组合。
本发明的要点在于提供了seqidno:1-3所示的氨基酸序列和seqidno:4-6所示的核苷酸序列,在已知该氨基酸序列和核苷酸序列的情况下,该氨基酸序列和核苷酸序列的获得,以及相关载体、宿主细胞的获得,对于本领域技术人员来说均是显而易见的。
本发明的有益效果主要体现在:本发明提供了一种新型的具有纤维素酶活性或功能的肽或蛋白及其编码序列,还提供了其最适ph范围、最适酶反应温度等酶学特性。本发明提供的具有纤维素酶活性或功能的肽或蛋 白耐酸性ph和高温,因此,它们对恶劣的工业催化条件有潜在的用途。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
图1示出在e.colibl21中表达的和纯化的纤维素酶的sds-page分析;其中,a为cel7482;b为cel3623,c为cel36;其中m为标准蛋白分子量标记,1为没有诱导的e.colibl21的总的细胞裂解液,2为诱导的e.colibl21的总的细胞裂解液,3为分子大小为41kda的纯化的蛋白质;
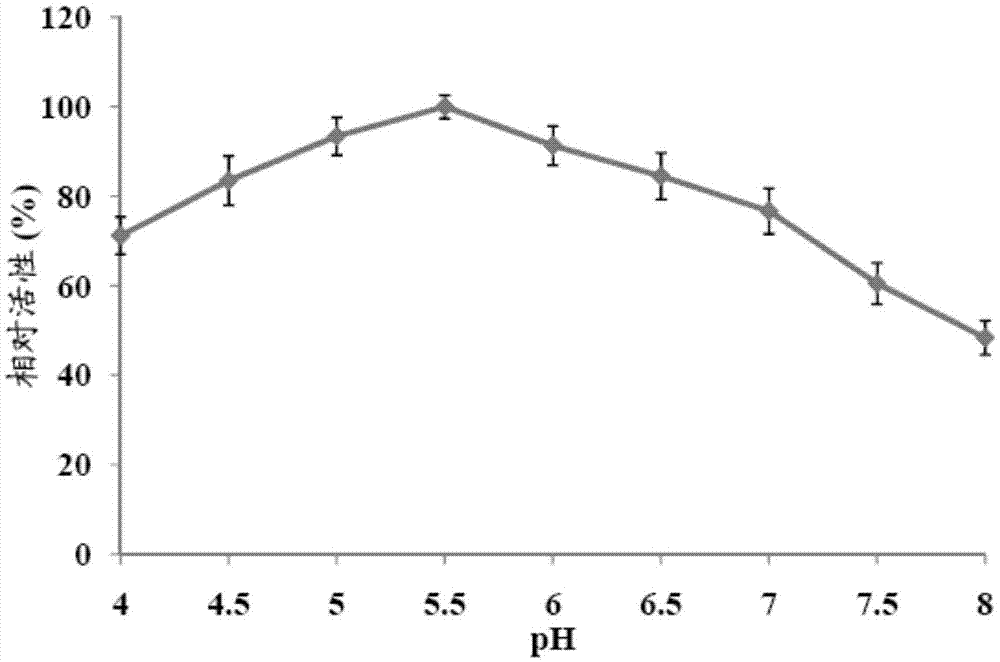
图2示出不同的ph对cel7482的活性影响;
图3示出不同的ph对cel3623的活性影响;
图4示出不同的ph对cel36的活性影响;
图5示出cel7482的热稳定性;
图6示出cel3623的热稳定性;
图7示出cel36的热稳定性;
图8示出不同的温度对cel7482的活性影响;
图9示出不同的温度对cel3623的活性影响;
图10示出不同的温度对cel36的活性影响;
图11为使用本发明的具有纤维素酶活性或功能的肽或蛋白的基因转化的重组e.colidh5α菌株降解滤纸的降解率示意图。
具体实施方式
以下将结合说明书附图和具体实施例进一步说明本发明,但实施例并不对发明做任何形式的限制。
除非特别说明,本发明所采用的试剂、方法和设备均为本领域常规试剂、方法和设备。
实施例1啤酒糟样品中宏基因组dna的获得
利用商业化试剂盒(用于土壤的fastdnaspinkit(mpbiomedicals,solon,oh))提取纯化啤酒糟中的基因组dna。dna可直接用于下游实验,无需进一步纯化;dna冷冻保存(-20℃~-80℃)。
实施例2从宏基因组dna中获得目的基因并进行序列分析
使用如下表1所示的引物序列,从宏基因组dna样品使用pcr得到3个纤维素酶基因,并将pcr产物进行琼脂糖凝胶电泳。同时,将纯化的pcr产物克隆到pmd19-tsimplevector(takara)并测序。
其中,所述方法具体如下:
pcr反应体系如下(50μl):正向和反向引物各2μl,2×extaqpcrmastermix25μl,基因组dna1μl,ddh2o20μl。
pcr程序如下:95℃预变性5min,30个循环(94℃变性45秒,62℃复性45秒,72℃延伸90秒),72℃最后延伸8分钟。
表1引物序列
表2使用的菌株、质粒和引物
根据测序结果,得到三种纤维素酶基因的相关序列,分别命名为cel7482、cel3623、cel36;
其中,纤维素酶基因7482cds编码341个氨基酸,其理论分子量为41kd。使用ncbi的conserveddomainsearch
(http://www.ncbi.nlm.nih.gov/structure/cdd/wrpsb.cgi)分析结构域,显示其具有糖基水解酶家族5的保守结构域。通过ncbi的blastp分析,纤维素酶基因7482与genbankaccessionno.aev59734未培养细菌的纤维素酶的同源性最高,氨基酸序列的identity为54%。
其中,纤维素酶基因36cds编码515个氨基酸,其理论分子量为58kd。使用ncbi的conserveddomainsearch分析结构域,显示其具有糖基水解酶家族5的保守结构域。通过ncbi的blastp分析,纤维素酶基因36与genbankaccessionno.wp_010249757的acetivibriocellulolyticus的纤维素酶的同源性最高,氨基酸序列的identity为48%。
其中,纤维素酶基因3623cds编码354个氨基酸,其理论分子量为41kd。使用ncbi的conserveddomainsearch分析结构域,显示其具有糖基水解酶家族5的保守结构域。通过ncbi的blastp分析,纤维素酶基因3623与genbankaccessionno.gap08306的anaerolineathermolimosa的内切葡聚糖酶的同源性最高,氨基酸序列的identity为51%。
实施例3目的基因在大肠杆菌中重组表达
将纤维素酶基因亚克隆到表达载体pet30a,提取质粒(相见表2中的质粒pet-c36、pet-c3623和pet-c7482)并转化到e.colibl21(de3)进行重组表达。表达后的蛋白使用ni-nta柱进行纯化,并将纯化后的蛋白进行sds-page电泳,其中表2中列出了本发明中使用的菌株和质粒。
其中,具体步骤如下:
从携带pet30a-cel的e.colibl21的培养物中纯化重组的纤维素酶,在 37℃,将5ml预培养物接种到1llb培养基中并生长至od600为0.6。随后,在30℃,加入0.5mm的iptg诱导蛋白表达12小时。根据标准程序,使用ni-nta亲和层析纯化重组的his6-标记的纤维素酶。简言之,在无细胞提取物ni-nta柱(novagen)上,his6-标记的纤维素酶紧密结合到ni-nta介质,并且融合蛋白被洗脱液(20mmtris-hcl,0.5mnacl,和300mm咪唑,ph7.9)洗脱。纯化的纤维素酶的纯度使用12%sds-page检查。蛋白质浓度使用bradford法测定。
所述活性测量使用dns方法,测量从cmc释放的还原糖的量分析酶催化活性。该分析混合物包含50μg纯化的酶、1%cmc(w/v)、100μl的50mmna2hpo4–nah2po4缓冲液(ph7.0),并且使用ddh2o将总体积调整至200μl。将分析混合物在37℃孵育10min;加入200μldns使反应停止,然后在水中沸腾5min。光度分析使用酶标仪(biolog)在od540读数。比酶活表达为单位(每分钟释放1μmol还原糖)每毫克蛋白质。
结果如下:
纤维素酶7482在e.colibl21中的表达通过sds-page分析表示如图1所示。通过使用ni-nta柱的金属亲和层析,从500mle.coli培养物中纯化重组的纤维素酶7482。his6-标记的纤维素酶7482紧密结合到ni-nta基质并且使用含300mm咪唑的洗脱液将融合蛋白洗脱,从而允许它们一步纯化到电泳纯的。
纯化的his6-标记的纤维素酶7482在sds-page的41kda的位置示出单条带,见图1,这与从融合蛋白推导的氨基酸序列估计的分子量有良好的一致性。从500mle.coli培养物中获得11mg纯化的纤维素酶7482,81%的最终产量,28.73u/mg的比活性,倍数为24。在表3中概括了纯化的数据。
表3使用金属亲和层析从500mle.coli培养物中纯化重组his6-标记的纤维素酶7482
纤维素酶3623在e.colibl21中的表达通过sds-page分析表示(图1)。通过使用ni-nta柱的金属亲和层析,从500mle.coli培养物中纯化重组蛋白。his6-标记的蛋白紧密结合到ni-nta基质并且使用含300mm咪唑的洗 脱液将融合蛋白洗脱,从而允许它们一步纯化到电泳纯的。纯化的his6-标记的蛋白质在sds-page的41kda的位置示出单条带(图1),这与从融合蛋白推导的氨基酸序列估计的分子量有良好的一致性。从500mle.coli培养物中通常获得14mg纯化的蛋白质,76%的最终产量,17.43u/mg的比活性,倍数为20。在表4中概括了纯化的数据。
表4使用金属亲和层析从500mle.coli培养物纯化重组his6-标记的纤维素酶3623
纤维素酶36在e.colibl21中的表达通过sds-page分析表示(图1)。通过使用ni-nta柱的金属亲和层析,从500mle.coli培养物中纯化重组蛋白。his6-标记的蛋白紧密结合到ni-nta基质并且使用含300mm咪唑的洗脱液将融合蛋白洗脱,从而允许它们一步纯化到电泳纯的。纯化的his6-标记的蛋白质在sds-page的58kda的位置示出单条带(图1),这与从融合蛋白推导的氨基酸序列估计的分子量有良好的一致性。从500mle.coli培养物中通常获得具有13mg纯化的蛋白质,80%的最终产量,14.08u/mg的比活性,纯化倍数为22。在表5中概括了纯化的数据。
表5使用金属亲和层析从500mle.coli培养物纯化重组his6-标记的纤维素酶36
实施例4ph值对本发明的纤维素酶的稳定性影响测试
制备ph范围为4~8的pbs缓冲液,ph值每增加0.5为一个梯度,测定本发明的纤维素酶在这些ph下的相对活性,检测结果如图2-4所示。
研究结果表明,纤维素酶7482的最适ph为5.5,并且在ph4~7的范围内保持70%以上的相对活性。纤维素酶3623最适ph为5.5,并且在ph4~6.5的范围内保持70%以上的相对活性。纤维素酶36最适ph为5.5,并且在ph4~7的范围内保持55%以上的相对活性。以上研究结果表明本发 明的纤维素酶具有酸碱适应性,且特别适于在酸性环境下对纤维素底物进行高效降解。
实施例5本发明的纤维素酶的热稳定性测试
将纯化的his6-标记的纤维素酶cel7482在55℃、70℃、80℃下,cel3623在55℃、65℃、75℃下和cel36在55℃、60℃、70℃下,分别的水浴中孵育3个小时后,测量其残余活性。所述活性测量时间间隔为0.5个小时,即在0小时、0.5小时、1小时、1.5小时、2小时、2.5小时和3小时分别测量其残余活性。
所述活性测量使用dns方法,测量从cmc释放的还原糖的量分析酶催化活性。该分析混合物包含50μg纯化的酶、1%cmc(w/v)、100μl的50mmna2hpo4–nah2po4缓冲液(ph7.0),并且使用ddh2o将总体积调整至200μl。将分析混合物在37℃孵育10min;加入200μldns使反应停止,然后在水中沸腾5min。光度分析使用酶标仪(biolog)在od540读数。比酶活表达为单位(每分钟释放1μmol还原糖)每毫克蛋白质。
结果如图5-7所示,从图中可以看出,纤维素酶的相对活性随着热处理的时间而降低,其中cel7482在55℃的相对活性下降低程度最小,在2.5小时,相对活性仍为80%,在3小时,相对活性为75%;80℃的相对活性下降低程度较快,在2小时cel7482失活;cel3623在55℃的相对活性下降低程度最小,在1.5小时,相对活性仍为80%,在2.5小时,相对活性为60%;75℃的相对活性下降低程度较快,在1.5小时cel3623失活;cel36在55℃的相对活性下降低程度最小,在1.5小时,相对活性仍为80%,在2小时,相对活性为60%;70℃的相对活性下降低程度较快,在1小时cel36失活。
为了确定cel7482、cel3623、cel36的最适温度,在得到最大酶活对应的温度之后,在该温度前后每5℃为一个梯度,从而得出该重组蛋白降解的最适温度为55℃(结果如图8-10)。
实施例6本发明的纤维素酶的过滤降解试验
通过过滤降解试验,评估使用纤维素酶基因转化的重组e.colidh5α菌株。通过使用不同的纤维素酶基因(本发明的纤维素酶cel36、cel7482、cel3623,对照为纤维素酶cel6228、cel7082和cel7419)转化的重组e.colidh5α菌株降解滤纸。作为结果,重组菌株表达的纤维素酶cel36、cel7482或cel3623对滤纸示出较高的降解活性。
在37℃下,细胞在添加100μg/ml氨苄青霉素和0.5mmiptg的lb培 养基中过夜生长。收获细胞,使用20mm磷酸盐缓冲液(ph7.0)冲洗,并在相同的缓冲液中重悬。随后,将细胞悬液与滤纸一起孵育,37℃振荡12小时,然后测量滤纸的重量损失。结果如图11所示,重组菌株表达的纤维素酶cel36、cel7482或cel3623对滤纸示出较高的降解活性,而纤维素酶cel6228、cel7082和cel7419的降解活性显著低于纤维素酶cel36、cel7482或cel3623。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基因片段、载体pPlasmid‑Clearance及应用的制作方法与工艺
- 一种米曲霉脂肪酶、编码基因、载体、工程菌及其应用的制作方法与工艺
- 一种正电性的基因载体功能的聚合物荧光碳量子点的制备方法及应用与流程
- 人工优化合成的Mat基因与重组载体以及改变作物抗性的方法与流程
- 斜带石斑鱼补体C1INH基因、载体、重组菌株和蛋白及其应用的制造方法与工艺
- 一种几丁质代谢调控基因、编码蛋白、载体、工程菌及其应用的制造方法与工艺
- 用于减弱基因编辑抗病毒转移载体免疫应答的方法和组合物与流程
- 苯丙氨酸变位酶、编码基因、重组载体、宿主细胞、多重PCR引物及它们的应用的制造方法与工艺
- Hg‑snb1基因片段介导的RNAi载体及其在培育抗大豆胞囊线虫转基因植物中的应用的制造方法与工艺
- 纤维素酶及其编码基因、重组载体和应用的制造方法与工艺