ERCC1基因多态性检测体系及其试剂盒的制作方法
本发明涉及一种基因多态性的检测产品以及该产品所用到的引物、探针、检测体系,属于生物技术领域。
背景技术:
单核苷酸多态性(snps)是人类和动物的基因组中普遍存在的一种分子标记,通常是特定位点存在两个等位基因,研究表明,基因多态性与某些基因组dna的修复功能有关,分子水平的疾病诊断可对肿瘤个体化治疗和预后判断提供指导。
切除修复交叉互补基团1(ercc1)是核苷酸切除修复途径(ner)的关键酶,而核苷酸切除修复是人类最重要的dna损伤修复机制,可以防止基因突变,主要修复累积性损伤,可切除几乎一切导致dna螺旋扭曲的大分子致癌物。研究表明,ercc1基因多态性可以影响核酸切除修复过程,并使其功能异常,基因不稳定增加,导致肿瘤的发生。ercc1基因常见的一个单核苷酸多态性位点是第四外显子的118c>t多态性位点,该密码子c→t的产生的变异虽然属于同义突变,但是能够影响ercc`蛋白水平的表达,即t等位基因的肿瘤患者的mrna水平更高。临床上通过检测ercc1的基因多态性,有助于帮助肿瘤患者预测铂类药物化疗的预后,指导用药和个性化治疗。目前主要测采用一代测序、flp、等位基因特异的寡核苷酸杂交、等位基因特异的pcr和基因芯片等技术,但是操作过程繁琐,需要更换反应管而易发生污染,多需要电泳和多步后处理,影响检测结果的准确性。或仪器设备昂贵,难以大规模推广应用。
传统的巢式pcr反应由于有2次pcr扩增,不但耗时、开管操作极易造成交叉污染导致假阳性及结果的不准确性,而检测结果需要电泳及凝胶成像系统才能看到结果,从而降低了扩增多个靶点的可能性,从pcr到检测结果出来大约需要5h,主要应用于分子生物学领域和医学检测研究中。
技术实现要素:
本发明要解决的技术问题是提供一种能在样本初始模板量低的条件下准确检测出样本基因ercc1的c118t多态位点的基因型的ercc1基因多态性检测试剂盒,以及该试剂盒所用的检测体系。
本发明为解决上述技术问题提出的一种技术方案是:一种ercc1基因多态性检测体系,包括检测引物对、检测探针和肽核酸,
所述检测引物对包括检测ercc1基因c118t多态性位点外侧的核苷酸序列如seqidno.1所示的外侧上游引物、检测ercc1基因c118t多态性位点外侧的核苷酸序列如seqidno.2所示的外侧下游引物、检测ercc1基因c118t多态性位点内侧的核苷酸序列如seqidno.3所示的内侧上游引物、检测ercc1基因c118t多态性位点内侧的核苷酸序列如seqidno.4所示的内侧下游引物;所述外侧上下游引物引入脱氧次黄嘌呤;
所述检测探针包括检测ercc1基因c118t多态性位点为野生型的核苷酸序列如seqidno.7所示的野生型探针和检测ercc1基因c118t多态性位点为纯合子的核苷酸序列如seqidno.8所示的纯合子探针;所述野生型探针和纯合子探针引入脱氧次黄嘌呤和错配碱基;所述肽核酸包括与检测ercc1基因c118t多态性位点的内侧上游引物部分互补的核苷酸序列如seqidno.5所示的肽核酸和与检测ercc1基因c118t多态性位点的内侧下游引物部分互补的核苷酸序列如seqidno.6所示的肽核酸。
上述ercc1基因多态性检测体系还包括内参引物对、内参探针、质控引物对和质控探针;
所述内参引物上游引物的核苷酸序列如seqidno.9所示,所述内参下游引物的核苷酸序列如seqidno.10所示,所述内参探针的核苷酸序列如seqidno.11所示;
所述质控上游引物的核苷酸序列如seqidno.12所示,所述质控下游引物的核苷酸序列如seqidno.13所示,所述质控探针的核苷酸序列如seqidno.14所示。
上述各个探针的5’端设有荧光报告基团,所述各个探针的3’端设有荧光淬灭基团;所述荧光报告基团是fam、hex、rox或cy5,所述荧光淬灭基团是bhq1、bhq2或tamra。
上述外侧上下游引物在反应体系中的最终浓度0.05μm/l,所述内侧上下游引物在反应体系中的最终浓度0.19μm/l,所述肽核酸在反应体系中的最终浓度为1nm/l,所述野生型探针在反应体系中的最终浓度为0.19μm/l,所述纯合子探针在反应体系中的最终浓度为0.19μm/l;
所述质控引物对在反应体系中的最终浓度为0.19μm/l,所述内参引物对在反应体系中的最终浓度为0.19μm/l,所述内参探针在反应体系中的最终浓度为0.19μm/l,所述质控探针在反应体系中的最终浓度为0.19μm/l。
上述ercc1基因多态性检测体系还包括甲酰胺,反应体系中加入甲酰胺的体积是反应体系总体积的12%。
本发明为解决上述技术问题提出的另一种技术方案是:一种采用上述检测体系的ercc1基因多态性检测产品。
本发明为解决上述技术问题提出的另一种技术方案是:一种ercc1基因多态性检测试剂盒,包括pcr检测液、质控检测液、阳性对照和阴性对照;
所述pcr检测液包括检测引物对、检测探针和肽核酸;
所述检测引物对包括检测ercc1基因c118t多态性位点外侧的核苷酸序列如seqidno.1所示的外侧上游引物、检测ercc1基因c118t多态性位点外侧的核苷酸序列如seqidno.2所示的外侧下游引物、检测ercc1基因c118t多态性位点内侧的核苷酸序列如seqidno.3所示的内侧上游引物、检测ercc1基因c118t多态性位点内侧的核苷酸序列如seqidno.4所示的内侧下游引物;所述外侧上下游引物引入脱氧次黄嘌呤;
所述检测探针包括检测ercc1基因c118t多态性位点为野生型的核苷酸序列如seqidno.7所示的野生型探针和检测ercc1基因c118t多态性位点为纯合子的核苷酸序列如seqidno.8所示的纯合子探针;所述野生型探针和纯合子探针引入脱氧次黄嘌呤和错配碱基;
所述肽核酸包括与检测ercc1基因c118t多态性位点的内侧上游引物部分互补的核苷酸序列如seqidno.5所示的肽核酸和与检测ercc1基因c118t多态性位点的内侧下游引物部分互补的核苷酸序列如seqidno.6所示的肽核酸;
所述质控检测液包括内参引物对、内参探针、质控引物对和质控探针;
所述内参引物上游引物的核苷酸序列如seqidno.9所示,所述内参下游引物的核苷酸序列如seqidno.10所示,所述内参探针的核苷酸序列如seqidno.11所示;
所述质控上游引物的核苷酸序列如seqidno.12所示,所述质控下游引物的核苷酸序列如seqidno.13所示,所述质控探针的核苷酸序列如seqidno.14所示;
所述阳性对照液是浓度为野生型质粒和纯合子质粒的混合溶液;
所述阴性对照液是浓度为不含ercc1基因野生型、杂合子和纯合子的质粒溶液。
上述pcr检测液和质控检测液中还包括pcr缓冲液、2.5mm的dntps和5u/μl的taqdna聚合酶;所述pcr缓冲液包括100mm的tris-hcl、15mm的kcl和15mm的mgcl2,用于配置所述pcr缓冲液的tris-hcl缓冲液的ph值为8.3;所述dntps包括datp、dgtp、dctp和dttp。
上述外侧上下游引物在反应体系中的最终浓度0.05μm/l,所述内侧上下游引物在反应体系中的最终浓度0.19μm/l,所述肽核酸在反应体系中的最终浓度为1nm/l,所述野生型探针在反应体系中的最终浓度为0.19μm/l,所述纯合子探针在反应体系中的最终浓度为0.19μm/l;
所述质控引物对在反应体系中的最终浓度为0.19μm/l,所述内参引物对在反应体系中的最终浓度为0.19μm/l,所述内参探针在反应体系中的最终浓度为0.19μm/l,所述质控探针在反应体系中的最终浓度为0.19μm/l。
上述ercc1基因多态性检测试剂盒还包括甲酰胺,反应体系中加入甲酰胺的体积是反应体系总体积的12%。
本发明具有积极的效果:
(1)本发明的ercc1基因多态性检测体系及其试剂盒,采用特异引物探针组合,采用改进后的巢氏pcr,增加了检测的敏感性和可靠性,闭管操作降低污染,具有高的灵敏度,灵敏度可达到0.5%~1%,与常规pcr的浓度相比,办发明容易地检测出非常低浓度样本的ercc1c118t位点的基因型。可以为铂类药物的临床用药提供指导。
(2)本发明的保留了原有的荧光定量的高敏感性和特异性的基础上,极大地缩短了实验时间,提高检测效率,节约样本,并且本发明的基因多态性检测试剂盒,采用金标准进行对照实验,基因型符合率≥99%,分子分型准确度高。
(3)本发明设计了内参和质控对检测的整个检测过程监控,确保样本可检测结果的准确性与可靠性。
附图说明
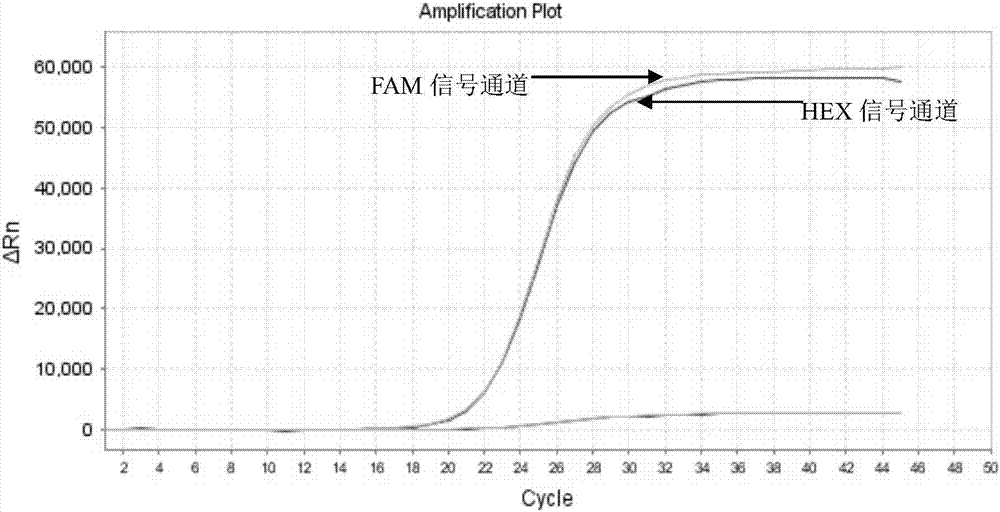
图1采用实施例的试剂盒检测阳性对照扩增曲线。
图2采用实施例的试剂盒检测野生样本扩增曲线。
图3采用实施例的试剂盒检测纯合样本扩增曲线。
图4采用实施例的试剂盒检测杂合样本扩增曲线。
具体实施方式
下面通过实施例对本发明进行具体的描述,有必要在此指出的是以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,该领域的技术人员可以根据上述本发明内容对本发明作出一些非本质的改进和调整。下述实施例中,若非特意表明,所用的试剂均为分析纯,所用试剂均可从商业渠道获得。文中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著的科学出版社2002年出版的《分子克隆实验指南》一书中所述的条件,或按照制造商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。
实施例
一、试剂盒的组成。
本实施例的ercc1基因多态性检测试剂盒包括:pcr检测液、质控检测液、阳性对照和阴性对照,具体成分如表1所示。
表1试剂盒组成表
上述表1中试剂盒各组分的说明如下:
pcr检测液由10×pcr缓冲液、dntps、热启动酶、引物探针肽核酸混合液配制而成。10×pcr缓冲液包括100mm的tris-hcl、500mm的kcl和15mm的mgcl2,用于配置pcr缓冲液的tris-hcl缓冲液的ph值为8.3。dntps包括datp、dgtp、dctp和dttp,在反应体系中终浓度为0.2mm。热启动酶是使用浓度为5u/μl的taqdna聚合酶,在反应体系中终浓度0.05u/μl。10×pcr缓冲液、dntps和热启动酶均来自takara(货号:r007a)。
引物探针肽核酸混合液包括检测ercc1基因的c118t位点的外侧上游引物、检测ercc1基因的c118t位点的外侧下游引物、检测ercc1基因的c118t位点的内侧上游引物、检测ercc1基因的c118t位点的内侧下游引物、针对ercc1基因的c118t位点的内侧上游引物的肽核酸、针对ercc1基因的c118t位点的内侧下游引物的肽核酸、检测ercc1基因的c118t位点的野生型探针、检测ercc1基因的c118t位点的纯合子探针,其核苷酸序列见表2,均由上海百力格生物技术有限公司合成。
外侧引物在反应体系中的最终浓度为0.05μm/l,内侧引物在反应体系中的最终浓度为0.19μm/l,肽核酸在反应体系最终的浓度为1nm/l,检测ercc1基因的c118t位点的野生型探针和检测ercc1基因的c118t位点的纯合子探针在最终反应体系中的最终浓度为0.19μm/l。为了减少非特异性扩增,提高检测的特异性和灵敏度,本实施例的检测反应体系中还加入12%甲酰胺试剂。
质控液由10×pcr缓冲液、dntps、热启动酶、引物对和探针混合液配制而成。10×pcr缓冲液包括100mm的tris-hcl、500mm的kcl和15mm的mgcl2,用于配置pcr缓冲液的tris-hcl缓冲液的ph值为8.3。dntps包括datp、dgtp、dctp和dttp,在反应体系中终浓度为0.2mm。热启动酶是使用浓度为5u/μl的taqdna聚合酶,在反应体系中终浓度0.05u/μl。10×pcr缓冲液、dntps和热启动酶均来自takara(货号:r007a)。
质控引物探针混合液包括内参上游引物、内参下游引物、内参探针、质控上游引物、质控下游引物、质控探针,其核苷酸序列见表2,均由上海生工生物工程有限公司合成。内参引物和探针在反应体系的最终浓度为0.19μm/l,质控引物和探针在反应体系的最终浓度为0.19μm/l。为了减少非特异性扩增,提高检测的特异性和灵敏度,本实施例的质控反应体系中加入12%甲酰胺试剂。
阳性对照液是浓度为10ng/μl的野生型质粒和10ng/μl的纯合子质粒的混合溶液。
阴性对照液是浓度为10ng/μl不含ercc1基因野生型、杂合子和纯合子的质粒溶液。
野生型质粒的获取为野生型质粒常规构建步骤:设计位于突变位点两侧的引物,扩增含对应位点的野生型产物,构建入质粒,挑选并测序验证。
纯合子质粒的获取为纯合子质粒常规构建步骤:设计一条覆盖相应多态性位点并将等位碱基引入到引物序列中的特异引物,与相对应的上游或下游野生型引物配对,扩增含相应位点的目的片段产物,构建入质粒,挑选并测序验证。
上述引物、探针和肽核酸的核苷酸序列如表2所示。
表2引物、探针、肽核酸序列表
ercc1外侧引物是针对ercc1基因的c118t多态性位点两侧产物长度约300-500bp的引物,ercc1内侧引物是针对ercc1基因的c118t多态性位点两侧产物长度约90-150bp的引物,为了使外侧引物先于内侧引物与dna模板结合,外侧引物引入脱氧次黄嘌呤,ercc1内侧肽核酸是针对ercc1基因的c118t多态性位点内侧的上游引物和内侧下游引物设计的dna类似物,肽核酸部分序列与内侧引物重合,能够先于内侧上游引物与dna模板结合,从而在反应初始阶段抑制了内侧引物的扩增,ercc1野生型探针和ercc1纯合子探针是针对ercc1基因的c118t多态性位点设计的特异性探针,探针的5’端标记有荧光信号基团,荧光信号基团有fam、hex、rox、cy5等,探针的3’端标记有荧光淬灭基团,荧光淬灭基团包括bhq1、bhq2、tamra等,由于野生型探针和纯合子探针序列只相差一个碱基,特异性较低,本发明将脱氧次黄嘌呤引入到检测多态性检测特异性探针中,并在探针的3’端引入1个错配碱基,在一定程度上提高探针的特异性。内参引物探针是区别于ercc1的gapdh基因,针对gapdh基因保守区域,通过检测内参基因的扩增,可分析实验结果有效性。
本实施例的野生型探针的荧光信号基团是fam,纯合子探针的荧光信号基团是hex。
质控基因的引物设计是排除ercc1基因外侧引物以外的ercc1基因其他位置保守区域,质控引物探针不享受突变检测位点引物和引物结合位点,在保守区域不同区段设计引物探针,质控序列扩增在本发明中作用除了可校正诸如dna含量、标本内pcr聚合酶抑制物,不同反应管间扩增效率的差异,还用于通过比较基因型和质控的扩增情况确定样本基因型。
二、试剂盒的使用方法。
本实施例的ercc1基因多态性检测试剂盒的具体检测步骤如下:
1、样本dna提取。
采用试剂盒(axygenmultisourcegenomicdnaminiprepkit)提取样本血液样本dna,或者采用康为世纪生物科技有限公司的口腔拭子基因组dna提取试剂盒(货号:cw0530s)抽提口腔黏膜样本dna,具体的操作参见试剂盒产品说明书。
2、样本dna质量检测。
获得样本dna后,通过thermo-fisher核酸蛋白定量仪(nanodrop2000)测定浓度和纯度,控制样本质量,最终加入反应体系中的样本。od260/od280的比值在1.8~2.0之间的可获得最优反应结果,浓度稀释为5~20ng/μl。
3、pcr反应。
采用本实施例的ercc1(c118t)基因多态性检测试剂盒试进行检测,反应体系的体积为10μl,试剂盒各组分的使用浓度及在反应体系中的终浓度详见表1。(反应体系的体积还可以是20μl,在配制时将10μl反应体系中的组分翻倍即可)。
1)配制10μl的质控pcr反应体系和10μl的检测pcr反应体系:
质控pcr反应体系:取9μl的质控检测液和1μl样本dna。检测pcr反应体系:别取9μl的检测试剂和1μl模板(如果是dna样本,浓度5~20ng/μl),并设置重复。
反应体系中的模板分别指对应的样本dna,阳性对照,阴性对照,空白对照,空白对照液为超纯水。
2)pcr反应程序。
各反应体系在abi实时荧光定量pcr扩增仪(stepone)上进行实时荧光pcr反应,最优反应程序如表3所示。
表3pcr反应程序表
优选地,pcr扩增的条件为:预变性阶段的条件95℃,10min;循环1,10个循环,条件为95℃15s,退火温度55℃,时间为10秒,延伸温度72℃,时间30秒;循环2,30个循环,条件为94℃15s,退火温度60℃,时间为10秒;循环3条件为4℃保温。本发明为了防止循环段2较长的片段的非特异性扩增,不设置延伸程序。
4、pcr结果判定。
1)试剂盒有效性的判定。
阳性对照:阳性对照fam和hex信号通道所有的扩增曲线有明显的指数增长期,且ct值均阳性≤25。
阴性对照:阴性对照fam、hex信号通道所有的扩增曲线无明显的指数增长期,或ct值均阴性≥40。
空白对照:空白对照阴性对照fam、hex信号通道所有的扩增曲线无明显的指数增长期。
2)检测样本有效性的判定。
根据内参fam通道和质控hex通道的ct值进行判定:
内参gapdh的fam信号通道扩增曲线呈s型,但ct<18,或者ct>32,检测结果无效;
内参gapdh的fam信号通道扩增曲线不呈s型,但且18≤ct≤32之间,样本检测结果无效;
内参gapdh的fam信号通道扩增曲线呈s型,并且18≤ct≤32之间,样本有效。
质控ercc1的hex信号通道扩增曲线呈s型,且ct<20,则样本基因组加入过量,建议稀释后重新检测;
质控ercc1的hex信号通道扩增曲线呈s型,20≤ct≤30,样本加入量适中,适合进行结果判定;
质控ercc1的hex信号通道扩增曲线呈s型,ct>30,则样本基因组加入量低,不能稳定的进行突变结果判定。
3)多态性结果的判定。
通过以上步骤,确定检测样本和实验结果均有效的前提下,再对样本的结果进行判定。野生基因型检测是检测反应液中fam信号通道的扩增情况,纯合基因型检测是检测反应液中hex信号通道的扩增情况。按照以下步骤对样本检测结果进行判读,确定样本基因型。
a.若检测液中有fam信号通道的扩增曲线有明显的指数增长期,hex信号通道的扩增曲线无明显的指数增长期,且20≤ct≤35,则检测样本为野生型。
b.若检测液中有hex信号通道的扩增曲线有明显的指数增长期,fam信号通道的扩增曲线无明显的指数增长期,且20≤ct≤35,则检测样本为纯合型。
c.若检测液中有fam和hex信号通道的扩增曲线均有明显的指数增长期,且|ct(检测fam)-ct(检测hex)|≤5,则检测样本为杂合型。
d.若检测液中有fam和hex信号通道的扩增曲线均有明显的指数增长期,|ct(检测fam)-ct(检测hex)|>5,则将检测的较小的ct值与质控ct比较,两者之间的差记做△△ct,若△△ct=|ct(检测fam/hex)-ct(质控hex)|≤8,则为ct值较小检测结果基因型,若△△ct=|ct(检测fam/hex)-ct(质控hex)|>8,重新检测。
显然,上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而这些属于本发明的精神所引伸出的显而易见的变化或变动仍处于本发明的保护范围之中。
sequencelisting
<110>上海赛安生物医药科技股份有限公司
<120>ercc1基因多态性检测体系及其试剂盒
<130>无
<160>14
<170>patentinversion3.3
<210>1
<211>18
<212>dna
<213>人工合成
<400>1
ggtgggaggagggaggag18
<210>2
<211>18
<212>dna
<213>人工合成
<400>2
ctcctccctcctcccacc18
<210>3
<211>20
<212>dna
<213>人工合成
<400>3
tgatggcttctgcccttcgt20
<210>4
<211>20
<212>dna
<213>人工合成
<400>4
tcacctgaggaacagggcac20
<210>5
<211>12
<212>dna
<213>人工合成
<400>5
tctgcccttcgt12
<210>6
<211>11
<212>dna
<213>人工合成
<400>6
gaacagggcac11
<210>7
<211>22
<212>dna
<213>人工合成
<400>7
cgtactgaagttcgtgctcaac22
<210>8
<211>21
<212>dna
<213>人工合成
<400>8
gtactgaagttcgtgcacaat21
<210>9
<211>21
<212>dna
<213>人工合成
<400>9
tgtaggagggacttagagaag21
<210>10
<211>21
<212>dna
<213>人工合成
<400>10
accctttagggagaaaacgct21
<210>11
<211>22
<212>dna
<213>人工合成
<400>11
cctgccctttgagtttgatgat22
<210>12
<211>21
<212>dna
<213>人工合成
<400>12
tgaggttccacatgatccagc21
<210>13
<211>21
<212>dna
<213>人工合成
<400>13
tgctgatggacacaggttggt21
<210>14
<211>22
<212>dna
<213>人工合成
<400>14
caatcccactgctgggtatatc22
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于HRM检测基因多态性的引物组合物的应用的制作方法与工艺
- MDR1基因多态性检测体系及其试剂盒的制作方法与工艺
- GSTP1基因多态性检测体系及其试剂盒的制作方法与工艺
- 一种检测MTHFR基因rs1801131多态位点基因型的方法及试剂盒与流程
- 检测10个位点耳聋基因多态性的SNaPshot试剂盒的制造方法与工艺
- 一种检测人类CYP2C19基因多态性的方法及试剂盒与流程
- CDA基因多态性检测体系及其试剂盒的制造方法与工艺
- 检测22个位点耳聋基因多态性的SNaPshot试剂的应用的制造方法与工艺
- 检测22个位点耳聋基因多态性的SNaPshot试剂盒的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺