用于检测不同亚型犬细小病毒的引物对和探针的组合产品的制作方法
本发明涉及病毒检测领域,具体而言,涉及一种用于检测不同亚型犬细小病毒的引物对和探针的组合产品。
背景技术:
犬细小病毒能够引起犬的急性致命的传染性胃肠炎和幼犬亚急性的心肌炎,该病毒发现于1978年,被认为是猫细小病毒的变异毒株,可能是猫细小病毒样病毒通过适应野生肉食动物而进化来的。虽然没有明确的证据,但是fpv和cpv的中间体病毒的存在和fpv不能感染犬一直支持着这种假说。犬细小病毒起初被称为cpv-2型,这是因为犬细小病毒从遗传进化和抗原特性上与之前从犬体内分离的犬微小病毒(canineminutevirus,cnmv又称canineparvovirustype1,cpv-1)不同,所以起初命名为canineparvovirustype2,简称cpv-2。现在犬微小病毒改名为肉食动物博卡细小病毒1型隶属于博卡细小病毒属,而犬细小病毒隶属于原细小病毒属,所以现在cpv特指犬细小病毒。与fpv相比cpv至少发生了6或7个氨基酸位点的改变,这些氨基酸位点影响了病毒与宿主细胞转铁蛋白受体(tfr)的结合能力,从而使cpv获得了与犬tfr结合的能力。与fpv相比另外一个重要的特性是cpv的进化速度更快,cpv的单核苷酸单位点每年的置换率达到了10-4,其基因置换率之快与某些rna病毒的基因置换率相仿。
cpv流行后最初的免疫接种程序可以有助于犬群体免疫力的增强,减少犬群体死亡率和遏制病毒进一步地扩大传播。然而宿主免疫压力或许促使了cpv新抗原型的出现。在1979年和1984年出现了两种新的抗原型,分别命名为cpv-2a型和cpv-2b型,新的抗原型可以用单克隆抗体与之前出现的cpv-2型进行区分。目前新的抗原型cpv-2a和cpv-2b已经完全取代了cpv-2型在世界各国犬体内广泛的流行感染,但是cpv-2型疫苗仍在广泛的使用。cpv-2a和cpv-2b型与cpv-2型相比在vp2蛋白上发生了5个或6个氨基酸的突变。cpv-2a与cpv-2b的区别在于只有2个氨基酸的改变,分别是n426d和i555v。
426位氨基酸位于衣壳蛋白的三折叠纤突上的a抗原表位上,在鼠微小病毒上426位氨基酸的作用已被证实与抗原免疫逃逸有关。原始cpv-2a型在第555位氨基酸残基为异亮氨酸,与cpv-2/2b型在第555位是缬氨酸不同。伴随着第555位氨基酸从i(异亮氨酸)到v(缬氨酸)的变化,最近cpv-2a株仅在vp2衣壳蛋白的第426位氨基酸残基与cpv-2b/2c有差异。
1987年发现的cpv-2a/2b型与之前报道的cpv-2a/2b型不同之处在于vp2蛋白上297位氨基酸发生了从丝氨酸(ser)到丙氨酸(ala)的突变,297位氨基酸残基位于vp2上b抗原表位上面,该位点的突变改变了病毒与宿主细胞受体的亲和力,并命名为newcpv-2a/2b型。而440位氨基酸残基从t(苏氨酸)到a(丙氨酸)的变化已广泛报道于世界各地分离毒株中,但是此位点突变的作用还不明确有待于进一步研究。267位残基到498位残基形成了位于gβ折叠桶和hβ折叠桶之间的gh闭合环,该闭合环暴露于病毒衣壳蛋白的外部,所以该段残基的改变影响了病毒衣壳蛋白的可塑性。
2000年在意大利分离得到vp2蛋白426位上天冬氨酸到谷氨酸的变异毒株,后来被称为cpv-2c型,很快cpv-2c型传播到了其他一些欧洲国家和其他的大洲。与cpv-2型相比,cpv-2a、cpv-2b和cpv-2c等新的抗原型病毒对犬的致病性更强,而且宿主范围也不断的扩大,包括能感染猫并引起猫的发病。研究发现cpv-2c型现已在世界范围内广泛的流行,而且常常引起成年犬严重的发病,即使疫苗免疫过的犬也会发病。
目前疫苗免疫是犬有效抵抗细小病毒感染的有效手段,灭活疫苗仅仅能够引起短期的免疫力而弱毒活疫苗已经广泛的用于本病的免疫预防上面,而且这些疫苗是非常有效的,能够保护犬免受细小病毒的感染,目前cpv-2型和cpv-2b型源的犬细小病毒活疫苗还是非常安全的,能够保护动物免受病毒的攻击,而且免疫犬也很少发生副反应。犬一旦感染cpv只能对症治疗,采取高免血清或单克隆抗体进行治疗。所用疫苗主要是cpv-2型和cpv-2b型源的单苗或者联苗,而没有cpv-2a型和cpv-2c型的疫苗。decaro等(2014)的血清流行病学研究发现,cpv-2型疫苗和cpv-2b型疫苗免疫犬产生中和抗体的时间有所不同,前者在免疫后14d才能产生有效的中和抗体,而后者只需7d就可以达到免疫保护。最近有报道现有的疫苗不能完全的保护cpv-2c型,免疫后的犬感染cpv而发生了细小病毒性腹泻。因此,无论是出于cpv不同亚型研究中的需要,还是为疫苗间的交叉保护研究及临床治疗提供技术支持,都需要提供一种高效的区分cpv不同亚型的方法。
有鉴于此,特提出本发明。
技术实现要素:
本发明人经过创造性的劳动和大量的试验,得到了能够用于检测检测犬细小病毒cpv-2型、2a型、2b型和2c型毒株的引物对和探针,所述引物对和探针可用于区分检测犬细小病毒cpv-2型、2a型、2b型和2c型毒株,且特异性强、灵敏度高。由此提供了下述发明。
本发明的一个方面涉及一种引物对和探针的组合产品,其选自如下引物对探针组合中的任一组或全部:
第一组:
探针cpv-2-305-p和/或cpv-2a-305-p,其核苷酸序列分别如seqidno:1-2所示;
上、下游引物cpv-305-f、cpv-305-r,其核苷酸序列分别如seqidno:3-4所示;
第二组:
探针cpv-2a-426-p、cpv-2b-426-p、cpv-2c-426-p中的一种、两种或全部,其核苷酸序列分别如seqidno:5-7所示;
上、下游引物cpv-426-f、cpv-426-r,其核苷酸序列分别如seqidno:8-9所示。
其中第二组引物对和探针的组合可用于区分cpv-2/2a型、2b型、2c型,但无法用于区分cpv-2型、2a型;第一组引物对和探针的组合可用于区分cpv-2型和2a/2b/2c型,但无法用于区分cpv-2a型、2b型和2c型。将两组配合使用可用于检测、定量分析犬细小病毒cpv-2型、2a型、2b型和2c型毒株中的任一种,或区分各种毒株。
所述引物和探针可以根据本领域的现有技术合成,也可以委托专业的公司制备。
具体地,所述探针带有可检测的标记。
优选的,根据本发明任一项所述的引物对和探针的组合产品,所述探针均为自身淬灭探针。
优选的,根据本发明任一项所述的引物对和探针的组合产品,所述自身淬灭探针的5′端标记荧光发射基团,3′端标记淬灭基团。
优选的,根据本发明任一项所述的引物对和探针的组合产品,所述荧光发射基团选自fam、hex、tamra、vic和joe。
探针cpv-2-305-p、cpv-2a-305-p、cpv-2a-426-p、cpv-2b-426-p、cpv-2c-426-p可以选择相同或不同的荧光发射基团。
优选的,根据本发明任一项所述的引物对和探针的组合产品,所述猝灭基团选自tamra、bhq和mgb。
更优选的,所述自身淬灭探针3′端结合有小沟结合物(mgb)。
探针cpv-2-305-p、cpv-2a-305-p、cpv-2a-426-p、cpv-2b-426-p、cpv-2c-426-p可以选择相同或不同的猝灭基团。
本发明的另一方面还涉及一种组合物,其含有如上所述的引物对和探针的组合产品。
所述组合物能够用于检测犬细小病毒cpv-2型、2a型、2b型和2c型毒株中的任一种,或区分各种毒株。
本发明的另一方面还涉及一种试剂盒,且包含权利要求如上所述的引物对和探针的组合产品,优选的,还包括rt-pcr反应缓冲液、反转录酶和taq酶中的一种或多种。
优选的,所述反转录酶为高效反转录酶(仅在5分钟内就可从高拷贝基因中生产大量的cdna,普通反转录酶需半小时),所述taq酶为热启动taq酶。
优选的,根据本发明任一项所述的试剂盒,其还包含rna提取试剂。
优选的,根据本发明任一项所述的试剂盒,其还包含阳性对照;
所述阳性对照选自cpv-2、cpv-2a、cpv-2b、cpv-2c的标准毒株中的一种或多种;更优选的,所述标准毒株为灭活毒株;
或;
所述阳性对照选自含有cpv-2、cpv-2a、cpv-2b、cpv-2c的标准毒株中的一种或多种vp2序列的质粒。
本发明提供的试剂盒能够用于检测犬细小病毒cpv-2型、2a型、2b型和2c型毒株中的任一种,或区分各种毒株。
根据本发明的一方面,本发明还涉及如上所述的引物对和探针的组合产品、如上所述的组合物或如上所述的试剂盒在制备用于检测或鉴别犬细小病毒cpv-2型、2a型、2b型和2c型毒株的试剂中的应用。
与现有技术相比,本发明的有益效果为:
快速简便、特异性强、敏感性高、可靠性好、检测成本低、时间短、检测效率高、准确性高、假阳性低等。本发明试剂盒不仅能检测犬细小病毒cpv-2型、2a型、2b型和2c型毒株,还能对各毒株进行区分和鉴定,能够为犬细小病毒的临床治疗提供指导,为疫情的监测、防控提供强有力的技术支持,有很好的应用前景。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
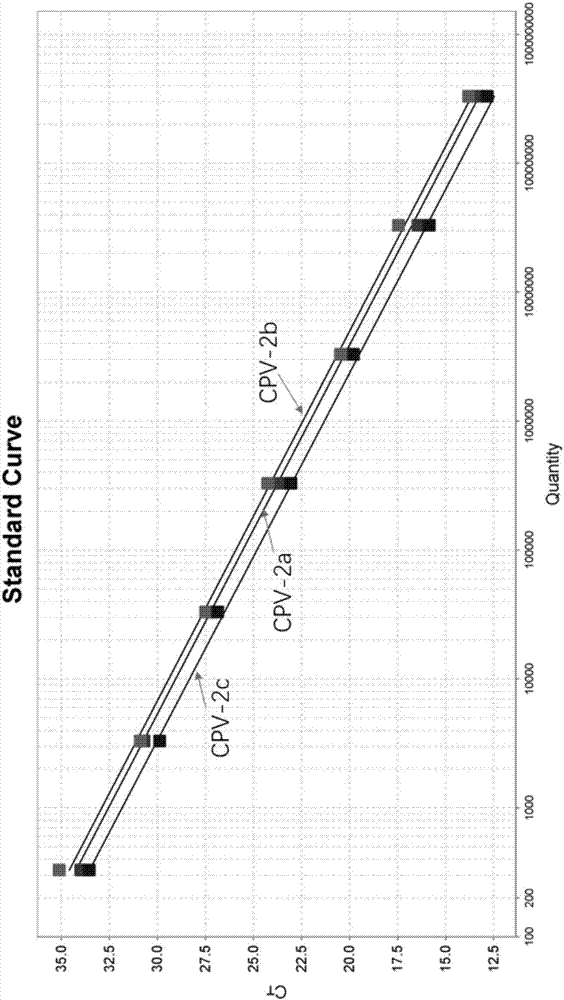
图1为用第一组引物对探针组合鉴定cpv-2和cpv-2a时的标准曲线;
图2为用第二组引物对探针组合鉴定cpv-2a、cpv-2b和cpv-2c时的标准曲线;
图3为用第一组引物对探针组合单独鉴定cpv-2时的溶解曲线;
图4为用第一组引物对探针组合鉴定cpv-2a/2b/2c时的溶解曲线;
图5为用第一组引物对探针组合鉴定cpv-2、cpv-2a/2b/2c时的溶解曲线;
图6为用第二组引物对探针组合鉴定cpv-2/2a时的溶解曲线;
图7为用第二组引物对探针组合单独鉴定cpv-2b时的溶解曲线;
图8为用第二组引物对探针组合单独鉴定cpv-2c时的溶解曲线;
图9为用第二组引物对探针组合鉴定cpv-2/2a、cpv-2b和cpv-2c时的溶解曲线;
图10为用第一组引物对探针组合对cpv-2、cpv-2a进行多重taqmanmgb荧光定量pcr时不同浓度的cpv-2的检测结果;
图11为用第一组引物对探针组合对cpv-2、cpv-2a进行多重taqmanmgb荧光定量pcr时不同浓度的cpv-2a的检测结果;
图12为用第二组引物对探针组合对cpv-2a、cpv-2b和cpv-2c进行多重taqmanmgb荧光定量pcr时不同浓度的cpv-2a的检测结果;
图13为用第二组引物对探针组合对cpv-2a、cpv-2b和cpv-2c进行多重taqmanmgb荧光定量pcr时不同浓度的cpv-2b的检测结果;
图14为用第二组引物对探针组合对cpv-2a、cpv-2b和cpv-2c进行多重taqmanmgb荧光定量pcr时不同浓度的cpv-2c的检测结果;
其中上述附图中cpv-2/2a、cpv-2a/2b/2c代表在图中无法区分,需要经过经过两组结合比对才能区分。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
1.序列分析
在genbank上下载所有犬细小病毒vp2序列,与中国农业科学院特产研究所特种动物病原与免疫团队保存的四株不同亚型毒株:cpvln15-32(cpv-2),cpvjl14-1(cpv-2a),cpvbj14-1(cpv-2b),cpvbj15-20(cpv-2c)的序列,利用mega7进行序列比对分析,vp2重要氨基酸和核苷酸位点突变如表1(参考毒株:cpv-2b,登录号:m38245)。
表1cpv不同基因型vp2基因氨基酸残基
a氨基酸残基和核苷酸位点以cpv-b毒株为参考(序列号:m38245)
b核苷酸位点
2.引物探针设计
mega7比对分析犬细小病毒vp2序列,针对vp2305位氨基酸残基的单核苷酸差异,设计区分cpv-2疫苗株与其他野生型的探针:cpv-2-305-p和cpv-2a-305-p及其上下游引物:cpv-305-f/cpv-305-r,针对vp2426位氨基酸残基的单核苷酸差异,设计区分cpv-2/2a与cpv-2b、cpv-2c相互区别的探针:cpv-2a-426-p、cpv-2b-426-p、cpv-2c-426-p,及其上下游引物:cpv-426-f/cpv-426-r如表2。
表2引物与探针序列
3.质粒构建
3.1核酸提取
分别取200ul四株毒株(cpvln15-32,cpvjl14-1,cpvbj14-1,cpvbj15-20)病毒原液,提取病毒dna。操作步骤按takara的minibestviralrna/dnaextractionkitver.5.0的操作说明进行。
①取200ul病毒原液,加入1.5ml离心管中。
②加入200ul的buffervgb、20ul的proteinasek和1.0ul的carrierrna,充分混匀于56℃水浴温浴10分钟。
③将spincolumn安置于collectiontube上,溶液移至spincolumn中,12000rpm离心2分钟,弃滤液。
④将500ul的bufferrwa加入至spincolumn中,12000rpm离心1分钟,弃滤液。
⑤将700ul的bufferrwb加入至spincolumn中,12000rpm离心1分钟,弃滤液。注:bufferrwb中已经加入了指定体积的无水乙醇。
⑥重复步骤⑤。
⑦将spincolumn安置于collectiontube上,12000rpm离心2分钟,弃滤液。
⑧将spincolumn安置于新的1.5mlrnasefreecollectiontube上,在spincolumn膜中央处加入30-50ul的rnasefreedh2o,室温静置5分钟。
⑨12000rpm离心2分钟,洗脱dna/rna。
3.2pcr扩增
以试剂盒提取的dna为模板,以cpv-up和cpv-down为引物进行pcr扩增。参照primertaqtm(extaqtmversion2.0plusdye)(takara,rr902a)说明,按以下组成配制pcr反应液
3.3pcr纯化
用稀释好的缓冲液(1×tae)配制1%凝胶。取5ulpcr产物加入凝胶孔中,电泳观察结果。剩余pcr产物参照
3.4连接
按以下反应体系表4将纯化的目的片段连接到peasy-t1载体上,反应条件为37℃15min。
表4连接反应体系(5ul)
3.2连接产物的转化
将连接产物,全部加入首先将连接产物,全部加入trans5α感受态细胞中,轻轻拍打管壁使其混匀,冰浴30min之后,放入42℃热激30s,立即取出置于冰浴2min;然后加入500ul无抗性lb培养液,放置于摇床中37℃200rpm,摇1h。4000rpm离心45s,留100ul上清轻轻吹起沉淀,将菌液均匀涂布与氨苄抗性的lb培养平板上,于37℃恒温培养箱中倒置培养过夜,观察生长情况。最后挑取单个菌落放入含有100u/mlamp的lb培养液中,置于摇床内37℃200rpm约12h,放大培养。
3.2质粒提取鉴定
按照北京全式金有限公司质粒提取试剂盒(easypureplasmidminiprepkit)使用说明书进行质粒提取,利用cpv-up/cpv-down进行pcr验证,并送库美生物公司测序分析。本研究共构建四种质粒,分别命名为cpvln15-32,cpvjl14-1,cpvbj14-1,cpvbj15-20
4.标准曲线建立
将cpvln15-32、cpvjl14-1、cpvbj14-1、cpvbj15-20四种标准质粒用双蒸水10倍系列稀释成8个梯度,使其终浓度为1×109copies/ul~1×102copies/ul。以此为模板,于abiquantstudiotmdesign荧光定量定量仪上,根据最佳的突光定量的体系进行扩增,在扩增完成后标准曲线于配套软件中自动生成。结果分别如图1和图2所示。
用第一组和第二组引物分别进行单独和多重pcr时的溶解曲线结果分别如图3-图9所示。
5.特异性试验
以cpvln15-32、cpvjl14-1、cpvbj14-1、cpvbj15-20四株毒株的标准质粒和dna以及其他犬源病毒犬腺病毒(cav)、犬冠状病毒(ccv)、犬瘟热病毒(cdv)的dna或cdna为模板,在优化反应条件下进行荧光定量,鉴定其特异性。
305位、426位探针及引物能对上述4种基因型的cpv质粒及dna进行检测扩增,而对cav、ccv、cdv的dna或cdna无扩增,表明本试验的引物和探针具有良好特异性。
6.敏感性试验
将cpvln15-32、cpvjl14-1、cpvbj14-1、cpvbj15-20四种标准质粒用双蒸水10倍系列稀释成7个梯度,使其终浓度为1×106copies/ul~1×100copies/ul。以此为模板,于abiquantstudiotmdesign荧光定量定量仪上,分别进行单重taqmanmgb荧光定量pcr,确定检出下限;将cpvln15-32和cpvjl14-1标准质粒1:1混合,双蒸水10倍稀释,使其终浓度为5×106copies/ul~5×100copies/ul,用第一组引物对探针组合进行多重taqmanmgb荧光定量pcr,确定检出下限,结果分别如图10和图11所示;将cpvjl14-1和cpvbj14-1和cpvbj15-20标准质粒1:1:1混合,双蒸水10倍稀释,使其终浓度为3.3×106copies/ul~3.3×100copies/ul,用第二组引物对探针组合进行多重taqmanmgb荧光定量pcr,确定检出下限结果分别如图12-14所示。
图10cpv-2;1×101copies/ul
图11cpv-2a;1×102copies/ul
图12cpv-2a;3.3×101copies/ul
图13cpv-2b;3.3×101copies/ul
图14cpv-2c;3.3×102copies/ul
7.重复性试验
将cpvln15-32、cpvjl14-1、cpvbj14-1、cpvbj15-20四种重组质粒标准品,10倍倍比稀释后,取高、中、低三个浓度梯度(108copies/ul、106copies/ul、104copies/ul),首先对单个质粒标准品分别进行单重荧光定量组pcr组内及组间重复性试验,再将质粒标准品混合分别进行鉴别疫苗株与野毒株,和鉴别cpv-2a/2b/2c的多重荧光定量组内及组间重复性试验,根据值计算组内和组间变异系数,鉴定其稳定性。
上述试验变异系数在0.2%-2.5%之间,具有良好的重复性。
8.临床应用试验
应用所建立的taqmanmgb多重荧光定量pcr,对河北、北京等地区送检的胶体金试纸条检测犬细小病毒的阳性粪便样品进行检测,并结合序列测定以评价本方法的实用性及符合率。
对临床114份cpv病料进行荧光定量pcr检测并且进行序列测定符合实验结果如下。荧光定量pcr结果和测序结果符合率为100%,在检测的114份阳性病料中,cpv-2、2a、2b和2c型分别为2、57、25和30份。
表3pcr体系(50ul)
预扩增反应程序为:95℃预变性5min;95℃变性1min,55℃退火1min,72℃延伸2min;循环35次;72℃终延伸10min。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
sequencelisting
<110>中国农业科学院特产研究所
<120>用于检测不同亚型犬细小病毒的引物对和探针的组合产品
<160>9
<170>patentinversion3.3
<210>1
<211>22
<212>dna
<213>人工序列
<400>1
actcctatatcaccaaagttag22
<210>2
<211>24
<212>dna
<213>人工序列
<400>2
actcctatataaccaaagttagta24
<210>3
<211>24
<212>dna
<213>人工序列
<400>3
cgttgcctcaatctgaaggagcta24
<210>4
<211>24
<212>dna
<213>人工序列
<400>4
ttgcccatttgagttacaccacgt24
<210>5
<211>25
<212>dna
<213>人工序列
<400>5
cctgtaacaaatgataatgtattgc25
<210>6
<211>26
<212>dna
<213>人工序列
<400>6
cttcctgtaacagatgataatgtatt26
<210>7
<211>26
<212>dna
<213>人工序列
<400>7
cttcctgtaacagaagataatgtatt26
<210>8
<211>26
<212>dna
<213>人工序列
<400>8
aggaagatatccagaaggagattgga26
<210>9
<211>27
<212>dna
<213>人工序列
<400>9
ccaattggatctgttggtagcaataca27
- 还没有人留言评论。精彩留言会获得点赞!
- 一种快速区分prv中国型、欧美型及疫苗株的双色荧光检测方法、引物及探针的制作方法
- 实时荧光pcr技术定量检测myd88基因l265p突变的方法、引物和探针的制作方法
- 用于定性检测白血病融合基因的引物、探针、试剂盒及方法
- 在体外检测或/及定量乙型肝炎病毒的方法及其所使用的引物、探针的制作方法
- 用于检测多种呼吸道病毒的pcr引物组、探针组及试剂盒的制作方法
- 一种检测人类met基因14外显子剪接突变的引物、探针及试剂盒的制作方法
- 使用重叠引物和熔解探针检测单核苷酸多态性的制作方法
- 用于检测多种呼吸道病毒的pcr引物组、探针组及试剂盒的制作方法
- 一种检测人类met基因14外显子剪接突变的引物、探针及试剂盒的制作方法
- 使用重叠引物和熔解探针检测单核苷酸多态性的制作方法
- 一种木瑚菌属食用菌鉴别用分子标记及引物和探针的制造方法与工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种快速检测异鳞蛇鲭和棘鳞蛇鲭源性成分的方法与制造工艺
- 一种检测食管癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测皮肤癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测骨髓瘤相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种用于检测样品中牛凸隆病毒的荧光RT-PCR引物、探针和试剂盒及检测方法与制造工艺
- CYP2C19基因多态性检测引物、探针及试剂盒的制造方法与工艺
- 检测CYP2C9和VKORC1基因多态性的引物、探针和试剂盒的制造方法与工艺