柯萨奇病毒A6型和A10型联合检测试剂盒及其应用的制作方法
本发明属于生物医学技术领域,具体涉及一种柯萨奇病毒a6型和a10型联合检测试剂盒及其应用。
背景技术:
手足口病,是一种由多种肠道病毒引起的儿童传染病。5岁以下儿童为易患人群,主要表现为口腔、手、足部位皮疹,少数病例可并发脑膜炎、脑炎,甚至肺水肿、循环衰竭等导致死亡。引起手足口病的病原体包括柯萨奇病毒、埃可病毒和新型人肠道病毒等,以ev71型和ca16型最常见。然而,近年来,其它肠道病毒感染的病例有逐渐增多的趋势。
柯萨奇病毒a6型和a10型是近年来在手足口病病原谱中呈逐渐上升趋势的病原体,都属于肠道病毒属中柯萨奇病毒a组成员。近年年,西班牙、芬兰、日本、美国、泰国、马来西亚和中国都有柯萨奇病毒a6型致手足口病的报道,感染柯萨奇病毒a6型的患者出现非传染的手足口症状,主要表现为口周、肛周、手足甚至躯干、头部等多个部位的广泛出疹,部分患者在病发后期还会出现脱皮、脱甲等。柯萨奇病毒a10型常可导致一些轻症的疾病,如手足口病、疱疹性咽峡炎等,但是国内外也有病毒性脑膜炎、死亡等重症病例的报道。
目前市场上的检测产品多为只检测是否是肠道病毒,但不能区分属于哪种肠道病毒,只有肠道病毒71型和柯萨奇病毒a16型有单独的检测产品,很少见有能区分其它肠道病毒型别的产品。因此建立快速、准确柯萨奇病毒a6和a10型产品就显得尤为重要。
技术实现要素:
为了克服现有技术中的缺陷,本发明的目的在于提供一种柯萨奇病毒a6型和a10型联合检测试剂盒及其应用。以实现单管联合检测柯萨奇病毒a6型及a10型。
为实现上述目的及其他相关目的,第一方面,本发明提供了一种柯萨奇病毒a6型和a10型联合检测试剂盒,包括:柯萨奇病毒a6型反应物、柯萨奇病毒a10型反应物;其中,所述柯萨奇病毒a6型反应物包括:柯萨奇病毒a6型上游引物、柯萨奇病毒a6型下游引物、柯萨奇病毒a6型探针,所述柯萨奇病毒a6型探针的结构为5’-第一荧光报告基团-第一碱基序列-荧光淬灭基团-3’;所述柯萨奇病毒a10型反应物包括:柯萨奇病毒a10型上游引物、柯萨奇病毒a10型下游引物、柯萨奇病毒a10型探针,所述柯萨奇病毒a10型探针的结构为5’-第二荧光报告基团-第二碱基序列-荧光淬灭基团-3’;所述第二荧光报告基团与所述第一荧光报告基团不同。
在一个可能的实现方式中,所述柯萨奇病毒a6型和a10型联合检测试剂盒还包括内部对照品和/或阳性对照品。
在一个可能的实现方式中,所述柯萨奇病毒a6型上游引物的碱基序列如seqidno.1所示,具体为:5’-tgtcggtgaatagrttcta-3’;所述柯萨奇病毒a6型下游引物的碱基序列如seqidno.2所示,具体为:5’-ctgtgtcatttagyacrtca-3’;所述第一碱基序列的探针序列如seqidno.3所示,具体为:5’-agccagtagattctgtcttccarctc-3’。
在一个可能的实现方式中,所述柯萨奇病毒a10型上游引物的碱基序列如seqidno.4所示,具体为:5’-gaagcaacaggattraca-3’;所述柯萨奇病毒a10型下游引物的碱基序列如seqidno.5所示,具体为:5’-gtccaactaaggtrgattg-3’;所述第二碱基序列的探针序列如seqidno.6所示,具体为:5’-trataccagtgtcctcgcagaa-3’。
在一个可能的实现方式中,所述第一荧光报告基团为fam,或hex/vic/joe,或calred610/rox/texasred。
在一个可能的实现方式中,所述第二荧光报告基团为fam,或hex/vic/joe,或calred610/rox/texasred。
在一个可能的实现方式中,所述荧光淬灭基团为bhq1。
在一个可能的实现方式中,所述第一荧光报告基团为fam,所述第二荧光报告基团为hex。
在一个可能的实现方式中,述柯萨奇病毒a6型和a10型联合检测试剂盒还包括taq酶和逆转录酶。
第二方面,本发明提供了第一方面所述的柯萨奇病毒a6型和a10型联合检测试剂盒在制备手足口病病原体检测试剂中的用途。
第三方面,本发明提供了第一方面所述的柯萨奇病毒a6型和a10型联合检测试剂盒在制备柯萨奇病毒a6型和/或柯萨奇病毒a10型检测试剂中的用途。
与现有技术相比,本发明的有益效果在于:
可以在同一反应管中同时检测柯萨奇病毒a6型和a10型,提高了检测效率,并且有助于节约标本用量,可应用取材较少的检测。
附图说明
图1为柯萨奇病毒a6型检测样品的灵敏度检测曲线图;
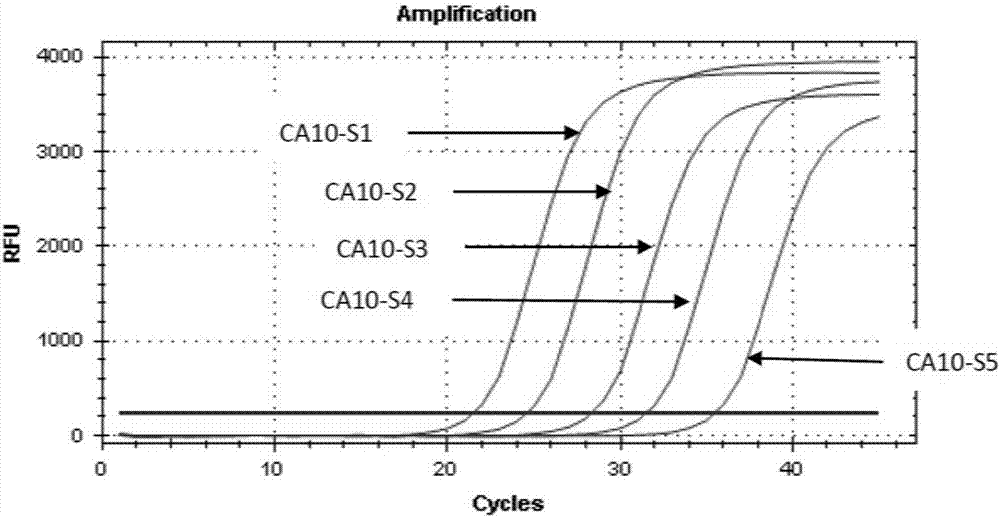
图2为柯萨奇病毒a10型检测样品的灵敏度检测曲线。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其它优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecμlarcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecμlarbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecμlarbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
荧光rt-pcr技术是上世纪九十年代末才发展起来的新技术,它具有快速、特异性、灵敏度高、成本相对低等优点,被广泛应用于临床检测的各个方面。目前已开发出利用荧光定量pcr技术针对肠道病毒总型或者肠道病毒71型和柯萨奇病毒a16型的快速检测试剂盒。因此本发明在荧光rt-pcr技术的基础上,建立单管联合检测柯萨奇病毒a6型及a10型的方法具有非常重要的意义。
在本发明实施例中,采用taqman荧光定量pcr原理,分别针对柯萨奇病毒a6型及a10型设计特异性引物,扩增特异性核酸序列,同时分别设计taqman探针,并标记不同的荧光报告基团,位于上下游引物之间。探针其5’端标记荧光报告基团,3’端标记非荧光淬灭基团。当探针完整的时候,报告基团所发射的荧光能量被淬灭基团吸收,仪器检测不到信号。随着pcr的进行,taq酶在链延伸过程中遇到与模板结合的探针,其5′→3′外切核酸酶活性就会将探针切断,报告基团远离淬灭基团,其能量不能被吸收,即产生荧光信号。因此,本发明采用的荧光定量pcr技术具有实时检测、定量和高通量检测等特点,且操作简便、灵敏度高、特异性好等优点。
实施例1.柯萨奇病毒a6和a10型联合检测试剂盒对标品中柯萨奇病毒a6型和a10型检测
11、配制核酸荧光pcr检测混合液:
取柯萨奇病毒a6型上游引物0.5μl/test,下游引物0.5μl/test,探针0.1μl/test;柯萨奇病毒a10型上游引物0.5μl/test;下游引物0.5μl/test;探针0.1μl/test;内部对照品探针0.1μl/test;实时定量pcr(realtime-pcr,rt-pcr)mix12.5μl/test;工艺用水3.2μl/test;混匀即为柯萨奇病毒a6型和a10型核酸荧光pcr检测混合液。
其中,所述柯萨奇病毒a6型上游引物的碱基序列如seqidno.1所示,具体为:5’-tgtcggtgaatagrttcta-3’;所述柯萨奇病毒a6型下游引物的碱基序列如seqidno.2所示,具体为:5’-ctgtgtcatttagyacrtca-3’;所述柯萨奇病毒a6型探针的结构为5’-第一荧光报告基团-第一碱基序列-荧光淬灭基团-3’;其中,第一荧光报告基团为fam,荧光淬灭基团为bhq1,第一碱基探针序列如seqidno.3所示,具体为:5’-agccagtagattctgtcttccarctc-3’。
所述柯萨奇病毒a10型上游引物的碱基序列如seqidno.4所示,具体为:5’-gaagcaacaggattraca-3’;所述柯萨奇病毒a10型下游引物的碱基序列如seqidno.5所示,具体为:5’-gtccaactaaggtrgattg-3’;所述柯萨奇病毒a10型探针的结构为5’-第二荧光报告基团-第二碱基序列-荧光淬灭基团-3’,所述第二荧光报告基团为hex,所述荧光淬灭基团为bhq1,所述第二碱基序列的探针序列如seqidno.6所示,具体为:5’-trataccagtgtcctcgcagaa-3’。在一个替换方案,第二荧光报告基团还可以为vic/joe。
内部对照品探针的荧光报告基团为rox,在替代方案中所述内部对照品探针的荧光报告基团还可以为calred610/texasred。
rt-pcrmix中含有dntp、缓冲液等。
12、标本的核酸提取:
用商业化的病毒rna抽提试剂盒提取标本中的总rna;其中,标本可以临床样本,具体可以为咽拭子,也可以为粪便。
13、配制pcr反应体系:
131、试剂配制:
取n×18μl步骤11制备的柯萨奇病毒a6型和a10型核酸荧光pcr检测混合液和n×1μl内部对照品,以及n×1μlrt-pcr酶(n为反应管数),振荡混匀数秒,3000rpm离心数秒。rt-pcr酶中包括热启动taq酶和逆转录酶。
132、加样:
取步骤131制备的混合液20μl置于薄壁pcr管或pcr反应板中,然后将提取的标本的总rna、阳性对照品、depc-h2o各5μl分别加入薄壁pcr反应管或pcr反应板中,盖好薄壁pcr反应管盖或pcr反应板膜,离心数秒后立即进行pcr扩增反应。
133、pcr扩增:
将步骤132中的薄壁pcr管或pcr反应板置于定量荧光pcr仪上,循环参数可以为:
45℃×10min;95℃×15min;再按95℃×15sec→60℃×60sec,循环40次;单点荧光检测在60℃。反应体系为25μl。
134、基线和阈值设定:
基线调整取6-15个循环的荧光信号,阈值设定原则以阈值线刚好超过depc-h2o检测荧光曲线的最高点。
135、质量控制:
阳性对照品和内部对照品须达到以下如表1所示的要求,否则实验无效。
表1
136、实验结果判断:
实验结果如表2所示。
表2
在实施例1中,涉及了2对pcr引物和探针分别针对特异性扩增柯萨奇病毒a6型和a10型,2对pcr引物可在同一pcr反应管里同时进行扩增,实现多重检测,大大缩短检测时间,操作简便。特异性引物和和探针的设计保证了引物和探针的高度保守和特异性,避免了两对引物和探针之间无互补配对或交叉扩增的情况。实施例1选用的三个荧光基团的荧光波长相差较大且信号强度相近,避免了信号之间的相互干扰。
实施例2.柯萨奇病毒a6和a10型联合检测试剂盒的灵敏度分析。
21、制备检测样品:
取1×107copies/ml的柯萨奇病毒a6型质粒(ca6-s1)按1:10、1:100、1:1000、1:10000稀释,获得ca6-s2(1×106copies/ml)、ca6-s3(1×105copies/ml)、ca6-s4(1×104copies/ml)、ca6-s5(1×103copies/ml)共5份作为柯萨奇病毒a6型检测样品。
取1×107copies/ml的柯萨奇病毒a10型质粒(ca10-s1)按1:10、1:100、1:1000、1:10000稀释,获得ca10-s2(1×106copies/ml)、ca10-s3(1×105copies/ml)、ca10-s4(1×104copies/ml)、ca10-s5(1×103copies/ml)共5份作为柯萨奇病毒a10型检测样品。
22、配制试剂:
取实施例1中的步骤131制备的混合液20μl置于薄壁pcr管或pcr反应板中,然后将步骤12制备的各检测样品、阳性对照品、depc-h2o各5μl分别加入薄壁pcr反应管或pcr反应板中,盖好薄壁pcr反应管盖或pcr反应板膜,离心数秒后立即进行pcr扩增反应。
23、pcr扩增:
将步骤132中的薄壁pcr管或pcr反应板置于定量荧光pcr仪上,循环参数可以为:
45℃×10min;95℃×15min;再按95℃×15sec→60℃×60sec,循环40次;单点荧光检测在60℃。反应体系为25μl。
24、检测结果:
各检查样品的检测结果如表3所示。柯萨奇病毒a6型检测样品的灵敏度检测曲线如图1所示;柯萨奇病毒a10型检测样品如图2所示。
表3
备注:+代表阳性结果,即检出了柯萨奇病毒a6型或柯萨奇病毒a10型.
表3表明,对于柯萨奇病毒a6型质粒,ca6-s1(1×107copies/ml)—ca6-s5(1×103copies/ml)均检测为阳性,表明试剂盒检测柯萨奇病毒a6型的检测灵敏度能达到1×103copies/ml。对于柯萨奇病毒a10型质粒,ca10-s1(1×107copies/ml)——ca10-s5(1×103copies/ml)均检测为阳性,表明试剂盒检测a10型的检测灵敏度能达到1×103copies/ml。
综上所述,可以在同一反应管中同时检测柯萨奇病毒a6型和a10型,提高了检测效率,并且有助于节约标本用量,可应用取材较少的检测。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
序列表
<110>杨兴林
<120>柯萨奇病毒a6和a10型联合联合检测试剂盒及其应用
<130>174853
<160>6
<170>siposequencelisting1.0
<210>1
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>1
tgtcggtgaatagrttcta19
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
ctgtgtcatttagyacrtca20
<210>3
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>3
agccagtagattctgtcttccarctc26
<210>4
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>4
gaagcaacaggattraca18
<210>5
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>5
gtccaactaaggtrgattg19
<210>6
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>6
trataccagtgtcctcgcagaa22
- 还没有人留言评论。精彩留言会获得点赞!