用于鉴别变异型PEDV和TGEV的检测引物和探针的制作方法
本发明提供一组用于鉴别变异型pedv和tgev的实时荧光定量pcr检测引物和探针,属于动物传染病学检测领域。
背景技术:
猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)和猪传染性胃肠炎病毒(transmissiblegastroenteritisvirus,tgev)是引起猪病毒性腹泻的主要病原。被感染的仔猪主要临床症状表现为腹泻、呕吐和脱水,各年龄阶段猪均可感染。由于两者引起的症状、病理变化和流行病学极为相似,且往往混合感染,单单凭借临床症状和组织病理学难以鉴别诊断。近年来其因其传染性强,死亡率高,给生猪养殖业造成不可估量的经济损失,严重困扰养猪业的发展。
pedv为线性单股正链rna病毒,属于尼多病毒目,冠状病毒科,冠状病毒属。病毒粒子呈多形性,大小变化不一,其直径为95-190nm,囊膜上有花瓣状纤突,纤突短小而密集,纤突约长18-23nm,从核心向四周呈放射状分布,排列规则似皇冠。该病于1971年首先在英国发生,1978年比利时科学家从病料中分离到病毒,命名为cv777。我国于2010年发现新的变异型pedv毒株,暴发了严重的疫情。tgev为线性单股正链rna病毒,属于冠状病毒科,冠状病毒属。病毒粒子直径为90-200nm,呈椭圆形、圆形或多边形,有囊膜,表面有棒状纤突。该病于1933年首先发生于美国伊利诺伊州,1946年确定该病的病原体并做了详细的报告。我国于1958年发生本病。由于这2种病原体在临床上常表现为混合感染,同时变异型pedv毒株与经典cv777毒株的遗传距离较远,因而给疫病的鉴别、诊断带来了很大困难,因此急需建立特异性的鉴别诊断方法。
当前,pedv和tgev两种病毒鉴别诊断的传统方法主要有病毒分离、免疫组织化学和电镜等常规的诊断技术,而传统方法由于操作繁琐、耗时长且成本较高,应用范围大大受到限制。随着分子生物学的发展,pcr检测方法,应用越来越广泛,taqman荧光探针法实时荧光定量pcr(quantitativereal-timepcr)是在加入引物的同时加入一个特异性的荧光探针,探针完整时,报告基团发射的荧光信号被淬灭基团吸收,从而出现荧光信号,通过收集荧光信号的累积与pcr产物形成完全同步。因此实时荧光定量pcr技术在检测病原时能够定性检测病原,而且还能通过荧光信号的收集实现定量的分析病毒含量的多少。多重荧光定量pcr是一种特殊的荧光定量pcr形式,其突出的特点是一次实时荧光定量pcr反应可同时检测多种病原,能实现对复杂病原或存在多种基因型的病原进行鉴别检测。
在临床上,猪病毒性腹泻疫病常呈混合感染状态,主要的病原有变异型pedv和tgev,两者感染的临床症状相似,很难从临床症状和病理变化上鉴别诊断。因此,建立能够同时对变异型pedv和tgev的鉴别检测方法,既可简化操作程序、节约成本,临床上可进行大样本的检测,对猪病毒性腹泻病毒的流行病学调查及开展相关的致病机理研究具有重要的意义,尤其是在混合感染的样品中的病原体鉴别检测上具有独特的优势和使用价值。
技术实现要素:
本发明提供一组用于鉴别变异型pedv和tgev的实时荧光定量pcr检测引物和探针。建立能够同时对变异型pedv和tgev的鉴别检测方法,既可简化操作程序、节约成本,临床上可进行大样本的检测,对猪病毒性腹泻病毒的流行病学调查及开展相关的致病机理研究具有重要的意义,尤其是在混合感染的样品中的病原体鉴别检测上具有独特的优势和使用价值。
本发明是通过以下技术方案来实现的:
用于检测变异型pedv的n基因:
上游引物pedv-f(5'-3'):ctcccgagtgtagttgagattg
下游引物pedv-r(5'-3'):ctccacgaccctggttattt
荧光探针pedv-p(5'-3'):fam–caacccaacacacctcctacttcacg-bhq1;
用于检测tgev的s基因:
上游引物tgev-f(5'-3'):tgagggtgctggctttgat
下游引物tgev-r(5'-3'):caagagtgacaccacccgtt
荧光探针tgev-p(5'-3'):vic-cactgtggcacccttacctgattgt-bhq1。
其中,变异型pedv的荧光探针pedv-p的5’端标记有荧光报告基团fam,tgev的荧光探针tgev-p的5’端标记有荧光报告基团vic;变异型pedv的荧光探针pedv-p的3’端和tgev的荧光探针tgev-p的3’端均标记淬灭基团bhq1。
用于鉴别变异型pedv和tgev的实时荧光定量pcr方法,包括所述的引物和探针。
双重taqman实时荧光定量pcr反应体系为:
双重taqman实时荧光定量pcr方法反应条件为:94℃3min;94℃5s,57℃15s,72℃30s,40个循环。
实时荧光定量pcr结束后,分析试验结果,在520nm处选择fam通道见有阳性扩增信号,表明检测样品中存在变异型pedv感染;在550nm处选择vic通道见有阳性扩增信号,表明检测样品中存在tgev感染;若520nm处选择fam通道和550处选择vic通道均见有阳性扩增型号,表明检测样品中同时存在变异型pedv和tgev感染。
本发明提供一组用于鉴别变异型pedv和tgev的实时荧光定量pcr检测引物和探针,建立的实时荧光定量pcr方法,具有以下优点和效果:
1、同时检测:建立的方法能够同时检测变异型pedv和tgev,操作程序简单、节约成本。实时荧光定量pcr结束后,分析试验结果,在520nm处选择fam通道见有阳性扩增信号,表明检测样品中存在变异型pedv感染;在550nm处选择vic通道见有阳性扩增信号,表明检测样品中存在tgev感染;若520nm处选择fam通道和550处选择vic通道均见有阳性扩增型号,表明检测样品中同时存在变异型pedv和tgev感染。
2、检测快速、高效:该检测方法无需进行传统的凝胶电泳检测,反应结束后可通过实时荧光定量pcr仪器传输给电脑的数字信号进行判断。从核酸提取到结果判定仅需100min,且一次可同时进行96个样品检测。
3、定量准确:通过制备标准品、绘制标准曲线,根据检测待检样品中变异型pedv和tgev的ct值,直接对其感染变异型pedv和tgev进行准确定量。
4、灵敏度高:对变异型pedv最低可检测10个拷贝;对tgev最低可检测10个拷贝。
5、特异性强:与其他常见猪源病原体,如猪瘟病毒、蓝耳病病毒、伪狂犬病毒、猪圆环病毒2型、乙脑病毒、细小病毒不发生非特异性的反应。仅对变异型pedv和tgev检测出现特异性阳性结果。
对65份临床送检腹泻病料进行变异型pedv和tgev双重实时荧光定量pcr检测,用商品化核酸提取试剂盒提取相应的核酸,按照建立的双重实时荧光定量pcr体系和反应条件进行检测。结果发现,在520nm处选择fam通道见有30份阳性扩增信号,表明30份检测样品中存在变异型pedv感染,阳性率为46.15%;在550nm处选择vic通道见有5份阳性扩增信号,表明5份检测样品中存在tgev感染,阳性率为7.69%;其中还有2份样品在520nm处选择fam通道和550nm处选择vic通道均有扩增信号,表明该2份样品中存在变异型pedv和tgev混合感染,阳性率为3.08%。
附图说明
图1变异型pedv实时荧光定量pcr方法的扩增动力学曲线。
图2变异型pedv实时荧光定量pcr方法的标准曲线。
图3变异型pedv实时荧光定量pcr方法的特异性试验,其中1为pedv,2为tgev,3-8为csfv、prv、prrsv、ppv、jev、pcv-2,9为ddh2o。
图4tgev实时荧光定量pcr方法的扩增动力学曲线。
图5tgev实时荧光定量pcr方法的标准曲线。
图6tgev实时荧光定量pcr方法的特异性试验,其中1为pedv,2为tgev,3-8为csfv、prv、prrsv、ppv、jev、pcv-2,9为ddh2o。
图7双重实时荧光定量pcr方法的特异性试验,其中1为pedv,2为tgev,3-8为csfv、prv、prrsv、ppv、jev、pcv-2,9为ddh2o。
具体实施方式
下面进一步描述本发明,本描述中介绍的实施案例仅是范例性的,并不对本发明的范围构成限制。本专业技术人员应该理解的是,在不偏离本发明原理和方法的情况下,对本发明技术方案的细节和形式进行部分修改或替换,但基于此修改或替换均属于本发明的保护范围内。
实施例1
一、实验方法和步骤
1、相关试验病原
试验用猪瘟病毒、蓝耳病病毒、伪狂犬病毒、猪圆环病毒2型、乙脑病毒、细小病毒、变异型pedv和tgev的阳性核酸均由福建省农业科学院畜牧兽医研究所鉴定和保存。
2、引物和探针设计
根据genbank中检索到的变异型pedv(aj1102株)的n基因和tgev(wh-1)的s基因序列,设计特异性的针对变异型pedv和tgev的引物和探针,其序列如下:
用于检测变异型pedv的n基因:
上游引物pedv-f(5'-3'):ctcccgagtgtagttgagattg
下游引物pedv-r(5'-3'):ctccacgaccctggttattt
荧光探针pedv-p(5'-3'):fam–caacccaacacacctcctacttcacg-bhq1
用于检测tgev的s基因:
上游引物tgev-f(5'-3'):tgagggtgctggctttgat
下游引物tgev-r(5'-3'):caagagtgacaccacccgtt
荧光探针tgev-p(5'-3'):vic-cactgtggcacccttacctgattgt-bhq1
其中,变异型pedv的荧光探针pedv-p的5’端标记有荧光报告基团fam,tgev的荧光探针tgev-p的5’端标记有荧光报告基团vic;变异型pedv的荧光探针pedv-p的3’端和tgev的荧光探针tgev-p的3’端均标记淬灭基团bhq1。
上述引物均在生工生物工程(上海)股份有限公司合成。
1、变异型pedv和tgev双重荧光定量pcr检测方法的建立
3.1变异型pedv阳性标准品的构建
根据变异型pedv(aj1102株)的n基因序列保守性特点,利用引物设计软件oligo设计特异性引物,引物序列为:pedv-f(5'-3'):ctcccgagtgtagttgagattg和pedv-r(5'-3'):ctccacgaccctggttattt,用于扩增约175bp的n基因片段,引物由生工生物工程(上海)股份有限公司合成。
用商品化病毒核酸提取试剂盒提取pedv核酸rna,以rna为模板,按照easyscriptone-steprt-pcrsupermix说明书进行反转录得到cdna产物,反应体系为:easyscriptone-steprt-pcrsupermix10µl,ddh2o6µl,rna模板4µl,合计20µl。反应条件为:25℃5min,45℃30min;按照2×transtaq-tpcrsupermix(+dye)说明书进行pcr反应,反应体系参考试剂盒说明书配制,反应体系为50µl,其中2×transtaq-tpcrsupermix反应液25µl、上下游引物(pedv-f、pedv-r)各1µl、cdna模板1µl,补充去离子水22µl至终体积50µl。反应条件为:94℃5min;94℃50s,54℃30s,72℃30s,35个循环;循环结束后72℃延伸10min。用1.0%的琼脂糖凝胶电泳对pcr产物进行鉴定,利用琼脂糖凝胶回收试剂盒对特异性目的片段进行切胶回收。按照peasy-t1simplecloningkit克隆连接试剂盒说明书将n基因片段克隆到peasy-t1载体上,随机挑取8个单菌落于氨苄青霉素(含量为100µg/ml)抗性的lb液体培养基培养15个小时后,利用快速质粒小提取试剂盒提取相应的质粒。采用pcr扩增时的引物和条件对提取的质粒进行pcr鉴定,将筛选出的阳性重组质粒送生工生物工程(上海)股份有限公司进行测序鉴定。将测序结果在ncbi行进行blat分析验证,符合试验预期的阳性重组质粒作为实时荧光定量pcr的阳性标准品(t-pedv),分装后置于-20℃保存备用。
3.2tgev阳性标准品的构建
根据变异型tgev(wh-1株)的s基因序列保守性特点,利用引物设计软件oligo设计特异性引物,引物序列为tgev-f(5'-3'):tgagggtgctggctttgat和tgev-r(5'-3'):caagagtgacaccacccgtt,用于扩增约149bp的n基因片段,引物由生工生物工程(上海)股份有限公司合成。
用商品化病毒核酸提取试剂盒提取tgev核酸rna,以rna为模板,按照easyscriptone-steprt-pcrsupermix说明书进行反转录得到cdna产物,反应体系为:easyscriptone-steprt-pcrsupermix10µl,ddh2o6µl,rna模板4µl,合计20µl。反应条件为:25℃5min,45℃30min;按照2×transtaq-tpcrsupermix(+dye)说明书进行pcr反应,反应体系参考试剂盒说明书配制,反应体系为50µl,其中2×transtaq-tpcrsupermix反应液25µl、上下游引物(tgev-f、tgev-r)各1µl、cdna模板1µl,补充去离子水22µl至终体积50µl。反应条件为:94℃5min;94℃50s,54℃30s,72℃30s,35个循环;循环结束后72℃延伸10min。用1.0%的琼脂糖凝胶电泳对pcr产物进行鉴定,利用琼脂糖凝胶回收试剂盒对特异性目的片段进行切胶回收。按照peasy-t1simplecloningkit克隆连接试剂盒说明书将n基因片段克隆到peasy-t1载体上,随机挑取8个单菌落于氨苄青霉素(含量为100µg/ml)抗性的lb液体培养基培养15个小时后,利用快速质粒小提取试剂盒提取相应的质粒。采用pcr扩增时的引物和条件对提取的质粒进行pcr鉴定,将筛选出的阳性重组质粒送生工生物工程(上海)股份有限公司进行测序鉴定。将测序结果在ncbi行进行blat分析验证,符合试验预期的阳性重组质粒作为实时荧光定量pcr的阳性标准品(t-tgev),分装后置于-20℃保存备用。
3.3反应条件的优化及标准曲线的建立
按照taqmanfastqpcrmastermix(highrox)试剂盒使用说明书配置20µl的实时荧光定量pcr反应体系,在不同退火温度(55、57、59、61和63℃)、引物浓度(0.1-0.5µm)及探针浓度(1.5-20µm)条件下进行实时荧光定量pcr反应,对反应条件进行优化。以变异型pedv阳性标准品(t-pedv)和tgev阳性标准品(t-tgev)为模板,在520nm处选择fam通道,在550nm处选择vic通道。采用优化后的反应条件进行扩增,获得扩增动力学曲线。以标准品起始拷贝数的常用对数(lgc)为横坐标,以循环阈值(cyclethrehold,ct值)为纵坐标,推导出标准线性回归方程(标准曲线)。
结果:最终优化的双重taqman实时荧光定量pcr方法最佳反应体系(20µl)如下表1。
表1优化后的双重taqman实时荧光定量pcr方法反应体系
结果:优化出的双重taqman实时荧光定量pcr方法反应条件为:94℃3min;94℃5s,57℃15s,72℃30s,40个循环。
实验结果的判定:
实时荧光定量pcr反应结束后,分析试验结果,在520nm处选择fam通道见有阳性扩增信号,表明检测样品中存在变异型pedv感染;在550nm处选择vic通道见有阳性扩增信号,表明检测样品中存在tgev感染;若520nm处选择fam通道和550处选择vic通道均见有阳性扩增型号,表明检测样品中同时存在变异型pedv和tgev感染。
3.4变异型pedv敏感性试验
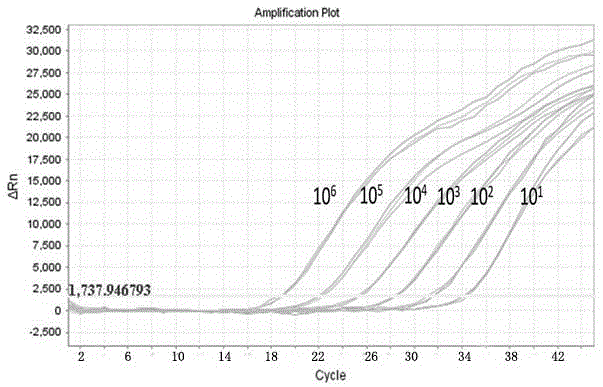
利用微量核酸测定仪测定阳性标准品(t-pedv)的浓度,测得质粒浓度为71.89ng/μl,计算其拷贝数为2.32×1010拷贝/μl,将其稀释成1.0×1010拷贝/μl作为标准品,对其进行10倍连续稀释,选取连续稀释的质粒含量分别为1.0×106拷贝/μl、1.0×105拷贝/μl、1.0×104拷贝/μl、1.0×103拷贝/μl、1.0×102拷贝/μl、1.0×101拷贝/μl和1.0×100拷贝/μl,分装后置于-20℃保存备用。分别以上述不同稀释度阳性标准品(t-pedv)作为模板,用优化后的反应条件进行扩增,获得扩增动力学曲线(见图1)。以标准品起始拷贝数的常用对数(lgc)为横坐标,以循环数阈值(cyclethrehold,ct值)为纵坐标,推导出标准线性回归方程(标准曲线)(见图2),获得其敏感性试验数据。
从表2可以看出,本发明建立的实时荧光定量pcr方法最低检测限为10拷贝/μl。以各标准品中质粒含量(c)的常用对数(lgc)为横坐标,以循环数阈值(cyclethrehold,ct值)为纵坐标,获得变异型pedv实时荧光定量pcr标准曲线(图2),所获得标准曲线斜率为-3.224,y轴截距为39.631,相关系数为0.999,扩增效率为104.242%,符合实验预期。
表2实时荧光定量pcr灵敏度检测
3.5tgev敏感性试验
利用微量核酸测定仪测定阳性标准品(t-tgev)的浓度,测得质粒浓度为83.23ng/μl,计算其拷贝数为2.71×1010拷贝/μl,将其稀释成1.0×1010拷贝/μl作为标准品,对其进行10倍连续稀释,选取连续稀释的质粒含量分别为1.0×106拷贝/μl、1.0×105拷贝/μl、1.0×104拷贝/μl、1.0×103拷贝/μl、1.0×102拷贝/μl、1.0×101拷贝/μl和1.0×100拷贝/μl,分装后置于-20℃保存备用。分别以上述不同稀释度阳性标准品(t-tgev)作为模板,用优化后的反应条件进行扩增,获得扩增动力学曲线(见图4)。以标准品起始拷贝数的常用对数(lgc)为横坐标,以循环数阈值(cyclethrehold,ct值)为纵坐标,推导出标准线性回归方程(标准曲线)(见图5),获得其敏感性试验数据。
从表3可以看出,本发明建立的实时荧光定量pcr方法最低检测限为10拷贝/μl。以各标准品中质粒含量(c)的常用对数(lgc)为横坐标,以循环数阈值(cyclethrehold,ct值)为纵坐标,获得tgev实时荧光定量pcr标准曲线(图5),所获得标准曲线斜率为-3.116,y轴截距为37.772,相关系数为0.999,扩增效率为109.395%,符合实验预期。
表3实时荧光定量pcr灵敏度检测
3.6特异性试验
用优化后的双重实时荧光定量pcr条件分别对猪源其他常见的病原体,如猪瘟病毒、蓝耳病病毒、伪狂犬病毒、猪圆环病毒2型、乙脑病毒和细小病毒进行实时荧光定量pcr检测,以变异型pedv和tgev为阳性对照。用病毒基因组dna/rna提取试剂盒提取相应病毒的核酸,taqmanfastqpcrmastermix(highrox)试剂盒说明书用优化后的反应条件进行检测,评价建立的实时荧光定量pcr方法的特异性。
从图3可见,用优化后的双重实时荧光定量pcr条件分别对猪源其他常见病原,如猪瘟病毒、蓝耳病病毒、伪狂犬病毒、猪圆环病毒2型、乙脑病毒和细小病毒进行实时荧光定量pcr检测,从fam荧光信号通道,仅见有变异型pedv特异性荧光信号,该通道也未见tgev阳性荧光信号。
从图6可见,用优化后的双重实时荧光定量pcr条件分别对猪源其他常见病原,如猪瘟病毒、蓝耳病病毒、伪狂犬病毒、猪圆环病毒2型、乙脑病毒和细小病毒进行实时荧光定量pcr检测,从vic荧光信号通道,仅见有tgev特异性阳性荧光信号,该通道也未见变异型pedv阳性荧光信号。
从图7可见,用优化后的双重实时荧光定量pcr条件分别对猪源其他常见病原,如猪瘟病毒、蓝耳病病毒、伪狂犬病毒、猪圆环病毒2型、乙脑病毒和细小病毒进行实时荧光定量pcr检测,从fam、vic荧光信号通道,可见有变异型pedv、tgev特异性荧光信号。上述结果表明,建立的双重实时荧光定量pcr特异性强,对猪源其他常见病原,如猪瘟病毒、蓝耳病病毒、伪狂犬病毒、猪圆环病毒2型、乙脑病毒和细小病毒均未见非特异性交叉干扰。
3.7临床样品检测
对65份临床送检腹泻病料进行变异型pedv和tgev双重实时荧光定量pcr检测,用商品化核酸提取试剂盒提取相应的核酸,按照建立的双重实时荧光定量pcr体系和反应条件进行检测。结果发现,在520nm处选择fam通道见有30份阳性扩增信号,表明30份检测样品中存在变异型pedv感染,阳性率为46.15%;在550nm处选择vic通道见有5份阳性扩增信号,表明5份检测样品中存在tgev感染,阳性率为7.69%;其中还要2份样品在520nm处选择fam通道和550nm处选择vic通道均有扩增信号,表明该2份样品中存在变异型pedv和tgev混合感染,阳性率为3.08%。
将相关的阳性样品实时荧光定量pcr反应结束后的产物,用琼脂糖凝胶回收试剂盒对特异性目的片段进行切胶回收。按照peasy-t1simplecloningkit克隆连接试剂盒说明书将对应的基因片段(pedv的n基因片段、tgev的s基因片段)克隆到peasy-t1载体上,随机挑取8个单菌落于氨苄青霉素(含量为100µg/ml)抗性的lb液体培养基培养15个小时后,利用快速质粒小提取试剂盒提取相应的质粒。采用pcr扩增时的引物和条件对提取的质粒进行pcr鉴定,将筛选出的阳性重组质粒送生工生物工程(上海)股份有限公司进行测序鉴定。将测序结果在ncbi行进行blat分析验证,均为变异型pedv的n基因片段和tgev的s基因片段,符合率为100%。
以上所述仅为发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属于本发明的涵盖范围。
sequencelisting
<110>福建省农业科学院畜牧兽医研究所
<120>用于鉴别变异型pedv和tgev的检测引物和探针
<130>6
<160>6
<170>patentinversion3.3
<210>1
<211>22
<212>dna
<213>人工序列
<400>1
ctcccgagtgtagttgagattg22
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
ctccacgaccctggttattt20
<210>3
<211>26
<212>dna
<213>人工序列
<400>3
caacccaacacacctcctacttcacg26
<210>4
<211>19
<212>dna
<213>人工序列
<400>4
tgagggtgctggctttgat19
<210>5
<211>20
<212>dna
<213>人工序列
<400>5
caagagtgacaccacccgtt20
<210>6
<211>25
<212>dna
<213>人工序列
<400>6
cactgtggcacccttacctgattgt25
- 还没有人留言评论。精彩留言会获得点赞!
- 一种荧光定量PCR技术检测意大利蜜蜂王浆主蛋白MRJP 2基因表达的方法与流程
- 一种用于对不同银杏进行基因分型的SNP引物及检测方法与流程
- 用于基因甲基化检测的引物和探针、采样方法、试剂盒与流程
- 一种基于荧光PCR检测ESR1基因突变的引物及探针的制造方法与工艺
- 转基因甜菜GTSB77品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 一种基于单核苷酸多态性的葡萄球菌种水平鉴定和菌株分型一体化方法与流程
- 一套毛花猕猴桃和中华猕猴桃物种间杂交子代的鉴定引物的制造方法与工艺
- 检测黄杉大小蠹的引物、试剂盒及检测方法与流程
- 环介导等温扩增技术检测铜绿假单胞菌的引物和试剂盒的制造方法与工艺
- 一种用于鉴定浙贝母的引物对及其应用的制造方法与工艺