一种用于辅助吞咽口服固体药物的稳定的凝胶的制作方法
本发明提供一种辅助吞咽口服固体药物制剂的凝胶,用于吞咽障碍患者(含心理性),属于食品领域,含特殊医学用途配方食品。
背景技术:
:吞咽障碍患者给予口服药物时,均比较困难,在长期恢复过程中,口服药物是最主要的给药方式,吞咽障碍患者如何口服给药问题,至今临床没有好的办法,急需解决。而且许多口服药物制剂具有特殊的味道,如苦味、酸涩、辛辣等刺激性味道,使用者难以接受。药物制剂,尤其是片径较大的固体药物制剂,不经咀嚼,直接用水吞服,喉咙常会有异物感,不适感,甚至粘附于咽、喉以及食管等部位,造成局部损伤,尤其对老年人和儿童,会造成服药困难,依从性低,达不到治疗效果。对于吞咽困难患者而言,在服用药物时,因液体易导致呛咳,继而导致吸入性肺炎的发生,一般无法通过液体送服固体药物,需采用凝胶类产品辅助患者服用药物。申请人的先前发明专利申请CN201410013366.2中对此已有描述,该专利申请的全部内容引入本专利申请中作为参考。CN201410013366.2公开了一种用于辅助吞咽的凝胶,其中使用卡拉胶(角叉菜胶)作为酸中促崩解材料,并且该发明令人意外地发现,控制所述凝胶中卡拉胶在特定用量范围内时,所制得的凝胶不仅具有在水、0.1mol/L盐酸溶液或pH6.8磷酸盐缓冲液中快速崩解性,而且还具有合适的凝胶强度,满足辅助吞咽口服固体药物制剂的需要,从而完成了发明。该凝胶可包裹口服固体药物制剂,隔离药物的不适味道并增加顺滑的口感,提高服药者的顺应性,帮助吞咽困难者服药,同时该凝胶在体内可迅速崩解溶散,不影响口服固体药物制剂在体内发挥药效。CN201410013366.2专利申请的全部内容引入本专利申请中作为参考。然而辅助吞咽凝胶形成后在放置过程中存在一定程度的析水现象是众所周知的。凝胶因体积收缩而分泌出液体,这种析水现象不仅影响外观,也易引起产品质量变化。如何改善辅助吞咽口服固体药物制剂的凝胶的持水性,控制凝胶的析水率,是目前辅助吞咽凝胶领域亟待解决的问题。降低析水率更有利于改善凝胶的掩味效果,防止苦味、酸涩、辛辣等刺激性物质与析出的水接触后的快速溶出。技术实现要素:本发明目的旨在解决辅助吞咽口服固体药物制剂的凝胶的析水问题,以提高产品的稳定性。本发明在专利申请CN201410013366.2研究的基础上,令人惊喜地发现,凝胶中含有重量计为0.25%~0.35%的琼脂时,所制得凝胶在保持良好润滑、包裹和掩味性能,以及快速崩解和合适凝胶强度的效果外,同时还显著地改善了凝胶的持水性能,达到控制凝胶析水率不超过10%重量的令人意外技术效果。相比在先发明CN201410013366.2提供的辅助吞咽口服固体药物制剂的凝胶,本发明提供的新的用于辅助吞咽口服固体药物制剂的可快速崩解的稳定的凝胶,除了具有快速崩解性和合适的凝胶强度的技术效果外,还显著改善了凝胶的析水现象,达到控制凝胶析水率不超过10%重量的令人意外技术效果,改善了掩味效果和稳定性。相比卡拉胶(角叉菜胶)应用于婴幼儿存在的限制,本发明提供的新凝胶产品,例如作为具体实施方式之一的,由可用于婴幼儿的琼脂、果汁、可可粉、罗汉果甜苷等材料配方,对于婴幼儿也更加适用,可适用于婴幼儿到老年各年龄群的吞咽困难患者,尤其适用于儿童患者。本发明技术方案如下:本发明提供了一种改善凝胶持水性的方法,所述凝胶是用于辅助吞咽口服固体药物制剂的可快速崩解的稳定的凝胶,其特征在于所述凝胶中含有0.25%~0.35%重量的琼脂。上述所述的方法,改善所述凝胶的持水性,控制所述凝胶的析水率不超过10%重量。上述所述的方法,其中优选所述的凝胶在37℃的水、0.1mol/L盐酸溶液或pH6.8磷酸盐缓冲液的崩解时限不大于5分钟。上述所述的方法,其中优选所述的凝胶在20℃时凝胶强度10~80g/cm2。上述所述的方法,作为优选,其中所述的凝胶按重量计由0.25%~0.35%琼脂、0.01%~1.0%其他凝胶材料、0.01%~15%矫味剂、任选存在的食品或食品添加剂、余量为水所组成。作为本发明另一目的,提供一种新的用于辅助吞咽口服固体药物制剂的可快速崩解的稳定的凝胶,其特征在于所述凝胶含有0.25%~0.35%重量的琼脂,并且所述凝胶的析水率不超过10%重量。优选地,上述所述的凝胶,其中所述凝胶按重量计由0.25%~0.35%琼脂、0.01%~1.0%其他凝胶材料、0.01%~15%矫味剂、任选存在的其他食品或食品添加剂、余量为水所组成。优选地,上述所述的凝胶,在37℃的水、0.1mol/L盐酸溶液或pH6.8磷酸盐缓冲液中的崩解时限不大于5分钟。优选地,上述所述的凝胶,其中所述的凝胶在20℃时凝胶强度10~80g/cm2。其中,本发明上述所述的用于辅助吞咽口服固体药物制剂的凝胶,其中所述的口服固体药物制剂可以为片剂、丸剂、胶囊剂、颗粒剂、散剂、膜剂或锭剂等。其中,上述所述的其他凝胶材料,是指具有润滑和包裹性能的凝胶材料,例如可以选自黄原胶、瓜尔胶、槐豆胶、魔芋粉等中的一种或者多种。更优选地,所述的其他凝胶材料,按重量计,优选为黄原胶0.01%~0.4%、槐豆胶0.01%~0.3%、瓜尔胶0.01%~0.5%或者魔芋粉0.01%~0.3%等中一种或者多种。其中,上述所述的矫味剂,例如可以选自赤藓糖醇、麦芽糖醇、麦芽糖醇液、乳糖醇、山梨糖醇、山梨糖醇液、木糖醇、罗汉果提取物、罗汉果粉、可可粉、果汁、三氯蔗糖、食用香料或香精等中的一种或者多种。其中,上述所述的其他食品或食品添加剂,例如可以为乳化剂、pH调节剂或者着色剂中的一种或者多种,这些食品或食品添加剂在本发明所述的凝胶中可以不含或者含有,如果含有,其用量为常规的合适用量。上述所述的乳化剂,例如选自单或双甘油脂肪酸酯类、柠檬酸脂肪酸甘油酯、乳酸脂肪酸甘油酯、双乙酰酒石酸单双甘油酯、蔗糖脂肪酸酯中的一种或者多种。上述所述的pH调节剂,例如选自碳酸氢钠、柠檬酸和/或其钠盐、苹果酸等中的一种或者多种。上述所述的着色剂,例如选自天然胡萝卜素、栀子黄、甜菜红、胭脂树橙、胭脂虫红、焦糖色等中的一种或者多种。针对婴幼儿使用的辅助吞咽凝胶,矫味剂或其他食品或食品添加剂的使用可参考GB2760食品安全国家标准食品添加剂使用标准的规定,例如,使用罗汉果提取物和果汁作为矫味剂,单硬脂酸甘油酯作为乳化剂。本发明上述所述的凝胶,其pH值为3.0~8.0。需要的话,可以用合适pH调节剂调整凝胶至所需要的pH值。本发明上述所述的凝胶,可以用合适方法进行制备。例如,将凝胶成分加入水中,加热,搅拌溶解,加入矫味剂等,搅拌溶解。冷至65℃,过100目筛,保温灌装,冷却后即得。本发明上述所述的凝胶,其可用于口服固体药物制剂的辅助吞咽,其中所述的口服固体药物制剂,除泡腾片或泡腾颗粒外,没有特别限制,可以是药物活性成分和药用辅料按照常规制剂工艺制成的口服固体制剂,例如可以为片剂、丸剂、胶囊剂、散剂、颗粒剂、膜剂、锭剂等。本发明的凝胶是为了帮助服药困难者吞咽药物。本发明的凝胶pH值在3.0~8.0,凝胶强度控制在10~80g/cm2,有利于帮助吞咽。本发明的凝胶在37℃的水、0.1mol/L盐酸溶液或pH6.8磷酸盐缓冲液中的崩解时限在5分钟以内,避免影响药物的崩解与释放,从而避免影响药物的吸收。本发明的凝胶不仅具有掩盖药物不良气味和改善口感的效果,而且能在0.1mol/L盐酸溶液中快速崩解,不影响被助吞咽药物的释放和吸收。与专利申请CN201410013366.2公开的用于辅助吞咽口服固体药物制剂的凝胶相比,本发明提供的新的用于辅助吞咽口服固体药物制剂的凝胶,使用琼脂并且控制凝胶中琼脂含量在0.25%~0.35%的范围内,除保持助吞咽凝胶的润滑性能和包裹掩味性能,以及快速崩解性能和合适凝胶强度外,令人意外地,凝胶的持水性能还得到显著改善,凝胶析水率达到不超过10%重量的技术效果,明显低于在先发明专利申请CN201410013366.2公开的助吞咽凝胶。附图说明图1:桨法测定实施例1凝胶对西咪替丁片对比试验溶出曲线图2:桨法测定实施例1凝胶对甲硝唑片对比试验溶出曲线具体实施方式以下实施例,是为了进一步解释或者阐述本
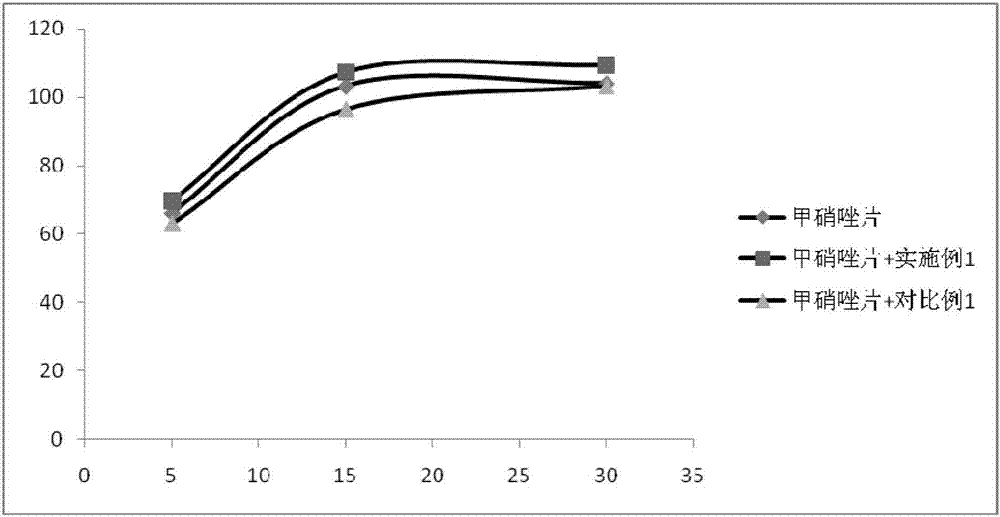
发明内容,对本发明保护范围不构成限制。除特别说明外,所采用的测试方法为:凝胶强度测定使用CT3质构仪,圆柱形探头,直径2cm。样品容器直径约40mm,样品厚约15mm。测定挤压速度10mm/秒,距离5毫米2次测定压缩。测定温度20℃。崩解时限测定,参考中华人民共和国药典2015年版的崩解时限检查法,使用崩解时限测定仪,取凝胶样品10g,崩解介质为37℃的0.1mol/L盐酸溶液,测定崩解时限。凝胶持水性考察,将滤纸(直径125mm中速定性滤纸,杭州特种纸业有限公司)折成漏斗状,置于玻璃漏斗(直径60mm)内。取整块凝胶样品约30g,称重,置于滤纸漏斗内。将装有样品的漏斗置于50mL玻璃量筒上,静置5min。取出凝胶样品,称重。计算凝胶损失的重量,计算析水率。实施例1:成分加入量(wt%)琼脂0.26%槐豆胶0.04%黄原胶0.15%赤藓糖醇5.0%木糖醇5.0%蒸馏单硬脂酸甘油酯0.01%浓缩橙汁2.0%柠檬酸0.2%柠檬酸钠0.16%水加至100%将琼脂、槐豆胶、黄原胶与赤藓糖醇、木糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入矫味剂等,搅拌溶解。煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度27g/cm2,pH值为3.6,崩解时限为2分钟,析水率2.94%。实施例2成分加入量(wt%)琼脂0.25%槐豆胶0.02%黄原胶0.1%赤藓糖醇4.0%木糖醇4.0%蒸馏单硬脂酸甘油酯0.01%可可粉0.5%罗汉果粉0.01%柠檬酸0.01%水加至100%将琼脂、黄原胶、槐豆胶与赤藓糖醇、木糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入矫味剂等,搅拌溶解。煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度34g/cm2,pH值为6.5,崩解时限为1分钟,析水率1.54%。实施例3将琼脂、槐豆胶、黄原胶与赤藓糖醇、木糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入矫味剂等,搅拌溶解。煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度38g/cm2,pH值为3.7,崩解时限为2分钟,析水率2.63%。实施例4成分加入量(w/w)琼脂0.3%魔芋粉0.2%赤藓糖醇4.0%水加至100%将琼脂、魔芋粉与赤藓糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入余量水,煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度42.4g/cm2,pH值为5.28,崩解时限为1分钟,析水率3.84%。实施例5成分加入量(w/w)琼脂0.25%魔芋粉0.3%赤藓糖醇4.0%水加至100%将琼脂、魔芋粉与赤藓糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入余量水,煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度44.2g/cm2,pH值为5.94,崩解时限为1分钟,析水率3.2%。实施例6将琼脂、魔芋粉和槐豆胶与赤藓糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入矫味剂等,搅拌溶解。煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度29.2g/cm2,pH值为3.83,崩解时限为1分钟。析水率3.02%。实施例7成分加入量(wt%)琼脂0.3%槐豆胶0.02%瓜尔胶0.3%赤藓糖醇4.0%柠檬酸0.21%柠檬酸钠0.14%水加至100%将琼脂、槐豆胶、瓜尔胶与赤藓糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入矫味剂等,搅拌溶解。煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度37.1g/cm2,pH值为3.68,崩解时限为1分钟,析水率3.49%。实施例8成分加入量(wt%)琼脂0.35%黄原胶0.15%赤藓糖醇4.0%柠檬酸0.21%柠檬酸钠0.14%水加至100%将琼脂、黄原胶与赤藓糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入矫味剂等,搅拌溶解。煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度22.6g/cm2,pH值为3.83,崩解时限为1分钟,析水率3.32%。实施例9成分加入量(wt%)琼脂0.35%魔芋粉0.3%赤藓糖醇4.0%柠檬酸0.21%柠檬酸钠0.14%水加至100%将琼脂、魔芋粉与赤藓糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入矫味剂等,搅拌溶解。煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度30.5g/cm2,pH值为3.7,崩解时限为1分钟,析水率3.22%。实施例10成分加入量(wt%)琼脂0.3%瓜尔胶0.3%赤藓糖醇4.0%柠檬酸0.21%柠檬酸钠0.14%水加至100%将琼脂、瓜尔胶与赤藓糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入矫味剂等,搅拌溶解。煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度29.2g/cm2,pH值为3.69,崩解时限为1分钟,析水率3.62%。实施例11成分加入量(w/w)琼脂0.3%黄原胶0.3%赤藓糖醇4.0%柠檬酸0.21%柠檬酸钠0.14%水加至100%将琼脂、黄原胶与赤藓糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入矫味剂等,搅拌溶解。煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度26.5g/cm2,pH值为3.68,崩解时限为1分钟,析水率2.84%。比较实施例1成分加入量(wt%)琼脂0.2%槐豆胶0.2%黄原胶0.2%赤藓糖醇4.0%柠檬酸0.21%柠檬酸钠0.14%水加至100%将琼脂、槐豆胶、黄原胶与赤藓糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入矫味剂等,搅拌溶解。煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度8.2g/cm2,pH值为3.84,崩解时限为1分钟,析水率10.52%。凝胶强度不符合使用要求,且析水率明显较高。比较实施例2成分加入量(wt%)琼脂0.4%槐豆胶0.01%黄原胶0.2%赤藓糖醇4.0%柠檬酸0.21%柠檬酸钠0.14%水加至100%将琼脂、槐豆胶、黄原胶与赤藓糖醇混合加入水中,边搅拌边加热至沸,搅拌溶解,加入矫味剂等,搅拌溶解。煮沸5分钟,过100目筛,冷却。经检测,所制得的凝胶在20℃时凝胶强度60.5g/cm2,pH值为3.68,崩解时限为15分钟未崩解,析水率2.26%。崩解时限不符合使用要求。比较实施例3与在先申请发明专利CN201410013366.2凝胶的析水率比较对比例按CN201410013366.2的凝胶组成进行如下制备:将本发明实施例1、实施例2、实施例3的样品与上述对比例1、2和3同时进行40℃高温稳定性试验(参考当前试行的特殊医学用途配方食品稳定性研究要求,影响因素实验的高温实验,将样品放置于40℃烘箱内,于第5天和第10天取样检测。理论上高温试验放置10天相当于常温存放24个月),考察析水率的变化。上述结果表明,本发明实施例凝胶的析水现象比本发明人先前的发明CN201410013366.2公开的凝胶得到显著改善。总体比较而言,与本发明人先前的发明CN201410013366.2的凝胶相比,本发明凝胶在持水性能控制方面有极为显著的提高,上述数据显示,本发明在析水率的控制方面具有极为明显的优势,取得了令人意外的技术效果。实施例12:凝胶对药物溶出效果测试为了考察助吞咽凝胶对药物溶出度的影响,选择西咪替丁片(规格:0.2g,市售)和甲硝唑片(规格:0.2g,市售)作为供试样品,将片剂用实施例1制得的助吞咽凝胶10克包裹后放入溶出杯,进行溶出测定。与不加凝胶的片剂溶出曲线比较。将上述比较实施例3中对比例1作为对比实施例,比较对不同药物溶出行为的影响。考察桨法对药物溶出度的影响:西咪替丁片:照中华人民共和国药典2015年版中溶出度测定法第二法(桨法),转速为每分钟50转。溶出介质pH1.2盐酸溶液,900mL。于5分钟、15分钟、30分钟时,取溶液10mL过滤,并补液。检测,计算累积溶出度。结果见表1和图1。表1对药物溶出度影响的测试(西咪替丁片,片重0.25g,片径为8.5mm)西咪替丁片溶出测试结果表明,用实施例1包裹片剂后,与未包裹的片剂相比,15分钟取样点的溶出度均大于85%,溶出行为一致,实施例1对药物的体外崩解、释放无显著影响。对比例1包裹西咪替丁片后,15分钟取样点的溶出度也大于85%。结果表明,实施例1可达到对比例1同样的快速崩解,不影响药物的崩解与释放的效果,且在第一时间点(5分钟取样点)明显较优。甲硝唑片:照中华人民共和国药典2015年版中溶出度测定法第二法(桨法),转速为每分钟50转。溶出介质盐酸溶液(9→1000),900mL。于5分钟、15分钟、30分钟时,取溶液10mL过滤,并补液。检测,计算累积溶出度。结果见表2和图2。表2对药物溶出度影响的测试(甲硝唑片,片重0.30g,片径为9mm)甲硝唑片溶出测试结果表明,用实施例1包裹片剂后,与未包裹的片剂相比,15分钟取样点的溶出度均大于85%,溶出行为一致,实施例1对药物的体外释放无显著影响。对比例1包裹甲硝唑片后,15分钟取样点的溶出度也大于85%,结果表明,实施例1可达到对比例1同样的快速崩解,不影响药物的崩解与释放的效果。两种药物的溶出对比试验结果均显示,实施例1包裹药物后,在溶出介质中均可快速崩解,不影响药物的崩解、释放,包裹与不包裹的药物溶出行为一致,结果表明,实施例1具有与发明CN201410013366.2具有同样的效果,即凝胶在溶出介质中可快速崩解,不影响药物的崩解、释放,对药物的体外溶出行为无显著影响。考察转篮法对药物溶出度的影响:选择西咪替丁片(规格:0.2g,市售)和甲硝唑片(规格:0.2g,市售)作为供试样品,将片剂用实施例1、2,3,4制得的助吞咽凝胶包裹后放入转篮,进行溶出测定,绘制累积溶出曲线,与不加凝胶的片剂溶出曲线比较。因转篮容积较小,使用5g凝胶样品包裹药片后放入转篮内,然后进行溶出试验。西咪替丁片:照中华人民共和国药典2015年版中溶出度测定法第一法(转篮法),转速为每分钟100转。溶出介质pH1.2盐酸溶液,900mL。于5分钟、15分钟、30分钟时,取溶液10mL过滤,并补液。检测,计算累积溶出度。结果见表3。表3对药物溶出度影响的测试(西咪替丁片,片重0.25g,片径为8.5mm)结果显示,凝胶样品包裹药片后,在前期(5分钟取样点)对溶出度有一定影响,但对15分钟取样点的溶出度影响不大,助吞咽凝胶包裹药物后不影响药物的体外释放,15分钟取样点的溶出度均大于85%。结果表明,凝胶样品包裹药片后与未包裹药片溶出一致。甲硝唑片:照中华人民共和国药典2015年版中溶出度测定法第一法(转篮法),转速为每分钟100转。溶出介质盐酸溶液(9→1000),900mL。于5分钟、15分钟、30分钟时,取溶液10mL过滤,并补液。检测,计算累积溶出度。结果见表4。表4对药物溶出度影响的测试(甲硝唑片,片重0.30g,片径为9mm)结果显示,凝胶样品包裹样片后,在5分钟取样点时,实施例1和实施例3包裹药物后,对溶出度有一定影响,药物溶出略微滞后,但对15分钟取样点溶出度的影响不大,溶出度均大于85%。结果表明,凝胶样品包裹药片后与未包裹药片溶出一致。实施例13:凝胶在不同溶出介质中的崩解性能测试将发明CN201410013366.2的实施例1和国外市售的辅助吞咽凝胶作为对比例,比较本发明的实施例1与他们的崩解时限的差异。结果见表5。结果显示,实施例1与发明CN201410013366.2的实施例1快速崩解性能基本一致,均明显快于市售辅助吞咽凝胶。表5崩解时限测试结果样品介质崩解时限(分钟)实施例1水3分钟国外市售助吞咽凝胶水15分钟未崩解CN201410013366.2实施例1水5分钟实施例10.1mol/L盐酸溶液2分钟国外市售助吞咽凝胶0.1mol/L盐酸溶液15分钟未崩解CN201410013366.2实施例10.1mol/L盐酸溶液2分钟实施例1pH6.8磷酸盐缓冲液3分钟国外市售助吞咽凝胶pH6.8磷酸盐缓冲液15分钟未崩解CN201410013366.2实施例1pH6.8磷酸盐缓冲液5分钟实施例14:吞咽润滑性能体验测试由15名研究者参与了对实施例1的润滑性能进行体验,试验样品为:20*13mm胶囊形空白片(片重1.2g,批号:160501);20*8mm胶囊形空白片(片重1.2g,批号:160501);13mm圆形空白片(片重0.65g,批号:160501),以上样品均采用微晶纤维素101直接压制。取上述较大片径的样品,分别用20ml温水送服和20g实施例1凝胶帮助吞咽,分别记录两种服用方式的感受。判断标准:无法吞咽(有吞咽抗拒或恐惧感,不能吞咽);吞咽困难(有明显异物感或其他不舒服感);吞咽无异常感觉(正常吞咽,无异常感觉);吞咽顺滑(感觉舒适,吞咽畅滑)。结果:见表6。表6.实施例1凝胶的吞咽润滑性能体验结果(参与体验的人员共15人,其中男性7人,女性8人,年龄段为23-52岁)结果显示:较大片径的空白片研究者体验表明,采用实施例1辅助吞咽后,吞咽正常无异常感觉的比例大幅度提高,有明显吞咽润滑作用。结果表明实施例1凝胶具有良好的吞咽润滑效果。实施例15:掩味性能测试溶胀实验:取同批次的实施例1及上述比较实施例3中的对比例1样品同时进行溶胀试验。常温存放10天样品;放置40℃高温试验5天取出,然后常温放置5天的样品;放置40℃高温试验10天取出的样品。包裹西咪替丁片,放置1.0min、3.0min、5min观察药片的溶胀情况,分析其可能对掩味效果的影响。试验结果显示,常温放置、高温试验5天和10天的实施例1样品包裹药物后稳定性较好,1min和3min均未见药物性状的变化,5min未见药物性状的明显变化,仅略有溶胀。对比例1样品包裹的药片溶胀较快,常温样品包裹药片1min和3min有可见的轻微的溶胀现象,5min有明显可见的溶胀现象;而高温试验5天、10天的对比例1样品包裹西咪替丁片在1min和3min均有明显可见的溶胀,5min可见药片局部有崩散现象。结果表明,实施例1样品包裹药物后稳定性明显好优于对比例1。上述凝胶样品包裹药片后发生明显溶胀或崩散,则其中的不良刺激性味道则有可能随之扩散逸出,尤其是药片崩散后更为明显,严重影响凝胶的掩味效果。结果提示,实施例1样品包裹药物后掩味性能应优于对比例1。掩味试验:10名研究者对实施例1和对比例1的掩味性能分别进行体验。以苦味制剂作为代表,试验样品为:13mm苦味片(圆片,片重0.65g,批号:160701);13mm苦味分散片(圆片,片重0.65g,批号:160701);0号苦味胶囊(装量:0.3g,批号:160701);1g苦味颗粒(批号:160701),苦味制剂由微晶纤维素101和苦味剂(黄连粉,所有处方中所加黄连粉比例一致)制成,以上试验样品均为自制。凝胶样品:常温存放10天样品;放置40℃高温试验5天取出,然后常温放置5天的样品;40℃高温试验10天取出的样品。分别用20ml水和20g凝胶帮助吞咽。用20ml水送服者,可即刻服用。采用20g凝胶样品帮助吞咽者,将待服用物品放入后,放置3.0min后吞咽,比较不同样品的掩味效果,考察苦味制剂是否有苦味逸出,记录吞咽体验感受。判断标准:无法吞咽(有吞咽抗拒或恐惧感,不能吞咽);苦(体验者有明显异常苦味感觉);略苦(有轻微的苦味,不影响吞咽);良好(未感觉到苦味,吞咽畅滑)。结果:见表7。表7.实施例1凝胶的掩味性能体验结果(参与体验人员共10人,男性6人,女性4人,年龄段23-52岁)对有苦味的普通片、分散片、胶囊剂、颗粒剂吞咽体验结果显示,采用实施例1凝胶辅助吞咽后,吞咽良好的比例大幅度提高,实施例1有明显的掩味效果,结果表明实施例1具有良好的掩味效果,3min内吞咽可以满足掩味需求。上述数据显示,放置3min后,对比例1样品的掩味效果比实施例1略差,但比直接用水吞服有显著的改善。根据体验数据,高温试验样品的掩味效果有所降低。结合析水率数据和溶胀情况分析,可能是经过高温试验,凝胶样品的析水率增加,析出的水会使药物的溶胀和溶解加快,苦味物质更容易被水溶解,扩散出来。体验数据显示,凝胶样品对片剂和胶囊有更好的掩味效果,而对颗粒剂的掩味效果较差。原因可能是片剂和胶囊体积较小,易于充分包裹。而1g颗粒剂体积较大,用20g凝胶样品难以充分包裹,颗粒中的苦味物质更易逸出与口腔接触,但跟用水吞服相比,仍然有显著的改善。上述体验数据表明,析水率与掩味性能存在明显的关联性,无论常温样品还是高温试验5天或10天(理论24个月)的样品,析水率越高,被包裹的药物溶胀越快,影响凝胶的掩味性能,控制凝胶中的析水率,可有效提高凝胶的掩味性能。本发明控制凝胶的析水率后,在掩味方面取得比先前发明更有明显优势的令人意外的效果。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1