原发性肝癌磁共振双靶点特异性分子探针及其制备方法与流程
本发明属于医疗及分子影像学技术领域,具体地说,本发明涉及一种原发性肝癌磁共振(MR)双靶点特异性分子探针及其制备方法。
背景技术:
磁共振检查具有软组织分辨率高、无电离辐射,能够提供多参数、多对比度图像等特点,已经成为肝脏占位病变临床影像学检查最重要的检查方法。但是,目前使用的或用于临床前期研究原发肝癌MR特异性分子探针均为甲胎蛋白(Alpha-fetoprotein,AFP)或磷脂酰肌醇蛋白聚糖3(Glypican-3,GPC3)单分子靶点的分子探针,这些单靶点特异性分子探针存在检测灵敏度低,对于AFP或 GPC3低表达得原发性肝癌就无法检测到,更是无法检测到小的肝癌病灶。
原发性肝癌(Hepatocellular carcinoma,HCC)是多种因素造成的多基因累积、多步骤和多阶段的过程,属于一种多基因复杂性状疾病。在其发生和发展过程涉及到不同的基因和不同表达形式。所以,单靶点的分子探针无法提高探测的灵敏度,致使无法检测到小的病灶,特别是肝癌微血管侵犯(microvascular invasion,MVI)病灶。肝细胞肝癌小病灶和MVI检出对于肝细胞肝癌治疗效果至关重要。
AFP和GPC3在原发性肝癌肝细胞呈现出高表达,但是有些肝癌细胞AFP 表达并不高,有文献报道在AFP低表达的肝癌细胞GPC3呈现高的表达。AFP 和GPC3在原发性肝癌检出中具有很好的互补性,原发性肝癌诊疗规范(2017 年版)也将这两个生物标志物纳入诊疗规范中。
为了解决检测小的肝癌病灶和提高对MVI检出率。我们先前工作的基础上,制备出原发性肝癌MR双靶点(AFP和GPC3)特异性分子探针。
技术实现要素:
针对相关技术中的上述技术问题,本发明提出一种对原发性肝癌MR双靶点特异性分子探针及其制备方法。
为实现上述技术目的,本发明的技术方案是这样实现的:
一种原发性肝癌MR双靶点特异性分子探针,包括载体,所述载体末端分别连接有两种能够与原发肝癌细胞特异性结合抗体:Anti-AFP和Anti-GPC3。
其中,所述载体为MR非特异性对比剂,所述载体选自超顺磁性氧化铁 (SPIO)或超小超顺磁性氧化铁(USPIO)。对所述载体末端修饰后增加羧基,通过所述羧基分别连接Anti-AFP和Anti-GPC3。
进一步的,Anti-AFP与所述载体连接的分子数量多于Anti-GPC3与所述载体连接的分子数量,Anti-AFP与Anti-GPC3优选比例为3:2或3:1。
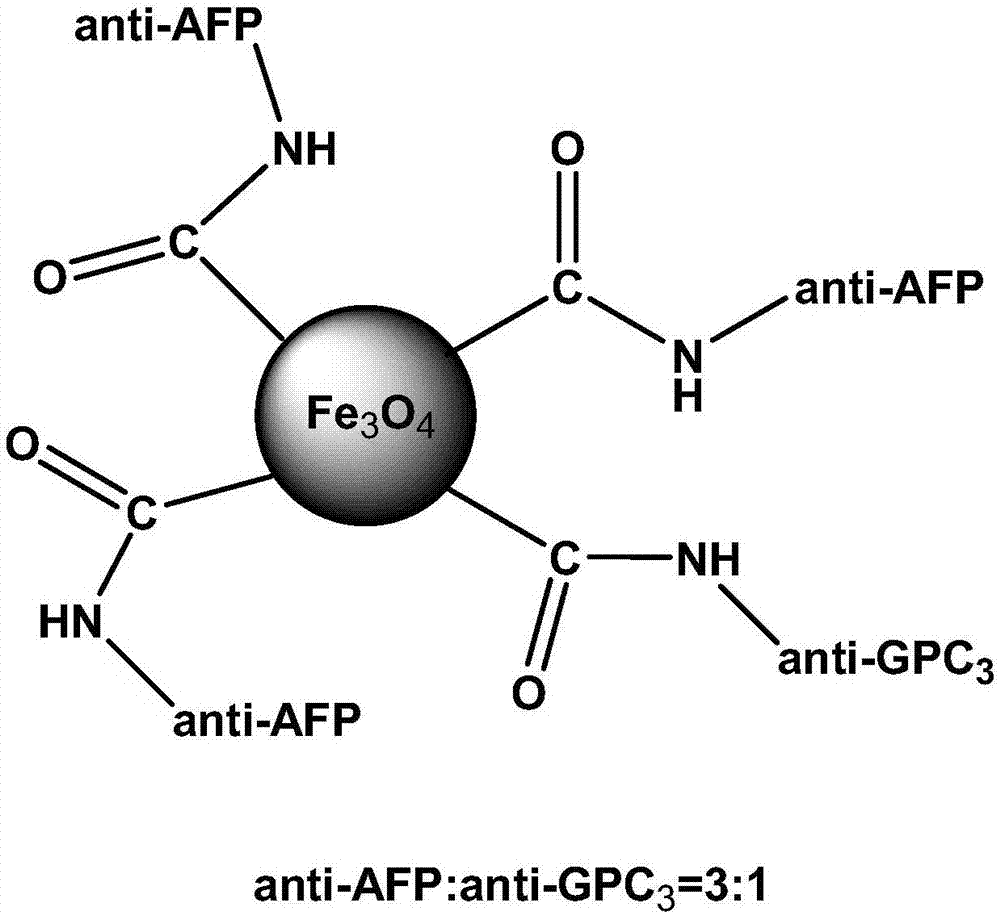
本发明提供一种原发性肝癌MR双靶点特异性分子探针,其分子结构如下所示:
本发明还提供一种原发性肝癌MR双靶点特异性分子探针的制备方法,采用一锅法制备,具体包括以下步骤:
S1选择载体,所述载体为超顺磁性氧化铁SPIO或超小超顺磁性氧化铁 USPIO,对其末端修饰后增加羧基;
S2利用羧基连接两个能够与原发肝癌细胞特异性结合抗体:Anti-AFP和 Anti-GPC3;
S3采用离心机离心方法或磁性分离方法分离最后产物。
进一步的,Anti-AFP与所述载体结合分子数量多于Anti-GPC3与所述载体结合分子数量。
优选的,Anti-AFP与所述载体结合分子数量和Anti-GPC3与所述载体结合分子数量的比例为3:2或3:1。
本发明的有益效果:在一个分子探针上连接连个双靶点特异性抗体,可以显著提高对肝癌病灶,以及MVI检出率。同时也便于对原发性肝癌体外和活体分子成像研究。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1和图2是根据本发明实施例的一种原发肝癌双靶点USPIO纳米载体双靶点特异性分子探针分子结构;
图3和图4是两种羧基末端修饰的载体与Anti-AFP-NH2/Anti-GPC3-NH2的酰胺反应式;
图5是三种特异性肝癌MR分子探针与人肝癌细胞BEL-7402结合图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
基于纳米USPIO或SPIO为载体,对其末端修饰后增加羧基。
采用一锅法,将N-乙基-N'-(3-二甲胺基丙基)碳二亚胺盐酸盐(N-ethyl-N’- (3-dimethylaminopropyl)carbodiimide hydrochloride,EDC)1mg和N-羟基硫代琥珀酰亚胺(sulfo-NHS)2mg溶解到0.5mL磷酸盐缓冲液(phosphate-buffered saline,PBS)中,PH=7.4。将缓冲液PH调至5.0。加入末端修饰后带有羧基USPIO 或SPIO 1ml或5mg后反应3小时;然后,加入磷脂酰肌醇蛋白聚糖3(Glypican 3,GPC3)抗体(anti-GPC3)反应1小时后,加入甲胎蛋白(Alpha-Fetoprotein,AFP) 抗体(anti-AFP)再继续反应3小时。将反应液中的PH值调至7.0。然后再反应30分钟。反应过程进行缓慢搅拌。将反应液离心(5000rpm/min,5min)分离探针。或采用磁性分离技术分离探针。
本发明实施例所有试剂均从Sigma-Aldrich公司购得,SPIO或USPIO的比重均为2.6g/cm3,SPIO的颗粒大小大于50nm,USPIO的颗粒大小小于50nm。质量控制:直接用电镜检测,流式细胞鉴定或荧光显微镜。
在EDC/NHS的活化作用下,Anti-AFP/Anti-GPC3与纳米分子或MR对比剂连接化学反应式如下式1和式2,其中,式1中,Anti-AFP与所述载体结合分子数量与Anti-GPC3与所述载体结合分子数量比例为3:2(图1);式2中,Anti-AFP 与所述载体结合分子数量与Anti-GPC3与所述载体结合分子数量比例为3:1(图 2)。
测量T1/T2(USPIO 0.125mg)
图5所示,是三种特异性肝癌MR分子探针(USPIO-antiAFP, USPIO-antiGPC3及antiAFP-USPIO-antiGPC3与人肝癌细胞BEL-7402结合图,表明双靶点分子探针(antiAFP-USPIO-antiGPC3)明显提高细胞摄取率,半定量计算累积光密度值提高25%以上。
- 还没有人留言评论。精彩留言会获得点赞!