抗微生物多肽及其用途的制作方法
抗微生物肽(AMP)是整个自然中生物体防御系统的必需组分并且提供抵抗侵入的病原体的保护。它们表现出针对革兰氏阳性及革兰氏阴性细菌、真菌、寄生虫和病毒的强效抗微生物活性。较小的AMP(通常约15-40个氨基酸)主要通过破坏微生物细胞膜的结构或功能来作用,其不靶向单一限定的分子结构。因此,与常规抗生素相反,无论细菌的代谢活性如何,它们都是有效的。人AMP例如防御素和导管素(LL-37)存在于白细胞中,通过皮肤和粘膜表面中的各种上皮细胞分泌。除了其抗微生物活性之外,AMP还是炎症、免疫活化和伤口愈合中的重要效应分子。AMP在序列和二级结构上是特别多样性的,但是它们有一些共同的性质。它们通常为阳离子、两性离子,通过损害细菌膜完整性来发挥其杀微生物效果。AMP与靶微生物的阴离子膜表面的相互作用导致膜透化、细胞裂解和死亡。公认胞质膜是大多数AMP的主要靶标,而膜中肽的积累导致增加的透过性和屏障功能的丧失,造成胞质组分泄漏和细胞死亡。
常规抗生素通过结合靶标来杀伤细菌,所述靶标例如细胞壁上的表位、或细菌蛋白和DNA或RNA合成中的靶标。通过改变抗生素靶标以致抗生素无法继续结合这些靶标,致病细菌能快速发展出抗性。AMP相对常规抗生素的主要优势是无法快速发展出抗性。一个原因是其不像常规抗生素一样靶向单一限定分子结构(表位),而是作用在细胞膜上杀伤微生物。AMP尤其适用于对抗所谓生物膜相关感染(BAI),其为微生物的表面结合的细胞团聚体,大多数为细菌但也可为真菌。生物膜显著有助于细菌对常规抗生素的抗性。生物膜与人的各种病理症状例如囊性纤维化、内置医疗装置的定殖和牙科斑块形成和损伤相关。使用常规抗生素对抗生物膜相关感染还由于许多原因而不足,所述原因包括对促炎微生物化合物释放的刺激、生物膜穿透不充分、以及必需的全身给药导致的血液中的失活或降解。AMP针对常规细菌的其他优势包括快速启动杀伤、生物可降解性从而减轻了当前对环境残留抗生素的担忧、以及具有伴随的抗炎活性。
在成百上千的潜在天然和合成肽的库中,进行到临床试验的相当之少。示例为爪蟾抗菌肽、奥米加南、OP-145、诺瓦克汀(novexatin)和立体可(lytixar)。仅两种AMP,达托霉素和DPK-060正处于临床研发中。例如已经进行了2期临床试验的OP-145,又称P60.4Ac(Peptides,2006;27:649-60)。OP-145是衍生自内源性人导管素抗微生物肽LL-37的24个氨基酸的肽。OP-145已经发展为用于局部治疗慢性中耳炎的内毒素中和抗微生物肽。除了作为抗微生物肽,OP-145还中和LPS。
当前已知的AMP(包括OP-145),仍存在一些缺陷。例如多种细菌,如绿脓假单胞菌(P.aeruginosa)、粪肠球菌(E.faecalis)、奇异变形菌(Proteus mirabilis)、酿脓链球菌(Streptococcus pyogenes)和金黄色葡萄球菌(S.aureus)全部分泌降解几种抗微生物肽(如导管素LL-37)的蛋白酶。因此,从治疗的角度来看,耐蛋白酶的抗微生物肽有优势。此外,由于AMP针对细菌以及哺乳动物膜的潜在裂解效果和其它性质,设计新肽的挑战之一取决于开发与受感染患者的细胞膜相比,具有高的针对微生物如细菌或真菌细胞的特异性的AMP,即高治疗指数(最小溶血浓度/最小抗微生物活性;MHC/MEC)。已知AMP(包括OP-145)的另一重要缺点是其活性受到血浆组分存在的严重影响。例如,对于OP-145来说,PBS中的LC99.9(杀死≥99.9%的最低肽浓度)是1.6μM,而PBS/血浆(1:1)中的LC99.9约为200μM。这对系统给予AMP来说尤其不利。
有多种机制导致AMP在血浆存在下的显著较低的活性,例如血浆组分对肽的失活例如酶降解、或由于非特异性结合血浆组分导致的肽不可用。抵抗血浆组分的AMP非常重要,不仅由于其是潜在的全身治疗剂,而且由于其用于治疗(例如)感染的伤口和医学移植相关感染和炎症。尤其是深层组织感染中可能存在的高蛋白水解酶活性,其可导致没有蛋白水解酶抗性的AMP失活。慢性伤口的伤口流体具有过量的蛋白酶,并且移植的材料被来自宿主流体的血浆组分快速覆盖。慢性伤口和医学移植物均常与微生物生物膜关联。尤其是在治疗生物膜相关感染中,抗生素大多全身给予,因此易于在血液和周围组织中被酶促降解。因此,由于对血浆组分敏感,许多AMP(包括OP-145)的应用受限于例如局部应用。因此明显需要对血浆组分有抗性的替代的AMP,尤其是潜在的全身治疗剂和/或有效对抗与例如慢性伤口和医学移植物相关的生物膜感染的治疗剂。
本发明目的在于提供新型强效抗微生物肽,其克服了常规抗生素的劣势并具有优于已知的抗微生物肽改善的性质,尤其由于其抵抗血浆组分。本文另一目的是提供在导入哺乳动物如人时为非变应原性的抗微生物肽,其对致病性微生物具有高特异性,并且对生物膜相关感染中的病原性微生物具有特别高的抗微生物活性。本发明的肽或多肽针对生物膜中的微生物以及未组织在生物膜中的微生物发挥强效、广谱的抗微生物活性,具有快速的抗微生物活性,并且可用作治疗剂、预防剂或诊断剂。本发明的肽或多肽设计为克服有效性持续时间受限和应用性受限的问题,这是由于其在血液、血浆和血清中以及存在来自它们的组分时能保留其抗微生物活性。
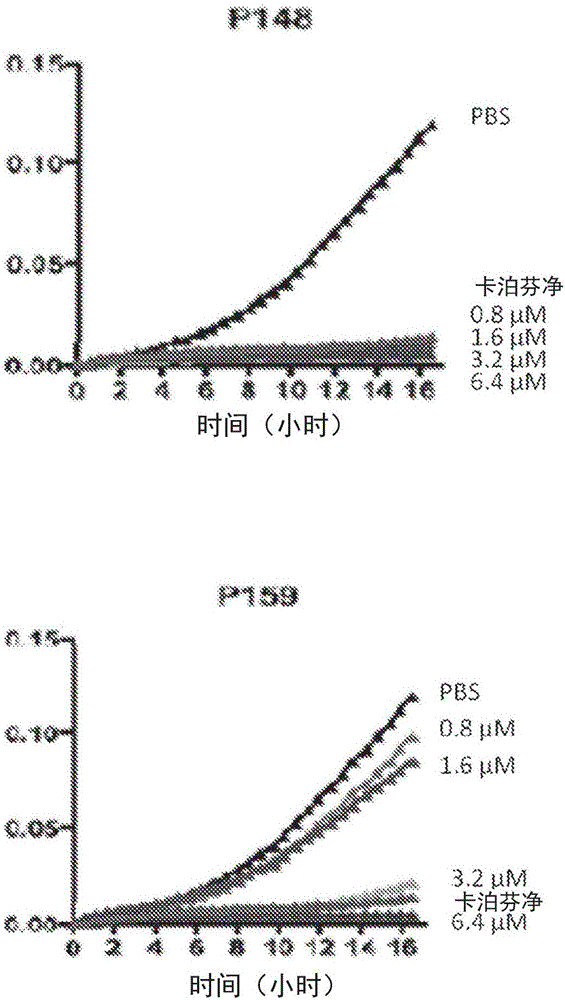
发明人发现基于序列LKKLYKRLVKILKRWWRYLKRPVR的肽P139-P163对(耐药性)革兰氏阳性菌(例如,金黄色葡萄球菌(Staphylococcus aureus)和表皮葡萄球菌(Staphylococcus epidermidis))和革兰氏阴性菌(例如,绿脓假单胞菌(Pseudomonas aeruginosa))以及真菌(例如白色念珠菌(Candida albicans)和黑曲霉(Aspergillus niger))高度有效,参见表2-4和11,图1和2。因此所述肽发挥广谱抗生物素活性。所有肽均非常强效,如其低IC99.9值所示,其在PBS中与OP-145相当。重要的是,发现存在血浆时,所有的肽均比OP-145有效。存在血浆时的大多数肽甚至比OP-145明显更强效,具有多至16倍高的活性(表2-4)。如表2所证实,存在50%血浆时OP-145的IC99.9为204.8μM。存在血浆时P148和P159的IC99.9为12.8μM(16倍增加)。存在血浆时P140、P141、P144、P145、P150、P151、P152、P153、P158、P160、P161、P162和P163的IC99.9为25.6μM(8倍增加)。存在血浆时,P139、P142、P143、P146、P147、P154、P156和P157的IC99.9为51.2μM(4倍增加),P149和P155的IC99.9为102.4μM(2倍增加)。
已证实P145、P148和P159对中对数生长期和稳定期细菌培养物均有效(参见表2-4)。此外,P145、P148和P159能抑制金黄色葡萄球菌生物膜形成(参见图3)。此外,P145、P148和P159具有可证明的免疫调节活性,因其中和内毒素脂磷壁酸(LTA)和脂多糖(LPS),因此降低促炎反应(表12)。
还发现具有至少16个氨基酸的短P148变体在PBS中的抗微生物活性与P148相当(参见表5)。重要的是,存在血浆时的抗微生物活性在该短变体中依然保留。具有14个氨基酸的P148短变体具有比P148低的抗微生物活性,但其仍比存在血浆的OP-145的效果强5倍。
因此,本发明的多肽在存在或不存在血浆时均具有针对残留或不残留在生物膜中的微生物的高抗微生物活性,具有LPS和LTA中和活性表明的最佳的抗炎(微生物化合物-中和)活性。
本发明的抗微生物肽对生物膜感染的效果在以下三点:它们防止生物膜形成并打散已有的生物膜,杀死释放位点处及周围的细菌、真菌或其它微生物,和通过中和促炎微生物内毒素如脂磷壁酸(LTA)、肽聚糖(PG)和脂多糖(LPS)并激活巨噬细胞以促进它们的吞噬作用和杀微生物活性来协调免疫反应。这种免疫控制对于防止植入物周围的组织变为病原体的新环境而言是必要的。
因此,本发明提供了一种分离或重组多肽,包含氨基酸序列LAREYKKIVEKLKRWLRQVLRTLR,或所述氨基酸序列的变体,所述多肽具有抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫活性,并且在存在50%血浆的情况下针对至少一种微生物种具有体外抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫的活性,在相同条件下测定时,该活性比OP-145的活性至少高1.3倍,
所述变体序列具有至少14个氨基酸并且任选具有:
-一个或多个下述的氨基酸取代:
·选自L、V、F、A、I、W、Y或Q的组的一个或多个氨基酸被选自该组的另一氨基酸取代;
·R和/或K被带正电氨基酸取代;
-由相应的D-氨基酸取代一个或多个氨基酸;
-由相应的非天然氨基酸取代一个或多个氨基酸,和/或
-来自所述氨基酸序列的至少14个连续氨基酸的逆反序列。
本发明还提供了一种分离或重组多肽,包含氨基酸序列LAREYKKIVEKLKRWLRQVLRTLR,或所述氨基酸序列的变体,所述多肽具有抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫活性,并且在存在50%血浆的情况下针对至少一种微生物种具有体外抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫的活性,在相同条件下测定时,该活性比OP-145的活性至少高1.3倍,
所述变体序列具有至少14个氨基酸并且任选具有:
-一个或多个下述的氨基酸取代:
·选自L、V、F、A、I、W、Y或Q的组的一个或多个氨基酸被选自该组的另一氨基酸取代;
·R和/或K被A或带正电氨基酸取代;
-由相应的D-氨基酸取代一个或多个氨基酸;
-由相应的非天然氨基酸取代一个或多个氨基酸,和/或
-来自所述氨基酸序列的至少14个连续氨基酸的逆反序列。
在本文限定的氨基酸序列或其变体中,用单字母符号表示氨基酸。这些单字母符号和三字母符号是本领域技术人员所熟知的,并具有以下含义:A(Ala)是丙氨酸、C(Cys)是半胱氨酸、D(Asp)是天冬氨酸、E(Glu)是谷氨酸、F(Phe)是苯丙氨酸、G(Gly)是甘氨酸、H(His)是组氨酸、I(Ile)是异亮氨酸、K(Lys)是赖氨酸、L(Leu)是亮氨酸、M(Met)是甲硫氨酸、N(Asn)天冬酰胺、P(Pro)是脯氨酸、Q(Gln)是谷氨酰胺、R(Arg)是精氨酸、S(Ser)是丝氨酸、T(Thr)是苏氨酸、V(Val)是缬氨酸、W(Trp)是色氨酸、Y(Tyr)是酪氨酸。如本文所用,“带正电氨基酸”指生理pH下(即pH 7.3-7.4)具有正电荷的氨基酸。
本发明的多肽具有抗微生物活性,优选抗细菌、抗病毒和/或抗真菌活性,更优选抗细菌和/或抗真菌活性。此外,本发明的多肽优选同时具有抗微生物和抗炎活性。本文所述的术语多肽的“抗微生物活性”是指抵抗至少一种微生物,例如细菌、病毒和/或真菌的生长或增殖,并包括抑制、降低或防止生长或增殖以及杀死微生物。微生物是微观的生物体,即,通常太小难以被人的肉眼看到。微生物是非常多种多样的,它们包括细菌、病毒、真菌、古细菌、原生动物和细藻。类似地,本文所用术语“抗细菌活性”、“抗病毒活性”、“抗真菌活性”和“抗寄生虫活性”是指分别抵抗一般细菌、病毒、真菌和寄生虫的生长或增殖,并包括抑制、降低或防止生长或增殖以及杀死它们。例如,抗微生物活性表示为抑制浓度(IC)或致死浓度(LC)。本文所用ICx或LCx指2小时后杀伤至少x%微生物的最低肽浓度。例如IC99.9和LC99.9指杀伤≥99.9%微生物的最低肽浓度。可通过本领域已知的方法来测量抗微生物、抗细菌、抗病毒、抗真菌和抗寄生虫活性。
这类方法之一详述于本申请的实施例并涉及测定抗微生物活性的体外试验。在该方法中,在微生物-多肽混合物在合适的培养基之中或之上孵育之后,用不同浓度的本发明多肽孵育微生物,例如细菌或真菌孵育持续例如约1-2小时,以确立与未用多肽孵育的微生物样品(以相同方式进一步处理)相比的存活和/杀伤的微生物的数量。
可以使用病毒空斑试验来评估本发明的多肽的抗病毒活性。简言之,病毒接种物在任意单层细胞感染之前暴露于多肽。在标准间隔之后,使用这些提取物的多个稀释物通过感染新鲜的单层细胞并定量它们对单层细胞的作用来确定细胞提取物中的病毒效价。
为了评价抗寄生虫活性,本发明的多肽与寄生虫孵育标准时间间隔。此后,可直接分析寄生虫的代谢活性,例如通过MTT试验,或者可将寄生虫移植到哺乳动物细胞中并在孵育之后通过显微镜来评价这些细胞中的寄生虫繁殖。
本文所用术语多肽的“抗炎活性”是指在已感染微生物,例如细菌、病毒、真菌和/或寄生虫的对象中抑制、减少或防止炎症反应。本发明的多肽的抗炎活性通过抑制、减少或防止促炎微生物化合物,如脂磷壁酸(LTA)、肽聚糖(PG)和/或脂多糖(LPS)的释放来实现。可通过本领域已知的方法来测量抗炎活性。此类方法的示例为LPS中和试验和LTA中和试验,如本申请实施例所述。该方法中,本发明的多肽与固定浓度的LPS或LTA(例如500ng/ml LPS或2mg/ml LTA)混合并孵育30分钟。此后,将这些混合物加入稀释的新鲜人全血中并在20小时后,通过ELISA测量血液样品中细胞因子(例如,LTA为1L-8,LPS为1L-12p40)的水平。
本发明的多肽抵抗血浆,还称为血液血浆,优选人血浆。本文所用“血浆”或“血液血浆”具有本领域常规含义。其指血液中移除了红细胞、白细胞和血小板的流体部分,该部分包括蛋白质、激素和其他有机化合物和无机化合物例如电解质。本文所用“抵抗血浆”定义为在存在50%血浆,优选人血浆的情况下针对至少一种微生物种具有体外抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫的活性,在相同条件下测定时,该活性比OP-145的活性至少高1.3倍。优选针对至少一种微生物物种的所述活性比OP-145的活性高至少1.5倍,更优选至少2倍、更优选至少4倍、更优选比OP-145的活性高至少5倍。在存在50%血浆的情况下,特别优选的多肽针对至少一种微生物物种的抗微生物活性比OP-145的抗微生物活性至少高16倍。
“存在50%血浆”表示当多肽或OP-145与添加血浆的液体(例如PBS)中的微生物孵育时测量的抗微生物活性,所述血浆优选人血浆,终浓度为50%。“相同反应条件”表示对本发明多肽的抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫活性的测定所用的条件与对OP-145的抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫活性的测定所用的条件相同。此类条件包括但不限于:孵育多肽和微生物的缓冲液、微生物物种的同一性、微生物浓度、孵育时间和温度以及所用血浆的来源。
OP-145具有序列JIGKEFKRIVERIKRFLRELVRPLRB,其中J是乙酰基且B是酰氨基。本领域技术人员能使用常用固相合成法或本文详述的重组技术来合成OP-145从而能比较OP-145与其他肽的抗微生物活性。此外,乙酰化和酰胺化是本领域常用技术,因此本领域技术人员能对OP-145的肽链的N末端进行乙酰化并对C末端进行酰胺化。
如本文所述,体外抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫活性优选表示为IC99.9或IC 50。本文所用“IC99.9”和“IC50”分别指在给定时间内(例如2小时)杀伤至少99.9%或50%微生物的最低肽浓度。本发明的多肽优选在存在50%血浆的情况下针对至少一种微生物种的体外IC99.9至多为相同条件下测定的OP-145的IC99.9的75%。本发明的多肽在存在50%血浆的情况下针对至少一种微生物种的体外IC99.9优选至多为相同条件下测定的OP-145的IC99.9的70%,更优选至多为60%、更优选至多为50%、更优选至多为40%、更优选至多为30%、更优选至多为20%、最优选至多为10%。特别优选的多肽在存在50%血浆的情况下针对至少一种微生物种的体外IC99.9至多为相同条件下测定的OP-145的IC99.9的10%。
本发明多肽在存在50%血浆的情况下在2小时后于37℃下针对至少一种微生物物种的体外IC99.9优选为150μM。该IC99.9优选按照实施例中所述的测定抗微生物活性的方法测定。实施例中所述用于测定针对与生物膜不关联的微生物的抗微生物活性的方法涉及将添加人血浆(终浓度50%)的PBS中的50μL多肽溶液与5x106CFU/mL PBS的20μL细菌悬液在孔中混合。该混合物37℃震荡孵育2小时后,样品用于评估细菌计数。杀伤99.9%细菌的最低肽浓度称为抑制浓度(IC)99.9。细菌计数可通过手工CFU计数来测定。为了测定抗细菌活性,使用例如1x106CFU/ml细菌,为了测定抗真菌活性,使用例如1x105细胞/ml。
为了测定抗生物膜活性,实施例所述方法涉及在96‐孔聚丙烯板中的生物膜调整的BM2中用1x108CFU/ml的金黄色葡萄球菌JAR060131于37℃孵育所述多肽24小时后测定IC50,所述板通过用20%血浆于4℃孵育过夜而包被有血浆,通过PBS洗涤四次移除浮游细菌并用结晶紫染色生物膜。用乙醇增溶之后,测定590nm的光密度作为生物膜质量的量度。
本发明多肽在存在50%血浆的情况下的体外IC99.9优选至多为100μM、更优选至多为80μM、更优选至多为51.2μM、更优选至多为30μM。本发明的优选多肽的本文所定义的IC99.9为至多25.6μM。特别优选所述多肽在存在50%血浆的情况下针对至少一种微生物物种的体外IC99.9至多为12.8μM。
所述至少一种微生物物种为例如细菌物种例如金黄色葡萄球菌(S.aureus)、表皮葡萄球菌(S.epidermidis)、铜绿假单胞菌(P.aeruginosa),真菌物种例如白色念珠菌(C.albicans)和黑曲霉菌(A.niger),寄生虫物种例如恶性疟原虫(Plasmodium falciparum)和弓形虫(Toxoplasma gondii),或病毒物种例如甲肝病毒、丙肝病毒、甲型流感病毒等。优选地,本发明多肽在存在50%血浆的情况下针对至少一种细菌或真菌物种的体外IC99.9为至多105μM,优选针对金黄色葡萄球菌、表皮葡萄球菌、铜绿假单胞菌、白色念珠菌和黑曲霉菌,最优选本发明多肽在存在50%血浆的情况下针对至少金黄色葡萄球菌(最优选Campoccia等(Int J Artif Organs.2008 9月;31(9):841-7)所述的金黄色葡萄球菌JAR)的体外IC99.9为至多105μM。本发明的优选多肽针对金黄色葡萄球菌的本文所定义的IC99.9至多25.6μM、更优选至多12.8μM。
优选的变体序列具有至多一个氨基酸被A取代。这可为任何氨基酸,例如氨基酸1-24位中的任一。如表6-8所证实,其中一个氨基酸被丙氨酸取代的多肽保持至少部分抗微生物活性,而对于一些丙氨酸取代的多肽来说活性甚至增加。
还提供一种包含氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR,或所述氨基酸序列的变体的分离或重组多肽,
所述多肽具有抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫活性,并且在存在50%血浆的情况下具有体外抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫的活性,在相同条件下测定时,该活性比OP-145的活性至少高1.3倍,
所述变体具有至少14个氨基酸并且任选具有:
-一个或多个下述的氨基酸取代:
·K被带正电氨基酸取代,优选被R、高赖氨酸、高精氨酸、鸟氨酸、二氨基丁酸和二氨基丙酸取代;
·R被带正电氨基酸取代,优选被K、高赖氨酸、高精氨酸、鸟氨酸、二氨基丁酸和二氨基丙酸取代;
·L被V、I或W取代;
·Y被W或Q取代;
·V被F或A取代;
·I被L取代;
·W被F、Y、L或I取代
-由相应的D-氨基酸取代一个或多个氨基酸;
-由相应的非天然氨基酸取代一个或多个氨基酸,和/或
-来自所述氨基酸序列的至少14个连续氨基酸的逆反序列。
还提供一种包含氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR,或所述氨基酸序列的变体的分离或重组多肽,
所述多肽具有抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫活性,并且在存在50%血浆的情况下具有体外抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫的活性,在相同条件下测定时,该活性比OP-145的活性至少高1.3倍,
所述变体具有至少14个氨基酸并且任选具有:
-一个或多个下述的氨基酸取代:
·K被A或带正电氨基酸取代,优选被A、R、高赖氨酸、高精氨酸、鸟氨酸、二氨基丁酸和二氨基丙酸取代;
·R被A或带正电氨基酸取代,优选被A、K、高赖氨酸、高精氨酸、鸟氨酸、二氨基丁酸和二氨基丙酸取代;
·L被A、V、I或W取代;
·Y被A、W或Q取代;
·V被F或A取代;
·I被A或L取代;
·W被A、F、Y、L或I取代
-由相应的D-氨基酸取代一个或多个氨基酸;
-由相应的非天然氨基酸取代一个或多个氨基酸,和/或
-来自所述氨基酸序列的至少14个连续氨基酸的逆反序列。
该优选的变体序列还优选具有至多一个氨基酸被A取代。这可为任何氨基酸,因此氨基酸1-24位中的任一氨基酸可被A取代。
本文所用的氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR的变体的长度为至少14个氨基酸并且优选具有一个或多个下述氨基酸取代:
-K被带正电氨基酸取代,优选被R、高赖氨酸、高精氨酸、鸟氨酸、二氨基丁酸和二氨基丙酸取代,更优选被R取代;
-R被带正电氨基酸取代,优选被K、高赖氨酸、高精氨酸、鸟氨酸、二氨基丁酸和二氨基丙酸取代,更优选被K取代;
-L被V、I或W取代;
-Y被W或Q取代;
-V被F或A取代;
-I被L取代;
-W被F、Y、L或I取代
由相应的D-氨基酸取代一个或多个氨基酸
由相应的非天然氨基酸取代一个或多个氨基酸。优选地,所述变体序列具有多至14个所述取代,更优选多至10个所述取代,例如多至9、多至8、多至7、多至6、多至5、多至4、多至3、多至2或1个所述取代。
优选所述变体序列任选具有一个或多个下述氨基酸取代:
-在氨基酸位置2处用R取代K
-在氨基酸位置3处用R取代K
-在氨基酸位置4处用V取代L
-在氨基酸位置5处用W取代Y
-在氨基酸位置8处用V取代L
-在氨基酸位置9处用F或A取代V
-在氨基酸位置10处用R取代K
-在氨基酸位置11处用L取代I
-在氨基酸位置12处用I或W取代L
-在氨基酸位置15处用F、Y、L或I取代W
-在氨基酸位置16处用F、Y、L或I取代W
-在氨基酸位置18处用Q取代Y
-在氨基酸位置20处用R取代K
-在氨基酸位置21处用K取代R
由相应的D-氨基酸取代一个或多个氨基酸
在此,氨基酸位置的编号如下:L1K2K3L4Y5K6R7L8V9K10I11L12K13R14W15W16R17Y18L19K20R21P22V23R24。所述变体还任选具有一个或多个、更优选至多一个氨基酸被A取代。这可为任何氨基酸,因此氨基酸1-24位中的任一氨基酸可被A取代。
优选地,本文限定的变体序列具有至多15个所述氨基酸取代,更优选至多10个所述氨基酸取代,如0、1、2、3、4、5、6、7、8、9或10个所述取代。此外,本文所述变体序列优选至少包含氨基酸序列KRLVKILKRWWRYL,即氨基酸6-19,任选具有一个或多个所述氨基酸取代。因此提供一种包含氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR,或包含所述氨基酸序列的变体的分离或重组多肽,
所述多肽具有抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫活性,并且在存在50%血浆的情况下针对至少一种微生物种具有体外抗微生物、抗细菌、抗病毒、抗真菌和/或抗寄生虫的活性,在相同条件下测定时,该活性比OP-145的活性至少高1.3倍,
所述变体序列至少具有氨基酸序列KRLVKILKRWWRYL,任选具有:
-多至10个下述氨基酸取代:
·选自L、V、F、A、I、W、Y或Q的组的一个或多个氨基酸被选自该组的另一氨基酸取代;
·R和/或K被A或带正电氨基酸取代;
-由相应的D-氨基酸取代一个或多个氨基酸;
-由相应的非天然氨基酸取代一个或多个氨基酸,和/或
-来自所述氨基酸序列的至少14个连续氨基酸的逆反序列。
还优选具有至少一个所述氨基酸取代的变体序列。
本发明优选的多肽包括表1所示的肽P139、P140、P141、P142、P143、P144、P145、P146、P147、P148、P149、P150、P151、P152、P153、P154、P155、P156、P157、P158、P159、P160、P161、P162或P163的氨基酸序列,因为这些肽具有PBS中的高度抗微生物活性,并且在存在血浆时相比肽OP-145具有更高的抗微生物活性。优选地,所述多肽包括表1所示的肽P139、P140、P141、P142、P145、P146、P147、P148、P150、P151、P152、P153、P154、P156、P157、P158、P159、P160、P161、P162或P163的氨基酸序列,因为这些肽在存在血浆时相比肽OP-145具有至少高4倍的抗微生物活性。更优选地,所述多肽包括表1所示的肽P140、P141、P145、P148、P150、P151、P152、P153、P158、P159、P160、P161、P162或P163的氨基酸序列,因为这些肽在存在血浆时相比肽OP-145具有至少高8倍的抗微生物活性。
本发明特别优选的多肽包括氨基酸序列LKRLYKRLAKLIKRLYRYLKKPVR(其为肽P145的氨基酸序列),或所述氨基酸序列的变体,所述变体具有至少14个氨基酸并任选具有由相应的D-氨基酸和/或由相应的非天然氨基酸取代一个或多个氨基酸,和/或任选具有来自所述氨基酸序列的至少14个连续氨基酸的逆反序列,更优选所述多肽至少包括氨基酸序列LKRLYKRLAKLIKRLYRYLKKPVR的氨基酸14-19,最优选所述多肽包括氨基酸序列LKRLYKRLAKLIKRLYRYLKKPVR。该多肽特别优选是由于肽P145具有强效广谱抗微生物活性(存在或不存在血清),以及抗炎性。
本发明另一特别优选的多肽包括氨基酸序列LKRVWKRVFKLLKRYWRQLKKPVR(其为肽P148的氨基酸序列),或所述氨基酸序列的变体,所述变体具有至少14个氨基酸并任选具有由相应的D-氨基酸和/或由相应的非天然氨基酸取代一个或多个氨基酸,和/或任选具有来自所述氨基酸序列的至少14个连续氨基酸的逆反序列,更优选所述多肽至少包括氨基酸序列LKRVWKRVFKLLKRYWRQLKKPVR的氨基酸14-19,最优选所述多肽包括氨基酸序列LKRVWKRVFKLLKRYWRQLKKPVR、RVWKRVFKLLKRYWRQLKKPVR、LKRVWKRVFKLLKRYWRQLKKP、RVWKRVFKLLKRYWRQLKK、WKRVFKLLKRYWRQLKKPVR、LKRVWKRVFKLLKRYWRQLK、VWKRVFKLLKRYWRQLKK、WKRVFKLLKRYWRQLK、KRVFKLLKRYWRQL。这些是肽P148、P325、P326、P327、P328、P329、P330、P331和P332的氨基酸序列。该多肽特别优选是由于肽P148具有强效广谱抗微生物活性(存在或不存在血清),以及抗炎性,并且肽P325、P326、P327、P328、P329、P330、P331和P332保留肽P148的活性。
本发明另一个特别优选的多肽包括氨基酸序列LKRLYKRVFRLLKRYYRQLRRPVR(其为肽P159的氨基酸序列),或所述氨基酸序列的变体,所述变体具有至少14个氨基酸并任选具有由相应的D-氨基酸和/或由相应的非天然氨基酸取代一个或多个氨基酸,和/或任选具有来自所述氨基酸序列的至少14个连续氨基酸的逆反序列,更优选所述多肽至少包括氨基酸序列LKRLYKRVFRLLKRYYRQLRRPVR的氨基酸14-19,最优选所述多肽包括氨基酸序列LKRLYKRVFRLLKRYYRQLRRPVR。该多肽特别优选是由于肽P159具有强效广谱抗微生物活性(存在或不存在血清),以及抗炎性。
本发明另一优选的多肽包含表6、7和8所示的肽P246、P247、P248、P249、P250、P251、P252、P253、P254、P255、P256、P257、P258、P259、P260、P261、P262、P263、P264、P265、P266、P267、P268、P269、P270、P271、P272、P273、P274、P275、P276、P277、P278、P279、P280、P281、P282、P283、P284、P285、P286、P287、P288、P289、P290、P291、P292、P293、P294、P295、P296、P297、P298、P299、P300、P301、P302、P303、P304、P305、P306、P307、P308、P309、P310、P311、P312、P313、P314、P315、P316或P317的氨基酸序列,因为这些肽具有PBS中的高度抗微生物活性,并且在存在血浆时相比肽OP-145具有更高的抗微生物活性。具有该氨基酸序列的多肽为其中一个氨基酸被A取代的多肽P145、P148或P159的变体。本发明特别优选的多肽具有肽P276的氨基酸序列,其为在位置7处的R被A取代的P148的变体。
本发明优选的多肽具有选自表1、2、5、6、7、8、9和/或10的多肽的氨基酸序列。本发明多肽更优选包括氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR或其变体,其选自表2或5-10并且在50%血浆中的致死浓度(LC)99.9为至多102.4μM。在一个实施方式中,提供选自表2或5-10的50%血浆中LC 99.9为至多51.2μM(更优选至多51.2μM)的多肽。
或者或除了上述氨基酸被另一氨基酸取代之外,本文所述的氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR的变体可在上述一个或多个氨基酸取代之后包含一个或多个由其相应的D-氨基酸或由对应于所述氨基酸序列中已存在的L-氨基酸的D-氨基酸所取代的L-氨基酸。本文中用大写的单字母符号表示的氨基酸,如A代表丙氨酸,是天然蛋白质中通常发现的那些L-氨基酸。本文所用的“相应D-氨基酸”是L-氨基酸的D-氨基酸相对物。例如,丙氨酸(A)的相应D-氨基酸是D-丙氨酸(a),精氨酸(R)的相应D-氨基酸是D-精氨酸(r),天冬酰胺(N)的相应D-氨基酸是D-天冬酰胺(n)等。本文限定的变体序列的所有L-氨基酸可被它们相应的D-氨基酸取代。本发明因此提供了包含氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR或所述氨基酸序列的变体的多肽,所述多肽具有抗微生物、抗细菌、抗病毒、抗真菌、抗寄生虫和/或抗炎活性,
所述变体序列具有至少14个氨基酸并且任选具有:
-一个或多个下述的氨基酸取代:
·选自L、V、F、A、I、W、Y或Q的组的一个或多个氨基酸被选自该组的另一氨基酸取代,或被氨基酸L、V、F、A、I、W、Y或Q的对应D-氨基酸取代;
·R被带正电氨基酸取代,优选被K、高赖氨酸、高精氨酸、鸟氨酸、二氨基丁酸和二氨基丙酸取代,或被K或R的对应D-氨基酸取代;
·K被带正电氨基酸取代,优选被R、高赖氨酸、高精氨酸、鸟氨酸、二氨基丁酸和二氨基丙酸取代,或被R或K的对应D-氨基酸取代;
-由相应的D-氨基酸取代一个或多个氨基酸。该变体序列还可具有选自K和R的一个或多个氨基酸(优选至少一个氨基酸)被A取代,或被对应D-氨基酸取代。优选所述变体序列任选具有一个或多个下述氨基酸取代:
·K被R或R的对应D-氨基酸取代;
·R被K或K的对应D-氨基酸取代;
·L被V、I或W或被氨基酸V、I或W的对应D-氨基酸取代;
·Y被W或Q或被氨基酸W或Q的对应D-氨基酸取代;
·V被F或A或被氨基酸F或A的对应D-氨基酸取代;
·I被L或L的对应D-氨基酸取代;
·W被F、Y、L或I或氨基酸L F、Y、L或I的对应D-氨基酸取代;
-由相应的D-氨基酸取代一个或多个氨基酸;
更优选所述变体序列任选具有一个或多个下述氨基酸取代
-位置2的氨基酸K被R或被R的对应D-氨基酸取代;
-位置3的氨基酸K被R或被R的对应D-氨基酸取代;
-位置4的氨基酸L被V或被V的对应D-氨基酸取代;
-位置5的氨基酸Y被W或被W的对应D-氨基酸取代;
-位置8的氨基酸L被V或被V的对应D-氨基酸取代;
-位置9的氨基酸V被F或A或被氨基酸F或A的对应D-氨基酸取代;
-位置10的氨基酸K被R或被R的对应D-氨基酸取代;
-位置11的氨基酸I被L或被L的对应D-氨基酸取代;
-位置12的氨基酸L被I或W或被氨基酸I或W的对应D-氨基酸取代;
-位置15的氨基酸W被F、Y、L或I或被氨基酸F、Y、L或I的对应D-氨基酸取代;
-位置16的氨基酸W被F、Y、L或I或被氨基酸F、Y、L或I的对应D-氨基酸取代;
-位置18的氨基酸Y被Q或被Q的对应D-氨基酸取代;
-位置20的氨基酸K被R或被R的对应D-氨基酸取代;
-位置21的氨基酸R被K或被K的对应D-氨基酸取代;
-氨基酸被对应D氨基酸取代。
本文限定的氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR的变体可含有至多24个由其相应D-氨基酸取代的L-氨基酸。因此,变体序列可完全由D-氨基酸组成。例如,该变体序列可含有24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2或1个由其相应的D-氨基酸取代L-氨基酸。优选地,一个或多个L-氨基酸被其对应D-氨基酸取代的所述变体序列包含表1所示的肽P139、P140、P141、P142、P143、P144、P145、P146、P147、P148、P149、P150、P151、P152、P153、P154、P155、P156、P157、P158、P159、P160、P161、P162或P163的氨基酸序列的至少14个氨基酸。更优选地,一个或多个L-氨基酸被其对应D-氨基酸取代的本发明的多肽任选地包含肽P1454、P148或P159的氨基酸序列。在一个实施方式中,本文所述变体序列包含氨基酸被其对应D-氨基酸的一个取代。氨基酸序列中D-氨基酸的位置是无关的。在另一个实施方式中,变体序列含有的所有L-氨基酸被其相应的D-氨基酸取代。本文所述变体序列还可为氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR的至少14个连续氨基酸或肽P139-163(优选P145、P148或P159)之一的氨基酸序列的至少14个连续氨基酸的逆反肽。优选所述变体序列是所述氨基酸序列的全长的逆反肽,优选肽P139-163(更优选P145、P148或P159)之一的氨基酸序列的全长的逆反肽。逆反肽是以参考氨基酸序列的反向序列由D-氨基酸组成的肽。例如,本发明的优选变体序列是P145、P148或P159的氨基酸序列的逆反肽,即分别具有序列rvpkklyrylrkilkalrkylrkl、rvpkklqrwyrkllkfvrkwvrkl或rvprrlqryyrkllrfvrkylrkl,或所述序列之一的至少14个氨基酸。
本文所述的氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR的变体可包括多至5个取代,所述取代为氨基酸被非天然氨基酸取代,或在上述一个或多个氨基酸取代之后所述氨基酸序列中存在的氨基酸被非天然氨基酸取代。本文所用的“非天然氨基酸”是指非遗传编码的氨基酸,不考虑它们是否在自然中出现。可存在于本文所限定的氨基酸序列的变体中的非天然氨基酸包括:β-氨基酸、对-酰基-L-苯丙氨酸、N-乙酰基赖氨酸、O-4-烯丙基-L-酪氨酸、2-氨基己二酸、3-氨基己二酸、β-丙氨酸、氢2-叠氮琥珀酸4-叔丁酯、β-氨基丙酸、2-氨基丁酸、4-氨基丁酸、2,4-二氨基丁酸、6-氨基己酸、2-氨基庚酸、2-氨基异丁酸、3-氨基异丁酸、2-氨基庚二酸、对氨基苯丙氨酸、2,3-二氨基丁酸、2,3-二氨基丙酸、2,2'-二氨基庚二酸、对氨基-L-苯丙氨酸、对-叠氮基-L-苯丙氨酸、D-烯丙基甘氨酸、对-苯甲酰基-L-苯丙氨酸、3-苯并噻吩基丙氨酸对-溴苯丙氨酸、叔丁基丙氨酸、叔丁基甘氨酸、4-氯苯丙氨酸、环己基丙氨酸、磺基丙氨酸、D-瓜氨酸、硫代-L-瓜氨酸、锁链素、ε-氨基己酸、N-乙基甘氨酸、N-乙基天冬酰胺、2-氟苯丙氨酸、3-氟苯丙氨酸、4-氟苯丙氨酸、高精氨酸、高半胱氨酸、高丝氨酸、羟基赖氨酸、异-羟基赖氨酸、3-(3-甲基-4-硝基苄基)-L-组氨酸甲酯、异锁链素、异-异亮氨酸、异丙基-L-苯并丙氨酸、3-甲基-苯丙氨酸、N-甲基甘氨酸、N-甲基异亮氨酸、6-N-甲基赖氨酸、O-甲基-L-酪氨酸、N-甲基缬氨酸、甲硫氨酸亚砜、2-萘基丙氨酸、L-3-(2-萘基)丙氨酸、异丝氨酸、3-苯基丝氨酸、正缬氨酸、正亮氨酸、5,5,5-三氟-DL-亮氨酸、鸟氨酸、3-氯-酪氨酸、N5-氨基甲酰基鸟氨酸、青霉胺、苯基甘氨酸、γ-氨基丁酸、吡啶基丙氨酸、1,2,3,4-四氢-异喹啉-3-羧酸、β-2-噻吩基丙氨酸、γ-羧基-DL-谷氨酸、4-氟-DL-谷氨酸、D-甲状腺素、异-苏氨酸、5-羟基-色氨酸、5-甲氧基-色氨酸、5-氟-色氨酸、3-氟-缬氨酸。
优选地,所述序列的天然氨基酸由相应的非天然氨基酸取代。本文所用的“相应非天然氨基酸”是指是参考天然氨基酸的衍生物的非天然氨基酸。例如,天然氨基酸被相应的β-氨基酸取代。β-氨基酸的氨基与β碳结合,而不是与天然氨基酸中的α碳结合。例如,α-丙氨酸被β-丙氨酸取代等。天然氨基酸被所述天然氨基酸的衍生物的非天然氨基酸取代的其它示例如下。丙氨酸被例如β-丙氨酸、叔丁基丙氨酸、2-萘基丙氨酸;L-3-(2-萘基)丙氨酸、2-氨基异丁酸取代。精氨酸被例如高精氨酸、鸟氨酸、N5-氨基甲酰基鸟氨酸、3-氨基-丙酸取代。天冬酰胺被例如N-乙基天冬酰胺取代。天冬氨酸被例如4-叔丁基氢2-叠氮琥珀酸取代。半胱氨酸被例如磺基丙氨酸、高半胱氨酸取代。谷氨酸被例如γ-羧基-DL-谷氨酸、4-氟-DL-谷氨酸取代。谷氨酰胺被例如D-瓜氨酸、硫代-L-瓜氨酸取代。甘氨酸被例如N-甲基甘氨酸、叔丁基甘氨酸、N-甲基甘氨酸、D-烯丙基甘氨酸取代。组氨酸被例如3-(3-甲基-4-硝基苄基)-L-组氨酸甲酯取代。异亮氨酸被例如异锁链素、N-甲基异亮氨酸、异-异亮氨酸取代。亮氨酸被例如正亮氨酸、锁链素、5,5,5-三氟-亮氨酸取代。赖氨酸被例如6-N-甲基赖氨酸、2-氨基庚酸、N-乙酰基赖氨酸、羟基赖氨酸、异-羟基赖氨酸取代。甲硫氨酸被例如甲硫氨酸亚砜取代。苯丙氨酸被例如对-氨基-L-苯丙氨酸、3-苯并噻吩基丙氨酸、对-溴苯丙氨酸、对-酰基-L-苯丙氨酸、2-氟苯丙氨酸、3-氟苯丙氨酸、4-氟苯丙氨酸取代。脯氨酸被例如3-羟基脯氨酸、4-羟基脯氨酸、1-乙酰基-4-羟基-L-脯氨酸取代。丝氨酸被例如高丝氨酸、异丝氨酸、3-苯基丝氨酸取代。苏氨酸被例如D-甲状腺素、异-苏氨酸取代。色氨酸被例如5-羟基-色氨酸、5-甲氧基-色氨酸、5-氟-色氨酸取代。酪氨酸被例如O-甲基-L-酪氨酸、O-4-烯丙基-L-酪氨酸、3-氯-酪氨酸取代。缬氨酸被例如正缬氨酸、N-甲基缬氨酸、3-氟-缬氨酸取代。
本发明因此提供了包含氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR或所述氨基酸序列的变体的多肽,所述多肽具有抗微生物、抗细菌、抗病毒、抗真菌、抗寄生虫和/或抗炎活性,
所述变体序列具有至少14个氨基酸并且任选具有:
-一个或多个下述的氨基酸取代:
·选自L、V、F、A、I、W、Y或Q的组的一个或多个氨基酸被选自该组的另一氨基酸取代,或被氨基酸L、V、F、A、I、W、Y或Q的对应非天然氨基酸取代;
·R被K或K的对应非天然氨基酸取代;
·K被R或K的对应非天然氨基酸取代;
-由相应的D-氨基酸取代一个或多个氨基酸。该变体序列还可具有选自K和R的一个或多个氨基酸(优选至少一个氨基酸)被对应非天然氨基酸A取代。
优选所述变体序列任选具有一个或多个下述氨基酸取代:
·K被R或R的对应非天然氨基酸取代;
·R被K或K的对应非天然氨基酸取代;
·L被V、I或W或被氨基酸V、I或W的对应非天然氨基酸取代;
·Y被W或Q或被氨基酸W或Q的对应非天然氨基酸取代;
·V被F或A或被氨基酸F或A的对应非天然氨基酸取代;
·I被L或L的对应非天然氨基酸取代;
·W被F、Y、L或I或氨基酸L F、Y、L或I的对应非天然氨基酸取代;
-由相应的非天然氨基酸取代一个或多个氨基酸;
更优选所述变体序列任选具有一个或多个下述氨基酸取代
-位置2的氨基酸K被R或被R的对应非天然氨基酸取代;
-位置3的氨基酸K被R或被R的对应非天然氨基酸取代;
-位置4的氨基酸L被V或被V的对应非天然氨基酸取代;
-位置5的氨基酸Y被W或被W的对应非天然氨基酸取代;
-位置8的氨基酸L被V或被V的对应非天然氨基酸取代;
-位置9的氨基酸V被F或A或被氨基酸F或A的对应非天然氨基酸取代;
-位置10的氨基酸K被R或被R的对应非天然氨基酸取代;
-位置11的氨基酸I被L或被L的对应非天然氨基酸取代;
-位置12的氨基酸L被I或W或被氨基酸I或W的对应非天然氨基酸取代;
-位置15的氨基酸W被F、Y、L或I或被氨基酸F、Y、L或I的对应非天然氨基酸取代;
-位置16的氨基酸W被F、Y、L或I或被氨基酸F、Y、L或I的对应非天然氨基酸取代;
-位置18的氨基酸Y被Q或被Q的对应非天然氨基酸取代;
-位置20的氨基酸K被R或被R的对应非天然氨基酸取代;
-位置21的氨基酸R被K或被K的对应非天然氨基酸取代;
-氨基酸被对应D氨基酸取代。
本发明的多肽可由氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR或本文限定的该序列的变体组成。本文所用的“多肽”是指包含多个氨基酸的肽、多肽和拟肽。术语“多肽”和“肽”可互换使用。证明具有抗微生物活性的最小的本发明的多肽的长度为14个氨基酸。然而,氨基酸序列或其变体可以是更大的多肽的部分,即N端和/或C端被一个或多个其它氨基酸延伸的多肽的部分。本发明的多肽的氨基酸序列或其变体可在N端和/或C端经修饰,优选通过包含N端和/或C端延伸基团。或者,所述氨基酸序列或其变体是N端和/或C端延伸的。本发明的多肽因此包含至少14个氨基酸,并且可包含多达1000个氨基酸。然而,优选较小的多肽以保持尽可能低的生产成本。优选地,本发明的多肽的长度是14-200个氨基酸,更优选14-100个氨基酸,更优选14-50个氨基酸。例如,本发明的多肽包含14-24个氨基酸,即16、17、18、19、20、21、22、23或24个氨基酸。优选所述多肽包含至少16个氨基酸,例如16-200、16-100或16-50个氨基酸。所述多肽优选具有14-24个氨基酸。这类具有14-24个氨基酸的多肽任选地还具有N-端和/或C-端修饰,如选自乙酰基-、己酰基-、癸酰基-、肉豆蔻酰基-、NH-(CH2-CH2-O)11-CO-和丙酰基-残基的N-端修饰和/或如选自酰胺-、NH-(CH2-CH2-O)11-CO-酰胺-和1个或2个氨基-己酰基基团的C-端修饰。在一个实施方式中,本发明的多肽由本文所述氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR或其变体组成,优选由表1所述的P145、P148或P159的氨基酸序列或其至少14个氨基酸组成,任选具有N端和/或C端修饰,优选包含N和/或C末端延长基团。
本文所用的“拟肽”是指含有非肽结构元件的化合物,该化合物模拟本发明的多肽的抗微生物、抗细菌、抗病毒、抗真菌、抗寄生虫和/或抗炎性质。因此,本发明的多肽可包含非肽结构元件。这类非肽结构元件可存在于本发明多肽的氨基酸序列中,作为所述序列的一个或多个氨基酸的取代或修饰的结果。或者,本发明的多肽可包含氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR或其本文限定的变体外侧,即在任选的N端和/或C端延伸基团中的非肽结构元件。拟肽中的非肽结构元件一般是对一个或多个现有氨基酸的修饰。通过对本发明的多肽进行结构性修饰来得到优选的拟肽,例如,使用非天然氨基酸如本文上述限定的那些、构象约束物、多肽的环化、等排替代或其它修饰。本发明的多肽的氨基酸序列因此任选包含一个或多个修饰。可通过天然方法对该多肽进行修饰,如翻译后加工,或通过化学修饰技术。可在所述多肽的任意位置处插入修饰,包括多肽主链、氨基酸侧链和N端或C端处。单个多肽可含有多种类型的修饰,或单一类型的几个修饰。修饰可包括乙酰化、酰胺化、酰基化、磷酸化、甲基化、去甲基化、ADP-核糖基化、二硫键形成、泛素化、γ羧化、糖基化、羟基化、碘化、氧化、PEG化和硫化。另外,可向本发明的多肽提供标记物,如生物素、荧光素或黄素、脂质或脂质衍生物、糖基团。还可向本发明的多肽提供靶向部分。
在优选实施方式中,本发明的多肽经N末端和/或C末端修饰。本发明的多肽因此优选包含N端和/或C端延伸基团。可用于本发明的多肽的N端和C端延伸基团是本领域熟知的。N端修饰的优选示例是乙酰基-、己酰基-、癸酰基-、肉豆蔻酰基-、NH-(CH2-CH2-O)11-CO-和丙酰基-残基。C端修饰的优选示例是酰胺-、NH-(CH2-CH2-O)11-CO-酰胺-和1个或2个氨基-己酰基基团。然而,其它N端或C端延伸基团也会产生本领域技术人员已知的活性化合物。在一个实施方式中,所述多肽包含N端乙酰基-、己酰基-、癸酰基-、肉豆蔻酰基-、NH-(CH2-CH2-O)11-CO-或丙酰基-残基,以及C端酰胺-、NH-(CH2-CH2-O)11-CO-酰胺-和1个或2个氨基-己酰基基团。在一个实施方式中,提供了本发明的多肽,其中N端是乙酰化的而C端是酰胺化的。
本发明因此提供了包含氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR或所述氨基酸序列的变体的分离或重组多肽,所述多肽具有抗微生物、抗细菌、抗病毒、抗真菌、抗寄生虫和/或抗炎活性,所述变体序列具有至少14个氨基酸并任选地具有以下氨基酸取代中的一个或多个、优选多至10个:
-在氨基酸位置2处用R取代K;
-在氨基酸位置3处用R取代K;
-在氨基酸位置4处用V取代L;
-在氨基酸位置5处用W取代Y;
-在氨基酸位置8处用V取代L;
-在氨基酸位置9处用F或A取代V;
-在氨基酸位置10处用R取代K;
-在氨基酸位置11处用L取代I;
-在氨基酸位置12处用I或W取代L;
-在氨基酸位置15处用F、Y、L或I取代W;
-在氨基酸位置16处用F、Y、L或I取代W;
-在氨基酸位置18处用Q取代Y;
-在氨基酸位置20处用R取代K;
-在氨基酸位置21处用K取代R;和/或
-由相应的D-氨基酸取代一个或多个氨基酸,
其中,所述氨基酸序列或其所述变体包含N端和/或C端延伸基团,优选包含N端乙酰基-、己酰基-、癸酰基-、肉豆蔻酰基-、NH-(CH2-CH2-O)11-CO-或丙酰基-残基,以及C端酰胺-、NH-(CH2-CH2-O)11-CO-酰胺-和1个或2个氨基-己酰基基团。本领域技术人员会清楚其它N端或C端延伸基团也会产生活性化合物。在此,氨基酸的编号如下:L1K2K3L4Y5K6R7L8V9K10I11L12K13R14W15W16R17Y18L19K20R21P22V23R24。所述多肽优选包含表1所述的P145、P148或P159的氨基酸序列或其至少14个氨基酸。所述多肽还优选具有14-24个氨基酸。
在优选的实施方式中,本发明的多肽包含疏水性部分。向阳离子(多)肽加入疏水性基团改善了它们中和微生物内毒素并与微生物膜相互作用的能力,并因此改善了它们消除微生物,例如病原体的能力。
如上文所述,可通过本领域已知的化学修饰技术来修饰本发明的多肽。可在多肽合成期间或结束时导入对本发明的多肽的修饰。例如,当使用固相合成技术合成多肽时,可通过将仍然与树脂结合的氨基酸序列与乙酸反应来进行N端乙酰化。作为另一个示例,在固相肽合成中使用特定类型的树脂来进行C端酰胺化,如市售的Tentagel SAM(德国蒂宾根的ex Rapp(ex Rapp,Tübingen))。这些树脂包含化学柄(chemical handle),在切割期间从这些化学柄释放酰胺化的(多)肽。修饰多肽的这些和其它方法是本领域任何技术人员已知的。
在优选的实施方式中,本发明的多肽包含细胞穿透肽。该细胞穿透肽是这样一种肽序列,当其与本发明的抗微生物肽连接时,有助于有效转移所述多肽穿过细胞膜。本领域任何已知的穿透肽均可用于本发明多肽中。细胞穿透肽的示例包括但不限于多聚精氨酸、TAT、HIV-Tat、R9-TAT、Pep-1、Pep-7、穿膜肽(penetratin)、转运子、Antp、Rev、FHV包被蛋白、buforin II、MAP、K-FGF、Ku70、SynBl、HN-1、TP10、pVEC、BGSC和BGTC。
本发明多肽优选是天然不存在的多肽,即本发明多肽优选为非天然产生的多肽。本文所用“非天然产生”表示天然中不存在该形式的所述多肽,优选天然中不存在所述多肽的氨基酸序列。
还提供本发明多肽的多聚体,其包含多至6个多肽,包括本文所述氨基酸序列LKKLYKRLVKILKRWWRYLKRPVR或其变体,优选包含P145、P148或P159的氨基酸序列或其至少14个氨基酸。所述多聚体可包含至多6个具有相同氨基酸序列的多肽单体,或至多6个多肽单体,其中2个或更多个多肽单体具有不同的氨基酸序列。在优选的实施方式中,本发明的多聚体包含至多6个具有相同氨基酸序列的本发明的多肽。
也提供了本发明的多肽的盐。这类盐包括,但不限于酸加成盐和碱加成盐。本文所用的多肽的“药学上可接受的盐”是指保留多肽的所需抗微生物、抗细菌、抗真菌、抗病毒、抗寄生虫和/或抗炎活性并适于给予人或动物的盐。制备多肽的盐的方法是本领域已知的,并且一般包括将多肽与药学上可接受的酸或碱混合,例如,通过将产物的游离酸或游离碱形式与一个或多个当量的合适的酸或碱在溶剂或介质(盐在该溶剂或介质中不溶)或溶剂(如水,其然后被真空或冻干去除)中混合,或通过在合适的离子交换树脂上将现有盐的阳离子交换成另一种阳离子。药学上可接受的酸和碱的示例包括有机和无机酸,如甲酸、乙酸、丙酸、乳酸、乙醇酸、草酸、丙酮酸、琥珀酸、马来酸、丙二酸、三氟乙酸、肉桂酸、硫酸、盐酸、氢溴酸、硝酸、高氯酸、磷酸和硫氰酸,其与多肽的游离氨基形成铵盐,和碱,其与多肽的游离羧基形成羧酸盐,如乙胺、甲胺、二甲胺、三乙胺、异丙胺、二异丙胺和其它单烷基、二烷基和三烷基胺,以及芳基胺。
可通过多种方法制备本发明的多肽。例如,可通过本领域熟知的常用的固相合成方法,例如,涉及α氨基的t-BOC或FMOC保护的方法来合成多肽。在此,随后向加长的氨基酸链加入氨基酸。这类方法例如描述于Merrifield(1963),J.Am.Chem.Soc.85:2149-2156;和Atherton等,"Solid Phase Peptide Synthesis(固相肽合成)"伦敦的IRL出版社,(1989)。固相肽合成方法特别适于大规模生产中较短长度的多肽,如长度达到约70个氨基酸的多肽的合成。
或者,可使用本领域熟知的重组技术来制备本发明的多肽,其中在宿主细胞中表达编码多肽的核苷酸序列。本发明因此提供了制备本发明的多肽的方法,包括:
-提供包含编码本发明的多肽的核酸序列的核酸分子;
-用所述核酸分子转化宿主细胞;
-在允许所述多肽表达的条件下培养所述宿主细胞;
-从所述细胞收获所述多肽;
-任选地N端或C端修饰所述多肽,例如通过加入N端和/或C端延伸基团。
本发明还提供了包含编码本发明的多肽的核酸序列的核酸分子,其在本文中也称为本发明的核酸分子。本文所用的本发明的核酸分子或核酸序列包含核苷酸,优选DNA和/或RNA链。
还提供了包含本发明的核酸序列分子的载体。本文所用术语“载体”是指能够向宿主细胞导入异源核酸序列的核酸分子,如质粒、噬菌体或动物病毒。本发明的载体允许在宿主细胞中表达或产生由异源核酸序列编码的本发明的多肽。本发明所用的载体例如衍生自动物病毒,其示例包括,但不限于痘苗病毒(包括减毒衍生物,如改良的安卡拉痘苗病毒,MVA)、新城疫病毒(NDV)、腺病毒或逆转录病毒。本发明的载体优选包含含有启动子的表达盒,该启动子适于在所选的宿主细胞中引发本发明的多肽的转录。真核宿主细胞中表达本发明的多肽的合适启动子的示例包括,但不限于β-肌动蛋白启动子、免疫球蛋白启动子、5S RNA启动子或病毒衍生的启动子,如巨细胞病毒(CMV)、劳氏肉瘤病毒(RSV)和猴病毒40(SV40)启动子,用于哺乳动物宿主。
本发明还提供了包含本发明的核酸分子和/或载体的重组宿主细胞。宿主细胞是已经或能够被核酸分子如本发明的载体转化的细胞。“转化”是指外来核酸向受体细胞的导入。宿主细胞的转化可导致重组蛋白质被所述细胞瞬时表达,表示该重组蛋白质仅表达持续限定的时间段。替代地,受体细胞的转化可导致稳定表达,表明核酸导入细胞的基因组中并由此传到下一代细胞中。另外,可以实现重组蛋白质的诱导型表达。诱导型表达系统需要存在或缺少允许编码本发明的多肽的核酸序列的表达的分子。诱导型表达系统的示例包括,但不限于Tet-On和Tet-Off表达系统、激素诱导型基因表达系统(例如蜕皮激素诱导型基因表达系统)、阿拉伯糖诱导型基因表达系统、和使用pMT/BiP载体(英杰公司(Invitrogen))的果蝇诱导型表达系统,该载体包含诱导型金属硫蛋白启动子。在制备本发明的多肽的方法中使用的宿主细胞是例如革兰氏阳性原核生物、革兰氏阴性原核生物或真核生物。优选地,所述宿主细胞是真核细胞,如植物细胞、酵母细胞、哺乳动物细胞或昆虫细胞,最优选昆虫细胞或哺乳动物细胞。合适的宿主细胞的示例包括植物细胞,如玉米细胞、水稻细胞、浮萍细胞、烟草细胞(如BY-2或NT-1细胞)和马铃薯细胞。酵母细胞的示例是酿酒酵母(Saccharomyces)和毕赤酵母(Pichia)。昆虫细胞的示例是草地贪夜蛾(Spodoptera frugiperda)细胞,如Tn5、SF-9和SF-21细胞,以及果蝇细胞,如果蝇施耐德2(S2)细胞。适于表达本发明的多肽的哺乳动物的示例包括,但不限于,非洲绿猴肾细胞(Vero)、幼仓鼠肾细胞(如BHK-21)、人视网膜细胞(例如PerC6细胞)、人胚胎肾细胞(如HEK293细胞)、马-达二氏犬肾(MDCK)细胞、鸡胚成纤维细胞(CEF)、鸡胚肾细胞(CEK细胞)、胚盘衍生的胚胎干细胞(例如EB14)、小鼠胚成纤维细胞(如3T3细胞)、中华仓鼠卵巢(CHO)细胞、和这些细胞类型的衍生物。
本发明的方法优选还包括收获、纯化和/或分离本发明的多肽的步骤。所得的本发明的多肽优选用于人类治疗,任选地在额外纯化、分离或加工步骤之后,例如使用凝胶电泳或色谱方法纯化。
本发明的多肽显示出可优选同时用于治疗或非治疗应用的多种活性。具体地,本发明的多肽可用于对抗多种微生物感染,如细菌感染、真菌感染、病毒感染,以及对抗寄生虫感染。提供了包含本发明的多肽或其药学上可接受的盐,以及至少一种药学上可接受的运载体、稀释剂和/或赋形剂的药物组合物。还提供了包含本发明的核酸分子或载体以及至少一种药学上可接受的运载体、稀释剂和/或赋形剂的药物组合物。
本发明还提供了用作药物的本发明的多肽。还提供用作药物的包含编码本发明的多肽的核酸序列的核酸分子。所述药物可以是治疗剂或预防剂。
在一个实施方式中,本发明提供了一种治疗患有或有风险患有细菌、真菌、病毒和/或寄生虫感染的对象的方法,该方法包括给予所述对象治疗有效量的本发明的多肽、本发明的药物组合物或本发明的核酸分子。还提供了一种制备用于治疗感染微生物的对象或用于预防微生物感染的药物的方法。在优选的实施方式中,所述微生物是细菌、真菌、病毒或寄生虫。还提供了用于防止或治疗微生物、细菌、真菌、病毒和/或寄生虫感染或微生物、细菌、真菌、病毒和/或寄生虫感染导致的病症的本发明用途的多肽和/或核酸分子。
本文所用的“对象”是人或动物。对象包括但不限于哺乳动物,如人、猪、雪貂、海豹、兔、猫、狗、牛和马,以及鸟类如鸡、鸭、鹅和火鸡。在本发明的优选实施方式中,对象是哺乳动物。在一个特别优选的实施方式中,对象是人。
本发明还提供了抑制微生物,例如细菌、病毒、真菌或寄生虫生长的方法,该方法包括将所述微生物或寄生虫与本发明的多肽或药物组合物接触。可在体内或体外进行所述接触。
本发明的多肽和药物组合物有效治疗多种微生物感染,如各种病毒、细菌和真菌感染。例如,多肽和药物组合物有效治疗革兰氏阴性和革兰氏阳性菌。可在人或动物中造成可用本发明的多肽和组合物治疗的感染的致病性细菌的示例包括,但不限于利斯特氏菌属、埃希氏菌属、衣原体属、立克次氏体属、分枝杆菌属、葡萄球菌属、链球菌属、肺炎球菌属、脑膜炎球菌属、克雷伯氏菌属、假单胞菌属、军团菌属、白喉、沙门氏菌属、杆菌属、霍乱弧菌、破伤风、梭菌属、芽孢杆菌属、耶尔森氏菌属、和钩端螺旋体属。
可在人或动物中造成可用本发明的多肽和组合物治疗的感染的致病性病毒的示例包括,但不限于甲肝、乙肝或丙肝、疱疹病毒(例如,VZV、HSV-I、HAV-6、HSV-II、CMV、EB病毒(EpsteinBarr))、腺病毒、流感病毒、黄病毒、艾柯病毒、鼻病毒、柯萨奇病毒、冠状病毒、呼吸道合胞病毒(RSV)、轮状病毒、麻疹病毒、风疹病毒、细小病毒、痘苗病毒、HTLV病毒、登革热病毒、乳头瘤病毒、脊髓灰质炎病毒、狂犬病病毒和人免疫缺陷病毒(HIV病毒;例如,I型和II型)。
可在人或动物中造成可用本发明的多肽和组合物治疗的感染的致病性真菌的示例包括,但不限于念珠菌(例如,白色念珠菌、克鲁斯念珠菌、光滑念珠菌、热带念珠菌)、曲霉(例如,烟曲霉、黑曲霉)、新型隐球菌(Cryptococcus neoformans)、夹膜组织胞浆菌(Histoplasma capsulatum)、毛霉属、皮炎芽生菌(Blastomyces dermatitidis)、巴西副球孢子(Paracoccidioides brasiliensis)、和粗球孢子菌(Coccidioides immitis)。
可在人或动物中造成可用本发明的多肽和组合物治疗的感染的致病性寄生虫的示例包括,但不限于痢疾内变形虫(Entamoeba histolytica)、疟原虫(例如,恶性疟原虫、间日疟原虫)、阿米巴虫、鞭毛虫、结肠小袋绦虫(Balantidium coli)、棘阿米巴属、隐孢子虫属、卡氏肺囊虫(Pneumocystis carinii)、果氏巴贝虫(Babesia microti)、锥虫(例如,布氏锥虫、克氏锥虫)、利什曼原虫(例如,杜氏利什曼原虫)、和弓形虫(Toxoplasma gondii)。
在优选的实施方式中,本发明的多肽和药物组合物有效治疗由甲氧西林耐药性金黄色葡萄球菌(Staphylococcus aureus)(MRSA)和(非耐药性)金黄色葡萄球菌(S.aureus)、表皮葡萄球菌(Staphylococcus epidermidis)、革兰氏阴性菌绿脓假单胞菌(Pseudomonas aeruginosa)和真菌物种白色念珠菌(Candida albicans)和黑曲霉(Aspergillus niger)引起的感染。
可给予含多肽的组合物用于预防性和/或治疗性处理。在治疗性应用中,向已患有疾病的对象(优选人)给予足够对抗感染的症状或由感染及其障碍导致的病症的量的多肽或组合物。在预防性应用中,向处于患有微生物或寄生虫感染风险的对象,例如人或动物给予足够防止感染或至少抑制感染发展的量的多肽或组合物。多肽一般以治疗性的量存在于本发明的药物组合物中,该量是足够治疗病症或疾病,尤其是与微生物或寄生虫感染相关的症状的量。给予本发明的多肽或其至少2种的组合的一般剂量是0.01至10mg多肽/kg体重,取决于多肽的大小。
本发明的多肽和药物组合物适用于广泛的应用。例如,其可用于局部应用,例如在治疗或预防皮肤感染、伤口感染和泌尿道感染中。如本文之前详述,本发明的多肽能够防止生物膜形成并且打散已有的生物膜,杀死在生物膜形成部位处或其周围的细菌、真菌或其它微生物,并通过中和促炎微生物内毒素来调节免疫反应。细菌生物膜可延迟皮肤伤口愈合并降低常规抗生素在愈合或处理受感染的皮肤伤口、皮肤感染或泌尿道感染中的局部抗菌功效。本发明因此提供用于治疗或预防皮肤感染、伤口感染和/或泌尿道感染的本发明的多肽、药物组合物和/或核酸分子。还提供本发明的多肽、药物组合物和/或核酸分子用于伤口愈合。还提供了本发明的多肽、药物组合物和/或核酸分子在制备用于治疗或预防皮肤感染、伤口感染、泌尿道感染和/或伤口愈合的药物组合物中的用途。本发明还提供了一种治疗患有皮肤感染、伤口感染和/或泌尿道感染的对象的方法,该方法包括给予所述对象治疗有效量的本发明的多肽、本发明的药物组合物或本发明的核酸分子。
本发明的多肽还优选用作易受微生物,例如细菌、病毒、真菌、寄生虫感染的物质的防腐剂。这类物质可浸渍、包被或覆盖本发明的多肽。如前详述,本发明多肽在血液、血浆和血清中以及存在组分例如血浆组分时保留抗微生物活性。因此,本发明的多肽和药物组合物特别适用于全身应用和用于治疗和/或防止移植物和医疗装置相关的感染。本文所用术语“医疗装置”是指可用于人或动物身体的任何类型的装置,并且包括但不限于医疗装置,医疗器械,假体如人工关节(包括臀部和膝盖),和牙科假体,胸植入体,可植入装置如起搏器,心脏瓣膜,支架,导管,耳管,夹板,医疗装置螺杆,和伤口或组织敷料。移植物和医疗装置常与微生物感染相关,特别是生物膜感染,而这被本发明多肽成功抑制,如实施例所示。此外,移植物和医疗装置在植入后通常被宿主流体的血浆组分快速覆盖。如实施例所示,由于本发明的多肽在存在血浆时发挥抗微生物活性,移植物和/或医疗装置的微生物感染被本发明多肽有效治疗和/或阻止。因此提供本发明多肽作为移植物和/或医疗装置的防腐剂的用途。还提供本发明多肽用于防止和/或治疗移植物和/或医疗装置的微生物感染、优选细菌感染。
本发明的多肽优选整合到控释和/或靶向递送运载体中。本文所用的术语“控释”是指以时间依赖性方式释放本发明的多肽。在一个实施方式中,控释是指缓释。本文所用的术语“靶向递送”是指以位点导向的方式释放本发明的多肽。控释载剂的使用具有以下优势,即可避免诸如通过注射本发明的多肽的频繁给药。使用靶向递送载剂具有以下优势,即本发明的多肽有效递送到和/或保留在对象身体的感兴趣部位处,如炎症部位或感染部位。优选地,本发明的多肽靶向受到微生物包括细菌、真菌、病毒和寄生虫感染的部位。控释和/或靶向递送运载体是本领域所熟知的。控释和/或靶向递送载剂的非限制性示例是纳米颗粒、微粒、纳米胶囊、微胶囊、脂质体、微球、水凝胶、聚合物、脂质复合物、血清白蛋白、抗体、环糊精和葡聚糖。例如,通过将本发明的多肽整合到这种运载体的表面中或表面上来提供控释。运载体由形成捕获本发明的多肽的颗粒并在合适的环境(如水性、酸性或碱性环境或体液)中缓慢降解或溶解,从而释放该多肽的材料组成。例如,通过提供表面上带靶向基团的运载体来实现靶向递送。这类包含靶向基团的运载体的示例是抗体官能化的运载体、具有位点特异性配体的运载体和带正或负表面电荷的运载体。用于控释和/或靶向递送的优选颗粒是纳米颗粒,即,直径范围为约1至500nm,优选至多约200nm的颗粒,和脂质体,任选地提供靶向基团。因此,本发明提供了包含本发明的多肽的控释运载体和包含这种控释运载体的药物组合物。还提供了包含本发明的多肽的靶向递送运载体,和包含这种靶向递送运载体的药物组合物。所述运载体优选自纳米颗粒、微粒、纳米胶囊、微胶囊、脂质体、微球、水凝胶、聚合物、脂质复合物、血清白蛋白、抗体、环糊精和葡聚糖。
优选的靶向递送和/或控释运载体由生物可降解材料组成。本文所用的“生物可降解”是指在生理条件下降解的分子。这包括可水解降解的分子和需要酶促降解的分子。合适的生物可降解材料包括,但不限于生物可降解的聚合物和天然的生物可降解的材料,如PLA(聚乳酸),PGA(聚乙醇酸),聚己酸内酯(PCA),聚环氧乙烷(PEO),聚二噁烷酮(PDS),聚己酸内酯(PCL),聚富马酸丙二醇酯,衍生自内酯的聚合物,如交酯、乙交酯和己内酯,碳酸酯如碳酸亚丙酯和碳酸亚丁酯,二噁烷酮,乙二醇,聚酯酰胺(PEA)环氧乙烷,酯酰胺,γ-羟基戊酸酯,β-羟基丙酸酯,α-羟基酸,羟基丁酸酯,羟基烷酸酯,聚酰亚胺碳酸酯,聚氨酯,聚酐,及其组合,多糖如透明质酸,壳聚糖和纤维素,以及蛋白质如明胶和胶原。
还提供了一种涂层,优选用于移植物和/或医疗装置,该涂层包含本发明的多肽。在一个实施方式中,这类涂层提供了本发明的多肽的控释。这类医疗装置的控释涂层优选包含生物可降解材料,使得通过降解涂层材料来实现本发明的多肽的释放。因此,还提供了包含本发明的多肽的控释涂层。还提供了包含这类涂层的医疗装置,该涂层包含本发明的多肽和生物可降解材料。还提供了包含这类涂层的移植物,该涂层包含本发明的多肽和生物可降解材料。本发明的生物可降解涂层包括上述定义的生物可降解材料。具体地,这类生物可降解涂层包含选自下组的材料:PLA(聚乳酸),PGA(聚乙醇酸),聚己酸内酯(PCA),聚环氧乙烷(PEO),聚二噁烷酮(PDS),聚己酸内酯(PCL),聚富马酸丙二醇酯,衍生自内酯的聚合物,如交酯、乙交酯和己内酯,碳酸酯如碳酸亚丙酯和碳酸亚丁酯,二噁烷酮,乙二醇,聚酯酰胺(PEA)环氧乙烷,酯酰胺,γ-羟基戊酸酯,β-羟基丙酸酯,α-羟基酸,羟基丁酸酯,羟基烷酸酯,聚酰亚胺碳酸酯,聚氨酯,聚酐,及其组合,多糖如透明质酸,壳聚糖和纤维素,以及蛋白质如明胶和胶原。此外,提供防止和/或处理移植物和/或医疗装置的微生物感染,优选细菌感染的方法,包括提供具有含本发明多肽的涂层的所述移植物和/或医疗装置并将所述移植物或医疗装置植入对象中。
多肽和药物组合物也可用作抗炎剂,由于它们中和促炎微生物内毒素如脂磷壁酸、肽聚糖和脂多糖,从而抑制、降低或防止嗜中性粒细胞、巨噬细胞/单核细胞和淋巴细胞的流入以及受感染的对象释放促炎微生物化合物。因此,还提供了一种抑制促炎化合物释放的方法,该方法包括将能够释放促炎化合物的细胞与本发明的多肽接触。可在体内或体外进行所述接触。还提供了用作抗炎剂的本发明的多肽。
虽然本发明的多肽是强效抗微生物剂,但是它们可与其它已知的抗微生物剂组合,所述抗微生物剂如常规抗感染药,如抗生素、抗病毒药和抗真菌药或其它抗微生物肽,以及抗体和化学物,例如,敏化剂、纳米颗粒。这种组合可产生增加的抗微生物活性或拓宽活性谱。本发明的多肽例如可与青霉素类、头孢菌素类、大环内酯类、氟喹诺酮类、磺酰胺类、四环素类和/或氨基糖苷类组合用于治疗细菌感染。为了治疗病毒感染,多肽可与抗病毒核苷类似物,如阿昔洛韦、更昔洛韦、齐多夫定(AZT)或地达诺新或者神经氨酸酶抑制剂,如奥塞米韦、帕拉米韦或扎那米韦组合。为了治疗真菌感染,本发明的多肽和组合物可与多烯抗真菌剂、咪唑类、三唑类、丙烯胺类、棘球白素类、环吡酮胺、氟胞嘧啶和/或灰黄霉素组合。因此,本发明提供了包含本发明的多肽和另外的抗微生物剂的药物组合物,该抗微生物剂是如抗生素或抗微生物肽,优选选自下组:青霉素类、头孢菌素类、碳青霉烯类、和莫匹罗星。
本发明的药物组合物包含至少一种药学上可接受的运载体、稀释剂或赋形剂。例如,合适的运载体的例子包括钥孔血蓝素(KLH)、血清白蛋白(如BSA或RSA)和卵清蛋白。在另一个优选的实施方式中,所述合适的运载体是溶液,如盐水。可整合到片剂、胶囊等中的赋形剂的示例如下:粘结剂如黄蓍胶、阿拉伯胶、玉米淀粉或明胶;赋形剂如微晶纤维素;崩解剂如玉米淀粉、预胶化淀粉、海藻酸等;润滑剂如硬脂酸镁;甜味剂如蔗糖、乳糖或糖精;调味剂如薄荷,冬青油,或樱桃。当剂量单位形式是胶囊时,除了上述类型的材料以外,它可包含液体运载体(如脂肪油)。可以存在各种各样的其它材料作为包衣或者来改变所述剂型的外形。例如,可用紫胶、糖或两者同时包被片剂。糖浆剂或酏剂可含有活性化合物,糖如甜味剂,用作防腐剂的对羟基苯甲酸甲酯或对羟基苯甲酸丙酯,染料和调味剂如樱桃或橙风味。本发明的药物组合物优选适合人使用。
可以多种不同的方式给予本文所述的药物组合物。示例包括通过口服、鼻内、直肠、局部、腹膜内、静脉内、肌肉内、皮下、真皮下、皮内、鞘内和颅内方法给予包含本发明的多肽并含有药学上可接受的运载体的药物组合物。对于口服给药,活性成份可以固体剂型给予,如胶囊、片剂和粉末,或以液体剂型,如酏剂、糖浆剂和悬液。
可按照常规药学实践通过在用于注射的载剂,如水或天然产生的植物油,如芝麻油、椰子油、花生油、棉籽油等,或合成脂肪载剂如油酸乙酯等中溶解或悬浮本发明的多肽来配制用于注射的无菌组合物。也可纳入缓冲剂、防腐剂、抗氧化剂等。
还可可按照常规药学实践来配制用于局部给药的组合物。本文所用的“局部给药”是指施用于身体表面,如皮肤或粘膜以局部治疗由微生物或寄生虫感染导致的病症。适用于局部给药的制剂的示例包括,但不限于乳膏、凝胶、软膏、洗液、泡沫、悬液、喷雾剂、气溶胶、粉末气溶胶。局部药物可以是经表皮的,表明它们可直接施涂于皮肤上。局部药物也可以是吸入的,例如,用于施用于呼吸道的粘膜上皮,或施用于除皮肤以外的组织的表面,如施用于结膜表面的滴眼液或置于耳中的滴耳液。所述配制用于局部给药的药物组合物包含至少一种适于局部施用的药物赋形剂,如利泄剂、稀释剂、润湿剂、防腐剂、pH调节剂和/或水。
本发明的多肽也特别适于诊断用途。多肽可用于检测微生物感染,例如,通过检测生理样品如血液、血浆、粘液、伤口渗出物和尿液中的微生物毒素,例如,细菌毒素包括LPS、LTA和PG。此外,多肽可用于测定这类样品中微生物毒素的量。因此,本文提供了用作诊断剂的本发明的多肽核酸分子。还提供了本发明的多肽在检测生理样品如血液、血浆、伤口渗出物和尿液样品中微生物毒素,优选细菌或真菌毒素中的用途。如上所述,本发明的多肽可偶联到合适的部分,如生物素、荧光素标记物、近红外染料或放射性同位素上。这类标记的多肽可用于检测微生物感染如细菌感染的方法中,因为它们会迁移到微生物感染的部位。使用适于所用的与多肽接合的标记物的检测器,可能检测感染部位。因此,本发明还提供了用于检测微生物感染,如细菌感染的方法。该方法一般包括向已感染或怀疑正感染微生物生物体的对象给予标记的多肽。因为标记的多肽能够与感染性生物体相互作用,其在感染部位处积累。为了检测生理样品中的微生物毒素,该方法包括向已感染或怀疑正感染微生物生物体的对象的生理样品给予标记的多肽。可能使用对接合多肽的标记物敏感的各种检测器来检测多肽在感染部位处或样品中的积累。
本发明的多肽的另一个有用的应用在于食品防腐。因此,还提供了本发明的多肽作为食品防腐剂的用途。一般而言,通过将食品经过60至100℃的温度的热处理来破坏致病性或腐坏微生物。这种处理可能对食品有不希望的影响,如不希望的感官作用。本发明的多肽作为食品防腐剂的用途可能导致延长的保质期和/或增强的食品安全性。
食品中的致病性微生物可引起对象感染或中毒,并且包括细菌如空肠弯曲杆菌(Campylobacter jejuni)、鼠伤寒沙门氏菌(Salmonella typhi)、副伤寒沙门氏菌(Salmonella paratyphi)和非鼠伤寒沙门氏菌(non-typhi Salmonella species)、金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、单核细胞增生利斯特氏菌(Listeria monocytogenes)、志贺氏菌(Shigella)和肉毒梭菌(Clostridium Botulinum),病毒如轮状病毒和诺瓦克病毒,寄生虫如猪肉绦虫(Taenia solium)、牛肉绦虫(Taenia saginata)和旋毛虫(Trichinella spiralis)和霉菌。食品腐坏是指食品的外观、稠度、风味和/或气味的变化,并且可能是由细菌如乳杆菌、明串珠菌、假单胞菌、微球菌、黄杆菌、沙雷氏菌、肠杆菌和链球菌,真菌如曲霉、镰刀菌和枝孢以及酵母造成的。
下面借助以下非限制性实施例更具体地解释本发明。
附图说明
图1:存在5μM卡泊芬净(Cancidas)或0.8‐6.4μM所述肽的情况下培养在PBS中的黑曲霉菌的生长曲线。值表示为相对于0小时处光密度的600nm处光密度。16小时孵育后PBS中的真菌生长的光学显微图。三次重复的代表性光学显微图。
图2:用PBS、卡泊芬净、OP‐145或所述肽孵育16小时后25%血浆中黑曲霉菌生长的光学显微图。三次重复的代表性光学显微图。
图3:不同浓度(μM)对金黄色葡萄球菌JAR060131生物膜形成的抑制。结果表示为三次独立实验的相对于未处理样品(0)±标准偏差的平均生物膜质量百分比。A,未包被孔中的生物膜形成。B,血浆包被孔中的生物膜形成。
实施例
材料和方法
抗微生物肽的合成
通过正常Fmoc-化学法来制备合成肽,其使用预加载Tentagel树脂,PyBop/NMM用于原位激活和NMP中20%哌啶用于去除Fmoc(Hiemstra HS等,Proc Natl Acad Sci USA,94,10313-10318(1997))。用6倍酰化物质进行偶联,持续60分钟。在最后去除Fmoc之后,当肽序列中存在C(三乙基硅烷)或W(乙硫醇)时,用含其他清除剂的TFA/H2O 19/1(v/v)来切割肽。通过用醚/戊烷1/1(v/v)沉淀和离心分离产物来分离肽。在约40℃下空气干燥之后,肽溶解在乙酸/水1/10(v/v)中并冻干。使用UPLC-MS(沃特斯公司(Waters)的Acquity)检验肽的纯度并且使用Maldi-Tof质谱(布鲁克公司(Bruker)的Microflex)检验完整性,显示预期的分子质量。
缩写:
Fmoc:9H-芴基甲氧羰基
NMM:N-甲基吗啉
PyBOP:苯并三唑-1-基-氧基-三-吡咯烷-六氟磷酸鏻
TFA:三氟乙酸
细菌菌株
由荷兰马斯特里赫特的马斯特里赫特大学医学中心的S.Croes博士友情提供甲氧西林耐药性金黄色葡萄球菌(Staphylococcus aureus,MRSA)的临床分离株LUH14616(参见Croes S BMC Microbiol.2009;9:229.doi:10.1186/1471-2180-9-229)。
金黄色葡萄球菌JAR描述于Campoccia等(Int J Artif Organs.2008年9月;31(9):841-7)。
表皮葡萄球菌RP62a如Infect.Immun.2008;75:1129-1136中所述。
铜绿假单胞菌(Pseudomonas aeruginosa)PAO1如Nucl.Acids Res 2011;39,增刊1:D596-D60所述。
细菌在-80℃下储存直至使用。通过将从血液琼脂板分离的细菌菌落在胰蛋白酶大豆汤(TSB)培养基(法国Le Pont de Clax的BD公司(Becton Dickinson))中孵育2.5小时,然后稀释至所需的浓度来制备对数中期细菌接种物。稳定期金黄色葡萄球菌JAR060131获自18‐20小时培养物。
测定抗细菌活性
用PBS中下述菌种的1x106CFU/ml的中对数生长期培养物孵育肽:金黄色葡萄球菌JAR060131、甲氧西林耐药性金黄色葡萄球菌(MRSA)LUH14616、表皮葡萄球菌RP62a和铜绿假单胞菌PAO1,添加或不添加汇集的人血浆(伞奎公司(Sanquin),阿姆斯特丹,荷兰)至终浓度50%。抗微生物活性表达为99.9%致死浓度(LC99.9),即37℃震荡孵育2小时后杀伤≥99.9%细菌的最低肽浓度。
为了评估肽对稳定期细菌的抗微生物活性,在上述条件下用1x106CFU/ml获自18-20小时培养物的稳定期金黄色葡萄球菌JAR060131孵育肽。
测定抗真菌活性
用白色念珠菌Y‐O1的1x105细胞/ml的中对数生长期培养物孵育肽,添加或不添加汇集的人血浆至终浓度50%。抗微生物活性表达为99%致死浓度(LC99),即37℃震荡孵育2小时后杀伤≥99%细胞的最低肽浓度。
肽对真菌生长的效果用黑曲霉评估。用PBS中的7.5x104孢子/ml黑曲霉PagsA‐lux孵育肽,添加或不添加汇集的人血浆至终浓度25%。
作为阳性对照,孢子用抗真菌卡泊芬净(Cancidas)处理。测定随时间的吸光度,并在16小时用光学显微镜观察真菌生长。
测定抗生物膜活性
如Antimicrob Agents Chemother 2012;56:2696-2704所述,在96孔聚丙烯板中的生物膜调整的BM2中用1x108CFU/ml金黄色葡萄球菌JAR060131孵育肽。37℃孵育24小时后,用PBS经四次冲洗移除浮游生物细菌,并用结晶紫染色生物膜。用乙醇增溶之后,测定590nm的光密度作为生物膜质量的量度。抗生物膜活性表达为50%抑制浓度(IC50),即导致≥50%生物膜质量降低的最低肽浓度。
为了评估存在血浆时肽的抗生物膜活性,用20%血浆通过4℃孵育过夜对96孔聚丙烯板进行血浆包被。用无菌水冲洗孔一次,并用上述金黄色葡萄球菌和肽进行接种。
免疫调节活性:LPS和LTA中和
用500ng/ml LPS(大肠杆菌O54)或2mg/ml LTA(无内毒素的金黄色葡萄球菌)或1x109CFU/ml的UV‐杀伤的金黄色葡萄球菌JAR060131于37℃预孵育肽30分钟。37℃用肽-LPS/LTA/金黄色葡萄球菌混合物刺激稀释的人全血进行20小时。用ELISA测定上清中的IL‐12p40和IL‐8水平。LPS和LTA中和活性表示为50%或90%抑制浓度(IC50和IC90),即导致LPS/LTA/金黄色葡萄球菌‐诱导的IL‐12p40或IL‐8生产下降≥50或≥90%的最低肽浓度。
结果
鉴定源自OP-145的25个肽
抗微生物并且相对OP-145而言对血浆组分易感性下降的新型肽基于计算机预测进行鉴定。
预测OP-145采取两亲性螺旋结构。在该结构中,所述肽折叠为α-螺旋,其在螺旋一侧含有带电荷基团,在另一侧含有疏水基团。从应用具有氨基酸取代的肽的前述研究可知,引入在螺旋的疏水侧结束的带电荷基团,或引入在螺旋的带电荷侧结束的疏水基团,产生具有降低的抗细菌活性的化合物。
因此我们决定新设计的肽需要预测为以两亲性螺旋折叠。基于OP-145的序列,我们针对氨基酸取代设计了如下基序。我们关注的取代所产生的肽与OP-145具有重要区别,使得OP-145的结构相似性最小,并且使最小化结合血浆组分(影响抗微生物活性)的机会最大。
计算机预测显示下述基序会得到具有两亲性螺旋的肽。
下述25个肽基于所述基序进行选择(J=乙酰基,B=酰胺)。
表1.肽P139-163的序列。J=乙酰基,B=酰胺
存在或不存在血浆的情况下测试这些肽的抗细菌活性(表2)。
基于所获结果,P145、P148和P159选择作为比OP-145显著改善的肽。
表2.源自OP-145的肽的抗微生物活性。1抗微生物活性表示为IC99.9(μM),即2小时内杀伤99.9%细菌接种物(约1x106CFU/ml的金黄色葡萄球菌JAR)的最低肽浓度。
P145,P148和P159针对不同细菌的抗微生物活性
在PBS中,P145、P148和P159与OP‐145一样针对中对数期培养物的所有细菌物种具有相似的抗微生物活性(表3)。存在50%血浆时,P145、P148和P159相对OP‐145显示出针对下述菌种的更高的杀菌活性:金黄色葡萄球菌JAR060131(11‐16‐倍)、MRSA LUH14616(21‐26‐倍)、表皮葡萄球菌RP62a(43‐倍)和铜绿假单胞菌PAO1(>11‐21‐倍)。
表3.中对数期培养物在PBS和50%血浆中的OP‐145、P145、P148和P159的抗微生物活性。结果表示为LC99.9,即导致≥99.9%细菌杀伤的最低肽浓度(μM)。结果是至少两次独立实验的中值。
OP‐145、P145、P148和P159显示针对稳定期金黄色葡萄球菌JAR060131的相比对数期细菌的相似的抗微生物活性(表4)。因此,存在50%血浆时,P145、P148和P159显示出针对金黄色葡萄球菌JAR060131而言比OP‐145更高的杀菌活性。
表4.PBS和50%血浆中的OP‐145、P145、P148和P159针对金黄色葡萄球菌JAR060131的稳定期上清的抗微生物活性。结果是三次独立实验的均值。
P148的长度变体的抗微生物活性
P148的C末端和N末端缺失4个氨基酸对针对金黄色葡萄球菌JAR060131的抗微生物活性没有影响(表5)。C末端和N末端缺失5个氨基酸相比P148降低了抗微生物活性,但是相对OP-145仍增加了5倍活性。
表5.PBS和50%血浆中P148的长度变体的抗微生物活性。结果表示为LC99.9,即导致≥99.9%金黄色葡萄球菌杀伤的最低肽浓度(μM)。结果是两次独立实验的均值。J=乙酰基,B=酰胺
具有多丙氨酸取代的P145、P148和P159的抗微生物活性
P145、P148和P159的一个氨基酸和P148的两个氨基酸取代为丙氨酸对其针对金黄色葡萄球菌JAR060131的抗微生物活性没有影响(表6-9)。
表6.在不同位置具有丙氨酸取代的P145在PBS和50%血浆中的抗微生物活性。两次独立实验的结果。J=乙酰基,B=酰胺
表7.在不同位置具有丙氨酸取代的P148在PBS和50%血浆中的抗微生物活性。两次独立实验的结果。J=乙酰基,B=酰胺
表8.在不同位置具有丙氨酸取代的P159在PBS和50%血浆中的抗微生物活性。两次独立实验的结果。J=乙酰基,B=酰胺
表9.具有多丙氨酸取代的P148在PBS和50%血浆中的抗微生物活性。结果是两次独立实验的均值。J=乙酰基,B=酰胺
具有带正电氨基酸取代的P148变体的抗微生物活性
其中赖氨酸或精氨酸已被带正电氨基酸取代的P148变体在PBS中和50%血浆中都保留针对金黄色葡萄球菌的抗微生物活性(表10)。
表10.具有带正电氨基酸取代的P148在PBS和50%血浆中的抗微生物活性。J=乙酰基,O=鸟氨酸;X=二氨基丁酸(DABA);U=二氨基丙酸(DAPA),B=酰胺。
P145、P148和P159的抗真菌活性
PBS中51.2μM的OP‐145对白色念珠菌Y‐O1没有抗真菌活性(表11)。P145、P148和P159杀伤99%白色念珠菌的浓度范围为12.8μM(对于P159)-38.4μM(对于P148)。在50%血浆中,P145、P148和P159的抗真菌活性为204.8μM。该浓度下,未观察到OP‐145的抗真菌活性。
表11.OP-145、P145、P148和P159在PBS和50%血浆中的抗真菌活性。结果是两次独立实验的均值。
OP‐145在3.2μM浓度时抑制>99.9%的黑曲霉生长(图1)。P145显示与OP‐145相似的抗真菌活性,而P148具有高4倍的抗真菌活性,0.8μM时已抑制真菌生长。相比OP‐145,P159的抗真菌活性低2倍。由于血浆影响光密度值,仅基于光学显微镜评估存在血浆时肽的抗真菌活性。存在25%血浆时,204.8μM的OP‐145抑制真菌生长(图2)。P145、P148和P159在102.4μM时抑制生长。
P145、P148和P159的抗生物膜活性
3.2μM的OP‐145显示对生物膜形成≥50%的抑制(图3A)。P145的IC50值为6.4μM,对P148和P159来说为12.8μM。最大生物膜抑制为约75%。值得注意的是,在生物膜调整的BM2培养基中,这些肽在多至51.2μM仍不显示抗微生物活性。在血浆包被的孔中,3.2μM的OP‐145和P159抑制50%的生物膜形成,而对P145和P148来说,抑制50%的生物膜形成需要2倍高的浓度(图3B)。存在血浆时的最大生物膜抑制范围为61%(对于P148)-82%(对于P159)。
免疫调节活性:P145、P148和P159的LPS和LTA中和
OP‐145的IC50和IC90分别为0.15nM和1.25nM。0.03nM时P148已经抑制>50%的LPS-诱导的IL‐12p40生产,P159为0.05nM时。P148和P159在0.25nM时达到对LPS-诱导的IL‐12p40的90%抑制,P145在0.75nM时达到(表11)。肽中和LTA的能力通过测量血细胞对LTA‐诱导的IL‐8生产的抑制来评估。在终浓度为0.781μM时,OP‐145抑制>50%的IL‐8生产(5μg/ml LTA诱导)(表11)。P145、P148和P159的LTA‐中和能力增加4倍。肽还用UV‐杀伤的金黄色葡萄球菌JAR060131进行预孵育。用0.195μM OP‐145孵育使得由金黄色葡萄球菌JAR诱导的IL‐8的产生下降>50%(表12)。P159与OP-145具有相似的中和活性,而使金黄色葡萄球菌诱导的IL‐8的产生抑制>50%则需要8倍高的P145和P148浓度。
表12.OP‐145、P145、P148和P159的LPS、LTA和金黄色葡萄球菌中和活性。对于LPS中和来说,用来自两个供体的血液进行实验。对于LTA和金黄色葡萄球菌中和而言,用来自一个供体的血液进行实验。
- 还没有人留言评论。精彩留言会获得点赞!