一种青蒿酸衍生物及其制备方法和用途与流程
本发明涉及医药技术领域,涉及一种青蒿酸衍生物,利用青霉制备该青蒿酸衍生物的方法,以及该青蒿酸衍生物在制备用于预防和/或治疗与一氧化氮信号传导有关的炎症的药物中的用途。
背景技术:
炎症反应是机体重要的防御反应,不仅可以稀释毒素、运走有害物质、减轻损害,而且可以带来抗体等杀菌物质和营养物质。然而,炎症反应也存在潜在的危害,可能导致某些疾病的发生,例如严重的超敏反应会威胁病人生命,脑部炎症会压迫神经中枢,声带炎症会阻塞咽喉并导致窒息。另外,慢性炎症则可能导致癌症、糖尿病、心血管系统和神经系统疾病,对机体产生严重危害,甚至威胁患者生命。因此,需要使用抗炎药物来抑制炎症反应。
目前,从使用量的角度上讲,抗炎药物已成为仅次于抗感染药物的第二大类药物,临床上使用的抗炎药物大多为非甾体抗炎药和肾上腺皮质激素类药物,长期使用会带来许多不良反应。随着中药的不断开发和深入研究,人们发现中药具有抗炎作用良好并且副作用小的特点。因此,从天然产物中寻找药效化合物或者先导化合物,并对其进行结构修饰而获得相应的衍生物,从而得到高效低毒的潜在药物具有重要价值,研究其抗炎机理及结构改造,已成为抗炎药物的研发热点。
一氧化氮(NO)是由氧分子和L-精氨酸在一氧化氮合成酶(NOS)的催化下经多步氧化还原反应生成的一种气体信号分子,其参与调节机体的许多生理或病理过程,如血管舒张、局部缺血再灌损伤、慢性或急性炎症反应等。研究表明,通过白介素-1b、肿瘤坏死因子和脂多糖等细胞因子的刺激,巨噬细胞、上皮细胞等细胞可以激活诱导型一氧化氮合成酶的表达,从而产生过量的NO。另有研究表明,过量的NO与感染、炎症和自身免疫过程有关,可以介导炎症、休克、哮喘等疾病的发生。因此,抑制过量NO的产生是一种有效的抗炎手段,NO已经成为炎症研究中最重要的药物靶点之一。
青蒿为菊科植物黄花蒿(Artemisia annua L.)的干燥地上部分,是我国传统使用的一味中草药。从黄花蒿中提取的青蒿素(Artemisinin)是现今最好的抗疟药物,具有活性好、无明显毒副作用等特点,是我国唯一被世界卫生组织(WHO)认可的按照西药标准研究开发的中药。随着研究及应用的深入,人们发现青蒿素及其衍生物在许多方面具有应用价值,导致青蒿素类衍生物的市场需求量逐年增加。而青蒿素在黄花蒿中的含量较低(仅占干重的0.01%~1%),这就需要大量采收黄花蒿来提取青蒿素,以缓解青蒿素供应短缺的现状。然而,黄花蒿中含有丰富的青蒿酸(其含量为青蒿素含量的8~10倍,并且在抗疟疾、抗菌、解热、抗肿瘤等许多方面具有药理活性),其在青蒿素的提取过程中被丢弃,造成严重的资源浪费。因此,发掘青蒿酸类化合物的生理活性、拓宽黄花蒿的利用价值具有重要的现实意义。
技术实现要素:
针对上述情况,本发明提供了一种青蒿酸衍生物,该青蒿酸衍生物可以利用简便易得的青霉属真菌(Penicillium sp.)对青蒿酸进行结构修饰而制得,具有较强的抗炎活性并且没有毒性。
具体而言,本发明采用如下技术方案:
一种青蒿酸衍生物,其结构如式(I)所示:
其中:X为-(CHOH)-、-CH2-或-(C=O)-,R为-CH3、-COOH或-CH2OH,并且当X为-CH2-时,R不为-CH3。
优选的,在上述青蒿酸衍生物中,当X为-(CHOH)-时,R为-CH3。
优选的,在上述青蒿酸衍生物中,当X为-CH2-时,R为-COOH。
优选的,在上述青蒿酸衍生物中,当X为-(C=O)-时,R为-CH2OH。
一种如式(I)所示的青蒿酸衍生物的制备方法,其包括如下步骤:
(1)液体培养基的配制:向1L水中加入10~30 g蔗糖、2~7 g蛋白胨、2~4 g氯化钠、2~4 g磷酸二氢钠、3~5 g硝酸钠、2~5 g硫酸镁、2~6 g氯化钾、0.2~2 g硫酸亚铁和0.2~2 g 硫酸锰,调节pH值至3~7,得到液体培养基;
(2)微生物发酵液的配制:按照0.2~1.0 cm2青霉:50 mL培养基的比例,将从固体培养基中取出的青霉接种至步骤(1)中获得的液体培养基中,置于摇床中,在温度为26~32℃,转速为140~220 rpm的条件下培养0.5~4天,得到微生物发酵液;
(3)青蒿酸的微生物转化:将青蒿酸配制成5 mg/mL的丙酮溶液,按照青蒿酸丙酮溶液:微生物发酵液=1:5~200的体积比,加入到步骤(2)中获得的微生物发酵液中,在温度为26~32℃,转速为140~220 rpm的条件下培养2~20天,得到青蒿酸衍生物培养液;培养结束后,将青蒿酸衍生物培养液过滤并收集滤液,采用乙酸乙酯萃取3~5次,合并萃取液并回收乙酸乙酯,获得粗浸膏;
(4)产物的分离及纯化:将步骤(3)中得到的粗浸膏依次通过ODS色谱柱和制备型色谱柱进行分离,得到青蒿酸衍生物。
优选的,在上述制备方法中,步骤(1)中所述水为蒸馏水。
优选的,在上述制备方法中,步骤(1)中所述pH值通过氢氧化钾、氢氧化钠、盐酸中的任意一种来调节。
优选的,在上述制备方法中,步骤(2)中所述青霉分离于植物体内或土壤中。
优选的,在上述制备方法中,步骤(2)中在温度为28℃,转速为150 rpm的条件下培养2天,得到所述微生物发酵液。
优选的,在上述制备方法中,步骤(3)中在温度为28℃,转速为150 rpm的条件下培养14天,得到所述青蒿酸衍生物培养液。
优选的,在上述制备方法中,步骤(3)中所述萃取采用等体积的乙酸乙酯来完成。
优选的,在上述制备方法中,步骤(4)中所述ODS色谱柱利用甲醇-水系统进行梯度洗脱,收集甲醇体积百分比为70~80%的洗出液进行后续纯化;所述制备型色谱柱利用甲醇-甲酸水溶液系统或乙腈-甲酸水溶液系统进行洗脱,所述甲酸水溶液中甲酸的体积百分比为0.05%;更优选的,所述甲醇-甲酸水溶液系统中甲醇与甲酸水溶液的体积比为45:55,所述乙腈-甲酸水溶液系统中乙腈与甲酸水溶液的体积比为45:55或35:65。
如式(I)所示的青蒿酸衍生物在制备用于预防和/或治疗与一氧化氮信号传导有关的炎症的药物中的用途。
与现有技术相比,采用上述技术方案的本发明具有如下优点:
(1)提供了一种结构新颖的青蒿酸衍生物,具有无毒、抗炎活性好等特点;
(2)提供了一种采用微生物转化方法来制备青蒿酸衍生物的方法,方法简便易行;
(3)运用体外抗炎活性筛选体系对青蒿酸及其衍生物进行活性评价,发现青蒿酸对正常细胞无毒且无抗炎活性,但经过结构修饰后的本发明的青蒿酸衍生物不仅保留了无毒的特性,而且能够有效地抑制NO的释放,表明本发明的青蒿酸衍生物具有预防和/或治疗与NO的信号传导有关的炎症的作用,具有良好的研究及开发前景。
附图说明
图1为青蒿酸衍生物的细胞毒性结果示意图。
图2为青蒿酸衍生物的抗炎活性评价结果示意图。
具体实施方式
下面将结合附图和具体实施例来进一步描述本发明的技术方案。除非另有特殊说明,下列实施例中所使用的试剂、材料、仪器等均可通过商业手段获得。
实施例1:青蒿酸衍生物的制备。
(1)液体培养基的配制:向蒸馏水中加入试剂至下列浓度:蔗糖30 g/L、蛋白胨5 g/L、NaCl 3 g/L、NaH2PO4 3 g/L、NaNO3 3 g/L、MgSO4 3.4 g/L、KCl 4.1 g/L、FeSO4 1 g/L和MnSO4 1 g/L,采用NaOH调节pH值至5.5,得到液体培养基;
(2)微生物发酵液的配制:将分离于黄花蒿健康植物体内的青霉从固体培养基中取出,并按照1.0 cm2/50 mL的比例接种至步骤(1)中获得的液体培养基中,置于摇床中,在温度为28℃、转速为150 rpm的条件下培养2天,得到微生物发酵液;
(3)青蒿酸的微生物转化:将青蒿酸配制成5 mg/mL的丙酮溶液,按照1 mL青蒿酸丙酮溶液/5 mL微生物发酵液的比例,加入到步骤(2)中获得的微生物发酵液中,在温度为28℃、转速为150 rpm的条件下培养14天,得到青蒿酸衍生物培养液;培养结束后,将青蒿酸衍生物培养液过滤并收集滤液,采用等体积乙酸乙酯萃取3次,合并萃取液并浓缩至干,得到粗浸膏;
(4)产物的分离纯化:将步骤(3)中获得的粗浸膏通过ODS色谱柱进行分离,利用甲醇-水系统进行梯度洗脱,收集甲醇体积百分比为70~80%的洗出液,减压浓缩至干,得浸膏;然后将所得浸膏用少量乙醇溶解,通过制备型色谱柱进行分离,利用乙腈:0.05%甲酸水溶液=45:55(v/v)系统进行洗脱,得到化合物1、化合物2和化合物3,所得化合物的结构式及13C-NMR信号峰的归属情况如表1所示。
实施例2:青蒿酸衍生物的制备。
(1)液体培养基的配制:向蒸馏水中加入试剂至下列浓度:蔗糖10 g/L、蛋白胨7 g/L、NaCl 4 g/L、NaH2PO4 2 g/L、NaNO3 4 g/L、MgSO4 2 g/L、KCl 6 g/L、FeSO4 0.2 g/L和MnSO4 2 g/L,采用KOH调节pH值至7,得到液体培养基;
(2)微生物发酵液的配制:将分离于腐烂橘子表面的青霉从固体培养基中取出,并按照0.5 cm2/50 mL的比例接种至步骤(1)中获得的液体培养基中,置于摇床中,在温度为26℃、转速为140 rpm的条件下培养4天,得到微生物发酵液;
(3)青蒿酸的微生物转化:将青蒿酸配制成5 mg/mL的丙酮溶液,按照1 mL青蒿酸丙酮溶液/200 mL微生物发酵液的比例,加入到步骤(2)中获得的微生物发酵液中,在温度为26℃、转速为140 rpm的条件下培养20天,得到青蒿酸衍生物培养液;培养结束后,将青蒿酸衍生物培养液过滤并收集滤液,采用等体积乙酸乙酯萃取4次,合并萃取液并浓缩至干,得到粗浸膏;
(4)产物的分离纯化:将步骤(3)中获得的粗浸膏通过ODS色谱柱进行分离,利用甲醇-水系统进行梯度洗脱,收集甲醇体积百分比为70~80%的洗出液,减压浓缩至干,得浸膏;然后将所得浸膏用少量乙醇溶解,通过制备型色谱柱进行分离,利用乙腈:0.05%甲酸水溶液=35:65(v/v)系统进行洗脱,得到化合物1、化合物2和化合物3。
实施例3:青蒿酸衍生物的制备。
(1)液体培养基的配制:向蒸馏水中加入试剂至下列浓度:蔗糖20 g/L、蛋白胨2 g/L、NaCl 2 g/L、NaH2PO4 4 g/L、NaNO3 5 g/L、MgSO4 5 g/L、KCl 2 g/L、FeSO4 2 g/L和MnSO4 0.2 g/L,采用HCl调节pH值至3,得到液体培养基;
(2)微生物发酵液的配制:将分离于腐植土中的青霉从固体培养基中取出,并按照0.2 cm2/50 mL的比例接种至步骤(1)中获得的液体培养基中,置于摇床中,在温度为32℃、转速为220 rpm的条件下培养0.5天,得到微生物发酵液;
(3)青蒿酸的微生物转化:将青蒿酸配制成5 mg/mL的丙酮溶液,按照1 mL青蒿酸丙酮溶液/100 mL微生物发酵液的比例,加入到步骤(2)中获得的微生物发酵液中,在温度为32℃、转速为220 rpm的条件下培养2天,得到青蒿酸衍生物培养液;培养结束后,将青蒿酸衍生物培养液过滤并收集滤液,采用等体积乙酸乙酯萃取5次,合并萃取液并浓缩至干,得到粗浸膏;
(4)产物的分离纯化:将步骤(3)中获得的粗浸膏通过ODS色谱柱进行分离,利用甲醇-水系统进行梯度洗脱,收集甲醇体积百分比为70~80%的洗出液,减压浓缩至干,得浸膏;然后将所得浸膏用少量乙醇溶解,通过制备型色谱柱进行分离,利用甲醇:0.05%甲酸水溶液=45:55(v/v)系统进行洗脱,得到化合物1、化合物2和化合物3。
实施例4:MTT法测定青蒿酸衍生物的细胞毒性。
取生长状态良好的RAW264.7细胞,消化后加入10% FBS的DMEM高糖培养基制成细胞悬液,并将细胞浓度稀释至4×104个/mL,每孔200闪接种到96孔培养板,置于37℃,5% CO2的孵箱中培养过夜,然后加入不同浓度(1.25、2.5、5、10 μM)的青蒿酸及其衍生物,同时设置溶剂对照组(0.1% DMSO)和空白对照组,每组设置6个复孔,在37℃,5% CO2的条件下继续培养24 h,然后加入20 μL MTT(5 mg/mL)继续培养4 h,洗掉培养基,加入DMSO 100 μL/孔,振荡10 min,在570 nm波长下用酶标仪测定吸光度值,其结果如图1所示。
由图1中的MTT实验结果可知,采用4种浓度(1.25、2.5、5、10 μM)的药物干预细胞24 h后,对细胞生长没有显著影响,说明本发明所用的底物——青蒿酸及其衍生物对正常RAW264.7细胞均无毒性作用,从而证明所得产物具有低毒的特性。
实施例5:青蒿酸衍生物的活性评价。
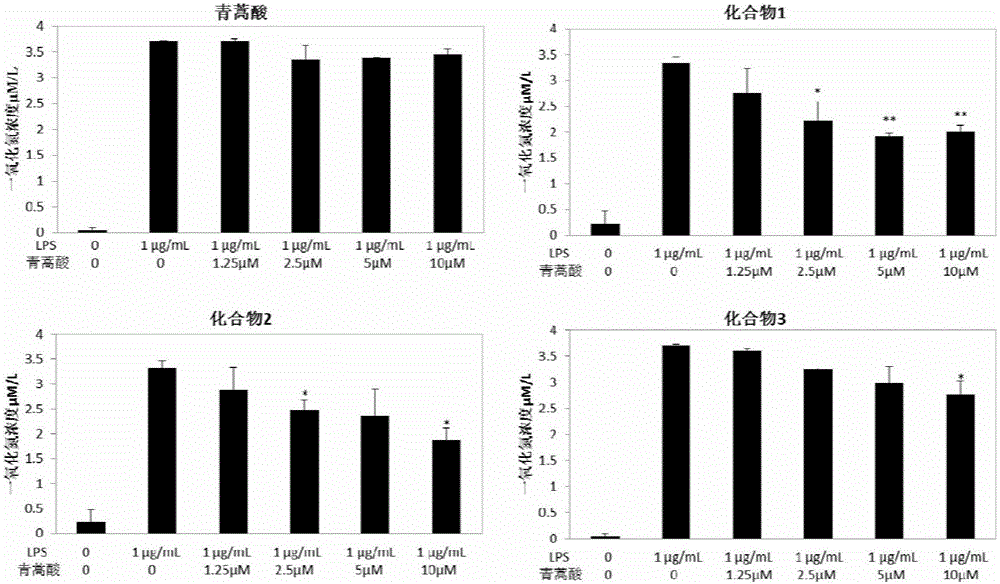
取生长状态良好的RAW264.7细胞,消化后加入10% FBS的DMEM高糖培养基制成细胞悬液,并将细胞浓度调整至5×105个/mL,每孔1 mL细胞悬液接种到24孔培养板中,然后置于37℃,5% CO2的孵箱中培养过夜,待细胞贴壁后,加入不同浓度的青蒿酸及其衍生物(10、5、2.5、1.25 μM),1 h后用LPS(1 μg/mL)培养24h,用Griess方法检测NO的含量,其结果如图2所示。
Griess法测定NO含量的过程如下:
(1)按照50 μL/孔的标准,在96孔板中加入标准品及各组样品,标准品用10% FBS的DMEM高糖培养基稀释2倍,稀释后标准品的浓度为0、1.25、2.5、5、10、20、40、80μM;
(2)按照50 μL /孔的标准,在各孔中按顺序加入Griess Reagent I和Griess Reagent II;
(3)利用多功能酶标仪于540 nm波长处测定每孔的吸光度(OD值),并计算出NO的含量。
由图2可知,通过对LPS刺激RAW264.7细胞培养液中的NO水平进行检测,发现本发明所用的底物——青蒿酸对NO的产生无抑制作用,而经微生物转化后所生成的产物均能抑制LPS刺激的RAW264.7细胞分泌NO,且呈现剂量依赖性;其中,化合物1的抑制作用最强,其在2.5~5 μM的剂量下就可显著抑制NO的产生;相比之下,化合物3的抑制细胞分泌NO作用稍弱,但在10 μM的剂量下仍有显著的NO抑制作用。由此可知,通过本发明的方法可将原本无抗炎活性的青蒿酸转化为具有较好的抗炎活性的衍生物。
- 还没有人留言评论。精彩留言会获得点赞!