秦川牛microRNA‑320a‑1基因单核苷酸多态性的检测方法及其应用与流程
本发明属于生物
技术领域:
,涉及基因单核苷酸多态性(SNP)的检测,特别涉及一种检测秦川牛microRNA-320a-1基因单核苷酸多态性的方法。
背景技术:
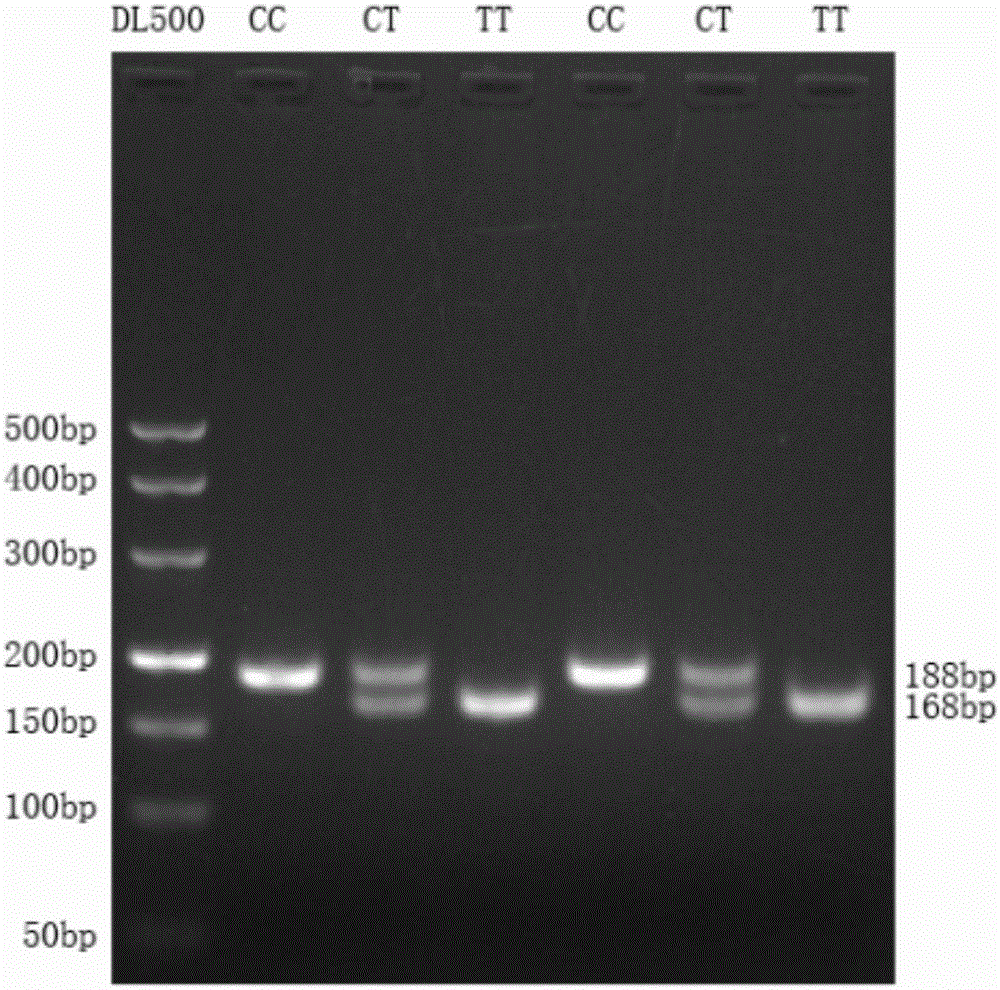
:单核苷酸多态性(SingleNucleotidePolymorphism,SNP)是生物基因组DNA序列中由于单个核苷酸(A/T/C/G)的替换而引起的变异。研究表明,基因组DNA序列发生单核苷酸替换,会造成DNA序列的改变或编码蛋白质的氨基酸发生改变,从而使不同基因型的生物体表现出不同的性状。MicroRNAs是生物基因组DNA转录产生的一类长约22nt的非编码RNA,研究表明,microRNAs发挥作用的方式是与下游靶基因的mRNA碱基互补配对,使该mRNA降解或翻译受到抑制,从而影响生物体的性状。目前,对microRNA-320a基因的研究多集中在人类,主要包括该基因与癌细胞的转移和侵染等相关研究,未见microRNA-320a基因在黄牛上的遗传变异研究。黄牛microRNA-320a基因包括2个亚型,分别是microRNA-320a-1和microRNA-320a-2,这两个亚型发挥作用的途径相同。目前黄牛microRNA-320a-1基因遗传变异领域的研究匮乏,该基因多态位点的功能研究及其遗传变异与生长发育性状(如:体重、体高、体长、胸宽、胸深和胸围等性状)关联研究仍是空白。技术实现要素:本发明的目的在于提供一种秦川牛microRNA-320a-1基因单核苷酸多态性的检测方法及其应用,加快具有优质经济性状秦川牛种群的建立。为达到上述目的,本发明采用了以下技术方案:以包含microRNA-320a-1基因的待测秦川牛全基因组DNA为模板,以引物对P2为引物,PCR扩增秦川牛microRNA-320a-1基因片段;用限制性内切酶PvuII消化PCR扩增产物之后,再对酶切后的扩增片段进行琼脂糖凝胶电泳;根据琼脂糖凝胶电泳结果鉴定秦川牛microRNA-320a-1基因(rs518926539:C>T)位点的单核苷酸多态性;所述的引物对P2为:上游引物:AACTCCCACGTTGCGTCCAGC21nt;下游引物:GCTCCCCTCCGCCTTCTCTT20nt。所述的PCR扩增反应程序为:94℃预变性2min;94℃变性30s,63℃退火30s,72℃延伸15s,30~36个循环;72℃延伸5min。所述的琼脂糖凝胶电泳为质量浓度为3%的琼脂糖凝胶电泳。所述的琼脂糖凝胶电泳结果鉴定秦川牛microRNA-320a-1基因(rs518926539:C>T)位点的单核苷酸多态性为:CC基因型表现为188bp条带;CT基因型表现为188bp、168bp和20bp条带;TT基因型表现为168bp和20bp条带;其中,TT基因型为突变纯合基因型。本发明具有以下有益的技术效果:本发明提供的秦川牛microRNA-320a-1基因单核苷酸多态性检测方法,针对(rs518926539:C>T)位点由C突变为T的突变,通过在设计的上游引物的3’端引入碱基错配,构造出被限制性内切酶PvuII所识别的切割位点。当没有突变发生时,PCR扩增microRNA-320a-1基因后在错配位置附近无法形成限制性内切酶PvuII识别位点;当由C突变为T时,PCR扩增microRNA-320a-1基因后可形成PvuII识别位点。通过琼脂糖凝胶电泳可以准确、快速的检测microRNA-320a-1基因单核苷酸多态性:CC基因型表现为188bp条带;CT基因型表现为188bp、168bp和20bp条带;TT基因型表现为168bp和20bp条带。可以对秦川牛群体的microRNA-320a-1基因(rs518926539:C>T)位点的等位基因和基因型频率的变化进行监控。同时,由于秦川牛microRNA-320a-1基因(rs518926539:C>T)位点的多态性与秦川牛体重、体长、十字部高等生长性状相互关联,本发明提供的检测方法为利用microRNA-320a-1基因SNP与生长性状的关系进行秦川牛肉用生长性状的标记辅助选择(MAS)奠定了基础,可快速建立遗传资源优良的秦川牛种群。附图说明图1为分型引物(引物对P2)设计思路示意图;图2为错配引入PvuII酶切位点PCR产物酶切后鉴定秦川牛microRNA-320a-1基因(rs518926539:C>T)位点处单核苷酸多态性的电泳检测结果;其中DL500为Marker所在列。图3为秦川牛microRNA-320a-1基因(rs518926539:C>T)位点处SNP的不同基因型(CC、CT、TT)测序图。具体实施方式下面结合附图和实施例对本发明做进一步的详细说明,所述是对本发明的解释而不是限定。本发明通过对秦川牛microRNA-320a-1基因(rs518926539:C>T)位点的单核苷酸多态性进行检测,以便用于中国秦川牛肉用生长性状的标记辅助选择,快速建立遗传资源优良的秦川牛种群。1、秦川牛microRNA-320a-1基因含(rs518926539:C>T)突变的PCR引物的设计以NCBI所公布的海福特牛(GCF_000003055.6)序列为参考,利用Primer5.0设计能够扩增包含秦川牛microRNA-320a-1基因及其上下游各200bp的PCR引物对P1,其引物序列如下:上游引物F1(SEQ.ID.NO.1):CCGAGCCCAGCCTAGAGC18nt;下游引物R1(SEQ.ID.NO.2):CGCACCCCTTCGCACCCA18nt;以上述引物对秦川牛基因组扩增,能够扩增秦川牛microRNA-320a-1基因的488bp片段,其中包含突变碱基的序列部分。由于在此SNP位点处无自然酶切位点,不能通过直接酶切检测,而如果人工设计PCR引物错配,将CAGA(如图1下划线所示序列)错配为CAGC,在没有突变发生时,PCR扩增microRNA-320a-1基因后在错配位置附近无法形成限制性内切酶PvuII识别位点而由C突变为T时,PCR扩增microRNA-320a-1基因后可形成PvuII识别位点这样就可以对该位点SNP多态性进行检测。所设计PCR扩增引物对P2为:上游引物F2(SEQ.ID.NO.3):TTCTCCCACGTTGCGTCCAGC21nt;下游引物R2(SEQ.ID.NO.4):GCTCCCCTCCGCCTTCTCTT20nt。其中,上游引物第21bp的A被错配成C;引物对P2扩增的基因片段在引物对P1扩增的基因片段内部,大小是188bp,酶切分型后的电泳检测如图2所示。2、以引物对P2PCR扩增待测秦川牛的microRNA-320a-1基因片段(1)秦川牛样本采集及基因组DNA提取1)秦川牛样本的采集本发明具体以中国优良秦川牛品种的种群作为检测对象,具体采集样本见表1:陕西秦川牛(N=227),采集时间2014年6月;表1.秦川牛样本的采集2)血样基因组DNA的分离、提取a)冷冻血样(主要为血细胞)室温解冻,转移500μL至1.5mLEppendorf离心管,加入等体积PBS液,充分混匀,12000r/min离心10min(4℃),弃去上清液,重复上述步骤至上清液透明、沉淀呈淡黄色;b)在离心管中加入DNA抽提缓冲液500μL,摇动,使血细胞沉淀脱离离心管管壁,37℃水浴1h;c)加入10μL蛋白酶K(20mg/mL)并混匀,55℃过夜至澄清。d)将反应液冷却至室温,加Tris-饱和酚500μL,温和摇动离心管20min,使其充分混匀;4℃,12000r/min离心10min,将上清液转入另一1.5mL离心管中,重复一次;e)加氯仿500μL,充分混匀20min,4℃,12000r/min离心10min,将上清液转入另一1.5mL离心管中;f)加氯仿、异戊醇混合液(24:1)500μL,充分混匀20min,4℃,12000r/min离心10min,将上清液转入另一1.5mL离心管中;g)加0.1倍体积的NaAc缓冲液及2倍体积的冰冷的无水乙醇,颠倒混匀,直至白色的絮状沉淀析出,-20℃保存30~60min;h)4℃,12000r/min离心10min,弃去上清液,用70%冰冷乙醇漂洗DNA沉淀2次;i)4℃,12000r/min离心10min,弃上清液,室温下使乙醇挥发干净;j)干燥后的DNA溶于80~100μL的TE液,4℃保存直至DNA完全溶解,0.8%琼脂糖凝胶电泳检测其质量,-80℃保存。(2)PCR扩增PCR反应体系采用混合加样法,即根据每一个反应体系所需的各种组分的数量和1次反应所需的PCR反应的个数,算出各种反应组分的总量,加入到1个1.5mL或者2.0mL离心管中,充分混匀后瞬时离心,再分装到每个200μLEppendorfPCR管中,然后加入模板DNA,再瞬时离心后进行PCR扩增;PCR反应体系见表2:表2.PCR反应体系2×TaqPCRMasterMix12.5μL上游引物F2(10pmol/L)0.5μL下游引物R2(10pmol/L)0.5μLDNA模板(50ng/μL)1.0μLddH2O补足25μLPCR反应程序:3、PvuII酶切消化PCR扩增的microRNA-320a-1基因片段(1)PvuII酶切反应消化体系(20μL):17μLPCR产物,10×Mbuffer2μL,PvuII(15U/μL)为1μL;(2)酶切消化条件:37℃恒温培养箱中消化过夜。4、PvuII消化PCR产物后琼脂糖凝胶电泳分析(1)琼脂糖凝胶电泳制作3%的琼脂糖凝胶,120V电压电泳50min,EB染色;(2)待分子量不同的DNA片段分离清晰时,在BIO-RADGelDoc2000凝胶成像系统成像;(3)根据琼脂糖凝胶电泳结果分析SNP多态性:用BIO-RADGelDoc2000凝胶成像系统照相分析,判断SNP的多态性:microRNA-320a-1基因(rs518926539:C>T)位点发生由C到T的突变时,由于引入了碱基错配,PCR扩增microRNA-320a-1基因产物的序列为形成了限制性内切酶PvuII(CAG^CTG)的酶切位点;当没有发生突变时时,PCR扩增microRNA-320a-1基因产物的序列为限制性内切酶PvuII不能识别,这样就可以对该位点SNP多态性进行检测。秦川牛microRNA-320a-1基因(rs518926539:C>T)位点多态性的琼脂糖凝胶电泳结果为:CC基因型表现为188bp条带,CT基因型表现为188bp、168bp、20bp条带,TT基因型表现为168bp和20bp条带。由于20bp较小,故在琼脂糖电泳分析中不易观察到,但通过188bp和168bp条带还是能够准确的鉴别CC基因型、CT基因型和TT基因型。如图2,不包含168bp条带为CC基因型个体,不包含188bp条带为TT基因型个体,同时包含188bp和168bp条带为CT基因型个体。5、不同基因型个体PCR产物的测序验证利用ABI3730测序仪对不同基因型个体PCR产物分别进行正反双向测序;同时,进行SNP位置分析,结果见图3。包含188bp和168bp条带的杂合子CT基因型个体的测序结果的确为C或T,而CC基因型、TT基因型分别为C、T。6、秦川牛种群microRNA-320a-1基因SNP位点的频率统计分析(1)基因型频率基因型频率是指一个群体中某种基因型个体数占总个体数的比率。PCC=NCC/NPTT=NTT/N其中PCC、PTT代表某一位点的CC、TT基因型频率;NCC、NTT表示群体中具有CC、TT基因型的个体数;N为检测群体的总数量。(2)等位基因频率基因频率是指一个群体中某一基因数对其等位基因总数的相对比率。计算的公式可以写成:PT=(2NTT+NTT1+NTT2+NTT3+NTT4+……+NTTn)/2N式中,PT表示等位基因T频率,NTT表示群体中具有TT基因型的个体数量,NTTi表示群体中具有TTi基因型个体数量,a1-an为等位基因T的n个互不相同的复等位基因。本研究所涉及的等位基因为C和T,所以具体的基因频率计算公式为:PC=(2NCC+NGC)/2NPT=(2NTT+NGC)/2N式中,PC,PT分别表示等位基因C和T等位基因的频率,NCC、NCT和NTT分别表示CC、CT和TT基因型的个体数量,N表示总群体数目。秦川牛microRNA-320a-1基因SNP中的C等位基因频率以及T等位基因频率如表3所示。表3.秦川牛microRNA-320a-1基因(rs518926539:C>T)位点基因频率分布表7、microRNA-320a-1基因SNP位点与秦川牛生长性状的相关性分析(1)数据分析测定的性状包括:体重,体高,体长,胸围,胸宽,胸深,坐骨端宽,腰角宽,十字部高,以及尻长。关联分析一般线性的模型:用SPSS17.0软件一般线性模型GLM(GeneralLinearModelsProcedure)对各基因型对生长性状的影响进行显著性检验。依据本实验的其体情况建立如下统计模型:Yijk=μ+Ai+Gj+Eijk,其中:Yijk:个体表型记录;μ:总体均数;Ai:年龄效应;Gj:基因型效应;Eijk:随机误差。(2)关联分析结果结果见表4。具有TT基因型的成年秦川牛个体在十字部高、体重上显著大于CT型个体(P<0.05)。以上结果表明,秦川牛microRNA-320a-1基因(rs518926539:C>T)位点不同基因型表型差异显著不同,如果倾向于选择体格高大、体重大的个体,应选择TT型。由此,在今后的育种工作中,可参考以上结果进行选种和淘汰,从而加快具有优质经济性状秦川牛种群的建立。表4.秦川牛microRNA-320a-1基因(rs518926539:C>T)位点多态性与生长性状的关联分析注:表中数值表示均值±标准误差。上角标具有相同字母表示差异不显著(P>0.05),字母不同表示差异显著(P<0.05)。核苷酸序列表<110>西北农林科技大学<120>秦川牛microRNA-320a-1基因单核苷酸多态性的检测方法及其应用<160>4<210>1<211>18<212>DNA<213>人工合成<400>1ccgagcccagcctagagc18<210>2<211>18<212>DNA<213>人工合成<400>2cgcaccccttcgcaccca18<210>3<211>21<212>DNA<213>人工合成<400>3aactcccacgttgcgtccagc21<210>4<211>20<212>DNA<213>人工合成<400>4gctcccctccgccttctctt20当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 一种单核苷酸多态性位点在辅助鉴定大豆花叶病毒抗性中的应用的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 一种判定中国人群rs125055单核苷酸多态性与儿童IBD之间的相关性的方法与制造工艺
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 使用PNA探针的熔解曲线分析、使用熔解曲线分析用于分析核苷酸多态性的方法和试剂盒与制造工艺
- 人KRAS中单核苷酸多态性的检测的制造方法与工艺
- 一种InDel位点基因型分型的方法与制造工艺
- 单核苷酸多态性rs145562243在筛查麻风患者中的应用的制造方法与工艺
- 一种用于评估皮肤防御情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤防晒情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤抗皱情况的引物和探针及试剂盒的制作方法
- 人PLIN1基因rs2289487位点多态性检测方法及试剂盒的制作方法
- 测定人NEFM基因rs12515位点多态性的方法及试剂盒的制作方法
- 一种人TERF1基因rs3863242位点多态性检测技术的制作方法
- 测定人CCNH基因rs3093816位点多态性的方法及试剂盒的制作方法
- 测定人NEFL基因rs2979704位点多态性的方法及试剂盒的制作方法
- 测定人PON1基因rs854560位点多态性的方法及试剂盒的制作方法
- 测定人PON1基因rs662位点多态性的方法及试剂盒的制作方法
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 一种单核苷酸多态性位点在辅助鉴定大豆花叶病毒抗性中的应用的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 一种判定中国人群rs125055单核苷酸多态性与儿童IBD之间的相关性的方法与制造工艺
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 使用PNA探针的熔解曲线分析、使用熔解曲线分析用于分析核苷酸多态性的方法和试剂盒与制造工艺
- 人KRAS中单核苷酸多态性的检测的制造方法与工艺
- 一种InDel位点基因型分型的方法与制造工艺
- 单核苷酸多态性rs145562243在筛查麻风患者中的应用的制造方法与工艺
- 用于检测人类CYP2D6基因多态性的核酸、试剂盒及方法与流程
- 单核苷酸多态性位点rs2523607在筛查疱疹样皮炎患者中的应用的制作方法与工艺
- 核苷酸多态性检测方法与流程
- 单核苷酸多态性rs146466242在筛查麻风患者中的应用的制作方法与工艺
- 基于信号谱差异的混合样本单核苷酸多态性的检测方法与流程
- 一种检测牛PCAF基因单核苷酸多态性的RFLP方法及试剂盒与流程
- 秦川牛microRNA‑320a‑1基因单核苷酸多态性的检测方法及其应用与流程
- 单核苷酸多态性rs76418789在筛查麻风患者中的应用的制作方法与工艺
- 判定rs4676410和rs2531875单核苷酸多态性与AS之间相关性的方法与流程
- 一种可视化检测基因序列中单核苷酸多态性位点的反向探针、试剂盒及其检测方法与流程