新颖的启动子及其用途的制作方法
本公开涉及新颖的启动子、包含该启动子的载体、包含该载体的微生物以及使用该启动子制备靶蛋白的方法。
背景技术:
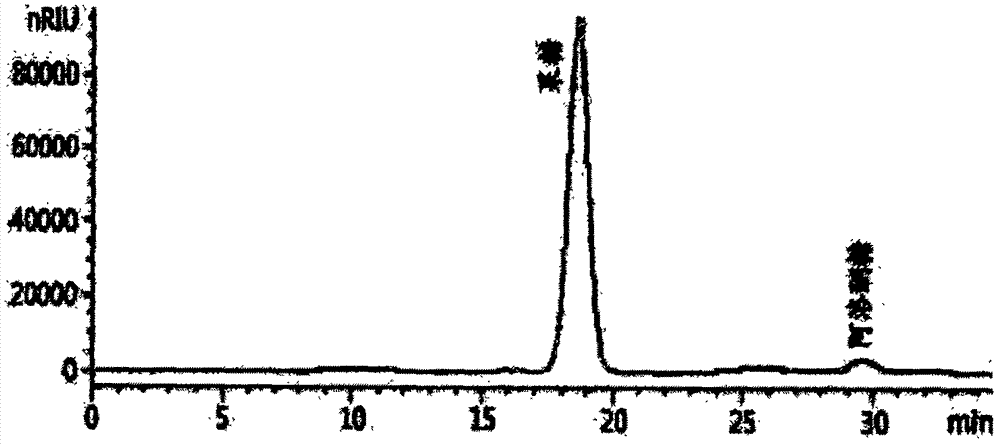
:在用于生产氨基酸或有用材料的棒状杆菌(corynebacterium)属微生物中,所述材料能够用于诸如饲料、药品、食品等多种目的,一直努力通过在生物合成途径中操纵基因和/或引入外来基因等增加产量(韩国专利第10-0924065号)。在棒状杆菌属微生物中诱导靶基因的过度表达需要高效的基因表达系统。在这些努力中,启动子的选择是基因表达系统中极为重要的,而启动子是基因表达中所涉及的最重要的因素。直到现在,来自埃希氏大肠杆菌(e.coli)的若干启动子(plac、ptrc、ptac)和来自棒状杆菌属微生物的若干启动子(psod、peftu、pgapa)已被用作棒状杆菌属微生物中可以使用的启动子。然而,与大肠杆菌中大多数基因表达系统相比,棒状杆菌属微生物中的基因表达系统的表达效率较低。因此,需要开发在棒状杆菌属微生物的基因表达系统中具有高表达效率的启动子。公开技术问题本公开的发明人已经进行了许多努力,以发现能够在棒状杆菌属菌株中诱导强基因表达的启动子,由此开发了新颖的启动子,并且证实了其高活性,从而完成了本公开。技术方案本公开的目的是提供具有启动子活性的新颖的核酸分子。本公开的另一目的是提供靶蛋白表达盒,其包含具有启动子活性的核酸分子和编码靶蛋白的基因。本公开的另一目的是提供包含具有启动子活性的核酸分子的重组载体。本公开的另一目的是提供引入该载体的重组微生物。本发明的另一目的是提供利用引入该载体的重组微生物制备靶蛋白的方法。本发明的另一目的是提供制备阿洛酮糖的方法,其包括:(a)培养引入载体的微生物;以及(b)将培养的微生物与果糖反应以生成阿洛酮糖。发明的有益效果与现有的重组微生物中用于大规模制备蛋白的启动子相比,通过本公开得到的启动子具有显著增加的基因表达率,因此,该启动子可以有效地用于食品、医药和农业等领域,其中使用棒状杆菌属或埃希氏杆菌属微生物作为表达宿主高产率地制备功能材料。附图简要说明图1示出了pfis-2-atpe-2载体图谱。图2示出了谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032/peccg117-pcj4-atpe(fis-4-atpe)与果糖底物反应后的hplc色谱图。图3示出了谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032/peccg117-pspl1-atpe(fis-2-atpe)与果糖底物反应后的hplc色谱图。图4示出了谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032/peccg117-pspl1-atpe-2(fis-2-atpe-2)与果糖底物反应后的hplc色谱图。最佳方式为了实现上述目的,本公开的一方面提供了具有启动子活性的核酸分子。具体而言,具有启动子活性的核酸分子可以是具有seqidno:1的核苷酸序列的核酸分子。在本公开中,具有seqidno:1的核苷酸序列且具有启动子活性的核酸分子可以与“spl1启动子”或“pspl1”交换使用。此外,具有启动子活性的核酸分子可以被命名为启动子,并且上述所有术语都可用于本说明书中。本公开的启动子可以在靶微生物中使靶基因表达并且具有seqidno:1的核苷酸序列,但不限于此,所述靶基因与启动子活性的核酸分子可操作地连接。此外,本领域普通技术人员通过常规的诱变如定向进化、定点突变等可以很容易地修饰本公开的启动子序列。因此,启动子可以包括但不限于与seqidno:1的核苷酸序列具有70%或更高同源性,特别是80%或更高,更特别是90%或更高,甚至更特别是95%或更高,甚至更特别是98%或更高,甚至更特别是99%或更高的任何核苷酸序列。此外,应当理解,具有该等同源性并具有启动子活性的任何核苷酸序列也应当属于本公开的范围,即使核苷酸序列的部分序列可能存在缺失、修饰、替换或插入。本文所使用的术语“同源性”系指两个多核苷酸或多肽部分之间的同一性的比例。由一部分到另一部分的序列对应性可以由本领域中已知的技术来确定。例如,可以使用易于获得并且能够匹配序列信息(例如参数,如得分、同一性、相似性等)(例如blast2.0)的计算机程序通过直接匹配两个多核苷酸分子或两个多肽分子来确定同源性。此外,可以通过在同源区段形成稳定双链的条件下杂交多核苷酸,随后通过单链特异性核酸酶消化杂交链以确定消化片段的大小从而确定多核苷酸之间的同源性。本文所使用的术语“启动子”系指位于编码区上游的未翻译的核酸序列,所述编码区包括聚合酶结合位点并且具有启动位于启动子下游的基因转录为mrna的活性,即与聚合酶结合并且启动基因转录的dna域。启动子可以位于mrna转录起始区的5’域。可以使用标准分子生物学技术分离或制备本公开的启动子的核酸分子。例如,可以使用利用自动dna合成仪的标准合成仪技术来制备启动子的核酸分子,但不限于此。虽然对具有本公开的启动子活性的核酸分子可以作为启动子的细胞类型没有特别的限制,但可以具体列举属于棒状杆菌(corynebacterium)属或埃希氏杆菌(escherichia)属的微生物,更具体地是谷氨酸棒状杆菌(corynebacteriumglutamicum)、产氨短杆菌(corynebacteriumammoniagenes),埃希氏大肠杆菌k12(escherichiacolik12)等,甚至更具体地是谷氨酸棒状杆菌(corynebacteriumglutamicum)或埃希氏大肠杆菌(escherichiacoli),但不限于此,并且可以包括但不限于属于棒状杆菌(corynebacterium)属或埃希氏杆菌(escherichia)属的任何微生物。本公开的另一方面提供用于靶蛋白的表达盒,其包含具有启动子活性的核酸分子和编码靶蛋白的基因。所述核酸分子与上面解释的相同。本文所使用的术语“表达盒”系指包含启动子和编码靶蛋白的基因的单元盒,其与启动子的下游可操作地连接,以便能够表达靶蛋白。可以将辅助高效制备靶蛋白的各种因子包括在表达盒的内部或外部。通常,表达盒可以包含与多核苷酸可操作地连接的启动子、转录终止信号、核糖体结合域以及翻译终止信号。具体而言,表达盒可以是编码靶蛋白的基因与启动子下游可操作地连接的形式。本文所使用的术语“表达盒”系指希望由微生物表达的蛋白。具体而言,包括但不限于将由微生物表达的任何蛋白(例如由atpe基因编码的蛋白),但不限于此。通过atpe基因编码的蛋白质,即阿洛酮糖差向异构酶,系指具有将果糖转化为阿洛酮糖活性的阿洛酮糖-3-差向异构酶。由本领域普通技术人员通过已知的数据库如nih的genbank(美国)能够很容易得到atpe基因的序列。此外,酶可以包括例如韩国专利申请公开第10-2011-0035805号的seqidno:1的氨基酸序列或其功能性片段,但不限于此。本文所使用的术语“功能区”包括通过部分氨基酸序列的替换、插入或缺失等而修饰氨基酸序列,并且没有特别的限制,只要片段具有将果糖转化为阿洛酮糖的活性即可。atpe基因是靶基因之一,其能够与具有本公开的具有启动子活性的核酸分子可操作地连接,并且仅仅是示例性实施方案。任何能够在重组微生物中表达的蛋白质都可以用作靶蛋白而不受限制。本文所使用的术语“可操作地链接”系指基因序列与启动子序列之间的功能性连接,从而具有本公开的启动子活性的核酸序列能够启动并介导编码靶蛋白的基因的转录。可以使用本领域已知的基因重组技术制备可操作的连接,并且可以使用酶等制备本领域中用于断裂和连接的位点特异性dna断裂和连接,但不限于此。本公开的另一方面提供了重组载体,其包含具有启动子活性的核酸分子。所述核酸分子与上面解释的相同。重组载体还可包括编码靶蛋白的基因。也就是说,重组载体可包括用于靶蛋白的表达盒。基因可能是在载体中与具有启动子活性的核酸分子可操作地连接的形式。本文所使用的术语“载体”系指具有能够在合适的宿主中表达靶基因的遗传物质的人工dna分子,并且尤其系指dna的构建体,其包含与合适的调控序列可操作地连接的基因的核苷酸序列。调控序列可以包括能够启动转录的启动子、任何能够控制该转录的操纵子序列、编码合适的mrna核糖体结合域的序列以及调控转录和翻译终止的序列,但不限于此。为本公开的目的,启动子可以是本公开的spl1启动子。本公开中使用的重组载体并不受到特别的限制,只要载体在宿主细胞中能够复制即可,并且可以使用本领域已知的任何载体。通常使用的载体的实例可以包括天然或重组质粒、粘粒、病毒和噬菌体。本公开中使用的载体并不受到特别的限制,并且可以使用本领域已知的任何表达载体。例如,作为噬菌体载体或粘粒载体,可以使用pwe15、m13、mbl3、mbl4、ixii、ashii、apii、t10、t11、charon4a、charon21a等;作为质粒载体,可以使用基于pbr、puc、pbluescriptii、pgem、ptz、pcl、pet等的那些载体。能够用于本公开的载体并不受到特别的限制,并且可以使用任何已知的表达载体。例如可以使用peccg117、pdz、pacyc177、pacyc184、pcl、puc19、pbr322、pmw118、pcc1bac、pces208、pxmj19载体等,但不限于这些载体。此外,可以通过用于插入宿主细胞的载体使用具有本公开的启动子活性的核酸分子代替染色体中的内源启动子。可以使用本领域中任何已知的方法例如通过同源重组来实施核酸分子插入染色体。由于本公开的载体能够通过同源重组插入染色体,因此还可以包括用于确认载体插入染色体的选择标记物。选择标记物用于选择转化细胞,即用以确认靶核酸分子是否已经插入,并且可以使用能够提供可选择的表型如耐药性、营养需求、细胞毒性试剂抗性以及表面蛋白表达的标记物。在选择试剂处理的情况下,只有能够表达选择标记物的细胞才能存活或表达其他表型性状,从而能够容易选择转化细胞。因此,即使在载体中的靶基因未与具有本公开的seqidno:1的核苷酸序列并具有启动子活性的核酸分子可操作地连接的情况下,宿主细胞(如棒杆菌(corynebacterium)属微生物)中的内源性启动子可以通过同源重组被核酸分子替代。通过这样做,宿主细胞(如棒杆菌(corynebacterium)属微生物)的内源性基因可以过度表达。在重组载体中,编码靶蛋白的基因可以是atpe基因,但不限于此。在这种情况下,重组载体可以是atpe基因,所述atpe基因与具有seqidno:1的核苷酸序列并且具有启动子活性的核酸分子可操作地连接,例如在本公开的示例性实施方案中使用的“pfis-2-atpe”或“pfis-2-atpe-2”,但不限于此。本公开的另一方面提供引入上述载体的重组微生物。所述载体与上面解释的相同。载体可以是含有具有启动子活性的核酸分子的载体或含有具有启动子活性的核酸分子和编码靶蛋白的基因的载体。可以通过转化将载体引入微生物。本文所使用的术语“转化”系指将包含本公开的启动子或者还包含编码靶蛋白的基因的载体引入宿主细胞的过程。对于编码靶蛋白的转化基因,只要基因能够在宿主细胞中表达即可,而无论是否将基因插入宿主细胞的染色体中并基因位于染色体上或位于染色体之外。本公开的转化载体的方法可以包括能够将核酸引入细胞的任何方法,并且可以根据宿主细胞通过选择本领域已知的合适的技术来进行转化。例如,所述方法可包括电穿孔法,磷酸钙(capo4)沉淀法、氯化钙(cacl2)沉淀法、显微注射法、聚乙二醇(peg)法、deae-葡聚糖法、阳离子脂质体法以及乙酸锂/dmso法等,但不限于此。本公开中使用的微生物可以是不受限制的任何微生物,只要具有本公开的启动子活性的核酸分子被引入微生物中并能够作为启动子起作用即可。具体而言,微生物可以是属于棒杆菌(corynebacterium)属的微生物,例如谷氨酸棒状杆菌(corynebacteriumglutamicum)或产氨短杆菌(corynebacteriumammoniagenes),但不限于此。此外,微生物可以是属于埃希氏杆菌(escherichia)属的微生物,例如埃希氏大肠杆菌(escherichiacoli),但不限于此。本公开的另一方面提供制备靶蛋白的方法,其包括:(a)在培养基中培养重组微生物以制备靶蛋白;以及(b)从所述培养的微生物或所述培养基中收获所述制备的靶蛋白。本文所使用的术语“培养”系指在适当调整的环境中微生物的生长。在本公开中,可以通过本领域已知的方法,使用重组微生物进行制备靶蛋白的方法。具体而言,可以在分批处理、分批补料或重复分批补料处理中连续进行培养,但不限于此。用于培养的培养基必须以适当的方法满足特定菌株的要求。已知属于棒状杆菌(corynebacterium)属的菌株或属于埃希氏菌(escherichia)属的菌株的培养基(例如manualofmethodsforgeneralbacteriology(通用细菌学方法手册).americansocietyforbacteriology.washingtond.c.,usa,1981)。碳源的实例可以包括糖和碳水化合物,如葡萄糖、蔗糖、乳糖、果糖、麦芽糖、淀粉、纤维素等;油和脂肪,如豆油、葵花油、蓖麻油、椰子油等;脂肪酸,如棕榈酸、硬脂酸、亚油酸、等;醇,如甘油和乙醇;有机酸,如葡萄糖酸、乙酸和丙酮酸,但不限于此。这些碳源可以单独使用也可以联合使用。氮源的实例可以包括蛋白胨、酵母提取物、肉汁、麦芽提取物、玉米浆(csl)、大豆粉以及尿素;或者无机氮源,如硫酸铵、氯化铵、磷酸铵、碳酸铵和硝酸铵,但不限于此。这些氮源可以单独使用或联合使用。磷源的实例可以包括磷酸二氢钾、磷酸氢二钾以及相应的含钠的盐,但不限于此。此外,培养基可以含有诸如硫酸镁或硫酸铁的金属盐。最后,可以使用诸如氨基酸和维生素的生长必需的物质。此外,培养基中可以含有适当的前体。可以通过合适的方法以间歇式或连续式向培养基中加入上述原料。参考文献例如“biochemicalengineering”(生化工程)jamesm.lee,prentice-hallinternationaleditions,第138页至第176页公开了不同的培养方法。培养基的ph值可以通过适当使用碱性化合物如氢氧化钠、氢氧化钾、氨水或酸性化合物如磷酸和硫酸进行调节。此外,可以加入消泡剂如脂肪酸聚乙二醇酯以防止泡沫的产生。为了保持培养的有氧状态,可以在培养物中注入氧或含氧气体(如空气)。培养温度通常可以是20℃至45℃,优选25℃至40℃,并且温度可以根据条件而变化,但不限于此。制备本公开的靶蛋白的方法可以包括从微生物或其培养物中收获靶蛋白。作为从微生物中收获靶蛋白的方法,可以使用本领域已知的方法,如过滤、阴离子交换色谱、结晶、hplc等,但不限于此。回收可以包括纯化步骤,并且本领域普通技术人员能够从各种纯化方法中选择纯化步骤并按需要使用。本公开的另一方面提供制备阿洛酮糖的方法,其包括:(a)培养微生物,其中导入了包含具有seqidno:1的核苷酸序列的启动子和atpe基因的载体;以及(b)将所述培养的微生物与果糖反应以制备阿洛酮糖。所述启动子、atpe基因、载体以及微生物与上面解释的相同。与任何传统情况相比,上述制备方法能显著提高阿洛糖的产率,其中atpe基因与已知的启动子可操作地连接并在微生物中表达。发明详述以下将参考随后的实施例等更详细地描述本公开,以帮助理解本公开。然而,这些实施例可以用各种其他形式加以修改,并且本公开的范围不应被解释为受这些实施例的限制。提供本公开的实施例是为了向那些具有本领域平均知识的人作出更全面的解释。对于能够诱导靶基因表达的启动子的合成,通过分析源自棒状杆菌(corynebacterium)属和埃希氏杆菌(escherichia)属微生物的不同的启动子序列来制备具有seqidno:1的核苷酸序列的启动子,并将启动子命名为spl1启动子(以下简称“pspl1”)。为了测量spl1的表达诱导活性,通过将pspl1与gfp基因或atpe基因可操作地连接来构建重组载体。将质粒转化为棒状杆菌(corynebacterium)属微生物并由此制备转化菌株。实施例1:启动子文库的制备制备文库以便筛选强大的合成启动子,所述启动子能够在棒状杆菌(corynebacterium)属的菌株中表达高表达水平的外源蛋白。具体而言,使用谷氨酸棒状杆菌(corynebacteriumglutamicum)、产氨短杆菌(corynebacteriumammoniagenes)和埃希氏大肠杆菌k12(escherichiacolik12)各自的基因组dna,通过dna改组技术获得了能够表现出更强表达谱或不同表达谱的启动子文库。更具体而言,谷氨酸棒杆菌(corynebacteriumglutamicum)、产氨短杆菌(corynebacteriumammoniagenes)和埃希氏大肠杆菌k12(escherichiacolik12)的基因组dna首先经dnasei消化为若干片段,然后再进行pcr而不使用引物。因此,具有相似核苷酸序列的每一片段均能够彼此充当引物,由此能够制备文库。然后通过平端连接将文库插入puc19载体。然后,使用含有kpni/psti限制性位点的seqidno:2和seqidno:3的引物进行pcr,以制备各种合成的启动子文库。所使用的文库的空载体为peccg117(韩国专利第10-0620092号,kfcc-10673/kfcc-10674),其为能够在棒状杆菌(corynebacterium)和埃希氏杆菌(escherichia)的菌株中表达的穿梭载体。首先,通过pcr使用作为模板的pgfpuv载体(clontechlaboratoriesinc.,u.s.a.)、含有kpni/psti限制性位点的正向引物(seqidno:4)以及含有kpni/psti限制性位点的反向引物(seqidno:5)来制备编码绿色荧光蛋白的基因片段。通过在94℃下预变性5分钟,在94℃下30次循环变性30秒,在55℃下退火30秒,在72℃下聚合1分钟,最后在72℃下延伸7分钟来进行pcr。最终,获得了含有gfp基因的开放阅读框(orf)的pcr产物(seqidno:6)。pcr产物和peccg117分别用限制性内切酶(psti和xbai)处理,使用dna连接酶可操作地连接在一起,并且最终制备了peccg117-gfp质粒,其为与gfp连接的重组载体,所述peccg117是空载体。用限制性内切酶(kpni和psti)处理并使用dna连接酶连接如此得到的启动子文库和载体,以制备启动子文库质粒,将绿色荧光蛋白(以下简称gfp)克隆入载体。这样制备的质粒转化为谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032以制备合成的启动子文库。在细胞中筛选谷氨酸棒杆菌(corynebacteriumglutamicum)的如此制备的合成的启动子文库,所述细胞通过经过培养、获得微生物细胞以及预处理的步骤后表达gfp而显示荧光。经过多轮筛选,得到最终的强合成的启动子psl1并且启动子具有seqidno:1的核苷酸序列。实施例2:通过比较经筛选最终得到的启动子和其它启动子之间的活性来确认在谷氨酸棒状杆菌(corynebacteriumglutamicum)中诱导表达的活性使用具有实施例1中最终得到的pspl1启动子的peccg117-pspl1-gfp质粒,作为阳性对照组的具有通常已知的pcj4启动子的peccg117-pcj4-gfp质粒(韩国专利第10-0620092号),以及作为阴性对照组的peccg117质粒,根据gfp的表达分析启动子的活性,所述gfp为报告蛋白。具体而言,对于pspl1活性的确认,如如下所述,培养谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032/peccg117、谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032/peccg117-pcj4-gfp以及上述得到的谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032/peccg117-pspl1-gfp的转化株,并测定其gfp活性。谷氨酸棒杆菌(corynebacteriumglutamicum)的每一转化株分别以1∶20的比例接种于250ml的拐角挡板烧瓶中,其含有25ml的培养基(葡萄糖(20g)、硫酸铵(5g)、酵母提取物(5g)、尿素(1.5g)、kh2po4(4g)、k2hpo4(8克)、mgso4·7h2o(0.5g)、生物素(150μg)、硫胺素(1.5mg)、泛酸钙(3mg)、烟酰胺(3mg)(基于1l的蒸馏水),ph值为7.2),并在30℃下在摇床(200rpm)中培养直到在600nm处的吸光度达到10.0。通过离心(5,000rpm,15分钟)从培养物中回收微生物细胞,使用0.1%的tris·hcl(ph8.0)缓冲液洗涤两次,并悬浮于同样的缓冲液中使得浊度约为160。悬浮液装入玻璃珠(1.25g玻璃珠/1.5ml悬浮液),细胞用珠磨器破坏6分钟。随后,通过离心(1,5000rmp,20分钟)回收上清液,用bradford法定量蛋白浓度(bradford,mm1976.anal.biochem.72:248to254)。使用lauregory法(femsmicrobiologyletters(fems微生物快报)194,127to133,2001)等,相同数量的微生物细胞提取物在488nm处受激发光的照射,并且用ls-50b分光光度计装置(perkinelmer)测量所发出的光,从而测量gfp基因的表达水平(表1)。[表1]菌株荧光灵敏度atcc13032/peccg1170.0atcc13032/pcj4-gfp897.2atcc13032/pspl1-gfp3256.3如表1所示,pspl1在谷氨酸棒状杆菌(corynebacteriumglutamicum)中确实具有的启动子活性,并证实了与申请人的公司制备的现有的pcj4启动子相比,pspl1是能够更强烈表达gfp基因的优良的启动子。实施例3:制备用于表达包含pspl1启动子的序列的atpe的载体对于评价具有棒状杆菌(corynebacterium)的改进表达的启动子(以下称pspl1),在一示例性实施方案中,制备了棒状杆菌(corynebacterium)菌株的载体,其中atpe(源自根癌农杆菌(agrobacteriumtumefaciens)atcc33970的环状差向异构酶)的表达增加了。使用pet24-atpe载体(与韩国专利申请公开第10-2011-0035805号中公开的seqidno:1的核苷酸序相同)或pet24-atpe-2载体(与韩国专利第10-1203856号中公开的核苷酸序列相同:具有改进的热稳定性的变体,i33l-s213c)以及具有seqidno:7和8的核苷酸序列的引物,通过pcr(下列条件下的30个循环:94℃30秒,55℃30秒和72℃1分钟)对atpe基因的开放阅读框(orf)进行扩增。用于实施例1中制备的棒状杆菌(corynebacterium)属的菌株的peccg117-pspl1-gfp载体用限制性内切酶(psti和xbai)处理,然后使用bdin-fusion试剂盒将atpe基因和atpe-2(与改进的atpe稳定性的变体)的orf片段可操作地连接,从而最终制备用于棒状杆菌(corynebacterium)属的菌株的peccg117-pspl1-atpe载体(以下称为“pfis-2-atpe”)和peccg117-pspl1-atpe-2(以下称为“pfis-2-atpe-2”)(图1)。实施例4:确认谷氨酸棒杆菌(corynebacteriumglutamicum)菌株中生产阿洛酮糖的酶的表达及其活性上述制备的“pfis-2-atpe”和“pfis-2-atpe-2”载体通过电穿孔引入atcc13032以制备fis-2-atpe和fis-2-atpe-2菌株。其中,fis-2-atpe-2菌株于2015年3月27日保藏于韩国微生物保藏中心(kccm),并给予保藏号kccm11678p。使用实施例1的培养基(葡萄糖(20g)、硫酸铵(5g)、酵母提取物(5g)、尿素(1.5g)、kh2po4(4g)、k2hpo4(8克)、mgso4·7h2o(0.5g)、生物素(150μg)、硫胺素(1.5mg)、泛酸钙(3mg)、烟酰胺(3mg)(基于1l的蒸馏水),ph值为7.2)在erlenmeyer烧瓶中培养菌株并测定atpe的活性。将置于30℃培养器中的lb固体培养基中培养过夜的每一菌株接种于25ml的培养基中,并在培养器中国(30℃,200rpm)培养24小时。培养后,离心移除所得的上清液,用冷pbs洗涤由此得到的微生物组织。每个如此得到的颗粒溶解在epps溶液(ph8)中使得浓度为20%(w/v),使用poesa(1mg/ml)处理,在室温下反应1小时,并离心。离心得到的每一颗粒均溶于epps溶液(ph8)中使得浓度为20%(w/v),使用果糖溶液(300g/l)处理,在50℃下反应3小时,并由热处理停止反应。随后,通过离心收集上清液并由hplc分析测定阿洛酮糖的生产量(图2至4)。[表2]如上表2所示,证实了,在棒状杆菌(corynebacterium)菌株中,表达了atpe基因,源自如上制备的野生型菌株,与谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032/peccg117-pcj4-atpe(fis-4-atpe)相比,谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032/peccg117-pspl1-atpe(fis-2-atpe)和谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032/peccg117-pspl1-atpe-2(fis-2-atpe-2)显示了如显著增加的阿洛酮糖产量。根据上述描述,本公开所涉及的领域中的技术人员将能够理解,本公开可以其他具体形式实施,而不改变本公开的技术构思或本质特征。因此,本文公开的示例性实施方案仅用于说明目的,不应被解释为限制本公开的范围。相反,本公开旨在不仅包括示例性实施方案,还包括各种其他方案、修改、等同物以及可以包括在由所附权利要求书定义的本公开的精神和范围内的其他实施方案。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1