用于遗传工程改造的细胞中调节抑制性相互作用的组合物和方法与流程
本申请要求于2015年5月29日提交的题为“用于在遗传工程改造的细胞中调节抑制性相互作用的组合物和方法”的美国临时专利申请号62/168,721,以及2015年10月20日提交的题为“用于在遗传工程改造的细胞中调节抑制性相互作用的组合物和方法”的美国专利申请号62/244,132的优先权,其内容通过引用其全文纳入本文。
通过引用纳入序列表
本申请与电子格式的序列表一同提交。所提供的序列表名称为735042002440seqlist.txt,创建于2016年5月27日,其文件大小为41kb。该序列表的电子格式的信息通过引用其全文纳入本文。
技术领域
本公开在一些方面涉及用于过继治疗的工程改造的细胞,包括T细胞。在一些方面中,本发明还涉及用于工程改造和产生所述细胞的方法和组合物、含有该细胞的组合物、和用于向对象给予它们的方法。在一些实施方式中,所述细胞(如T细胞)包含特异性结合抗原的遗传工程改造的抗原受体,如嵌合抗原受体(CAR)。在一些实施方式中,所述细胞(如表达CAR的T细胞)包含一种能够通过阻遏和/或破坏工程改造的细胞中基因(如涉及抑制免疫应答的基因)来降低抑制作用的物质(agent)。在一些实施方式中,方法和细胞的特征提供了增强的或改善的活性、功效和/或持久性。
背景技术:
有多种策略可用于产生并给予用于过继治疗的工程改造的细胞。例如,有策略可用于工程改造表达遗传工程改造的抗原受体(如CAR)的免疫细胞,并且用于阻抑或阻遏细胞中的基因表达。需要改善的策略以改善所述细胞的功效,例如,所述改善通过避免在给予对象之后对效应物功能的阻抑和改善在给予对象后细胞的活性和/或存活来进行。提供了满足此类需求的方法、细胞、组合物、试剂盒和系统。
发明概述
提供了产生或生成表达遗传工程改造(重组)细胞表面受体的细胞的方法,所述细胞用于如过继细胞治疗中,例如,以治疗对象中的疾病和/或病症。还提供了用于这类方法的细胞、组合物和制品。组合物和细胞通常包括这样的物质,其降低PD-L1和/或PD-1表达,或能够造成PD-L1和/或PD-1表达的降低。在一些实施方式中,所述物质是或者包括抑制性核酸分子,例如互补于、靶向、抑制和/或结合编码PD-L1或PD-1的核酸或基因的抑制性核酸分子。在一些实施方式中,所述物质是或者包括含有核糖核蛋白(RNP)复合物的复合物,所述RNP复合体包括Cas9,例如在一些情况中,酶失活的Cas9,以及靶向编码PD-L1或PD-1的基因的gRNA。还提供了向对象给予所提供的细胞的方法,所述细胞表达遗传工程改造(重组)细胞表面受体(如通过本文所述方法产生),其例如,用于过继细胞治疗以治疗对象的疾病和/或病症。
在一些实施方式中,提供了这样的细胞,其包含编码遗传工程改造的抗原受体(如嵌合抗原受体(CAR))的核酸分子以及是或包括或编码这样物质的核酸分子,所述物质降低PD-L1表达,或能够产生PD-L1表达的降低。在一些实施方式中,重组受体是遗传工程改造的抗原受体,如功能性非-TCR抗原受体,例如,嵌合抗原受体(CAR)和其他重组抗原受体如转基因T细胞受体(TCR)。受体还包括其他重组嵌合受体,如含特异性结合配体或受体或其他结合伴侣的胞外部分和胞内信号转导部分(如CAR的胞内信号转导部分)的那些受体。提供了用于在过继细胞治疗中给予对象表达遗传工程改造(重组)细胞表面受体的细胞的方法,例如,以治疗对象中的疾病和/或病症。
在任意这些实施方式的一些中,工程改造的T细胞包含特异性结合抗原的遗传工程改造抗原受体;以及这样的物质,其降低PD-L1表达或能够造成PD-L1表达的降低。在一些实施方式中,所述物质包括抑制性核酸分子,如互补于、靶向、抑制和/或结合编码PD-L1的其它核酸或基因和/或编码PD-L1的其它核酸或基因(例如,CD274基因)的抑制性核酸分子。这任意这些实施方式的一些中,抑制性核酸分子包括RNA干扰剂。在任意这些实施方式的一些中,抑制性核酸是或包含或编码小干扰RNA(siRNA)、微小RNA适应性shRNA、短发夹RNA(shRNA)、发夹siRNA、前体微小RNA(前-miRNA)或微小RNA(miRNA)。
在任意这些实施方式的一些中,抑制性核酸分子包含与编码PD-L1的核酸互补的序列。在任意这些实施方式的一些中,抑制性核酸分子包含与编码PD-L1的核酸互补的反义寡核苷酸。
在一些实施方式中,所述物质包括gRNA,所述gRNA具有与编码PD-L1的基因的靶结构域互补的靶向结构域,以及与之组合的Cas9分子,如酶失活的Cas9(例如eiCas9),用于减少或阻遏基因表达。在一些实施方式中,所述物质包括核酸分子,其编码至少一个gRNA和/或Cas分子。在一些实施方式中,所述物质包括Cas9分子和gRNA的至少一个复合物,所述gRNA具有与PD-L1基因的靶结构域互补的靶向结构域。
在任意这些实施方式的一些中,遗传工程改造的T细胞包含特异性结合抗原的遗传工程改造的抗原受体;以及被破坏的编码PD-L1的基因,用于破坏PD-L1编码基因的物质,和/或对编码PD-L1的基因的破坏。在任意这些实施方式的一些中,基因的破坏是通过基因编辑核酸酶、锌指核酸酶(ZFN)、成簇规律间隔短回文核酸(CRISPR)/Cas9、和/或TAL效应物核酸酶(TALEN)介导的。在任意这些实施方式的一些中,破坏包括使基因的至少一个外显子的至少一部分缺失。在任意这些实施方式的一些中,破坏包括基因中的缺失、突变和/或插入,其导致基因中存在提早终止密码子;和/或破坏包括基因的第一或第二外显子内的缺失、突变、和/或插入。在任意这些实施方式的一些中,T细胞中PD-L1的表达,与在不存在抑制性核酸分子或基因破坏或不存在其活化的T细胞中的表达相比,降低至少50、60、70、80、90或95%。
在任意这些实施方式的一些中,遗传工程改造的T细胞包含特异性结合抗原的遗传工程改造的抗原受体;以及编码这样的分子的多核苷酸,所述分子降低或破坏细胞中PD-1或PD-L1的表达,其中所述多核苷酸的表达或活性是条件型的。在任意这些实施方式的一些中,表达受到条件型启动子或增强子或反式激活因子的控制。在任意这些实施方式的一些中,条件型启动子或增强子或反式激活因子是诱导型启动子、增强子或反式激活因子或阻遏型启动子、增强子或反式激活因子。在任意这些实施方式的一些中,降低或破坏PD-1或PD-L1表达的分子是或包括或编码反义分子,siRNA,shRNA,miRNA,基因编辑核酸酶,锌指核酸酶蛋白(ZFN),TAL效应物核酸酶(TALEN)或CRISPR-Cas9组合的一种或多种组分,其特异性地结合、识别或杂交所述基因。
在任意这些实施方式的一些中,启动子选自RNA pol I、pol II或pol III启动子。在任意这些实施方式的一些中,启动子选自:pol III启动子,其为U6或H1启动子;或pol II启动子,其为CMV、SV40早期区或腺病毒主要晚期启动子。在任意这些实施方式的一些中,启动子是诱导型启动子。在任意这些实施方式的一些中,启动子包括Lac操纵子序列、四环素操纵子序列、半乳糖操纵子序列或多西环素操纵子序列,或是其类似物。
在任意这些实施方式的一些中,启动子是阻遏型启动子。在任意这些实施方式的一些中,启动子包括Lac阻遏型元件或四环素阻遏型元件,或是其类似物。
在任意这些实施方式的一些中,T细胞是CD4+或CD8+T细胞。在任意这些实施方式的一些中,遗传工程改造的抗原受体是功能性非T细胞受体。
在任意这些实施方式的一些中,遗传工程改造的抗原受体是嵌合抗原受体(CAR)。在任意这些实施方式的一些中,CAR包含特异性结合靶抗原的胞外抗原识别结构域和胞内信号转导结构域,包括ITAM。在任意这些实施方式的一些中,胞内细胞信号转导结构域包括CD3ζ链的胞内结构域。在任意这些实施方式的一些中,CAR还包含共刺激信号转导区域。在任意这些实施方式的一些中,共刺激信号转导区域包含CD28或4-1BB的信号转导结构域。在任意这些实施方式的一些中,共刺激结构域是CD28。
在任意所述实施方式的一些中,所述细胞是人细胞。在任意所述实施方式的一些中,所述细胞是分离的细胞。
在一些实施方式中,还提供了核酸分子,其包含编码抗原受体(CAR)的第一核酸(任选地是第一表达盒)以及编码抑制性核酸分子的第二核酸(任选地是第二表达盒),所述抑制性核酸分子针对编码PD-1或PD-L1的基因和/或与编码PD-1或PD-L1基因互补的核酸序列。这任意这些实施方式的一些中,抑制性核酸分子包含RNA干扰剂。在任意这些实施方式的一些中,抑制性核酸是或包含或编码小干扰RNA(siRNA)、微小RNA适应性shRNA、短发夹RNA(shRNA)、发夹siRNA、前体微小RNA(前-miRNA)、初级-miRNA或微小RNA(miRNA)。在任意这些实施方式的一些中,抑制性核酸包含与编码PD-1的核酸互补的序列;在任意这些实施方式的一些中,其包含与编码PD-L1的核酸互补的序列。在任意这些实施方式的一些中,抑制性核酸分子包含与编码PD-1的核酸互补的反义寡核苷酸;在任意这些实施方式的一些中,抑制性核酸分子包含与编码PD-L1的核酸互补的反义寡核苷酸。在一些实施方式中,第二核酸包括含有靶向结构域的gRNA序列,所述靶向结构域与编码PD-1或PD-L1的基因的靶结构域互补。在任意这些实施方式的一些中,核酸分子还可以包括编码Cas9分子的第三核酸,其在一些情况中包括酶失活的Cas9(eiCas9或iCas9)或eiCas9融合蛋白。
在一些实施方式中,一个或多个核酸中的每一个都可以被元件隔开,从而允许从相同转录物翻译多个基因。在一些实施方式中,核酸分子是多顺反子,如双顺反子。在一些实施方式中,元件是或包括内部核糖体进入位点(IRES)或包括跳跃序列(skip sequence),如编码自切割2A肽(例如,T2A、P2A、E2A或F2A)的序列。
在任意这些实施方式的一些中,核酸编码是功能性非T细胞受体的抗原受体。在任意这些实施方式的一些中,遗传工程改造的抗原受体是嵌合抗原受体(CAR)。在任意这些实施方式的一些中,CAR包含特异性结合所述抗原的胞外抗原识别结构域和包含ITAM的胞内信号转导结构域。在任意这些实施方式的一些中,胞内细胞信号转导结构域包含CD3ζ链的胞内结构域。在任意这些实施方式的一些中,CAR还包括共刺激信号转导区域。在任意这些实施方式的一些中,共刺激信号转导区域包括CD28或4-1BB的信号转导结构域。在任意这些实施方式的一些中,共刺激结构域是CD28。
在任意这些实施方式的一些中,第一和第二核酸,任选地,第一和第二表达盒,可操作地连接相同或不同的启动子。在任意这些实施方式的一些中,第一核酸,任选地第一表达盒可操作地连接诱导型启动子或阻遏型启动子,并且第二核酸,任选地第二表达盒可操作地连接组成型启动子。
在任意所述实施方式的一些中,核酸是分离的。在实施方式中,还提供了含有一些或任一实施方式的核酸的载体。在任意所述实施方式的一些中,载体是质粒、慢病毒载体、逆转录病毒载体、腺病毒载体或腺相关病毒载体。在任意这些实施方式的一些中,载体是整合酶缺陷型的。
在一些实施方式中,还提供了含有核酸分子或载体的T细胞。在任意这些实施方式的一些中,T细胞是CD4+或CD8+T细胞。在任何所述实施方式的一些中,T细胞是人细胞。在任意所述实施方式的一些中,T细胞是分离的。
在一些实施方式中,还提供了含有本文任意所述实施方式中的一些实施方式的细胞和药学上接受的运载体的药物组合物。
在一些实施方式中,还提供了产生遗传工程改造的T细胞的方法,其包括以下步骤:(a)将特异性结合抗原的遗传工程改造(重组)抗原受体导入包括T细胞的细胞群,如通过将编码抗原受体的核酸分子导入细胞;以及(b)将这样的物质导入细胞群,相对于经一种或多种条件孵育的没有导入所述物质的对应细胞群的T细胞中PD-L1表达和/或上调,所述物质能够在经所述一种或多种条件孵育的所述群中的T细胞中导致PD-L1表达的减少和/或抑制PD-L1的上调,其中步骤(a)和(b)可以同时进行或以任意顺序依次进行,从而将所述遗传工程改造的抗原受体和所述物质导入所述群的T细胞中。
在任意这些实施方式的一些中,调节遗传工程改造的T细胞中的PD-L1表达的方法包括,将这样的物质导入T细胞,相对于经一种或多种条件孵育的没有导入所述物质的对应T细胞中PD-L1的表达或上调,所述物质能够在经所述一种或多种条件孵育后的细胞中导致PD-L1表达的减少和/或抑制PD-L1的上调,所述T细胞包含特异性结合抗原的遗传工程改造的抗原受体。在任意这些实施方式的一些中,在具有抗原存在的条件下进行的孵育诱导对应群中PD-L1的表达或上调,所述对应群包含未导入所述物质的T细胞。
在任意这些实施方式的一些中,抗原存在下的孵育包括在体外孵育所述细胞与抗原。在任意这些实施方式的一些中,抗原存在下的孵育持续如下时间长度:2小时至48小时,6小时至30小时或12小时至24小时,各自包括端值,或持续少于48小时,少于36小时或少于24小时。
在任意这些实施方式的一些中,孵育包括在某些条件下将细胞给予对象,从而使得工程改造的抗原受体就该孵育的至少一部分而言特异性地结合抗原。在任意这些实施方式的一些中,将细胞给予对象后24小时、2天、3天、4天、5天、6天、7天、8天、9天或10天的时间内,孵育诱导表达或上调。在任意这些实施方式的一些中,PD-L1表达的减少或对其上调的抑制是至少或至少约30%、40%、50%、60%、70%、80%、90%、95%或更多。
在任意这些实施方式的一些中,该方法是是离体进行的。在任意这些实施方式的一些中,所述物质的导入是通过导入包含编码所述物质的序列的核酸进行的。在一些实施方式中,所述物质的导入包括导入Cas9分子的至少一种复合物,如酶失活的Cas9(例如eiCas9)或其融合蛋白,和gRNA,所述gRNA具有与编码PD-L1的基因的靶结构域互补的靶向结构域。在任意这些实施方式的一些中,所述导入包括诱导T细胞的所述物质的瞬时表达,从而造成所述细胞中PD-L1表达的临时减少或破坏,和/或其中所述减少或破坏不是永久的。
在任意这些实施方式的一些中,所述物质的表达或活性是条件型的。在任意这些实施方式的一些中,表达受到条件型启动子或增强子或反式激活因子的控制。在任意这些实施方式的一些中,条件型启动子或增强子或反式激活因子是诱导型启动子、增强子或反式激活因子或阻遏型启动子、增强子或反式激活因子。在任意这些实施方式的一些中,启动子选自RNA pol I、pol II或pol III启动子。在任意这些实施方式的一些中,启动子选自:pol III启动子,其为U6或H1启动子;或pol II启动子,其为CMV、SV40早期区或腺病毒主要晚期启动子。
在任意这些实施方式的一些中,启动子是诱导型启动子。在任意这些实施方式的一些中,启动子包括Lac操纵子序列、四环素操纵子序列、半乳糖操纵子序列或多西环素操纵子序列。在任意这些实施方式的一些中,启动子是阻遏型启动子。在任意这些实施方式的一些中,启动子包括Lac阻遏型元件或四环素阻遏型元件。
在任意这些实施方式的一些中,所述物质在T细胞中稳定表达,从而在所述细胞中产生PD-L1表达的持续的减少或破坏。这任意这些实施方式的一些中,所述物质是包含在病毒载体中的核酸分子。在任意所述实施方式的一些中,病毒载体是腺病毒、慢病毒、逆转录病毒、疱疹病毒或腺相关病毒载体。这任意这些实施方式的一些中,所述物质是抑制性核酸分子,其使细胞中PD-L1的表达减少。
这任意这些实施方式的一些中,抑制性核酸分子包括RNA干扰剂。在任意这些实施方式的一些中,抑制性核酸是或包括或编码小干扰RNA(siRNA)、微小RNA适应性shRNA、短发夹RNA(shRNA)、发夹siRNA、前体微小RNA(前-miRNA)、初级-miRNA或微小RNA(miRNA)。在任意这些实施方式的一些中,抑制性核酸分子包含与编码PD-L1的核酸互补的序列。在任意这些实施方式的一些中,抑制性核酸分子包含与编码PD-L1的核酸互补的反义寡核苷酸。在一些实施方式中,核酸包含含有靶向结构域的gRNA序列,所述靶向结构域与编码PD-L1的基因的靶结构域互补。在任意这些实施方式的一些中,核酸分子可以还包含编码Cas9分子的第三核酸,其在一些情况中包括酶失活的Cas9(eiCas9或iCas9)或eiCas9融合蛋白。
在任意这些实施方式的一些中,本文提供的方法中所造成的减少和/或对上调的抑制包括破坏编码PD-L1的基因。在任意这些实施方式的一些中,破坏包括在DNA水平破坏基因,和/或破坏是不可逆的;和/或破坏不是瞬时的。
在任意这些实施方式的一些中,破坏包括导入这样的物质,所述物质是特异性结合或杂交所述基因的DNA-结合核酸或DNA结合蛋白。在任意这些实施方式的一些中,破坏包括导入:(i)包含DNA-靶向蛋白和核酸酶的融合蛋白或(ii)RNA-引导的核酸酶。在任意这些实施方式的一些中,DNA-靶向蛋白或RNA-引导的核酸酶包含锌指蛋白(ZFP)、TAL蛋白或由对所述基因具有特异性的成簇规律间隔短回文核酸(CRISPR)引导的Cas蛋白(例如,Cas9)(CRISPR/Cas)。在任意这些实施方式的一些中,破坏包括导入锌指核酸酶(ZFN)、TAL-效应物核酸酶(TALEN)、或和CRISPR-Cas9组合,其特异性结合、识别或杂交所述基因。在任意这些实施方式的一些中,导入是通过导入包含编码DNA-结合蛋白、DNA-结合核酸、和/或包括所述DNA-结合蛋白或DNA-结合核酸的复合物的序列的核酸来进行的。
这任意这些实施方式的一些中,核酸在病毒载体中。这任意这些实施方式的一些中,对所述基因的特异性结合在所述基因的外显子内和/或在所述基因的部分内,所述基因编码靶抗原的N-末端。这任意这些实施方式的一些中,所述导入由此实现了所述基因中的移码突变和/或在所述基因的编码区内插入早期终止密码子。
这任意这些实施方式的一些中,所述方法还包括将这样的物质导入细胞,相较于经一种或多种条件孵育的没有导入所述物质的对应细胞中PD-1表达或上调,所述物质能够在经所述一种或多种条件孵育的细胞中导致PD-1表达的减少和/或抑制PD-1的上调,其中所述表达的减少和/或上调的抑制是暂时的或瞬时的。在任意这些实施方式的一些中,所述物质在细胞中被诱导型表达或阻遏,从而在所述细胞中造成PD-1表达的条件型减少或破坏。
在一些实施方式中,还提供了产生遗传工程改造的T细胞的方法,其包括(a)将特异性结合抗原的遗传工程改造的抗原受体导入包含T细胞的细胞群,如通过将编码所述抗原受体的核酸分子导入所述细胞;以及(b)将这样的物质导入细胞群,相对于经一种或多种条件下孵育的没有导入所述物质的对应细胞群的T细胞中的PD-1表达和/或上调,所述物质能够在经所述一种或多种条件孵育的所述群中的T细胞中瞬时减少PD-1表达和/或瞬时抑制PD-1上调,其中步骤(a)和(b)同时进行或以任意顺序依次进行,从而将所述遗传工程改造的抗原受体和所述物质导入所述群的T细胞中。
在任意这些实施方式的一些中,调节遗传工程改造的T细胞PD-1表达的方法包括,将这样的物质导入T细胞,相对于经一种或多种条件孵育的没有导入所述物质的对应T细胞中PD-1的表达或上调,所述物质能够使在所述一种或多种条件下孵育后的细胞中的PD-1表达瞬时减少和/或对PD-1上调产生瞬时抑制,所述T细胞包含特异性结合抗原的抗原受体。
在任意这些实施方式的一些中,瞬时降低包括细胞中PD-1表达的可逆降低。在任意这些实施方式的一些中,在具有抗原存在的条件下进行的孵育诱导对应群中PD-1的表达或上调,所述对应群包含未导入所述物质的T细胞。在任意这些实施方式的一些中,抗原存在下的孵育包括在体外孵育所述细胞与抗原。在任意这些实施方式的一些中,抗原存在下的孵育持续如下长度的时间:2小时至48小时,6小时至30小时或12小时至24小时,各自包括端值,或持续少于48小时,少于36小时或少于24小时。在任意这些实施方式的一些中,孵育包括在某些条件下将细胞给予对象,从而使得工程改造的抗原受体就该孵育的至少一部分而言特异性地结合抗原。在任意这些实施方式的一些中,将细胞给予对象后24小时、2天、3天、4天、5天、6天、7天、8天、9天或10天的时间内,孵育诱导表达或上调。在任意这些实施方式的一些中,PD-1表达的减少或对PD-1表达上调的抑制是至少或至少约30%、40%、50%、60%、70%、80%、90%、95%或更多。在任意这些实施方式的一些中,该方法是是离体进行的。
在任意这些实施方式的一些中,所述物质的导入是通过将包含编码所述物质的序列的核酸导入细胞进行的,例如,针对PD-1和/或某一核酸序列的抑制性核酸分子,所述核酸序列与编码PD-1的基因互补或结合。在一些实施方式中,所述物质包括gRNA,所述gRNA具有与编码PD-1的基因的靶结构域互补的靶向结构域,以及与之组合的Cas9分子,如酶失活的Cas9(例如eiCas9)或eiCas融合蛋白,用于减少或阻遏基因表达。在一些实施方式中,所述物质包括核酸分子,其编码至少一个gRNA和/或Cas分子。在一些实施方式中,所述物质包括Cas9分子和gRNA的至少一个复合物,所述gRNA具有与PD-1基因的靶结构域互补的靶向结构域。
在任意这些实施方式的一些中,所述物质在所述细胞中瞬时表达,从而在T细胞中造成PD-1表达的暂时减少或破坏。在任意这些实施方式的一些中,所述物质的表达或活性是条件型的。在任意这些实施方式的一些中,表达受到条件型启动子或增强子或反式激活因子的控制。在任意这些实施方式的一些中,条件型启动子或增强子或反式激活因子是诱导型启动子、增强子或反式激活因子或阻遏型启动子、增强子或反式激活因子。
在任意这些实施方式的一些中,启动子选自RNA pol I、pol II或pol III启动子。在任意这些实施方式的一些中,启动子选自:pol III启动子,其为U6或H1启动子;或pol II启动子,其为CMV、SV40早期区或腺病毒主要晚期启动子。在任意这些实施方式的一些中,启动子是诱导型启动子。在任意这些实施方式的一些中,启动子包括Lac操纵子序列、四环素操纵子序列、半乳糖操纵子序列或多西环素操纵子序列。在任意这些实施方式的一些中,启动子是阻遏型启动子。在任意这些实施方式的一些中,启动子包括Lac阻遏型元件或四环素阻遏型元件。
这任意这些实施方式的一些中,所述物质是抑制性核酸分子,其减少所述细胞中PD-1的表达。这任意这些实施方式的一些中,抑制性核酸分子包括RNA干扰剂。在任意这些实施方式的一些中,抑制性核酸是或包括或编码小干扰RNA(siRNA)、微小RNA适应性shRNA、短发夹RNA(shRNA)、发夹siRNA、前体微小RNA(前-miRNA)或微小RNA(miRNA)。在任意这些实施方式的一些中,抑制性核酸分子包括与编码PD-L1的核酸互补的序列。在任意这些实施方式的一些中,抑制性核酸分子包含与编码PD-L1的核酸互补的反义寡核苷酸。
在提供的方法的任意这些实施方式的一些中,T细胞是CD4+或CD8+T细胞。在任意这些实施方式的一些中,遗传工程改造的抗原受体是功能性非T细胞受体。在任意这些实施方式的一些中,遗传工程改造的抗原受体是嵌合抗原受体(CAR)。在任意这些实施方式的一些中,CAR包括特异性结合所述抗原的胞外抗原识别结构域和包括ITAM的胞内信号转导结构域。在任意这些实施方式的一些中,胞内细胞信号转导结构域包括CD3ζ链的胞内结构域。在任意这些实施方式的一些中,CAR还包括共刺激信号转导区域。在任意这些实施方式的一些中,共刺激信号转导区域包括CD28或4-1BB的信号转导结构域。在任意这些实施方式的一些中,共刺激结构域是CD28。
在任意这些实施方式的一些中,导入遗传工程改造(重组)抗原受体和物质的步骤是同时进行的,所述步骤包括导入这样的核酸分子,所述核酸分子包括编码所述抗原受体的第一核酸(其任选地是第一表达盒)和编码造成PD-1或PD-L1表达减少的物质的第二核酸(其任选地是第二表达盒)。
在任意这些实施方式的一些中,本文提供的方法的任意一些还包括将特异性结合相同或不同抗原的第二遗传工程改造的抗原受体导入细胞群,所述第二抗原受体包含除了CD28以外的共刺激分子。
在一些实施方式中,本文还提供了一种产生遗传工程改造的T细胞的方法,其包括(a)将特异性结合第一抗原的第一遗传工程改造的抗原受体导入包含T细胞的细胞群,所述第一抗原受体包括CD28共刺激分子,其中第一遗传工程改造的抗原受体的导入可以通过向细胞导入编码第一抗原受体的核酸分子来进行;(b)将特异性结合相同或不同抗原的第二遗传工程改造的抗原受体导入包含T细胞的细胞群,如通过导入编码第二抗原受体的核酸分子来进行;和(c)将这样的物质导入包括T细胞的细胞群,相较于经一种或多种条件孵育的未导入所述物质的对应细胞群的T细胞中PD-1和/或PD-L1表达或上调,所述物质能够在经所述一种或多种条件孵育的所述群的T细胞中导致PD-1或PD-L1表达的减少和/或抑制PD-1或PD-L1的上调,从而将第一抗原受体、第二抗原受体和所述物质导入所述群中的T细胞。
在任意这些实施方式的一些中,在具有抗原存在的条件下的孵育诱导对应群中PD-1和/或PD-L1的表达或上调,所述对应群包含未导入所述物质的T细胞。
在任意这些实施方式的一些中,抗原存在下的孵育包括在体外孵育所述细胞与抗原。在任意这些实施方式的一些中,在抗原存在下的孵育持续如下长度的时间:2小时至48小时,6小时至30小时或12小时至24小时,各自包括端值,或持续少于48小时,少于36小时或少于24小时。在任意这些实施方式的一些中,孵育包括在某些条件下将细胞给予对象,从而使得工程改造的抗原受体就该孵育的至少一部分而言特异性地结合抗原。在任意这些实施方式的一些中,将细胞给予对象后24小时、2天、3天、4天、5天、6天、7天、8天、9天或10天的时间内,孵育诱导表达或上调。在任意这些实施方式的一些中,相较于通过不导入物质的方法产生的工程改造的细胞,细胞中PD-1和/或PD-L1的上调或表达被抑制或减少至少或至少约30%、40%、50%、60%、70%、80%、90%、95%或更多。
在任意这些实施方式的一些中,第一和第二遗传工程改造的抗原受体结合相同的抗原。在任意这些实施方式的一些中,第二抗原受体包括不同于CD28的共刺激分子。在任意这些实施方式的一些中,不同于CD28的共刺激分子是4-1BB。在任意这些实施方式的一些中,所述物质造成PD-L1表达的减少和/或对PD-L1上调的抑制。
在任意这些实施方式的一些中,导入第一抗原受体、第二抗原受体和/或所述物质的步骤是同时进行的,所述步骤包括导入这样的核酸分子,所述核酸分子包括编码第一抗原受体的第一核酸(其任选地是第一表达盒)、编码第二抗原受体的第二核酸(其任选地是第二表达盒)和编码造成PD-1或PD-L1表达减少的物质的第三核酸(其任选地是第三表达盒)。在任意这些实施方式的一些中,第一、第二和/或第三核酸,任选地,第一、第二和/或第三表达盒,可操作地连接相同或不同的启动子。在任意这些实施方式的一些中,第一和/或第二核酸,任选地,第一和/或第二表达盒,可操作地连接诱导型启动子或阻遏型启动子,并且第三核酸,任选地,第三表达盒,可操作地连接组成型启动子。
在任意这些实施方式的一些中,所述方法涉及将此类分子或物质导入人细胞。
在一些实施方式中,提供了一种产生遗传工程改造的T细胞的方法,其包括(a)获得包含T细胞的原代细胞群;(b)针对所述群中不表达靶抗原的细胞进行富集;和(c)将特异性结合靶抗原的遗传工程改造的抗原受体导入细胞群;由此产生遗传工程改造的T细胞。
在任意这些实施方式的一些中,所述方法还包括在刺激条件下培养和/或孵育细胞以造成细胞的增殖,其中所述细胞的增殖和/或扩增多于采用所述方法但未针对不表达所述靶抗原的细胞进行富集的方法所产生的细胞中的情况。在任意这些实施方式的一些中,细胞的增殖和/或扩增是至少或至少约1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多。在任意这些实施方式的一些中,针对不表达靶抗原的细胞进行富集包括,在所述群中进行负选择以消耗表达所述靶抗原的细胞,或破坏所述细胞中编码所述靶抗原的基因。
在任意这些实施方式的一些中,刺激条件包括能够活化TCR复合物的一种或多种组分的一种或多种胞内信号转导结构域的物质。
在一些实施方式中,提供了通过本文所述方法中的任意一种产生的细胞。在一些实施方式中,提供了一种药物组合物,其包括所述细胞和药学上接受的运载体。
在一些实施方式中,提供了一种治疗方法,其包括将所述细胞或所述药物组合物给予患有疾病或病症的对象。在任意这些实施方式的一些中,所述细胞以如下剂量方案给予,所述剂量方案涉及:(a)将表达嵌合抗原受体(CAR)的细胞的第一剂量给予对象;和(b)将表达CAR的细胞的继续剂量给予对象,所述继续剂量在当(a)中给予所述对象的表达CAR的细胞的表面上的PD-L1的表达被诱导或上调的时候给予给予所述对象,和/或,所述继续剂量在(a)中的给予开始后至少5天给予所述对象。
在一些实施方式中,提供了这样的方法,其包括(a)将表达嵌合抗原受体(CAR)的细胞的第一剂量给予对象;和(b)将表达CAR的细胞的继续剂量给予对象,所述继续剂量在当(a)中给予所述对象的表达CAR的细胞的表面上的PD-L1的表达被诱导或上调的时候给予所述对象,和/或,所述继续剂量在(a)中的给予开始后至少5天给予所述对象。
在任意这些实施方式的一些中,方法包括在(a)中给予开始后至少或超过约5天并且不到约12天给予继续剂量的细胞。在任意这些实施方式的一些中,第一和/或第二剂量中给予的细胞数量为约0.5x106细胞/kg对象体重至4x106细胞/kg,约0.75x106细胞/kg至3.0x106细胞/kg或约1x106细胞/kg至2x106细胞/kg,各自包括端值。
在任意这些实施方式的一些中,遗传工程改造的抗原受体特异性结合与疾病或病症相关联的抗原。在任意这些实施方式的一些中,疾病或病症是癌症。在任意这些实施方式的一些中,疾病或病症是白血病或淋巴瘤。在任意这些实施方式的一些中,疾病或病症是急性淋巴细胞性白血病。在任意这些实施方式的一些中,疾病或病症是非霍奇金淋巴瘤(NHL)。
附图简要说明
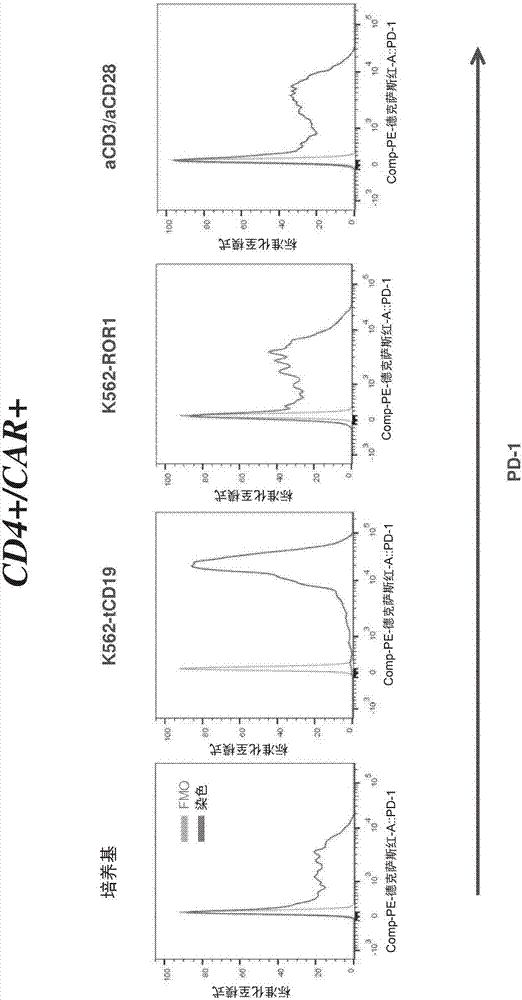
图1A:描绘了如实施例1所述在各种条件下(培养基,K562-tCD19,K562-tROR1,aCD3/aCD28)孵育24小时后,通过流式细胞术检测的在针对CD4和抗CD19嵌合抗原受体(CAR)的阳性表面表达进行门选(门选策略示于上图)的T细胞群上的PD-1、PD-L1和PD-L2的表面表达。
图1B:描述了如实施例1所述在各种条件下(培养基,K562-tCD19,K562-tROR1,aCD3/aCD28)孵育24小时后,通过流式细胞术检测的在针对CD4的阳性表面表达和抗CD19嵌合抗原受体(CAR)的阴性表面表达进行门选(门选策略示于上图)的T细胞群上的PD-1、PD-L1和PD-L2的表面表达。
图2A:描绘了如实施例1所述在各种条件下(培养基,K562-tCD19,K562-tROR1,aCD3/aCD28)孵育24小时后,通过流式细胞术检测的在针对CD8和抗CD19嵌合抗原受体(CAR)的阳性表面表达进行门选(门选策略示于上图)的T细胞群上的PD-1、PD-L1和PD-L2的表面表达。
图2B:描述了如实施例1所述在各种条件下(培养基,K562-tCD19,K562-tROR1,aCD3/aCD28)孵育24小时后,通过流式细胞术检测的在针对CD8的阳性表面表达的和抗CD19嵌合抗原受体(CAR)的阴性表面表达进行门选(门选策略示于上图)的T细胞群上的PD-1、PD-L1和PD-L2的表面表达。
发明详述
除非另外定义,本文使用的所有专业术语、符号和其它技术和科学术语或专有词汇旨在具有本发明所属领域技术人员通常所理解的相同含义。在一些情况中,本文出于阐明和/或便于引用目的对具有常规理解含义的术语加以限定,本文中包括此类限定不应理解为表示与本领域常规理解的有显著差异。
本发明中提及的所有出版物,包括专利文件、学术论文和数据集,均以各个体出版物好似独立地通过引用纳入的相同程度通过引用其全文纳入本文用于所有目的。如果本文所示的定义与通过引用纳入本文的专利、公开申请和其它出版物中所示的定义不同或其它情况下不一致,则相对于通过引用纳入本文的文件中的定义,以本文所示的定义为主。
本文所用章节标题仅用于组织目的,而不应理解为限制所述客体。
I.过继细胞治疗中用于降低免疫阻抑和抑制性相互作用的方法和组合物
提供了用于过继细胞治疗(例如,过继性免疫治疗)中的方法、细胞(如表达遗传工程改造受体(如CAR)的T细胞)、组合物和核酸。在一些方法中,提供的实施方式增强了过继细胞治疗的功效和寿命,例如,在实体瘤或肿瘤微环境中递送免疫抑制性信号。该方法通常涉及破坏某些T细胞抑制性途径或信号的作用,否则这些途径或信号可能会损害癌症治疗中某些所需的效应物功能。因此,提供了在过继细胞治疗中增强T细胞功能的方法和组合物,包括提供改善的功效的那些,如通过提高给予的遗传工程改造(例如,CAR+)细胞的活性和效力,同时维持转移的细胞随时间推移的暴露或持久性。在一些实施方式中,相较于某些现有方法,当将所述遗传工程改造的细胞(如表达CAR的T细胞)体内给予对象时,其表现出提高的扩增和/或持久性。
提供的方法、细胞和组合物调节和/或调整抑制性相互作用(如减小或抑制抑制性相互作用)在用抗原受体工程改造的细胞中(如在包含嵌合抗原受体(CAR)细胞中)的发生。在一些实施方式中,提供的实施方式调节(如降低或抑制)遗传工程改造的T细胞(如表达CAR的细胞)中的程序性死亡-1(PD-1)和其配体PD-L1之间的抑制性相互作用,该抑制性相互作用可能是由这些分子在T细胞的共表达所导致的。因此,在一些实施方式中,与其它方法或产品相比,本文提供的实施方式具有以下方面的益处:通过细胞的抑制性分子的作用,减少或消除遗传工程改造的T细胞(如表达CAR的细胞)中可能出现的功能缺失。
在一些实施方式中,所述组合物和方法涉及破坏经由免疫检验点分子PD-1递送的信号,如通过破坏过继转移的(例如,CAR+)T细胞中的一个或多个PD-1配体的表达来进行。肿瘤细胞和/或肿瘤微环境中的细胞常常上调针对PD-1的配体(如PD-L1和PD-L2),这进而导致表达PD-1的肿瘤特异性T细胞上的PD-1的连接,这递送抑制性信号。肿瘤微环境中的T细胞,例如肿瘤浸润T细胞的PD-1也常常被上调,这可能在通过所述抗原受体的信号或某些其它活化信号后出现。
肿瘤微环境中经诱导以表达PD-1和PD-L1或PD-L2表达型细胞的T细胞之间的相互作用可能会损害抗肿瘤免疫和/或过继转移的T细胞的功能或功效。例如,通过T细胞的PD-1分子的信号转导可以促进耗尽或无反应性,和/或抑制增殖或效应物功能。某些方法已旨在阻断PD-1信号转导或破坏T细胞中PD-1表达,包括在癌症治疗的情况下。这样的阻断或破坏可通过给予阻断性抗体、小分子或抑制性肽,或通过敲除或减少T细胞中(例如,在过继转移的T细胞中)PD-1的表达来进行。然而,转移T细胞中PD-1的破坏可能并不尽如人意。
提供的细胞、组合物和应用是相对于靶向PD-1信号以促进癌症治疗的其它方法而言具有某些优势的那些。例如,提供的是这样的细胞、方法或组合物,其在肿瘤靶向T细胞中抑制抑制性PD-1信号的不利影响,并且不导入某些PD-1靶向方法所导致或与之相关的某些负面影响。
虽然PD-1表达和信号转导可减少某些效应物功能和T细胞的扩增,但是其还与T细胞寿命,分化以及记忆T细胞(例如,长寿和/或中心记忆T细胞)随时间推移的持久性相关联。例如,已显示PD-1信号诱导长寿细胞的生物能量性质。抗肿瘤T细胞中PD-1的破坏(例如,敲减或敲除)可以在短期内改善功效,通过促进细胞扩增、细胞因子的分泌和其它效应物功能,特别是在其中有针对PD-1的配体存在或上调的肿瘤微环境的情况下。然而,且不论这些增强,破坏过继转移的细胞中的PD-1可能会使具有记忆或中心记忆表型的这些细胞的数量或百分比随时间减小。T细胞中PD-1的破坏可导致PD-1-缺陷型T细胞群的中心记忆区室和/或长寿记忆T细胞区室的减少,如中心记忆区室(例如,长寿记忆CD8+T细胞和/或CD8+中心记忆T细胞),和/或降低这些细胞长期存活的可能性。
因此,虽然遗传工程改造T细胞中PD-1的破坏(例如,通过敲减或敲除)可以促进它们的效应物功能,但是长期可能不是最理想的,由于工程改造细胞在记忆区室中的长期留存的能力受损和/或分化成对于长期暴露和抗肿瘤功效可能具有重要性的记忆细胞亚组的能力受损。因此,尽管阻断过继转移的T细胞中PD-1的功能就肿瘤微环境的抑制性信号而言作为促进功效的机制在某些方面具有吸引力,但是从长远来看这可能不是最佳选择。提供了这样的方法和组合物,其用于减小该途径对肿瘤靶向T细胞的负面影响,并且没有可能有损于长期功效的某些负面后果。
在某些方面,提供的组合物和方法部分基于对于PD-L1的观察结果:PD-L1是T细胞检验点分子PD-1的配体,而PD-1通常表达于非T细胞并且负责通过PD-L1将负信号传递至T细胞,PD-L1可以在表达CAR特异性的抗原的细胞存在下培养的表达CAR的T细胞的表面被迅速(例如,在24小时内)上调。本文所述的研究中,虽然PD-L1和PD-1响应这样的信号被迅速上调,但是这两个分子都没有被上调至显著超过在该时间范围内响应模拟通过典型T细胞受体复合物和相关联的共刺激信号(抗-CD3/抗-CD28刺激)的信号的条件的对照样品中所见的水平。因此,在一些实施方式中,本文提供的方法基于本文的观察结果,即在存在对CAR具有特异性的抗原的情况下对表达CAR的T细胞进行孵育可使细胞中的PD-1和PD-L1表达迅速上调。初步的结果表明,在一些方面中,这种上调快速出现,并且在与抗原体外孵育后24小时内出现。相反,在一定条件下进行刺激后,细胞中并未出现PD-1或PD-L1的上调,所述条件经设计以模拟相同时间段内通过典型T细胞受体复合物和相关联的共刺激信号(抗-CD3/抗-CD28刺激)的信号。
因此,这样的细胞在遇到表达靶抗原的肿瘤后,其不仅可以上调PD-1,而且可以上调PD-L1,这将导致负自动调节或通过其它转移或肿瘤环境内的其它T细胞中的转移的T细胞的调节。在某些情况下(例如,在较长的时间范围内),通过TCR复合物响应典型信号,PD-1和/或PD-L1也可以被上调。
换言之,本文的观察表明,在一些情况中,通过工程改造的受体和人工受体的刺激,经由其抗原,可以导致共表达的抑制性分子对的上调,如PD-1和PD-L1,和/或这样的抑制性配对,两个不同的T细胞上各自一个,这可以导致T细胞活性的自下调(self-downregulation)或抑制(或通过反式的T细胞抑制)、扩增或效应物功能,在抗原相遇存在的情况下或在抗原相遇之后。在一些方面中,这种调节或负面影响可能会在更早的时间或更大的程度出现在表达CAR的细胞中,相比T细胞被其天然抗原受体复合物刺激时在一些方面中可能出现的情况。
在一些情况中,此类事件可导致遗传工程改造(例如,CAT+)T细胞在抗原-抗原受体结合后获得衰竭表型(exhausted phenotype),或者当与已经遇到抗原并且上调PD-L1的其它细胞接近时,其进而导致降低的功能性。T细胞的衰竭可导致T细胞功能和/或细胞消耗的逐渐丧失(Yi等(2010)Immunology,129:474-481)。T细胞衰竭和/或T细胞持久性的缺乏是过继细胞治疗功效和治疗效果的障碍;临床试验已经揭示了与抗原受体(例如,CAR)表达型细胞更强和/或更久程度的接触与治疗效果之间的关联。
在一些实施方式中,提供了方法和组合物用于待通过过继方式转移的T细胞(如经工程改造以表达CAR或转基因TCR的细胞)中PD-L1表达的缺失、敲除、破坏或减少,并且在一些方面中,不破坏或在其它情况中不损害这些待通过过继方式转移的细胞中PD-1的表达和功能。因此,转移的细胞能够上调PD-1并且通过不同于其它转移的T细胞的细胞接受信号,这可以改善记忆区室中包括的转移的细胞的寿命。所以,提供的方法在一些方面可以降低自调节的负面影响,同时避免长寿记忆CAR+T细胞的长期损害,否则这可能会在这些细胞中PD-1敲减或敲除的情况中出现。在一些实施方式中,编码PD-1或PD-L1、或PD-1或PD-L1分子的基因或其它核酸或生物分子的表达的减少、缺失、敲除、破坏、降低、破坏,上调的抑制和/或功能的抑制是在基因组水平(例如,敲除、基因编辑、敲入、基因组缺失)、转录水平(例如,转录阻遏、转录敲减)、转录后水平、翻译水平、翻译后水平、细胞运输水平、表面表达水平或功能活性水平上作用。
还提供了这样的方法,其中给予一个或多个继续剂量的工程改造的细胞。如本文所述,细胞中PD-1或PD-1在遇到被工程改造的受体(例如,CAR)识别的抗原后上调时,第一剂量的细胞可能衰竭和/或效果较弱。通过在已经发生或已经观察到发生这种情况的时刻提供新鲜细胞,或者在对象或疾病状态中这种事件通常会出现的时刻提供新鲜细胞,本文提供的方法提供了细胞的新鲜剂量,所述细胞的新鲜剂量未衰竭或无能并且不准备通过PD-L1分子传递负信号,这使暴露增加。
还提供了这样的方法,其中PD-1和/或PD-L1表达在过继转移的细胞中被瞬时和/或诱导性地破坏。例如,在一些实施方式中,所述方法涉及给予能破坏或者减少PD-1或PD-L1表达的物质,其中破坏并不是永久的,从而允许转移后的细胞遇到抗原,扩增并发挥效应物功能(如细胞杀伤或细胞毒性),并且消除或者减小因PD-1/PD-L1上调所致的抑制或衰竭的风险。因为这样的下调是瞬时的,在不与某些长期负面影响(如受损的长寿记忆分化或持久性)相关联的情况中是有利的。瞬时破坏停止后,细胞可以上调并通过PD-1接受信号,促进长寿记忆生成和持久性。在一些实施方式中,瞬时破坏通过表达的下调来提供,例如,通过给予细胞一定的介质,例如一种或多种核酸和/或多肽或其组合或复合物,其在给予之后的有限的时间段内产生靶向破坏的基因表达。瞬时表达可以通过遗传工程改造技术产生,所述遗传工程改造技术将基因置于启动子或增强子或在传递另一信号后(如在给予活化或阻断这种控制的其它物质或化合物后)允许诱导或减少其表达的其它控制系统的控制下。在一些实施方式中,表达的降低是可诱导的,从而允许细胞在不存在PD-L1或PD-1的任何调节的情况下发挥其作用,但是,在给予另一物质后,如在当观察到转移的细胞的持久性将要降低或已经降低时,细胞内的PD-1和/或PD-L1表达可被破坏,其可以是瞬时的或永久的。
还提供了旨在避免离体培养物中检验点分子和配体(例如,PD-1/PD-L1)中的一种或两种上调后的不利或损害性影响的方法,所述离体培养物用于制备和工程改造用于过继细胞治疗的细胞。在本文所述的实施方式中,细胞在不促进所述上调的条件下孵育,如通过使用某些物质进行刺激,而不是使用被细胞表达的CAR特异性结合的抗原进行孵育。这样的物质包括被设计成模拟TCR/共受体信号的那些,如抗-CD3/抗-CD28抗体和/或细胞因子。在一些实施方式中,培养条件并不包括促进PD-1或PD-L1表达的细胞因子或其它物质和/或包括促进细胞寿命或其它所需要的特征的细胞因子。
在一些实施方式中,共刺激抑制性受体或其配体中的一种或两者的表达和/或上调可以负性控制T细胞活化和T细胞功能。PD-1是属于B7:CD28共刺激分子家族的免疫抑制性受体,并且与其配体PD-L1和PD-L2反应以抑制T细胞功能。示例性的PD-1氨基酸和编码核酸序列分别在SEQ ID NO:9和10中列出。在一些实施方式中,编码PD-1的核苷酸是PDCD1基因。据报道,PD-L1一般表达在抗原呈递细胞和/或癌细胞,其在此处与T细胞表达的PD-1相互作用,例如,以抑制T细胞的活化。示例性的PD-1氨基酸和编码核酸序列分别在SEQ ID NO:7和8中列出;同样参见GenBank登录号AF233516。在一些实施方式中,编码PD-L1的核酸是CD274基因。在一些情况中,PD-L1还被报道表达在T细胞。在一些情况中,PD-1和PD-L1的相互作用阻抑细胞毒性T细胞的活性,并且在一些方面中,其可以抑制肿瘤免疫,以提供肿瘤细胞的免疫逃逸。在一些实施方式中,肿瘤微环境中和/或T细胞的PD-L1和PD-1表达可以降低过继T细胞治疗的效力和功效。
因此,在一些实施方式中,本文提供的细胞包括其中某些基因已经被减少或被破坏的那些细胞,这些基因包括编码免疫抑制性分子(如PD-1或PD-L1中的一种或两者)的基因。在一些实施方式中,减少、阻抑或破坏一种或多种抑制性分子(如PD-1或PD-L1中的一种或多种)的表达的步骤是离体进行的。在一些方面中,生成或产生所述遗传工程改造的T细胞的方法包括,将编码遗传工程改造的抗原受体(例如,CAR)的一种或多种核酸和编码一种或多种物质的一种或多种核酸分子导入包含T细胞的细胞群,所述一种或多物质减少或破坏或能够减少或破坏编码免疫抑制性分子(如PD-1或PD-L1中的一种或两者,即抑制性核酸分子)的一种或多种基因。
本文所使用术语“导入”包括将DNA导入细胞的各种体内或体外方法,这样的方法包括转化、转导、转染和感染。载体可用于将DNA编码分子导入细胞。可能的载体包括质粒载体和病毒载体。病毒载体包括逆转录病毒、慢病毒载体、或其它载体,如腺病毒载体或腺相关载体。
包含T细胞的细胞群可以是获得自对象的细胞,如获得自外周血单核细胞(PBMC)样品、未分级分离的T细胞样品、淋巴细胞样品、血液白细胞样品、清血法产物或白细胞去除术产物。在一些实施方式中,可以使用正选择或负选择和富集方法分离或选择T细胞以富集所述群中的T细胞。在一些实施方式中,所述群包含CD4+、CD8+或CD4+和CD8+T细胞。在一些实施方式中,导入编码遗传工程改造的抗原受体的核酸的步骤以及导入所述物质的步骤可以同时或以任意顺序依次进行。在一些实施方式中,导入遗传工程改造的抗原受体(例如,CAR)和一种或多种物质后,将细胞在刺激细胞扩增和/或增殖的条件下培养或孵育。
在一些实施方式中,本文提供的T细胞(如通过本文提供的方法产生的细胞)显示一种或多种抑制性分子(例如,PD-1或PD-L1)的表达的减少和/或对一种或多种抑制性分子(例如,PD-1或PD-L1)的上调的抑制,所述表达或上调发生于所述T细胞在可导致或可能会导致一种或多种抑制性分子的表达和/或上调的其它条件下孵育的情况中。在一些实施方式中,相较于未导入所述物质的对应T细胞在导致一种或多种抑制性分子的表达和/或上调的条件下孵育时的相同的抑制性分子的表达或上调,表达的减少和/或上调的抑制是至少30%、40%、50%、60%、70%、80%、90%、95%或更多。
如本文所用,“对应T细胞”或“包含T细胞的对应细胞群”表示在相同或基本相同的条件下获得、分离、生成、产生和/或孵育的T细胞或细胞,不同之处在于该T细胞或T细胞的群并未导入所述物质。在一些方面,除了不包含所述物质的导入以外,所述细胞或T细胞以与导入所述物质的T细胞或细胞相同或基本相同的方式处理,因此,除了所述物质的导入,可能会影响细胞活性或性质的任何一种或多种条件(包括抑制性分子的上调和表达)在细胞之间没有差异或者没有显著差异。例如,出于评价一种或多种抑制性分子(例如,PD-1和PD-L1)的表达减少和/或上调抑制的目的,将包含所述物质的导入的T细胞和并未包含所述物质的导入的T细胞在已知导致T细胞中一种或多种抑制性分子表达和/或上调的相同条件下孵育。
例如,在一些实施方式中,当T细胞在包括抗原存在的条件下孵育时(其如本文中所示将快速诱导不包含导入的物质的细胞中一种或多种抑制性分子(例如,PD-1或PD-L1)的表达或上调),相较于不包含所述物质的导入的对应T细胞,一种或多种抑制性分子(例如,PD-1或PD-L1)的表达和/或一种或多种抑制性分子(例如,PD-1或PD-L1)的上调被减少或抑制。在一些实施方式中,抗原存在下的孵育包括体外孵育所述细胞与所述抗原,如2小时至48小时,6小时至30小时或12小时至24小时,各自包括端值,或少于48小时,少于36小时或少于24小时。在一些实施方式中,在将细胞给予对象后,发生抗原存在下的体内孵育,这导致细胞暴露于特定抗原并且引起就所述孵育的至少部分而言的抗原与细胞的特异性结合。在一些实施方式中,在不包含所述物质的T细胞中,将细胞给予对象之后至少或约24小时、2天、3天、4天、5天、6天、7天、8天、9天或10天内,抑制性分子(例如,PD-1或PD-L1)的表达或上调被诱导。在一些实施方式中,在将本文提供的包含导入物质的细胞给予对象后的相同时间段内,抑制性分子的表达或上调被减少或抑制。
用于评估T细胞标志物,包括抑制性分子(如PD-1或PD-L1)的水平和/或表达的方法和技术是本领域已知的。用于这些标志物检测的试剂和抗体是本领域已知且易于获得的。用于检测这样的标志物的试验和方法包括但是不限于,流式细胞术,包括胞内流式细胞术,ELISA,ELISPOT,流式微珠阵列或其它多样的方法,Western印迹和其它基于免疫亲和性的方法。在一些实施方式中,评价T细胞上标志物的表面表达包括在给予后检测对象中给予的表达抗原受体(例如,CAR)的细胞。检测对象中表达抗原受体(例如,CAR)的细胞和评价表面标志物的水平在本领域技术人员的能力范围之内。在一些实施方式中,可以通过流式细胞术或其它基于免疫亲和性的方法来检测表达抗原受体(例如,CAR)的细胞(如获得自对象外周血的细胞)的这些细胞特有的标志物的表达,然后可以针对另一种T细胞表面标志物(如抑制性分子(例如,PD-1或PD-L1))对这些细胞进行共同染色。在一些实施方式中,可以生成表达抗原受体(例如,CAR)的T细胞,其包含作为非免疫原性选择表位的截短的EGFR(EGFRt),然后可以将它们用作标志物以检测这样的细胞(参见例如,美国专利号8,802,374)。
在一些实施方式中,减少、阻抑或破坏T细胞(如通过提供的方法产生的T细胞)中一种或多种抑制性分子(如PD-1和/或PD-L1)一段时间,所述一段时间长于细胞离体维持或培养的时间。在一些方面中,进行产生这种细胞的方法,从而在将细胞给予对象之时和/或在将细胞给予对象一段时间之后,减少、阻抑或破坏一种或多种抑制性分子,如PD-1或PD-L1。在一些实施方式中,将细胞给予对象之前不超过2小时、6小时、12小时、24小时、2天、3天或4天的时刻,将所述物质导入离体培养的细胞。
在一些实施方式中,向细胞中导入所述物质,以实现细胞中一种或多种抑制性分子(如PD-1或PD-L1)表达的瞬时或暂时减少。在一些实施方式中,表达或上调的瞬时或暂时减少或抑制持续至少6小时、12小时、24小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天或更久。
在一些实施方式中,向细胞中导入所述物质,以实现细胞中一种或多种抑制性分子(如PD-1或PD-L1)表达的条件型减少和/或上调的条件型抑制。在一些实施方式中,条件型减少或抑制可以是诱导型的,因此只有在存在对诱导型元件(如诱导型启动子)具有特异性的诱导物的情况下,所述物质才在细胞中产生。在一些实施方式中,条件型减少或抑制可以是阻遏型的,因此只有在存在对阻遏型元件(如阻遏型启动子)具有特异性的阻遏物的情况下,所述物质才在细胞中下调。在一些实施方式中,物质可操作地连接诱导型或阻遏型启动子,以分别诱导或阻遏编码所述物质的DNA的转录。如本文所用,“可操作地连接”或“可操作地关联”包括至少两个序列的功能性连接。例如,可操作地连接包括启动子和第二序列之间的连接,其中启动子序列起始并介导对应于第二序列的DNA序列的转录。可操作地关联包括诱导或阻遏型元件和启动子之间的连接,其中所述诱导或阻遏型元件作为所述启动子的转录激活子。
在一些实施方式中,向细胞中导入所述物质,以实现所述细胞中一种或多种抑制性分子的表达的永久的或非瞬时的减少,如通过基因的破坏和/或将一种或多种物质稳定导入细胞来进行。
在一些实施方式中,本文提供的细胞包括细胞中PD-L1的表达被减少或破坏的那些细胞,如通过将能够减少基因表达或破坏编码PD-L1的基因(如CD274)的物质导入来进行。在一些实施方式中,相较于并不包含所述物质的导入的对应T细胞在导致PD-L1表达和/或上调的条件下孵育时PD-L1的表达或上调,PD-L1表达的减少和/或上调的抑制是至少30%、40%、50%、60%、70%、80%、90%、95%或更多。在一些实施方式中,细胞中PD-L1表达的减少或破坏是永久的或非瞬时的。在一些实施方式中,细胞中PD-L1表达的减少或破坏是瞬时的或条件型的。
在一些实施方式中,本文提供的细胞包括细胞中PD-1的表达被瞬时地或条件型地减少、以及在一些情况中非永久地减少的那些细胞。在一些实施方式中,PD-1导致记忆表型T细胞的分化,因此基因的永久减少或破坏可随时间推移对CD8记忆分化具有不利影响。在一些实施方式中,相较于不包含所述物质的导入的对应T细胞在与瞬时作用的时间段相同条件下孵育时PD-L1的表达或上调,PD-L1表达的瞬时(如条件型)减少和/或上调的瞬时(如条件型)抑制是至少30%、40%、50%、60%、70%、80%、90%、95%或更多。
在一些实施方式中,使用瞬时或可逆阻遏策略,如使用反义RNAi或其它RNA干扰剂的基因敲减。本文所用术语“RNA干扰剂”表示这样一类多核苷酸,所述多核苷酸能够抑制或下调基因表达,例如通过以序列特异性的方式介导RNA干扰或基因沉默。例如,RNA干扰剂可以包括但是不限于dsRNA,包括siRNA,以及shRNA,miRNA。述及“抑制”、“下调”或“减少”表达,其指基因产物的表达,和/或对应的靶mRNA分子的水平,和/或由靶mRNA编码的一种或多种基因产物的活性水平被降低至低于不存在RNA干扰剂的情况中观察到的水平,即基线或对照水平。在一些实施方式中,下调或抑制的百分比是约或10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。相应地,在一些实施方式中,“抑制的”或“减少的”或“下调的”靶标的mRNA水平、基因产物水平或基因产物活性可以等于或者大于基线水平或活性的10%、20%、30%、40%、50%、60%、70%、80%、90%。
在一些实施方式中,生成或产生遗传工程改造的T细胞的方法包括,将编码遗传工程改造的抗原受体(例如,CAR)的一种或多种核酸和某一物质导入包含T细胞的细胞群,例如,所述物质是或包括或编码诸如反义RNAi或针对抑制性免疫分子(如PD-1或PD-L1)具有特异性的其它干扰剂的一种或多种物质的一种或多种核酸分子。在一些实施方式中,核酸分子是或包括或编码这样一种或多种物质,所述一种物质或多种物质是小干扰RNA(siRNA)、微小RNA适应性shRNA、短发夹RNA(shRNA)、发夹siRNA、前体微小RNA(前-miRNA)、初级-miRNA或微小RNA(miRNA)。
在一些实施方式中,导入细胞的一种或多种物质能够破坏编码抑制性分子(PD-L1)的基因。在一些实施方式中,破坏是通过缺失,例如,整个基因、外显子或区域的缺失,和/或用外源性序列进行替代,和/或通过突变,例如,移码或错义突变,在基因内,一般在基因的外显子内,来实现抑制。在一些实施方式中,破坏导致提早终止密码子(premature stop codon)被纳入基因中,因此抑制性分子(例如,PD-1或PD-L1)不被表达或者不以能够在细胞表面上表达和/或能够介导细胞信号转导的形式被表达。一般在DNA水平上进行破坏。破坏一般是永久的、不可逆的,或者不是瞬时的。
在一些方面中,通过基因编辑,如使用DNA结合蛋白或DNA-结合核酸来进行破坏,其特异性结合或杂交破坏所靶向的区域处的基因。在一些方面中,蛋白质或核酸与核酸酶偶联或复合,如以嵌合或融合蛋白的形式。例如,在一些实施方式中,使用这样的融合体来实现破坏,所述融合体包括DNA-靶向蛋白和核酸酶,如锌指核酸酶(ZFN)或TAL-效应子核酸酶(TALEN)、或RNA-引导的核酸酶,如成簇规律间隔短回文核酸(CRISPR)-Cas系统,如CRISPR-Cas9系统,其对被破坏的核酸有特异性。在一些实施方式中,产生或生成遗传工程改造的T细胞的方法包括,将编码遗传工程改造的抗原受体(例如,CAR)的一种或多种核酸和编码靶向PD-L1的物质的一种或多种核酸导入包含T细胞的细胞群,所述靶向PD-L1的物质是对PD-L1具有特异性的基因编辑核酸酶,如DNA-靶向蛋白和核酸酶的融合体,如ZFN或TALEN,或RNA-引导的核酸酶,如CRISPR-Cas9系统。
在一些实施方式中,本文提供的减少或抑制遗传工程改造的细胞(如表达CAR的细胞)中抑制性相互作用的方法涉及,在给予细胞的第一剂量后,给予一个或多个重复或继续剂量的细胞。在一些情况中,给予的细胞的第一或前施剂量可在遇到遇到靶抗原受体或其它T细胞活化刺激,一种或多种抑制性分子,如PD-1和/或PD-L1(例如,在细胞表面)之后最终使其上调。这类分子的上调可能导致T细胞的功能丧失和/或耗尽,并且例如可能损害对细胞的长期暴露。与对象中存在的细胞相比,重复或继续剂量的细胞可用于递送不表达抑制性分子,例如PD-1和/或PD-L1,或以较低水平表达它们的细胞。在一些实施方式中,在继续剂量中,其中的细胞(或其中超过50、40、30、20、10或5%的细胞)不表达或不显著表达(或以与参考细胞群相同的程度表达)抑制性分子,例如,仅在给予的细胞以低水平表达,例如,比当在诱导所述分子表达的条件下刺激时和/或当通过暴露于被CAR识别的抗原刺激时细胞的抑制性分子表达的最高水平低或约低70%、60%、50%、40%、30%、20%、10%、5%或更低的水平。在一些实施方式中,不表达或不显著表达抑制性分子(例如PD-1和PD-L1)的重复剂量的细胞可以延长具有强健功能的表达CAR的T细胞或功能性的表达CAR的T细胞在对象中存在的时间。在一些实施方式中,通过给予一个或多个继续剂量来补充遗传工程改造的T细胞的群体可导致对于表达抗原受体(例如,CAR)的细胞的更大和/或更久程度的暴露并改善治疗结果。在一些实施方式中,与参考水平或群相比,PD-L1或PD-1上调时,如与临给予对象之前的第一剂量的组合物中的细胞相比,PD-L1或PD-1的表面表达与参考群相比上调例如至少10%、20%、30%、40%、50%、60%、70%或80%更高的程度时,给予继续剂量。
由继续剂量的细胞表达的受体(例如CAR)一般特异性结合与第一剂量的CAR相同的抗原,并且通常是与第一剂量的细胞的受体相同的受体或极相似的受体。在一些实施方式中,继续剂量中细胞的受体与第一剂量的细胞中的受体相同或者与该受体有大的相同性。
在一些实施方式中,由继续剂量的细胞表达的CAR包含与由第一剂量的细胞表达的CAR相同的scFv,相同的信号转导结构域和/或相同的连接。在一些实施方式中,其还包含与第一剂量相同的共刺激、刺激、跨膜和/或其它结构域。在一些实施方式中,继续剂量的CAR的一种或多种组分不同于第一剂量的CAR。
在任意提供的方法的一些方面中,遗传工程改造的细胞是以离体的方法在这样的条件下产生或生成的,所述条件中一种或多种抑制性分子(如PD-1和/或PD-L1)没有被诱导或上调或没有被显著诱导或上调,或与其它条件相比被上调或诱导至较低的程度。在一些实施方式中,在给予对象之前,可以测定或监测遗传工程改造的T细胞的PD-1和/或PD-L1表达的水平,以确证所述细胞不表达或不显著表达一种或多种抑制性分子。可采用用于评价重组分子的表达水平的许多熟知的方法,例如通过如下方法的检测:基于亲和性的方法,例如,基于免疫亲和性的方法,例如,在细胞表面蛋白质方面,例如通过流式细胞术。在一些情况中,表达水平可以与在已知将会诱导分子表达的条件下刺激的细胞中的表达水平相比。例如,如本文所述,诱导分子表达的条件可以包括,在一些情况中,经由工程改造的抗原受体(如CAR)的抗原刺激。同样,诱导T细胞活化的其它条件,如经由天然TCR/CD28信号转导途径的刺激,也可以诱导抑制性分子(如T细胞的PD-1和PD-L1)的表达。在一些实施方式中,使用这样的条件,其中PD-1被上调或被上调至与参考条件相同或相似程度,但是其中PD-L1表达或上调被阻断没有被上调,或没有被显著上调,或与参考条件相比上调至较低的程度。
在一些实施方式中,提供了包含遗传工程改造的细胞(如表达CAR的细胞),其在体内给予对象时,表现出提高的持久性。在一些实施方式中,给予之后,对象中的遗传工程改造的细胞(例如表达CAR的T细胞)的持久性大于通过可供替代的方法可以实现的持久性,所述可供替代的方法例如涉及给予通过如下方法遗传工程改造的细胞的那些,所述方法中T细胞未被导入能够减少或破坏涉及抑制免疫应答的基因(PD-1和/或PD-L1)的物质。在一些方面,与通过给予包含遗传工程改造的抗原受体(如表达CAR的细胞)的细胞群(其中组合物中的细胞能够响应通过工程改造的和人工的受体经由特定抗原的刺激而表达或上调抑制性配体PD-L1)可以实现的持久性相比,本文提供的细胞(如通过本文提供的方法产生的细胞)的持久性更大。
在一些实施方式中,持久性增大至少或至少约1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、50倍、60倍、70倍、80倍、90倍、100倍或更多。
在一些实施方式中,细胞给予对象后,可以对给予的细胞的持久性的程度或范围进行检测或定量。例如,在一些方面,使用定量PCR(qPCR)来评价在对象的血液或血清或器官或组织(例如疾病部位)中表达重组受体的细胞(例如,表达CAR的细胞)的量。在一些方面,持久性被定量为每微克DNA中编码受体,例如CAR的DNA或质粒的拷贝,或作为每微升样品例如,血液或血清的受体表达,例如CAR表达细胞的数量,或每微升样品的外周血单核细胞(PBMC)或白细胞或T细胞的总数。在一些实施方式中,也可以进行通常使用对受体具有特异性的抗体来检测表达受体的细胞的流式细胞试验。还可以使用基于细胞的测定来检测功能细胞的数量或百分比,如能够结合和/或中和和/或诱导针对疾病或病症或表达被受体识别的抗原的细胞的应答(例如,细胞毒性应答)。在这些实施方式的任意一项中,可以使用与重组受体相关联的另一标志物(例如,表达CAR的细胞)的表达的水平或程度在对象中区分给予的细胞和内源性细胞。
还提供了所述细胞的用途和方法,如在治疗癌症中的过继治疗中的用途和方法。还提供了用于工程改造、制备、和产生该细胞的方法,含有该细胞的组合物,以及含有并用于使用、产生和给予该细胞的装置和试剂盒。还提供了用于产生工程改造的细胞的方法、化合物和组合物。提供了用于细胞分离、遗传工程改造和基因减少或破坏的方法。提供了核酸,如构建体,例如,编码遗传工程改造的抗原受体和/或编码用于造成减少或破坏的物质的病毒载体,以及用于向细胞中导入这类核酸的方法,如通过转导。还提供了包含工程改造的细胞的组合物,以及用于向对象给予细胞或组合物,如用于过继细胞治疗的方法、试剂盒和装置。在一些方面中,细胞从对象中分离,经工程改造,并给予同一对象。在其他方面中,它们从一个对象中分离,经工程改造,并给予另一个对象。
II.遗传工程改造的细胞和T细胞
提供了用于过继细胞治疗(例如,过继免疫治疗)的细胞以及用于产生或生成该细胞的方法。该细胞包括免疫细胞,如T细胞。一般通过导入一种或多种遗传工程改造的核酸或其产物来对细胞进行工程改造。这类产物包括遗传工程改造的抗原受体,包括遗传工程改造的T细胞受体(TCR)和功能性非TCR抗原受体,例如嵌合抗原受体(CAR),包括活化、刺激性和共刺激性CAR,及其组合。在一些实施方式中,还向细胞同时或依次导入编码遗传工程改造的抗原受体的核酸,以及是或包括或编码能够减少、阻抑或破坏免疫抑制性分子(如细胞中的PD-1和PD-L1)的物质的核酸。
A.细胞
在一些实施方式中,细胞,例如,工程改造的细胞是真核细胞,如哺乳动物细胞,例如,人细胞。在一些实施方式中,细胞衍生自血液、骨髓、淋巴或淋巴器官,是免疫系统的细胞,如先天或适应性免疫的细胞,例如,骨髓或淋巴样细胞,包括淋巴细胞,一般是T细胞和/或NK细胞。其他示例性的细胞包括干细胞,如专能(multipotent)和多能(pluripotent)干细胞,包括诱导性多能干细胞(iPSC)。在一些方面中,细胞是人细胞。细胞一般是原代细胞,如直接从对象分离和/或从对象分离并冷冻的那些细胞。在一些实施方式中,细胞包括T细胞或其他细胞类型的一个或多个亚组,如全T细胞群、CD4+细胞、CD8+细胞及其亚群,如由功能、活化状态、成熟、分化潜力、扩增、再循环、定位,和/或持续能力、抗原特异性、抗原受体类型、特定器官或区室中的存在、标志物或细胞因子分泌概况,和/或分化程度限定的那些。关于待治疗的对象,细胞可以是同种异体和/或自体的。方法包括现成的方法。在一些方面中,如对于现成的技术,细胞是多能和/或专能的,如干细胞,如诱导性多能干细胞(iPSC)。在一些实施方式中,该方法包括从对象分离细胞,对其进行制备、处理、培养和/或工程改造,如本文所述,并且在冷冻保存前或后将其再导入同一患者。
T细胞和/或CD4+和/或CD8+T细胞的亚型和亚群包括:原初T(TN)细胞、效应T细胞(TEFF)、记忆T细胞及其亚型,如干细胞记忆T(TSCM)、中心记忆T(TCM)、效应记忆T(TEM)、或最终分化的效应记忆T细胞、肿瘤-浸润性淋巴细胞(TIL)、不成熟T细胞、成熟T细胞、辅助性T细胞、细胞毒性T细胞、粘膜相关的非变体T(MAIT)细胞、天然产生的和过继性调节T(Treg)细胞、辅助性T细胞,如TH1细胞、TH2细胞、TH3细胞、TH17细胞、TH9细胞、TH22细胞、滤泡辅助性T细胞、α/βT细胞,和δ/γT细胞。
在一些实施方式中,富集或消耗的T细胞群中的一种或多种是:呈阳性(标志物+)或表达高水平(标志物高)的一种或多种具体标志物(例如表面标志物)的细胞,或呈阴性(标志物-)或表达相对较低的水平(标志物低)的一种或多种标志物的细胞。在一些情况中,此类标志物在某些T细胞群(例如非记忆细胞)上不存在或以相对较低的水平表达,但在某些其它T细胞群(例如记忆细胞)上存在或以相对较高的水平表达的那些。在一个实施方式中,对所述细胞(如CD8+细胞或T细胞,例如,CD3+细胞)富集(即,正选择)CD45RO、CCR7、CD28、CD27、CD44、CD127和/或CD62L呈阳性或表达高表面水平的CD45RO、CCR7、CD28、CD27、CD44、CD127和/或CD62L的细胞,和/或,消耗(例如,负选择)CD45RA阳性或表达高表面水平的CD45RA的细胞。在一些实施方式中,对细胞富集或消耗CD122、CD95、CD25、CD27和/或IL7-Rα(CD127)阳性细胞或表达高表面水平的CD122、CD95、CD25、CD27和/或IL7-Rα(CD127)的细胞。在一些实例中,对CD8+T细胞富集CD62L和CD45RO阳性(或CD45RA阴性)细胞。
在一些实施方式中,对CD4+T细胞群和CD8+T细胞亚群,例如,富集中心记忆(TCM)细胞的亚群。
在一些实施方式中,细胞是自然杀伤(NK)细胞。在一些实施方式中,细胞是单核细胞或粒细胞,例如,骨髓细胞、巨噬细胞、嗜中性粒细胞、树突细胞、肥大细胞、嗜酸性粒细胞,和/或嗜碱性粒细胞。
B.遗传工程改造的抗原受体
在一些实施方式中,细胞包括通过遗传工程改造导入的一种或多种核酸,以及这类核酸经遗传工程改造的产物。在一些实施方式中,核酸是异源性的,即,通常不存在于细胞或从该细胞获得的样品中,如从另一个生物体或细胞获得的样品,其例如通常不在工程改造中的细胞和/或这类细胞来源的生物体中发现。在一些实施方式中,核酸不是天然存在的,如核酸不是自然中发现的,包括包含编码来自多种不同细胞类型的各种结构域的核酸的嵌合组合。
1.嵌合抗原受体(CAR)
细胞通常表达重组受体,如抗原受体,包括功能性非TCR抗原受体,例如,嵌合抗原受体(CAR),和其它抗原结合受体如转基因T细胞受体(TCR)。受体包括其他嵌合受体。
示例性的抗原受体,包括CAR,以及用于工程改造和将受体导入细胞中的方法,包括例如,在国际专利申请公开号WO200014257、WO2013126726、WO2012/129514、WO2014031687、WO2013/166321、WO2013/071154、WO2013/123061,美国专利申请公开号US2002131960、US2013287748、US20130149337,美国专利号6,451,995、7,446,190、8,252,592、8,339,645、8,398,282、7,446,179、6,410,319、7,070,995、7,265,209、7,354,762、7,446,191、8,324,353、和8,479,118,和欧洲专利申请号EP2537416中所述的那些,和/或Sadelain等,Cancer Discov.2013年4月;3(4):388–398;Davila等,(2013)PLoS ONE 8(4):e61338;Turtle等,Curr.Opin.Immunol.,2012年10月;24(5):633-39;Wu等,Cancer,2012年3月18(2):160-75中所述的那些。在一些方面中,所述抗原受体包括美国专利号7,446,190中所述的CAR,和国际专利申请公开号WO/2014055668A1中所述的那些。CAR的实例包括任何上述出版物中公开的CAR,例如WO2014031687,US 8,339,645,US 7,446,179,US 2013/0149337,美国专利号7,446,190,美国专利号8,389,282,Kochenderfer等,2013,Nature Reviews Clinical Oncology,10,267-276(2013);Wang等,(2012)J.Immunother.35(9):689-701;和Brentjens等,Sci Transl Med.2013 5(177)。还参见WO2014031687、US 8,339,645、US 7,446,179、US 2013/0149337、美国专利号7,446,190和美国专利号:8,389,282。嵌合受体,例如CAR通常包括细胞外抗原结合结构域,如抗体分子的一部分,通常是抗体的可变重(VH)链区和/或可变轻(VL)链区,例如,scFv抗体片段。
在一些实施方式中,受体靶向的抗原是多肽。在一些实施方式中,其是糖或其他分子。在一些实施方式中,与正常或非靶向的细胞或组织相比,抗原在疾病或病症的细胞,例如,肿瘤或致病性细胞上选择性表达或过表达。在其他实施方式中,抗原在正常细胞上表达和/或在工程改造的细胞上表达。
在一些实施方式中,受体靶向的抗原包括孤儿酪氨酸激酶受体RORl、tEGFR、Her2、Ll-CAM、CD19、CD20、CD22、间皮素、CEA、和乙型肝炎表面抗原、抗叶酸受体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3、或4、FBP、胎儿乙酰胆碱e受体、GD2、GD3、HMW-MAA、IL-22R-α、IL-13R-α2、kdr、κ轻链、Lewis Y、L1-细胞粘附分子、MAGE-A1、间皮素、MUC1、MUC16、PSCA、NKG2D配体、NY-ESO-1、MART-1、gp100、癌胚抗原、ROR1、TAG72、VEGF-R2、癌胚抗原(CEA)、前列腺特异性抗原、PSMA、Her2/neu、雌激素受体、孕酮受体、酪氨酸蛋白激酶B2、CD123、c-Met、GD-2,和MAGE A3、CE7、维尔姆斯瘤(WT-1)、细胞周期蛋白如细胞周期蛋白A1(CCNA1)和/或生物素化分子,和/或通过HIV、HCV、HBV或其它病原体表达的分子。
在一些实施方式中,CAR结合病原体特异性抗原。在一些实施方式中,所述CAR对病毒抗原(例如HIV,HCV,HBV等),细菌抗原,和/或寄生性抗原具有特异性。
在一些实施方式中,重组受体(例如,CAR)的抗体部分还包括免疫球蛋白恒定区的至少部分,如铰链区,例如,IgG4铰链区,和/或CH1/CL和/或Fc区。在一些实施方式中,恒定区或部分是人IgG的,例如IgG4或IgG1的。在一些方面中,恒定区的部分作为抗原-识别部分,例如,scFv,和跨膜结构域之间的间隔物区域。所述间隔物可具有这样的长度,相较于该间隔物不存在的情况,该长度在抗原结合之后提供增加细胞响应性。示例性间隔物,例如,铰链区,包括描述于国际专利申请公开号WO2014031687中的那些。在一些实例中,间隔物长度为或约为12个氨基酸或长度不超过12个氨基酸。示例性的间隔物包括具有如下长度的那些:至少约10至229个氨基酸、约10至200个氨基酸、约10至175个氨基酸、约10至150个氨基酸、约10至125个氨基酸、约10至100个氨基酸、约10至75个氨基酸、约10至50个氨基酸、约10至40个氨基酸、约10至30个氨基酸、约10至20个氨基酸或约10至15个氨基酸,并且包括上述所列范围的任何端点之间的整数。在一些实施方式中,间隔物区具有约12个氨基酸或更短,约119个氨基酸或更短或约229个氨基酸或更短。示例性间隔物包括单独IgG4铰链,连接CH2和CH3结构域的IgG4铰链或连接CH3结构域的IgG4铰链。
该抗原识别结构域一般连接一个或多个胞内信号转导部分,如在CAR的情况中,通过抗原受体复合物(例如TCR复合物)和任选地相关联的共刺激剂信号模拟活化的信号转导部分,和/或通过另一细胞表面受体的信号。因此,在一些实施方式中,抗原-结合组分(例如,抗体)与一个或多个跨膜和胞内信号转导结构域连接。在一些实施方式中,跨膜结构域融合胞外结构域。在一个实施方式中,使用天然关联受体(例如CAR)中的结构域之一的跨膜结构域。在一些情况中,跨膜结构域通过氨基酸取代来选择或修饰,以避免这类结构域结合相同或不同表面膜蛋白的跨膜结构域,以使与受体复合物的其它成员的相互作用最小化。
在一些实施方式中,所述跨膜结构域源自天然或合成来源。当所述来源是天然来源时,在一些方面中,所述结构域源自任何膜结合或跨膜蛋白。跨膜区包括源自T-细胞受体的α、β或ζ链,CD28,CD3ε,CD45,CD4,CD5,CDS,CD9,CD16,CD22,CD33,CD37,CD64,CD80,CD86,CD134,CD137,CD154的那些(即包含至少它们的跨膜区域)。或者,在一些实施方式中,所述跨膜结构域是合成的。在一些方面中,所述合成跨膜结构域主要包括疏水残基例如亮氨酸和缬氨酸。在一些方面中,苯丙氨酸、色氨酸和缬氨酸的三聚体将出现在合成的跨膜结构域的各末端。在一些实施方式中,所述连接通过接头、间隔物和/或跨膜结构域发生。
胞内信号转导结构域包括模拟或近似通过天然抗原受体的信号(例如,CD3信号)、通过此类受体联合共刺激受体的信号(CD3/CD28信号),和/或通过单独共刺激受体的信号的那些。在一些实施方式中,存在短的寡肽或多肽接头,例如,长度为2至10个氨基酸的接头,例如包含甘氨酸和丝氨酸(例如,甘氨酸-丝氨酸双联体)的接头,并在CAR的胞质信号转导结构域和跨膜结构域之间形成连接。
所述受体(例如,CAR),一般包括至少一种的一个或多个胞内信号转导部分。在一些实施方式中,所述受体包括TCR复合物的胞内组分,例如介导T-细胞活化和细胞毒性的TCR CD3链,例如,CD3ζ链。因此,在一些方面中,抗原-结合部分连接一个或多个细胞信号转导模块。在一些实施方式中,细胞信号转导模块包括CD3跨膜结构域、CD3胞内信号转导结构域,和/或其它CD跨膜结构域。在一些实施方式中,所述受体,例如,CAR,还包括一种或多种其它分子的部分,例如Fc受体γ、CD8、CD4、CD25或CD16。例如,在一些方面中,CAR或其它嵌合受体包括CD3ζ(CD3-ζ)或Fc受体γ与CD8、CD4、CD25或CD16之间的嵌合分子。
在一些实施方式中,在CAR或其它嵌合受体结合时,受体的细胞质结构域或胞内信号转导结构域活化免疫细胞的正常效应功能或应答中的至少一种,例如经工程改造以表达CAR的T细胞。例如,在一些情况中,CAR诱导T细胞的功能,如溶细胞活性或辅助性T细胞活性,如细胞因子或其它因子的分泌。在一些实施方式中,采用抗原受体部分或共刺激分子的胞内信号转导结构域的截短部分来替代完整免疫刺激链,例如,如果其转导效应物功能信号的话。在一些实施方式中,胞内信号转导结构域包括T细胞受体(TCR)的胞质序列,并且在一些方面中,还包括天然情况下存在的共受体的那些与这些受体一致作用以在抗原受体接合后启动信号转导。
在天然TCR的情况中,完全活化一般不仅需要通过TCR的信号转导,而且还需要共刺激信号。因此,在一些实施方式中,为了促进完全活化,在CAR中诱导了用于生成第二或共刺激信号的组分。在其他实施方式中,CAR不包括用于生成共刺激信号的组分。在一些方面中,其他CAR在同一细胞中表达并且提供用于生成第二或共刺激信号的组分。
在一些方面中,T细胞活化被描述为通过两类胞质信号转导序列介导:通过TCR起始抗原依赖性第一活化的那些(第一胞质信号转导序列),和以抗原非依赖性方式作用以提供第二或共刺激信号的那些(第二胞质信号转导序列)。在一些方面中,CAR包括此类信号转导组分之一或两者。
在一些方面中,CAR包括主要胞质信号转导序列,其调节TCR复合物的初始活化。以刺激方式作用的第一胞质信号转导序列可包含信号转导基序,其已知是免疫受体基于酪氨酸的活化基序或ITAM。ITAM的实例包括第一胞质信号转导序列,其包括源自如下的那些:TCRζ,FcRγ,FcRβ,CD3γ,CD3δ,CD3ε,CDS,CD22,CD79a,CD79b,和CD66d。在一些实施方式中,CAR中的胞质信号转导分子包含胞质信号转导结构域,其部分或源自CD3ζ的序列。
在一些实施方式中,所述CAR包括共刺激受体的跨膜部分和/或信号转导结构域,例如CD28、4-1BB、OX40、DAP10,和ICOS。在一些方面中,同一CAR同时包括活化和共刺激部分。
在一些实施方式中,活化结构域包括在一个CAR内,而共刺激组分由识别另一种抗原的另一CAR提供。在一些实施方式中,CAR包括活化或刺激CAR、共刺激CAR,其均表达在同一细胞上(参见WO2014/055668)。在一些方面,细胞包括一种或多种刺激或活化CAR和/或共刺激CAR。在一些实施方式中,细胞还包括抑制性CAR(iCAR,参见Fedorov等,Sci.Transl.Medicine,5(215)(2013年12月)),如识别除了与疾病或病症相关和/或特异性的CAR,由此通过所述疾病靶向CAR递送的激活信号通过抑制性CAR与其配体结合而减少或抑制,例如减少脱靶效应。
在某些实施方式中,所述胞内信号转导结构域包含CD28跨膜和信号转导结构域,其连接至CD3(例如,CD3-ζ)胞内结构域。在一些实施方式中,胞内信号转导结构域包括了嵌合CD28和CD137(4-1BB,TNFRSF9)共刺激结构域,其连接CD3ζ胞内结构域。
在一些实施方式中,CAR涵盖一个或多个,例如,两个或更多个,共刺激结构域和活化结构域,例如,胞质部分中的初始活化结构域。示例性的CAR包括CD3-ζ、CD28和4-1BB的胞内部分。
在一些实施方式中,CAR或其它抗原受体还包括标志物,例如细胞表面标志物,其可用于确定所述细胞用于表达所述受体的转导或工程改造,例如细胞表面受体的截短形式,例如截短的EGFR(tEGFR)。在一些方面,标记物包括CD34、NGFR或表皮生长因子受体(例如tEGFR)的全部或部分(例如截短形式)。在一些实施方式中,编码标志物的核酸可操作性地连接编码接头序列(例如可切割接头序列,例如,T2A)的多核苷酸。参见WO2014031687。
在一些实施方式中,标志物是分子,例如,细胞表面蛋白质,其非天然见于T细胞上的或非天然见于T细胞表面或其部分。
在一些实施方式中,所述分子是非自体分子,例如,非自体蛋白质,即,不被待向其过继转移所述细胞的宿主的免疫系统识别为“自身”的蛋白质。
在一些实施方式中,所述标志物无治疗性功能和/或除了用作遗传工程改造的标志物(例如,用于选择成功地工程改造的细胞)之外没有任何作用。在其它实施方式中,标志物可以是治疗性分子或在其它情况中发挥一些所需效果的分子,如用于待在体内遇到的细胞的配体,如共刺激或免疫检查点分子,以增强和/或减弱细胞在过继转移和遇到配体之后的响应。
在一些情况中,CAR被称为第一、第二和/或第三代CAR。在一些方面中,第一代CAR是在抗原结合时仅提供CD3链诱导信号的CAR;在一些方面中,第二代CAR是提供这样的信号和共刺激信号的CAR,如包括来自共刺激受体(例如CD28或CD137)的胞内信号转导结构域的CAR;在一些方面,第三代CAR是包括不同共刺激受体的多个共刺激结构域的CAR。
在一些实施方式中,嵌合抗原受体包括包含抗体或抗体片段的胞外部分。在一些方面,嵌合抗原受体包括包含抗体或片段的胞外部分和胞内信号转导结构域。在一些实施方式中,所述抗体或片段包括scFv,且所述胞内结构域包含ITAM。在一些方面中,所述胞内信号转导结构域包括CD3-ζ链的ζ链的信号转导结构域。在一些实施方式中,所述嵌合抗原受体包括跨膜结构域,其连接胞外结构域和胞内信号转导结构域。在一些方面中,所述跨膜结构域包含CD28的跨膜部分。在一些实施方式中,所述嵌合抗原受体包含T细胞共刺激分子的细胞内结构域。在一些方面中,T细胞共刺激分子是CD28或41BB。
术语“多肽”和“蛋白质”可互换使用,表示氨基酸残基的聚合物,并且不限于最小长度。包括提供的受体和其他多肽(例如接头或肽)的多肽可以包括氨基酸残基,包括天然和/或非天然氨基酸残基。该术语还包括多肽的表达后修饰,例如糖基化、唾液酸化、乙酰化和磷酸化。在一些方面中,所述多肽可包含对原始或天然序列进行的修饰,只要该蛋白质保留所需活性即可。这些修饰可以是有意的,例如通过定点诱变,或者可以是意外的,例如通过产生蛋白质的宿主突变或PCR扩增所致的误差。
2.TCR
在一些实施方式中,遗传工程改造的抗原受体包括重组T细胞受体(TCR)和/或从天然产生的T细胞克隆的TCR。在一些实施方式中,鉴定分离自患者的针对靶抗原(例如,癌症抗原)的高亲和力T细胞克隆,并导入所述细胞。在一些实施方式中,针对靶抗原的TCR克隆已在用人免疫系统基因(例如,人白细胞抗原系统,或HLA)工程改造的转基因小鼠中产生。参见例如,肿瘤抗原(参见例如,Parkhurst等,(2009)Clin Cancer Res.15:169–180和Cohen等.(2005)J Immunol.175:5799–5808)。在一些实施方式中,使用病原体展示以针对靶抗原的分离TCR(参见例如,Varela-Rohena等,(2008)Nat Med.14:1390–1395和Li(2005)Nat Biotechnol.23:349–354)。
在一些实施方式中,在获得T-细胞克隆之后,将TCRα和β链分离并克隆进入基因表达载体。在一些实施方式中,所述TCRα和β基因通过小核糖核酸病毒2A核糖体跳跃肽(skip peptide)连接,从而两条链共同表达。在一些实施方式中,TCR的遗传转移(genetic transfer)通过逆转录病毒或慢病毒载体,或通过转座子完成(参见例如,Baum等(2006)Molecular Therapy:The Journal of the American Society of Gene Therapy.18:1748–1757;和Hackett等.(2010)Molecular Therapy:The Journal of the American Society of Gene Therapy.18:674–683)。
3.多靶向
在一些实施方式中,细胞和方法包括多靶向策略,如在细胞上表达两种或更多种遗传工程改造的受体,其各自识别相同或不同抗原,并且一般各自包含不同的胞内信号转导组分。这类多靶向策略描述于,例如,国际专利申请公开号WO 2014055668A1(描述了活化和共刺激性CAR的组合,例如,靶向在脱靶,例如正常细胞上独立存在但仅在待治疗的疾病或病症的细胞上一起存在的2种不同抗原)和Fedorov等,Sci.Transl.Medicine,5(215)(2013年12月)(描述了表达活化和抑制性CAR的细胞,如其中活化CAR结合正常或非疾病细胞以及待治疗疾病或病症的细胞上同时表达的抗原,并且抑制性CAR结合仅在正常细胞或不希望治疗的细胞上表达的另一种抗原的那些策略)。
例如,在一些实施方式中,细胞包括表达第一遗传工程改造的抗原受体(例如,CAR或TCR)的受体,其能够诱导针对该细胞的活化信号,一般在特异性结合至由第一受体识别的抗原,例如第一抗原之后。在一些实施方式中,细胞还包括第二传工程改造的抗原受体(例如,CAR或TCR),例如,嵌合共刺激受体,其能够诱导针对免疫细胞的共刺激信号,一般在特异性结合至由第二受体识别的第二抗原之后。在一些实施方式中,第一抗原和第二抗原是相同的。在一些实施方式中,第一抗原和第二抗原是不同的。
在一些实施方式中,所述第一和/或第二遗传工程改造的抗原受体(例如,CAR或TCR)能够诱导针对细胞的活化信号。在一些实施方式中,受体包括包含ITAM或ITAM-样基序的胞内信号转导组分。在一些实施方式中,由第一受体诱导的活化包括细胞中的蛋白质表达改变或信号转导,其导致引发免疫应答,如ITAM磷酸化和/或引发ITAM-介导的信号转导级联,位于结合受体附近簇集分子(例如,CD4或CD8等)和/或形成免疫学突触,一种或多种转录因子(如NF-κB和/或AP-1)的活化,和/或诱导因子如细胞因子的表达、增殖和/或存活。
在一些实施方式中,所述第一和/或第二受体包括共刺激受体的胞内信号转导结构域,如CD28、CD137(4-1BB)、OX40、和/或ICOS。在一些实施方式中,所述第一和第二受体包括不同的共刺激受体的胞内信号转导结构域。在某一实施方式中,第一受体包含CD28共刺激信号转导区域,而第二受体包含4-1BB共刺激信号转导区域,或反之亦然。
在一些实施方式中,所述第一和/或第二受体包括包含ITAM或ITAM-样基序的胞内信号转导结构域以及共刺激受体的胞内信号转导结构域。
在一些实施方式中,所述第一受体包括包含ITAM或ITAM-样基序的胞内信号转导结构域,而所述第二受体包含共刺激受体的胞内信号转导结构域。与在相同细胞内诱导的活化信号结合的共刺激信号导致了免疫应答,如稳健且持续的免疫应答,如增加的基因表达、细胞因子和其他因子的分泌,和T细胞介导的效应功能,如细胞杀伤。
在一些实施方式中,仅连接第一受体或仅连接第二受体都不会诱导稳健的免疫应答。在一些方面中,如果仅连接一个受体,细胞变得耐受或对抗原无应答,或者被抑制,和/或不被诱导增殖或分泌因子或发挥效应物功能。在一些这类实施方式中,然而,当连接多个受体时,如在表达第一和第二抗原的细胞的相遇之后,实现所需的应答,如全免疫活化或刺激,例如,由一种或多种细胞因子的分泌、增殖、持续、和/或进行免疫效应功能如细胞毒性杀伤靶细胞所示。
在一些实施方式中,两种受体分别诱导针对细胞的活化和抑制信号,使得受体之一与其抗原的结合活化细胞或诱导应答,但是第二抑制性受体与其抗原的结合诱导阻抑或减弱该应答的信号。示例是活化CAR与抑制性CAR或iCAR的组合。可使用这种策略,例如,其中活化CAR结合在疾病或病症中表达,但也在正常细胞上表达的抗原,并且抑制性受体结合在正常细胞上表达但不在疾病或病症的细胞上表达的分开的抗原。
在一些实施方式中,在如下情况中使用多靶向策略,瞬时(例如,在与遗传工程改造相关的刺激下)或永久地在非疾病细胞上表达和/或工程改造的细胞本身上表达与特定疾病或病症相关的抗原。在这种情况中,通过要求连接2个分离并单独特异性的抗原受体,可改善特异性、选择性和/或功效。
在一些实施方式中,多种抗原,例如,第一和第二抗原在靶向的细胞、组织、或者疾病或病症上,如癌细胞上表达。在一些方面中,细胞、组织、疾病或病症是多发性骨髓瘤或多发性骨髓瘤细胞。在一些实施方式中,多种抗原中的一种或多种一般也在不希望用细胞治疗靶向的细胞,如正常或非疾病细胞或组织,和/或工程改造的细胞本身上表达。在这类实施方式中,通过需要连接多个受体来实现细胞应答,实现了特异性和/或功效。
4.用于遗传工程改造的方法和载体
还提供了用于产生遗传工程改造的细胞的方法、核酸、化合物和试剂盒。在一些方面中,遗传工程改造包括导入编码遗传工程改造的组分或导入细胞的其他组分的核酸,如编码基因破坏蛋白质或核酸的组分。
在一些实施方式中,通过首先刺激细胞生长,例如,T细胞生长、增殖、和/或活化,之后转导活化的细胞,并在培养中增殖至足够临床应用的数量来实现基因转移。
在一些情况中,刺激因子(例如,淋巴因子或细胞因子)的过表达可能对对象具有毒性。因此,在一些情况中,工程改造的细胞包括,例如在过继免疫治疗中给予后,使细胞对体内负选择易感的基因区段。例如,在一些方面中,所述细胞经工程改造,从而它们可因它们所给予的患者的体内状况的变化而被消除。可负选择的表型可通过将提供对给予的物质(例如,化合物)的敏感性的基因来产生。可负选择的基因包括:单纯疱疹病毒I型胸苷激酶(HSV-I TK)基因(Wigler等,Cell II:223,I977),其提供更昔洛韦敏感性;细胞次黄嘌呤磷酸核糖基转移酶(HPRT)基因,细胞腺嘌呤磷酸核糖基转移酶(APRT)基因,细菌胞嘧啶脱氨酶(Mullen等,Proc.Natl.Acad.Sci.USA.89:33(1992))。
在一些方面中,细胞还经工程改造以促进细胞因子或其他因子的表达。用于引入遗传工程改造的组分,例如,抗原受体(例如,CAR)的各种方法是熟知的,并可采用本文提供的方法和组合物。示例性方法包括用于转移编码受体的核酸的那些,包括通过病毒,例如,逆转录病毒或慢病毒,转导,转座子,和电穿孔。
在一些实施方式中,采用重组感染性病毒颗粒将重组核酸转移进入细胞,例如,源自猿病毒40(SV40)、腺病毒、腺相关病毒(AAV)的载体。在一些实施方式中,采用重组慢病毒载体或逆转录病毒载体,例如γ-逆转录病毒载体,将重组核酸转移进入T细胞(参见例如,Koste等,(2014)Gene Therapy 2014年4月3日.doi:10.1038/gt.2014.25;Carlens等,(2000)Exp Hematol 28(10):1137-46;Alonso-Camino等,(2013)Mol Ther Nucl Acids 2,e93;Park等,Trends Biotechnol.2011年11月;29(11):550–557)。
在一些实施方式中,所述逆转录病毒载体具有长末端重复序列(LTR),例如,源自莫洛尼鼠白血病病毒(MoMLV),骨髓增生性肉瘤病毒(MPSV),鼠胚胎干细胞病毒(MESV),鼠干细胞病毒(MSCV),脾病灶形成病毒(SFFV)或腺相关病毒(AAV)的逆转录病毒载体。大多数逆转录病毒载体源自鼠逆转录病毒。在一些实施方式中,所述逆转录病毒包括源自任何禽或哺乳动物细胞来源的那些。逆转录病毒通常是双嗜性的,这意味着它们能够感染数种物种(包括人类)的宿主细胞。在一个实施方式中,用待表达的基因替代逆转录病毒gag、pol和/或env序列。已描述许多示例性逆转录病毒系统(例如,美国专利号5,219,740;6,207,453;5,219,740;Miller和Rosman(1989)BioTechniques 7:980-990;Miller,A.D.(1990)Human Gene Therapy 1:5-14;Scarpa等(1991)Virology 180:849-852;Burns等(1993)Proc.Natl.Acad.Sci.USA 90:8033-8037;和Boris-Lawrie和Temin(1993)Cur.Opin.Genet.Develop.3:102-109。
慢病毒转导的方法是已知的。示例性方法描述于,例如,Wang等,(2012)J.Immunother.35(9):689-701;Cooper等,(2003)Blood.101:1637–1644;Verhoeyen等,(2009)Methods Mol Biol.506:97-114;和Cavalieri等,(2003)Blood.102(2):497-505。
在一些实施方式中,通过电穿孔将重组核酸转移进入T细胞(参见例如,Chicaybam等,(2013)PLoS ONE 8(3):e60298和Van Tedeloo等.(2000)Gene Therapy 7(16):1431-1437)。在一些实施方式中,通过转位将重组核酸转移进入T细胞(参见例如,Manuri等(2010)Hum Gene Ther 21(4):427-437;Sharma等,(2013)Molec Ther Nucl Acids 2,e74;和Huang等,(2009)Methods Mol Biol 506:115-126)。在免疫细胞中引入和表达遗传物质的其它方法包括磷酸钙转染(例如,描述于《分子生物学方案新编》(Current Protocols in Molecular Biology),约翰威利父子公司(John Wiley&Sons),纽约州纽约)、原生质体融合、阳离子脂质体介导的转染;钨颗粒促进的微粒轰击(Johnston,Nature,346:776-777(1990));和磷酸锶DNA共沉淀(Brash等,Mol.Cell Biol.,7:2031-2034(1987))。
用于转移编码遗传工程改造的产物的遗传工程改造的核酸的其他方法和载体是描述于,例如,国际专利申请公开号WO2014055668和美国专利号7,446,190的那些。
用于引入的其他核酸(例如基因)包括用以例如通过促进转移的细胞的活力和/或功能改善治疗功效的那些;用以提供遗传标志物以供选择和/或评价细胞的基因,如以评估体内存活或定位;用以改善安全性的基因,例如,通过使细胞对体内负选择易感,如Lupton S.D.等,Mol.and Cell Biol.,11:6(1991);和Riddell等,Human Gene Therapy 3:319-338(1992)所述;也参见Lupton等的公开PCT/US91/08442和PCT/US94/05601,其描述显性阳性可选择的标志物与阴性可选择的标志物的融合衍生的双功能可选择的融合基因的应用。参见例如Riddell等,美国专利号6,040,177,第14-17栏处。
其它核酸还包括编码抑制性核酸分子的那些核酸,包括如下所述的那些。
5.用于工程改造的细胞的制备
在一些实施方式中,经工程改造的细胞的制备包括一种或多种培养和/或一个或多个制备步骤。用于导入编码转基因受体(如CAR)的核酸的细胞可从样品(如生物样品,例如,获自或源自对象的样品)分离。在一些实施方式中,从中分离细胞的对象是患有一定疾病或病症或需要细胞治疗或将给予细胞治疗的对象。在一些实施方式中,对象是需要特定治疗性介入的人,如需要过继细胞疗法的人,用于该疗法的细胞是经分离、加工和/或经工程改造的。
因此,在一些实施方式中,所述细胞是原代细胞,例如,原代人细胞。所述样品包括直接取自对象的组织、体液和其它样品,以及获自一个或多个处理步骤,例如分离、离心、遗传工程改造(例如采用病毒载体的转导)、清洗和/或孵育的样品。所述生物样品可以是直接获自生物来源的样品或经处理的样品。生物样品包括但不限于,体液,例如血液、血浆、血清、脑脊髓液、滑膜液、尿液和汗液,组织和器官样品,包括源自它们的经处理的样品。
在一些方面中,从中衍生或分离细胞的样品是血液或血液源性的样品或者,是或衍生自单采或白细胞去除术产物。示例性样品包括全血、外周血单核细胞(PBMC)、白细胞、骨髓、胸腺、组织活检物、肿瘤、白血病、淋巴瘤、淋巴结、肠相关的淋巴样组织、粘膜相关的淋巴样组织、脾、其它淋巴样组织、肝、肺、胃、肠、结肠、肾、胰腺、乳腺、骨、前列腺、子宫颈、睾丸、卵巢、扁桃体或其它器官,和/或源自其中的细胞。在细胞治疗(例如,过继细胞治疗)的情况中,样品包括来自自体和同种异体来源的样品。
在一些实施方式中,所述细胞源自细胞系,例如,T细胞系。在一些实施方式中,细胞获自异种异体来源,例如,获自小鼠、大鼠、非人灵长类,和猪。
在一些实施方式中,细胞的分离包括一个或多个制备和/或不基于亲和性的细胞分离步骤。在一些实例中,细胞在一种或多种物质的存在下经清洗、离心和/或孵育,例如,以移除不需要的组分,富集所需组分,裂解或移除对具体物质敏感的细胞。在一些实例中,细胞基于一种或多种性质,例如密度、粘附性质、尺寸、对具体组分的敏感性和/或抗性被分离。
在一些实例中,例如,通过单采或白细胞去除术,获得来自对象循环血液的细胞。在一些方面中,所述样品包括淋巴细胞,包括T细胞、单核细胞、粒细胞、B细胞、其它有核血液白细胞、血红细胞,和/或血小板,和,在一些方面中包括与血红细胞和血小板不同的细胞。
在一些实施方式中,从所述对象收集的血液细胞经清洗,例如,以移除血浆部分,并将该细胞置于合适的缓冲液或培养基中以供后施处理步骤。在一些实施方式中,所述细胞用磷酸盐缓冲盐水(PBS)清洗。在一些实施方式中,清洗溶液缺乏钙和/或镁和/或许多或全部二价阳离子。在一些方面中,清洗步骤按照生产商说明,通过半自动化的“流通”离心法(例如,Cobe 2991细胞处理器,百特公司(BaXter))完成。在一些方面中,清洗步骤按照生产商说明,通过内切流过滤(TFF)完成。在一些实施方式中,在清洗后,所述细胞在多种生物相容缓冲液中重悬,例如,无Ca++/Mg++PBS。在某些实施方式中,移除血液细胞样品组分,并将细胞直接重悬于培养基中。
在一些实施方式中,所述方法包括基于密度的细胞分离方法,如通过裂解血红细胞并通过Percoll或Ficoll梯度离心来从外周血制备血液白细胞。
在一些实施方式中,所述分离方法包括,基于细胞中一种或多种特定分子,例如表面标志物,例如,表面蛋白质、胞内标志物或核酸的表达或存在来分离不同的细胞类型。在一些实施方式中,可采用基于此类标志物进行分离的任何已知方法。在一些实施方式中,所述分离是基于亲和力或基于免疫亲和力的分离。例如,在一些方面中,所述分离包括基于细胞的一种或多种标志物(通常是细胞表面标志物)的表达或表达水平来分离细胞和细胞群,例如,通过与特异性地结合此类标志物的抗体或结合伴侣孵育,随后通常是清洗步骤,和从尚未结合至所述抗体或结合伴侣的那些细胞分离已结合所述抗体或结合伴侣的细胞。
此类分离步骤可基于正选择,其中已结合所述试剂的细胞被保留用于进一步应用,和/或,负选择,其中尚未结合至所述抗体或结合伴侣的细胞被保留。在一些实例中,两种部分均保留用于进一步应用。在一些方面中,当没有可用于在异质群中特异性地鉴定细胞类型的抗体时,负选择可能是特别有用的,从而分离最好基于通过与所需群不同的细胞表达的标志物进行。
所述分离不需导致具体细胞群或表达具体标志物的细胞的100%的富集或移除。例如,正选择或富集具体类型的细胞,如表达标志物的那些,指的是,增加所述细胞的数量或百分数,但不需要导致不表达所述标志物的细胞完全不存在。同样地,负选择、移除或消耗具体类型的细胞,例如表达标志物的那些,指的是,减少所述细胞的数量或百分数,但不需要导致所有此类细胞的完全移除。
在一些实例中,进行多轮分离步骤,其中,对来自一个步骤的正或负选择的部分进行另一分离步骤,例如后施正或负选择。在一些实例中,单个分离步骤同时消耗表达多重标志物的细胞,例如通过孵育使细胞与各自对负选择靶向的标志物具有特异性的多种抗体或结合伴侣孵育。同样地,可通过将细胞与各种细胞类型上表达的多种抗体或结合伴侣孵育来对多重细胞类型进行同时正选择。
例如,在一些方面中,T细胞的特定亚群,如一种或多种表面标志物阳性细胞或表达高水平的一种或多种表面标志物的细胞,例如,CD28+、CD62L+、CCR7+、CD27+、CD127+、CD4+、CD8+、CD45RA+和/或CD45RO+T细胞,通过正或负选择技术分离。
例如,CD3+、CD28+T细胞可以采用抗-CD3/抗-CD28连接的磁珠(例如,M-450CD3/CD28T细胞扩增器)来正选择。
在一些实施方式中,分离通过如下方式进行:通过正选择富集具体细胞群,或通过负选择消耗具体细胞群。在一些实施方式中,正或负选择通过将细胞与特异性地结合一种或多种表面标志物的一种或多种抗体或其它结合试剂孵育来完成,所述一种或多种表面标志物分别在正选择或负选择的细胞上表达(标志物+)或以相对较高水平表达(标志物高)。
在一些实施方式中,T细胞通过对在非T细胞(例如B细胞、单核细胞或其它血液白细胞)上表达的标志物(例如CD14)进行负选择来从PBMC样品分离分离。在一些方面中,使用CD4+或CD8+选择步骤来分离辅助性CD4+和CD8+细胞毒性T细胞。通过针对一种或多种原初、记忆和/或效应T细胞亚群上表达或以相对较高的程度表达的标志物进行正或负选择,可将此类CD4+和CD8+群进一步分选成亚群。
在一些实施方式中,CD8+细胞针对原初、中心记忆、效应记忆和/或中心记忆干细胞进行进一步富集或消耗,例如通过基于与对应亚群相关联的表面抗原进行正或负选择。在一些实施方式中,进行针对中心记忆T(TCM)细胞的富集,以增加功效,如以改善长期存活、扩增和/或给予后的植入,在一些方面中,其在此类亚群中特别强健。参见Terakura等.(2012)Blood.1:72–82;Wang等(2012)J Immunother.35(9):689-701。在一些实施方式中,将TCM-富集的CD8+T细胞与CD4+T细胞合并以进一步增强功效。
在实施方式中,记忆T细胞在CD8+外周血淋巴细胞的CD62L+和CD62L-亚组中存在。PBMC可以针对CD62L-CD8+和/或CD62L+CD8+部分进行富集或消耗,例如采用抗-CD8和抗-CD62L抗体。
在一些实施方式中,针对中心记忆T(TCM)细胞的富集基于CD45RO、CD62L、CCR7、CD28、CD3、和/或CD127阳性或高表面表达;在一些方面中,其基于CD45RA和/或粒酶B表达或高度表达的细胞进行负选择。在一些方面中,针对TCM细胞富集的CD8+群的分离通过如下方式进行:消耗表达CD4、CD14、CD45RA的细胞,和正选择或针对表达CD62L的细胞进行富集。一方面,针对中心记忆T(TCM)细胞的富集通过如下方式进行:由基于CD4表达选择的细胞的阴性部分起始,其基于CD14和CD45RA的表达进行负选择,和基于CD62L进行正选择。在一些方面中,此类选择同时进行,且在其它方面中,此类选择以某一顺序依次进行。在一些方面中,相同的基于CD4表达的选择步骤用于制备CD8+细胞群或亚群,也用以产生CD4+细胞群或亚群,从而保留来自基于CD4分离的阳性和阴性部分,并任选地在一种或多种进一步正或负选择步骤之后,用于所述方法的后施步骤。
在具体实例中,对PBMC样品或其它血液白细胞样品进行CD4+细胞选择,其中保留阴性和阳性部分。然后,基于CD14和CD45RA或CD19的表达对阴性部分进行负选择,并基于中心记忆T细胞特征性标志物(例如CD62L或CCR7)进行正选择,其中,所述正和负选择以某一顺序进行。
通过鉴定具有细胞表面抗原的细胞群,将辅助性CD4+T细胞分选成原初、中心记忆和效应细胞。CD4+淋巴细胞可通过标准方法获得。在一些实施方式中,原初CD4+T淋巴细胞是CD45RO-、CD45RA+、CD62L+、CD4+T细胞。在一些实施方式中,中心记忆CD4+细胞是CD62L+和CD45RO+。在一些实施方式中,效应CD4+细胞是CD62L-和CD45RO。
在一个实例中,为了通过负选择针对CD4+细胞进行富集,单克隆抗体混合物通常包括针对CD14、CD20、CD11b、CD16、HLA-DR,和CD8的抗体。在一些实施方式中,使所述抗体或结合伴侣结合至固体支持物或基质,如磁珠或顺磁珠,以允许分离用于正和/或负选择的细胞。例如,在一些实施方式中,所述细胞和细胞群采用免疫磁性(或亲和力磁性)分离技术分开(separated)或分离(isolated)(综述参见《分子医学方法》(Methods in Molecular Medicine),第58卷:代谢研究方法(Metastasis Research Protocols),第2卷:细胞体外和体内性能(Cell Behavior In Vitro and In Vivo),第17-25页,S.A.Brooks和U.Schumacher编新泽西州托托华的胡玛纳出版社(Humana Press Inc.))。
在一些方面中,使待分离的样品或细胞组合物与较小的可磁化或磁响应性材料(如磁响应性颗粒或微粒,例如顺磁珠(例如,Dynalbeads珠或MACS珠))孵育。所述磁响应性材料(例如,颗粒)一般直接或间接连接结合伴侣(例如,抗体),其特异性地结合某一分子,例如,需要分离(例如,需要进行负或正选择)的一种或多种细胞或细胞群上存在的表面标志物。
在一些实施方式中,所述磁性颗粒或珠包括磁响应性材料,其结合特异性的结合部分,例如抗体或其它结合伴侣。有多种熟知的磁响应性材料用于磁性分离方法。合适的磁性颗粒包括描述于Molday,美国专利号4,452,773和欧洲专利说明书EP 452342B中的那些,其通过引用纳入本文。胶体定形的颗粒,例如描述于Owen美国专利号4,795,698的那些,而Liberti等,美国专利号5,200,084是其它实例。
孵育一般在一定条件下进行,由此,所述抗体或结合伴侣或分子,如二抗或其它试剂,其特异性地结合所述抗体或结合伴侣,其连接所述磁性颗粒或珠,特异性地结合所述样品中的细胞上(如果)存在的细胞表面分子。
在一些方面中,将所述样品置于磁场中,并且,具有与其连接的磁性响应或可磁化颗粒的那些细胞将被磁铁吸引,并与未标记的细胞分离。对于正选择而言,保留被磁铁吸引的细胞;对于负选择而言,保留不被吸引的细胞(未标记的细胞)。在一些方面中,在相同选择步骤中进行正和负选择的组合,其中,保留阳性和阴性部分,并进一步处理或进行进一步分离步骤。
在某些实施方式中,磁响应性颗粒在一抗或其它结合伴侣、二抗、凝集素、酶或链霉亲和素中被覆。在某些实施方式中,磁性颗粒通过对一种或多种标志物具有特异性的一抗的覆层连接细胞。在某些实施方式中,所述细胞,而非珠,用一抗或结合伴侣标记,然后,添加细胞类型特异性的二抗或其它结合伴侣(例如,链霉亲和素)被覆的磁性颗粒。在某些实施方式中,链霉亲和素被覆的磁性颗粒与生物素化一抗或二抗联用。
在一些实施方式中,使所述磁响应性颗粒保留连接待经后施孵育、培养和/或工程改造的细胞;在一些方面中,保留所述颗粒连接用于给予患者的细胞。在一些实施方式中,从所述细胞移去可磁化的或磁响应性颗粒。用于从细胞移去可磁化颗粒的方法是已知的,并且包括,例如,采用竞争性非标记的抗体、和可磁化颗粒或连接至可切割接头的抗体。在一些实施方式中,所述可磁化颗粒是生物可降解的。
在一些实施方式中,所述基于亲和力的选择通过磁性活化的细胞分选(MACS)(加利福尼亚奥本的美天旎生物技术公司(Miltenyi Biotech))进行。磁性活化的细胞分选(MACS)系统能够高纯度选择其上连接有磁化的颗粒的细胞。在某些实施方式中,MACS以如下模式操作,其中在施加外部磁场之后,依次洗脱非靶标和靶标物质。即,使附接至磁化的颗粒的细胞保持在原位,而洗脱未附接的物质。然后,在该第一洗脱步骤完成后,将滞留在磁场中且防止被洗脱的物质以某种方式解放,从而它们可以被洗脱和回收。在某些实施方式中,所述非靶细胞带标记并从异质细胞群消耗。
在某些实施方式中,所述分离(isolation)或分开(separation)采用进行所述方法的分离、细胞制备、分开、处理、孵育、培养和/或配制步骤中的一种或多种的系统、装置或设备来进行。在一些方面中,所述系统用以在封闭或无菌环境中进行这些步骤中的各个步骤,例如,以使错误、用户处理和/或污染最小化。在一个实例中,所述系统是国际专利申请公开号WO2009/072003或US20110003380A1中描述的系统。
在一些实施方式中,所述系统或设备在整合或独立系统中,和/或以自动化的或可编程的形式,进行分离、处理、工程改造和配制步骤中的一个或多个,例如,全部。在一些方面中,所述系统或设备包括与所述系统或设备信息连通的计算机和/或计算机程序,其允许用户编程、控制、评估所述处理、分离、工程改造和配制步骤的结果,和/或调节所述处理、分离、工程改造和配制步骤的各方面。
在一些方面中,使用CliniMACS系统(美天旎生物技术公司(Miltenyi Biotic))进行所述分离和/或其它步骤,例如,以供在封闭和无菌系统中进行临床级别水平的细胞的自动化分离。组件可包括整合的微型计算机、磁性分离单元、蠕动泵,和各种夹管阀。在一些方面中,整合的计算机控制所述仪器的所有组件,并指示所述系统以标准化的顺序进行重复的步骤。在一些方面中,所述磁性分离单元包括可移动的永久磁铁和用于所述选择柱的支持物(holder)。所述蠕动泵控制通过管组的流速,并且,与夹管阀一起,确保通过所述系统的缓冲液的受控流和细胞的连续悬液。
在一些方面中,CliniMACS系统使用以无菌、无热源溶液的形式提供的抗体-偶联的可磁化颗粒。在一些实施方式中,在用磁性颗粒标记细胞之后,所述细胞经清洗以移除过量的颗粒。然后,将细胞制备袋连接至管组,其进一步连接包含缓冲液的袋和细胞收集袋。所述管组由预组装的无菌管道组成,包括前置柱和分离柱,并且仅用于单次使用。在分离程序起始之后,所述系统自动化地将所述细胞样品施加至分离柱上。使带标记的细胞保留在柱中,而通过一系列清洗步骤移除未标记的细胞。在一些实施方式中,用于本文所述方法的细胞群是未标记的,并且不被保留在柱中。在一些实施方式中,用于本文所述方法的细胞群是经标记的,并且被保留在柱中。在一些实施方式中,在移除磁场之后,从所述柱洗脱用于本文所述方法的细胞群,并收集在细胞收集袋中。
在一些实施方式中,分离和/或其它步骤采用CliniMACS Prodigy系统(美天旎生物技术公司)进行。在一些方面中,CliniMACS Prodigy系统装配有细胞处理单元,所述细胞处理单元允许自动化清洗和通过离心分级分离细胞。
CliniMACS Prodigy系统还可包括内置摄像机和图像识别软件,其通过识别来源细胞产物的肉眼可见层来确定最优选细胞分级分离终点。例如,外周血被自动化地分离成红细胞、血液白细胞和血浆层。CliniMACS Prodigy系统还可包括整合的细胞培育腔室,其完成细胞培养方案,例如,细胞分化和扩增、抗原加载和长期细胞培养。输入端口可允许无菌移除和补充培养基,并且细胞可采用整合显微镜来监测。参见例如,Klebanoff等.(2012)J Immunother.35(9):651–660,Terakura等.(2012)Blood.1:72–82,和Wang等.(2012)J Immunother.35(9):689-701。
在一些实施方式中,本文所述的细胞群通过流式细胞术收集和富集(或消耗),其中针对多重细胞表面标志物被染色的细胞携载于流体中。在一些实施方式中,本文所述的细胞群通过制备规模(FACS)-分选法收集和富集(或消耗)。在某些实施方式中,本文所述的细胞群通过采用微电机系统(MEMS)芯片联合基于FACS的检测系统来收集和富集(或消耗)(参见例如,WO2010/033140,Cho等(2010)Lab Chip 10,1567-1573;和Godin等(2008)J Biophoton.1(5):355–376。在这两种情况中,细胞可以用多重标志物标记,以允许以高纯度分离明确界定的T细胞亚组。
在一些实施方式中,所述抗体或结合伴侣用一种或多种可检测标志物标记,以促进用于正和/或负选择的分离。例如,分离可基于与荧光标记的抗体的结合。在一些实例中,将基于抗体或对一种或多种细胞表面标志物具有特异性的其它结合伴侣的结合所进行的细胞分离携载于流体流中,例如通过荧光活化的细胞分选(FACS)(其包括制备规模(FACS)和/或微电机系统(MEMS)芯片),例如,与流式细胞术检测系统联合。此类方法允许进行基于多重标志物的同时正和负选择。
在一些实施方式中,制备方法包括:冷冻步骤,例如,在分离、孵育和/或工程改造之前或之后,冻存所述细胞。在一些实施方式中,所述冷冻和后施融化步骤移除粒细胞,并且,在某种程度上,移除细胞群中的单核细胞。在一些实施方式中,例如,在清洗步骤以移除血浆和血小板之后,将所述细胞悬浮于冷冻溶液中。在一些方面中,可采用任何各种已知冷冻溶液和参数。一个实例涉及采用包含20%DMSO和8%人血清白蛋白(HAS)的PBS或其它合适的细胞冷冻培养基。然后,其用培养基1:1稀释,从而DMSO和HSA的终浓度分别是10%和4%。然后,一般以1°/分钟的速率将细胞冷冻至-80℃,并贮存在液氮储罐的汽相中。
在一些实施方式中,提供的方法包括培育、孵育、培养,和/或遗传工程改造步骤。孵育和/或工程改造可以在培养容器中进行,如单元、腔室、孔、柱、管、管组、阀,小瓶,培养皿,袋或其他培养或培养细胞的容器。在一些实施方式中,在遗传工程改造之前或与遗传工程改造一起孵育和/或培养细胞。孵育步骤可包括培养、培育、刺激、活化,和/或增殖。在一些实施方式中,在刺激条件或刺激性试剂存在下孵育细胞或组合物。这样的类条件包括设计成在群中诱导细胞增殖、繁殖、活化,和/或存活以模拟抗原接触(与或不与共刺激),和/或引发细胞用于遗传工程改造,如用于导入重组抗原受体的那些。
所述条件可包括如下一种或多种:具体培养基、温度、含氧量、二氧化碳含量、时间、物质,例如,营养物、氨基酸、抗生素、离子,和/或刺激因子,例如细胞因子、趋化因子、抗原、结合伴侣、融合蛋白、重组可溶性受体,和经设计以活化细胞的任何其它物质。
在一些实施方式中,刺激条件或物质包括一种或多种物质,例如,配体,其能够活化TCR复合物的胞内信号转导结构域。在一些方面中,所述物质开启或启动T细胞中的TCR/CD3胞内信号转导级联。这样的物质可包括抗体,例如对TCR组分和/或共刺激受体具有特异性的那些,例如,抗-CD3、抗-CD28,例如,其结合至固体支持物,例如珠,和/或一种或多种细胞因子。任选地,扩增方法还可包括如下步骤:向培养基(例如,以至少约0.5ng/ml的浓度)添加抗-CD3和/或抗-CD28抗体。在一些实施方式中,刺激剂包括1L-2和/或IL-15,例如,至少约10单位/mL浓度的IL-2。
在一些方面中,孵育根据技术,例如授予Riddell等的美国专利号6,040,16,040,177,Klebanoff等.(2012)J Immunother.35(9):651–660,Terakura等.(2012)Blood.1:72–82和/或Wang等.(2012)J Immunother.35(9):689-701中所述的那些进行。
在一些实施方式中,T细胞群通过如下方式扩增:添加至培养起始组合物饲养层细胞,如非分裂型外周血单核细胞(PBMC),(例如,从而针对待扩增的初始群中的各T淋巴细胞,所得细胞群包含至少约5、10、20或40或更多PBMC饲养层细胞);并孵育所述培养物(例如,足以扩增所述数量的T细胞的时间)。在一些方面中,所述非分裂型饲养层细胞可包括γ-辐照的PBMC饲养层细胞。在一些实施方式中,所述PBMC用约3000-3600拉德范围内的γ射线辐照以防止细胞分裂。在一些方面中,所述饲养层细胞在添加T细胞的群之前添加至培养基。
在一些实施方式中,所述刺激条件包括适于人T淋巴细胞生长的温度,例如,至少约25摄氏度,一般至少约30度,且一般是或约是37摄氏度。任选地,孵育还可包括添加非分裂型EBV-转化的类淋巴母细胞(LCL)作为饲养层细胞。LCL可以用约6000-10000拉德范围内的γ射线辐照。在一些方面中,LCL饲养层细胞以任何合适的量提供,例如LCL饲养层细胞与初始T淋巴细胞的比率是至少约10:1。
III.阻遏基因表达以调整涉及遗传工程改造的T细胞和工程改造的细胞的PD-1和PD-L1相互作用的方法
在一些实施方式中,制备遗传工程改造的细胞的方法包括,导入减少或者能够减少细胞中免疫抑制性分子(例如,PD-1或PD-L1)的表达的物质,该导入可以与编码转基因受体(如CAR)的核酸的导入同时或依次进行。在一些实施方式中,将包括、包含在或编码所述物质的核酸分子导入细胞。还提供了这样的细胞,其包括遗传工程改造(重组)的细胞表面受体,并且其中所述免疫抑制性分子(如PD-1或PD-L1)的表达减少,或者所述免疫抑制性分子(如PD-1或PD-L1)的编码基因被破坏。在一些实施方式中,所述细胞包括减少或阻遏免疫抑制性分子的表达的物质,如抑制性核酸分子。
在一些实施方式中,阻遏了细胞中一个或多个基因的表达、活性、和/或功能。本文提供的方法导致细胞中基因的阻遏,如T细胞中,例如,表达CAR的T细胞中。在一些实施方式中,还提供了细胞,如T细胞,例如表达CAR的T细胞,其包含能够通过阻遏和/或破坏工程改造的细胞中的基因(如所述细胞的免疫应答的抑制中所涉及的基因)而减小抑制作用的物质。在一些实施方式中,一种或多种基因阻遏编码PD-1和/或PD-L1的基因。在一些实施方式中,被阻遏的一种或多种基因是PDCD1和/或CD274。
在一些实施方式中,通过在基因中进行破坏,如敲除、插入、错义或移码突变如双等位移码突变、缺失全部或部分基因,例如其一个或多个外显子或部分、和/或敲入来进行基因阻遏。在一些实施方式中,由包括序列特异性或靶向的核酸酶的物质来实现这样的破坏,包括DNA-结合性靶向的核酸酶和基因编辑核酸酶,如锌指核酸酶(ZFN)和转录激活因子样效应子核酸酶(TALEN)、和RNA-引导的核酸酶,如CRISPR-结合核酸酶(Cas),其经特定设计以靶向基因的序列或其部分。在一些实施方式中,这样的序列特异性或靶向的核酸酶由抑制性核酸分子编码。在一些实施方式中,这样的核酸酶可以被DNA结合核酸分子(如,引导RNA(gRNA))所引导或靶向。
在一些实施方式中,基因阻遏通过造成免疫抑制性分子(如PD-1或PD-L1)的表达的减少而进行。在一些实施方式中,这样的基因阻遏采用抑制性核酸分子实现,如通过RNA干扰(RNAi)、短干扰RNA(siRNA)、短发夹(shRNA)、微RNA(miRNA)、反义RNA、和/或核糖酶,其可以被用来选择性抑制或阻遏基因表达。siRNA技术包括基于利用双链RNA分子的RNAi的技术,所述双连RNA分子具有与从基因转录的mRNA的核苷酸序列同源的序列和与该核苷酸序列互补的序列。siRNA一般与从基因转录的mRNA的一个区域同源/互补,或者可以是包括与不同区同源/互补的多个RNA分子的siRNA。在一些实施方式中,基因阻遏采用DNA-结合核酸分子,如引导RNA(gRNA),和RNA引导的核酸酶的变体,如酶失活的Cas9(eiCas9)蛋白或包含eiCas9的融合蛋白来实现。在一些实施方式中,基因阻遏采用DNA-结合靶向蛋白,如锌指蛋白(ZFP)或包含ZFP的融合蛋白来实现。
A.减少PD-1或PD-L1表达在一些实施方式中,提供的方法或细胞导致细胞中PD-1或PD-L1表达的敲减,如减少或阻遏。在一些实施方式中,敲减可以是瞬时的,如是条件型的。在一些实施方式中,敲减是非瞬时的或永久的。
在一些实施方式中,PD-1或PD-L1表达的敲减、阻遏或降低可以通过RNA干扰(RNAi)实现。在一些实施方式中,对其靶核酸序列具有序列特异性同源性的双链RNA(dsRNA)分子可以介导RNAi(Caplen,N.J.,等,Proc.Natl.Acad.Sci.USA 98:9742-9747(2001))。果蝇无细胞裂解物的生物化学研究表明,在一些实施方式中,RNA依赖性基因沉默的介导物是21-25个核苷酸的“小干扰”RNA双链体(siRNA)。siRNA可源自通过被称为Dicer的RNA酶对dsRNA的处理(Bernstein,E.,等,Nature 409:363-366(2001))。siRNA双链体产物可以被纳入叫做RNA诱导的沉默复合物(RISC)的多重蛋白siRNA复合物在一些实施方式中,其后可以将RISC引导至靶核酸(适当地mRNA),siRNA双链体在此处以序列特异性方式相互作用从而以催化方式介导切割(Bernstein,E.,等,Nature 409:363-366(2001);Boutla,A.,等,Curr.Biol.11:1776-1780(2001))。可以根据本领域熟知以及普通技术人员所熟悉的方法使用和合成小干扰RNA。小干扰RNA包括约0至约50个氨基酸(nt)。在非限制性实施方式的实例中,siRNA可以包括约5至约40个nt,约5至约30个nt,约10至约30个nt,约15至约25个nt或约20至25个核苷酸。
在一些实施方式中,RNA干扰剂至少部分是双链RNA,其具有本领域已知的分子结构特点,以通过RNAi机制或者包括彼此杂交以形成所述结构的至少部分互补的部分的RNA链,介导对基因表达的抑制。当RNA包括彼此之间相互杂交的互补区域时,该RNA被称为自杂交(self-hybrideize)。在一些实施方式中,抑制性核酸(如RNA干扰剂)包括与靶基因基本上互补的部分。在一些实施方式中,RNA干扰剂任选地包括一个或多个核苷酸类似物或修饰。本领域普通技术人员将会意识到,RNAi物质可以包括核糖核苷酸、脱氧核糖核苷酸、核苷酸类似物、修饰的核苷酸或主链等。在一些实施方式中,可以在转录后对RNA干扰剂进行修饰。在一些实施方式中,RNA干扰剂包括一条或多条链,其杂交或自杂交以形成包括长度在约15至29个核苷酸之间的双链体部分的结构,任选地在双链体内具有一个或多个错配的或未配对的核苷酸。在一些实施方式中,RNA干扰剂包括短干扰RNA(siRNA)、短发夹RNA(shRNA)和可以经胞内处理产生shRNA的其它RNA物质,包括但不限于,与天然产生的miRNA前体或miRNA样RNA的设计前体(designed precursor)相同的RNA物质。
在一些实施方式中,术语“短干扰RNA(siRNA)”表示这样的核酸,其包括长度在15至29个核苷酸之间的双链部分,并且任选地还在一条或两条链上包括单链突出端(例如,长度在1至6个核苷酸)。在某些实施方式中,双链部分的长度可以是17至21个核苷酸,例如19个核苷酸。在一些实施方式中,出现在各链3′端的突出端可以是2个核苷酸长度,并且可以包括DNA或核苷酸类似物。siRNA可以由杂交在一起的两条RNA链构成,或者可由较长的双链RNA或可由包括自杂交部分的单RNA链(如短发夹RNA)中的任意一种生成。本领域普通技术人员能够理解,由两条siRNA链构成的双链体中可能会出现一个或多个错配或未配对的核苷酸。在一些实施方式中,siRNA的一条链(“反义”或“引导”链)包括与靶核酸(例如,mRNA转录物)杂交的部分。在一些实施方式中,反义链与靶标完美互补约15至29个核苷酸,一些时候是17至21个核苷酸,例如,19个核苷酸,这表明siRNA与靶向转录物的杂交在该长度没有一个错配。然而,本领域普通技术人员能够理解,由siRNA链和靶标转录物之间构成的双链体中可能会出现一个或多个错配或未配对的核苷酸。
在一些实施方式中,采用编码PD-L1或PD-1的靶核酸的小发夹RNA(shRNA)阻遏或减少PD-L1和/或PD-1表达。在一些实施方式中,短发夹RNA(shRNA)是这样的核酸分子,其包括至少两个互补部分,所述互补部分杂交或能够杂交以形成足够长的双链体结构以介导RNAi(长度通常是15至29个核苷酸),以及至少一个单链部分,长度通常在约1至10个核苷酸之间,其形成连接形成所述双链体的两条序列的末端的环。在一些实施方式中,该结构还可以包括突出端。用于给定靶基因敲减的合适shRNA序列是本领域已知的或者可以由本领域技术人员容易地确定。
在一些实施方式中,通过shRNA自身互补部分杂交形成的双链体可能具有与siRNA相似的性质并且,如下所述,通过保守的细胞RNAi机理,shRNA可被加工成siRNA。因此,shRNA可以是siRNA的前体,并且相似地,可以能够抑制靶向转录物的表达。在一些实施方式中,shRNA包括与靶核酸(例如,mRNA转录物)杂交的部分,并且可以与靶标在约15至29个核苷酸上完美互补,有些时候在17至21个核苷酸之间,例如,19个核苷酸。然而,本领域普通技术人员将会意识到,由shRNA链和靶向转录物之间构成的双链体中可能会出现一个或多个错配或未配对的核苷酸。
在一些实施方式中,shRNA包括A-B-C或C-B-A结构的核苷酸(例如,DNA)序列。在一些实施方式中,所述盒包括至少两个DNA区段A和B或C和A,其中所述至少两个区段各自受如上定义的分开的启动子的控制(如Pol III启动子,包括诱导型U6、H1等)。在上述区段中:A可以是15至35bp或19至29bp的DNA序列,其与待敲减的基因(例如,PD-L1或PD-1)至少90%或100%互补;B可以是具有5至9bp的间隔子DNA序列,其形成表达的RNA发夹分子的环;和,C可以是15至35或19至29bp的DNA序列,其与序列A至少85%互补。
在一些实施方式中,如果(1)RNAi物质包括与转录物在约为15-29个氨基酸长度的区域(例如,至少约15、约17、约18或约19个核苷酸长度的区域)上至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或至少约100%互补的部分(例如,链);和/或(2)在哺乳动物细胞的细胞质或细胞核中通常存在的条件下(不包括温度),由RNAi物质一条链的15个核苷酸的延伸和转录物的15个核苷酸部分形成的双链体的Tm比由RNA干扰剂的相同的15个核苷酸和其准确互补体(exact complement)形成的双链体的Tm低不超过约15℃,或低不超过约10℃;和/或(3)相较于不存在RNA干扰剂的情况,转录物的稳定性在RNA干扰剂存在的情况下降低,那么RNA干扰剂被认为“靶向”转录物和编码该转录物的基因。在一些实施方式中,靶向转录物的RNA干扰剂还可以被认为靶向编码并指导该转录物合成的基因。在一些实施方式中,靶区域可以是与RNA干扰剂的反义链杂交的靶转录物的区域。在一些实施方式中,靶转录物可以是针对通过RNA干扰而进行抑制的靶标的任何RNA。
在一些实施方式中,siRNA选择性阻抑PD-L1和/或PD-1的表达。此外,siRNA的所有核苷酸序列可以源自PD-L1和/或PD-1的mRNA的核苷酸序列,或其部分可源自所述核苷酸序列。
在一些实施方式中,siRNA可以包括核糖核苷酸,并且其一部分可以包括不同于核糖核苷酸的核苷酸,例如,脱氧核糖核苷酸,脱氧核糖核苷酸的衍生物,核糖核苷酸的衍生物等。siRNA可以通过已知的化学合成方法合成,但是所述方法不受到特别限制。在一些实施方式中,其可以是采用合适的模板核酸通过酶促方式(例如,采用RNA聚合酶)制备。在一些实施方式中,siRNA可以具有这样的形式:可以在分子中形成双链体的单链RNA,和具有茎环结构(短发夹结构:sh结构)的单链RNA,所述茎环结构具有作为茎的siRNA部分以及作为环的任意序列(shRNA)。在一些实施方式中,可以将1至30个核苷酸、1至25个核苷酸或5至22个核苷酸的序列用作任意序列。
siRNA的序列可以根据希望将其表达阻抑的基因序列进行适当设计。已经报到了许多siRNA设计算法(参见例如,WO 2004/0455543和WO2004/048566),并且还可以使用市售可得的软件。此外,现有许多公司由希望其表达被阻抑的基因序列的信息设计siRNA,并且合成和提供这些siRNA。因此,基于希望其表达被阻抑的基因序列,本领域普通技术人员可以轻易的获得siRNA。在一些实施方式中,可以生成或使用选择性阻抑PD-L1和/或PD-1的表达的任何siRNA。例如,包括SEQ ID NOS:1-5中任一项的核苷酸序列的siRNA可以被用于PD-L1,而包括SEQ ID NOS:6的核苷酸序列的siRNA可以被用于PD-1。针对PD-L1的其它示例性siRNA序列可以在美国专利申请公开号20140148497中找到,通过引用纳入本文。
在一些实施方式中,shRNA和siRNA区段还可包括终止和/或聚腺苷酸化序列。
在一些实施方式中,反义核苷酸可以被用于阻抑PD-L1和/或PD-1的表达。在一些实施方式中,反义核苷酸可以被用于阻抑蛋白质的表达,例如,通过直接干扰PD-L1和/或PD-1PD-1的mRNA分子的翻译,通过RNA降解酶H对mRNA的降解,通过干扰mRNA的5'加帽,通过掩蔽5'帽,通过阻止翻译因子与mRNA的结合,或通过抑制mRNA的聚腺苷酸化。在一些实施方式中,蛋白质表达的阻抑可以通过反义核苷酸和PD-L1和/或PD-1的mRNA之间的杂交发生。在一些实施方式中,为了降低mRNA的稳定性或降解mRNA,选择mRNA上的特定靶位点作为反义核苷酸的靶标。在一些实施方式中,当鉴定出一个或多个靶位点时,可以设计与靶位点具有足够互补性的核苷酸序列的核苷酸(即,在生理条件下充分杂交并且具有充分特异性)。在一些实施方式中,反义核苷酸可以具有,例如,8至100个核苷酸、10至80个核苷酸或14至35个核苷酸长度的链。
在一些实施方式中,导入或递送进细胞的方法可以与上述用于将编码遗传工程改造的抗原受体的核酸导入细胞的方法相同或相似。在一些实施方式中,抑制性核酸分子(如shRNA或siRNA)在例如T细胞的细胞中的表达可以通过采用任何常规表达系统,例如,慢病毒表达系统实现。在一些实施方式中,RNA可以是病毒载体的组分。在一些实施方式中,病毒载体包括寡核苷酸,其抑制PD-1或PD-L1的表达,或编码shRNA或具有这种能力的其它抑制性核酸。在一些实施方式中,所述病毒载体是慢病毒载体。在一些实施方式中,所述慢病毒载体是整合型慢病毒载体。
在一些实施方式中,合适的启动子包括,例如,RNA聚合酶(pol)III启动子,其包括但不限于,(人或小鼠)U6启动子、(人或小鼠)H1启动子和(人或小鼠)7SK启动子。在一些实施方式中,可以制备杂合启动子,其包含源自例如RNA聚合酶(pol)III启动子的不同类型的元件。在一些事实方式中,本领域技术人员可以获得修饰的启动子以在需要的一组条件下或在特定的情况中进行转录,所述修饰的启动子包含源自两个或更多个天然产生的启动子序列的序列元件。例如,人和鼠U6RNA聚合酶(pol)III和H1RNA pol III启动都已被充分表征。本领域普通技术人员将能够选择和/或修饰对于所需应用和细胞类型最有效的启动子,从而优化一种或多种基因表达的调节。在一些实施方式中,启动子序列可以是不存在于自然界的序列,只要其在真核细胞,例如,哺乳动物细胞中起作用即可。
在一些所述方法中,示例性的递送载剂是纳米颗粒,例如,脂质体或其它合适的次微米尺寸的递送系统。在一些实施方式中,考虑使用脂质制剂将核酸导入细胞。脂质颗粒可以是核酸-脂质颗粒,其可以由阳离子脂质、非阳离子脂质、和任选地,防止颗粒聚集的偶联脂质形成。可以将核酸包封在颗粒的脂质部分,因此保护其免于酶促降解。稳定的核酸-脂质颗粒可以是由脂质(例如,阳离子脂质、非阳离子脂质、和任选地,防止颗粒聚集偶联脂质)制成的颗粒,其中核酸完全包封在脂质中。
在一些实施方式中,脂质颗粒具有如下的平均直径:从约30nm至约150nm、从约40nm至约150nm、从约50nm至约150nm、从约60nm至约130nm、从约70nm至约110nm、从约70nm至约100nm、从约80nm至约100nm、从约90nm至约100nm、从约70至约90nm、从约80nm至约90nm、从约70nm至约80nm、或约30nm、35nm、40nm、45nm、50nm、55nm、60nm、65nm、70nm、75nm、80nm、85nm、90nm、95nm、100nm、105nm、110nm、115nm、120nm、125nm、130nm、135nm、140nm、145nm或150nm。在一些实施方式中,所述脂质颗粒是基本上无毒性的。在一些实施方式中,当核酸存在于本发明的脂质颗粒中的时候,其可以在水性溶液中耐受核酸酶的降解。
在一些实施方式中,脂质颗粒提供了具有完全包封、部分包封或所述两者的核酸。在一些实施方式中,核酸被完全包封在脂质颗粒中,以形成核酸-脂质颗粒。
在一些实施方式中,偶联的脂质抑制脂质颗粒的聚集,包括聚乙二醇(PEG)-脂质偶联物,例如,偶联二烷氧基丙基的PEG(例如,PEG-DAA偶联物),偶联二酰基甘油的PEG(例如PEG-DAG偶联物),偶联胆固醇的PEG,偶联磷脂酰乙醇胺的PEG,和偶联神经酰胺的PEG,阳离子PEG脂质,聚噁唑啉(POZ)-脂质偶联物(例如,POZ-DAA偶联物;聚酰胺寡聚物(例如,ATTA-脂质偶联物)及其混合物。在一些实施方式中,PEG或POZ可以直接偶联脂质,或者可以经由接头部分连接脂质。可使用适用于偶联PEG或POZ与脂质的任何接头部分,包括例如不含酯的接头部分和含酯的接头部分。在一些实施方式中,可以使用不含酯的接头部分,例如,酰胺或氨基甲酸酯。
在一些实施方式中,两亲性脂质可以具有趋于疏水相取向的疏水部分,以及定向成水相的亲水部分。在一些实施方式中,亲水特性来源于极性或带电基团的存在,如碳水化合物、磷酸盐、羧酸盐、硫酸盐、氨基、巯基、硝基、羟基和其它类似基团。在一些实施方式中,可以通过包括非极性基团获得疏水性,所述非极性基团包括但不限于,长链饱和和不饱和脂肪族烃基团和被一个或多个芳族、脂环族或杂环基团取代的这类基团。两亲性化合物的实例包括但不限于,磷脂、氨基脂和鞘脂。
磷脂的示例性实例包括但不限于,磷脂酰胆碱,磷脂酰乙醇胺,磷脂酰丝氨酸,磷脂酰肌醇,磷脂酸,棕榈酰油酰磷脂酰胆碱,溶血磷脂酰胆碱,溶血磷脂酰乙醇胺,二棕榈酰磷脂酰胆碱,二油酰磷脂酰胆碱,二硬脂酰磷脂酰胆碱和二油酰磷脂酰胆碱。缺少磷的其它化合物,如鞘脂,糖鞘脂家族,二酰甘油和(3-酰氧基酸,也属于称为两亲性脂质的物质之中。此外,如上所述的两亲性脂质可与其它脂质混合,包括三酸甘油酯和类固醇。
在一些所述方法中,中性脂质在选定的pH以不带电荷或中性的两性离子形式存在。在一些实施方式中,在生理pH下,这样的脂质包括,例如,二酰基磷脂酰胆碱、二酰基磷脂酰乙醇胺、神经酰胺、鞘磷脂、脑磷脂、胆固醇、脑苷脂和二酰甘油。
在一些实施方式中,非阳离子脂质可以是任何两亲性脂质以及任何其他中性脂质或阴离子脂质。
在一个实施方式中,阴离子脂质在生理pH下是带负电荷的。这些脂质包括但是不限于,磷脂酰甘油、心磷脂、二酰基磷脂酰丝氨酸、二酰基磷脂酸、N-十二烷酰磷脂酰乙醇胺、N-琥珀酰磷脂酰乙醇胺、N-戊二酰磷脂酰乙醇胺、赖氨酰磷脂酰甘油、棕榈酰甘油磷脂酰甘油(POPG)和连接中性脂质的其他阴离子修饰基团。
在一些实施方案中,疏水性脂质具有非极性基团,其包括但是不限于,长链饱和和不饱和脂肪族烃基团和被一个或多个芳族、脂环族或杂环基团取代的这类基团。合适的实例包括但是不限于,甘油二酯、二烷基甘油、N—N-二烷基氨基、1,2-二酰氧基-3-氨基丙烷、和1,2-二烷基-3-氨基丙烷。在一些实施方式中,核酸-脂质颗粒包括:(a)核酸(例如,干扰RNA);(b)阳离子脂质,其包括存在于颗粒中的总脂质的约50mol%至约65mol%;(c)非阳离子脂质,其包括存在于颗粒中的总脂质的约25mol%至约45mol%;和(d)抑制颗粒聚集的偶联的脂质,其包括存在于颗粒中的总脂质的约5mol%至约10mol%。
在一些实施方式中,核酸-脂质颗粒包括:(a)核酸(例如,干扰RNA);(b)阳离子脂质,其包括存在于颗粒中的总脂质的约50mol%至约60mol%;(c)磷脂和类固醇或其衍生物的混合物,其包括存在于颗粒中的总脂质的约35mol%至约45mol%;和(d)PEG-脂质偶联物,其包括存在于颗粒中的总脂质的约5mol%至约10mol%。
在一些实施方式中,核酸-脂质颗粒包括:(a)核酸(例如,干扰RNA);(b)阳离子脂质,其包括存在于颗粒中的总脂质的约55mol%至约65mol%的;(c)类固醇或其衍生物,其包括存在于颗粒中的总脂质的约30mol%至约40mol%的;和(d)PEG-脂质偶联物,其包括存在于颗粒中的总脂质的约5mol%至约10mol%。在一些实施方式中,可以使用CRISPR/Cas系统进行敲减,如减少或阻抑,PD-L1和/或PD-1的表达(参见例如,WO2015/161276)。CRISPR/Cas系统的示例性特征如下所述,并且通过使用酶失活的核酸酶,其可以适用于降低或阻抑分子的表达,而不是破坏或去除编码分子的基因。在一些实施方式中,可以将靶向编码PD-L1或PD-1的基因(如CD274或PDCD1基因)或启动子、增强子或其它顺式或反式调节区的引导RNA(gRNA)联合修饰的Cas9蛋白或融合蛋白导入以从阻抑所述基因的表达(例如,敲减),所述融合蛋白包含修饰的Cas9蛋白。在一些实施方式中,Cas9分子是酶失活的Cas9(eiCas9)分子,其包括引起Cas9分子失活的突变(例如,点突变),例如,消除或大幅降低了Cas9分子切割活性的突变。在一些实施方式中,eiCas9分子直接或间接地融合转录激活因子或阻遏物蛋白质。
在一些实施方式中,靶向PDCD1或CD274基因的启动子区域,以敲减PDCD1或CD247的表达。靶向的敲减方法降低或消除功能性PDCD1或CD274基因产物的表达。在一些实施方式中,通过靶向酶失活的Cas9(eiCas9)或融合转录阻遏物结构域或染色质改性蛋白的eiCas9介导靶向的敲减,以改变PDCD1和/或CD274基因的转录,例如,以阻断、降低、干扰或减少其转录。靶向PDCD1或CD274基因中或附近的靶序列的gRNA,如果被eiCas9或eiCas9融合蛋白所靶向,导致功能性PDCD1或CD274基因产物(如PD-1或PD-L1)表达的降低或消除。在一些实施方式中,降低或消除转录。
在一些实施方式中,gRNA分子的靶向结构域被设置成靶向十分接近基因组中靶序列的酶失活的Cas9(eiCas9)或eiCas9融合蛋白(例如,融合转录阻遏物结构域的eiCas9),以降低、减少或阻遏PDCD1或CD274基因的表达。在一些实施方式中,eiCas9融合转录阻遏物结构域或染色质改性蛋白以改变PDCD1或CD274基因的转录,例如,以阻断、降低、干扰或减少其转录。在一些实施方式中,可以使用一个或多个eiCas9以阻断一个或多个内源性转录因子的结合。在另一实施方式中,eiCas9可以融合染色质改性蛋白。改变染色质状态可能会导致靶基因表达的减少。可以使用融合一各或多个染色质改性蛋白的eiCas9的一个或多个改变染色质状态。
在一些实施方式中,靶向结构域被设置成靶向PDCD1或CD274的启动子区域,以阻断转录起始,结合一个或多个转录增强子或激活因子,和/或RNA聚合酶。可以使用一个或多个gRNA靶向PDCD1和/或CD274基因的启动子区域的eiCas9。在一些实施方式中,PDCD1和/或CD274的一个或多个区域可以被靶向。
在一些实施方式中,通过本领域技术人员已知的方法,包括如下所述与CRISPR/Cas系统有关的那些方法,可以将PD-L1或PD-1的复合物导入细胞,所述复合物靶向CRISRP gRNA和酶失活的核酸酶,例如,iCas9或eiCas9融合蛋白。在一些实施方式中,CRISPR gRNA和酶失活的核酸酶,例如,iCas9或eiCas9融合蛋白,被瞬时导入到细胞,例如,通过核糖核蛋白复合物(RNP)的复合物的瞬时导入。在一些实施方式中,采用任何常规表达系统,例如,慢病毒表达系统,将eiCas9和/或gRNA的编码核酸分子导入细胞。在一些实施方式中,导入或递送进细胞的方法可以是与下述用于将核酸-蛋白质复合物(如核糖核蛋白复合物)导入细胞相同或相似的方法。
在一些实施方式中,基因敲减的实现是采用DNA-结合靶向蛋白,如锌指蛋白(ZFP)或包含ZFP的融合蛋白。在一些实施方式中,通过干扰或抑制靶基因的表达,DNA-结合蛋白(如ZFP)可以产生靶基因阻遏。DNA-结合蛋白,包括ZFP的示例性特征如下所述,并且通过不导入效应物蛋白(内切核酸酶,如锌指核酸酶(ZFN)),其可以适用于降低或阻抑分子的表达,而不是破坏或删除编码分子的基因。
B.PD-1或PD-L1表达的敲除在一些方面中,通过基因编辑,如使用DNA结合蛋白或DNA-结合核酸来敲除(如破坏)编码PD-1和/或PD-L1的基因(如PDCD1和/或CD274),其在被靶向以供破坏的区域处特异性结合或杂交所述基因。在一些方面中,蛋白质或核酸与基因编辑核酸酶偶联或复合,如以嵌合或融合蛋白的形式。例如,在一些实施方式中,使用包含DNA-靶向蛋白和核酸酶,如锌指核酸酶(ZFN)或TAL-效应子核酸酶(TALEN)、或RNA-引导的核酸酶如成簇规律间隔短回文核酸(CRISPR)-Cas系统,如CRISPR-Cas9系统的对破坏的核酸有特异性的融合体来实现破坏。在一些实施方式中,基因编辑导致编码PD-1和/或PD-L1(如PDCD1和/或CD274)的基因的基因组破坏或敲除。
在一些实施方式中,使用特异性结合或杂交至基因的DNA-靶向分子,如DNA-结合蛋白或DNA-结合核酸,或含有其的复合物、化合物或组合物来实现抑制。在一些实施方式中,DNA-靶向分子包括DNA-结合结构域,例如,锌指蛋白(ZFP)DNA-结合结构域、转录激活因子样蛋白(TAL)或TAL效应子(TALE)DNA-结合结构域、成簇规律间隔短回文重复序列(CRISPR)DNA-结合结构域、或来自大范围核酸酶的DNA-结合结构域。
锌指、TALE和CRISPR系统结合结构域可经工程改造,以结合预定的核苷酸序列,例如,通过对天然产生的锌指或TALE蛋白的识别螺旋区的工程改造(改变一个或多个氨基酸)。工程改造的DNA结合蛋白(锌指或TALE)是非自然产生的蛋白质。设计的合理标准包括应用替代法则和计算机算法来处理现有ZFP和/或TALE设计和结合数据的数据库存储信息中的信息。参见例如,美国专利号6,140,081、6,453,242和6,534,261;也参见WO 98/53058、WO 98/53059、WO 98/53060、WO 02/016536和WO 03/016496,以及美国公开号20110301073和US20140120622。
在一些实施方式中,DNA-靶向分子、复合物、或组合包含DNA-结合分子和一个或多个其他结构域,如效应结构域以促进基因的阻遏或破坏。例如,在一些实施方式中,通过包括DNA-结合蛋白和异源调节结构域或功能性片段的融合蛋白来进行基因破坏或阻遏。在一些方面中,结构域包括,例如,转录因子结构域,如激活子、抑制子、共激活子、共抑制子、沉默子、致癌基因、DNA修复酶及其相关因子和修饰子、DNA重排酶及其相关因子和修饰子、染色质相关蛋白及其修饰子(例如激酶、乙酰化酶和脱乙酰基酶)、和DNA修饰酶(例如甲基转移酶、拓扑异构酶、解螺旋酶、连接酶、激酶、磷酸酶、聚合酶、内切核酸酶)及其相关因子和修饰子。参见例如,美国专利申请号20050064474、20060188987和2007/0218528,关于DNA-结合结构域和核酸酶切割结构域的融合的详细内容通过引用全文纳入本文。在一些方面中,其他结构域是核酸酶结构域。因此,在一些实施方式中,通过基因或基因组编辑来促进基因破坏,使用工程改造的蛋白质,如基因编辑核酸酶和含有基因编辑核酸酶的复合物或融合蛋白,其包含与非特异性DNA-切割分子如核酸酶融合或络合的序列特异性DNA-结合结构域。
在一些方面中,这些靶向的嵌合核酸酶或含核酸酶的复合物通过诱导靶向的双链断裂或单链断裂、刺激细胞DNA-修复机制、包括易错非同源末端连接(NHEJ)和同源导向修复(HDR)来进行精确遗传修饰。在一些实施方式中,核酸酶是内切核酸酶,如锌指核酸酶(ZFN)、TALE核酸酶(TALEN)、RNA-引导的内切核酸酶(RGEN),如CRISPR-结合(Cas)蛋白、或大规模核酸酶。
在一些实施方式中,提供了供体核酸,例如,编码遗传工程改造的受体的供体质粒或核酸并通过HDR在引入DSB后的基因编辑位点处插入。因此,在一些实施方式中,基因的破坏和抗原受体(例如,CAR)的导入同时进行,从而该基因被CAR-编码核酸的敲入或插入而部分破坏。
在一些实施方式中,没有提供供体核酸。在一些方面中,导入DSB后的NHEJ-介导的修复导致可以引起基因破坏的插入或删除突变,例如,通过产生错义突变或移码。
1.ZFP和ZFN;TAL,TALE,和TALEN
在一些实施方式中,DNA-靶向分子包括与效应蛋白如内切核酸酶融合的DNA-结合蛋白,如一种或多种锌指蛋白(ZFP)或转录激活因子样蛋白(TAL)。示例包括ZFN、TALE、和TALEN。参见Lloyd等,Fronteirs in Immunology,4(221),1-7(2013)。
在一些实施方式中,DNA-靶向分子包括一个或多个锌指蛋白(ZFP)或其结构域,其以序列特异性方式结合DNA。ZFP或其结构域是能以序列特异性方式通过一个或多个锌指结合DNA的较大蛋白质内的蛋白质或结构域,锌指是通过锌离子配位稳定其结构的结合结构域内氨基酸序列的区域。术语锌指DNA结合蛋白常缩写作锌指蛋白或ZFP。
ZFP包括靶向特定DNA序列的人工ZFP结构域,一般长度为9-18个核苷酸,由单个指的组装生成。ZFP包括其中单个指结构域长度为约30个氨基酸并且含有含2个非变异组氨酸残基的α螺旋,其通过锌与单个β转角的2个半胱氨酸配位,并且具有2、3、4、5或6个指。一般而言,可通过在锌指识别螺旋的4个螺旋位置(-1、2、3和6)处进行氨基酸取代来改变ZFP的序列特异性。因此,在一些实施方式中,ZFP或含ZFP的分子是非天然产生的,例如,经工程改造以结合选择的靶位点。参见例如,Beerli等(2002)Nature Biotechnol.20:135-141;Pabo等(2001)Ann.Rev.Biochem.70:313-340;Isalan等(2001)Nature Biotechnol.19:656-660;Segal等(2001)Curr.Opin.Biotechnol.12:632-637;Choo等(2000)Curr.Opin.Struct.Biol.10:411-416;美国专利号6,453,242;6,534,261;6,599,692;6,503,717;6,689,558;7,030,215;6,794,136;7,067,317;7,262,054;7,070,934;7,361,635;7,253,273;和美国专利公开号2005/0064474;2007/0218528;2005/0267061,其均通过引用其全文纳入本文。
在一些方面中,阻遏基因是通过使该基因中的第一靶位点与第一ZFP接触,从而阻遏该基因。在一些实施方式中,基因中的靶位点与具有6个指和调节结构域的融合ZFP接触,从而抑制基因的表达。
在一些实施方式中,接触步骤还包括使基因中的第二靶位点与第二ZFP接触。在一些方面中,第一和第二靶位点相邻。在一些实施方式中,第一和第二ZFP是共价连接的。在一些方面中,第一ZFP是包括调节结构域或至少两个调控结构域的融合蛋白。在一些实施方式中,第一和第二ZFP是融合蛋白,各自包括调控结构域或各自包括至少两个调节结构域。在一些实施方式中,调节结构域是转录阻遏物、转录激活因子、内切核酸酶、甲基转移酶、组蛋白乙酰转移酶、或组蛋白去乙酰化酶。
在一些实施方式中,ZFP由可操作地连接至启动子的ZFP核酸编码。在一些方面中,该方法还包括首先以脂质:核酸复合物或裸核酸向细胞给予核酸的步骤。在一些实施方式中,ZFP由包含可操作地连接至启动子的ZFP核酸的表达载体编码。在一些实施方式中,ZFP由可操作地连接至诱导型启动子的核酸编码。在一些方面中,ZFP由可操作地连接至弱启动子的核酸编码。
在一些实施方式中,靶位点在基因的转录起始位点的上游。在一些方面中,靶位点与基因的转录起始位点相邻。在一些方面中,靶位点与基因的转录起始位点下游的RNA聚合酶停止位点相邻。
在一些实施方式中,DNA-靶向分子是或者包括与DNA切割结构域融合的锌指DNA结合结构域以形成锌指核酸酶(ZFN)。在一种实施方式中,融合蛋白包括来自至少一种IIS型限制性酶的切割结构域(或切割半结构域)和一种或多种经或未经工程改造的锌指结合域。在一些实施方式中,切割结构域来自IIS型限制性内切核酸酶Fok I。Fok I通常催化DNA的双链切割,其一是在距其一条链上的识别位点9个核苷酸处,而另一是在距其另一条链上的识别位点13个核苷酸处。参见例如,美国专利号5,356,802、5,436,150和5,487,994;以及Li等,(1992)Proc.Natl.Acad.Sci.USA 89:4275-4279;Li等,(1993)Proc.Natl.Acad.Sci.USA 90:2764-2768;Kim等(1994a)Proc.Natl.Acad.Sci.USA91:883-887;Kim等(1994b)J.Biol.Chem.269:31,978-31,982。
在一些实施方式中,ZFN靶向编码免疫抑制性分子的基因,如编码PD-1和/或PD-L1的基因。在具体实施方式中,ZFN靶向编码PD-L1的基因。在一些方面中,ZFN高效生成双链断裂(DSB),例如,在基因的编码区中的预定位点处。一般靶向的区包括外显子、编码N-末端区的区、第一外显子、第二外显子、和启动子或增强子区。在一些实施方式中,ZFN的瞬时表达促进了对遗传工程改造的细胞中靶基因的高效且永久的破坏。具体地,在一些实施方式中,ZFN的递送导致以超过50%的效率永久性破坏基因。
许多基因特异性工程改造的锌指是市售可得的。例如,Sangamo生物科学公司(Sangamo Biosciences)(美国加利福尼亚州里士满(Richmond,CA,USA))已与西格玛奥德里奇公司(Sigma–Aldrich)(美国密苏里州圣路易斯(St.Louis,MO,USA))合作开发了用于锌指构建的平台(CompoZr),使得研究人员能够绕过锌指构建和验证,并提供针对上千种蛋白质的特异性靶向的锌指。Gaj等,Trends in Biotechnology,2013,31(7),397-405。在一些实施方式中,使用市售的锌指或定制。(参见,例如,西格玛奥德里奇目录号CSTZFND、CSTZFN、CTI1-1KT、和PZD0020)。
2.TALE和TALEN
在一些实施方式中,DNA-靶向分子包括天然产生或工程改造(非天然产生)的转录激活因子样蛋白(TAL)DNA结合结构域,如在激活因子样蛋白效应(TALE)蛋白中,参见,例如,美国专利公开号20110301073,其通过引用全文纳入本文。
TALE DNA结合结构域或TALE是包括一种或多种TALE重复结构域/单元的多肽。重复结构域涉及TALE与其关联靶DNA序列的结合。单一“重复单元”(也称作“重复”)通常是33-35个氨基酸长度,并且与自然产生的TALE蛋白中的其它TALE重复序列显示至少一些序列同源。各TALE重复单元包括1或2个DNA-结合残基,其组成重复可变双残基(RVD),一般在重复的12位和/或13位处。已确定用于这些TALE的DNA识别的天然(规范)编码,因此位于12与13位的HD序列导致结合于胞嘧啶(C),NG结合T、NI结合A、NN结合G或A、并且NG结合T,并且非规范(非典型)RVD也是已知的。参见美国专利公开号20110301073。在一些实施方式中,TALE可通过用针对靶DNA序列的特异性设计TAL阵列来靶向任何基因。靶序列一般从胸苷开始。
在一些实施方式中,分子是DNA结合内切核酸酶,如TALE-核酸酶(TALEN)。在一些方面中,TALEN是包括衍生自TALE的DNA-结合结构域和核酸酶催化结构域以切割核酸靶序列的融合蛋白。在一些实施方式中,TALE DNA-结合结构域已经工程改造以结合编码靶抗原和/或免疫阻遏分子的基因内的靶序列。例如,在一些方面中,TALE DNA-结合结构域可以靶向编码免疫抑制性分子的基因,如编码PD-1和/或PD-L1的基因。在具体实施方式中,TALE DNA-结合结构域靶向编码PD-L1的基因,如CD274。
在一些实施方式中,TALEN识别并切割基因中的靶序列。在一些方面中,DNA切割导致双链断裂。在一些方面中,断裂促进了同源重组或非同源末端连接(NHEJ)的速率。一般而言,NHEJ是不完美的修复过程,其通常导致DNA序列在切割位点处改变。在一些方面中,修复机制包括通过直接再连接(Critchlow和Jackson,Trends Biochem Sci.1998年10月;23(10):394-8)或通过所谓的微同源介导的末端连接再接合2个DNA末端剩余部分。在一些实施方式中,通过NHEJ的修复产生小的插入或缺失,并且可用于破坏,从而抑制基因。在一些实施方式中,修饰可以是至少一个核苷酸的取代、缺失、或添加。在一些方面中,其中已经出现切割诱导的诱变事件,即,与NHEJ事件连续的诱变事件的细胞可通过本领域熟知的方法鉴定和/或选择。
在一些实施方式中,组装TALE重复以特异性靶向基因。(Gaj等,Trends in Biotechnology,2013,31(7),397-405)。已经构建了靶向18740种人蛋白质编码基因的TALEN的文库(Kim等,Nature Biotechnology.31,251–258(2013))。定制设计的TALE阵列通过塞尔克蒂斯公司生物研究公司(Cellectis Bioresearch)(法国巴黎)、Transposagen生物药物公司(美国肯塔基州列克星敦(Lexington,KY,USA))、和生命技术公司(美国纽约州格兰德岛(Grand Island,NY,USA))市售可得。具体地,靶向PD-1的TALEN是市售可得的(参见,复能基因公司(Gencopoeia),目录号HTN212662-1、HTN212662-2和HTN212662-3,可获自万维网www.genecopoeia.com/product/search/detail.php?prt=26&cid=&key=HTN212662)。示例性的分子描述于,例如,美国专利公开号US 2014/0120622和2013/0315884。同样参见http://www.e-talen.org/E-TALEN/和Heigwer等,Nucleic Acids Res.41(20):e190(2013)。
在一些实施方式中,TALEN以由一个或多个质粒载体编码的转基因形式导入。在一些方面中,质粒载体可以包含选择标志物,其提供对接受所述载体的细胞的鉴定和/或选择。
3.RGEN(CRISPR/Cas系统)
在一些实施方式中,使用一种或多种DNA-结合核酸来进行抑制,如通过RNA-导向内切核酸酶(RGEN)的破坏,或通过另一种RNA-导向效应分子的其他阻遏形式。例如,在一些实施方式中,使用成簇规律间隔短回文重复序列(CRISPR)和CRISPR-结合(Cas)蛋白来进行抑制。参见Sander和Joung,Nature Biotechnology,32(4):347-355。
一般而言,“CRISPR系统”笼统指代参与CRISPR-结合(“Cas”)基因表达或指导其活性的转录本或其他元件,包括编码Cas基因的序列、tracr(反式作用CRISPR)序列(例如,tracrRNA或活性部分tracrRNA)、tracr-伴侣序列(在内源性CRISPR系统中包括“直接重复”和tracrRNA-处理的部分直接重复)、引导序列(在内源性CRISPR系统中也称为“间隔子”,或“靶向序列”)、和/或来自CRISPR基因座的其他序列和转录本。
在一些实施方式中,CRISPR/Cas核酸酶或CRISPR/Cas核酸酶系统包括非编码RNA分子(引导)RNA(gRNA),其序列特异性结合DNA,和Cas蛋白(例如,Cas9),具有核酸酶功能(例如,2个核酸酶结构域)或其变体。
在一些实施方式中,CRISPR系统的一个或多个元件衍生自I型、II型、或III型CRISPR系统。在一些实施方式中,CRISPR系统的一个或多个元件衍生自包括内源性CRISPR系统的特定生物体,如酿脓链球菌(Streptococcus pyogenes)或金黄色酿脓葡萄球菌(Staphylococcus aureus)。在一些实施方式中,Cas9核酸酶(例如,由来自金黄色酿脓葡萄球菌或酿脓链球菌的mRNA编码的,例如,pCW-Cas9,艾德基因公司(Addgene)#50661,Wang等(2014)Science,3:343-80-4;或核酸酶或缺刻酶(nickase)慢病毒载体,购自应用生物材料公司(Applied Biological Materials)(ABM;加拿大),目录号K002、K003、K005或K006)和对靶基因(例如,PDCD1基因,其编码PD-1,或CD274基因,其编码PD-L1)具有特异性的引导RNA被导入细胞。
一般而言,CRISPR系统由促进在靶序列位点处形成CRISPR复合物的元件表征。在一些实施方式中,靶序列或靶位点是编码免疫抑制性分子的基因,如编码PD-1和/或PD-L1的基因。例如,靶序列位于编码PD-1的PDCD1基因或编码PD-L1的CD274基因中或其邻近。在具体实施方式中,靶序列或把位点是编码PD-L1的基因,如CD274。一般而言,在形成CRISPR复合物的情况中,“靶序列”一般是指引导序列被针对其设计具有互补性的序列,例如,基因或基因组序列,其中靶序列与引导序列之间的杂交促进形成CRISPR复合物。并不必然需要完全互补,前提是有充足的互补性产生杂交并促进CRISPR复合物形成。在一些实施方式中,选择引导序列以降低引导序列内的二级结构的程度。可通过任意合适的多核苷酸折叠算法来确定二级结构。
一般而言,引导序列包括这样的靶向结构域,其包括与靶多核苷酸序列有足够互补性以与靶序列杂交并引导CRISPR复合物与靶序列的序列特异性结的多核苷酸序列。在一些实施方式中,当使用合适的比对算法进行最佳比对时,引导序列与其相应靶序列之间的互补程度为约或超过约50%、60%、75%、80%、85%、90%、95%、97.5%、99%或更高。在一些实例中,gRNA的靶向结构域与靶核酸的靶序列(如CD274或PDCD1基因中的靶序列)互补,例如,至少80、85、90、95、98或99%互补,例如,完全互补。
可使用任意合适的用于比对序列的算法来确定最佳比对,其非限制性示例包括Smith-Waterman算法、Needleman-Wunsch算法、基于Burrows-Wheeler变换的算法(例如,Burrows Wheeler Aligner)、ClustalW、Clustal X、BLAT、Novoalign(Novocraft技术公司)、ELAND(加利福尼亚州圣迭戈的亿明达公司(Illumina,San Diego,Calif.))、SOAP(可获自soap.genomics.org.cn)、和Maq(可获自maq.sourceforge.net)。在一些实施方式中,引导序列的长度是约或超过约5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、75或更多个核苷酸。在一些实施方式中,引导序列的长度小于约75、50、45、40、35、30、25、20、15、12或更少个核苷酸。可通过任意合适的试验来评价引导序列指导CRISPR/Cas复合物序列特异性结合靶序列的能力。例如,足够形成CRISPR/Cas复合物的CRISPR/Cas系统的组分,包括待测试的引导序列,可提供至具有相应靶序列的细胞,如通过用编码CRISPR/Cas复合物的组分的载体转染,之后评价靶序列内的优先切割,如通过本文所述的Surveyor试验。类似地,可通过提供靶序列,CRISPR/Cas复合物的组分,包括待测试的引导序列和与测试引导序列不同的对照引导序列,并比较测试和对照引导序列反应之间在靶序列处的切割速率或结合,在试管中评估靶多核苷酸序列的切割。
在一些实施方式中,将Cas核酸酶和gRNA(例如,包括靶序列特异性的crRNA与固定的tracrRNA的融合)导入细胞中。一般而言,在gRNA的5’末端处的靶位点使用互补碱基配对将Cas核酸酶靶向所述靶位点,例如,所述基因。在一些实施方式中,基于其原型间隔子邻近基序(PAM)序列刚好5’处的位置选择靶位点,如一般NGG或NAG。在该方面中,通过修饰引导RNA的前20个核苷酸以对应靶DNA序列来使gRNA靶向所需序列。
在一些实施方式中,靶序列位于或靠近编码PD-L1或PD-1的基因(如CD274或PDCD1基因)。在一些实施方式中,与靶向结构域互补的靶核酸位于感兴趣的基因(如CD274和PDCD1)的早期编码区(early coding region)。早期编码区的靶向可以被用于感兴趣基因的敲除(即,感兴趣基因表达的清除)。在一些实施方式中,感兴趣基因的早期编码区包括紧接起始密码子(例如,AUG)的序列,或起始密码子500bp内(例如,少于500、450、400、350、300、250、200、150、100或50bp)的序列。在一些实施方式中,靶序列处于CD274或PDCD1启动密码子的200、150或100bp内。启动子区域或转录起始位点附近的区域的靶向可以被用于感兴趣基因的敲减(即,感兴趣基因表达的减少)。例如,转录起始位点附近的区域可以包括转录起始位点上游500bp内的区域(例如,少于500、450、400、350、300、250、200、150、100或50bp)。在一些实施方式中,靶序列可以在启动子、增强子或其它顺式或反式作用调节区中。
本领域技术人员能够设计和鉴定gRNA序列,所述gRNA序列是或包括靶向CD274或PDCD1的序列,包括外显子序列和调节区的序列,包括启动子和激活因子。用于CRISPR基因组编辑的全基因组gRNA数据库是公众可及的,其中包含人基因组或小鼠基因组中基因的组成型外显子中示例性的单个引导RNA(sgRNA)靶序列(参见例如,genescript.com/gRNA-database.html;同样参见,Sanjana等(2014)Nat.Methods,11:783-4;http://www.e-crisp.org/E-CRISP/;http://crispr.mit.edu/;https://www.dna20.com/eCommerce/cas9/input)。在一些实施方式中,gRNA序列是或包括这样的序列,其具有与非靶基因最小的脱靶结合。
PDCD1中与gRNA靶向结构域序列互补的示例性靶序列在SEQ ID NO:13-18中示出。CD274中与gRNA靶向结构域序列互补的示例性靶序列在SEQ ID NO:19-24中示出。在一些实施方式中,针对PDCD1基因的靶向结构域可以包括这样的序列,所述序列与例如在国际专利申请公布号WO2015/161276中所述gRNA序列的任一示例性靶向结构域相同或具有不超过1、2、3、4或5个核苷酸不同的序列。
在一些实施方式中,CRISPR系统在靶位点处诱导双链断裂(DSB),之后进行破坏,如本文所述。在其他实施方式中,被视为“缺刻酶”的Cas9变体用于在靶位点处切开单链。在一些方面中,使用配对的缺刻酶,例如,以改善特异性,各自由一对不同的gRNA靶向序列指导,使得在诱导缺口的同时导入5’突出端。在其他实施方式中,催化上无活性的Cas9与异源效应结构域,如转录阻遏物或活化因子融合,以影响基因表达。
在一些实施方式中,破坏包括将序列插入基因。一般而言,可用于重组到包含靶序列的靶向的基因座中的序列或模板被称作“编辑模板”或“编辑多核苷酸”或“编辑序列”。在一些方面中,外源性模板多核苷酸可被称为编辑模板。在一些方面中,重组是同源重组。
一般而言,在内源性CRISPR系统中,CRISPR复合物(包括与靶序列杂交并与一个或多个Cas蛋白络合的引导序列)的形成导致在靶序列中或其附近(例如,在来自其中的1、2、3、4、5、6、7、8、9、10、20、50或更多碱基对内)切割一条链或两条链。
在一些实施方式中,还可包括tracr序列,其可包括或由全部或部分野生型tracr序列组成(例如,野生型tracr序列的约或超过约20、26、32、45、48、54、63、67、85、或更多个核苷酸),其也可形成CRISPR复合物的部分,如通过沿着tracr序列的至少一部分与可操作地连接引导序列的tracr伴侣序列的全部或部分杂交。在一些实施方式中,tracr序列与tracr伴侣序列有充足的互补性以杂交并参与CRISPR复合物形成。对于靶序列,在一些实施方式中,完全互补性并非必需。在一些实施方式中,tracr序列在最佳比对时沿tracr伴侣序列的长度有至少50%、60%、70%、80%、90%、95%或99%的序列互补性。
一般而言,tracr伴侣序列包括与tracr序列有足够互补性以促进以下一种或多种的任意序列:(1)在含有相应tracr序列的细胞中切割由tracr伴侣序列侧接的引导序列;和(2)在靶序列处形成CRISPR复合物,其中CRISPR复合物包括与tracr序列杂交的tracr伴侣序列。一般而言,互补程度参考tracr伴侣序列与tracr序列沿两条序列中较短序列的长度的最佳比对。
最佳比对可通过任何合适的比对算法确定,并且还考虑二级结构,如tracr序列或tracr伴侣序列内的自互补。在一些实施方式中,当最佳比对时,tracr序列和tracr伴侣序列之间沿两者之间较短的序列的互补程度是约或超过约25%、30%、40%、50%、60%、70%、80%、90%、95%、97.5%、99%、或更高。在一些实施方式中,tracr序列长度为约或超过约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、50或更多个核苷酸。在一些实施方式中,tracr序列和tracr伴侣序列包含在单个转录本内,使得两者之间的杂交产生具有二级结构如发夹的转录本。在一些方面中,用于发夹结构的环形成序列长度为4个核苷酸,并且具有序列GAAA。然而,可使用较长或较短的环序列,替代序列也可以。在一些实施方式中,序列包括核苷酸三连体(例如,AAA),和额外核苷酸(例如,C或G)。环形成序列的示例包括CAAA和AAAG。在一些实施方式中,转录本或转录的多核苷酸序列具有至少2个或更多个发夹。在一些实施方式中,转录本具有2、3、4或5个发夹。在其他实施方式中,转录本具有至多5个发夹。在一些实施方式中,单个转录本还包括转录终止序列,如聚T序列,例如,6个T核苷酸。
在一些实施方式中,驱动CRISPR系统的一个或多个元件的表达的一个或多个载体被导入细胞中,使得CRISPR系统的元件的表达在一个或多个靶位点处指导CRISPR复合物形成。例如,Cas酶、与tracr-伴侣序列连接的引导序列、和tracr序列可各自可操作地连接分开的载体上的分开的调节元件。或者,从相同或不同调节元件表达的元件中的两个或更多个可在单一载体中组合,一个或多个其他载体提供不包括在第一载体内的CRISPR系统的任意组分。在一些实施方式中,在单一载体中组合的CRISPR系统元件可以任意合适的取向排列,使得一个元件位于第二元件的5′(“上游”)或3′(“下游”)。一个元件的编码序列可位于第二元件的编码序列的相同或相反链上,并且可以相同或相反方向取向。在一些实施方式中,单一启动子驱动编码CRISPR酶的转录本和一种或多种以下的表达:引导序列、tracr伴侣序列(任选地可操作地连接引导序列)、和包埋在一个或多个内含子序列内的tracr序列(例如,各自在不同内含子中,2个或更多个在至少一个内含子中,或者全部在单一内含子中)。在一些实施方式中,CRISPR酶、引导序列、tracr伴侣序列、和tracr序列可操作地连接至同一启动子并从其表达。
在一些实施方式中,载体包括一个或多个插入位点,如限制性内切核酸酶识别序列(也称为“克隆位点”)。在一些实施方式中,一个或多个插入位点(例如,约或超过约1、2、3、4、5、6、7、8、9、10或更多个插入位点)位于一个或多个载体的一个或多个序列元件的上游和/或下游。在一些实施方式中,载体包括在tracr伴侣序列上游,和任选地在可操作地连接tracr伴侣序列的调节元件下游的插入位点,使得在将引导序列插入插入位点并表达之后,引导序列指导CRISPR复合物与真核细胞中靶序列的序列特异性结合。在一些实施方式中,载体包含2个或更多个插入位点,各插入位点位于2个tracr伴侣序列之间以使得在各位点处插入引导序列。在这种排列中,2个或更多个引导序列可包括2个或更多个不同引导序列、单一引导序列的2个或更多个拷贝、或这些的组合。当使用多个不同的引导序列时,可使用单一表达构建体来将CRISPR活性靶向细胞内的多个不同的相应靶序列。例如,单一载体可包括约或超过约1、2、3、4、5、6、7、8、9、10、15、20或更多个引导序列。在一些实施方式中,可提供约或超过约1、2、3、4、5、6、7、8、9、10或更多个这类含引导序列的载体,并任选地递送至细胞。
在一些实施方式中,载体包括可操作地连接编码CRISPR酶(如Cas蛋白)的酶编码序列的调节元件。Cas蛋白的非限制性示例包括Cas1、Cas1B、Cas2、Cas3、Cas4、Cas5、Cas6、Cas7、Cas8、Cas9(也称为Csn1和Csx12)、Cas10、Csy1、Csy2、Csy3、Cse1、Cse2、Csc1、Csc2、Csa5、Csn2、Csm2、Csm3、Csm4、Csm5、Csm6、Cmr1、Cmr3、Cmr4、Cmr5、Cmr6、Csb1、Csb2、Csb3、Csx17、Csx14、Csx10、Csx16、CsaX、Csx3、Csx1、Csx15、Csf1、Csf2、Csf3、Csf4、其同源物、或其修饰形式。这些酶是已知的;例如,可在登录号Q99ZW2下在SwissProt数据库中发现酿脓链球菌(S.pyogenes)Cas9蛋白的氨基酸序列。在一些实施方式中,未修饰的CRISPR酶具有DNA切割活性,如Cas9。在一些实施方式中,CRISPR酶是Cas9,并且可以是来自酿脓链球菌(S.Pyogenes)、金黄色葡萄球菌(S.aureus)或肺炎链球菌(S.pneumoniae)的Cas9。在一些实施方式中,CRISPR酶指导在靶序列位置处,如在靶序列内和/或在靶序列的互补物内的一条或两条链的切割。在一些实施方式中,CRISPR酶指导在距离靶序列的第一或最后核苷酸的约1、2、3、4、5、6、7、8、9、10、15、20、25、50、100、200、500或更多碱基对内切割一条或两条链。
在一些实施方式中,载体编码相对于对应野生型酶突变的CRISPR酶,使得突变的CRISPR酶缺少切割含有靶序列的靶多核苷酸的一条或两条链的能力。例如,来自酿脓链球菌(S.pyogenes)的Cas9的RuvC I催化结构域中的天冬氨酸至丙氨酸的突变(D10A;SEQ ID NO:12)将Cas9从切割两条链的核酸酶转变为缺刻酶(切割单链)。在一些实施方式中,Cas9缺刻酶可与引导序列联用,例如,2个引导序列,其分别靶向DNA靶标的正义链和反义链。这种组合使得两条链被切开并用于诱导NHEJ。
在一些实施方式中,Cas或分开的Cas9缺少内切核酸酶活性。在一些实施方式中,所获得的Cas或分开的Cas9与引导RNA共表达,其中引导RNA被设计为包括靶核酸序列的互补序列,例如,编码PD-L1或PD-1的基因。在一些实施方式中,缺少内切核酸酶活性的Cas9的表达产生感兴趣基因的特异性沉默或减少。这样的系统被命名为CRISPR干扰(CRISPRi)(Qi,Larson等2013)。在一些实施方式中,沉默可以出现在转录或翻译步骤。在一些实施方式中,沉默可以通过直接阻断翻译发生,例如,通过阻断转录延长或通过靶向关键任意启动子中的顺式作用部分,空间上阻断它们的关联反式作用转录因子的结合。在一些实施方式中,缺少内切核酸酶活性的Cas9包括非功能性HNH和RuvC结构域。在一些实施方式中,Cas9或分开的Cas9多肽包括RuvC样和HNH结构域催化残基中失活性突变。例如,切割Cas9活性所需的催化残基可以是酿脓链球菌Cas9的D10、D31、H840、H865、H868、N882和N891(COG3513-SEQ ID NO:11)或使用CLUSTALW方法在Cas家族成员的同源物上对齐的位置。在一些实施方式中,HNH或RuvC基序中包括的残基可以是在上述段落中所述的那些。在一些实施方式中,任意的这些残基可以被其它氨基酸中的任意一个替换,例如,被丙氨酸残基。在一些实施方式中,催化残基中的突变意味着被其它氨基酸所取代,或缺失或添加导致至少一个Cas9催化结构域失活的氨基酸。
Cas9蛋白中突变的非限制性实例是本领域已知的(参见例如,WO2015/161276),其中的任意一种都可以包括在根据所提供的方法的CRISPR/Cas9系统中。
在一些实施方式中,编码CRISPR酶的酶编码序列经密码子优化用于在特定细胞,如真核细胞中表达。真核细胞可以是特定生物体的那些或从中衍生的那些,所述生物体诸如哺乳动物,包括但不限于人、小鼠、大鼠、兔、狗、或非人灵长类。一般而言,密码子优化是指通过将天然序列的至少一个密码子(例如,约或超过约1、2、3、4、5、10、15、20、25、50或更多个密码子)用在宿主细胞的基因中更频繁或最频繁使用的密码子替换修饰核酸序列用于增强宿主细胞中的表达同时保持天然氨基酸序列的过程。各种物种显示出对特定氨基酸的某些密码子的特定偏好。密码子偏好(生物体间密码子使用差异)常和信使RNA(mRNA)的翻译效率相关,继而认为其依赖于被翻译的密码子性质和具体转移RNA(tRNA)分子的有效性。所选tRNA在细胞中的优势通常反映了肽合成中使用最频繁的密码子。因此,可基于密码子优化就给定生物体中最佳的基因表达来调整基因。在一些实施方式中,编码CRISPR酶的序列中的一个或多个密码子(例如,1、2、3、4、5、10、15、20、25、50或更多、或全部密码子)对应于特定氨基酸的最频繁使用的密码子。
在一些实施方式中,CRISPR酶是包含一个或多个异源蛋白质结构域(例如,除CRISPR酶外,约或超过约1、2、3、4、5、6、7、8、9、10或更多个结构域)的融合蛋白的部分。CRISPR酶融合蛋白可包含任何其他蛋白质序列,和任选地任意两个结构域之间的接头序列。可与CRISPR酶融合的蛋白质结构域的示例包括,但不限于,表位标签、报告基因序列、和具有一种或多种以下活性的蛋白质结构域:甲基化酶活性、去甲基化酶活性、转录活化活性、转录抑制活性、转录释放因子活性、组蛋白修饰活性、RNA切割活性和核酸结合活性。表位标签的非限制性示例包括组氨酸(His)标签、V5标签、FLAG标签、流感血凝素(HA)标签、Myc标签、VSV-G标签、和硫氧还蛋白(Trx)标签。报告基因的示例包括但不限于,谷胱甘肽-5-转移酶(GST)、辣根过氧化物酶(HRP)、氯霉素乙酰基转移酶(CAT)β-半乳糖苷酶、β-葡萄糖醛酸糖苷酶、荧光素酶、绿色荧光蛋白(GFP)、HcRed、DsRed、青色荧光蛋白(CFP)、黄色荧光蛋白(YFP)、和自荧光蛋白包括蓝色荧光蛋白(BFP)。CRISPR酶可融合编码结合DNA分子或结合其他细胞分子的蛋白质或蛋白质的片段的基因序列,包括但不限于麦芽糖结合蛋白(MBP)、S-标签、Lex A DNA结合结构域(DBD)融合体、GAL4A DNA结合结构域融合体、和单纯疱疹病毒(HSV)BP16蛋白融合体。可形成包括CRISPR酶的融合蛋白的部分的其他结构域描述于US20110059502,其通过引用纳入本文。在一些实施方式中,带标签的CRISPR酶用于鉴定靶序列的位置。
在一些实施方式中,向细胞递送与引导序列组合(和任选地络合)的CRISPR酶。在一些实施方式中,根据本公开将蛋白质组分导入细胞的方法(例如,Cas9/gRNA RNP)可以通过物理递送方法(例如,电穿孔、颗粒枪、磷酸钙转染、细胞压缩或挤压)、脂质体或纳米颗粒。
用于通过CRISPR敲除PD-1的市售试剂盒、gRNA载体和供体载体可购自,例如,OG公司(OriGene)。参见www.origene.com/CRISPR-CAS9/Product.aspx?SKU=KN210364;目录号KN210364G1,KN210364G2,KN210364D。此外,用于通过CRISPR敲除PD-1的市售可得的试剂盒、gRNA载体和供体载体可购自,例如,OG公司。参见www.origene.com/CRISPR-CAS9/Product.aspx?SKU=KN213071;目录号KN213071G1,KN213071G2,KN213071D。
在一些方面中,在导入CRISPR复合物的细胞中修饰靶多核苷酸,如编码PD-1或PD-L1的基因。在一些实施方式中,该方法包括使CRISPR复合物结合靶多核苷酸以实现对所述靶多核苷酸的切割,从而修饰该靶多核苷酸,其中CRISPR复合物包括与杂交至所述靶多核苷酸内的靶序列的引导序列络合的CRISPR酶,其中所述引导序列连接tracr伴侣序列,其进而杂交至tracr序列。
在一些实施方式中,该方法包括使CRISPR复合物结合靶多核苷酸,使得所述结合导致所述多核苷酸的表达增加或降低;其中CRISPR复合物包括与杂交至所述多核苷酸内的靶序列的引导序列络合的CRISPR酶,其中所述引导序列连接tracr伴侣序列,其进而杂交至tracr序列。
D.条件型基因阻抑系统
在一些实施方式中,编码PD-1或PD-L1的基因,或PD-1或PD-L1分子的缺失,敲除,破坏,表达的减少,表达的破坏,上调的抑制和/或功能的抑制是条件型的。在一些实施方式中,在给予的经抗原受体(例如,CAR)工程改造的细胞的持久性降低后和/或这样的细胞表现出衰竭表型后,可以启动或诱导基因(如编码PD-1和/或PD-L1基因)的条件型阻抑。在一些实施方式中,条件型阻抑可通过产生表现出增加的曝露持续时间的细胞和/或通过允许控制治疗的时间和/或剂量来促进治疗应用。
1.条件型调节物(modulator)
在一些实施方式中,通过用调节因子,如多西环素、四环素或类似物,可以外部控制本文所述任何肽或核酸的表达。四环素的类似物包括,例如,金霉素、土霉素、去甲基氯四环素,甲烯土霉素、多西环素和米诺环素。
在一些实施方式中,可以使用反式激活因子诱导的启动子与所述反式激活因子一起实现可逆的基因沉默。在一些实施方式中,这类反式激活因子诱导的启动子包括用于增强或阻遏感兴趣的核酸或转基因的转录的控制元件。控制元件包括但不限于,操纵子、增强子和启动子。在一些实施方式中,反式激活因子诱导型启动子在结合反式激活因子时有转录活性,其进而在特定条件组下激活,例如,在特定化学信号组合存在或不存在下,例如,通过从例如前述所列出的调节因子中选择的。
反式激活因子诱导的启动子可以是本文所提及的任何启动子,其经修饰以纳入反式激活因子结合序列,如数个tet-操纵子序列,例如,3、4、5、6、7、8、9或10个tet-操纵子序列。在一些实施方式中,tet-操纵子序列是串联的。在一些实施方式中,启动子是四环素响应元件(TRE)。例如,这类序列可以替换U6启动子,包括人U6启动子的远端序列元件(DSE)中Staf和Oct-1的功能性识别位点。
调节因子存在下诱导表达的转录调节物结构域的具体实例包括但不限于,在如下转录调节物中发现的转录调节物结构域:Tet-On转录调节物;和Tet-On晚期转录调节物(Advanced transcription modulator)和the Tet-On 3G转录调节物;这些均可购自加利福尼亚州山景城克隆泰克实验室公司(Clontech Laboratorie)。调节因子不存在下诱导表达的转录调节物结构域的具体实例包括但不限于,在如下转录调节物中发现的转录调节物结构域:Tet-off转录调节物和Tet-off晚期转录调节物;两者均可购自加利福尼亚州山景城克隆泰克实验室公司。可以根据本领域熟知以及普通技术人员将所熟悉的方法使用和适用这些系统。
在一些实施方式中,反式激活因子诱导的启动子包括多个可操作地连接抑制性核酸分子的反式激活因子结合序列。
可以通过这样的核酸分子提供反式激活因子,其在相同的表达载剂或在不同的表达载体,包括可操作地连接编码反式激活因子的序列的调整因子依赖型启动子。术语“不同的表达载体”意在包括用于递送核酸的任何载剂,例如,病毒、质粒、粘粒或转座子。用于所述核酸序列的合适启动子包括,例如,组成型、调控型、组织特异性或遍在启动子,其可以是细胞的、病毒的或合成的,如CMV、RSV、PGK、EF1α、NSE、突触蛋白、β-肌动蛋白、GFAP。
根据一些实施方式,示例性的反式激活因子是rtTA-Oct2反式激活因子,其由Oct-2Q(Q→A)活化结构域和rtTA2-M2的DNA结构域组成。根据一些实施方式,其它示例性的反式激活因子是rtTA-Oct3反式激活因子,其由Oct-2Q(Q→A)活化结构域和Tet-阻遏物蛋白(大肠杆菌)的DNA结构域组成。两者在专利申请WO 2007/004062中描述。
一些实施方式包括分离的编码调节融合蛋白(RPR)的核苷酸序列,其中融合蛋白包括(1)转录阻断结构域,其能够抑制感兴趣的核苷酸序列的表达,和(2)配体-结合结构域,其中在存在能够结合配体-结合结构域的关联配体的情况下,融合蛋白是稳定的。
在一些实施方式中,转录阻断结构域可以源自细菌、噬菌体、真核或酵母阻遏物蛋白。在一些实施方式中,转录阻断结构域源自细菌或噬菌体阻遏物蛋白,例如,TetR、LexA、LacI、TrpR、Arc和λCI。在一些实施方式中,转录阻断结构域源自真核阻遏物蛋白,例如,GAL4。在一些实施方式中,转录阻断结构域是突变的限制性酶,其能够结合DNA,但是不能切割DNA,并且操纵子是限制性酶的识别位点。在一些实施方式中,例如,转录阻断结构域是突变的NotI。
在一些实施方式中,配体-结合结构域衍生自类固醇、甲状腺或类维生素A受体。在一些实施方式中,配体-结合结构域衍生自雌性激素受体,并关联配体是雌性激素。在一些实施方式中,雌性激素受体包含一个或多个突变,例如,T2突变,并且关联配体是他莫昔芬。可以根据本领域熟知以及普通技术人员将所熟悉的方法使用和适用这些系统。
在一些实施方式中,可以使用RheoSwitch系统调节转录。在一些实施方式中,RheoSwitch细胞包括Rheo受体和Rheo激活蛋白质,其可以通过RSL1配体的存在活化。在一些实施方式中,受体和激活因子稳定地二聚化,并且结合响应元件,并且在RSL1配体存在的情况下打开转录(参见例如,“哺乳动物诱导表达系统”的说明书,新英格兰生物实验室公司(New EnglandInc),1.3版,2007年月;Karzenowski,D.等,BioTechiques 39:191-196(2005);Dai,X.等,Protein Expr.Purif 42:236-245(2005);Palli,S.R.等,Eur.J.Biochem.270:1308-1515(2003);Dhadialla,T.S.等,Annual Rev.Entomol.43:545-569(1998);Kumar,M.B,等,J.Biol.Chem.279:27211-27218(2004);Verhaegent,M.和Christopoulos,T.K.,Annal.Chem.74:4378-4385(2002);Katalam,A.K.,等,Molecular Therapy 13:S103(2006);和Karzenowski,D.等,Molecular Therapy 13:S194(2006))。
在一些实施方式中,可以使用电磁能来调节转录,包括例如,WO 2014/018423中描述的方法和系统,其通过引用纳入本文。
在一些实施方式中,RNA转录的可控调节可以通过包括阻遏物结合区实现,例如,针对哺乳动物修饰的lac阻遏物/操纵子系统。
2.通过位点特异性重组的条件型活性
在一些实施方式中,可以在是或编码抑制性物质的引入的核酸整合进宿主基因组后的某个时间将其除去,如通过使用位点特异性重组方法。在一些实施方式中,抑制性物质,如是或编码CRISPR、gRNA、Cas、ZFP、ZFN、TALE、TALEN、RNAi、siRNA、shRNA、miRNA、反义RNA和/或核糖酶的核酸被置于重组位点序列之间,如loxP。在一些实施方式中,核酸包括至少一个(通常两个)位点,用于通过位点特异性重组酶介导的重组。在一些实施方式中,位点特异性重组酶催化DNA片段的导入或从更长的DNA分子切割DNA片段。在一些实施方式中,这些酶识别相对短且独特的核酸序列,其用来识别和重组。在一些实施方式中,重组位点包含短的反向重复序列(6、7或8个碱基长度)以及长度约11至约13bp长度的DNA-结合元件。
在一些实施方式中,载体可以包括多种位点特异性重组酶中任一种的一个或多个重组位点。应当理解的是,针对位点特异性重组酶的靶位点是附加于病毒(例如,慢病毒)基因组整合所需要的任何位点的。在一些实施方式中,核酸包括针对选自下述重组酶的一个或多个位点:Cre、XerD、HP1和Flp。这些酶及其重组位点是本领域已知的(参见例如,Sauer等,1989,Nucleic Acids Res.,17:147;Gorman等,2000,Curr.Op.Biotechnol,11:455;O'Gorman等,1991,Science,251:1351;Kolb,2002,Cloning Stem Cells,4:65;Kuhn等,2002,Methods MoI.Biol,180:175)。
在一些实施方式中,这些重组酶在两个34bp的识别位点(分别是loxP和FRT)之间催化保守DNA重组时间。在一些实施方式中,将可操作地连接启动子元件的异源性核酸序列置于两个loxP位点之间(在这种情况下,该序列是“floxed”的)允许受控表达导入的编码抑制性物质的核酸,如本文所述的那些中的任一种,然后将其转移进细胞。通过在细胞中诱导Cre的表达,异源性核酸序列被切割,因此防止进一步的转录和/或有效地消除序列的表达。一些实施方式包括Cre-介导的基因活化,其中异源性或内源性基因可以被活化,例如,通过移除抑制性元件或聚腺苷酸化位点。
如上所述,在转移进细胞后,在loxP位点之间设置异源性核酸序列允许异源性序列的受控表达。通过在细胞中诱导Cre表达,异源性核酸序列可以被切割,因此防止进一步的转录和/或有效地消除序列的表达。可以多种方式诱导Cre表达。例如,Cre可以在诱导型启动的控制下存在于细胞中,并且可以通过活化启动子来诱导Cre表达。替代或补充地,可以通过导入引导Cre在细胞中表达的表达载体来诱导Cre表达。可以使用任何合适的表达载体,包括但不限于,病毒载体,如慢病毒或腺病毒载体。本文所用短于“诱导Cre表达”指导致细胞中Cre水平增加的任何方法。
包括两个loxP位点的慢病毒载体可以用于任何可以使用包括两个loxP位点的标准载体的应用。例如,可以将选择性标志物安置于loxP位点之间。这允许对于单个细胞(或其后代)多个基因的连续和重复靶向。在将包括floxed的选择性标志物的转移治疗导入细胞后,可以选择稳定的转染子。再将稳定的转染自分离后,可以通过诱导Cre来切出标志物。然后可以将所述标志物用于靶向细胞或其后代的第二基因。可以相同的方式使用包括衍生自转移质粒的慢病毒基因组的慢病毒颗粒。
在一些实施方式中,转移质粒和慢病毒可用于实现细胞、组织或生物体内组成型、条件型、可逆的或组织特异性表达。一些实施方式包括在细胞中可逆地表达转录本的方法,其包括(i)将慢病毒递送到细胞,其中所述慢病毒包括异源性核酸,并且其中所述异源性核酸位于供于位点特异性重组酶的位点之间;和(ii)诱导位点特异性重组酶在细胞内的表达,因而防止转录本在这些细胞内的合成。根据一些实施方式,编码位点特异性重组酶的核酸可操作地连接诱导型启动子,并且诱导步骤包括如上述诱导启动子。
E.编码基因破坏分子和复合物的核酸、物质的递送
在一些方面,将编码核酸分子的核酸给予或导入细胞中,所述核酸分子是、包括或编码核酸抑制性分子,如RNA干扰分子,DNA靶向分子,其复合物(例如,Cas9/gRNA RNP),或组合。在一些实施方式中,通过本领域已知的方法,可以将这样的核酸分子或其复合物导入细胞,如T细胞。这样的方法包括但不限于,以重组病毒载体(例如,逆转录病毒、慢病毒、腺病毒)、脂质体或纳米颗粒的形式导入。在一些实施方式中,方法可以包括显微注射、电穿孔、颗粒轰击、磷酸钙转染、细胞压缩、挤压。在一些实施方式中,可将多核苷酸包括在载体中,更具体地,质粒或病毒中,以供在细胞中表达。
在一些实施方式中,可使用给予病毒和非病毒的基因转移方法将核酸导入细胞,如T细胞。这类方法可用于向宿主生物体中或培养中的细胞给予编码组分的核酸。非病毒载体递送系统包括DNA质粒、RNA(例如,本文所述载体的转录本)、裸核酸和与递送载体(例如脂质体)复合的核酸。非病毒递送核酸的方法包括脂质转染、核转染、显微注射、基因枪、病毒颗粒、脂质体、免疫脂质体、聚阳离子或脂质:核酸偶联物、裸DNA、人工病毒粒,和试剂增强型DNA摄取。脂质转染描述于例如,美国专利号5,049,386、4,946,787和4,897,355,并且脂质转染试剂市售可得(例如,TransfectamTM和LipofectinTM)。适于多核苷酸的高效受体-识别脂质转染的阳离子和中性脂质包括那些Felgner、WO 91/17424、WO 91/16024的那些。可以递送至细胞(例如,体外或离体给予)或靶组织(例如,体内给予)。
在一些实施方式中,递送是通过使用用于递送核酸的基于RNA或DNA病毒的系统。病毒载体递送系统包括DNA和RNA病毒,其在递送至细胞后具有附加体或整合的基因组。对于基因治疗法的综述,参见Anderson,Science 256:808-813(1992);Nabel和Felgner,TIBTECH 11:211-217(1993);Mitani和Caskey,TIBTECH 11:162-166(1993);Dillon.TIBTECH 11:167-175(1993);Miller,Nature 357:455-460(1992);Van Brunt,Biotechnology 6(10):1149-1154(1988);Vigne,Restorative Neurology and Neuroscience 8:35-36(1995);Kremer和Perricaudet,British Medical Bulletin 51(1):31-44(1995);Haddada等,刊于《微生物与免疫学热门主题》(Current Topics in Microbiology and Immunology)Doerfler与B?hm(编)(1995);和Yu等,Gene Therapy 1:13-26(1994)。在一些实施方式中,基于病毒的系统包括用于基因转移的逆转录病毒、慢病毒、腺病毒、腺相关病毒和单纯疱疹病毒载体。
在一些实施方式中,以表达载体,如病毒表达载体的形式给予核酸。在一些方面中,表达载体是慢病毒表达载体、腺病毒表达载体、DNA质粒表达载体、或AAV表达载体。在一些实施方式中,导入的载体,如病毒载体还包括编码移除工程改造的抗原受体(如CAR)的核酸。在一些实施方式中,可以将核酸分子提供给可操作地连接启动子的分开的表达盒,用于由此控制分开的表达。
在一些方面中,包括但不限于谷胱甘肽-5-转移酶(GST)、辣根过氧化物酶(HRP)、氯霉素乙酰基转移酶(CAT)β-半乳糖苷酶、β-葡萄糖醛酸糖苷酶、荧光素酶、绿色荧光蛋白(GFP)、HcRed、DsRed、青色荧光蛋白(CFP)、黄色荧光蛋白(YFP)、和自荧光蛋白包括蓝色荧光蛋白(BFP)的报告基因可被导入细胞中以编码基因产物,其用作标记物,通过其测量基因产物的表达改变或修饰。在另一个实施方式中,可通过载体将编码基因产物的DNA分子导入细胞中。在一些实施方式中,基因产物是荧光素酶。在另一个实施方式中,基因产物的表达降低。
在一些实施方式中,将能够诱导编码PD-1和/或PD=L1的基因(如PDCD1和/或CD274)的遗传破坏,如敲减或敲除的物质以复合物(例如核糖核蛋白(RNP)复合物)的形式导入。RNP复合物包括核糖核苷酸的序列,如RNA或gRNA分子,和多肽,如Cas9蛋白或其变体。在一些实施方式中,Cas9蛋白以RNP复合物递送,所述RNP复合物包括Cas9蛋白和gRNA分子,例如,靶向PDCD1或CD274的gRNA。在一些实施方式中,RNP通过物理递送方法(例如,电穿孔、颗粒枪、磷酸钙转移、细胞压缩或挤压)、脂质体或纳米颗粒被直接导入细胞,所述RNP包括靶向PDCD1或CD274的一个或多个gRNA分子,和Cas9酶或其变体。在具体实施方式中,包括靶向PDCD1或CD274的一个或多个gRNA分子以及Cas9酶或其变体的RNP通过电穿孔导入。
在一些实施方式中,可以使用多种用于评价细胞中基因破坏的熟知试验中的任一种来评估不同时间点(例如,转移后24至72小时)上基因(例如,PDCD1或CD274)的敲除程度。可以使用多种用于评价细胞中基因破坏的熟知试验中的任一种,如确定转录或蛋白质表达或细胞表面表达的水平的试验来评估不同时间点(例如,转移后24至72小时)上基因(例如,PDCD1或CD274)的敲除程度。
IV.给予的组合物、制剂和方法
还提供细胞、细胞群,和包含所述细胞和群(如通过本文提供的方法产生的细胞和群)的组合物(包括药物和治疗组合物)。还提供方法,例如,用于将所述细胞和组合物备于对象(例如患者)的治疗方法。
A.组合物和制剂
还提供了包括用于给药的细胞的组合物,包括药物组合物和制剂,如来自包括给定剂量或其部分的用于给药的细胞数量的单位剂型组合物。所述药物组合物和制剂一般包括一种或多种任选的药学上可接受的运载体或赋形剂。在一些实施方式中,所述组合物包括至少一种其它治疗剂。
术语“药物制剂”指此类形式的制剂:所述制剂允许其中所含活性成分的生物学活性有效,并且不含具有待给予该制剂的对象不可接受的毒性的额外成分。
“药学上可接受的运载体”指药物制剂中的一种成分,其不是活性成分,其对于对象无毒性。药学上可接受的运载体包括但是不限于,缓冲剂、赋形剂、稳定剂或防腐剂。
在一些方面中,运载体的选择部分由特定细胞和/或给药方法来确定。因此,存在多种合适的配方。例如,所述药物组合物可包含防腐剂。合适的防腐剂可包括,例如,对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸钠和苯扎氯铵。在一些方面中,采用两种或更多种防腐剂的混合物。防腐剂或其混合物的存在量通常是约0.0001%至约2%(以组合物总重量计)。运载体描述于,例如,《雷明顿药物科学》(Remington's Pharmaceutical Sciences),第16版,Osol,A.编(1980)。在所用剂量和浓度下,药学上可接受的运载体通常是对受者无毒的,包括但不限于:缓冲剂如磷酸盐、柠檬酸盐和其它有机酸缓冲剂;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;氯化六烃季铵;苯扎氯铵、苄索氯铵;苯酚、丁基或苄基醇;对羟基苯甲酸烷酯,如对羟基苯甲酸甲酯或丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(小于约10个残基)的多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷胺酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其它糖,包括葡萄糖、甘露糖或糊精;螯合剂,如EDTA;糖,如蔗糖、甘露醇、海藻糖或山梨糖醇;形成盐的抗衡离子,如钠;金属络合物(如Zn-蛋白质络合物);和/或非离子型表面活性剂,例如聚乙二醇(PEG)。
在一些方面中,所述组合物包含缓冲剂。合适的缓冲剂包括,例如,柠檬酸、柠檬酸钠、磷酸、磷酸钾和多种其他酸和盐。在一些方面中,采用两种或更多种缓冲剂的混合物。缓冲剂或其混合物的存在量通常是约0.001%至约4%(以组合物总重量计)。用于制备可给予的药物组合物的方法是已知的。示例性方法具体描述于,例如,《雷明顿:药物科学与实践》(Remington:The Science and Practice of Pharmacy),LWW公司(Lippincott Williams&Wilkins);第21版(2005年5月1日)。
该制剂可包含水溶液。所述制剂或组合物还可包含多于一种活性成分,该活性成分可用于待用所述细胞治疗的特定适应症、疾病或病症,优选对所述细胞具有补充活性的那些,其中相应活性剂彼此不产生负面影响。这类活性成分适合以有效用于所需目的的用量联合存在。因此,在一些实施方式中,所述药物组合物还包含其它药学活性物质或药物,例如化疗剂,例如,天冬酰胺酶,白消安,卡铂,顺铂,柔红霉素,多柔比星,氟尿嘧啶,吉西他滨,羟基脲,甲氨蝶呤,紫杉醇,利妥昔单抗,长春碱,和/或长春新碱。
在一些实施方式中,药物组合物包含有效治疗或预防疾病或病症的量,如治疗有效或预防有效量的细胞。在一些实施方式中,通过定期评估治疗的对象来监测治疗或预防性功效。所需剂量可以通过单药丸给予所述细胞,通过多药丸给予所述细胞或通过连续输注给予细胞来递送。
该细胞和组合物可采用标准给予技术、制剂和/或装置给予。所述细胞的给予可以是自体同源或异源的。例如,免疫抑制细胞或祖细胞可获自一个对象,并给予相同对象或不同的相容对象。外周血衍生的免疫抑制细胞或其后代(例如,体内、离体或体外衍生的)可通过局部注射给予,包括导管给药、全身注射、局部注射、静脉注射、或胃肠外给药。当给予治疗性组合物(例如,含有遗传修饰的免疫抑制细胞的药物组合物)时,其通常被配制成单位剂型的可注射形式(溶液、悬液、乳液)。
制剂包括用于口服、静脉内、腹膜内、皮下、肺、透皮、肌肉内、鼻内、粘膜、舌下或栓剂给药的那些。在一些实施方式中,所述细胞群胃肠外给予。本文所用的术语“胃肠外”,包括静脉内、肌内、皮下、直肠、阴道和腹膜内给予。在一些实施方式中,所述细胞通过静脉内,腹膜内或皮下注射采用外围全身递送给予对象。
在一些实施方式中,组合物以无菌液体制剂的形式提供,例如,等渗水性溶液、悬液、乳液、分散体或粘性组合物,其在一些方面中可缓冲至选择的pH。液体制剂通常比凝胶、其他粘性组合物和固体组合物更容易制备。另外,液体组合物多少更便于给药,尤其是通过注射。在另一方面,粘性组合物可在合适的粘度范围内配制以提供与特定组织更长的接触时间。液体或粘性组合物可包括运载体,其可以是溶剂或分散介质,其含有,例如,水、盐水、磷酸盐缓冲盐水、多羟基化合物(例如,甘油、丙二醇、液体聚乙二醇)及其合适混合物。
可通过将所述细胞纳入溶剂中,如与合适的运载体、稀释剂、或赋形剂如无菌水、生理盐水、葡萄糖、右旋糖等来制备无菌可注射溶液。组合物可含有辅助性物质,如润湿、分散、或乳化剂(例如,甲基纤维素)、pH缓冲剂、胶凝或粘度增强添加剂、防腐剂、风味剂、和/或色素,取决于所需的给药和制备途径。在一些方面中,可查阅标准教科书来制备合适制备物。
可添加增强组合物稳定性和无菌性的各种添加剂,包括抗微生物防腐剂、抗氧化剂、螯合剂和缓冲剂。也可通过各种抗细菌剂和抗真菌剂,如对羟基苯甲酸酯类、氯丁醇、苯酚、和山梨酸确保防止微生物的作用。可通过使用延迟吸收的物质,如单硬脂酸铝和明胶延长可注射药物形式的吸收。
用于体内给药的制剂一般为无菌的。无菌可例如通过无菌滤膜过滤来容易地实现。
B.过继细胞治疗中给予的方法和细胞的应用
提供给予所述细胞、群和组合物的方法,和所述细胞、群和组合物用于治疗或防止疾病、病症和紊乱,包括癌症,的应用。在一些实施方式中,将所述细胞、群和组合物给予具有具体待治疗(例如,通过过继细胞治疗,例如过继T细胞治疗)的疾病或病症的对象或患者。在一些实施方式中,将通过本文提供的方法制备的细胞和组合物,例如在孵育和/或其它处理步骤之后工程改造的组合物和生产终末组合给予对象,如具有所述疾病或病症或有风险患上所述疾病或病症的对象。在一些方面中,所述方法由此治疗,例如,减轻所述疾病或病症的一种或多种症状,例如通过减小表达由工程改造的T细胞识别的抗原的癌症中的肿瘤负荷。
用于给予用于过继细胞治疗的细胞的方法是已知的,并可与本文提供的方法和组合物联用。例如,过继T细胞治疗方法描述于,例如,Gruenberg等的美国专利申请公开号2003/0170238;Rosenberg的美国专利号4,690,915;Rosenberg(2011)Nat Rev Clin Oncol.8(10):577-85)。参见例如,Themeli等(2013)Nat Biotechnol.31(10):928-933;Tsukahara等.(2013)Biochem Biophys Res Commun 438(1):84-9;Davila等(2013)PLoS ONE 8(4):e61338。
本文中所用的“对象”是哺乳动物,例如人或其它动物,并且通常是人。在一些实施方式中,向其给予所述细胞、细胞群或组合物的对象(例如,患者)是哺乳动物,通常是灵长类,例如人。在一些实施方式中,所述灵长类是猴子或猿。所述对象可以是男性或女性,并且可以是任何合适的年龄,包括婴儿,少年,青少年,成人,和老年对象。在一些实施方式中,所述对象是非灵长类哺乳动物,例如啮齿类。
本文中所用的术语“治疗”(及其语法变化形式例如“治疗的”和“治疗性”)指完全或部分减轻或减少疾病或病症或紊乱或与其相关的症状、不利作用或结果或表型。所需的治疗效果包括但不限于,预防疾病的发生或复发、减轻症状、减少疾病的任何直接或间接病理学结果、防止转移、减缓疾病进展速率、改善或减轻疾病状态,和减轻或改善预后。该术语不表示完全治愈疾病或完全消除任何症状或对所有症状或结果具有效果。
本文中所用的“延迟疾病的发展”表示推迟、阻碍、减缓、减慢、稳定、遏制和/或拖延所述疾病(例如癌症)的发展。该延迟可具有不同的时间长度,这取决于疾病史和/或待治疗的个体。本领域技术人员应明了,实际上,充分或显著的延可涵盖预防(对于未发展所述疾病的个体而言)。例如,晚期癌症,例如转移的发展,可被延迟。
本文中所用的“预防”包括对于疾病在倾向于发展疾病但尚未被诊断患病的对象中的发生或复发提供预防方法。在一些实施方式中,所提供的细胞和组合物用于延迟疾病发展或减缓疾病进展。
本文中所用的“阻抑”功能或活性意指,在与其它情况下的相同(除感兴趣病症或参数)病症相比时或者相较于另一病症,功能或活性的减少。例如,与没有细胞下的肿瘤生长速率相比,阻抑肿瘤生长的细胞降低了肿瘤的生长速率。
试剂,例如,药物制剂、细胞或组合物,在给予情况下的“有效量”,指某一个量,其在一定剂量/量下且作用必要的时间长度时,有效于实现所需结果,例如治疗或预防结果。
试剂,例如,药物制剂或细胞的“治疗有效量”,指某一个量,其在剂量上和必需时程上,有效于实现所需治疗结果,例如疾病、病症或紊乱的治疗,和/或该治疗的药物动力学或药代动力学效果。治疗有效量可根据多种因素变化,例如,疾病状态、年龄、性别,和对象体重,以及给予的细胞群。在一些实施方式中,所提供的方法涉及给予有效量(例如,治疗有效量)的所述细胞和/或组合物。
“预防有效量”指某一个量,其对于一定剂量和必要时程而言,有效于实现所需预防结果。通常而言(但不一定),由于预防剂量在疾病的早期或之前用于对象,预防有效量将小于治疗有效量。在较低肿瘤负荷的情况中,在一些方面中,预防有效量将高于治疗有效量。
在一些实施方式中,所述细胞治疗,例如,过继T细胞治疗,通过如下方式进行:自体转移,其中所述细胞经分离和/或在其它情况中从接受所述细胞治疗的对象或从源自此类对象的样品制备。因此,在一些方面中,所述细胞源自需要治疗和所述细胞的对象(例如,患者),其在分离和处理之后给予同一对象。
在一些实施方式中,所述细胞治疗,例如,过继T细胞治疗,通过如下方式进行:同种异体转移,其中所述细胞分离和/或在其它情况中从对象制备,该对象与待接受或最终接受所述细胞治疗的对象(例如,第一对象)不同。在此类实施方式中,然后将所述细胞给予相同物种的不同对象,例如,第二对象。在一些实施方式中,所述第一和第二对象是遗传学相同的。在一些实施方式中,所述第一和第二对象是遗传学相似的。在一些实施方式中,所述第二对象表达与第一对象相同的HLA类别或超类型。
在一些实施方式中,在给予细胞或包含细胞的组合物之前,已经用靶向疾病或病症,例如,肿瘤的治疗剂治疗对象。在一些方面中,对象对于其他治疗剂是难治性的或非响应性的。在一些实施方式中,对象具有持续或复发的疾病,例如,在用另一种治疗性介入之后,包括化疗、放射、和/或造血干细胞移植(HSCT),例如,同种异体HSCT。在一些实施方式中,所述给予有效地治疗对象,无论该对象是否已对另一种疗法具有抗性。
在一些实施方式中,对象对其他治疗剂有响应性并且用治疗剂治疗降低了疾病负荷。在一些方面中,对象初始对治疗剂有响应性,但是随着时间显示出疾病或病症的复发。在一些实施方式中,对象还没有复发。在一些这类实施方式中,所述对象经测定具有复发风险,如处于复发高风险中,并且由此预防性地给予细胞,例如,以减小复发可能性或预防复发。
在一些方面中,对象还没有接受用另一种治疗剂的在先治疗。
用于采用本文提供的组合物、细胞、方法和应用治疗的所述疾病、病症和紊乱包括:肿瘤,包括实体肿瘤、血液恶性肿瘤,和黑素瘤,以及感染性疾病,例如病毒或其它病原体,例如,HIV,HCV,HBV,CMV的感染,和寄生性疾病。在一些实施方式中,所述疾病或病症是肿瘤,癌症,恶性肿瘤,赘生物,或其它增殖性疾病或病症。所述疾病包括但不限于:白血病、淋巴瘤、例如、慢性淋巴细胞白血病(CLL)、急性淋巴细胞性白血病(ALL)、非霍奇金氏淋巴瘤、急性骨髓性白血病、多发性骨髓瘤、难治滤泡性淋巴瘤淋巴瘤、套细胞淋巴瘤、惰性B细胞淋巴瘤、B细胞恶性瘤、结肠癌、肺癌、肝癌、乳腺癌、前列腺癌、卵巢癌、皮肤癌、包括黑素瘤、骨癌、和脑癌、卵巢癌、上皮癌、肾细胞癌、胰腺腺癌、霍奇金淋巴瘤、宫颈、结肠直肠癌、胶质母细胞瘤、成神经细胞瘤、尤文肉瘤、成神经管细胞瘤、骨肉瘤、滑膜肉瘤,和/或间皮瘤。
在一些实施方式中,所述疾病或病症是感染性疾病或病症,例如但不限于,病毒、逆转录病毒、细菌和原生动物感染、免疫缺陷、巨细胞病毒(CMV)、EB病毒(EBV)、腺病毒、BK多瘤病毒。在一些实施方式中,所述疾病或病症是自体免疫或炎性疾病或病症,例如关节炎,例如类风湿性关节炎(RA),I型糖尿病,系统性红斑狼疮(SLE),炎性肠病,牛皮癣,硬皮病,自身免疫性甲状腺疾病,格雷夫斯病,克罗恩病多发性硬化,哮喘和/与移植相关的疾病或病症。
在一些实施方式中,与所述疾病或紊乱相关联的抗原选择自下组:孤儿酪氨酸激酶受体RORl、tEGFR、Her2、Ll-CAM、CD19、CD20、CD22、间皮素、CEA、和肝炎B表面抗原、抗叶酸受体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、0EPHa2、ErbB2、3、或4、FBP、胎儿乙酰胆碱e受体、GD2、GD3、HMW-MAA、IL-22R-α、IL-13R-α2、kdr、κ轻链、Lewis Y、L1-细胞粘附分子、MAGE-A1、间皮素、MUC1、MUC16、PSCA、NKG2D配体、NY-ESO-1、MART-1、gp100、癌胚抗原、ROR1、TAG72、VEGF-R2、癌胚抗原(CEA)、前列腺特异性抗原、PSMA、Her2/neu、雌激素受体、孕酮受体、酪氨酸蛋白激酶B2、CD123、CS-1、c-Met、GD-2,和MAGE A3和/或生物素化分子,和/或通过HIV、HCV、HBV或其它病原体表达的分子。
在一些实施方式中,所述细胞以所需剂量给予,其在一些方面中包括所需剂量或细胞数量或细胞类型和/或所述细胞类型的所需比率。因此,在一些实施方式中,细胞剂量基于总细胞数量(或数量/kg体重)和个体群或亚型的所需比率,例如CD4+与CD8+之比。在一些实施方式中,细胞剂量基于个体群中细胞的所需总数(或数量/kg体重)或个体细胞类型。在一些实施方式中,所述剂量基于此类特征的组合,例如总细胞所需数量、所需比率,和个体群中的所需总细胞数量。
在一些实施方式中,所述细胞的群或亚型,例如CD8+和CD4+T细胞,在或处于总细胞的所需剂量,例如T细胞的所需剂量的耐受差异之内给予。在一些方面中,所述所需的剂量是所需的细胞数量或所需的细胞数量/向其给予所述细胞的对象的体重单位,例如,细胞/kg。在一些方面中,所需剂量是或高于最小细胞数量或最小细胞数量/体重单位。在一些方面中,在以所需剂量给予的总细胞中,个体群或亚型以或接近所需的输出比(例如CD4+与CD8+之比)存在,例如,处于所述比率的某一耐受差异或误差之内。
在一些实施方式中,所述细胞以或在细胞的一种或多种个体群或亚型的所需剂量的耐受差异之内给予,例如CD4+细胞的所需剂量和/或CD8+细胞的所需剂量。在一些方面中,所需剂量是所述亚型或群的所需细胞数量,或此类细胞的所需数量/向其给予所述细胞的对象的体重单位,例如,细胞/kg。在一些方面中,所需剂量是或高于所述群或亚型的最小细胞数量,或所述群或亚型的最小细胞数量/体重单位。
因此,在一些实施方式中,所述剂量基于总细胞的所需固定剂量和所需比率,和/或基于所述个体亚型或亚群的一种或多种,例如,各自,的所需固定剂量。因此,在一些实施方式中,所述剂量基于T细胞的所需固定或最小剂量和所需CD4+与CD8+细胞之比,和/或基于CD4+和/或CD8+细胞的所需固定或最小剂量。
在某些实施方式中,所述细胞,或细胞亚型的个体群,以如下范围给予所述对象:约100万至约1000亿细胞,例如,100万至约500亿细胞(例如,约5百万细胞,约2500万细胞,约500亿细胞,约10亿细胞,约50亿细胞,约200亿细胞,约300亿细胞,约400亿细胞,或前述任何两个值之间确定的范围),例如约1000万至约1000亿细胞(例如,约2000万细胞,约3000万细胞,约4000万细胞,约6000万细胞,约7000万细胞,约8000万细胞,约9000万细胞,约100亿细胞,约250亿细胞,约500亿细胞,约750亿细胞,约900亿细胞,或前述任何两个值之间确定的范围),和在一些情况中,约1亿细胞至约500亿细胞(例如,约1.2亿细胞,约2.5亿细胞,约3.5亿细胞,约4.5亿细胞,约6.5亿细胞,约8亿细胞,约9亿细胞,约30亿细胞,约300亿细胞,约450亿细胞)或这些范围之间任何值。
在一些实施方式中,总细胞剂量和/或细胞个体亚群剂量在如下范围中:介于是或约是104和是或约是109细胞/千克(kg)体重之间,如介于105和106细胞/kg体重之间,例如,至少或至少约或是或约是1x105细胞/kg,1.5x105细胞/kg,2x105细胞/kg,或1x106细胞/kg体重。例如,在一些实施方式中,所述细胞以如下量或在一定误差范围内给予:介于是或约是104和是或约是109T细胞/千克(kg)体重之间,如介于105和106T细胞/kg体重之间,例如,至少或至少约或是或约是1x105T细胞/kg,1.5x105T细胞/kg,2x105T细胞/kg,或1x106T细胞/kg体重。
在一些实施方式中,所述细胞以如下量或在一定误差范围内给予:介于是或约是104和是或约是109CD4+和/或CD8+细胞/千克(kg)体重之间,如介于105和106CD4+和/或CD8+细胞/kg体重之间,例如,至少或至少约或是或约是1x105CD4+和/或CD8+细胞/kg,1.5x105CD4+和/或CD8+细胞/kg,2x105CD4+和/或CD8+细胞/kg,或1x106CD4+和/或CD8+细胞/kg体重。
在一些实施方式中,所述细胞以如下量或在一定误差范围内给予:大于和/或至少约1x106,约2.5x106,约5x106,约7.5x106,或约9x106CD4+细胞,和/或至少约1x106,约2.5x106,约5x106,约7.5x106,或约9x106CD8+细胞,和/或至少约1x106,约2.5x106,约5x106,约7.5x106,或约9x106T细胞。在一些实施方式中,所述细胞以如下量或在一定误差范围内给予:介于约108和1012或介于约1010和1011T细胞之间,介于约108和1012或介于约1010和1011CD4+细胞之间,和/或介于约108和1012或介于约1010和1011CD8+细胞之间。
在一些实施方式中,所述细胞按如下量或在一定误差范围内给予:多重细胞群或亚型,例如CD4+和CD8+细胞或亚型的所需输出比。在一些方面中,所需比率可以是特定比率或可以是比率范围。例如,在一些实施方式中,所需比率(例如,CD4+与CD8+细胞之比)介于是或约是5:1和是或约是5:1(或大于约1:5和少于约5:1)之间,或介于是或约是1:3和是或约是3:1(或大于约1:3和少于约3:1)之间,例如介于是或约是2:1和是或约是1:5(或大于约1:5和少于约2:1,例如是或约是5:1,4.5:1,4:1,3.5:1,3:1,2.5:1,2:1,1.9:1,1.8:1,1.7:1,1.6:1,1.5:1,1.4:1,1.3:1,1.2:1,1.1:1,1:1,1:1.1,1:1.2,1:1.3,1:1.4,1:1.5,1:1.6,1:1.7,1:1.8,1:1.9,1:2,1:2.5,1:3,1:3.5,1:4,1:4.5或1:5。在一些方面中,所述耐受差异在所需比率的约1%,约2%,约3%,约4%约5%,约10%,约15%,约20%,约25%,约30%,约35%,约40%,约45%,约50%之内,包括这些范围之间的任何值。
对于预防或治疗疾病,合适剂量可取决于待治疗的疾病类型,重组受体或细胞类型,疾病的严重程度和疾病病程、该细胞是否给予用于预防性或治疗性目的、先前治疗、对象的临床史和对所述细胞的响应,以及主治医师的判断。在一些实施方式中,所述组合物和细胞适合在一个时间点或以一系列治疗来给予对象。
所述细胞可通过任何合适的方式给予,例如,通过注射,例如,静脉内或皮下注射、眼内注射、眼底注射、视网膜下注射、玻璃体内注射、反间隔注射、巩膜下注射、脉络膜内注射、前房注射、结膜下(subconjectval)注射、结膜下(subconjuntival)注射、巩膜上腔注射、球后注射、眼周注射或球周递送。在一些实施方式中,它们通过胃肠外、肺内的和鼻内,以及如果希望局部治疗,病灶内给予。腹膜外输注包括肌内、静脉内、动脉内、腹膜内或皮下给予。在一些实施方式中,通过单次推注给予细胞来给予给定剂量。在一些实施方式中,通过多次推注给予细胞,例如,在不超过3天的时间上,或通过连续输注给予细胞来给予。
在一些实施方式中,所述细胞作为联合治疗的部分给予,例如,与另一治疗性介入,例如抗体或经工程改造的细胞或受体或试剂,例如细胞毒性或治疗剂,同时或依次地,以任何顺序给予。在一些实施方式中,细胞与一种或多种其它治疗剂共同给予,或与另一治疗介入联合,同时或以任何顺序依次进行。在一些情况中,所述细胞与另一治疗在足够接近的时间共同给予,从而所述细胞群增强一种或多种其它治疗剂的作用,反之亦然。在一些实施方式中,所述细胞在一种或多种其它治疗剂之前给予。在一些实施方式中,所述细胞在一种或多种其它治疗剂之后给予。在一些实施方式中,一种或多种其他治疗剂包括细胞因子,如IL-2,例如,以增强持久性。在一些实施方式中,所述方法包括化疗剂的给予。
在给予细胞之后,在一些实施方式中,检测工程改造的细胞群的生物活性,例如,通过任何数量的已知方法进行。用以评估的参数包括:工程改造的或天然T细胞或其它免疫细胞与抗原的特异性结合,体内方式(例如,通过成像)或离体方式(例如,通过ELISA或流式细胞术)。在某些实施方式中,工程改造的细胞破坏靶细胞的能力可采用本领域已知的任何合适的方法来检测,例如描述于如下文献的细胞毒性试验,例如,Kochenderfer等,J.Immunotherapy,32(7):689-702(2009),和Herman等.J.Immunological Methods,285(1):25-40(2004)。在某些实施方式中,通过测定一种或多种细胞因子,例如CD107a,IFNγ,IL-2和TNF的表达和/或分泌,来检测细胞的生物活性。在一些方面中,生物活性通过评估临床结果,例如肿瘤负荷或负载的减少,来检测。
在某些实施方式中,所述工程改造的细胞以任何数量的方式进一步修饰,从而增加其治疗或预防性功效。例如,通过所述群表达的工程改造的CAR或TCR可通过接头直接或间接地偶联靶向部分。偶联化合物,例如,将CAR或TCR连接至靶向部分的实践是本领域已知的。参见例如,Wadwa等,J.Drug Targeting 3:1 1 1(1995),和美国专利5,087,616。
给药方案或计划
在一些实施方式中,提供了重复剂量方法,其中在给予第一剂量细胞后给予一个或多个第二连接剂量。通常设计多剂量细胞的时机和大小,从而在过继治疗方法中将表达抗原的T细胞(如表达CAR的T细胞)给予对象时,增强其功效和/或活性和/或功能。在一些实施方式中,重复剂量降低下调或抑制活性,这可能在如PD-1和/或PD-L1的抑制性免疫分子在表达抗原的T细胞(如表达CAR的T细胞)上被上调时出现。该方法包括通常在一个或多个继续剂量之后,在不同剂量之间的特定时间范围内给予第一剂量。
在过继细胞治疗的情况下,给予给定的“剂量”包括以单一组合物和/或单次不间断给药,例如以单次注射或连续输注给予给定量或数量的细胞,并且还包括在不超过3天特定时间段内,以分开剂量,在多个单独组合物或输注物中提供,给予给定量或数量的细胞。因此,在一些情况下,第一或继续剂量是在单个时间点给予或开始的指定数量的细胞的单次或连续给予。然而,在一些情况下,第一或继续剂量在不超过三天的时间段内进行多次注射或输注,例如每天一次持续三天或两天,或通过在一天时间内的多次输注。
因此,在一些方面,第一剂量的细胞以单一药物组合物给予。在一些实施方案中,继续剂量的细胞以单一药物组合物给予。
在一些实施方式中,第一剂量的细胞以总体含有第一剂量的细胞的多个组合物给予。在一些实施方式中,继续剂量的细胞以总体含有继续剂量的细胞的多个组合物给予。在一些方面,可以在不超过3天的时间内以多个组合物给予额外的继续剂量。
术语“分开剂量”是指分开的剂量,使其在超过一天的时间内给药。这种类型的给药包括在本方法中,并且被认为是单一剂量。
因此,在一些方面中,第一剂量和/或继续剂量可以分开剂量给予。例如,在一些实施方式中,可在2天或3天内向对象给予该剂量。分开给药的示例性方法包括在第一天给予25%的剂量,并在第二天给予剩余的75%的剂量。在其他实施方式中,第一剂量的33%可以在第一天给予,而在第二天给予剩余的67%。在一些方面,在第一天给予10%的剂量,在第二天给予30%的剂量,并且在第三天给予60%的剂量。在一些实施方式中,分开剂量扩展不超过3天。
关于前施剂量,例如第一剂量,术语“继续剂量”是指在在先的,例如,第一剂量之后期间没有向对象给予任何间插剂量的情况下给予受试者的剂量。尽管如此,该术语不包括在单次分开剂量内包含的一系列输注或注射中的第二,第三和/或其他注射或输注。因此,除非另有说明,否则在一天、两天或三天内的第二输注不被认为是本文所用的“连续”剂量。相似地,在分开剂量内的多个剂量系列中的第二,第三和其他的剂量也不被认为是“连续”剂量意义内容中的“间插”剂量。因此,除非另有说明,即使在对象在第一剂量开始之后接受第二或后施注射或输注,在第一或前施剂量开始之后,在超过3天的一定时间段给予的剂量被认为是“连续”剂量只要在第一或前施剂量开始后的三天时间内开始第二或后施注射或输注。
因此,除非另有说明,否则在多达3天的时间段内将相同细胞的多次给予视为单一剂量,并且在初始给药后3天内给予细胞不被认为是继续剂量,并且不被认为是以确定第二剂量是否与第一剂量“连续”为目的的间插剂量。
在一些实施方式中,在一些方面,给予多个继续剂量,使用与关于第一剂量和第一继续剂量之间的时间相同的时序指导,例如通过给予第一和多个继续剂量,每个继续剂量在一段时间内给予,在这段时间中,抑制性分子(如PD-1和/或PD-L1)在对象细胞中由于第一剂量的给予已经被上调。对于本领域技术人员而言可以凭经验确定合适提供继续剂量,如通过外周血或其它体液评估表达抗原的细胞(如表达CAR的细胞)中PD-1和/或PD-L1的水平。
在一些实施方式中,第一剂量和第一继续剂量或第一和多个继续剂量之间的时间如下:各继续剂量在大于约5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天或更久的时间段中给予。在一些实施方式中,给予第一剂量或紧邻的前施剂量之后,继续剂量在少于约28天的时间段中给予。额外的多个其他继续剂量也称为后续剂量或后续继续剂量。
通常设计第一和/或一个或多个继续剂量的细胞的大小以提供改善的功效和/或降低的毒性风险。在一些方面中,第一剂量或任何继续剂量的剂量的量或大小是如上所述的任何剂量或量。在一些实施方式中,第一剂量或任何继续剂量中细胞的数量为约0.5x106细胞/kg对象体重至5x106细胞/kg,约0.75x106细胞/kg至3x106细胞/kg或约1x106细胞/kg至2x106细胞/kg,各自包括端值。
如本文所用,“第一剂量”用于描述在给予连续或后续剂量之前给定剂量的时间。该术语并不一定意味着对象之前从未接受过一定剂量的细胞治疗,或者对象之前还没有接受表达相同重组受体或靶向相同抗原的相同细胞的剂量。
在一些实施方式中,继续剂量的由细胞表达的受体,例如,CAR包含至少一种免疫反应性表位作为由第一剂量的细胞表达的受体,例如,CAR。在一些方面,由以继续剂量给予的细胞表达的受体(例如CAR)与例如由第一剂量表达的受体,例如CAR相同,或者与由第一剂量给予的细胞表达的受体,例如CAR基本相同。
由以各种剂量给予对象的细胞表达的重组受体(例如CAR)通常识别或特异性结合被治疗的疾病或病症或细胞所表达的、与之相关的和/或特异性的分子。在特异性结合分子例如抗原时,受体通常将免疫刺激信号(例如ITAM转导的信号)递送到细胞中,从而促进靶向疾病或病症的免疫应答。例如,在一些实施方式中,第一剂量中的细胞表达特异性结合由疾病或病症的细胞或组织表达的抗原或与疾病或病症相关的抗原的CAR。
V.定义
本文使用的术语“约”是指本技术领域技术人员容易知晓的各值的通常误差范围。本文中述及“约”值或参数,包括(并描述)指向该值或参数本身的实施方式。
如本文所用,单数形式的“一个”、”一种“和”该“包括复数指代对象,除非文本中另有明确说明。例如,”一种“或”一个“指”至少一种或一个”或“一种(个)或多种(个)”。
本公开内容中,请求保护的主题的各个方面均以范围形式呈现。应当理解,范围形式的描述仅仅是为了方便和简洁,并且不应被解释为对所要求保护的主题的范围的硬性限制。因此,范围的描述应当被认为已经具体公开了所有可能的子范围以及该范围内的单个数值。例如,在提供值的范围的情况下,应当理解,在该范围的上限和下限之间的每个中间值以及在所述范围内的任何其他所述的或中间的值均被包括在要求保护的主题内。所述较小范围内可独立地包含这些较小范围的上下限,它们也属于请求保护的主题的范围,除非明确地排除所述范围的上下限。设定范围包含一个或两个限值时,请求保护的主题也包括排除所述限值之一个或两个的范围。这适用而无关范围的宽度。
当用于氨基酸序列(参照多肽序列)时,本文中所用的“氨基酸序列相同性百分数(%)”和“相同性百分数”定义为,序列比对和导入间隙(必要时)以实现最大序列相同性百分比之后,候选序列(例如,链霉亲和素突变蛋白)中与参照多肽序列的氨基酸残基相同的氨基酸残基的百分数,且不考虑任何保守取代作为序列相同性的部分。以测定氨基酸序列相同性百分率为目的比对可以本领域技术范围内的不同方式实现,例如,使用公共渠道可获得的计算机软件如BLAST、BLAST-2、ALIGN或Megalign(DNASTAR)软件。本领域技术人员能够确定用于比对序列的合适参数,包括使比较的序列实现全长最大对齐所需的任何算法。
氨基酸取代可包括多肽中的一种氨基酸被另一种氨基酸替代。氨基酸一般可以根据如下常规侧链性质分类:
(1)疏水:正亮氨酸,Met,Ala,Val,Leu,Ile;
(2)中性亲水:Cys,Ser,Thr,Asn,Gln;
(3)酸性:Asp,Glu;
(4)碱性:His,Lys,Arg;
(5)影响链取向的残基:Gly,Pro;
(6)芳香族:Trp,Tyr,Phe。
非保守性氨基酸取代将涉及这些类别之一的成员与另一类别交换。
本文中所用的对象包括任何活的生物体,例如人类和其它哺乳动物。哺乳动物,包括但不限于,人类和非人动物,包括农场动物,体育动物,啮齿类和宠物。
本文中所用的组合物指,两种或更多种产物、物质或化合物,包括细胞,的任何混合物。其可以是溶液、悬液、液体、粉末、糊剂、水性、非水性或其任何组合。
当述及一种或多种具体细胞类型或细胞群时,本文中所用的“富集”指,所述细胞类型或群的数量或百分数的增加,例如,相比于组合物中的总细胞数量或所述组合物的体积,或相对于其它细胞类型,例如通过基于由所述群或细胞表达的标志物的正选择,或通过基于不存在于待消耗的细胞群或细胞上的标志物的负选择。该术语不需要从所述组合物完全移除其它细胞、细胞类型或群,并且不需要如此富集的细胞以100%或甚至接近100%地在所述富集的组合物中存在。
本文中所用的,称细胞或细胞群针对具体标志物呈“阳性”指,所述细胞上或细胞中具体标志物(通常是表面标志物)的可检测的存在。当述及表面标志物时,该术语指,通过流式细胞术检测到存在表面表达,例如,通过用特异性结合所述标志物的抗体染色,并检测所述抗体,其中,所述染色可被流式细胞术以一定水平检测到,所述水平显著高于采用同种型匹配的对照或荧光扣除(FMO)门选对照在其它条件相同的情况下进行相同步骤时检测到的染色的水平、和/或基本相似于已知对所述标志物呈阳性的细胞的水平、和/或显著高于已知对所述标志物呈阴性的细胞的水平。
本文中所用的,称细胞或细胞群针对具体标志物呈“阴性”指,所述细胞上或细胞中具有具体标志物,通常是表面标志物,的基本可检测的不存在。当述及表面标志物时,该术语指,通过流式细胞术检测到不存在表面表达,例如,通过用特异性结合至所述标志物的抗体染色,并检测所述抗体,其中,所述染色以一定水平未被流式细胞术检测到,所述水平显著高于采用同种型匹配的对照或荧光扣除(FMO)门选对照在其它条件相同的情况下进行相同步骤时检测到的染色的水平、和/或显著低于已知对所述标志物呈阳性的细胞的水平、和/或基本类似于已知对所述标志物呈阴性的细胞的水平。
本文所用术语“载体”指一种核酸分子,所述核酸分子能够增殖其连接的另一核酸。该术语包括自复制核酸结构形式的载体,以及被导入已将其导入的宿主细胞基因组的载体。某些载体能够引导与其操作性连接的核酸的表达。所述载体在本文中称为“表达载体”。
VI.示例性实施方式
提供的示例性实施方式包括:
1.一种工程改造的T细胞,其包括:
(a)特异性结合抗原的遗传工程改造的抗原受体;和
(b)抑制性核酸分子,其减少PD-L1的表达或能够造成PD-L1的表达的减少。
2.如实施方式1所述的细胞,其中,所述抑制性核酸分子包括RNA干扰剂。
3.如实施方式1或实施方式2所述的细胞,其中,所述抑制性核酸是或包括或编码小干扰RNA(siRNA)、微小RNA适应性shRNA、短发夹RNA(shRNA)、发夹siRNA、前体微小RNA(前-miRNA)或微小RNA(miRNA)。
4.如实施方式1-3中任一项所述的细胞,其中,所述抑制性核酸分子包括与编码PD-L1的核酸互补的序列。
5.如实施方式1所述的细胞,其中,所述抑制性核酸分子包括与编码PD-L1的核酸互补的反义寡核苷酸。
6.一种遗传工程改造的T细胞,其包括:
(a)特异性结合抗原的遗传工程改造的抗原受体;和
(b)破坏的PD-L1基因,用于破坏PD-L1基因的物质,和/或对编码PD-L1的基因的破坏。
7.如实施方式6所述的细胞,其中,基因的破坏是通过基因编辑核酸酶、锌指核酸酶(ZFN)、成簇规律间隔短回文核酸(CRISPR)/Cas9、和/或TAL效应物核酸酶(TALEN)介导的。
8.如实施方式6或实施方式7所述的细胞,其中,所述破坏包括使所述基因的至少一个外显子的至少部分的缺失。
9.如实施方式6-8中任一项所述的细胞,其中:
所述破坏包括基因中的缺失、突变和/或插入,这导致所述基因中提早终止密码子的存在;和/或
所述破坏包括基因的第一或第二外显子内的缺失、突变、和/或插入。
10.如实施方式1-9中任一项所述的细胞,其中,T细胞中PD-L1的表达,与在不存在抑制性核酸分子或基因破坏或不存在其活化的T细胞中的表达相比,降低至少50、60、70、80、90或95%。
11.一种遗传工程改造的T细胞,其包括:
(a)特异性结合抗原的遗传工程改造的抗原受体;和
(b)编码减少或破坏细胞中PD-1或PD-L1表达的分子的多核苷酸,其中所述多核苷酸的活性或表达是条件型的。
12.如实施方式11所述的细胞,其中,所述表达受到条件型启动子或增强子或反式激活因子的控制。
13.如实施方式12所述的细胞,其中,所述条件型启动子或增强子或反式激活因子是诱导型启动子、增强子或反式激活因子或阻遏型启动子、增强子或反式激活因子。
14.如实施方式13所述的遗传工程改造的T细胞,其中,所述减少或破坏PD-1或PD-L1的表达的分子是或包括或编码反义分子,siRNA,shRNA,miRNA,基因编辑核酸酶,锌指核酸酶(ZFN),TAL效应物核酸酶(TALEN)或CRISPR-Cas9,其特异性地结合、识别或杂交所述基因。
15.如实施方式12-14中任一项所述的细胞,其中,所述启动子选自RNA pol I、pol II或pol III启动子。
16.如实施方式15所述的细胞,其中,所述启动子选自:
pol III启动子,其为U6或H1启动子;或
pol II启动子,其为CMV、SV40早期区或腺病毒主要晚期启动子。
17.如实施方式12-16中任一项所述的细胞,其中,所述启动子是诱导型启动子。
18.如实施方式17所述的细胞,其中,所述启动子包括Lac操纵子序列、四环素操纵子序列、半乳糖操纵子序列或多西环素操纵子序列,或是其类似物。
19.如实施方式12-16中任一项所述的细胞,其中,所述启动子是阻遏型启动子。
20.如实施方式19所述的细胞,其中,所述启动子包括Lac阻遏型元件或四环素阻遏型元件,或是其类似物。
21.如实施方式1-20中任一项所述的细胞,其中,所述T细胞是CD4+或CD8+T细胞。
22.如实施方式1-21中任一项所述的细胞,其中,所述遗传工程改造的抗原受体是功能性非T细胞受体。
23.如实施方式1-22中任一项所述的细胞,其中,所述遗传工程改造的抗原受体是嵌合抗原受体(CAR)。
24.如实施方式23所述的细胞,其中,所述CAR包括特异性结合抗原的胞外抗原识别结构域和包括ITAM的胞内信号转导结构域。
25.如实施方式24所述的细胞,其中,所述胞内信号转导结构域包含CD3-ζ(CD3ζ)链的胞内结构域。
26.如实施方式24或25所述的细胞,其中,所述CAR还包括共刺激信号转导区域。
27.如实施方式26所述的细胞,其中,所述共刺激信号转导区域包括CD28或4-1BB的信号转导结构域。
28.如实施方式26或实施方式27所述的细胞,其中,所述共刺激结构域是CD28。
29.如实施方式1-28中任一项所述的细胞,其是人细胞。
30.如实施方式1-29中任一项所述的细胞,其是分离的细胞。
31.一种核酸分子,其包括编码抗原受体(CAR)的第一核酸和编码针对PD-1或PD-L1的抑制性核酸分子的第二核酸,其中所述第一核酸任选地是第一表达盒,所述第二核酸任选地是第二表达盒。
32.如实施方式31所述的核酸分子,其中,所述抑制性核酸分子包括RNA干扰剂。
33.如实施方式31或实施方式22所述的核酸分子,其中,所述抑制性核酸是或包括或编码小干扰RNA(siRNA)、微小RNA适应性shRNA、短发夹RNA(shRNA)、发夹siRNA、前体微小RNA(前-miRNA)或微小RNA(miRNA)。
34.如实施方式31-33中任一项所述的核酸分子,其中,所述抑制性核酸包括与编码PD-L1的核酸互补的序列。
35.如实施方式31所述的核酸分子,其中,所述抑制性核酸分子包括与编码PD-L1的核酸互补的反义寡核苷酸。
36.如实施方式31-35中任一项所述的核酸分子,其中,所述抗原受体是功能性非T细胞受体。
37.如实施方式31-36中任一项所述的核酸分子,其中,所述遗传工程改造的抗原受体是嵌合抗原受体(CAR)。
38.如实施方式37所述的核酸分子,其中,所述CAR包括特异性结合抗原的胞外抗原识别结构域和包括ITAM的胞内信号转导结构域。
39.如实施方式38所述的核酸分子,其中,所述胞内信号转导结构域包括CD3-ζ(CD3ζ)链的胞内结构域。
40.如实施方式38或39所述的核酸分子,其中,所述CAR还包括共刺激信号转导区域。
41.如实施方式40所述的核酸分子,其中,所述共刺激信号转导区域包括CD28或4-1BB的信号转导结构域。
42.如实施方式40或实施方式41所述的核酸分子,其中,所述共刺激结构域是CD28。
43.如实施方式31-42中任一项所述的核酸分子,其中,所述第一和第二核酸,任选地所述第一和第二表达盒可操作地连接相同或不同的启动子。
44.如实施方式31-43中任一项所述的核酸分子,其中,所述第一核酸,任选地第一表达盒,可操作地连接诱导型启动子或阻遏型启动子,并且所述第二核酸,任选地第二表达盒,可操作地连接组成型启动子。
45.如实施方式31-44中任一项所述的核酸分子,其是分离的。
46.一种载体,其包括实施方式31-45中任一项所述的核酸分子。
47.如实施方式46所述的载体,其中,所述载体是质粒、慢病毒载体、逆转录病毒载体、腺病毒载体或腺相关病毒载体。
48.如实施方式47所述的载体,其是整合酶缺陷型的。
49.一种T细胞,其包括实施方式31-45中任一项所述的核酸分子或实施方式46-48中任一项所述的载体。
50.如实施方式49所述的T细胞,其是CD4+或CD8+T细胞。
51.如实施方式49或实施方式50中所述的T细胞,其是人细胞。
52.如实施方式49-51中任一项所述的T细胞,其是分离的。
53.一种药物组合物,其包括如实施方式1-30或49-52中任一项所述的细胞和药学上可接受运载体。
54.一种产生遗传工程改造的T细胞的方法,包括:
(a)将特异性结合抗原的遗传工程改造的抗原受体导入包括T细胞的细胞群;并且
(b)将如下物质导入细胞群:相对于在一种或多种条件下孵育的没有导入所述物质的对应细胞群中T细胞中PD-L1的表达和/或上调,所述物质能够在经所述一种或多种条件孵育的群中的T细胞中导致PD-L1表达的减少和/或抑制PD-L1的上调。
其中,步骤(a)和(b)同时或以任意顺序依次进行,从而将所述遗传工程改造的抗原受体和所述物质导入所述群中的T细胞。
55.一种在遗传工程改造的T细胞中调节PD-L1表达的方法,其包括将如下物质导入T细胞:相对于在一种或多种条件下孵育的没有导入所述物质的对应T细胞中PD-L1的表达或上调,所述物质能够在经所述一种或多种条件孵育的所述细胞中导致PD-L1表达的降低和/或抑制PD-L1的上调,所述T细胞包括特异性结合抗原的遗传工程改造的抗原受体。
56.如实施方式54或实施方式55所述的方法,其中,在具有抗原存在的条件下的孵育诱导所述对应群中PD-L1的表达或上调,所述对应群包括未导入所述物质的T细胞。
57.如实施方式56所述的方法,其中,在所述抗原存在下的孵育包括在体外孵育细胞与所述抗原。
58.如实施方式57所述的方法,其中,在所述抗原存在下的孵育进行:2小时至48小时,6小时至30小时或12小时至24小时,各自包括端值,或少于48小时,少于36小时或少于24小时。
59.如实施方式56所述的方法,其中,所述孵育包括在条件下将所述细胞给予对象,从而使得所述工程改造的抗原受体就所述孵育的至少部分而言特异性地结合所述抗原。
60.如实施方式59所述的方法,其中,将细胞给予所述对象后24小时、2天、3天、4天、5天、6天、7天、8天、9天或10天的时间内,所述孵育诱导表达或上调。
61.如实施方式54-60中任一项所述的方法,其中,所述PD-L1表达的减少或对PD-L1上调的抑制是至少或至少约30%、40%、50%、60%、70%、80%、90%、95%或更多。
62.如实施方式54-61中任一项所述的方法,其是离体进行的。
63.如实施方式54-62中任一项所述的方法,其中,(b)中所述的导入通过导入包括编码所述物质的序列的核酸而进行。
64.如实施方式54-63中任一项所述的方法,其中,所述导入包括在T细胞中诱导所述物质的瞬时表达,以使细胞中PD-L1表达临时减少或破坏,和/或其中所述降低或破坏不是永久性的。
65.如实施方式54-64中任一项所述的方法,其中,所述物质的活性或表达是条件型的。
66.如实施方式65所述的方法,其中,所述表达受到条件型启动子或增强子或反式激活因子的控制。
67.如实施方式66所述的方法,其中,所述条件型启动子或增强子或反式激活因子是诱导型启动子、增强子或反式激活因子或阻遏型启动子、增强子或反式激活因子。
68.如实施方式66或实施方式67所述的方法,其中,所述启动子选自RNA pol I、pol II或pol III启动子。
69.如实施方式68所述的方法,其中,所述启动子选自:
pol III启动子,其为U6或H1启动子;或
pol II启动子,其为CMV、SV40早期区或腺病毒主要晚期启动子。
70.如实施方式66-69中任一项所述的方法,其中,所述启动子是诱导型启动子。
71.如实施方式70所述的方法,其中,所述启动子包括Lac操纵子序列、四环素操纵子序列、半乳糖操纵子序列或多西环素操纵子序列。
72.如实施方式66-69中任一项所述的方法,其中,所述启动子是阻遏型启动子。
73.如实施方式72所述的方法,其中,所述启动子包括Lac阻遏型元件或四环素阻遏型元件。
74.如实施方式54-63中任一项所述的方法,其中,所述物质在所述T细胞中稳定表达,以在所述细胞中产生PD-L1表达的持续的减少或破坏。
75.如实施方式54-74中任一项所述的方法,其中,所述物质是包含在病毒载体中的核酸分子。
76.如实施方式75所述的方法,其中,所述病毒载体腺病毒、慢病毒、逆转录病毒载体、疱疹病毒或腺相关病毒载体。
77.如实施方式54-76中任一项所述的方法,其中,所述物质是减少所述细胞中PD-L1表达的抑制性核酸分子。
78.如实施方式77所述的方法,其中,所述抑制性核酸分子包括RNA干扰剂。
79.如实施方式77或实施方式78所述的方法,其中,所述抑制性核酸是或包括或编码小干扰RNA(siRNA)、微小RNA适应性shRNA、短发夹RNA(shRNA)、发夹siRNA、前体微小RNA(前-miRNA)或微小RNA(miRNA)。
80.如实施方式78或实施方式79所述的细胞,其中,所述抑制性核酸分子包括与编码PD-L1的核酸互补的序列。
81.如实施方式77所述的方法,其中,所述抑制性核酸分子包括与编码PD-L1的核酸互补的反义寡核苷酸。
82.如实施方式54-81中任一项所述的方法,其中,所述造成减少和/或抑制上调包括破坏编码PD-L1的基因。
83.如实施方式82所述的方法,其中:
所述破坏包括在DNA水平上破坏基因,和/或
所述破坏是不可逆的;和/或
所述破坏不是瞬时的。
84.如实施方式82或83所述的方法,其中,所述破坏包括在步骤(b)中导入特异性结合或杂交所述基因的DNA-结合核酸或DNA结合蛋白。
85.如实施方式84所述的方法,其中,所述破坏包括导入:(i)包括DNA-靶向蛋白和核酸酶的融合蛋白或(ii)RNA-引导的核酸酶。
86.如实施方式85所述的方法,其中,所述DNA-靶向蛋白或RNA-引导的核酸酶包括锌指蛋白(ZFP)、TAL蛋白、或由对所述基因具有特异性的成簇规律间隔短回文核酸(CRISPR)引导的Cas蛋白。
87.如实施方式82-86中任一项所述的方法,其中,所述破坏包括导入锌指核酸酶(ZFN)、TAL-效应子核酸酶(TALEN)、或和CRISPR-Cas9组合,其特异性结合至、识别或杂交至该基因。
88.如实施方式84-87中任一项所述的方法,其中,通过导入通过导入包括编码所述DNA-结合蛋白、DNA-结合核酸、和/或包括所述DNA-结合蛋白或DNA-结合核酸的复合物的序列的核酸来进行。
89.如实施方式88所述的方法,其中,所述核酸是病毒载体。
90.如实施方式84-89中任一项所述的方法,其中,对基因的特异性结合位于所述基因的外显子内和/或在编码靶抗原的N-末端的所述基因的部分内。
91.如实施方式84-90中任一项所述的方法,其中,所述导入从而实现了所述基因中的移码突变和/或在所述基因的编码区内插入早期终止密码子。
92.如实施方式54-91中任一项所述的方法,其还包括(c)将如下物质导入细胞:相较于经一种或多种条件孵育的没有导入所述物质的对应细胞中PD-1表达或上调,所述物质能够在经所述一种或多种条件孵育的细胞中导致PD-1表达的减少和/或抑制PD-1的上调,其中所述表达的减少和/或对上调的抑制是暂时的或瞬时的。
93.如实施方式92所述的方法,其中,所述物质在所述细胞中被诱导型表达或阻遏,以在所述细胞中造成PD-1表达的条件型减少或破坏。
94.一种产生遗传工程改造的T细胞的方法,包括:
(a)将特异性结合抗原的遗传工程改造的抗原受体导入包括T细胞的细胞群;并且
(b)将如下物质导入细胞群:相较于经一种或多种条件孵育的没有导入所述物质的对应细胞群的T细胞中PD-1的表达和上调,所述物质能够使在所述一种或多种条件下孵育的群中的T细胞中的PD-1表达瞬时减少和/或PD-1上调被瞬时抑制。
其中,步骤(a)和(b)同时或以任意顺序依次进行,从而将所述遗传工程改造的抗原受体和所述物质导入所述群中的T细胞。
95.一种调节遗传工程改造的T细胞中PD-1表达的方法,其包括将如下物质导入T细胞:相对于经一种或多种条件孵育的没有导入所述物质的对应T细胞中PD-1的表达或上调,所述物质能够使在所述一种或多种条件下孵育的细胞中的PD-1表达瞬时减少和/或PD-1上调被瞬时抑制,所述T细胞包括特异性结合抗原的抗原受体。
96.如实施方式94或实施方式95所述的方法,其中,瞬时减少包括所述细胞中PD-1表达的可逆减少。
97.如实施方式94-96中任一项所述的方法,其中,在具有抗原存在的条件下的孵育诱导所述对应群中PD-L1的表达或上调,所述对应群包括未导入所述物质的T细胞。
98.如实施方式97所述的方法,其中,在所述抗原存在下的孵育包括在体外孵育所述细胞与抗原。
99.如实施方式98所述的方法,其中,在所述抗原存在下的孵育进行:2小时至48小时,6小时至30小时或12小时至24小时,各自包括端值,或少于48小时,少于36小时或少于24小时。
100.如实施方式97所述的方法,其中,所述孵育包括在条件下将所述细胞给予对象,从而使得所述工程改造的抗原受体就所述孵育的至少部分而言特异性地结合所述抗原。
101.如实施方式100所述的方法,其中,将细胞给予所述对象后24小时、2天、3天、4天、5天、6天、7天、8天、9天或10天的时间内,所述孵育诱导表达或上调。
102.如实施方式94-101中任一项所述的方法,其中,所述PD-1表达的减少或所述PD-1上调的抑制是至少或至少约30%、40%、50%、60%、70%、80%、90%、95%或更多。
103.如实施方式94-102中任一项所述的方法,其是离体进行的。
104.如实施方式94-103中任一项所述的方法,其中,(b)中所述的导入通过将包括编码所述物质的序列的核酸导入所述细胞而进行。
105.如实施方式94-104中任一项所述的方法,其中,所述物质在所述细胞中瞬时表达,以造成所述T细胞中PD-1表达的暂时减少或破坏。
106.如实施方式94-105中任一项所述的方法,其中,所述物质的活性或表达是条件型的。
107.如实施方式106所述的方法,其中,所述表达受到条件型启动子或增强子或反式激活因子的控制。
108.如实施方式107所述的方法,其中,所述条件型启动子或增强子或反式激活因子是诱导型启动子、增强子或反式激活因子或阻遏型启动子、增强子或反式激活因子。
109.如实施方式108所述的方法,其中,所述启动子选自RNA pol I、pol II或pol III启动子。
110.如实施方式109所述的方法,其中,所述启动子选自:
pol III启动子,其为U6或H1启动子;或
pol II启动子,其为CMV、SV40早期区或腺病毒主要晚期启动子。
111.如实施方式108-110中任一项所述的方法,其中,所述启动子是诱导型启动子。
112.如实施方式111所述的方法,其中,所述启动子包括Lac操纵子序列、四环素操纵子序列、半乳糖操纵子序列或多西环素操纵子序列。
113.如实施方式108-112中任一项所述的方法,其中,所述启动子是阻遏型启动子。
114.如实施方式113所述的方法,其中,所述启动子包括Lac阻遏型元件或四环素阻遏型元件。
115.如实施方式92-114中任一项所述的方法,其中,所述物质是使所述细胞中PD-1表达减少的抑制性核酸分子。
116.如实施方式115所述的方法,其中,所述抑制性核酸分子包括RNA干扰剂。
117.如实施方式115或实施方式116所述的方法,其中,所述抑制性核酸是或包括或编码小干扰RNA(siRNA)、微小RNA适应性shRNA、短发夹RNA(shRNA)、发夹siRNA、前体微小RNA(前-miRNA)或微小RNA(miRNA)。
118.如实施方式115-117中任一项所述的细胞,其中,所述抑制性核酸分子包括与编码PD-L1的核酸互补的序列。
119.如实施方式115所述的方法,其中,所述抑制性核酸分子包括与编码PD-L1的核酸互补的反义寡核苷酸。
120.如实施方式54-119中任一项所述的方法,其中,所述T细胞是CD4+或CD8+T细胞。
121.如实施方式54-120中任一项所述的方法,其中,所述遗传工程改造的抗原受体是功能性非T细胞受体。
122.如实施方式54-121中任一项所述的方法,其中,所述遗传工程改造的抗原受体是嵌合抗原受体(CAR)。
123.如实施方式122所述的方法,其中,所述CAR包括特异性结合所述抗原的胞外抗原识别结构域和包括ITAM的胞内信号转导结构域。
124.如实施方式123所述的方法,其中,所述胞内信号转导结构域包括CD3-ζ(CD3ζ)链的胞内结构域。
125.如实施方式123或实施方式124所述的方法,其中,所述CAR还包括共刺激信号转导区域。
126.如实施方式125所述的方法,其中,所述共刺激信号转导区域包括CD28或4-1BB的信号转导结构域。
127.如实施方式125或实施方式126所述的方法,其中,所述共刺激结构域是CD28。
128.如实施方式127所述的方法,其中,所述步骤(a)和(b)同时进行,所述步骤包括导入包括第一核酸和第二核酸的核酸分子,所述第一核酸任选地是第一表达盒,其编码所述抗原受体,所述第二核酸任选地是第二表达盒,其编码造成PD-1或PD-L1表达减少的物质。
129.如实施方式127或实施方式128所述的方法,其还包括将特异性结合相同或不同抗原的第二遗传工程改造的抗原受体导入细胞群,所述第二抗原受体包括不同于CD28的共刺激分子。
130.一种产生遗传工程改造的T细胞的方法,包括:
(a)将特异性结合第一抗原的第一遗传工程改造的抗原受体导入包括T细胞的细胞群;所述第一抗原受体包括CD28共刺激分子;
(b)将特异性结合相同或不同抗原的第二遗传工程改造的抗原受体导入所述包括T细胞的细胞群;并且
(c)将如下物质导入所述包括T细胞的细胞群:相对于经一种或多种条件孵育的没有导入所述物质的对应细胞群的T细胞中PD-1和/或PD-L1的表达或上调,所述物质能够在经所述一种或多种条件孵育的所述群中导致T细胞中PD-1或PD-L1表达的减少和/或抑制PD-1或PD-L1的上调。
131.如实施方式130所述的方法,其中,在具有抗原存在的条件下的孵育诱导所述对应群中PD-1和/或PD-L1的表达或上调,所述对应群包括未导入所述物质的T细胞。
132.如实施方式131所述的方法,其中,在所述抗原存在下的孵育包括在体外孵育所述细胞与抗原。
133.如实施方式132所述的方法,其中,在所述抗原存在下的孵育进行:2小时至48小时,6小时至30小时或12小时至24小时,各自包括端值,或少于48小时,少于36小时或少于24小时。
134.如实施方式131所述的方法,其中,所述孵育包括在条件下将所述细胞给予对象,从而使得所述工程改造的抗原受体就所述孵育的至少部分而言特异性地结合所述抗原。
135.如实施方式134所述的方法,其中,将细胞给予所述对象后24小时、2天、3天、4天、5天、6天、7天、8天、9天或10天的时间内,所述孵育诱导表达或上调。
136.如实施方式130-135中任一项所述的方法,其中,相较于通过没有导入所述物质的方法产生的工程改造的细胞,所述细胞中PD-1和/或PD-L1的上调或表达被抑制或减少至少或至少约30%、40%、50%、60%、70%、80%、90%、95%或更多。
137.如实施方式129-136中任一项所述的方法,其中,所述第一和第二遗传工程改造的抗原受体结合相同的抗原。
138.如实施方式130-137中任一项所述的方法,其中,所述第二抗原受体包括不同于CD28的共刺激分子。
139.如实施方式129-138中任一项所述的方法,其中,不同于CD28的共刺激分子是4-1BB。
140.如实施方式130-139中任一项所述的方法,其中,所述物质造成PD-L1表达的减少和/或对PD-L1上调的抑制。
141.如实施方式130-140中任一项所述的方法,其中,步骤(a)和(b)同时进行,所述步骤包括导入包括第一核酸和第二核酸的核酸分子,所述第一核酸任选地是第一表达盒,其编码所述抗原受体,所述第二核酸任选地是第二表达盒,其编码造成PD-1或PD-L1表达减少的物质。
142.如实施方式141所述的方法,其中,所述第一和第二核酸,任选地所述第一和第二表达盒,可操作地连接相同或不同的启动子。
143.如实施方式141或实施方式142所述的方法,其中,所述第一核酸,任选地第一表达盒,可操作地连接诱导型启动子或阻遏型启动子,并且所述第二核酸,任选地第二表达盒,可操作地连接组成型启动子。
144.如实施方式54-143中任一项所述的方法,其是人细胞。
145.一种产生遗传工程改造的T细胞的方法,包括:
(a)获得包括T细胞的原代细胞群;
(b)针对所述群中不表达靶抗原的细胞进行富集;和
(c)将特异性结合所述靶抗原的遗传工程改造的抗原受体导入所述细胞群,从而产生遗传工程改造的T细胞。
146.如实施方式145所述的方法,其还包括在刺激条件下培养和/或孵育所述细胞以使所述细胞增殖,其中所述细胞的增殖和/或扩增多于由所述方法产生但未针对不表达所述靶抗原的细胞进行富集的细胞。
147.如权利要求146所述的方法,其中,细胞的增殖和/或扩增是至少或至少约1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多。
148.如实施方式145-147中任一项所述的方法,其中,针对不表达靶抗原的细胞进行富集包括在所述群中进行负选择以消耗表达靶抗原的细胞,或破坏细胞中编码所述靶抗原的基因。
149.如实施方式146-148中任一项所述的方法,其中,所述刺激条件包括如下物质:所述物质能够活化TCR复合物的一种或多种组分的一种或多种胞内信号转导结构域。
150.一种细胞,通过实施方式54-149中任一项所述的方法产生。
151.一种药物组合物,其包括实施方式150所述的细胞和药学上可接受的运载体。
152.一种治疗方法,其包括向具有疾病或病症的对象给予实施方式1-30、49-52或150中任一项所述的细胞或实施方式46或115所述的药物组合物。
153.如实施方式152所述的治疗方法,其中,将所述细胞以如下剂量方案给予,包括:
(a)将第一剂量的表达嵌合抗原受体(CAR)的细胞给予所述对象;并且
(b)将继续剂量的表达CAR的细胞给予所述对象,所述继续剂量在当(a)中给予对象的表达CAR的细胞的表面上的PD-L1表达被诱导或上调的时候给予,和/或所述继续剂量在(a)中的给予开始后至少5天给予对象。
154.一种治疗方法,其包括:
(a)将第一剂量的表达嵌合抗原受体(CAR)的细胞给予所述对象;并且
(b)将继续剂量的表达CAR的细胞给予所述对象,所述继续剂量在当(a)中给予对象的表达CAR的细胞的表面上的PD-L1表达被诱导或上调的时候给予,和/或所述继续剂量在(a)中的给予开始后至少5天给予对象。
155.如实施方式153或实施方式154所述的方法,其中,在(a)中给予开始后至少或超过约5天并且不到约12天时给予继续剂量的细胞。
156.如实施方式153-155中任一项所述的方法,其中,所述第一和/或第二剂量中给予的细胞的数量为约0.5x106细胞/kg对象体重至4x106细胞/kg,约0.75x106细胞/kg至3.0x106细胞/kg或约1x106细胞/kg至2x106细胞/kg,各自包括端值。
157.如实施方式152-156中任一项所述的方法,其中,所述遗传工程改造的抗原受体特异性结合与所述疾病或病症相关联的抗原。
158.如实施方式152-157中任一项所述的治疗方法,其中,所述疾病或病症是癌症。
159.如实施方式152-158中任一项所述的方法,其中,所述疾病或病症是白血病或淋巴瘤。
160.如实施方式152-159中任一项所述的方法,其中,所述疾病或病症是急性淋巴细胞性白血病。
161.如实施方式152-159中任一项所述的方法,其中,所述疾病或病症是非霍奇金淋巴瘤(NHL)。
VII.实施例下面的实施例仅是为了阐述,而不是用来限制本发明的范围。
实施例1:评估通过嵌合抗原受体(CAR)刺激的T细胞中PD-1/PD-L1表达
通过基于免疫亲和力的富集由来自人对象的白细胞分离样品分离T细胞,并用编码含有人CD28衍生的胞内信号转导结构域和人CD3ζ衍生的信号转导域的抗-CD19嵌合抗原受体(CAR)的病毒载体激活和转导细胞。通过流式细胞术评估所得分离的组合物(CAR和某些T细胞标记物)的表面表达,以确定组合物中T细胞亚群中和T细胞亚群间所有T细胞中CAR+细胞的百分比,以及CD4+与CD8+T细胞的比率(参见表1)。
然后通过与以下孵育将组合物分成不同的样品:1)表达CAR特异性的抗原的K562细胞(K562-tCD19细胞)(抗原特异性共培养物);2)表达不相关抗原的K562细胞(K562-ROR1细胞)(非特异性共培养对照);或3)平板结合的抗-CD3抗体和可溶性抗-CD28抗体(用于通过TCR复合物刺激),最初使用平板结合的抗-CD3和可溶性抗-CD28,以及在第3天,适用的情况下孵育。对于(1)和(2),K562(永生化骨髓性白血病细胞系)细胞被分别工程改造以表达CD19和ROR1,并以1:1的比率与CAR-表达T细胞一起孵育。对于每种条件,刺激CAR-表达T细胞24小时。使用未刺激的样品(“基质”,无K562细胞或刺激抗体)作为额外的阴性对照。
培养24小时后,进行流式细胞术来评估PD1、PD-L1、PD-L2、T细胞标志物和CAR在各样品中细胞上的表面表达(基于山羊抗小鼠(“GAM”)染色以检测CAR的鼠可变区部分)。门选带有匹配淋巴细胞的前向散射和侧面散射概况的活单细胞用于分析。在各种门选T细胞群(CD4+/CAR+,CD4+/CAR-,CD8+/CAR+,和CD8+/CAR-)上评估PD-1、PD-L1和PD-L2的表达,基于各种标志物的表面表达设定门选,并使用阴性对照(“基质”)样品的值来确定合适的门选。
如图1A和2A所示,当与表达CAR特异性的抗原的细胞(K562-tCD19)一起培养时,PD-1和PD-L1表达在24小时内在CD4+/CAR+和CD8+/CAR+T细胞中增加。在与表达不相关抗原细胞(K562-ROR1)的相同类型的细胞孵育的CAR+细胞中或在任何经设计以实现通过TCR复合物的刺激的条件下孵育的任何CD4+或CD8+细胞群体的CAR+细胞中,在该时间段内没有观察到PD-1和PD-L1的表达增加。在任何测试的刺激条件下,PD-L2的表达在该时间段内未被上调。
如图1B和2B所示,观察到与CD19-表达细胞孵育的细胞中PD-1和PD-L1的表达增加主要是由于抗CD19CAR的表达。在与CD19-表达细胞孵育后,不表达CAR(“CAR-”)的CD4+门选和CD8+门选的T细胞均未显示出PD-1或PD-L1表面表达的明显增加。
在用含有人4-1BB衍生的胞内信号转导结构域和人CD3ζ衍生的信号转导结构域的抗-CD19嵌合抗原受体(CAR)进行遗传工程改造的T细胞的存在下获得相似的结果。因此,结果显示PD-1和PD-L1的上调出现在用含有CD28或4-1BB共刺激信号转导结构域的CAR构建体转导的T细胞上。这些数据表明通过嵌合抗原受体刺激后24小时内PD-1和PD-L1的表面表达上调,但是在设计模拟通过典型T细胞抗原受体复合物和相关联的共刺激受体(抗-CD3/抗-CD28抗体)信号的条件下刺激后没有上调。
本发明并不意在将范围限制于具体公开的实施方式,这些实施方式仅为提供,例如,对于本发明不同方面的说明。根据本文的描述和教导,对于所述组合物和方法的各种修改形式是显而易见的。这些变化形式可以不偏离本发明实际范围和精神的方式被实施,并且落在本发明范围内。
序列
序列表
<110> 朱诺治疗学股份有限公司(JUNO THERAPEUTICS, INC.)
V·厄德高
<120> 用于遗传工程改造的细胞中调节抑制性相互作用的组合物和方法
<130> 735042002440
<140> Not Yet Assigned
<141> Concurrently Herewith
<150> 62/168,721
<151> 2015-05-29
<150> 62/244,132
<151> 2015-10-20
<160> 24
<170> PatentIn version 3.5
<210> 1
<211> 25
<212> RNA
<213> 人工序列
<220>
<223> PD-L1特异性siRNA
<400> 1
aaugcguuca gcaaaugcca guagg 25
<210> 2
<211> 19
<212> RNA
<213> 人工序列
<220>
<223> PD-L1特异性siRNA
<400> 2
cuaauugucu auugggaaa 19
<210> 3
<211> 19
<212> RNA
<213> 人工序列
<220>
<223> PD-L1特异性siRNA
<400> 3
cgacuacaag cgaauuacu 19
<210> 4
<211> 25
<212> RNA
<213> 人工序列
<220>
<223> PD-L1特异性siRNA (正义序列)
<400> 4
ccuacuggca uuugcugaac gcauu 25
<210> 5
<211> 25
<212> RNA
<213> 人工序列
<220>
<223> PD-L1特异性siRNA (反义序列)
<400> 5
aaugcguuca gcaaaugcca guagg 25
<210> 6
<211> 25
<212> RNA
<213> 人工序列
<220>
<223> PD-1特异性siRNA
<400> 6
uuacgucucc uccaaaugug uauca 25
<210> 7
<211> 290
<212> PRT
<213> 智人
<220>
<221> MISC_FEATURE
<223> PD-L1
<400> 7
Met Arg Ile Phe Ala Val Phe Ile Phe Met Thr Tyr Trp His Leu Leu
1 5 10 15
Asn Ala Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr
20 25 30
Gly Ser Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu
35 40 45
Asp Leu Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile
50 55 60
Ile Gln Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser
65 70 75 80
Tyr Arg Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn
85 90 95
Ala Ala Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr
100 105 110
Arg Cys Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val
115 120 125
Lys Val Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val
130 135 140
Asp Pro Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr
145 150 155 160
Pro Lys Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser
165 170 175
Gly Lys Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn
180 185 190
Val Thr Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr
195 200 205
Cys Thr Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu
210 215 220
Val Ile Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Thr His
225 230 235 240
Leu Val Ile Leu Gly Ala Ile Leu Leu Cys Leu Gly Val Ala Leu Thr
245 250 255
Phe Ile Phe Arg Leu Arg Lys Gly Arg Met Met Asp Val Lys Lys Cys
260 265 270
Gly Ile Gln Asp Thr Asn Ser Lys Lys Gln Ser Asp Thr His Leu Glu
275 280 285
Glu Thr
290
<210> 8
<211> 3691
<212> DNA
<213> 智人
<220>
<221> misc_feature
<223> 编码PD-L1的CD274
<400> 8
ggcgcaacgc tgagcagctg gcgcgtcccg cgcggcccca gttctgcgca gcttcccgag 60
gctccgcacc agccgcgctt ctgtccgcct gcagggcatt ccagaaagat gaggatattt 120
gctgtcttta tattcatgac ctactggcat ttgctgaacg catttactgt cacggttccc 180
aaggacctat atgtggtaga gtatggtagc aatatgacaa ttgaatgcaa attcccagta 240
gaaaaacaat tagacctggc tgcactaatt gtctattggg aaatggagga taagaacatt 300
attcaatttg tgcatggaga ggaagacctg aaggttcagc atagtagcta cagacagagg 360
gcccggctgt tgaaggacca gctctccctg ggaaatgctg cacttcagat cacagatgtg 420
aaattgcagg atgcaggggt gtaccgctgc atgatcagct atggtggtgc cgactacaag 480
cgaattactg tgaaagtcaa tgccccatac aacaaaatca accaaagaat tttggttgtg 540
gatccagtca cctctgaaca tgaactgaca tgtcaggctg agggctaccc caaggccgaa 600
gtcatctgga caagcagtga ccatcaagtc ctgagtggta agaccaccac caccaattcc 660
aagagagagg agaagctttt caatgtgacc agcacactga gaatcaacac aacaactaat 720
gagattttct actgcacttt taggagatta gatcctgagg aaaaccatac agctgaattg 780
gtcatcccag aactacctct ggcacatcct ccaaatgaaa ggactcactt ggtaattctg 840
ggagccatct tattatgcct tggtgtagca ctgacattca tcttccgttt aagaaaaggg 900
agaatgatgg atgtgaaaaa atgtggcatc caagatacaa actcaaagaa gcaaagtgat 960
acacatttgg aggagacgta atccagcatt ggaacttctg atcttcaagc agggattctc 1020
aacctgtggt ttaggggttc atcggggctg agcgtgacaa gaggaaggaa tgggcccgtg 1080
ggatgcaggc aatgtgggac ttaaaaggcc caagcactga aaatggaacc tggcgaaagc 1140
agaggaggag aatgaagaaa gatggagtca aacagggagc ctggagggag accttgatac 1200
tttcaaatgc ctgaggggct catcgacgcc tgtgacaggg agaaaggata cttctgaaca 1260
aggagcctcc aagcaaatca tccattgctc atcctaggaa gacgggttga gaatccctaa 1320
tttgagggtc agttcctgca gaagtgccct ttgcctccac tcaatgcctc aatttgtttt 1380
ctgcatgact gagagtctca gtgttggaac gggacagtat ttatgtatga gtttttccta 1440
tttattttga gtctgtgagg tcttcttgtc atgtgagtgt ggttgtgaat gatttctttt 1500
gaagatatat tgtagtagat gttacaattt tgtcgccaaa ctaaacttgc tgcttaatga 1560
tttgctcaca tctagtaaaa catggagtat ttgtaaggtg cttggtctcc tctataacta 1620
caagtataca ttggaagcat aaagatcaaa ccgttggttg cataggatgt cacctttatt 1680
taacccatta atactctggt tgacctaatc ttattctcag acctcaagtg tctgtgcagt 1740
atctgttcca tttaaatatc agctttacaa ttatgtggta gcctacacac ataatctcat 1800
ttcatcgctg taaccaccct gttgtgataa ccactattat tttacccatc gtacagctga 1860
ggaagcaaac agattaagta acttgcccaa accagtaaat agcagacctc agactgccac 1920
ccactgtcct tttataatac aatttacagc tatattttac tttaagcaat tcttttattc 1980
aaaaaccatt tattaagtgc ccttgcaata tcaatcgctg tgccaggcat tgaatctaca 2040
gatgtgagca agacaaagta cctgtcctca aggagctcat agtataatga ggagattaac 2100
aagaaaatgt attattacaa tttagtccag tgtcatagca taaggatgat gcgaggggaa 2160
aacccgagca gtgttgccaa gaggaggaaa taggccaatg tggtctggga cggttggata 2220
tacttaaaca tcttaataat cagagtaatt ttcatttaca aagagaggtc ggtacttaaa 2280
ataaccctga aaaataacac tggaattcct tttctagcat tatatttatt cctgatttgc 2340
ctttgccata taatctaatg cttgtttata tagtgtctgg tattgtttaa cagttctgtc 2400
ttttctattt aaatgccact aaattttaaa ttcatacctt tccatgattc aaaattcaaa 2460
agatcccatg ggagatggtt ggaaaatctc cacttcatcc tccaagccat tcaagtttcc 2520
tttccagaag caactgctac tgcctttcat tcatatgttc ttctaaagat agtctacatt 2580
tggaaatgta tgttaaaagc acgtattttt aaaatttttt tcctaaatag taacacattg 2640
tatgtctgct gtgtactttg ctatttttat ttattttagt gtttcttata tagcagatgg 2700
aatgaatttg aagttcccag ggctgaggat ccatgccttc tttgtttcta agttatcttt 2760
cccatagctt ttcattatct ttcatatgat ccagtatatg ttaaatatgt cctacatata 2820
catttagaca accaccattt gttaagtatt tgctctagga cagagtttgg atttgtttat 2880
gtttgctcaa aaggagaccc atgggctctc cagggtgcac tgagtcaatc tagtcctaaa 2940
aagcaatctt attattaact ctgtatgaca gaatcatgtc tggaactttt gttttctgct 3000
ttctgtcaag tataaacttc actttgatgc tgtacttgca aaatcacatt ttctttctgg 3060
aaattccggc agtgtacctt gactgctagc taccctgtgc cagaaaagcc tcattcgttg 3120
tgcttgaacc cttgaatgcc accagctgtc atcactacac agccctccta agaggcttcc 3180
tggaggtttc gagattcaga tgccctggga gatcccagag tttcctttcc ctcttggcca 3240
tattctggtg tcaatgacaa ggagtacctt ggctttgcca catgtcaagg ctgaagaaac 3300
agtgtctcca acagagctcc ttgtgttatc tgtttgtaca tgtgcatttg tacagtaatt 3360
ggtgtgacag tgttctttgt gtgaattaca ggcaagaatt gtggctgagc aaggcacata 3420
gtctactcag tctattccta agtcctaact cctccttgtg gtgttggatt tgtaaggcac 3480
tttatccctt ttgtctcatg tttcatcgta aatggcatag gcagagatga tacctaattc 3540
tgcatttgat tgtcactttt tgtacctgca ttaatttaat aaaatattct tatttatttt 3600
gttacttggt acaccagcat gtccattttc ttgtttattt tgtgtttaat aaaatgttca 3660
gtttaacatc ccagtggaga aagttaaaaa a 3691
<210> 9
<211> 288
<212> PRT
<213> 智人
<220>
<221> MISC_FEATURE
<223> PD-1
<400> 9
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly
165 170 175
Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys
180 185 190
Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro
195 200 205
Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly
210 215 220
Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro
225 230 235 240
Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly
245 250 255
Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg
260 265 270
Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
275 280 285
<210> 10
<211> 2115
<212> DNA
<213> 智人
<220>
<221> misc_feature
<223> 编码PD-1的PDCD1
<400> 10
agtttccctt ccgctcacct ccgcctgagc agtggagaag gcggcactct ggtggggctg 60
ctccaggcat gcagatccca caggcgccct ggccagtcgt ctgggcggtg ctacaactgg 120
gctggcggcc aggatggttc ttagactccc cagacaggcc ctggaacccc cccaccttct 180
ccccagccct gctcgtggtg accgaagggg acaacgccac cttcacctgc agcttctcca 240
acacatcgga gagcttcgtg ctaaactggt accgcatgag ccccagcaac cagacggaca 300
agctggccgc cttccccgag gaccgcagcc agcccggcca ggactgccgc ttccgtgtca 360
cacaactgcc caacgggcgt gacttccaca tgagcgtggt cagggcccgg cgcaatgaca 420
gcggcaccta cctctgtggg gccatctccc tggcccccaa ggcgcagatc aaagagagcc 480
tgcgggcaga gctcagggtg acagagagaa gggcagaagt gcccacagcc caccccagcc 540
cctcacccag gccagccggc cagttccaaa ccctggtggt tggtgtcgtg ggcggcctgc 600
tgggcagcct ggtgctgcta gtctgggtcc tggccgtcat ctgctcccgg gccgcacgag 660
ggacaatagg agccaggcgc accggccagc ccctgaagga ggacccctca gccgtgcctg 720
tgttctctgt ggactatggg gagctggatt tccagtggcg agagaagacc ccggagcccc 780
ccgtgccctg tgtccctgag cagacggagt atgccaccat tgtctttcct agcggaatgg 840
gcacctcatc ccccgcccgc aggggctcag ctgacggccc tcggagtgcc cagccactga 900
ggcctgagga tggacactgc tcttggcccc tctgaccggc ttccttggcc accagtgttc 960
tgcagaccct ccaccatgag cccgggtcag cgcatttcct caggagaagc aggcagggtg 1020
caggccattg caggccgtcc aggggctgag ctgcctgggg gcgaccgggg ctccagcctg 1080
cacctgcacc aggcacagcc ccaccacagg actcatgtct caatgcccac agtgagccca 1140
ggcagcaggt gtcaccgtcc cctacaggga gggccagatg cagtcactgc ttcaggtcct 1200
gccagcacag agctgcctgc gtccagctcc ctgaatctct gctgctgctg ctgctgctgc 1260
tgctgctgcc tgcggcccgg ggctgaaggc gccgtggccc tgcctgacgc cccggagcct 1320
cctgcctgaa cttgggggct ggttggagat ggccttggag cagccaaggt gcccctggca 1380
gtggcatccc gaaacgccct ggacgcaggg cccaagactg ggcacaggag tgggaggtac 1440
atggggctgg ggactcccca ggagttatct gctccctgca ggcctagaga agtttcaggg 1500
aaggtcagaa gagctcctgg ctgtggtggg cagggcagga aacccctcca cctttacaca 1560
tgcccaggca gcacctcagg ccctttgtgg ggcagggaag ctgaggcagt aagcgggcag 1620
gcagagctgg aggcctttca ggcccagcca gcactctggc ctcctgccgc cgcattccac 1680
cccagcccct cacaccactc gggagaggga catcctacgg tcccaaggtc aggagggcag 1740
ggctggggtt gactcaggcc cctcccagct gtggccacct gggtgttggg agggcagaag 1800
tgcaggcacc tagggccccc catgtgccca ccctgggagc tctccttgga acccattcct 1860
gaaattattt aaaggggttg gccgggctcc caccagggcc tgggtgggaa ggtacaggcg 1920
ttcccccggg gcctagtacc cccgccgtgg cctatccact cctcacatcc acacactgca 1980
cccccactcc tggggcaggg ccaccagcat ccaggcggcc agcaggcacc tgagtggctg 2040
ggacaaggga tcccccttcc ctgtggttct attatattat aattataatt aaatatgaga 2100
gcatgctaag gaaaa 2115
<210> 11
<211> 1368
<212> PRT
<213> 酿脓链球菌(Streptococcus pyogenes)
<220>
<221> MISC_FEATURE
<223> 酿脓链球菌(S. Pyogenes)Cas9 Q99ZW2
<400> 11
Met Asp Lys Lys Tyr Ser Ile Gly Leu Asp Ile Gly Thr Asn Ser Val
1 5 10 15
Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val Pro Ser Lys Lys Phe
20 25 30
Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile Lys Lys Asn Leu Ile
35 40 45
Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala Glu Ala Thr Arg Leu
50 55 60
Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg Lys Asn Arg Ile Cys
65 70 75 80
Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala Lys Val Asp Asp Ser
85 90 95
Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val Glu Glu Asp Lys Lys
100 105 110
His Glu Arg His Pro Ile Phe Gly Asn Ile Val Asp Glu Val Ala Tyr
115 120 125
His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg Lys Lys Leu Val Asp
130 135 140
Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr Leu Ala Leu Ala His
145 150 155 160
Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu Gly Asp Leu Asn Pro
165 170 175
Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln Leu Val Gln Thr Tyr
180 185 190
Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala Ser Gly Val Asp Ala
195 200 205
Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser Arg Arg Leu Glu Asn
210 215 220
Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn Gly Leu Phe Gly Asn
225 230 235 240
Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn Phe Lys Ser Asn Phe
245 250 255
Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser Lys Asp Thr Tyr Asp
260 265 270
Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly Asp Gln Tyr Ala Asp
275 280 285
Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala Ile Leu Leu Ser Asp
290 295 300
Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala Pro Leu Ser Ala Ser
305 310 315 320
Met Ile Lys Arg Tyr Asp Glu His His Gln Asp Leu Thr Leu Leu Lys
325 330 335
Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr Lys Glu Ile Phe Phe
340 345 350
Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile Asp Gly Gly Ala Ser
355 360 365
Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile Leu Glu Lys Met Asp
370 375 380
Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg Glu Asp Leu Leu Arg
385 390 395 400
Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro His Gln Ile His Leu
405 410 415
Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu Asp Phe Tyr Pro Phe
420 425 430
Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile Leu Thr Phe Arg Ile
435 440 445
Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn Ser Arg Phe Ala Trp
450 455 460
Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro Trp Asn Phe Glu Glu
465 470 475 480
Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe Ile Glu Arg Met Thr
485 490 495
Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val Leu Pro Lys His Ser
500 505 510
Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu Leu Thr Lys Val Lys
515 520 525
Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe Leu Ser Gly Glu Gln
530 535 540
Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr Asn Arg Lys Val Thr
545 550 555 560
Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys Ile Glu Cys Phe Asp
565 570 575
Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe Asn Ala Ser Leu Gly
580 585 590
Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp Lys Asp Phe Leu Asp
595 600 605
Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile Val Leu Thr Leu Thr
610 615 620
Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg Leu Lys Thr Tyr Ala
625 630 635 640
His Leu Phe Asp Asp Lys Val Met Lys Gln Leu Lys Arg Arg Arg Tyr
645 650 655
Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile Asn Gly Ile Arg Asp
660 665 670
Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu Lys Ser Asp Gly Phe
675 680 685
Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp Asp Ser Leu Thr Phe
690 695 700
Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly Gln Gly Asp Ser Leu
705 710 715 720
His Glu His Ile Ala Asn Leu Ala Gly Ser Pro Ala Ile Lys Lys Gly
725 730 735
Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu Val Lys Val Met Gly
740 745 750
Arg His Lys Pro Glu Asn Ile Val Ile Glu Met Ala Arg Glu Asn Gln
755 760 765
Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu Arg Met Lys Arg Ile
770 775 780
Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile Leu Lys Glu His Pro
785 790 795 800
Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu Tyr Leu Tyr Tyr Leu
805 810 815
Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu Leu Asp Ile Asn Arg
820 825 830
Leu Ser Asp Tyr Asp Val Asp His Ile Val Pro Gln Ser Phe Leu Lys
835 840 845
Asp Asp Ser Ile Asp Asn Lys Val Leu Thr Arg Ser Asp Lys Asn Arg
850 855 860
Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val Val Lys Lys Met Lys
865 870 875 880
Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu Ile Thr Gln Arg Lys
885 890 895
Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly Leu Ser Glu Leu Asp
900 905 910
Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu Thr Arg Gln Ile Thr
915 920 925
Lys His Val Ala Gln Ile Leu Asp Ser Arg Met Asn Thr Lys Tyr Asp
930 935 940
Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val Ile Thr Leu Lys Ser
945 950 955 960
Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln Phe Tyr Lys Val Arg
965 970 975
Glu Ile Asn Asn Tyr His His Ala His Asp Ala Tyr Leu Asn Ala Val
980 985 990
Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys Leu Glu Ser Glu Phe
995 1000 1005
Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val Arg Lys Met Ile Ala
1010 1015 1020
Lys Ser Glu Gln Glu Ile Gly Lys Ala Thr Ala Lys Tyr Phe Phe
1025 1030 1035
Tyr Ser Asn Ile Met Asn Phe Phe Lys Thr Glu Ile Thr Leu Ala
1040 1045 1050
Asn Gly Glu Ile Arg Lys Arg Pro Leu Ile Glu Thr Asn Gly Glu
1055 1060 1065
Thr Gly Glu Ile Val Trp Asp Lys Gly Arg Asp Phe Ala Thr Val
1070 1075 1080
Arg Lys Val Leu Ser Met Pro Gln Val Asn Ile Val Lys Lys Thr
1085 1090 1095
Glu Val Gln Thr Gly Gly Phe Ser Lys Glu Ser Ile Leu Pro Lys
1100 1105 1110
Arg Asn Ser Asp Lys Leu Ile Ala Arg Lys Lys Asp Trp Asp Pro
1115 1120 1125
Lys Lys Tyr Gly Gly Phe Asp Ser Pro Thr Val Ala Tyr Ser Val
1130 1135 1140
Leu Val Val Ala Lys Val Glu Lys Gly Lys Ser Lys Lys Leu Lys
1145 1150 1155
Ser Val Lys Glu Leu Leu Gly Ile Thr Ile Met Glu Arg Ser Ser
1160 1165 1170
Phe Glu Lys Asn Pro Ile Asp Phe Leu Glu Ala Lys Gly Tyr Lys
1175 1180 1185
Glu Val Lys Lys Asp Leu Ile Ile Lys Leu Pro Lys Tyr Ser Leu
1190 1195 1200
Phe Glu Leu Glu Asn Gly Arg Lys Arg Met Leu Ala Ser Ala Gly
1205 1210 1215
Glu Leu Gln Lys Gly Asn Glu Leu Ala Leu Pro Ser Lys Tyr Val
1220 1225 1230
Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu Lys Leu Lys Gly Ser
1235 1240 1245
Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe Val Glu Gln His Lys
1250 1255 1260
His Tyr Leu Asp Glu Ile Ile Glu Gln Ile Ser Glu Phe Ser Lys
1265 1270 1275
Arg Val Ile Leu Ala Asp Ala Asn Leu Asp Lys Val Leu Ser Ala
1280 1285 1290
Tyr Asn Lys His Arg Asp Lys Pro Ile Arg Glu Gln Ala Glu Asn
1295 1300 1305
Ile Ile His Leu Phe Thr Leu Thr Asn Leu Gly Ala Pro Ala Ala
1310 1315 1320
Phe Lys Tyr Phe Asp Thr Thr Ile Asp Arg Lys Arg Tyr Thr Ser
1325 1330 1335
Thr Lys Glu Val Leu Asp Ala Thr Leu Ile His Gln Ser Ile Thr
1340 1345 1350
Gly Leu Tyr Glu Thr Arg Ile Asp Leu Ser Gln Leu Gly Gly Asp
1355 1360 1365
<210> 12
<211> 1368
<212> PRT
<213> 酿脓链球菌(Streptococcus pyogenes)
<220>
<221> MISC_FEATURE
<223> 酿脓链球菌(S. Pyogenes) Cas9 D10A
<400> 12
Met Asp Lys Lys Tyr Ser Ile Gly Leu Ala Ile Gly Thr Asn Ser Val
1 5 10 15
Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val Pro Ser Lys Lys Phe
20 25 30
Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile Lys Lys Asn Leu Ile
35 40 45
Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala Glu Ala Thr Arg Leu
50 55 60
Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg Lys Asn Arg Ile Cys
65 70 75 80
Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala Lys Val Asp Asp Ser
85 90 95
Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val Glu Glu Asp Lys Lys
100 105 110
His Glu Arg His Pro Ile Phe Gly Asn Ile Val Asp Glu Val Ala Tyr
115 120 125
His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg Lys Lys Leu Val Asp
130 135 140
Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr Leu Ala Leu Ala His
145 150 155 160
Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu Gly Asp Leu Asn Pro
165 170 175
Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln Leu Val Gln Thr Tyr
180 185 190
Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala Ser Gly Val Asp Ala
195 200 205
Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser Arg Arg Leu Glu Asn
210 215 220
Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn Gly Leu Phe Gly Asn
225 230 235 240
Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn Phe Lys Ser Asn Phe
245 250 255
Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser Lys Asp Thr Tyr Asp
260 265 270
Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly Asp Gln Tyr Ala Asp
275 280 285
Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala Ile Leu Leu Ser Asp
290 295 300
Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala Pro Leu Ser Ala Ser
305 310 315 320
Met Ile Lys Arg Tyr Asp Glu His His Gln Asp Leu Thr Leu Leu Lys
325 330 335
Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr Lys Glu Ile Phe Phe
340 345 350
Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile Asp Gly Gly Ala Ser
355 360 365
Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile Leu Glu Lys Met Asp
370 375 380
Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg Glu Asp Leu Leu Arg
385 390 395 400
Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro His Gln Ile His Leu
405 410 415
Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu Asp Phe Tyr Pro Phe
420 425 430
Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile Leu Thr Phe Arg Ile
435 440 445
Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn Ser Arg Phe Ala Trp
450 455 460
Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro Trp Asn Phe Glu Glu
465 470 475 480
Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe Ile Glu Arg Met Thr
485 490 495
Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val Leu Pro Lys His Ser
500 505 510
Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu Leu Thr Lys Val Lys
515 520 525
Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe Leu Ser Gly Glu Gln
530 535 540
Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr Asn Arg Lys Val Thr
545 550 555 560
Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys Ile Glu Cys Phe Asp
565 570 575
Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe Asn Ala Ser Leu Gly
580 585 590
Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp Lys Asp Phe Leu Asp
595 600 605
Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile Val Leu Thr Leu Thr
610 615 620
Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg Leu Lys Thr Tyr Ala
625 630 635 640
His Leu Phe Asp Asp Lys Val Met Lys Gln Leu Lys Arg Arg Arg Tyr
645 650 655
Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile Asn Gly Ile Arg Asp
660 665 670
Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu Lys Ser Asp Gly Phe
675 680 685
Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp Asp Ser Leu Thr Phe
690 695 700
Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly Gln Gly Asp Ser Leu
705 710 715 720
His Glu His Ile Ala Asn Leu Ala Gly Ser Pro Ala Ile Lys Lys Gly
725 730 735
Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu Val Lys Val Met Gly
740 745 750
Arg His Lys Pro Glu Asn Ile Val Ile Glu Met Ala Arg Glu Asn Gln
755 760 765
Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu Arg Met Lys Arg Ile
770 775 780
Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile Leu Lys Glu His Pro
785 790 795 800
Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu Tyr Leu Tyr Tyr Leu
805 810 815
Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu Leu Asp Ile Asn Arg
820 825 830
Leu Ser Asp Tyr Asp Val Asp His Ile Val Pro Gln Ser Phe Leu Lys
835 840 845
Asp Asp Ser Ile Asp Asn Lys Val Leu Thr Arg Ser Asp Lys Asn Arg
850 855 860
Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val Val Lys Lys Met Lys
865 870 875 880
Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu Ile Thr Gln Arg Lys
885 890 895
Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly Leu Ser Glu Leu Asp
900 905 910
Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu Thr Arg Gln Ile Thr
915 920 925
Lys His Val Ala Gln Ile Leu Asp Ser Arg Met Asn Thr Lys Tyr Asp
930 935 940
Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val Ile Thr Leu Lys Ser
945 950 955 960
Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln Phe Tyr Lys Val Arg
965 970 975
Glu Ile Asn Asn Tyr His His Ala His Asp Ala Tyr Leu Asn Ala Val
980 985 990
Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys Leu Glu Ser Glu Phe
995 1000 1005
Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val Arg Lys Met Ile Ala
1010 1015 1020
Lys Ser Glu Gln Glu Ile Gly Lys Ala Thr Ala Lys Tyr Phe Phe
1025 1030 1035
Tyr Ser Asn Ile Met Asn Phe Phe Lys Thr Glu Ile Thr Leu Ala
1040 1045 1050
Asn Gly Glu Ile Arg Lys Arg Pro Leu Ile Glu Thr Asn Gly Glu
1055 1060 1065
Thr Gly Glu Ile Val Trp Asp Lys Gly Arg Asp Phe Ala Thr Val
1070 1075 1080
Arg Lys Val Leu Ser Met Pro Gln Val Asn Ile Val Lys Lys Thr
1085 1090 1095
Glu Val Gln Thr Gly Gly Phe Ser Lys Glu Ser Ile Leu Pro Lys
1100 1105 1110
Arg Asn Ser Asp Lys Leu Ile Ala Arg Lys Lys Asp Trp Asp Pro
1115 1120 1125
Lys Lys Tyr Gly Gly Phe Asp Ser Pro Thr Val Ala Tyr Ser Val
1130 1135 1140
Leu Val Val Ala Lys Val Glu Lys Gly Lys Ser Lys Lys Leu Lys
1145 1150 1155
Ser Val Lys Glu Leu Leu Gly Ile Thr Ile Met Glu Arg Ser Ser
1160 1165 1170
Phe Glu Lys Asn Pro Ile Asp Phe Leu Glu Ala Lys Gly Tyr Lys
1175 1180 1185
Glu Val Lys Lys Asp Leu Ile Ile Lys Leu Pro Lys Tyr Ser Leu
1190 1195 1200
Phe Glu Leu Glu Asn Gly Arg Lys Arg Met Leu Ala Ser Ala Gly
1205 1210 1215
Glu Leu Gln Lys Gly Asn Glu Leu Ala Leu Pro Ser Lys Tyr Val
1220 1225 1230
Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu Lys Leu Lys Gly Ser
1235 1240 1245
Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe Val Glu Gln His Lys
1250 1255 1260
His Tyr Leu Asp Glu Ile Ile Glu Gln Ile Ser Glu Phe Ser Lys
1265 1270 1275
Arg Val Ile Leu Ala Asp Ala Asn Leu Asp Lys Val Leu Ser Ala
1280 1285 1290
Tyr Asn Lys His Arg Asp Lys Pro Ile Arg Glu Gln Ala Glu Asn
1295 1300 1305
Ile Ile His Leu Phe Thr Leu Thr Asn Leu Gly Ala Pro Ala Ala
1310 1315 1320
Phe Lys Tyr Phe Asp Thr Thr Ile Asp Arg Lys Arg Tyr Thr Ser
1325 1330 1335
Thr Lys Glu Val Leu Asp Ala Thr Leu Ile His Gln Ser Ile Thr
1340 1345 1350
Gly Leu Tyr Glu Thr Arg Ile Asp Leu Ser Gln Leu Gly Gly Asp
1355 1360 1365
<210> 13
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> PDCD1 CRISPR引导RNA靶序列1
<400> 13
tgacgttacc tcgtgcggcc 20
<210> 14
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> PDCD1 CRISPR引导RNA靶序列2
<400> 14
cacgaagctc tccgatgtgt 20
<210> 15
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> PDCD1 CRISPR引导RNA靶序列3
<400> 15
gcgtgacttc cacatgagcg 20
<210> 16
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> PDCD1 CRISPR引导RNA靶序列4
<400> 16
ttggaactgg ccggctggcc 20
<210> 17
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> PDCD1 CRISPR引导RNA靶序列5
<400> 17
gtggcatact ccgtctgctc 20
<210> 18
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> PDCD1 CRISPR引导RNA靶序列6
<400> 18
gatgaggtgc ccattccgct 20
<210> 19
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> CD274 CRISPR引导RNA靶序列1
<400> 19
taccgctgca tgatcagcta 20
<210> 20
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> CD274 CRISPR引导RNA靶序列2
<400> 20
agctactatg ctgaaccttc 20
<210> 21
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> CD274 CRISPR引导RNA靶序列3
<400> 21
ggatgaccaa ttcagctgta 20
<210> 22
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> CD274 CRISPR引导RNA靶序列4
<400> 22
accccaaggc cgaagtcatc 20
<210> 23
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> CD274 CRISPR引导RNA靶序列5
<400> 23
tctttatatt catgacctac 20
<210> 24
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> CD274 CRISPR引导RNA靶序列6
<400> 24
accgttcagc aaatgccagt 20
- 还没有人留言评论。精彩留言会获得点赞!