一种靶向DNA纳米自组装体载NF‑kB decoy ODNs的制备方法及其应用与流程
本发明属于医药技术领域,涉及一种靶向dna纳米自组装体载nf-κbdecoyodns的制备方法及其应用。
背景技术:
核因子-κb/rel转录因子家族在协调参与免疫和炎症过程的几种基因的表达中起着中心作用,nf-κb几乎在所有细胞的细胞质中都有表达,正常情况下,nf-κb通常是抑制性蛋白(iκb)与p50和p65亚基结合的异源二聚体,但在炎症介入的疾病的相关细胞中,细胞被多种因子激活,如促炎细胞因子,细菌脂多糖(lps)和佛波酯等,nf-κb被激活,nf-κb的抑制剂iκb会被磷酸化而被降解,并释放脱离了iκb的p50/p65复合体,p50/p65复合体进入细胞,启动各种炎症基因的转录和表达。基因药物nf-κbdecoyodns可以特异性地结合nf-κb的p50/p65复合体,与p50/p65复合体特异性结合后可阻止nf-κb进入细胞核,抑制炎症基因的转录,抑制炎症因子的产生,从而降低炎症反应。
nf-κbdecoyodns与传统治疗方法相比,能特异性结合核因子-κb,从根源上改善炎症的发生,从而达到治疗目的,与传统药物相比,具有高效低毒的优势。然而游离的nf-κbdecoyodns由于细胞膜传递性差,在体内易受酶的降解,靶向性差而极大地限制了其发挥作用。dna纳米自组装体本身具有良好的稳定性,良好的生物相容性,大小和形状的高度可
控性等优点,dna纳米自组装体载nf-κbdecoyodns将显著提高nf-κbdecoyodns在体内外的稳定性和疗效,而且nf-κbdecoyodns纳米组装体通过高效阻止炎症反应,可有效控制疾病发展。
血管内皮细胞黏附分子(vascularcelladhesionmolecule-1,vcam-1),是一个90k~110k道尔顿的糖蛋白,其在炎症滑膜血管内皮细胞、炎症巨噬细胞和炎症成纤维样滑膜细胞表面均呈现高表达,主要与存在于白细胞和嗜酸性粒细胞表面的受体α4整合素家族的α4β1(又称verylateantigen4,vla-4)结合,介导并增强白细胞向血管内皮细胞和炎症成纤维样滑膜细胞的黏附,从而增强白细胞向滑膜关节腔的渗入和停留;参与淋巴细胞的活化、迁移和造血细胞的生长发育,并在肿瘤、炎症转移等病理过程中起重要作用。在dna纳米自组装体体上修饰vcam-1靶向多肽,将使纳米组装体像白细胞一样易于向发炎滑膜聚集。由于滑模腔内的炎症细胞表面高表达vcam-1,因此被vcam-1靶向多肽修饰的nf-κbdecoyodns纳米组装体可主动靶向于滑模腔内的炎症细胞,提高整体的抗炎效果,达到高效低毒治疗类风湿性关节炎的目的。
目前,通过dna纳米自组装体载nf-κbdecoyodns并修饰vcam-1靶向多肽形成的药物传递系统在治疗类风湿性关节炎的应用中尚未报道。
技术实现要素:
本发明为解决nf-κbdecoyodns在治疗类风湿性关节炎中稳定性差、抗炎效果不佳、副作用大的技术难题,公开了一种靶向dna纳米自组装体载nf-κbdecoyodns的制备方法及其应用。
为解决上述技术难题,本发明采用以下技术方案:
一种靶向dna纳米自组装体载nf-κbdecoyodns的制备方法,步骤如下:
(1)将四条单链直链dna与组成nf-κbdecoyodns的两条链nf-κbc、nf-κbd在体外缓冲盐溶液中,退火自组装形成td-dodns溶液;
(2)ssdna-peptide:低速搅拌向ssdna中滴加交联剂,在ph7~9条件下,室温反应2h,透析24h除去未反应的多肽,得到ssdna-smcc,然后加入vcam-1靶向多肽,ph6.5~7.5条件下,反应8~12h,透析24h除去未反应的多肽,得到ssdna-peptide;
(3)向步骤(1)中制备的td-dodns溶液中加入ssdna-peptide,以2min/℃的速度从40℃降至20℃,完成靶向dna纳米自组装体载nf-κbdecoyodns的制备。
所述步骤(1)中四条单链直链dna为单链直链s1、s2-f、s3、s4或单链直链s1、s2-f、s3p、s4或单链直链s1-p、s2-f、s3-p、s4-f或单链直链s1-f、s2-f、s3-p、s4-f;四条单链直链dna与nf-κbc和nf-κbd反应的物质的量比为:1:1:1:1:(1~3):(1~3)。
所述单链直链s1的序列如seqidno:1所示,单链直链s1-f的序列如seqidno:2所示,单链直链s1-p的序列如seqidno:3所示,单链直链s2的序列如seqidno:4所示,单链直链s2-f的序列如seqidno:5所示,单链直链s3的序列如seqidno:6所示,单链直链s3-p的序列如seqidno:7所示,单链直链s4的序列如seqidno:8所示,单链直链s4-f的序列如seqidno:9所示,nf-κbc序列如seqidno:10所示,nf-κbd序列如seqidno:11所示。
所述步骤(1)中体外缓冲盐溶液为将mgcl2溶于浓度5~20mm的tris·hcl溶液中,mgcl2的终浓度为5~20mm。
所述步骤(1)中退火条件为95℃保持5min,10s内由95℃降温至4℃,4℃保持30s。
所述步骤(2)中,ssdna序列如seqidno:11所示,其3’端c7经氨基修饰;交联剂为sulfo-smcc溶液;vcam-1靶向多肽序列如seqidno:12所示;ssdna:vcam-1靶向多肽的物质的量比为20:1。
所述步骤(3)中,ssdna-peptide:td-dodns的物质的量比为1:(1~2)。
所述dna纳米自组装体载nf-κbdecoyodns的平均粒径小于10nm。
一种靶向dna纳米自组装体载nf-κbdecoyodns作为抗类风湿性关节炎免疫治疗的应用。
本发明的有益效果在于:
1.本发明采用dna纳米自组装技术合成载体,制备方法简单,结构稳定,nf-κbdecoyodns可与载体通过碱基互补配对连接,同时提高了药物的稳定性。选用vcam-1靶向多肽修饰dna纳米自组装体,提高nf-κbdodns纳米组装体对炎症部位和炎症细胞的靶向性,增强抗炎效果。
2.本发明制备工艺简单、副作用小、能有效负载基因药物nf-κbdecoyodns到达炎症部位减少炎症反应,有望成为一种新的方法用于临床抗类风湿性关节炎免疫治疗。
附图说明
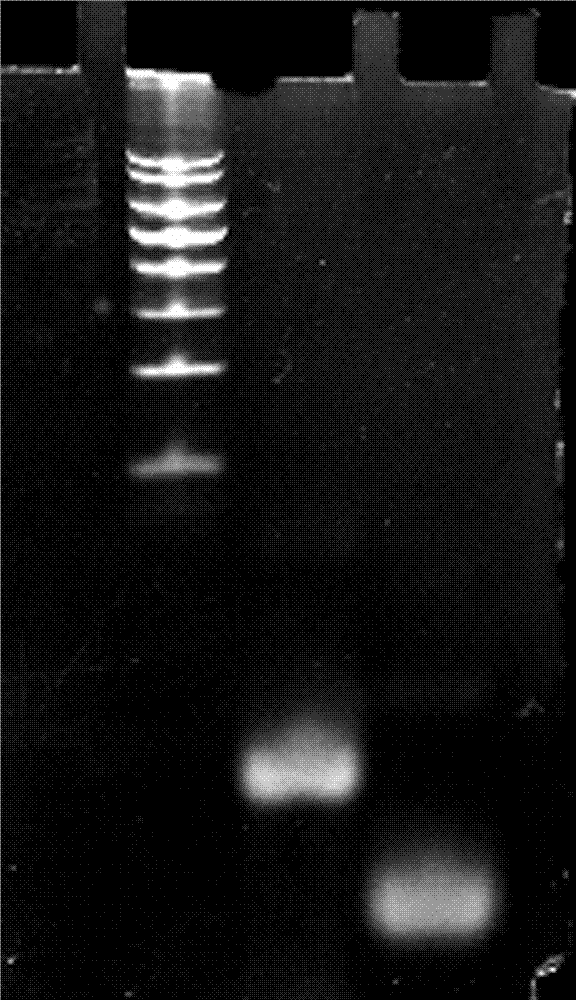
图1为dodns、td、td-dodns、td-1p-dodns、td-2p-2odns、td-3p-dodns、dodns的琼脂糖凝胶电泳图。
图2为ssdna、ssdna-peptide的聚丙烯酰胺凝胶电泳图。
图3为dna纳米自组装体的afm图。
图4为载体对巨噬细胞raw264.7的毒性考察。
图5为载体对脐静脉血管内皮细胞huvec的毒性考察。
图6为td、dodns、tdsodns、td-dodns、td-1p-dodns对巨噬细胞raw264.7的抗炎作用。
具体实施方式
现以合成靶向dna纳米自组装体载nf-κbdecoyodns为例阐述具体实施方式。
实施例1
(1)nf-κbdecoyodns的合成:
将合成nf-κbdecoyodns的两条单链nf-κbd、nf-κbd’等摩尔比混合,用tm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,从80℃降温到25℃,降温时间为2h。nf-κbdecoyodns合成,4℃保存。
(2)dna纳米自组装体的合成:
将合成dna纳米自组装体的四条单链s1、s2、s3、s4等摩尔比混合,用5mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(3)dna纳米自组装体载nf-κbdecoyodns的合成:
将s1、s2-f、s3、s4、nf-κbc、nf-κbd等摩尔比混合,用5mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(4)ssdna-peptide的合成:
低速搅拌下向3'端c7氨基修饰的单链直链dna(ssdna)中逐滴滴加sulfo-smcc溶液,物质的量比为ssdna:sulfo-smcc=1:400,ph7~9,室温反应2h,透析24h除去未反应多肽,得ssdna-smcc溶液;磁力搅拌下逐滴加入vcam-1靶向多肽,物质的量比为vcam-1靶向多肽:ssdna=1:20,ph6.5~7.5,反应过夜,透析24h除去未反应多肽,得到ssdna-peptide溶液,4℃保存。
(5)靶向四面体载nf-κbdecoyodns前体的合成:
将s1、s2-f、s3-p、s4、nf-κbc、nf-κbd等摩尔比混合,用5mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。靶向四面体载nf-κbdecoyodns前体的合成,4℃保存。
(6)靶向dna纳米自组装体载nf-κbdecoyodns的合成:
向已构建好的靶向dna纳米自组装体载nf-κbdecoyodns前体中加入等摩尔量的ssdna-peptide,从40℃开始,以2min/℃的速度降温至20℃。靶向dna纳米自组装体载nf-κbdecoyodns构建完成,4℃保存。
实施例2
(1)nf-κbdecoyodns的合成:
将合成nf-κbdecoyodns的两条单链nf-κbd、nf-κbd’等摩尔比混合,用tm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,从80℃降温到25℃,降温时间为2h。nf-κbdecoyodns合成,4℃保存。
(2)dna纳米自组装体的合成:
将合成dna纳米自组装体的四条单链s1、s2、s3、s4等摩尔比混合,用5mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(3)dna纳米自组装体载nf-κbdecoyodns的合成:
将s1、s2f、s3、s4、nf-κbc、nf-κbd等摩尔比混合,用5mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(4)ssdna-peptide的合成:
低速搅拌下向3'端c7氨基修饰的单链直链dna(ssdna)中逐滴滴加sulfo-smcc溶液,物质的量比为ssdna:sulfo-smcc=1:400,ph7~9,室温反应2h,透析24h除去未反应多肽,得ssdna-smcc溶液;磁力搅拌下逐滴加入vcam-1靶向多肽,物质的量比为vcam-1靶向多肽:ssdna=1:20,ph6.5~7.5,反应过夜,透析24h除去未反应多肽,得到ssdna-peptide溶液,4℃保存。
(5)靶向四面体载nf-κbdecoyodns前体的合成:
将s1p、s2f、s3p、s4f、nf-κbc、nf-κbd以1:1:1:1:2:2的摩尔比混合,用5mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。靶向四面体载nf-κbdecoyodns前体的合成,4℃保存。
(6)靶向dna纳米自组装体载nf-κbdecoyodns的合成:
向已构建好的靶向dna纳米自组装体载nf-κbdecoyodns前体中加入1:2摩尔比的ssdna-peptide,从40℃开始,以2min/℃的速度降温至20℃。靶向dna纳米自组装体载nf-κbdecoyodns构建完成,4℃保存。
实施例3
(1)nf-κbdecoyodns的合成:
将合成nf-κbdecoyodns的两条单链nf-κbd、nf-κbd’等摩尔比混合,用tm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,从80℃降温到25℃,降温时间为2h。nf-κbdecoyodns合成,4℃保存。
(2)dna纳米自组装体的合成:
将合成dna纳米自组装体的四条单链s1、s2、s3、s4等摩尔比混合,用5mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(3)dna纳米自组装体载nf-κbdecoyodns的合成:
将s1、s2f、s3、s4、nf-κbc、nf-κbd等摩尔比混合,用5mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(4)ssdna-peptide的合成:
低速搅拌下向3'端c7氨基修饰的单链直链dna(ssdna)中逐滴滴加sulfo-smcc溶液,物质的量比为ssdna:sulfo-smcc=1:400,ph7~9,室温反应2h,透析24h除去未反应多肽,得ssdna-smcc溶液;磁力搅拌下逐滴加入vcam-1靶向多肽,物质的量比为vcam-1靶向多肽:ssdna=1:20,ph6.5~7.5,反应过夜,透析24h除去未反应多肽,得到ssdna-peptide溶液,4℃保存。
(5)靶向四面体载nf-κbdecoyodns前体的合成:
将s1p、s2f、s3p、s4f、nf-κbc、nf-κbd以1:1:1:1:3:3的摩尔比混合,用5mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。靶向四面体载nf-κbdecoyodns前体的合成,4℃保存。
(6)靶向dna纳米自组装体载nf-κbdecoyodns的合成:
向已构建好的靶向dna纳米自组装体载nf-κbdecoyodns前体中加入等摩尔比的ssdna-peptide,从40℃开始,以2min/℃的速度降温至20℃。靶向dna纳米自组装体载nf-κbdecoyodns构建完成,4℃保存。
实施例4
(1)nf-κbdecoyodns的合成:
将合成nf-κbdecoyodns的两条单链nf-κbd、nf-κbd’等摩尔比混合,用tm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,从80℃降温到25℃,降温时间为2h。nf-κbdecoyodns合成,4℃保存。
(2)dna纳米自组装体的合成:
将合成dna纳米自组装体的四条单链s1、s2、s3、s4等摩尔比混合,用10mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(3)dna纳米自组装体载nf-κbdecoyodns的合成:
将s1、s2-f、s3、s4、nf-κbc、nf-κbd等摩尔比混合,用10mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(4)ssdna-peptide的合成:
低速搅拌下向3'端c7氨基修饰的单链直链dna(ssdna)中逐滴滴加sulfo-smcc溶液,物质的量比为ssdna:sulfo-smcc=1:400,ph7~9,室温反应2h,透析24h除去未反应多肽,得ssdna-smcc溶液;磁力搅拌下逐滴加入vcam-1靶向多肽,物质的量比为vcam-1靶向多肽:ssdna=1:20,ph6.5~7.5,反应过夜,透析24h除去未反应多肽,得到ssdna-peptide溶液,4℃保存。
(5)靶向四面体载nf-κbdecoyodns前体的合成:
将s1、s2-f、s3-p、s4、nf-κbc、nf-κbd等摩尔比混合,用10mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。靶向四面体载nf-κbdecoyodns前体的合成,4℃保存。
(6)靶向dna纳米自组装体载nf-κbdecoyodns的合成:
向已构建好的靶向dna纳米自组装体载nf-κbdecoyodns前体中加入等摩尔量的ssdna-peptide,从40℃开始,以2min/℃的速度降温至20℃。靶向dna纳米自组装体载nf-κbdecoyodns构建完成,4℃保存。
实施例5
(1)nf-κbdecoyodns的合成:
将合成nf-κbdecoyodns的两条单链nf-κbd、nf-κbd’等摩尔比混合,用tm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,从80℃降温到25℃,降温时间为2h。nf-κbdecoyodns合成,4℃保存。
(2)dna纳米自组装体的合成:
将合成dna纳米自组装体的四条单链s1、s2、s3、s4等摩尔比混合,用10mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(3)dna纳米自组装体载nf-κbdecoyodns的合成:
将s1、s2f、s3、s4、nf-κbc、nf-κbd等摩尔比混合,用10mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(4)ssdna-peptide的合成:
低速搅拌下向3'端c7氨基修饰的单链直链dna(ssdna)中逐滴滴加sulfo-smcc溶液,物质的量比为ssdna:sulfo-smcc=1:400,ph7~9,室温反应2h,透析24h除去未反应多肽,得ssdna-smcc溶液;磁力搅拌下逐滴加入vcam-1靶向多肽,物质的量比为vcam-1靶向多肽:ssdna=1:20,ph6.5~7.5,反应过夜,透析24h除去未反应多肽,得到ssdna-peptide溶液,4℃保存。
(5)靶向四面体载nf-κbdecoyodns前体的合成:
将s1p、s2f、s3p、s4f、nf-κbc、nf-κbd以1:1:1:1:2:2的摩尔比混合,用10mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。靶向四面体载nf-κbdecoyodns前体的合成,4℃保存。
(6)靶向dna纳米自组装体载nf-κbdecoyodns的合成:
向已构建好的靶向dna纳米自组装体载nf-κbdecoyodns前体中加入1:2摩尔比的ssdna-peptide,从40℃开始,以2min/℃的速度降温至20℃。靶向dna纳米自组装体载nf-κbdecoyodns构建完成,4℃保存。
实施例6
(1)nf-κbdecoyodns的合成:
将合成nf-κbdecoyodns的两条单链nf-κbd、nf-κbd’等摩尔比混合,用tm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,从80℃降温到25℃,降温时间为2h。nf-κbdecoyodns合成,4℃保存。
(2)dna纳米自组装体的合成:
将合成dna纳米自组装体的四条单链s1、s2、s3、s4等摩尔比混合,用10mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(3)dna纳米自组装体载nf-κbdecoyodns的合成:
将s1、s2f、s3、s4、nf-κbc、nf-κbd等摩尔比混合,用10mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。dna纳米自组装体合成,4℃保存。
(4)ssdna-peptide的合成:
低速搅拌下向3'端c7氨基修饰的单链直链dna(ssdna)中逐滴滴加sulfo-smcc溶液,物质的量比为ssdna:sulfo-smcc=1:400,ph7~9,室温反应2h,透析24h除去未反应多肽,得ssdna-smcc溶液;磁力搅拌下逐滴加入vcam-1靶向多肽,物质的量比为vcam-1靶向多肽:ssdna=1:20,ph6.5~7.5,反应过夜,透析24h除去未反应多肽,得到ssdna-peptide溶液,4℃保存。
(5)靶向四面体载nf-κbdecoyodns前体的合成:
将s1p、s2f、s3p、s4f、nf-κbc、nf-κbd以1:1:1:1:3:3的摩尔比混合,用10mmtm(tris∙hcl,ph8.0和mgcl2)缓冲液稀释至终浓度为0.5μm,低速涡旋至混合均匀。在pcr仪中,95℃变性5min后,迅速降温至4℃并保持30s。靶向四面体载nf-κbdecoyodns前体的合成,4℃保存。
(6)靶向dna纳米自组装体载nf-κbdecoyodns的合成:
向已构建好的靶向dna纳米自组装体载nf-κbdecoyodns前体中加入等摩尔比的ssdna-peptide,从40℃开始,以2min/℃的速度降温至20℃。靶向dna纳米自组装体载nf-κbdecoyodns构建完成,4℃保存。
效果实施例1:实施例1-3的琼脂糖凝胶电泳表征:
精密称取0.60g琼脂糖粉末,加到20ml1×tae电泳液中,置于电炉上加热煮沸3min,待温度冷却至70℃左右,加入1.2μl溴化乙锭(eb)溶液,混合后将凝胶倒入模具中,室温冷却30-45min,即制得3%琼脂糖凝胶。将制备好的凝胶放于装有1×tae电泳液的电泳槽中,使电泳液液面高于凝胶2mm左右,将各样品与6×loadingbuffer按1:0.2的比例进行混合,混合后加到凝胶加样孔中,冰浴条件,100v的电压电泳50min。电泳完成后,用凝胶成像仪分析。结果见图1。
效果实施例2:本发明实施例1的ssdna-peptide的聚丙烯酰胺凝胶电泳:
安装好电泳装置,检漏10min,制胶:向10mlep管中加入30%丙烯酰胺4ml、5×tbe1.6ml、10%过硫酸铵0.056ml、纯化水2.344ml、混合均匀后,加入temed5.2μl,混匀后,将胶注入玻璃板间,插入梳子,聚合30min,拔出梳子,用1×tbe电泳液充满电泳槽,将6×loadingbuffer与样品5:1充分混合,加入样品孔。110v电泳90min,将凝胶置于0.5%eb中染色15min,用凝胶成像仪分析。结果见图2。
效果实施例3:本发明实施例1的dna纳米自组装体的原子力显微镜:
将合成好的dna纳米自组装体用tmbuffer稀释至终浓度为125nm。取10µl样品,滴加到云母片上,通过正负电荷相互吸引,静止吸附5min,使dna纳米自组装体吸附到云母表面。再滴加tmbuffer覆盖样品。用afm在液相模式下进行扫描。结果见图3。可见三角形框架,大小约5.8nm,由于云母片的吸附作用dna四面体高度有所下降,约3.4nm。
效果实施例4:本发明实施例1的dna纳米自组装体的细胞毒性考察:
采用两种与炎症反应相关的细胞raw264.7和huvec对dna纳米自组装体的细胞毒性进行研究,用cck-8法考察细胞的增殖抑制情况。结果见图4。结果显示实验所用的dna纳米自组装体浓度对细胞生长抑制率都小于10%,在lps存在的情况下,dna纳米自组装体对细胞抑制率也低于10%,说明本实验所用载体材料对raw264.7和huvec细胞无明显毒性,可排除干扰。
效果实施例5:本发明实施例1的靶向dna纳米自组装体载nf-κbdecoyodns的体外抗炎作用:
采用两种与炎症反应相关的细胞raw264.7和huvec对靶向dna纳米自组装体载nf-κbdecoyodns的抗炎作用进行研究,用elisa法检测细胞产生的炎症因子。结果见图4。药物nf-κbdecoyodns对两种炎症细胞的抗炎作用随浓度的增加而增强,相同浓度下,td-1p-dodns对细胞炎症因子产生的抑制作用最明显,其次是td-dodns,游离nf-κbdecoyodns作用最弱。结果表明靶向dna纳米自组装体载nf-κbdecoyodns增强了nf-κbdecoyodns的抗炎作用。
效果实施例6:本发明实施例1的raw264.7和huvec对靶向dna纳米自组装体载nf-κbdecoyodns的定量摄取:
raw264.7和huvec对靶向dna纳米自组装体载nf-κbdecoyodns摄取2h和4h的荧光强度值见表1和表2,4h时细胞对药物nf-κbdecoyodns的摄取量明显高于2h的摄取量,td-1p-dodns明显比td-dodns的摄取量多,两者摄取量都高于游离nf-κbdecoyodns;4h时,raw264.7对td-1p-dodns的摄取量是td-dodns的1.05倍,是dodns的2.81倍,huvec对td-1p-dodns的摄取量是td-dodns的1.38倍,是dodns的2.63倍。
表1药物在raw264.7细胞摄取的荧光强度值
表2药物在huvec细胞摄取的荧光强度值
结果表明,dna纳米自组装体提高了细胞对药物摄取,修饰vcam-1靶向多肽后,明显增加了细胞的摄取量。
<110>郑州大学
<120>一种靶向dna纳米自组装体载nf-κbdecoyodns的制备方法及其应用
<160>12
<210>1
<211>55
<212>dna
<213>人工序列
<220>
<221>misc_difference
<222>(1)…(55)
<400>1
acattcctaagtctgaaacattacagcttgctacacgagaagagccgccatagta55
<210>2
<211>76
<212>dna
<213>人工序列
<220>
<221>misc_difference
<222>(1)…(76)
<400>2
gcttgcacgcgtgctattaatacattcctaagtctgaaacattacagcttgctacacgag60
aagagccgccatagta76
<210>3
<211>64
<212>dna
<213>人工序列
<220>
<221>misc_difference
<222>(1)…(64)
<400>3
tttttttttacattcctaagtctgaaacattacagcttgctacacgagaagagccgccat60
agta64
<210>4
<211>76
<212>dna
<213>人工序列
<220>
<221>misc_difference
<222>(1)…(76)
<400>4
tatcaccaggcagttgacagtgtagcaagctgtaatagatgcgagggtccaatac55
<210>5
<211>76
<212>dna
<213>人工序列
<220>
<221>misc_difference
<222>(1)…(76)
<400>5
gcttgcacgcgtgctattaattatcaccaggcagttgacagtgtagcaagctgtaataga60
tgcgagggtccaatac76
<210>6
<211>55
<212>dna
<213>人工序列
<220>
<221>misc_difference
<222>(1)…(55)
<400>6
tcaactgcctggtgataaaacgacactacgtgggaatctactatggcggctcttc55
<210>7
<211>64
<212>dna
<213>人工序列
<220>
<221>misc_difference
<222>(1)…(64)
<400>7
ttttttttttcaactgcctggtgataaaacgacactacgtgggaatctactatggcggct60
cttc64
<210>8
<211>55
<212>dna
<213>人工序列
<220>
<221>misc_difference
<222>(1)…(55)
<400>8
ttcagacttaggaatgtgcttcccacgtagtgtcgtttgtattggaccctcgcat55
<210>9
<211>76
<212>dna
<213>人工序列
<220>
<221>misc_difference
<222>(1)…(76)
<400>9
gcttgcacgcgtgctattaatttcagacttaggaatgtgcttcccacgtagtgtcgtttg60
tattggaccctcgcat76
<210>10
<211>41
<212>dna
<213>人工序列
<220>
<221>misc_difference
<222>(1)…(41)
<400>10
gcacgcgtgcaagctattaatccttgaagggatttccctcc41
<210>11
<211>20
<212>dna
<213>人工序列
<220>
<221>misc_difference
<222>(1)…(20)
<400>11
ggagggaaatcccttcaagg20
<210>12
<211>13
<212>prt
<213>人属(homo)
<400>12
valhisprolysglnhisargglyglyserlysglycys13
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺