一种精氨酸单糖苷(AF)的新合成方法及其在医药方面的用途与流程
本发明涉及一种精氨酸单糖苷(af)的新合成方法及其在医疗方面的用途。
背景技术:
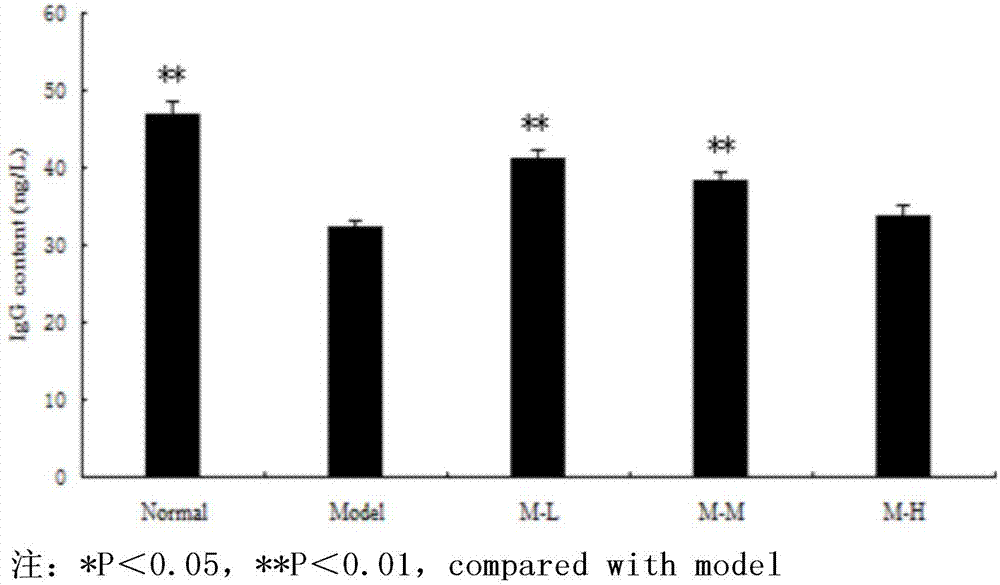
:精氨酸单糖苷英文名为arginyl-fructose,简称af,又称为精氨酸果糖苷,分子量为337.3,化学名称为1-(精氨酸-nα基)-1-去氧-d果糖。纯化后的af单体为白色粉末,af极易溶于水,几乎不溶于甲醇等有机溶剂,具有吸湿性,对热不稳定。精氨酸单糖苷(af),存在于自然界的许多植物中,郑毅男在鲜参加工成红参、生晒参的过程中,发现了af的存在。af在自然界中的含量非常低,但研究发现在人参加工成生晒参、红参时af含量较高。af是鲜人参经加热加工处理后,人参内的糖和氨基酸发生美拉德反应生成的[1,2]。研究发现,af有很强的药理活性,在疾病治疗上发挥着积极作用。目前已有研究表明,af在抗糖尿病[3,4]、抗氧化[5,6]、抗肿瘤[7]、保肝等治疗中发挥作用。目前精氨酸单糖苷合成的方法主要是专利“精氨酸果糖苷(af)制备方法及其医用用途,申请号:201410305612.1”所报道的,但是其方法在合成过程中所选用的溶剂不仅污染环境,对人体有危害,合成率也较低,后续的分离纯化过程也较为复杂,本发明为克服上述合成缺陷上开发了一种新型的合成工艺,并公开了合成后精氨酸糖苷的部分生物活性。技术实现要素:本发明的目的是公开一种精氨酸单糖苷的合成方法及其医用用途。本发明公开的精氨酸单糖苷的合成方法合成率大于63%,精氨酸和单糖的配比为1:0.5-2。本发明公开的精氨酸单糖苷的合成方法中所需要的精氨酸可以是l-精氨酸、d-精氨酸其中的一种或者两种的混合物。本发明公开的精氨酸单糖苷的合成方法中所需要的单糖可以是d-葡萄糖、d-果糖、d-半乳糖、d-木糖中的一种或者两种以上的混合物。本发明公开的精氨酸单糖苷的合成方法中所需要的合成时间为120-300min。本发明公开的精氨酸单糖苷的合成方法中所需要的合成温度为80℃。本发明公开的精氨酸单糖苷的合成方法中所需要的溶剂为丙二醇、丙三醇、丙醇、异丙醇中的一种或者两种以上的混合溶剂。本发明公开的精氨酸单糖苷的合成方法中还可以添加亚硫酸钠、维生素c、维生素e的中的一种或者两种以上的混合物。本发明公开的精氨酸单糖苷的合成方法中还可以添加柠檬酸、苹果酸等可食用的有机固体酸的中的一种或者两种以上的混合物。本发明公开的合成的精氨酸单糖苷具有清除羟基自由基和超氧阴离子自由基、抗肿瘤、提高免疫力的用途。本发明的积极效果在于:本发明中af的合成方法,合成率有大幅提高,可达63%,同时降低了af的生产成本,且粗合成物无刺激性气味,属于绿色环境友好型的合成方法。本发明通过实验表明,合成的af具有清除自由基、抗肿瘤和提高机体免疫力的功效。实验例1.精氨酸单糖苷(af)合成工艺1.1实验方法1.1.1标准曲线的绘制精密称取af对照品5mg,用水定容于25ml容量瓶中,分别移取2、4、6、8ml对照品溶液于10ml容量瓶中,用水定容至刻度,得质量浓度分别为0.1、0.2、0.3、0.4mg/ml的对照品溶液。hplc条件:venusil-aa氨基酸分析专用柱(5μm,4.6mm×250mm);流动相:a相-乙酸钠缓冲溶液(925ml纯净水,7.6g乙酸钠,2ml磷酸,2-3d冰乙酸,75ml乙腈),b相-有机相(乙腈∶水=4∶1)。流速1.0ml/min;检测波长254nm;柱温40℃;进样量20μl。1.1.2单因素试验1.1.2.1筛选最佳反应时间固定反应温度85℃,料液比1:20,苹果酸加入量0.75g,考察反应时间为60、90、120、150、180min对af合成率的影响。1.1.2.2筛选最佳反应温度固定反应时间150min,料液比1:20,苹果酸加入量0.75g,考察反应温度为70、75、80、85、90℃对af合成率的影响。1.1.2.3筛选最佳料液比固定反应时间150min,反应温度85℃,苹果酸加入量0.75g,考察料液比1:10、1:15、1:20、1:25、1:30g/ml对af合成率的影响。1.2.2.4筛选最佳苹果酸加入量固定反应时间150min,反应温度85℃,料液比1:20,考察苹果酸加入量0.5,0.75,1.0,1.25g对af合成率的影响。1.1.3响应面法试验在单因素的基础上,采用统计分析软件designexpert8.0.6,根据box-behnken的中心组合实验设计原理,以反应时间(x1)、反应温度(x2)、料液比(x3)、苹果酸加入量(x4)为自变量,af合成率(y)为响应值,进行优化,试验因素与水平编码如表1所示。表1响应面优化试验因素水平1.2试验结果1.2.1标准曲线的绘制测定不同浓度的af对照品溶液在254nm下的峰面积,以质量浓度x(mg/ml)对峰面积y绘制标准曲线,得到回归方程为:y=298449.88x,r2=0.9991,在质量浓度0.1~0.5mg/ml内呈良好线性关系。1.2.2单因素试验1.2.2.1反应时间对af合成率的影响在其它试验条件不变的情况下,随着时间的延长,苹果酸催化的af合成率逐渐升高,当时间达到150min时,合成率达到最高点,随着反应继续,反应向af减少方向进行。因此,box-behnken试验选取的反应时间的范围为120-180min(附图1)。1.2.2.2反应温度对af合成率的影响多次试验发现,温度70-90℃之间时,af的合成反应迅速发生,符合af在红参中形成的温度条件,当温度达到85℃时,af合成率达到最高点,随着温度继续升高,合成率降低。因此,box-behnken试验选取的反应温度的范围为80-90℃(附图2)。1.2.2.3料液比对af合成率的影响在其它试验条件不变的情况下,以料液比为变量时,丙三醇加量过低时,反应不易混匀,且反应不彻底,合成率偏低,随着溶媒体积的增大,达到1:20g/ml时,af合成率最高,随着丙三醇体积继续增加,合成率下降。因此,box-behnken试验选取的料液比的范围为1:15-1:25g/ml(附图3)。1.2.2.4苹果酸加入量对af合成率的影响在其它试验条件不变的情况下,随着苹果酸加入量的增加,af的合成率逐渐升高,苹果酸加入量达到0.75g时,合成率达到最大值,随后随着苹果酸含量的增加而有所降低。因此,box-behnken试验选取的苹果酸加入量的范围为0.5-1.0g(附图4)。1.2.3响应面法优化合成试验结果与分析1.2.3.1试验结果运用designexpert8.0分析软件进行box-behnken设计,设计方案及其试验结果见表2,试验号1-24位析因实验,试验号25-29位中心试验。1.2.3.2结果分析对表2的试验结果进行分析,得到af合成率(y)对反应温度(x1)、反应时间(x2)、料液比(x3)、加酸量(x4)的二次多项回归方程为:y=67.79+2.96x1+1.74x2-1.77x3+1.05x4+1.24x1x2+1.53x1x3+1.72x2x3-1.55x2x4-2.01x3x4-5.15x12-6.09x22-5.49x32-6.62x42。表3为回归模型的方差分析结果,该模型f值为53.18、r2=0.9815、p<0.0001,说明回归方程的你和程度较好,试验具有很高的可信性和准确性。模型的修正相关系数r2adj=0.9631,表明该方程较好地反映了合成时间、合成温度、料液比和苹果酸加入量与af合成率的关系,说明该模型能够解释96.31%的响应值变化,因此可用此模型对af的合成进行分析和预测。从f值的分析结果(a=95.2、b=32.83、c=34.03、d=11.89)可以看出,在所选的各因素水平范围内,对af合成率的影响大小的顺序为:反应温度>料液比>反应时间>苹果酸加入量。表2box-behnken试验设计方案与结果表3回归模型方差分析结果r2=0.9815,r2adj=0.9631,r2pred=0.9159,cv=1.811.2.3.3af合成工艺的响应面分析与优化附图6、10曲面陡峭,等高线呈椭圆形,说明反应温度与料液比、料液比与苹果酸加入量有很强的交互作用,呈极显著性;附图5、6、8曲面相对平缓,说明反应温度与反应时间、反应温度与料液比、反应时间与料液比有一定的交互作用,但等高线几乎为圆形,交互作用不是很强;附图7曲面平缓,等高线为圆形,说明反应温度与苹果酸加入量交互作用不显著。附图9中均存在极值,说明试验所选范围比较合理。1.2.3.4af合成工艺条件的确定结合回归模型分析结果可知,af合成的最佳工艺条件为反应温度85℃、反应时间150min、液料比1:20(g/ml)、苹果酸加入量0.75g。在此条件下af的理论合成率为67.79%,实际合成率为68.92%,理论值与实际值基本吻合。由此可见,响应面分析法所优化的最佳合成工艺数据真实可靠。1.3讨论采用响应曲面法优化af合成工艺,通过合理的实验设计,从而得出各因素对af合成率影响大小依次为:反应温度>料液比>反应时间>苹果酸加入量。料液比和苹果酸加入量对af合成的交互影响最为显著。其最佳合成条件为反应温度85℃、反应时间150min、料液比1:20(g/ml)、苹果酸加入量0.75g,af的实际合成率为68.92%。试验采用的响应曲面模型显著性较好,使得结果准确可靠,该研究结果是对人工合成af方法的进一步完善,具有一定的理论参考价值和实际应用前景。af单体在自然界中含量低,分离纯化难,因此采用人工合成的方法,以降低af合成成本,提高利用价值。赵婷、郑毅男等以冰醋酸为催化剂af的合成率为20-30%左右。冰醋酸是一种有机一元酸,且有强烈的刺激性气味,其蒸汽对眼和鼻有刺激性作用。本文以苹果酸为催化剂,是合成食药通用的af较好的选择之一。苹果酸的使用,解决了冰醋酸刺激性气味的缺点,且利用响应面法优化af合成工艺,它更好地处理离散水平值,实验周期短、精密度高,能对因素间交互作用进行研究,筛选出最佳合成条件,显著提高了af合成率,为下一步研究奠定基础,也使得af大量生产使用成为可能。实验例2精氨酸单糖苷(af)对羟基自由基和超氧阴离子自由基的清除作用2.1af样品溶液的制备取l-精氨酸10g,葡萄糖10g,苹果酸15g,溶于200ml丙三醇中,摇匀,于85℃水浴条件下反应90min,得af总合成物,上样于高效阳离子柱,1.5%氨水洗脱,部分接收器接样,分批处理后,样品通过hplc测得纯度,真空冷冻干燥机冻干为白色粉末。阳离子柱反复纯化,经高效液相测其纯度,大于95%。取纯化后的af,用水配置成质量浓度为1mg/ml的样品溶液,以此浓度为基础,逐步稀释成0.5、0.4、0.1、0.08、0.05mg/ml样品溶液,待用。2.2抗氧化活性测定2.2.1af对羟基自由基的清除作用2.2.1.1羟基自由基生成体系本试验采用fenton方法,建立·oh自由基反应体系模型。其反应方程为:h2o2+fe2+→oh-+·oh+fe3+,·oh存活的时间短,但具有很高的反应活性。而水杨酸能够有效的捕捉·oh,产生一定颜色的络合物,该颜色产物,在500nm处有强吸收。如果本试验中,af具有清除·oh功能,则与水杨酸争夺·oh,从而使有色络合物生成量减少,颜色减轻。所以,利用此方法,与空白对照管进行对比,就可测定样品的清除·oh自由基效果。清除率计算公式为:e(·oh)/%=1-(ai-aj)×100%aoe为羟基自由基的清除率;ao为空白对照管吸光度;ai为反应液吸光度;aj为未加水杨酸提取液自身的吸光度。2.2.1.2溶液的配制feso4溶液(6mmol/l):称取feso4晶体0.0456g,用水定容于50ml容量瓶中,配置成6mmol/l溶液,待用。h2o2(30%):取30%h2o213.6μl定容于50ml容量瓶中,配置成2.4mmol/l溶液,待用。水杨酸-乙醇溶液(6mmol/l):称取水杨酸固体0.0414g,用无水乙醇定容于用锡纸包裹的50ml容量瓶中,配置成6mmol/l溶液,待用。2.2.1.3羟基自由基的测定ao值的测定:在试管中加入2ml水,再加入6mmol/lfeso4溶液2ml,2.4mmol/lh2o2溶液2ml,摇匀,室温下静止10min,之后,加入6mmol/l水杨酸-乙醇溶液2ml,37℃水浴30min,离心(3000r/min,10min),弃去上清液,500nm测定其吸光度。ai值的测定:在试管中分别加入0.5、0.4、0.1、0.08、0.05mg/mlaf溶液2ml,再加入6mmol/lfeso4溶液2ml,2.4mmol/lh2o2溶液2ml,摇匀,室温下静止10min,之后,加入6mmol/l水杨酸-乙醇溶液2ml,37℃水浴30min,离心(3000r/min,10min),弃去上清液,500nm测定其吸光度。aj值的测定:在试管中分别加入0.5、0.4、0.1、0.08、0.05mg/mlaf溶液2ml,再加入6mmol/lfeso4溶液2ml,2.4mmol/lh2o2溶液2ml,摇匀,室温下静止10min,之后,37℃水浴30min,离心(3000r/min,10min),弃去上清液,500nm测定其吸光度。2.2.2af对超氧阴离子自由基的清除作用2.2.2.1超氧阴离子自由基生成体系本试验采用邻苯三酚自氧化法测定af对o2•-自由基的清除能力。邻苯三酚在碱性条件下自氧化,生成超氧阴离子自由基o2•-与自氧化中间产物,该产物在420nm处有吸收峰,其自氧化过程为:第一步,邻苯三酚自氧化成半醌自由基;第二步,氧化成醌,在此过程中伴随超氧自由基的生成。如果af抗氧化能力较强,则邻苯三酚自氧化过程将受到阻碍,o2•-自由基的生成就会受到抑制,吸收峰减弱,以吸光度值来测定样品清除o2•-自由基的能力。清除率计算公式如下:e(o2•-)/%=1-(ai-aj)×100%aoe为超氧阴离子自由基的清除率;ao为空白对照管吸光度;ai为反应液吸光度;aj为未加邻苯三酚自身的吸光度。2.2.2.2溶液的配制邻苯三酚溶液(25mmol/l):称取邻苯三酚晶体0.158g,用水定容于50ml容量瓶中,配置成25mmol/l溶液,待用。盐酸(80mmol/l):吸量管吸取2ml盐酸,定容于25ml容量瓶中,配置成80mmol/l盐酸溶液,待用。磷酸盐缓冲液(ph=8,0.05mol/l):称取磷酸氢二钠7.164g,用水定容于100ml容量瓶中,充分溶解;称取磷酸二氢钠3.121g,用水定容于100ml容量瓶中,充分溶解;分别吸取磷酸氢二钠水溶液22.88ml,磷酸二氢钠水溶液2.125ml于100ml容量瓶中,定容,充分混匀,配置成ph=8,0.05mol/l磷酸盐缓冲液,待用。2.2.2.3超氧阴离子的测定ao值的测定:在试管中加入ph=8,0.05mol/l磷酸盐缓冲液4.5ml,于25℃水浴中加热20min,之后,加入1ml水和25mmol/l邻苯三酚溶液,混匀后,25℃反应10min,加入80mmol/l盐酸溶液1ml终止反应,摇匀,反应3min,在420nm处测其吸光度。ai值的测定:在试管中加入ph=8,0.05mol/l磷酸盐缓冲液4.5ml,于25℃水浴中加热20min,之后,分别加入0.5、0.4、0.1、0.08、0.05mg/mlaf样品溶液1ml和25mmol/l邻苯三酚溶液,混匀后,25℃反应10min,加入80mmol/l盐酸溶液1ml终止反应,摇匀,反应3min,在420nm处测其吸光度。aj值的测定:在试管中加入ph=8,0.05mol/l磷酸盐缓冲液4.5ml,于25℃水浴中加热20min,之后,分别加入0.5、0.4、0.1、0.08、0.05mg/mlaf样品溶液1ml,混匀后,25℃反应10min,加入80mmol/l盐酸溶液1ml终止反应,摇匀,反应3min,在420nm处测其吸光度。2.3结果2.3.1af对羟基自由基清除能力实验结果显示,随着af样品质量浓度的增加,对羟基自由基的清除能力逐渐增强,当af0.5mg/ml时,清除率达到78.14%。此次结果表明,af能够起到清除羟基自由基作用,且效果比较明显,具体数值见表4。表4af对羟基自由基清除能力af质量浓度(mg/ml)aiajai-aje(·oh)/%空白0.8370.2560.581—0.50.7820.2360.54678.140.40.8160.2460.57072.180.10.8510.2560.59569.700.080.9110.2740.63762.470.050.9790.2840.68552.492.3.2af对超氧阴离子自由基清除能力实验结果显示,随着af样品质量浓度的增加,对超氧阴离子自由基的清除能力逐渐增强,当af0.5mg/ml时,清除率达到78.94%。此次结果表明,af能够起到清除超氧阴离子自由基作用,且效果比较明显,具体数值见表5。表5af对超氧阴离子自由基清除能力af质量浓度(mg/ml)aiajai-aje(·oh)/%空白0.3140.0290.285—0.50.0900.0300.06078.940.40.1190.0330.08669.820.10.1490.0300.11958.240.080.1740.0290.14549.120.050.1890.0310.15844.562.4小结本试验的结果表明,af能较好的清除超氧阴离子和羟基自由基,且随着af浓度的增加,清除能力也在增强,当af浓度为0.5mg/ml时,羟基自由基清除率达到78.14%,超氧阴离子自由基清除率达到78.94%,表明af具有较强的抗氧化能力,其具体机制还需要进一步研究。实验例3精氨酸单糖苷(af)对h22荷瘤小鼠肿瘤生长抑制作用3.1试验方法3.1.1造模方法取h22瘤细胞液(特产研究所提供),接种于小鼠腹腔,7-9d后,将其脱臼处死,75%酒精全面消毒,在无菌条件下抽取小鼠腹水,置于盛有生理盐水的带塞试管中,混匀,离心(1000r/min,3min),弃去上清液,并用生理盐水洗涤,重复3次,最后用生理盐水调整瘤细胞悬液细胞数为1.0×107个/ml,皮下接种于icr小鼠右前肢,0.2ml/只。3.1.2动物分组及给药小鼠接种24h后,将成功接种小鼠随机分成5组,每组10只,即模型组(m,0.9%生理盐水)、阳性对照组(p,环磷酰胺,25mg/kg)、af低剂量组(af-l,12.5mg/kg)、af中剂量组(af-m,25mg/kg)af高剂量组(af-h,50mg/kg),各组每日按10ml/kg小鼠体重给药,阳性对照组腹腔注射给药,其余各组灌胃给予相应的药物(空白对照组及模型组给予0.9%生理盐水),每天给药一次,连续给药21d。3.1.3抑瘤率测定末次给药12h后,眼球取血并脱臼处死小鼠后,一手用镊子夹住小鼠肿瘤部位皮肤,另一只手那手术剪剪开皮肤,暴露肿瘤,用手术剪沿肿瘤轮廓,剥离肿瘤,用9%生理盐水进行漂洗,滤纸吸干后称重,计算抑瘤率。抑瘤率(%)=(模型组平均瘤重-实验组平均瘤重)÷模型组平均瘤重×100%。3.1.4脏器指数末次给药12h后,眼球取血,离心机4500r分离血清,处理后的血清保存在-20℃冰箱,待用。将小鼠处死后进行系统的解剖,取出脾脏和胸腺,用9%生理盐水进行漂洗,滤纸吸干后称重,计算脾指数及胸腺指数。脏器指数=脏器重量(g)×100/体重(g)3.1.5生化指标检测3.1.5.1肝功能和肾功能指标测定通过测定血清中谷氨酸氨基转移酶(alt)和天门冬氨酸氨基转移酶(ast)、尿素氮(bun)和肌酐(cre)含量,以反映药物对肝脏、肾脏功能的影响。3.1.5.2肝组织中sod活力和mda含量的测定用黄嘌呤氧化酶法检测sod活力,用硫代巴比妥酸(tba)法检测mda含量,严格按照试剂盒说明书操作。3.1.5.3血清中tnf-α、il-2含量测定取分装好的小鼠血清,常温解冻,严格按照elisa说明书操作,点入96孔板,酶标仪测定后,进行数据处理分析。3.1.6肿瘤组织病理学检查取解剖后的肿瘤组织固定于10%甲醛固定液中,进行脱水、透明、浸蜡,最后包埋。用切片机将包埋后的肿瘤组织切成4~5μm,然后进行展片、捞片、烘片,将处理好的切片,经h&e染色法染色后,在显微镜下观察组织的结构及细胞的形态,最后进行分析比对。3.1.7统计学分析采用spss17.0应用软件进行分析,数据以平均值±标准差(±s)表示。多组间比较采用单因素方差分析法,以p<0.05表示差异有统计学意义。3.2实验结果3.2.1af对h22荷瘤小鼠的抑瘤作用如表6所示,af-l、af-m剂量组对肿瘤起到一定得抑制作用,与模型组比较,存在极显著差异(p<0.01),但抑瘤率低于阳性对照组。af-h组与模型组无显著性差异。af给药的三个剂量足,进行比较,af-l组抑瘤效果最好,抑瘤率达到47.65%。表6af对h22荷瘤小鼠的抑瘤作用(±s,n=10)groupsdosage(mg/kg)tumorweight(g)inhibitoryrate(%)model—1.82—positive250.85**53.37af-l12.50.95**47.65af-m251.24**31.81af-h501.679.08*p<0.05,**p<0.01,vs.modelgroup3.2.2af对h22荷瘤小鼠免疫器官的影响如表7所示,af对小鼠的胸腺指数与肾脏指数均可不同程度的提高。与空白对照组比较,模型组与阳性对照组均存在显著性差异(p<0.01),af-h组胸腺指数存在显著性差异(p<0.05)。与模型组比较,af-l、af-m、af-h剂量组均存在极显著性差异(p<0.01)。表7af对h22荷瘤小鼠免疫器官的影响(±s,n=10)groupdosage(mg/kg)spleenindex(mg/g)thymusindex(mg/g)normal—0.57±0.04**0.23±0.01**model—0.39±0.02##0.16±0.02##positive250.47±0.05**##0.19±0.02*##af-l12.50.530±0.02**0.21±0.03**af-m250.55±0.03**0.22±0.02**af-h500.54±0.05**0.20±0.01***p<0.05,**p<0.01,vs.modelgroup;#p<0.05,##p<0.01,vs.normalcontrolgroup3.2.3af对h22荷瘤小鼠细胞因子的影响如表8所示,模型组与空白对照组存在极显著性差异。与模型组比较,阳性对照组、af-l、af-m组血清中il-2含量显著上升,存在极显著性差异(p<0.01);af-h组存在显著性差异(p<0.05)。与m组比较,p、af-l、af-m、af-h组tnf-α含量显著提高,均呈现极显著性(p<0.01)。表8af对小鼠血清中细胞因子tnf-α、il-2的影响(±s,n=10)groupsdosage(mg/kg)il-2(pg/ml)tnf-α(pg/ml)normal—71.08±10.76148.21±28.03model—39.27±5.95##110.39±16.45##positive2565.56±7.23**174.05±41.35**af-l12.556.53±6.68**161.29±21.55**af-m2580.17±5.64**145.82±25.35**af-h5051.21±7.28*144.61±16.26***p<0.05,**p<0.01,vs.modelgroup;#p<0.05,##p<0.01,vs.normalcontrolgroup3.2.4af对h22荷瘤小鼠肝肾功能的影响与空白对照组比较,模型组cre、bun含量均存在极显著性差异(p<0.01)。与模型组比较,阳性对照组cre含量存在显著性差异(p<0.05);af-l、af-m组cre含量存在极显著性差异(p<0.01);af-h组与模型组无明显差别。血清中bun含量,与模型组相比,阳性对照组、af-l组均呈现极显著性差异(p<0.01);af-m、af-h组存在显著性差异(p<0.05)。af各剂量组均能显著降低血清中alt、ast含量。模型组与空白对照组存在极显著性差异(p<0.01);与模型组比较,阳性对照组、af-l、af-m、af-h组血清中alt含量均存在极显著性差异;阳性对照组、af-l、af-h组血清中ast含量存在极显著性差异(p<0.01),af-m组存在显著性差异(p<0.05),如表9所示。表9af对h22荷瘤小鼠肝肾功能的影响(±s,n=10)*p<0.05,**p<0.01,vs.modelgroup;#p<0.05,##p<0.01,vs.normalcontrolgroup3.2.5af对h22荷瘤小鼠sod和mda含量的影响如表10所示,模型组与空白对照组存在极显著性差异。与模型组比较,给药组小鼠肝脏组织中sod含量均显著提高,阳性对照组、af-l、af-m、af-h组均存在显著性差异(p<0.01)。与模型组比较,阳性对照组、af-l、af-m肝脏组织中mda含量明显升高(p<0.01),af-h组与模型组无明显差异。表10af对h22荷瘤小鼠sod和mda含量的影响(±s,n=10)groupsdosag(mg/kg)sod(u/mgprot)mda(nmol/mgprot)normal—216.95±17.5710.06±2.08model—124.78±15.06##14.88±0.92##positive25210.98±15.64**10.79±2.06**af-l12.5251.26±30.88**8.17±2.24**af-m25166.70±29.47**8.79±2.43**af-h50163.24±34.17**13.70±1.85*p<0.05,**p<0.01,vs.modelgroup;#p<0.05,##p<0.01,vs.normalcontrolgroup3.3小结与讨论h22肿瘤细胞株,接种率较高,接种成功后肿瘤完整,且不易发生转移,方便对肿瘤生长的直观观察、肿瘤体积及重量的测量等特点。目前,国内外肿瘤试验研究中,大多以h22肿瘤细胞株为模型。本试验以h22荷瘤小鼠为试验模型,研究af抗肿瘤活性,结果表明,af-l组作用比较明显,抑瘤率达到47.65%,低于环磷酰胺阳性对照组抑制率(53.37%),但两者不存在显著性差异。肿瘤的发生与免疫系统也存在较大的联系,二者相辅相成。肿瘤的发展、转移、浸润、恶化等都伴随着免疫功能的下降[8]。所以在肿瘤治疗的过程中,如何提高机体自身的抗肿瘤免疫活性引起了广泛的探究[9-10]。机体的两个重要免疫器官,胸腺和脾脏,其脏器指数经常被用于评价免疫活性的高低[11]。本文结果显示,af-l、af-m、af-h组胸腺指数与脾脏指数显著高于模型对照组,并存在显著性差异(p<0.01),由此说明,af能够延缓荷瘤小鼠免疫器官衰退。il-2、tnf-α在抗荷瘤小鼠免疫中起着至关重要的作用。il-2是t细胞生长所必须的生长因子,同时能够上调b细胞、nk细胞、巨噬细胞等的免疫功能,还可以刺激tnf、干扰素等其他的细胞因子的分泌[12]。tnf-α是目前国内外发现的活性最强的抗肿瘤细胞因子[13],它是由活化的单核巨噬细胞产生的,可直接溶解肿瘤,还可抵抗微生物入侵和调节机体免疫的功能。本试验研究显示,af-l、af-m组均可提高小鼠血清中il-2、tnf-α含量,与模型组均存在极显著性差异,即可说明,af-l、af-m组可增强荷瘤小鼠的机体免疫功能,从而抑制肿瘤的生长。谷丙转氨酶(alt)和谷草转氨酶(ast)主要富集肝脏组织中,所以肝脏组织受到损伤或严重坏死时,alt和ast大量外泄至血清中,故血清中二者含量显著升高,所以,经常以血清中alt、ast含量高低来监测肝脏是否损伤或坏死的重要指标。本试验中,给药组血清中alt、ast含量均低于模型组,并存在显著性差异,与空白对照组无明显变化,说明af对小鼠肝脏无损伤。bun、cre是临床上常用的检测肾脏功能的主要指标之一。当肾小球滤过率下降到正常的50%以下时,bun浓度迅速升高。当患有急、慢性肾小球肾炎等疾病时,使肾小球滤过功能减退,cre升高。此次试验,血清中bun、cre含量均显著低于模型组(p<0.01),与空白对照组无显著性差异,说明af对荷瘤小鼠肾脏功能无损伤。自由基与肿瘤的发生、发展存在一定的关系[14-15]。sod是一种抗氧化酶,是抗氧化的第一道防线,可以将超阳阴离子歧化为h2o2,而mda含量的变化可间接地反应组织中氧自由基含量的变化。因此可通过测定sod、mda含量来反映机体抗氧化的能力[16]。试验结果显示,af可以显著提高sod的值(p<0.01),af-l、af-m组可显著降低mda的值(p<0.01),说明af可提高机体的抗氧化能力,清除体内自由基。综上所述,af具有一定得抗肿瘤效果,尤其是af低剂量组,表现的最为明显,它能够明显抑制肿瘤的生长,且可提高机体免疫活性。但肿瘤的彻底治疗,是一项长期过程,还有待进一步探索研究。实验例4精氨酸单糖苷(af)对免疫抑制小鼠免疫功能的影响4.1实验方法4.1.1动物分组与剂量100只icr小鼠,适应性饲养一周后,随机分成5组,每组20只,即正常对照组(n),免疫抑制模型组(m),免疫抑制af低剂量组(m-l,20mg/kg),免疫抑制af中剂量组(m-m,40mg/kg),免疫抑制af高剂量组(m-h,80mg/kg)。各组每日按10ml/kg体重给小鼠灌胃给药,每天给药一次,连续给药28d。m、m-l、m-m及m-h组,每周前三天,腹腔注射环磷酰胺(ctx,80mg/kg),形成免疫抑制。4.1.2小鼠免疫器官脏器指数测定末次给药12h后,眼球取血,离心机4500r分离血清,处理后的血清保存在-20℃冰箱,待用。将小鼠处死后进行系统的解剖,取出脾脏和胸腺,用9%生理盐水进行漂洗,滤纸吸干后称重,计算脾指数及胸腺指数。脏器指数=脏器重量(g)×100/体重(g)4.1.3体外脾淋巴细胞转化试验给药第21d后,每组随机抽取10只小鼠,脱臼处死,置75%酒精中浸泡5min,无菌取脾脏,加入rpmi-1640,300目钢网研磨,吸取脾细胞悬液于1.5ml离心管中,离心10min(15000rpm,4℃),弃上清液。于上述离心管中加入acklysisbuffer,再次离心10min(15000rpm,4℃),弃上清液。再加入rpmi-1640,细胞计数,配成2×106/ml脾细胞悬液。试验分为三组,第一组为对照组即脾淋巴自然转化组;第二组加入cona(5μg/ml,100μl),刺激t细胞转化;第三组加入lps(10μg/ml,100μl),刺激b细胞转化。将各组细胞依次加到96孔板中,每孔加入100μl脾细胞悬液,每孔设立3个复孔。细胞培养条件为:5%co2培养箱,37℃,48h。培养48h后,每孔内加入mtt(5mg/ml)20μl,继续培养4h后,离心(2000rpm,10min),吸取上清液,加入150μl的dmso充分溶解紫色结晶,酶标仪490nm条件下,测定各孔od值。4.1.4血清tnf-α、il-2含量测定取分装好的小鼠血清,常温解冻,严格按照elisa说明书操作,点入96孔板,酶标仪测定后,进行数据处理分析。4.1.5特异性igg抗体的检测取分装好的小鼠血清,常温解冻,elisa法测定小鼠特异性igg抗体水平。4.1.6荧光定量rt-pcr测定4.1.6.1组织中rna提取取出各组小鼠保存在液氮中的脾脏组织,在depc水处理后的研钵中充分研磨至粉末状。加1mltrizol于1.5ml离心管中,再加入少许脾脏粉末,振荡器充分混匀后,静置5min。加200μl氯仿于上述离心管中,盖紧,用手颠倒混匀后,室温放置10min,12000g离心15min(4℃离心机内)。④吸出上清液于新的1.5ml离心管中,加500μl异丙醇,混匀,室温静置10min后,12000g离心10min(4℃离心机内),保留沉淀。⑤加75%冷乙醇1ml于上述沉淀离心管中,充分洗涤沉淀,7500g离心5min(4℃离心机内),弃上清。⑥室温干燥rna至半透明状。⑦向离心管中加20μldnase/rnase-freedeionizedwater溶解沉淀,-80℃冻存。rna提取图,见附图11。4.1.6.2反转录合成cdnatnf-α、il-2的基因序列从数据库ncbi获得,参照查询的基因序列使用primer5.0软件设计tnf-α、il-2定量引物,反转录引物使用试剂盒中的随机引物,荧光定量引物序列见表11。表11荧光定量引物序列按照东洋纺试剂盒说明书步骤,进行反转录试验,得到cdna产物,于-80℃保存。反转录加样体系见表12。表12反转录加样体系试剂加样量totalrna7μl(1ug)primermix0.5μlrtenzymemix0.5μl5×rtbuffer2μltotal10μl4.1.6.3实时荧光定量反应以gapdh为内参引物,采用荧光染料sybr-greeni检测tnf-α、il-2在小鼠脾脏组织中相对表达量,每个样品三个重复。扩增反应条件如下:95℃预变性5min;95℃反应10秒,60℃反应30秒,40个循环。反应结束后,记录溶解曲线和扩增曲线,每孔样本的ct值,使用2-△△ct方法计算。反应体系见表13。表13rt-pcr反应体系4.1.7统计学处理采用spss17.0应用软件进行分析,数据以平均值±标准差(±s)表示。多组间比较采用单因素方差分析法,以p<0.05表示差异有统计学意义。4.2实验结果4.2.1af对小鼠免疫器官脏器指数的影响与m组比较,n、m-l、m-m组胸腺指数、脾脏指数均存在显著性差异(p<0.01),m-h组无明显变化,如表14所示。表14af对小鼠免疫器官脏器指数的影响note:*p<0.05,**p<0.01,comparedwithmodel4.2.2af对脾淋巴细胞转化的影响与m组比较,m-l、m-m组脾淋巴细胞转化率明显增高,且m-l组呈现极显著性,如附图12所示。4.2.3af对小鼠血清中细胞因子tnf-α、il-2的影响如附图13所示,与m组比较,n组血清中tnf-α含量显著上升(p<0.01),呈极显著性,m-l、m-m组血清中tnf-α含量升高(p<0.05),m-h组tnf-α含量与m组无明显差异。与m组相比,m、m-l组血清中il-2含量明显升高(p<0.01),m-m组il-2含量升高(p<0.05),m-h组il-2含量与m组无显著性差异。4.2.4af对小鼠特异性igg抗体的影响结果显示,m、m-l、m-m组小鼠获得的免疫应答良好,与m组小鼠比较,抗体水平极显著性提高(p<0.01),m-h组无明显变化,见附图14。4.2.5af对小鼠脾脏组织中tnf-α、il-2mrna表达的影响荧光定量pcr结果显示,tnf-α、il-2熔解曲线为单一峰,扩增曲线均为典型s型,基线平整。m-l组tnf-α、il-2mrna表达分别为7.73±0.16、10.63±0.34,m-m组tnf-α、il-2mrna表达分别为2.6±0.03,5.43±0.23,显著高于m组(1.83±0.72、2.45±0.02)(p<0.01、p<0.05),见附图15。4.3讨论本研究显示,icr小鼠给药28d后,显著提高了免疫抑制小鼠脾脏及胸腺指数;m-l组脾淋巴细胞转换率较m组显著提高;m-l、m-m组小鼠特异性igg抗体明显高于m组;免疫抑制小鼠血清中,肿瘤坏死因子tnf-α及白细胞介素-2il-2的含量显著提高。且通过实时荧光定量pcr检测,tnf-α及il-2mrna水平明显增高。本试验以体内给药研究方式结合实时荧光定量pcr等体外试验进行研究,结果表明,af可减轻ctx造成的免疫器官萎缩现象。从免疫应答来看,本试验中免疫抑制af低剂量组、免疫抑制af中剂量组小鼠特异性igg抗体水平明显高于免疫抑制模型组小鼠,陈勃[17],guy等[18]研究表明,特异性igg抗体是血清主要的抗体成分,可清除有害补体片段,抑制炎症反应在机体免疫中起保护作用。本研究的igg水平表明,af能提高免疫抑制小鼠免疫应答能力。刘佳等[19],赵定亮等[20]报道,il-2能促进t、b淋巴细胞的增值与分化,可诱导杀伤细胞(lak)的产生。可以增强机体免疫监视功能。谭兵等[21],李卫等[22]报道,tnf-α能够抵抗微生物入侵和调节机体免疫的功能。此次试验,用elisa试剂法,检测出af免疫抑制组小鼠血清中il-2、tnf-α含量显著提高。同时,采用荧光定量pcr,检测tnf-α及il-2mrna水平。以上试验结果表明,af具有较强的免疫增强能力,能拮抗ctx免疫功能低下小鼠的免疫抑制作用。但本次试验,只是免疫研究中的一部分,应进一步探讨研究,以充分证实试验结果。附图说明图1反应时间对af合成率的影响图2反应温度对af合成率的影响图3料液比对af合成率的影响图4苹果酸加入量对af合成率的影响图5.反应温度与反应时间交互作用af合成率的影响图6.反应温度与料液比交互作用af合成率的影响图7.反应温度与苹果酸加入量交互作用af合成率的影响图8.反应时间与料液比交互作用af合成率的影响图9反应时间与苹果酸加入量交互作用af合成率的影响图10.料液比与苹果酸加入量交互作用af合成率的影响图11.rna提取结果图图12.af对脾淋巴细胞转化率的影响图13.af对小鼠血清中tnf-α、il-α含量的影响图14.af对小鼠血清中igg含量的影响图15.af对小鼠脾脏组织中tnf-α、il-2mrna表达的影响。具体实施方案实施例1精确称取精氨酸:葡萄糖=1g:1g,加入丙三醇10ml和柠檬酸0.1g,摇床160rpm混匀,85℃条件下反应120min,柱前衍生高效液相检测af含量,合成率为55.52%。实施例2精确称取精氨酸:果糖=1g:1g,加入丙三醇10ml和柠檬酸0.1g,摇床160rpm混匀,85℃条件下反应120min,柱前衍生高效液相检测af含量,合成率为58.52%。实施例3精确称取精氨酸:果糖:木糖=1g:0.5g:0.5g,加入丙三醇10ml和柠檬酸0.1,摇床160rpm混匀,85℃条件下反应180min,柱前衍生高效液相检测af含量,合成率为60.52%。实施例4精确称取精氨酸:木糖=1g:1g,加入丙三醇10ml和柠檬酸0.1g,摇床160rpm混匀,85℃条件下反应120min,柱前衍生高效液相检测af含量,合成率为65.52%。实施例5精确称取精氨酸:木糖=1g:1g,加入丙二醇10ml和维生素c0.1g,摇床160rpm混匀,85℃条件下反应120min,柱前衍生高效液相检测af含量,合成率为45.52%。实施例6精确称取精氨酸:木糖=1g:1g,加入异丙醇10ml和维生素c0.1g,亚硫酸钠0.05g摇床160rpm混匀,85℃条件下反应120min,柱前衍生高效液相检测af含量,合成率为45.52%。实施例7精确称取l-精氨酸:d-精氨酸:木糖=0.5g:0.5g:1g,加入异丙醇10ml和维生素c0.1g,亚硫酸钠0.05g摇床160rpm混匀,85℃条件下反应120min,柱前衍生高效液相检测af含量,合成率为65.52%。实施例8抗衰老口服液取实施例1纯化后的af粉末,配制成35mg/ml的水溶液,灭菌后装入玻璃瓶中,制成每支10ml的口服液。其他要求符合《中华人民共和国药典》2010版有关口服液的相关规定。实施例9美容护肤水取实施例1中纯化的af粉末,加入护肤水基质液中,af最终加入浓度为100mg/100ml。其他要求符合中国化妆品生产要求规范。参考文献[1]takaku,t.,han,l.k.,kamedak.,etal.productionofarginyl-frictosylglucoseduringprocessingofredginseng.j.tradit.med.1996,13,118-123.[2]suzuki,y.,choi,k.j.,uchida,k.,etal.arginyl-fructosyl-glucoseandarginyl-fructose,compoundsrelatedtobrowningreactioninthemodelsystemofsteamingandheat-dryingprocessesforthepreparationofredginseng.j.ginsengres.2004,28,143-148.[3]赵婷.人工合成l-精氨酸单糖苷(af)及其抗糖尿病药理活性研究[d].长春:吉林农业大学,2013.[4]kwang-hyounglee,kyoung-sooha,sung-hoonjo,etal.effectoflong-termdietaryarginyl-fru-ctose(af)onhyperglycemiaandhba1cindiabeticdb/dbmice.j.mol.sci.2014,15,8352-8359.[5]cho,e.j.;piao,x.l.;jang,m.h.etal.theeffectofsteamingonthefreeaminoacidcontentsandantioxidantactivityofpanaxginseng.j.foodchem.2008,107:876–882.[6]bylee,jung-sook;kim,gyo-nam;lee,sang-hyun,etal.invitroandcellularantioxidantactivityofarginyl-fructoseandarginyl-fructosyl-glucose.j.foodscienceandbiotechnology2009,18(6),1505-1510.[7]keum,y.s;park,k.k;lee,j.m.,etal.antioxidantandanti-tumorpromotingactivitiesofthemethanolextractofheat-processedginseng.j.cancerlett.2000,150,41-48.[8]程荔春,范青.主动靶向脂质体在抗肿瘤治疗中的研究进展[j].实用药物与临床,2011,14(5):426-429.[9]danzhang,yuhongsun,maoli,qinsun,minghualiu.effectsofperiplanetaamericanapolypeptideextractsontumorgrowthandimmunefunctionintumor-bearingmice[j].chinesejournalofnewdrugs,2015,24(6):681-686.[10]xinruiyang,gangwang,libinji,haiyanwang.effectsofarenariakansuensisaqueousextractonimmunefunctionofh22tumor-bearingmice[j].cancerresprevtreat,2015,42(7):662-665.[11]xiongq,jiaoy,zhaox,etal.purification,characterizationandimmunostimul-atoryactivityofpolysaccharidefromcipangopaludinachinensis[j].carbohydratepolymers,2013,98(1):217-223.[12]唐燕,张丹,孟祥林,等.白芍总苷脂质体对荷瘤小鼠肿瘤生长及免疫功能的影响[j].中国新药杂志,2014,23(21):2547-2551.[13]李墨林,李传刚,舒晓宏.美法仑治愈荷瘤小鼠的过程与tnf-α的关系[j].细胞与分子免疫学杂志,2007,23(4):320.[14]jakharr,pauls,pardyr,elal.3,5,7,3’,4’-pentamethoxyflavone,aquercetinderivativeprotectsdnafromoxidativechallenges:potentialmechanismofaction[j].photochemphotobiolb,2014,131:96-103.[15]fuhuali,dongliu,jianming.cellularantioxidantandantiproliferativeactivitiesofflavonoidsextractedfromtartarybuckwheat(fagopyrumtartaricum(l.)gaertn)bran[j].foodscience,2014.35(7):58-63.[16]esterbauerh,schaurrj,zolnerh.chemistryandbiochemistryof4-hydroxynonenal,malonaldehydeandrelatedaldehydes[j].freeradicbiolmed,1991,11(1):81-128.[17]陈勃.h-igg对新生大鼠脑缺血缺氧性损伤的保护作用及机制研究[d].长春:吉林大学,2013,16-22.[18]guyb,hesslerc,fourages,etal.systemicimmunizationwithureaseprotectsmiceagainsthelicobacterpyloriinfectionj.vaccine,1998,16(8):850-856.[19]刘佳,单安山,孙进华.白细胞介素-2的研究进展与应用[j].黑龙江畜牧兽医,2009(21):57-61.[20]赵定亮,单风平.细胞介素-2最新研究进展[j].微生物学杂志,2013,5(4):77-79.[21]谭兵,李瑜元,聂玉强.肿瘤坏死因子-α的研究进展[j].国际内科学杂志,2007,5(3):129-133.[22]李卫,刘佳,白家媛.α肿瘤坏死因子的研究进展[j].动物医学进展,2010,6(12):12-14。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1