埃兹蛋白衍生肽及其药物组合物的制作方法
本发明涉及医药领域,具体地,涉及化学和制药工业并且涉及埃兹蛋白(ezrin)衍生肽,具体地,一种含有如通式(I)X1EKKRRETVERE X2X3所示的氨基酸序列的肽,其中,每个X各自表示非极性氨基酸残基。所述肽作为免疫刺激剂的应用,并且更具体地,用于治疗和预防抗病毒、抗细菌和抗真菌感染,以及胃肠道疾病的治疗,特别是胃肠道的溃疡性病变。本发明还涉及含有所述肽的药物组合物。进一步地,本发明涉及感染和胃肠道的溃疡性疾病的治疗方法,该方法包括将所述肽给药至有需要的患者。
背景技术:
埃兹蛋白(Ezrin),也被称为细胞绒毛蛋白(cytovillin)或绒毛蛋白-2(villin-2),是人体内由EZR基因编码的蛋白。众所周知,由埃兹蛋白衍生的肽具有生物活性。与本发明的肽最接近的类似物为药用十四肽NH2_Thr-Glu-Lys-Lys-Arg-Arg-Glu-Thr-Val-Glu-Arg-Glu-Lys-Glu_COOH,其含有14个氨基酸残基,被称为HEP-1肽或人埃兹蛋白肽1(SEQ ID No.2:TEKKRRETVEREKE)并且被开发用于HIV感染的治疗[R.D.Holms,AIDS prophylactics.PCT/GB95/001285,02.06.95,WO 95/33768],进一步地,用于广泛治疗细菌、真菌和病毒感染。
冻干药物产品(销售授权号:РN000015/01-010911),含有约96%的HEP-1肽,其在俄罗斯联邦被广泛地用于医药建议(Kladova,O.V.,Kharlamova,F.S.,Shcherbakova,A.A.,Legkova,T.P,Feldfix,L.I.,Znamenskaya,A.A.,Ovchinnikova,G.S.,Uchaikin,V.F.The first experience of Hepon intranasal application in children with respiratory infections.//Pediatrics,2002,No.2,pp. 86-88),(Polyakova T.O.,Magomedov,M.M.,Artemyev,M.E.,Surikov,E.V.,Palchun,V.T.A new approach in the treatment of chronic diseases of the pharynx//Attending Doctor,2002,No.4,pp.64-65),(Novokshonov,A.A.,Uchaikin,V.F.,Sokolova,N.V.,Tikhonova,O.N.,Portnykh,O.Yu.Biocenosis-protecting therapy of intestinal infections in children.//Russian Medical Journal,special supplement“Diseases of the Digestive System”,2004,volume 6,No.1),(Parfenov,A.I.The activator of the local immunity Hepon in the complex treatment of dysbiotic disorders of the intestine.//Experimental and Clinical Gastroenterology,2003,№3,pp.66-69),.(Tishchenko,A.L.A new approach in the treatment of recurrent urogenital candidiasis.//Attending Doctor,2002,No.3,pp.46-47),(Telunts,A.V.Treatment of candidiasis in infants.//Questions of Gynecology,Obstetrics,and Perinatology,2004,vol.3,No.4,pp.89-90),(Ataullakhanov,R.I.,Holms,R.D.,Katlinsky,A.V.,Pichugin A.V.,Papuashvili,M.N.,Shishkova,N.M.Treatment with Hepon immunomodulator increases the efficacy of the immune control of opportunistic infections in HIV-infected patients.//Allergy,Asthma,and Clinical Immunology,2002,No.10,pp.3-11),(Cherednichenko,T.V.,Uchaikin,V.F.,Chaplygina,G.V.,Kurbanova,G.M.A new efficient treatment of viral hepatitis.//Attending Doctor,2003,No.3,pp.82-83),(Gorbarets,I.P.,Voronkova,N.V.,Lopatina,T.V.,Ivanovskaya,V.N.,Braginsky,D.M.,Blokhina,N.P.,Malyshev,N.A.The combined use of Hepon drug product and recombinant interferon-alpha in the patients with chronic hepatitis C increases the efficiency of antiviral treatment and reduces side effects of the therapy.//Hepatology,2003,No.4,pp.23-28),(Lazebnik,L.B.,Zvenigorodskaya,L.A.,Firsakova,V.Yu.,Pichugin,A.V.,Ataullakhanov,R.I.The application of Hepon immunomodulator in the treatment of erosive ulcerous lesions of gastroduodenal zone.//Experimental and Clinical Gastroenterology,2003,No.3,pp.17-20),(Malakhova,N.S.,Pichugin,A.V.,Khalif,I.L.,Ataullakhanov,R.I.The application of Hepon immunomodulator for the treatment of nonspecific ulcerative colitis.//Farmateka,2005,No.6[101],pp.105-108),Dudchenko,M.A.,Lysenko,B.F.,Chelishvili,A.L.,Katlinsky,A.V.,Ataullakhanov,R.R.Complex treatment of trophic ulcers.//Attending Doctor,2002,No.10,pp.72-75),(Bardychev,M.S.Treatment of local radiation injuries with the activator of local immunity.//Russian Medical Journal,2003,volume 11,No.11(183),pp.646-647),Salamov G.,R.Holms,W.Bessler,R.Ataullakhanov.Treatment of hepatitis C virus infection with human ezrin peptide one(HEP1)in HIV infected patients.//Arzneimittel-Forschung(Drug Research)2007;57(7):497–504]。
HEP-1具有抗丙型肝炎病毒生物活性并且可以被用于丙型肝炎患者的治疗[R.D.Holms,R.I.Ataullakhanov.HCV combination therapy.PCT/GB2004/000330,27.01.2004,WO 2004067024A2]。
HEP-1具有抗溃疡生物活性并且可以被用于胃肠道溃疡性疾病的治疗[R.D.Holms,R.I.Ataullakhanov.The use of peptides in anti-ulcer therapy.PCT/GB2006/004390,23.11.2006,WO/2007/060440]。
技术实现要素:
本发明的发明人已经研发出一种新型肽,该肽通过合成进行制备并且具有高免疫刺激活性。如生物学实验所示,本发明描述的肽及其药物组合物具有高免疫刺激活性,且超过了HEP-1肽(其为药物产品的主要成分)的活性。
在本发明的第一方面,提供了一种含有如通式(I)X1EKKRRETVEREX2X3所示的氨基酸序列的肽,其中,X1、X2和X3各自表示非极性氨基酸残基(SEQ ID No:5)。
非极性氨基酸残基可以独立地选自由甘氨酸、丙氨酸、缬氨酸、亮氨酸、蛋氨酸、异亮氨酸、脯氨酸、苯丙氨酸和色氨酸所组成的组中,和/或它们的组合。
在一些实施方式中,X1、X2和/或X3可以独立地选自具有小R基团的非极性氨基酸,特别是甘氨酸、丙氨酸和/或缬氨酸,和/或它们的组合。因此,在本发明的一些实施方式中,X1、X2和X3各自独立地选自由甘氨酸、丙氨酸和缬氨酸所组成的组中。
在一些实施方式中,X1、X2和/或X3可以全部为相同的氨基酸。在优选的实施方式中,X1、X2和X3中的至少一个为甘氨酸。在更优选的实施方式中,X1、X2和X3中的至少两个为甘氨酸。在最优选的实施方式中,X1、X2和X3各自为甘氨酸。在一种实施方式中,所述肽含有如通式(I)X1EKKRRETVERE X2X3所示的氨基酸序列,其中,X1、X2和X3各自是非极性的,并且,进一步地,其中,X1、X2和X3中的至少一个,或至少两个为甘氨酸。在优选的实施方式中,所述肽具有序列GEKKRRETVEREGG。
在本发明中,单字母代码已经被用于表示多种氨基酸。使用三字母和单字母代码时,氨基酸也可以按如下方式表示:甘氨酸(G或Gly),丙氨酸(A或Ala),缬氨酸(V或Val),亮氨酸(L或Leu),异亮氨酸(I或Ile),脯氨酸(P或Pro),苯丙氨酸(F或Phe),酪氨酸(Y或Tyr),色氨酸(W或Trp),赖氨酸(K或Lys),精氨酸(R或Arg),组氨酸(H或His),天冬氨酸(D或Asp),谷氨酸(E或Glu),天冬酰胺(N或Asn),谷氨酰胺(Q或Gln),半胱氨酸(C或Cys),甲硫氨酸(M或Met),丝氨酸(S或Ser)和苏氨酸(T或Thr)。在残基可能为天冬氨酸或天冬酰胺之处,可以使用符号Asx或B。在残基可能是谷氨酸或谷氨酰胺之处,可以使用符号Glx或Z。除非上下文另有规定,天冬氨酸的指代(references)包括天冬氨酸盐,并且谷氨酸的指代包括谷氨酸盐。
术语肽可以包括含有本文公开的氨基酸序列的组合物。例如,肽可以被修饰(例如在C或N末端)以防止其降解或者提高它们的生物利用度和/或生物相容性,因为这被本领域技术人员认为是合适的或有必要的。值得注意 的是,涉及“本发明的肽”的特征同样适用于通式中特定的氨基酸序列。
本发明的肽可以是任意长度的,其提供含有如通式(I)X1EKKRRETVEREX2X3的氨基酸序列,其中,X各自表示如本文所述的非极性氨基酸残基。
在一些实施方式中,所述肽的长度为14至25个残基,例如,长度为14至20个残基,或者长度为14至18个残基,并且含有如通式(I)所示的氨基酸序列(或者其进一步定义的实施方式)。在一些实施方式中,所述肽的长度为14、15、16、17、18、19、20、21、22、23、24或25个残基并且含有如通式(I)所示的氨基酸序列(或者其进一步定义的实施方式)。在进一步的实施方式中,所述肽的长度为14至25个残基,例如,长度为14至20个残基,或者长度为14至18个残基并且含有如SEQ ID No:1(GEKKRRETVEREGG)所示的序列。在一些实施方式中,所述肽的长度为14、15、16、17、18、19、20、21、22、23、24或25个残基并且含有如SEQ ID No:1(GEKKRRETVEREGG)所示的序列。在一种实施方式中,所述肽的长度在14至18个残基之间并且含有如通式(I)X1EKKRRETVERE X2X3所示的氨基酸序列,其中,X1、X2和X3各自为非极性的,并且,进一步地,其中X1、X2和X3中的至少两个为甘氨酸。在优选的实施方式中,本发明的肽的长度至少为14个氨基酸并且含有SEQ ID No:1(GEKKRRETVEREGG)。
优选地,本发明的肽的长度为14个氨基酸残基。在本发明最优选的实施方式中,所述肽具有NH2_Gly-Glu-Lys-Lys-Arg-Arg-Glu-Thr-Val-Glu-Arg-Glu-Gly-Gly_COOH(SEQ ID No.1:GEKKRRETVEREGG)(在本文中被称为HP-V2)的序列。
本发明的目的是扩大具有增强的免疫刺激活性的肽化合物的范围。此外,本发明的目的是基于要求保护的肽和已知的埃兹肽,制备具有最高免疫 刺激活性以及广泛作用的药物组合物。一般情况下,当与含有或者由SEQ ID No:2组成的肽相比时,本发明的肽具有较高的免疫刺激特性和/或较高的抗病毒活性。免疫刺激活性和抗病毒活性可以通过本领域技术人员公知的任意方法进行检测。例如,所述肽的免疫活性可以根据其对J-96细胞中细胞因子mRNA(例如:IFN-α、IL-1β和IL-6)合成的影响进行评价。抗病毒活性可以根据其对脑心肌炎病毒(ECM)的细胞毒性效应和/或根据所述肽抑制EMC病毒复制的IC50值进行测定。其它方法对于本领域技术人员来说是显而易见的。
使用含有如式(I)所示序列,如本文中讨论的其衍生物,以及更具体地含有如SEQ ID No.1:GEKKRRETVEREGG所示序列的建议的新型肽能够实现预期目的。本发明的这些肽通过合成制备并且具有高免疫刺激活性。在数据库http://research.bioinformatics.udel.edu/peptidematch/index.jsp中搜索肽序列,并且在数据库http://www.uniprot.org/blast/中搜索蛋白序列,搜索结果证实了含有14个氨基酸残基(SEQ ID No.1:GEKKRRETVEREGG)的所述肽(HP-V2)的新颖性。
如生物学实验所显示的,本发明的肽及其药物组合物具有高免疫刺激活性,超过了HEP-1肽的活性,HEP-1肽是药物产品的主要成分。
已知的埃兹肽HEP-1(SEQ ID No.2:TEKKRRETVEREKE),和两种较短的肽:在下文中被定义为HP1-5的如式NH2_Thr-Glu-Lys-Lys-Arg_COOH(SEQ ID No.3:TEKKR)所示的HP1-5肽,以及在下文中被定义为HP6-14的如式NH2_Arg-Glu-Thr-Val-Glu-Arg-Glu-Lys-Glu_COOH(SEQ ID No.4:RETVEREKE)所示的HP6-14肽,被用于和本发明的肽一起制备药物组合物。后两种肽是HEP1肽(SEQ ID No.2:TEKKRRETVEREKE)的切割产物并且具有与之前描述的序列相同的序列[R.D.Holms.Regulatory/unfolding peptides of ezrin.PCT/GB00/03566,15.09.2000,WO 01/025275]。HP1-5肽和 HP6-14肽是两种卫星肽,它们在药物产品中以杂质的形式被发现。
在一些实施方式中,本发明的肽可以与HEP-1(SEQ ID No.2:TEKKRRETVEREKE)、或者与在下文中被定义为HP1-5的如式NH2_Thr-Glu-Lys-Lys-Arg_COOH(SEQ ID No.3:TEKKR)所示的HP1-5肽,或者与在下文中被定义为HP6-14的如式NH2_Arg-Glu-Thr-Val-Glu-Arg-Glu-Lys-Glu_COOH(SEQ ID No.4:RETVEREKE)所示的HP6-14肽进行组合。
本发明的肽和本文所述的肽的组合在医学中可以是有益的,例如,用于治疗和预防病毒、细菌和真菌感染,以及用于治疗粘膜和软组织的溃疡性疾病。
在本发明的第二方面,提供了本发明的肽(例如,如通式(I)所示的肽,特别是含有如SEQ ID No:1所示的氨基酸序列的肽)在医药中的用途。具体的医药用途包括感染的治疗或预防。所述感染可以为病毒、细菌或真菌感染。本发明进一步的实施方式包括治疗或预防肠粘膜溃疡,例如,胃、大肠、十二指肠或小肠的溃疡,以及治疗或预防炎性肠疾病,包括与胃、大肠、十二指肠或小肠的溃疡相关的疾病和/或病症,和过敏性肠综合征(IBS)。还提供本发明的肽用于治疗或预防溃疡性结肠炎和克罗恩病。在优选的实施方式中,本发明的肽被用于治疗或预防下部肠道(lower gut)炎症和/或溃疡。
本发明还提供了一种肽(例如,如通式(I)所示的肽,特别是含有如SEQ ID No:1所示的氨基酸序列的肽),用于在受试者中刺激免疫应答。在本发明的一些实施方式中,所述肽可以被用于在受试者中刺激干扰素的内源性产生。所述肽还可以被用于刺激MAPK/ERK信号通路的激活。
在本发明的一些实施方式中,本发明的肽可以与HEP-1(SEQ ID No.2:TEKKRRETVEREKE)、或者与在下文中被定义为HP1-5的如式NH2_Thr-Glu-Lys-Lys-Arg_COOH(SEQ ID No.3:TEKKR)所示的HP1-5肽, 或者与在下文中被定义为HP6-14的如式NH2_Arg-Glu-Thr-Val-Glu-Arg-Glu-Lys-Glu_COOH(SEQ ID No.4:RETVEREKE)所示的HP6-14肽进行组合。例如,通式(I)所示的肽,特别是含有如SEQ ID No:1所示的氨基酸序列的肽,可以与SEQ ID No:2、3或4中的一种或多种进行组合。这种组合在本发明的医药方面是有用的,包括治疗或预防感染。所述感染可以为病毒、细菌或真菌感染。肽的组合对肠粘膜溃疡如胃、大肠、十二指肠或小肠溃疡的治疗或预防,以及炎性肠道疾病,包括与胃、大肠、十二指肠或小肠的溃疡相关的疾病和/或病症,和过敏性肠综合征(IBS)的治疗或预防也是有用的。本发明的肽还被提供用于治疗或预防溃疡性结肠炎和克罗恩病。在优选的实施方式中,本发明的肽组合被提供用于治疗或预防下部肠道炎症和/或溃疡。
本发明的实施方式进一步扩展至治疗或预防感染,胃、大肠、十二指肠或小肠的溃疡,与胃、大肠、十二指肠或小肠的溃疡相关的疾病和/或病症,和过敏性肠综合征(IBS),溃疡性结肠炎和克罗恩病的方法,该方法包括将本发明的肽(例如,通式(I)所示的肽,特别是含有如SEQ ID No:1所示的氨基酸序列的肽)给药至有需要的患者。所述感染可以为病毒、细菌或真菌感染。本发明的肽可以以治疗有效量进行给药,并且可以与一种或多种其它药物活性化合物联合给药。特别地,本发明的肽可以与SEQ ID No:2、3和/或4所示的肽中的一种或多种联合给药。
因此,还提供了本发明的肽(例如,通式(I)所示的肽,特别是含有如SEQ ID No:1所示的氨基酸序列的肽)与含有如SEQ ID No:2、3或4所示的氨基酸序列的肽的组合在医药中的用途。所述医药用途包括治疗或预防感染(如病毒、细菌或真菌感染),肠粘膜溃疡(如胃溃疡、大肠溃疡、十二指肠溃疡和小肠溃疡),或炎性肠疾病或与炎性肠疾病(如IBS、溃疡性结肠炎或克罗恩病)相关的疾病或病症。在优选的实施方式中,本发明的 肽被提供用于治疗或预防下部肠道炎症和/或溃疡。所述医药用途还包括在受试者中刺激免疫应答。
在优选的实施方式中,当本发明提供的肽与HEP-1、HP1-5或HP6-14联合使用时,加入的肽由SEQ ID No:2、3或4所示的氨基酸序列组成。
还提供了在受试者中刺激免疫应答的方法,该方法包括将治疗有效量的本发明的肽(例如,通式(I)所示的肽,特别是含有如SEQ ID No:1所示的氨基酸序列的肽)给药至有需要的患者。
在本发明的第三方面,提供了含有本发明的肽和药学上可接受的载体或填充剂的药物组合物。在本发明的一些实施方式中,所述药物组合物可以进一步含有额外的药物活性化合物。具体地,所述药物组合物可以进一步含有HEP-1(SEQ ID No.2:TEKKRRETVEREKE)、HP1-5(SEQ ID No.3:TERRK)或HP6-14(SEQ ID No.4:RETVEREKE)。
因此,在一种实施方式中,本发明提供了一种药物组合物,该药物组合物含有长度在14至18个残基之间的肽以及药学上可接受的载体或填充剂;所述肽含有具有如序列X1EKKRRETVERE X2X3所示的氨基酸序列的肽,其中,X1、X2和X3各自是非极性的,并且进一步地,其中,X1、X2和X3中的至少两个是甘氨酸。
本发明所述的药物组合物可以含有其它药学活性物质,例如,抗病毒、抗细菌、抗真菌、镇痛的和/或抗炎物质。所述药物组合物可以使用任意常规的佐剂和/或生理上可接受的稀释剂进行配制。
药物输送技术领域的技术人员常规使用的填充剂、载体、防腐剂和稳定剂可以被用作用于制备所提供的药物组合物的可接受的载体或填充剂。对于注射剂,主要使用蒸馏水或生理盐水。
所述药物组合物可以采用任意合适的途径进行给药,例如,通过口服(包括口腔或舌下)、直肠、鼻腔、局部(包括口腔、舌下或经皮)、阴道或肠胃 外(包括皮下、肌内、静脉内或皮内)给药途径。所述组合物可以通过药学领域公知的任意方法进行制备,例如,在无菌条件下,通过将活性组分与载体或辅料混合。在具体的实施方式中,含有本发明肽的本发明的药物组合物以片剂的形式用于口服给药,例如葡萄糖片剂。在一些实施方式中,所述片剂是可溶解的。
适用于口服给药的药物组合物可以以离散单位(例如,胶囊或片剂)、粉剂或颗粒剂、溶液、糖浆剂或悬浮液(在水性或非水性液体中,或者作为可食的泡沫或鞭(foams or whips),或者作为乳剂)的形式呈现。在优选的实施方式中,含有本发明肽的本发明的药物组合物为用于口服给药的片剂形式,例如,葡萄糖片剂。在一些实施方式中,所述片剂是可溶解的。
在本发明的一些实施方式中,所述肽以冻干粉或颗粒的形式提供。
用于片剂或硬明胶胶囊的合适的辅料包括乳糖、玉米淀粉或其衍生物,硬脂酸或其盐。合用于软明胶胶囊的合适的辅料包括,例如,植物油、蜡、脂肪、半固体或液体多元醇等。
对于溶液和糖浆的制备,可以使用的辅料包括,例如,水、多元醇和糖。对于悬浮液的制备,可以使用油(如植物油)用于提供水包油或油包水悬浮液。
适于经皮给药的药物组合物可以以离散贴剂的形式呈现,旨在与受体表皮保持延长时间的亲密接触。例如,通常如Pharmaceutical Research,3(6),page 318(1986)所描述的离子电渗疗法可以将活性组分从贴剂输送。
适用于局部给药的药物组合物可以被配制成软膏、乳膏、悬浮液、洗剂、粉剂、溶液、糊剂、凝胶剂、喷雾剂、气雾剂或油剂。对于眼睛或其它外部组织的感染,如口腔和皮肤,所述组合物适合以局部软膏或乳膏的形式给药。当被配制成软膏时,活性组分可以与石蜡或水可混的软膏基质一起使用。可选地,活性组分可以与水包油的乳膏基质或油包水的基质一起被配制成乳 膏。适合局部给药至眼睛的药物组合物包括滴眼液,其中,活性组分被溶解于或悬浮于合适的载体中,特别是水溶剂。适合局部给药至口腔的药物组合物包括糖锭(lozenges)、锭剂(pastilles)和漱口水。
适于直肠给药的药物组合物可以以栓剂或灌肠剂的形式呈现。
适于鼻腔给药的药物组合物,其中的载体为固体,包括具有粒径例如在20至500微米范围的粗粉。适于以鼻腔喷雾剂或鼻腔滴剂的形式给药的合适的组合物,其中的载体为液体,包括活性组分的水或油溶液。
适于吸入给药的药物组合物包括细颗粒粉剂或雾剂(mists),其可以通过各种类型的定量加压气雾器、喷雾器或吹药器产生。
适于阴道给药的药物组合物可以以阴道栓剂、棉塞、乳膏、凝胶剂、糊剂、泡沫剂或喷雾制剂的形式呈现。
适于肠胃外给药的药物组合物包括水溶性或非水溶性无菌注射溶液,其可以含有抗氧化剂、缓冲剂、抑菌剂和使得制剂基本上与计划受体的血液等渗的溶质;以及水溶性和非水溶性的无菌悬浮液,该悬浮液可以包括悬浮剂和增稠剂。可以被用于注射液的辅料,例如,包括水、醇、多元醇、甘油和植物油。所述组合物可以存在于单位剂量或多剂量容器中,例如,密封的安瓿和小瓶中,并且可以保存在冷冻干燥的(冻干的)条件下,这仅需要在使用前现加入携带的无菌液体,例如注射用水。即用型注射溶液和悬浮液可以由无菌粉末、颗粒和片剂进行制备。
所述药物组合物可以含有防腐剂、增溶剂(solubilising agent)、稳定剂、润湿剂、乳化剂、甜味剂、着色剂、增味剂(odourants)、盐(本发明的物质本身可以以药学上可接受的盐的形式提供)、缓冲液、包衣剂和抗氧化剂。除了本发明的物质以外,它们还可以含有治疗活性剂。
本发明的药物组合物的剂量可以依赖待治疗的疾病或病症,待治疗个体的年龄和病情等在较宽的范围之间变化,并且将由医生最终确定合适的使用 剂量。
这种组合物可以被配制成人用药或兽用药。本申请应该被解释为同样地适用于人以及动物,除非上下文另有明确的暗示。
在一种实施方式中,本发明提供了用于口服给药的片剂形式的药物组合物,特别是葡萄糖片剂,所述药物组合物含有长度在14至18个残基的肽以及药学上可接受的载体或填充剂,所述肽含有具有如序列X1EKKRRETVERE X2X3所示的氨基酸序列,其中,X1、X2和X3各自为非极性的,并且进一步地,其中,X1、X2和X3中的至少两个为甘氨酸。在更优选的实施方式中,所述肽具有序列GEKKRRETVEREGG。
本发明扩展至合适的药物组合物的制备方法,以及本发明的肽在制备用于医药用途的药物中的应用,用于任意本文所列举的用途。
在本发明进一步的方面,提供了编码本发明的肽的核酸序列,特别是通式I所示的肽,例如含有如SEQ ID No:1或SEQ ID No:5所示的氨基酸序列的肽。
所述核酸可以为通过克隆或化学合成法产生的DNA、cDNA或RNA,如mRNA。DNA可以是单链的或双链的。单链DNA可以是编码有义链,或者它可以是非编码链或反义链。
在本发明更进一步的方面,提供了含有本发明的核酸的载体。在本发明又进一步的方面,提供了含有本发明所述载体的宿主细胞。这种核酸、载体和宿主细胞的制备或获得方法也包括在本发明内,并且是本领域公知的。
本发明的肽可以通过肽合成化学法进行合成,例如,本发明的肽可以通过液相合成法(Combinatorial Chemistry:A Practical Approach,ed.Hicham Fenniri,Oxford University Press(2000))使用标准程序进行合成,或者通过固相合成,例如,“Fmoc”或“Bmoc”合成法进行合成(Fmoc Solid Phase Peptide Synthesis:A Practical Approach(Practical Approach S.),ed.s W.Chan&,Peter White,Oxford University Press(2000))。当采用固相合成法时,那么使用固相,例如,聚苯乙烯树脂或聚酰胺树脂,或PEG混合型聚苯乙烯树脂,或基于PEG的树脂。在合成过程中使用不同的保护基团,例如,N末端保护基团,t-Boc或FMOC保护基团。另外,也可以使用苄氧羰基(Z)基团或烯丙氧氧羰基(allyloxycarbonyl,Alloc)保护基团,或光动(photoremovable)(光刻(lithographic))保护基团,或者侧基保护技术。通过HPLC分离或者通过任意其它的纯化方法纯化肽产品。通过氨基酸分析、质谱和高效液相色谱数据确定肽结构。
在一些实例中,片段可以使用固相法(solid-state methods)进行合成,然后在溶液中偶联在一起。在该方法中,可以从氨基酸链的羰基端至氨基端合成肽,虽然肽在细胞中是被反向合成的。在该方法中,氨基被保护的氨基酸被结合至底物颗粒(substrate bead)上(如树脂颗粒),在羰基和树脂之间形成共价键。然后,氨基被去保护,并且与下一个氨基被保护的氨基酸的羰基进行反应。根据需要重复该循环,以形成预期的肽链。该过程结束时,从颗粒上切割下合成的肽。在该肽合成过程中主要使用的用于氨基的保护基团为9-芴基甲基氧羰基(9-fluorenylmethyloxycarbonyl)基团(“Fmoc”)和叔丁氧羰基(t-butyloxycarbonyl)(“Boc”)。使用碱从氨基末端脱除Fmoc基团,而使用酸脱除Boc基团。
在本发明中使用的用于所述药物组合物的制备的HEP-1肽、HP1-5肽和HP6-14肽由批准生产商“Immapharma”,LLC(Moscow)通过液相合成法进行制备。
在本发明的进一方面,提供了本发明的肽的制备方法,特别是如通式1所示的肽,例如,含有如SEQ ID No:1或SEQ ID No:5所示的氨基酸序列的肽。该方法可以包括通过液相合成法或固相合成法合成肽。
在本发明的一种实施方式中,提供了长度为14个氨基酸的肽,其中, 所述氨基酸的序列为GEKKRRETVEREGG。所述肽在医药中是有用的,特别是在治疗下部肠道炎症和/或溃疡中。所述肽可以以用于口服给药的片剂的形式提供,特别是葡萄糖片剂。
本发明的第二及后续方面的优选的特征如第一方面,加上必要的变更。
附图说明
现在将通过参考以下实施例的方式对本发明进行描述,实施例仅用于参考的目的,而不是用于构成对本发明的限制。在实施例中,提供了多个附图以供参考,其中:
图1:HEP-1肽的高效液相色谱图。Luna C18(2)柱,4.6×250mm,5.0μm颗粒。流动相:A–水,5%CAN,0.1%TFA;B–0.1%TFA;运行程序5-25%ACN20min。流量:1ml/min。X轴:时间,Y轴:紫外吸收(mV,上线,带峰),压力(偏低,水平线)。
图2:HEP-1肽和HP1-5肽的混合物的高效液相色谱图。Luna C18(2)柱,4.6×250mm,5.0μm颗粒。流动相:A–水,5%CAN,0.1%TFA;B–0.1%TFA;运行程序5-25%ACN 20min。流量:1ml/min。X轴:时间,Y轴:紫外吸收(mV,上线,带峰),压力(偏低,水平线)。
图3:HEP-1肽和HP6-14肽的混合物的高效液相色谱图。Luna C18(2)柱,4.6×250mm,5.0μm颗粒。流动相:A–水,5%CAN,0.1%TFA;B–0.1%TFA;运行程序5-25%ACN 20min。流量:1ml/min。X轴:时间,Y轴:紫外吸收(mV,上线,带峰),压力(偏低,水平线)。
图4:HEP-1肽和HP-V2肽的混合物的高效液相色谱图。Luna C18(2)柱,4.6×250mm,5.0μm颗粒。流动相:A–水,5%CAN,0.1%TFA;B–0.1%TFA;运行程序5-25%ACN 20min。流量:1ml/min。X轴:时间,Y轴:紫外吸收(mV,上线,带峰),压力(偏低,水平线)。
图5:HP-V2肽的高效液相色谱图。Luna C18(2)柱,4.6×250mm,5.0μm颗粒。流动相:A–水,5%CAN,0.1%TFA;B–0.1%TFA;运行程序5-25%ACN20min。流量:1ml/min。X轴:时间,Y轴:紫外吸收(mV,上线,带峰),压力(偏低,水平线)。
图6:HEP-1肽和HP-V2肽的混合物的MALDI TOF/TOF谱图。
具体实施方式
实施例
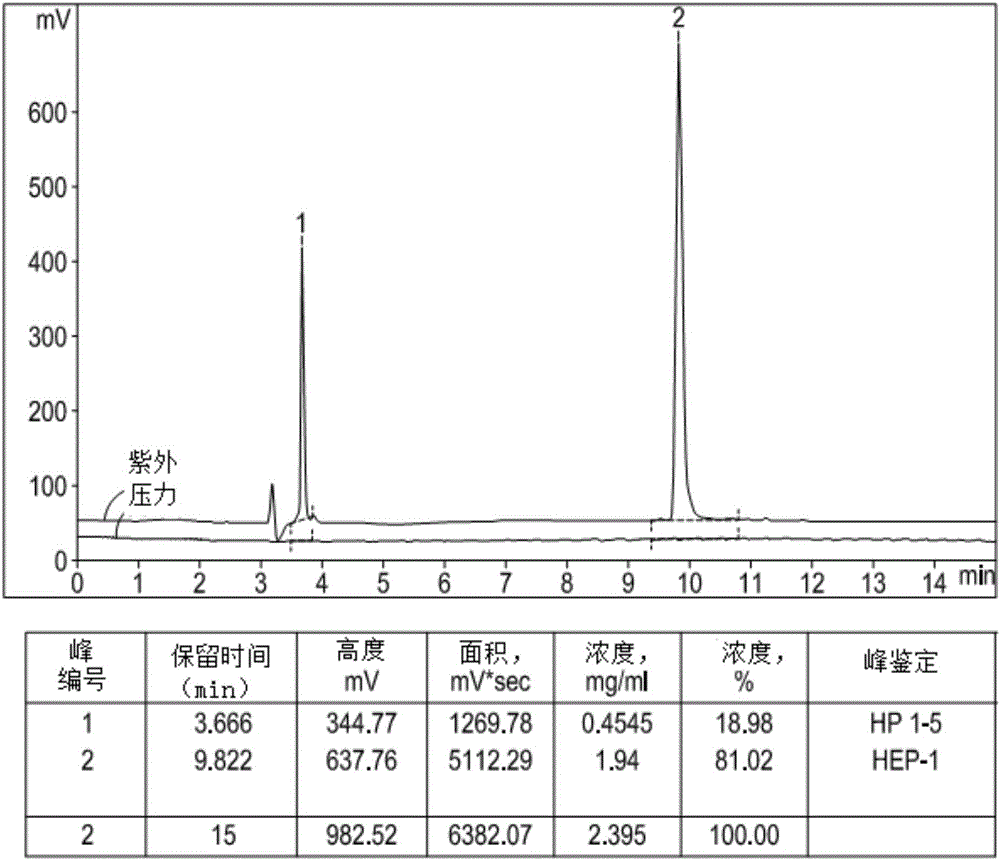
药物组合物的制备过程中,使用高效液相色谱法精确评估每种成分的浓度。研究结果表明,在高效液相色谱(HPLC)条件下,不可能将与HEP-1肽具有相似氨基酸数的HP-V2肽与HEP-1肽相区分,并且该事实使得无法评估基于HP-V2和HEP-1的组合物的定量含量(实施例4;图1,图4,图5)。同时,根据色谱图可以很容易地计算出要保护的HP-V2肽与卫星肽HP1-5和HP6-14的定量组成,因为他们分离良好(实施例2,3;图2,图3)。
然而,MALDI TOF质谱可以明确地检测出含有14个氨基酸残基的两种肽的混合物中的每一种肽,特别是,被定义为HP-V2的HP-V2肽(SEQ ID No.1:GEKKRRETVEREGG)与被定义为HEP-1的HEP-1肽(SEQ ID No.2:TEKKRRETVEREKE)的混合物(实施例5;图6)。
实施例1 HP-V2肽的制备
使用烷氧基苄基(alkoxybenzyl)聚合物通过固相法合成HP-V2肽。采用基于以下任一用法的方法进行偶联:1)四氟硼酸O-(苯并三唑-1-基)-N,N,N',N'-四甲基脲(tetramethyluronium)(TBTU);或2)1-羟基苯并三唑(HOBT)和N,N'-二异丙基碳二亚胺(DIPC)。单独进行Fmoc保护的氨基酸残基的顺序连接,除了偶联反应后在生成的肽基聚合物上发现未反应的氨 基时。通过茚三酮实验的方法控制肽基聚合物中未反应的氨基含量。三氟乙酸加入茴香硫醚、苯酚、乙二硫醇、三异丙基硅烷和水被用于肽与聚合物载体的分离以及最终的脱除(unblocking)。通过氨基酸分析、质谱和高效液相色谱数据确定预期产品的结构和同质性。
拟提供下列基于已提供的HP-V2肽(SEQ ID No.1:GEKKRRETVEREGG)的药物组合物,以及其与下列肽的混合物:
HEP-1(SEQ ID No.2:TEKKRRETVEREKE);
HP1-5(SEQ ID No.3:TEKKR);
HP6-14(SEQ ID No.4:RETVEREKE)。
药物组合物:
该药物组合物含有有效量的如SEQ ID No.1:GEKKRRETVEREGG所示的肽,以及药学上可接受的载体或填充剂–其它。
该药物组合物含有有效量的如SEQ ID No.1:GEKKRRETVEREGG所示的肽,如SEQ ID No.2:TEKKRRETVEREKE所示的肽,以及药学上可接受的载体或填充剂–其它。
该药物组合物含有有效量的如SEQ ID No.1:GEKKRRETVEREGG所示的肽,如SEQ ID No.3:TEKKR所示的肽,以及药学上可接受的载体或填充剂–其它。
该药物组合物含有有效量的如SEQ ID No.1:GEKKRRETVEREGG所示的肽,如SEQ ID No.4:RETVEREKE所示的肽,以及药学上可接受的载体或填充剂。
实施例6提供了具体的混合物,含有HP-V2肽和HEP-1、HP1-5、HP6-14,其被用于药物组合物的制备。
将0.01-1000mg的HP-V2肽或其与上述肽的混合物溶解于体积为1-10ml的无菌水中。在制备的溶液的基础上制备剂型,并且所述剂型可以被用于口 服、直肠,或阴道,或者用于滴鼻的滴剂,或者用于吸入的喷雾。
将0.01-1000mg量的HP-V2肽或肽的组合物置于片剂或胶囊、或栓剂、或凝胶、或软膏剂型中,结合药物输送技术领域技术人员常规使用的合适的填充剂、载体、防腐剂和稳定剂的药膏制剂。
可以采用上述药物组合物中的HP-V2肽或肽的组合用于剂型的制备,其可以口服、直肠,或阴道使用,或者可以局部使用。将含有0.01-1000mg的溶解在体积为1-10ml的注射用水或任意生理盐水中的HP-V2肽或肽的组合的无菌溶液通过皮下注射、肌内注射或静脉注射的途径给药。
实施例2:通过HPLC分离HEP-1和HP1-5
使用高效液相色谱法(HPLC)基于肽的保留时间将其分离。通过将HEP-1和HP1-5肽溶解在去离子水中,使得其浓度为1-2mg/ml,随后通过孔径为0.2μm的Millipore滤器进行过滤灭菌,以制备HEP-1和HP1-5肽的储备液。通过将适当体积的相应储备液混合以制备含有80%HEP-1肽和20%HP1-5肽的组合物。
HPLC在Luna C18(2)柱上进行,4.6×250mm尺寸,填充5μm颗粒。通过将A相和B相的混合程序制备流动相,其中,A含有水、5%乙腈(ACN)、0.1%TFA,并且B含有0.1%TFA。运行程序在5-25%乙腈(ACN)梯度下进行20分钟。进样体积为20μl;流量为1mg/min。通过不同保留时间下它们的紫外吸收值自动记录峰值。
图1表明HEP-1肽的HPLC峰值,具有其典型的保留时间为9至1-分钟。图2表明通过HPLC,HEP-1(RT=9.822min)与HP1-5(RT=3.666min)的两个峰的明确分离。
实施例3:通过HPLC分离HEP-1和HP6-14
按照实施例2所描述的制备HEP-1和HP6-14肽及其混合物的储备液。所述肽及其混合物的HPLC分析在如实施例1所描述的Luna C18(2)柱上进行,4.6×250mm尺寸,填充5μm颗粒。
在所使用的HPLC条件下,HEP-1和HP6-14肽的混合物被明确地分离成2个峰(图3),其中一个具有HP4-16肽的典型保留时间(RT=9.459min),并且另一个具有HEP-1肽的典型保留时间(RT=9.894min)。
实施例4:通过HPLC分析HEP-1和HP-V2的混合物
按照实施例2所描述的制备HEP-1和HP-V2肽及其混合物的储备液。所述肽及其混合物的HPLC分析在如实施例2所描述的的Luna C18(2)柱上进行,4.6×250mm尺寸,填充5μm颗粒。
在所使用的HPLC条件下,HEP-1和HP-V2肽的混合物以单峰的形式从柱上洗脱下来(图4),具有HEP-1肽的典型保留时间。单独的HP-V2肽溶液的HPLC分析已经表明(图5)该肽的保留时间确实与HEP-1肽的保留时间相同。这意味着在该HPLC条件下不可能区分HP-V2和HEP-1肽。
实施例5:HEP-1和HP-V2混合物的质谱
按照实施例2所描述的制备HEP-1和HP-V2肽及其混合物的储备液。使用2,5-二羟基苯甲酸作为基质,在Bruker Ultraflex TOF/TOF质谱仪上记录MALDI TOF图谱。
HEP-1和HP-V2肽的混合物的质谱图(图6)明确地显示出了这两种肽,具有分子离子1818.0726(MW)的HEP-1和1630.9385(MW)的HP-V2。
实施例6-8的介绍
以下的实施例6-8表明使用的所有的肽及其混合物均具有生物学活性。在体外细胞培养中,这些肽诱导干扰素产生,并且保护不同类型的人细胞免于由100TCID50/ml细胞病变脑心肌炎病毒感染引起的死亡。
研究了含有14个氨基酸残基的肽(HP-V2)(SEQ ID No.1:GEKKRRETVEREGG)及其与HEP-1肽(SEQ ID No.2:TEKKRRETVEREKE),或与HP1-5肽(SEQ ID No.3:TEKKR),或与HP6-14肽(SEQ ID No.4:RETVEREKE)的组合物在不同细胞培养中产生I型干扰素以诱导抗病毒应答的能力。我们使用了化合物在体外培养中的抗病毒(干扰素诱导)活性检测的传统方法,该方法被广泛用于免疫刺激剂、抗病毒药物和干扰素诱导剂的筛选。
在该体外方法中,我们使用研究的肽对不同类型的细胞进行了预处理,然后,使用100LD50的脑心肌炎病毒感染这些细胞。感染24小时后,评价病毒的致细胞病变作用,以评估测试化合物的保护活性,如果后者具有赋予细胞耐对细胞具有致死作用的病毒的状态的能力。
本领域公知的是,在大部分情况下,化合物的这种保护活性基于干扰素的诱导是可预期的(术语“干扰素”表示的是由细胞产生的并且可以阻止病毒复制的化合物)。通过在体外使用不同浓度的所述肽及其组合物以评估这些化合物的抗病毒(干扰素诱导)活性是可能的。
下方是保护50%的细胞免于由于剂量为100LD 50的脑心肌炎病毒感染导致的死亡的浓度,上方是测试的化合物的抗病毒(干扰素诱导)活性。
检测了含有14个氨基酸残基的肽(HP-V2)(SEQ ID No.1:GEKKRRETVEREGG)及其与HEP-1肽(SEQ ID No.2:TEKKRRETVEREKE),或与HP1-5肽(SEQ ID No.3:TEKKR),或与HP6-14肽(SEQ ID No.4:RETVEREKE)的组合物在免疫刺激(抗病毒,干扰素诱 导)方面的活性。
实施例6:肽在人肝癌细胞系培养中的抗病毒(干扰素诱导)活性的研究
从以Ivanovskiy(莫斯科)命名的Virology研究所获得PLC/PRF/5(Alexander)人肝癌细胞系。以MEM Eagle培养基为基础添加10%胎牛血清(FCS)、L-谷氨酰胺(300μg/ml)和青霉素(100U/ml)制备用于细胞培养的完全培养基。
对以下肽进行了测试:
HEP-1(SEQ ID No.2:TEKKRRETVEREKE);
HP1-5(SEQ ID No.3:TEKKR);
HP6-14(SEQ ID No.4:RETVEREKE);
HP-V2(SEQ ID No.1:GEKKRRETVEREGG);
肽的混合物:
MXHP1-5+HEP-1–90%HEP-1肽(SEQ ID No.2:TEKKRRETVEREKE)和10%HP1-5肽(SEQ ID No.3:TEKKR)的混合物;
MXHP6-14+HEP-1–90%HEP-1肽(SEQ ID No.2:TEKKRRETVEREKE)和10%HP6-14肽(SEQ ID No.4:RETVEREKE的混合物;
MXHP-V2+HP1-5–90%HP-V2肽(SEQ ID No.1:GEKKRRETVEREGG)和10%HP1-5肽(SEQ ID No.3:TEKKR)的混合物;
MXHP-V2+HP6-14–90%HP-V2肽(SEQ ID No.1:GEKKRRETVEREGG)和10%HP6-14肽(SEQ ID No.4:RETVEREKE)的混合物。
MXHP-V2+HEP-1–95%HP-V2肽(SEQ ID No.1:GEKKRRETVEREGG)和5%HEP-1肽(SEQ ID No.2:TEKKRRETVEREKE)的混合物。
将肽溶解在蒸馏水中,然后,通过孔径为0.2μm的滤器进行灭菌,以获得1-2mg/ml的储备液。第0天,将细胞接种至含有完全培养基的96孔板的孔中,细胞密度为1ml含有20万个细胞。第1天,在96孔板的孔中制备每个测试样品的系列稀释液(24个稀释液,增量为2),重复3次。第3天,所有的培养物均被剂量为100TCID50/ml的脑心肌炎病毒株“哥伦比亚SK-Col-SK”感染。最后,第4天,在不同浓度的测试肽存在下或者在不含肽(对照)的培养物中通过使用Leitz倒置显微镜评价病毒的致细胞病变作用。
基于保护50%的细胞免于由剂量为100TCLD50/ml的脑心肌炎病毒导致的死亡药物产品的最小浓度评价该药物产品的抗病毒作用。计算干扰素滴度(U/ml)值,其与药物产品的最大稀释倍数成反比,所述药物产品保护50%的细胞免于由剂量为100TCLD50/ml的脑心肌炎病毒导致的死亡。
得到的数据如表1所示。很明显,所有测试肽及其组合物可以阻止脑心肌炎病毒在人肝癌细胞中的复制。这些肽通过诱导产生干扰素具有保护肝癌细胞免于病毒的致细胞病变作用。所述肽及其组合物的效能不同。抗病毒(干扰素诱导)活性的最高水平登记为HP-V2肽及其与HP1-5肽的组合物。
表1.在PLC/PRF/5(Alexander)人肝癌细胞系培养中肽的抗病毒(干扰素诱导)活性。
注释:
抗病毒效能被表示为保护50%的细胞免于100LD 50的脑心肌炎病毒感染导致的死亡的最小化合物浓度。
计算诱导干扰素滴度(U/ml)值,其与化合物的最大稀释倍数成反比,所述化合物保护50%的细胞免于100LD 50的脑心肌炎病毒感染导致的死亡。
实施例7:肽在人宫颈癌细胞系培养中的抗病毒(干扰素诱导)活性的研究
从以Ivanovskiy(莫斯科)命名的Virology研究所获得HELA人宫颈癌细胞系。用于细胞培养的完全培养基、肽及其组合物,以及用于抗病毒(干扰素诱导)活性的评价方法均与实施例5所描述的相同。
得到的数据如表2所示。很明显,所有测试肽及所述组合物均可以防止脑心肌炎病毒感染在人宫颈癌细胞中的发展。这些肽通过诱导产生干扰素具有保护宫颈癌细胞免于病毒的致细胞病变作用。所述肽及其组合物具有不同的活性。当使用HP1-5肽(SEQ ID No.3:TEKKR)和HP6-14肽(SEQ ID No.4:RETVEREKE),及其与HP-V2肽的组合物时,检测到最大抗病毒(干扰素诱导)活性。
表2.在HELA人宫颈癌细胞系培养中肽的抗病毒(干扰素诱导)活性。
注释:
抗病毒效能被表示为保护50%的细胞免于100LD 50的脑心肌炎病毒感染导致的死亡的最小化合物浓度。
计算诱导干扰素滴度(U/ml)值,其与化合物的最大稀释倍数成反比,所述化合物保护50%的细胞免于100LD 50的脑心肌炎病毒感染导致的死亡。
实施例8:肽在Girardi心脏人上皮细胞系培养中的抗病毒(干扰素诱导)活性的研究
从以Ivanovskiy(莫斯科)命名的Virology研究所获得Girardi心脏人上皮细胞系的培养物。用于细胞培养的完全培养基、肽及其组合物,以及用于抗病毒(干扰素诱导的)活性的评价方法均与实施例5描述的相同。
得到的数据如表3所示。很明显,所有测试肽及组合物均可以防止脑心肌炎病毒感染在Girardi心脏人上皮细胞系中的发展。测试肽及其组合物在干扰素的诱导产生方面以及在保护Girardi心脏人上皮细胞系免于病毒的致 细胞病变作用方面是高度有效的。当使用HEP-1肽(SEQ ID No.2:TEKKRRETVEREKE)与HP1-5肽(SEQ ID No.3:TEKKR)和HP6-14肽(SEQ ID No.4:RETVEREKE)的组合物,以及HP-V2肽(SEQ ID No.1:GEKKRRETVEREGG)与HP1-5肽(SEQ ID No.3:TEKKR)肽和与HEP1肽(SEQ ID No.2:TEKKRRETVEREKE)的组合物时,检测到最大抗病毒(干扰素诱导)活性。
表3.在Girardi心脏人上皮细胞系培养中肽的抗病毒(干扰素诱导)活性。
注释:
抗病毒效能被表示为保护50%的细胞免于100LD 50的脑心肌炎病毒感染导致的死亡的最小化合物浓度。
计算诱导干扰素滴度(U/ml)值,其与化合物的最大稀释倍数成反比,所述化合物保护50%的细胞免于100LD 50的脑心肌炎病毒感染导致的死亡。
根据提供的带有生物学实验描述和表格的实施例表明,建议的新型 HP-V2肽具有高免疫刺激活性,当与已知的HEP-1肽相比较时,其活性与HEP-1相同(表3)或者比HEP-1高4倍。另外,基于要求保护的HP-V2肽和已知的埃兹肽获得了具有最高免疫刺激活性并且具有广泛作用范围(表1-3)的药物组合物,并且所述药物组合物有几次均高于HEP-1肽及其组合物的已知的功效。
实施例9:用于显示肽对组织修复和细胞增殖的分子机制的影响的研究
以下研究提供了本发明的肽(HP-V2)涉及组织修复和细胞增殖的分子机制的证据。本领域公知的是,影响细胞增殖得到分子机制的化合物,例如,TGFβ表达的调节与肠道的修复相关(Monteleone et al,,“Mongersen,an Oral SMAD7Antisense Oligonucleotide,and Crohn’s Disease”,New England Journal of Medicine,372:1104-1113)。另外,Akita et al.,“Basic Fibroblast Growth Factor in Scarless Wound Healing”,Adv.Wound Care,2013,2(2):44-49讨论了碱性(basic)成纤维细胞生长因子(bFGF)在临床应用中对伤口无瘢痕愈合的有益效果和作用以及基本机制。bFGF的是被广泛用于治疗伤口和溃疡的糖蛋白。bFGF可容易应用至任何类型的伤口并在肤色、肌理以及硬度方面产生更好的结果。Chen等,“NGF Accelerates Cutaneous Wound Healing by Promoting the Migration of Dermal Fibroblasts via the PI3K/Akt-Rac1-JNK and ERK Pathways”,BioMed Research International,Volume 2014,Article ID547187)表明NGF显著地加快了大鼠的皮肤切除伤口的愈合,以及由NGF诱导的成纤维细胞迁移有助于该愈合过程。还表明PI3K/Akt、Rac1、JNK和ERK的激活均涉及NGF诱导的成纤维细胞迁移的调控。进一步地,Raffetto等,“Mitogen-activated protein kinase pathway regulates cell proliferation in venous ulcer fibroblasts”,Vasc.Endovascular Surg.,2006,40(1):59-66表明MAPK ERK通路对于静脉溃疡的成纤维细胞的细胞增殖很重要。
因此,本发明的肽有助于下部肠道炎症和/或溃疡的预防和治疗。
已经表明肽GEKKRRETVEREGG(SEQ ID No:1)诱导成纤维细胞的激活,成纤维细胞是影响组织再生,以及伤口和溃疡的愈合的主要细胞类型。该实施例表明肽GEKKRRETVEREGG(SEQ ID No:1)对小鼠成纤维细胞的直接激活影响,揭示了在MAPK-ERK信号通路水平上的细胞内快速激活信号。
按照实施例1所描述的方法获得肽GEKKRRETVEREGG(SEQ ID No:1),BALB/c小鼠成纤维细胞购于美国典型培养物保藏中心,并且在由添加有10%胎牛血清的高糖DEME、1mM丙酮酸钠、1:50MEM非必需氨基酸、2mML-谷氨酰胺、10μg/ml庆大霉素和50μMβ-巯基乙醇组成的完全培养基中进行繁殖。细胞于10cm培养皿中5%CO2和37℃下生长。至50-60%汇合率时进行细胞传代。对于细胞的分离,使用0.05%胰蛋白酶/EDTA,然后在10倍体积的含有用于终止胰蛋白酶作用的10%FCS的洗涤培养基中离心(470×g,15min)。弃去上清液并且将细胞沉淀物重悬于10ml完全培养基中,然后在将细胞用于实验前,使用血球细胞数器对细胞进行计数。
在8孔培养板中培养成纤维细胞,将测试肽或细胞因子TGF-β1(阳性对照)溶液,或等体积的培养基(阴性对照)一式三份分别加入至培养基中。细胞在肽GEKKRRETVEREGG SEQ ID No:1(10μg/ml)或TGF-β1存在下,或无任何效应化合物的情况下,于5%CO2和37℃条件下进行孵育1小时或6小时。在计划的时间点,收集细胞,使用PBS清洗两遍,并且在蛋白酶抑制剂的存在下,于4℃使用细胞提取缓冲液对细胞进行裂解30min。通过离心(14,000×g,10min,4℃)纯化(cleared)提取物。使用蛋白测定试剂(Pierce,23225)检测蛋白浓度。然后,在8%SDS-PAGE中对提取物的适当稀释液(每孔道10μg蛋白)进行分离(fractionated),之后转移至PVDF膜(Amersham)上用于免疫印迹。使用磷酸化p44/42MAPK(Cell Signaling,4370)和GAPDH (Abcam ab8245)特异性抗体检测目标蛋白。蛋白条带显色,然后使用ImageJ软件对其强度进行检测。数据被表示为ERK1、ERK2或磷酸化ERK1和磷酸化ERK2的值(每条带的像素),该值为经各自的GAPDH条带标准化后的值。使用3次独立的运行的数据计算平均值+SD。
我们的实验结果表明肽GEKKRRETVEREGG(SEQ ID No:1)和阳性对照TGF-β1二者均可以诱导成纤维细胞中的MAPK/ERK信号通路的快速激活。在这些效应化合物孵育1小时后,磷酸化ERK1(44kD)和ERK2(42kD)的浓度增加了约3-5倍。因此,成纤维细胞经GEKKRRETVEREGG(SEQ ID No:1)肽(10μg/ml)或TGF-β1(5ng/ml)激活后1小时,经标准化的磷酸化ERK1值分别为0.4+0.02(p<0.01)和0.5+0.02(p<0.01),相比于阴性对照为0.1+0.002,并且磷酸化的ERK2值为1.3+0.05(p<0.01)和1.9+0.1(p<0.01),相比于阴性对照为0.4+0.01。之后,活化6小时后,使用肽GEKKRRETVEREGG(SEQ ID No:1)或TGF-β1激活的成纤维细胞中的的磷酸化ERK1值分别为0.1+0.006(p>0.1)和0.3+0.02(p<0.05),而阴性对照培养为0.1+0.01。在6小时时间点,所述肽、TGF-β1和未激活的培养物中的磷酸化ERK2的值分别为0.1+0.01(p>0.1),0.35+0.02(p<0.01)和0.1+0.007。
上述研究已经表明HP-V2的活性与TGFβ(阳性对照)的活性相当,因此,其具有用于预防和治疗下部肠道炎症和/或溃疡的潜力。
- 还没有人留言评论。精彩留言会获得点赞!