一类连接四个相同给电子基团的嘧啶衍生物的制备方法及其应用与流程
本发明涉及一类连接四个相同给电子基团的嘧啶衍生物的制备方法及其应用,属于发光材料在制备有机电致发光器件的应用技术领域。
背景技术:
OLED即有机发光二极管(Organic Light Emitting Diode,简称OLED),是利用有机材料电致发光效应的新型发光二极管。其工作原理是:通过施加电压产生电场,被电场激发的电子碰击发光中心,而引致电子在能级间的跃迁、变化、复合导致发光。因其具有制作工艺简单,取材广泛,结构可控,并且超薄,可卷曲等诸多特点,在显示和照明领域显示出极大的应用前景。一些实用或者接近实用的有机显示器件已经问世,例如三星公司基于主动矩阵有机电致发光二极管的显示屏已经大面积应用于Galaxy系列手机,其大尺寸的电视也已上市。有机白光照明技术也正在向低成本、高效率、长寿命光源的目标前进。
在有机电致发光材料中,与传统的荧光材料和磷光材料相比,热致延迟荧光材料兼具二者的优点,它既能够充分利用单重态和三重态激子发光而使得器件内量子效率理论上达到100%;同时,热致延迟荧光材料为有机小分子,化学性质稳定且不需要和贵重金属配位使得器件成本大幅降低。因而,研究、开发新型的热致延迟荧光材料具有十分重要的现实意义。
技术实现要素:
本发明的目的是以嘧啶环作为电子受体,分别连接四个相同的给体咔唑、叔丁基咔唑,9-苯基9-氢咔唑,10-苯基-10-氢吩噁嗪、10-苯基-10-氢吩噻嗪,9,9-二甲基-9,10-二氢吖啶制备新型的有机电致发光材料。
本发明所采用的技术方案是:一类连接四个相同给电子基团的嘧啶衍生物,该嘧啶衍生物以嘧啶作为发光材料的电子受体在其外围连接四个相同的给电子基团;所述嘧啶衍生物的通式为
其中:D的结构为
M1、M2、M3、M4、M5及M6的化学分子结构式分别为:
所述的一类嘧啶衍生物作为发光材料应用在制备有机电致发光器件中。本发明的有益效果是:这类嘧啶衍生物利用小基团密集排列产生的空间位阻效应,将电子给体和受体之间的共轭阻断,使HOMO与LUMO能级实现较高程度的分离,同时又可以保证分子具有较高的辐射速率常数。嘧啶作为发光材料的电子受体,在其外围连接咔唑、叔丁基咔唑,9-苯基9-氢咔唑,10-苯基-10-氢吩噁嗪、10-苯基-10-氢吩噻嗪,9,9-二甲基-9,10-二氢吖啶等电子供体,制备成有机电致发光材料。这些有机电致发光材料可以同时利用单重态和三重态激子发光,理论上内量子效率可以达到100%;此外,这些材料都是有机小分子,化学性质稳定且不需要贵重金属配位,成本较低,可作为发光材料应用于有机电致荧光器件。
附图说明
图1是分子M1的紫外吸收强度和在二氯甲烷和甲苯中的荧光发射强度。
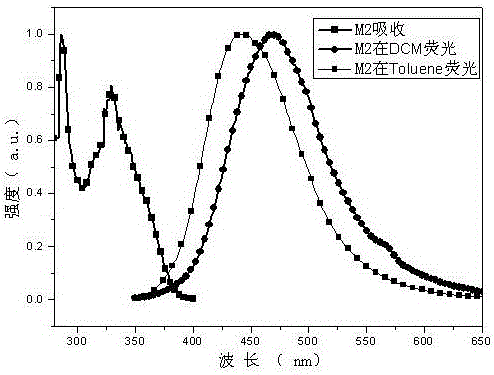
图2是分子M2的紫外吸收强度和在二氯甲烷和甲苯中的荧光发射强度。
图3是分子M1的最高未占有轨道电子云分布。
图4是分子M1的最高占有轨道电子云分布。
图5是分子M1的最高占有轨道电子云分布。
图6是分子M2的最高未占有轨道电子云分布。
图7是分子M1的器件电致发光光谱。
图8是分子M1器件外量子效率随电流密度的变化关系图。
具体实施方式
下面通过实施例对本发明作进一步说明,目的在于更好理解本发明的内容。因此所举实例并不限制本发明的保护范围。
实施例1衍生物M1的合成
将1.73g(10.35mmol)咔唑加入到250ml的三口烧瓶里,然后加入100mL N,N-二甲基甲酰胺作为反应溶剂,冰浴条件下,在磁力搅拌器上搅拌10min。将0.22g(9.2mmol)NaH分批加入到反应瓶中,继续搅拌1h。0.5g(2.30mmol)的2,4,5,6-四氯嘧啶溶解在20ml的N,N-二甲基甲酰胺里,逐滴加入到反应体系中,添加完毕后,室温下反应24h。反应结束后,将反应液倒入150ml浓度为10%的稀盐酸里淬灭,减压抽滤后,水洗,烘干,粗产品用石油醚和二氯甲烷(PE:DCM=6:1)为流动相过柱,得到白色固体1.16g,产率68.0%。MS(EI):m/z:740.87([M]+)。
实施例2衍生物M2的合成
将2.89g(10.35mmol)叔丁基咔唑加入到100ml的三口烧瓶里,然后加入100ml N,N-二甲基甲酰胺作为反应溶剂,冰浴条件下,在磁力搅拌器上搅拌10min。将0.22g(9.2mmol)NaH分批加入到反应瓶中,继续搅拌1h。0.5g(2.3mmol)的2,4,5,6-四氯嘧啶溶解在20ml的N,N-二甲基甲酰胺里,逐滴加入到反应体系中,添加完毕后,室温下反应24h。反应结束后,将反应液倒入100ml浓度为10%的稀盐酸里淬灭,减压抽滤后,水洗,烘干,粗产品用石油醚和乙酸乙酯(PE:DCM=6:1)为流动相过柱,白色固体1.01g,产率69.3%。MS(EI):m/z:1188.87([M]+)。
实施例3衍生物M3的合成
依次将1.162g(4.408mmol)N-苯基-3-咔唑硼酸,200mg(0.92mmol)2,4,5,6-四氯嘧啶,103mg(0.46mmol)醋酸钯,241mg(0.92mmol)三苯基膦以及1.17g(11.04mmol)无水碳酸钾加入到100ml三口烧瓶里,然后加入50mL乙二醇二甲醚作为反应溶剂,除去空气后回流24h。反应结束后减压蒸馏除去反应溶剂,DCM萃取三次后旋干过柱。得到黄色固体0.26g,产率30.6%。MS(EI):m/z:1044.39([M]+)。
实施例4衍生物M4的合成
称取3.56g(21.28mmol)咔唑,6.0g(21.28mmol)对溴碘苯,5.86g(42.56mmol)无水碳酸钾,0.76g(4.26mmol)1,10-邻菲啰啉,0.82g(4.26mmol)碘化亚铜于100mL三口瓶中,然后加入80mL N,N-二甲基甲酰胺作为反应溶剂。氮气保护下,除去空气后回流24h。反应结束后,将反应液倒入240mL饱和食盐水中淬灭,减压抽滤后用二氯甲烷(250mL×3)萃取反应液,合并萃取液并用无水硫酸镁干燥,旋出溶剂、烘干。粗产品用石油醚和二氯甲烷(PE:DCM=20:1)为流动相进行柱层析提纯,得到白色固体3.53g,产率55.2%。MS(EI):m/z:321.0166([M]+)。
称取3.44g(10.72mmol)中间体1于250mL干燥的三口瓶内,加入80mL干燥的四氢呋喃作为反应溶剂。氮气保护下,将其用液氮丙酮冷却到-78℃,在此温度下搅拌5min,使用注射器向反应体系中逐滴加入10.0mL(1.6mol/L,16.08mmol)正丁基锂。反应1小时后,使用注射器向反应体系中滴加2.4mL(42.89mmol)的硼酸三甲酯,并使之自然升温搅拌过夜。反应结束后加入稀盐酸溶液猝灭。旋干四氢呋喃后用二氯甲烷(100mL×3)萃取反应液,合并萃取液并用无水硫酸镁干燥,旋出溶剂、烘干。粗产品用二氯甲烷和乙酸乙酯为洗脱剂梯度进行柱层析提纯,得到白色结晶状固体2.05g,产率66.5%。MS(EI):m/z:287.1124([M]+)。
依次将1.162g(4.408mmol)4-(9H-咔唑-9-基)苯硼酸,200mg(0.92mmol)2,4,5,6-四氯嘧啶,103mg(0.46mmol)醋酸钯,241mg(0.92mmol)三苯基膦以及1.17g(11.04mmol)无水碳酸钾加入到100ml的三口烧瓶里,然后加入50mL乙二醇二甲醚作为反应溶剂,除去空气后回流24h。反应结束后减压蒸馏除去反应溶剂,DCM萃取三次后旋干过柱。得到黄色固体0.26g,产率30.6%。MS(EI):m/z:1044.39([M]+)。
实施例5衍生物M5的合成
称取4.0g(21.84mmol)吩噁嗪,2.78ml(6.12g,21.84mmol)对溴碘苯,14.24g(43.7mmol)无水碳酸铯,1.64ml(0.66mmol)三叔丁基膦,0.1g(0.44mmol)醋酸钯于250mL三口瓶中,然后加入100mL无水甲苯作为反应溶剂。除去空气后,加热至80℃反应20小时。反应结束后,减压抽出溶剂后用二氯甲烷(100mL×3)萃取反应液,合并萃取液并用无水硫酸镁干燥,旋干溶剂,烘干。粗产品用石油醚和二氯甲烷(PE:DCM=15:1)为洗脱剂进行柱层析提纯,得到白色结晶粉末4.85g,产率65.8%。MS(EI):m/z:337.0125([M]+)。
称取4.84g中间体3(14.36mmol)于250mL干燥的三口瓶内,加入80mL干燥的四氢呋喃作为反应溶剂。氮气保护下,将其用液氮丙酮冷却到-78℃,在此温度下搅拌5min,氮气保护下使用注射器向反应体系中逐滴加入13.46mL(1.6mol/L,21.54mmol)的正丁基锂。反应1小时后,使用注射器向反应体系中滴加3.25ml(8.8mol/L,28.72mmol)的硼酸三甲酯,并使之自然升温搅拌过夜。反应结束后加入稀盐酸溶液猝灭反应。旋干反应液中的四氢呋喃并且用二氯甲烷(100mL×3)萃取反应液,合并萃取液并用无水硫酸镁干燥,旋出溶剂、烘干。粗产品用二氯甲烷和乙酸乙酯为洗脱剂梯度进行柱层析提纯,得到白色结晶状固体3.02g,产率69%。MS(EI):m/z:303.1066([M]+)。
依次将1.226g(4.408mmol)4-(10H-吩恶嗪-10-基)苯硼酸,200mg(0.92mmol)2,4,5,6-四氯嘧啶,103mg(0.46mmol)醋酸钯,241mg(0.92mmol)三苯基膦以及1.17g(11.04mmol)无水碳酸钾加入到100ml的三口烧瓶里,然后加入50mL乙二醇二甲醚作为反应溶剂,除去空气后回流24h。反应结束后减压蒸馏除去反应溶剂,DCM萃取三次后旋干过柱。得到黄色固体0.38g,产率38.6%。MS(EI):m/z:1108.37([M]+)。
实施例6衍生物M6的合成
称取4.0g(11.12mmol)9,9-二甲基-9,10-二氢吖啶,2.44ml(5.40g,11.12mmol)对溴碘苯,3.98g(38.24mmol)无水叔丁醇钠,1.46ml(0.58mmol)三叔丁基膦,0.086g(0.38mmol)醋酸钯于250mL三口瓶中,然后加入100mL无水甲苯作为反应溶剂。氮气保护下,加热至80℃反应20小时。反应结束后,减压抽出溶剂后二氯甲烷(100mL×3)萃取反应液,合并萃取液并用无水硫酸镁干燥,旋干溶剂,烘干。粗产品用石油醚和二氯甲烷(PE:DCM=15:1)为洗脱剂进行柱层析提纯,得到白色结晶粉末4.56g,产率65.8%。MS(EI):m/z:363.0633([M]+)。
称取3.42g中间体5(9.42mmol)于100mL干燥的两口瓶内,加入50mL干燥的四氢呋喃作为反应溶剂。氮气保护下,将其用液氮丙酮冷却到-78℃,在此温度下搅拌5min,氮气保护下使用注射器向反应体系中逐滴加入8.85mL(1.6mol/L,14.13mmol)的正丁基锂。反应1小时后,向反应体系中滴加2.15ml(8.8mol/L,18.84mmol)的硼酸三甲酯,并使之自然升温搅拌过夜。反应结束后加入稀盐酸溶液猝灭反应。用二氯甲烷(100mL×3)萃取反应液,合并萃取液并用无水硫酸镁干燥,旋出溶剂、烘干。粗产品用二氯甲烷和乙酸乙酯为洗脱剂梯度进行柱层析提纯,得到白色固体2.18g,产率70.1%。MS(EI):m/z:329.1590([M]+)。
依次将1.451g(4.408mmol)4-(9,9-二甲基吖啶-10-基)苯硼酸,200mg(0.92mmol)2,4,5,6-四氯嘧啶,103mg(0.46mmol)醋酸钯,241mg(0.92mmol)三苯基膦以及1.17g(11.04mmol)无水碳酸钾加入到100ml的三口烧瓶里,然后加入50mL乙二醇二甲醚作为反应溶剂,除去空气后回流24h。反应结束后减压蒸馏除去反应溶剂,DCM萃取三次后旋干过柱。得到黄色固体0.26g,产率30.6%。MS(EI):m/z:1212.58([M]+)。
实施例7
对分子M1、M2进行了紫外可见光谱及荧光光谱的测试,M1和M2在甲苯中的最大吸收峰在443nm和444nm,也即M1和M2是目前很理想的蓝色发光分子。而且在二氯甲烷中的发射峰位置分别在467nm和469nm,随着极性的增大产生红移现象说明存在分子内的电荷转移态发光。而且M1、M2的理论计算结果表明M1和M2的电子云分布基本上一致,最低未占有轨道电子云分布在电子嘧啶环上,最高占有轨道电子云分布在外围的给电子体上,使最低未占有轨道和最高占有轨道具有较小的重叠,这是实现热致电致发光材料的必要条件。同时,M1的器件结构为:
ITO/PEDOT/TAPC(200nm)/M1:mcp(200nm)/TmPyPB(400nm)/LiF(10nm)/Al(2000nm),ITO是指氧化铟锡,PEDOT是指EDOT(3,4-乙烯二氧噻吩单体)的聚合物,TAPC是常用的空穴传输材料,mcp由于其较高的三线态作为主体材料,掺杂浓度为7%,TmPyPB是常用的电子传输材料,LiF作为电子注入材料,金属铝是金属阴极。材料的电致发光位置在440,弥补了目前蓝色电致发光材料的匮乏,将会极大改善电致发光器件的效率和加快有机电致发光材料的应用。
- 还没有人留言评论。精彩留言会获得点赞!